-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Lékové interakce v gerontopsychiatrii – výběr antipsychotik a antidepresiv pro geriatrické pacienty
Drug interactions in gerontopsychiatry – the choice of antipsychotics and antidepressants for geriatric patients
When different drugs are combined, drug interactions may lead to increased or decreased effect of the pharmacotherapy. Each drug may interact with another drug, dietary supplement, or food ingredient. Drugs overlap in their receptor profile via pharmacodynamic interaction, or target drug concentrations may be affected via pharmacokinetic interaction. Increased concentrations of the drug manifest in adverse drug reactions, whereas decreased concentrations of the drug in plasma result in ineffective treatment. In both cases, drug interaction is a very undesirable phenomenon we try to prevent, because it causes prolonged hospitalization, worsens quality of life of geriatric patients and increases health care costs. Prevention and elimination of drug interactions are objectives of safe pharmacotherapy. This article describes basic drug interactions in gerontopsychiatry, focusing specifically on antipsychotics and antidepressants. The article provides information about substrates, inhibitors and inducers of cytochrome P450. Furthermore, it presents the need for multidisciplinary cooperation of the physician and clinical pharmacist to solve drug interactions. In addition, examples of drug interactions are demonstrated using case reports from clinical practice, as experienced by geriatric patients.
Keywords:
antidepressants – geriatric patient – Antipsychotics – Drug interactions – psychiatry
Autoři: Jana Michalcová 1,2; Ivana Tašková 1,2; Katarína Bielaková 3,4
Působiště autorů: Ústav aplikované farmacie, Farmaceutická fakulta MU Brno 1; Pracoviště klinické farmacie, Psychiatrická nemocnice Bohnice, Praha 2; Klinika interní, geriatrie a praktického lékařství LF MU a FN Brno 3; Ústav farmakologie LF MU a FN Brno 4
Vyšlo v časopise: Geriatrie a Gerontologie 2022, 11, č. 2: 61-67
Kategorie: Přehledový článek
Souhrn
Při kombinaci léčiv může dojít k lékové interakci, která může vést k zesílení nebo zeslabení jejich účinku. Každé léčivo může podléhat interakci s dalším léčivem, doplňkem stravy nebo složkou potravy. Léčiva se mohou překrývat ve svém receptorovém profilu na základě farmakodynamické interakce nebo mohou být vzájemně ovlivněny cílové koncentrace léčiva v případě farmakokinetické interakce. Při navýšení plazmatické koncentrace léčiva dochází k častějším projevům nežádoucích účinků, naopak při snížení plazmatické koncentrace může být pozorována neúčinnost terapie. V obou případech je léková interakce velice nežádoucím jevem, kterému se snažíme předcházet, protože může zapříčinit prodloužení doby hospitalizace, snížit kvalitu života geriatrického pacienta a zvýšit celkové náklady na léčbu. Prevence a eliminace lékových interakcí jsou cílem bezpečné farmakoterapie. Tento přehledový článek popisuje základní lékové interakce v gerontopsychiatrii se zaměřením na skupinu antipsychotik a antidepresiv. Článek přináší informace o substrátech, inhibitorech a induktorech cytochromu P450. Dále je představena potřeba multioborové spolupráce lékaře a klinického farmaceuta při řešení lékových interakcí. Na závěr jsou uvedeny příklady lékových interakcí formou kazuistik z klinické praxe, se kterými se můžeme setkat u geriatrických pacientů.
Klíčová slova:
lékové interakce – antidepresiva – antipsychotika – geriatrický pacient – psychiatrie
Úvod
Stárnutí populace je celosvětový trend, aktuálně v České republice žije 2,1 milionu osob starších 65 let. Neustále se zvyšující hranice průměrného věku přináší rostoucí náklady na zdravotní péči.(1,2) Přirozené stárnutí provází řada farmakokinetických a farmakodynamických změn, které mohou mít značný vliv na efekt užívané farmakoterapie. Farmakokinetické změny ve stáří zahrnují změnu absorpce, distribuce, metabolismu a eliminace léčiv. S přibývajícím věkem může být omezena absorpce v důsledku snížené žaludeční sekrece a motility střev, atrofie slizničního povrchu a snížení krevního průtoku v gastrointestinálním traktu. Změna distribuce souvisí s vyšším podílem tuku v těle, naopak s úbytkem vody a svalové tkáně. Také může být ovlivněna vazebnost některých léčiv díky snížené plazmatické hladině albuminu. Distribuční objem léčiv rozpustných ve vodě je snížen, což přispívá k jejich vyšší toxicitě. Naopak distribuční objem léčiv rozpustných v tucích je zvýšen, což vede k prodloužení biologického poločasu a jejich kumulaci. Metabolismus léčiv může být ovlivněn sníženým průtokem krve v játrech, nižší aktivitou enzymů a celkovou atrofií jaterní tkáně. Eliminace léčiv bývá snížena vlivem poklesu renální clearance. Výsledkem je prodloužení eliminačního poločasu léčiv, která se vylučují převážně renálně, a tudíž roste riziko jejich kumulace u geriatrických pacientů. Farmakodynamické změny zahrnují ovlivnění senzitivity receptorů. Příkladem může být zvýšená citlivost na účinky psychotropních a kardiovaskulárních léčiv ve stáří.(3,4)
S vyšším věkem pacientů roste i počet užívaných léčiv. Nepřiměřeně vysoký počet léčiv označujeme jako polyfarmacie, kdy dochází k nadbytečným kombinacím, jež mohou být významným zdrojem lékových interakcí.(5–7) Psychofarmaka jsou v geriatrii hojně užívanou lékovou skupinou. Nejčastěji se můžeme setkat v klinické praxi s preskripcí antidepresiv, anxiolytik a antipsychotik v různých indikacích.(8) Obecně s vyšším počtem užívaných léčiv roste i riziko lékové interakce. Negativní dopady lékové interakce zahrnují komplikace zdravotního stavu pacienta, prodloužení doby hospitalizace a zvýšené náklady na léčbu. Důkladná znalost a správná interpretace klinického dopadu lékové interakce jsou nezbytné pro bezpečnou farmakoterapii.(9,10)
Lékové interakce
Lékové interakce lze rozdělit na farmakodynamické a farmakokinetické interakce. Farmakodynamická interakce je výsledkem působení léčiv na stejném cílovém místě. Může dojít k posílení účinku vlivem synergie obou léčiv nebo naopak k zeslabení účinku vlivem jejich antagonismu. Farmakokinetické interakce vznikají naopak působením organismu na dostupnost léčiva (plazmatickou koncentraci). K farmakokinetické interakci může dojít během absorpce, distribuce, metabolizace nebo eliminace léčiva. Nejčastěji k lékovým interakcím dochází na úrovni metabolismu léčiv. Většina psychofarmak je metabolizována pomocí jaterního cytochromu P450 (CYP450), což je soubor většího počtu izoenzymů, který se podílí na biotransformaci mnoha léčiv. Léčiva mohou být substráty CYP450, inhibitory, které zpomalují metabolismus substrátů, nebo induktory, které urychlují metabolismus substrátů. Zatímco inhibice se projeví v rámci hodin, tak indukce až v rámci dní. Cytochrom P450 má více izoforem, jež jsou substrátově specifické pro různá léčiva (tab. 1).
Tab. 1. Podíl izoforem CYP450 na metabolismu léčiv 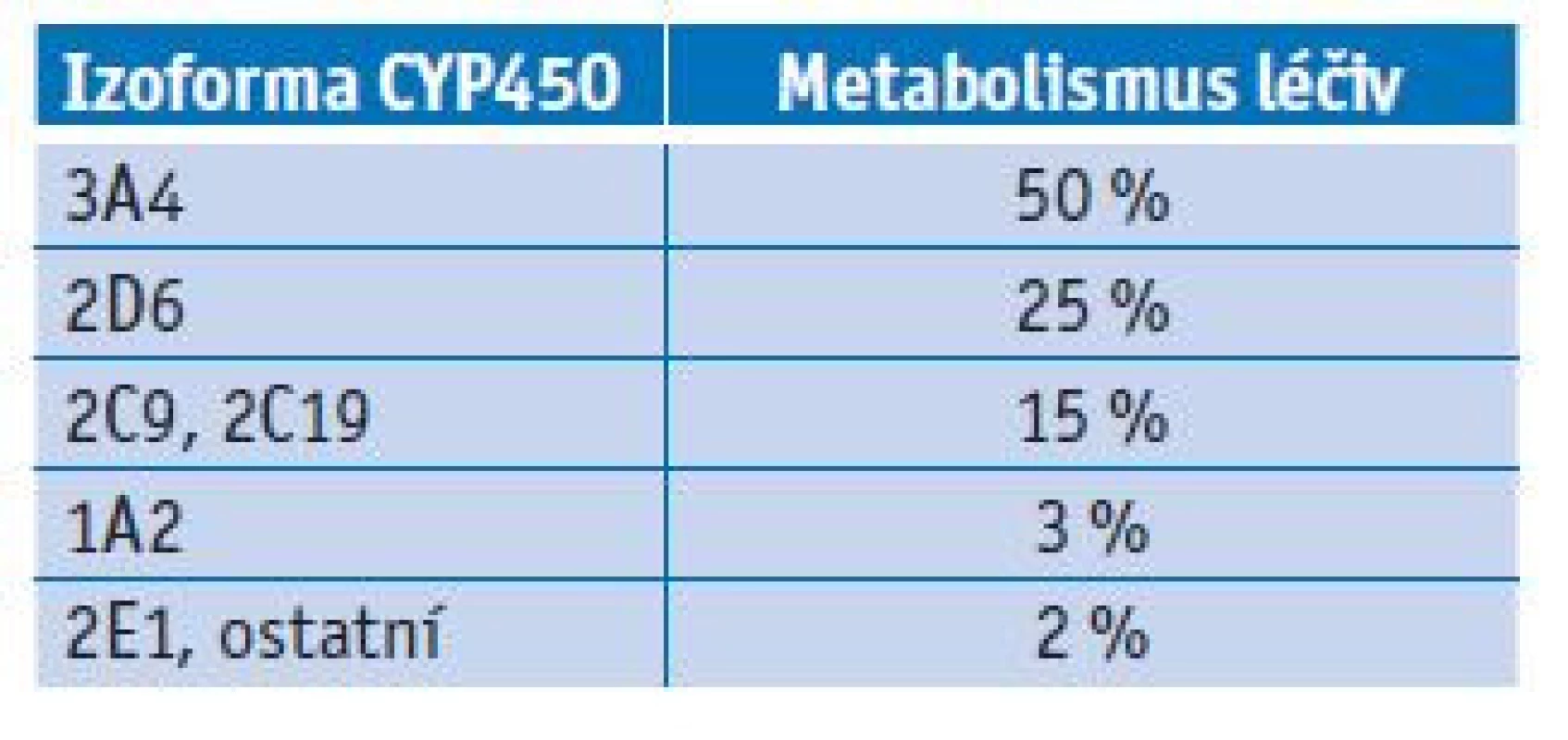
Jednotlivé izoformy CYP450
Až polovina všech léčiv je metabolizována za pomoci izoformy CYP3A4. Tato izoforma má vysoký překryv v rámci substrátové specifity s P-glykoproteinem (efluxní pumpa podílející se na transportu léčiv).(11) Významné inhibitory CYP3A4 jsou antidepresiva (fluoxetin, paroxetin), makrolidová antibiotika (klaritromycin), azolová antimykotika (itrakonazol, ketokonazol, vorikonazol), antivirotika (ritonavir), antiarytmika (amiodaron, vepapamil) a grepfruit. Tyto látky mohou vlivem zpomalení metabolismu během inhibice zvýšit plazmatické koncentrace psychofarmak, která se metabolizují touto cestou. Naopak významnými induktory CYP3A4 jsou antiepileptika (karbamazepin, fenytoin, fenobarbital, primidon), antituberkulotika (rifampicin), dexamethason a třezalka tečkovaná. Tyto látky mohou vlivem urychlení metabolismu na základě indukce naopak plazmatické koncentrace psychofarmak významně snížit. Izoforma CYP2D6 není inducibilní, proto je u ní možná pouze inhibice. Mezi významné inhibitory CYP2D6 patří opět antidepresiva (fluoxetin, paroxetin, bupropion, duloxetin), antivirotika (ritonavir) a antiarytmika (amiodaron, propafenon, verapamil). Řada psychofarmak se metabolizuje CYP1A2, jež je indukována aromatickými uhlovodíky z cigaretového kouře. K výrazné indukci dochází již při vykouření několika cigaret denně. Významnými inhibitory CYP1A2 jsou zánětlivé cytokiny a vyšší příjem kofeinu. Izoforma CYP2E1 je minoritní, ale uplatňuje se například při odbourávání alkoholu. V rámci řešení lékových interakcí spojených s jaterním cytochromem P450 je podstatná i znalost genetického polymorfismu, především u izoforem CYP2D6, CYP2C9 a CYP2C19.(12,13)
Lékové interakce antipsychotik
Mnoho antipsychotik je metabolizováno cytochromem P450. Nejčastěji jsou antipsychotika substráty CYP2D6, CYP3A4 a CYP1A2 (tab. 2). Klasická antipsychotika jsou dominantně metabolizována CYP2D6, případně některá z nich i CYP1A2. Incisivní antipsychotika, například haloperidol, jsou také dominantně metabolizována CYP2D6. V rámci metabolismu atypických antipsychotik je často zastoupeno více metabolických cest. Významnými substráty CYP3A4 jsou kvetiapin, ziprasidon a lurasidon, CYP2D6 risperidon a zotepin, CYP1A2 olanzapin a klozapin. Aripiprazol, brexpiprazol a kariprazin se metabolizují dvěma cestami CYP2D6 a CYP3A4. Z hlediska lékové interakce patří mezi nejvíce bezpečná antipsychotika paliperidon, sulpirid, amisulprid a tiaprid. Paliperidon je aktivní metabolit risperidonu a jedná se o poměrně hydrofilní léčivo, proto je jeho další metabolizace v organismu minimální. Je vylučován až z 80 % v nezměněné formě ledvinami. Dopaminoví antagonisté sulpirid, amisulprid a tiaprid se také vylučují převážně renálně v nezměněné formě, proto je jejich vstup do lékové interakce ve fázi metabolismu velmi omezený.(13,14)
Tab. 2. Substrátová specifita antipsychotik u jednotlivých forem CYP 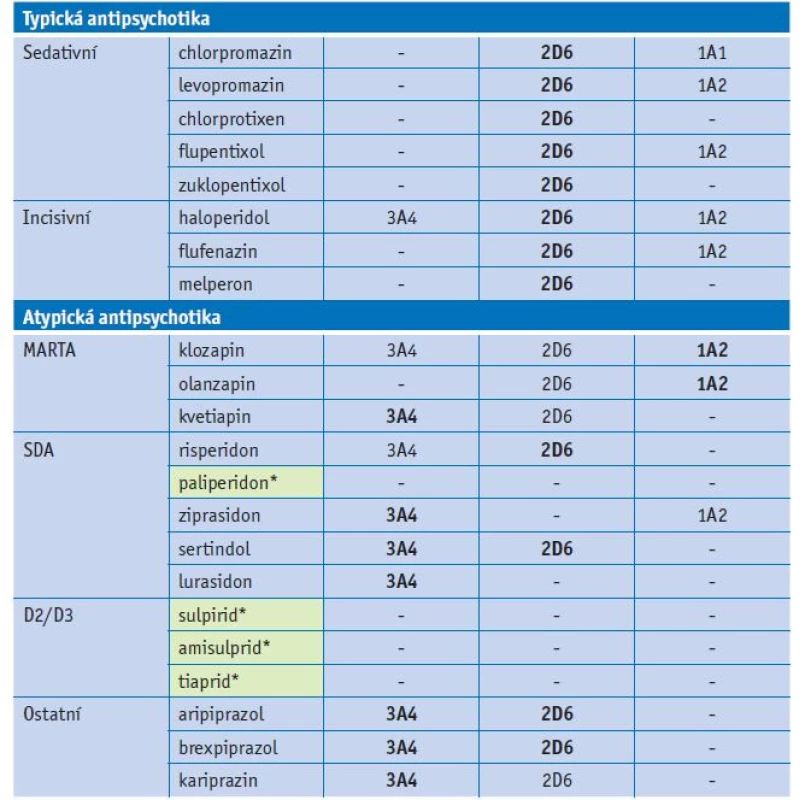
Vysvětlivky: zvýrazněny hlavní cesty metabolismu antipsychotik; *léčiva s minimálním vstupem do lékové interakce. Lékové interakce antidepresiv
Antidepresiva jsou v geriatrické populaci často předepisovanou skupinou léčiv, zejména selektivní inhibitory zpětného vychytávání serotoninu (SSRI). Fluoxetin a paroxetin jsou silné inhibitory CYP2D6, fluvoxamin silný inhibitor CYP1A2. Jejich interakční potenciál je vysoký. Další skupinou antidepresiv jsou selektivní inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI) venlafaxin a duloxetin, jejichž hlavní metabolická cesta vede přes CYP2D6. Tricyklická antidepresiva jsou také dominantně metabolizována CYP2D6. Trazodon je metabolizován CYP3A4, moklobemid zejména CYP2D6, bupropion CYP2D6 a agomelatin CYP1A2. Nejnovější antidepresivum vortioxetin je substrátem CYP2D6 a CYP3A4. Mezi antidepresiva s malým rizikem lékové interakce patří mirtazapin a někteří zástupci SSRI (sertralin, citalopram, escitalopram).(13,14) Cesty metabolismu antidepresiv jsou shrnuty v tabulce 3.
Tab. 3. Substrátová specifita antidepresiv u jednotlivých forem CYP 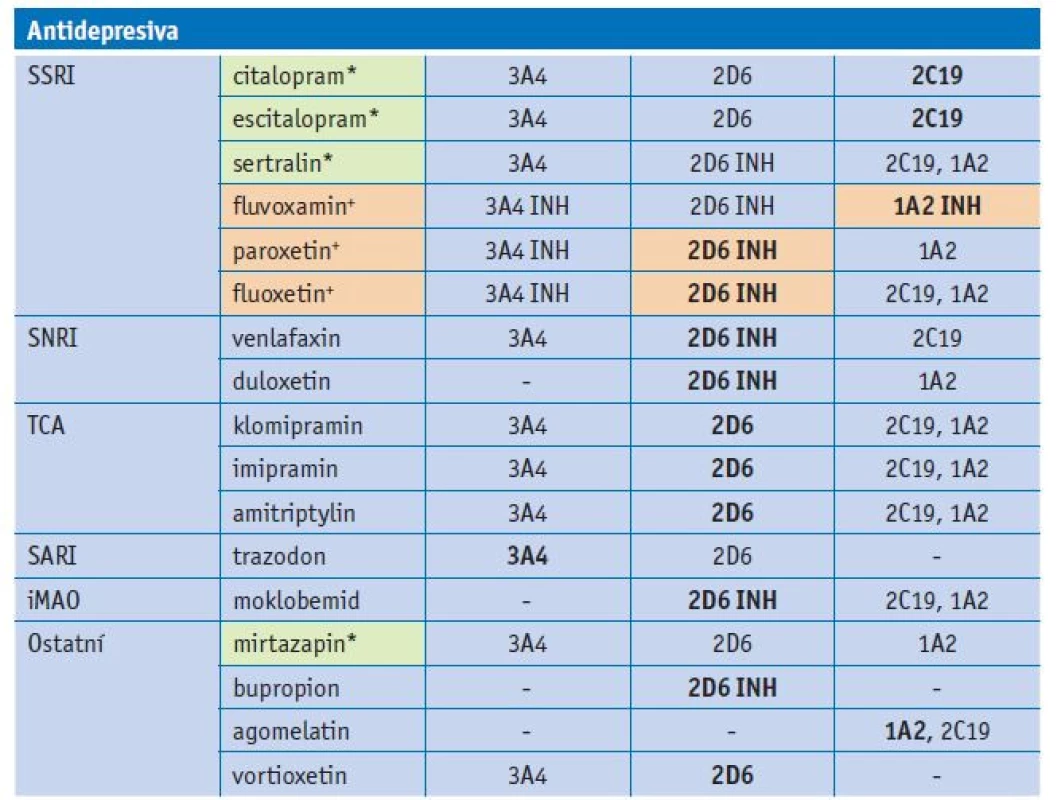
Vysvětlivky: zvýrazněny hlavní cesty metabolismu antidepresiv; INH – inhibice; *léčiva s minimálním vstupem do lékové interakce; +léčiva s vysokým rizikem lékové interakce Výběr psychofarmaka pro geriatrického pacienta
Při výběru psychofarmaka u geriatrické populace bychom měli zohlednit pacientovy potíže, zdravotní stav a přidružené komorbidity. Obecně jsou u této populace preferovány nižší dávky psychofarmak, které je v úvodní fázi léčby vhodné titrovat pomaleji v závislosti na jejich efektu a zejména pak snášenlivosti pacienta. Z antipsychotik je v gerontopsychiatrii preferován kvetiapin, který je spojen s nízkým rizikem extrapyramidových příznaků, navíc má dobrý efekt na spánek a uplatní se jako augmentační léčba deprese. Podobný receptorový profil má olanzapin, který se preferenčně používá v nižší dávce 5–10 mg. Alternativně se používá risperidon, ale i ten je vhodné podávat v nižší dávce do 2 mg. V praxi se často setkáme s tiapridem, který nemá antipsychotický efekt, ale používá se při potřebě zklidnění pacienta či při terapii delirantních stavů. Při neúčinnosti léčby výše uvedených variant může být zvolen i haloperidol ve snížené denní dávce, jehož výhodou je dostupnost v podobě různých lékových forem (tablety, kapky, injekce). Klozapin je indikován pouze jako rezervní antipsychotikum.(13,15)
Preferovanou skupinou antidepresiv v geriatrické populaci jsou SSRI, jež mají výhodný bezpečnostní profil a široké spektrum použití nejen při depresivních a úzkostných poruchách, ale i při poruchách chování. Nejnižší interakční potenciál mají citalopram, escitalopram a sertralin. Sertralin je bezpečný lék při zvýšeném kardiovaskulárním riziku pacienta, naproti tomu citalopram i escitalopram se mohou podílet na prodloužení QT intervalu, které je spojeno s rizikem závažné srdeční arytmie torsade de pointes. Fluoxetin a paroxetin patří mezi potencionálně nevhodná léčiva ve stáří. U fluoxetinu je překážkou jeho dlouhý biologický poločas s následným rizikem kumulace a paroxetin není vhodným lékem z důvodu jeho anticholinergního efektu. Obě léčiva mají také výrazný interakční potenciál.
Minimální vstup do lékové interakce má mirtazapin, jehož výhodou je pozitivní efekt na spánek a chuť k jídlu, čehož lze využít u pacientů s malnutricí. V praxi se setkáme u geriatrických pacientů s trazodonem v nižší dávce při nespavosti nebo s vortioxetinem, který vykazuje slibný efekt na zlepšení kognice. (13,15,16)
Přístup k lékovým interakcím v gerontopsychiatrii
Geriatričtí pacienti mohou mít komplexní léčebný režim, který přináší riziko lékových interakcí. Křehkost geriatrických pacientů souvisí mimo jiné s vyšší citlivostí na nežádoucí účinky léčiv, které mohou být podmíněny i lékovou interakcí.(17) Na každém geriatrickém oddělení se může uplatnit klinický farmaceut, který společně s lékařem zodpovídá za racionalitu a bezpečnost farmakoterapie. Přínos klinického farmaceuta spočívá v posouzení lékové interakce z hlediska její významnosti v celé šíři pacientovy medikace, tj. u psychiatrického pacienta včetně farmakoterapie somatických komorbidit. Multidisciplinární přístup při řešení lékových interakcí a racionalizaci farmakoterapie může vést ke zvýšení bezpečnosti a účinnosti lékových režimů a následně i kvality života geriatrických pacientů.(18–20)
Klinicky významné mohou být interakce u léčiv s podobným receptorovým působením nebo se stejným způsobem metabolizace nebo v případě, že jedno z léčiv je silným inhibitorem nebo induktorem některého z izoenzymů cytochromu P450. Individuální posouzení lékové interakce je důležité. Každá léková interakce nemusí nutně vést k přerušení terapie. Dostatečným opatřením může být změna dávky nebo monitorace plazmatické hladiny léčiva (TDM), která může být užitečným nástrojem při rozhodování, zda v léčbě pokračovat, nebo zvážit jiné možnosti. K TDM bychom měli přistoupit v indikovaných případech, a to zejména při změně dávek a nasazování nových léčiv ve specifických klinických situacích, např. výskyt nežádoucího účinku, použití off-label dávky, nedostatečný efekt terapie, podezření na nonadherenci nebo právě přítomnost lékové interakce.( 21) Terapeutické monitorování léčiv je vhodné u geriatrických pacientů, kdy může častěji docházet ke kumulaci léčiv při snížené funkci eliminačních orgánů, a také k častějšímu výskytu nežádoucích účinků vlivem lékových interakcí v komplexních režimech a různých komorbidit. Geriatričtí pacienti jsou obecně citlivější k nežádoucím účinkům léčiv, proto by TDM mělo být součástí individualizované léčby. Pro geriatrické pacienty mohou být z těchto důvodů dostatečné i nižší plazmatické hladiny. Například cílové hladiny klozapinu při léčbě psychóz u Parkinsonovi nemoci jsou mnohem nižší, 15–141 ng/L, oproti cílovým hladinám pro dospělou populaci, 350–600 ng/L.(22,23)
Příklady kazuistik z praxe klinického farmaceuta
Kazuistika 1: Léková interakce vlivem indukce CYP450
• Pacient: žena, 65 let
• Diagnóza: F33.0 periodická deprese
• Farmakoterapie: venlafaxin 150 mg tbl. (1-1-0), kvetiapin retard 200 mg tbl. (0-0-1), pregabalin 150 mg tbl. (2-0-2), karbamazepin 200 mg tbl. (1/2-1/2-1/2), trazodon 150 mg tbl. (0-0-2/3)
• Lékový problém: Posouzení interakčního potenciálu medikace, nedostatečný efekt antidepresivní medikace vlivem lékové interakce
Farmakoterapeutické doporučení klinického farmaceuta:
Pacientka s depresivní poruchou má v pravidelné medikaci léčivo s výrazným interakčním potenciálem, karbamazepin, který byl v minulosti indikován k léčbě neuropatie. Karbamazepin, jako silný induktor CYP3A4, může významně snížit účinek léčiv kvetiapinu a trazodonu, jež jsou dominantně metabolizována touto izoformou cytochromu. Současná léková kombinace proto nemusí být účinná.
U ostatních léčiv v medikaci (pregabalinu a venlafaxinu) by nemělo dojít k významnému ovlivnění jejich účinku. Venlafaxin je metabolizován dominantně jinou metabolickou cestou CYP2D6. Pregabalin je vylučován ledvinami z velké části v nezměněné formě, tj. nepodléhá metabolizaci. Z důvodu významného interakčního potenciálu karbamazepinu by byla vhodná konzultace neurologa za účelem zhodnocení přínosu karbamazepinu v léčbě neuropatie s případným přehodnocením jeho podávání.
V odborné literatuře jsou popsány klinické případy, kdy vlivem karbamazepinu plazmatické hladiny kvetiapinu a trazodonu klesly téměř k nulovým hodnotám.(24) Pokud by léková kombinace s karbamazepinem byla nadále podávána, hrozí selhání terapie. Pokud nebude možné karbamazepin vysadit, lze přistoupit k navýšení dávky obou léčiv, případně k jejich záměně na látky s jinou cestou metabolismu. Karbamazepin bude méně ovlivňovat plazmatické koncentrace olanzapinu, který se dominantně metabolizuje CYP1A2. Olanzapin lze u pacientky zvolit s výhodou podobného receptorového profilu jako kvetiapin, také může příznivě ovlivnit depresivní symptomatiku a mít pozitivní vliv na podporu spánku. Ze skupiny antidepresiv bude do lékové interakce s karbamazepinem v daleko menší míře vstupovat mirtazapin, citalopram, escitalopram nebo sertralin.
Závěr: Karbamazepin byl nasazen pro neuropatickou bolest před mnoha lety a nyní byl vyhodnocen jako zbytné léčivo. Karbamazepin byl vysazen z pravidelné medikace. Předpokládaná léková interakce karbamazepinu by mohla odeznít během 14 dní, proto by bylo vhodné s odstupem ověřit, zda budou plazmatické hladiny kvetiapinu a trazodonu po eliminaci lékové interakce v požadovaném terapeutickém rozmezí.
Kazuistika 2: Léková interakce vlivem inhibice CYP450
• Pacient: muž, 68 let
• Diagnóza: F32.2 těžká depresivní fáze bez psychotických příznaků
• Farmakoterapie: risperidon 1 mg tbl. (1-0-1), paroxetin 20 mg tbl. (1-0-1), pregabalin 150 mg tbl. (1-1-1), kyselina acetylsalicylová 100 mg tbl. (0-1 - 0), perindopril 4 mg tbl. (1-0-1)
• Lékový problém: Posouzení interakčního potenciálu medikace a projev nežádoucího účinku léčiva vlivem lékové interakce
Farmakoterapeutické doporučení klinického farmaceuta:
Pacient s těžkou depresivní fází přichází do hospitalizace s pravidelnou medikací od ambulantního psychiatra. U pacienta byl již ze začátku hospitalizace patrný mírný třes a zřejmě i dysartrie, což mohou být projevy extrapyramidové symptomatiky. Ta patří mezi časté nežádoucí účinky risperidonu, které je potřeba pravidelně sledovat.
Při stávající lékové kombinaci paroxetin a risperidon může dojít ke klinicky významné interakci. Paroxetin je silný inhibitor CYP2D6 a mírný inhibitor CYP3A4, jenž může významně zvyšovat hladiny risperidonu, který je dominantně metabolizován CYP2D6. Zvýšené hladiny risperidonu mohou indukovat poruchy hybnosti, které jsou u pacienta pozorovány. Také mohou způsobit prodloužení QT intervalu, a tím zvýšit riziko závažné srdeční arytmie. Z tohoto důvodu by bylo vhodné provést kontrolní EKG vyšetření, zejména ověřit hodnotu QT intervalu.
Paroxetin je řazen mezi potencionálně nevhodná léčiva ve stáří z důvodu jeho výrazněji vyjádřeného anticholinergního efektu v rámci skupiny SSRI. Mezi centrální anticholinergní účinky patří negativní vliv na kognici (tj. poruchy paměti, zhoršení projevů demence), agitovanost, delirium a mezi periferní anticholinergní účinky patří zácpa, retence moči, neostré vidění, tachykardie, suchost sliznic a jiné.(25) Pacient udává potíže se stolicí, které jsou aktuálně řešeny pravidelným podáváním laktulózy. Nelze tedy vyloučit ani negativní vliv paroxetinu na obstipaci. Paroxetin je navíc podáván ve vyšší denní dávce 40 mg, což obecně není vhodné u geriatrických pacientů.
Z těchto důvodu je ke zvážení výměna paroxetinu za jiného zástupce SSRI nebo antidepresiva z jiné lékové skupiny. U geriatrického pacienta lze s výhodou zvolit sertralin, který nemá výrazný interakční potenciál a má velmi nízké kardiovaskulární riziko. Vhodnou alternativou může být vortioxetin, jelikož u pacienta i přes pravidelné užívání SSRI došlo k dekompenzaci psychického stavu a následně i k hospitalizaci. Aktivizační vliv vortioxetinu by mohl být pro pacienta benefitem. Navíc toto antidepresivum vykazuje pozitivní vliv na kognici, čehož lze s výhodou využít u geriatrického pacienta.
Závěr: Paroxetin byl vysazen z pravidelné medikace záměnou za vortioxetin, po kterém došlo ke zlepšení psychického stavu pacienta ve smyslu projasnění nálady a zmírnění abulie. Extrapyramidové potíže se též zmírnily, dysartrie ustoupila a přetrvával pouze diskrétní třes, který nebránil každodenní sebeobsluze pacienta. Shrnutí Stárnutí naší populace je spojeno s polymorbiditou pacientů, která úzce souvisí s vysokým počtem léčiv, se kterým zároveň stoupá i riziko lékových interakcí. Ty mohou vést k neúčinnosti terapie nebo projevům nežádoucích účinků léčiv. Na základě uvedených kazuistik je snahou ilustrovat, že výskyt lékových interakcí v klinické praxi u geriatrických pacientů není ojedinělý. V gerontopsychiatrii jsou nejčastěji pozorovány lékové interakce na jaterním cytochromu P450, konkrétně jeho izoforem CYP2D6, CYP3A4 a CYP1A2, které metabolizují většinu běžně používaných psychofarmak.
Při výběru vhodného psychofarmaka pro geriatrického pacienta je zásadní znalost jeho receptorového profilu a farmakokinetických parametrů, abychom předešli nevhodným lékovým kombinacím. Důkladná znalost interakčního potenciálu léčiv je základním předpokladem racionální a bezpečné farmakoterapie geriatrických pacientů. Vzájemná spolupráce lékaře a klinického farmaceuta může být přínosem pro každého pacienta i pro zdravotnické zařízení, jelikož multidisciplinární přístup k managementu farmakoterapie ve stáří může být efektivním nástrojem, který zvyšuje kvalitu poskytované geriatrické péče.
PharmDr. Jana Michalcová
Promovala v roce 2014 na Farmaceutické fakultě v Brně. Své pracovní zkušenosti získala v nemocniční lékárně a domově pro seniory. V roce 2017 dokončila rigorózní práci na téma Možnosti farmaceutické intervence u psychiatrických pacientů a v roce 2018 dokončila atestaci z Nemocničního lékárenství. V roce 2019 absolvovala zahraniční stáž ve Finsku, kde pracovala na Oddělení klinické farmacie na Univerzitě v Helsinkách. Její oblastí zájmu je klinická farmacie se zaměřením psychiatrie a geriatrie. V současnosti dokončuje doktorské studium na Masarykově univerzitě a tématem její disertační práce je Bezpečnost farmakoterapie u geriatrických pacientů.
Korespondenční adresa:
PharmDr. Jana Michalcová
Ústav aplikované farmacie Farmaceutická fakulta MU Brno
Palackého třída 1946/1
612 00 Brno
e-mail: jana.michalcova@icloud.com
Zdroje
1. Kehusmaa S, Autti-Rämö I, Helenius H, et al. Factors associated with the utilization and costs of health and social services in frail elderly patients. BMC Health Serv Res 2012; 12 (1): 204.
2. Lehnert T, Heider D, Leicht H, et al. Review: Health Care Utilization and Costs of Elderly Persons With Multiple Chronic Conditions. Med Care Res Rev 2011; 68 (4): 387–420.
3. Chen Y, Zhu L, Zhou Q. Effects of drug pharmacokinetic/ pharmacodynamic properties, characteristics of medication use, and relevant pharmacological interventions on fall risk in elderly patients. Ther Clin Risk Manag 2014; 10 : 437–448.
4. Ambrose AF, Paul G, Hausdorff JM. Risk factors for falls among older adults: a review of the literature. Maturitas 2013; 75(1): 51–61.
5. Medication safety in polypharmacy: technical report. World Health Organization online. Dostupné z: https://www.who.int/publications - detail-redirect/medication-safety-in-polypharmacy-technical - report
6. Grundmann M. Problematika s podáváním léků ve stáří – II. nežádoucí účinky léků. Interní Med 2001; 3(2): 82–83.
7. Suchý D, Hromádka M. Příspěvek k problematice geriatrické farmakoterapie. Prakt Lékáren 2011; 7(3): 111–114.
8. Krombholz R, Drástová H. Polypragmázie – neblahý fenomén nejen v gerontopsychiatrii. Interní Med 2013; 15(8–9): 263 – 265.
9. Ereshefsky L, Jhee S, Grothe D. Antidepressant Drug-Drug Interaction Profile Update. Drugs R D 2005; 6(6): 323–336.
10. Gonzaga de Andrade Santos TN, Medonça da Cru Macieira G, Cardoso Sodré Alves BM, et al. Prevalence of clinically manifested drug interactions in hospitalized patients: A systematic review and meta-analysis. PLoS One 2020; 15(7): e0235353.
11. Akamine Y, Yasui-Furukori N, Ieri I, et al. Psychotropic Drug–Drug Interactions Involving P-Glycoprotein. CNS Drugs 2012; 26(11): 959–973.
12. Zanger UM, Schwab M. Cytochrome P450 enzymes in drug metabolism: Regulation of gene expression, enzyme activities, and impact of genetic variation. Pharmacol Ther 2013; 138(1): 103–141.
13. Mohr P, Kopeček M, Brunovský M, et al. Klinická psychofarmakologie, 2017.
14. Prokeš M, Suchopár J. Lékové interakce v psychiatrii-teorie a praxe. Psychiatrie pro praxi 2015; 16(2): 51–55.
15. Tašková I. Psychofarmaka v kazuistikách. 2021.
16. Češková E. Treatment of depressive disorder with cognitive dysfunction. Psychiatrie pro praxi 2017; 18(2): 60–63.
17. Bielaková K, Matějovská Kubešová H. Trends in pharmacotherapy for elderly patients. Prakt Lékáren 2018; 14(1): 8–10.
18. Rollason V, Vogt N. Reduction of Polypharmacy in the Elderly: A Systematic Review of the Role of the Pharmacist. Drugs Aging 2003; 20(11): 817–832.
19. Caffiero N, Delate T, Ehizuelen MD, et al. Effectiveness of a Clinical Pharmacist Medication Therapy Management Program in Discontinuation of Drugs to Avoid in the Elderly. J Manag Care Spec Pharm 2017; 23(5): 525–531.
20. Michalcova J, Vašut K, Airaksinen M, et al. Inclusion of medication - -related fall risk in fall risk assessment tool in geriatric care units. BMC Geriatr 2020;20 : 454.
21. Tašková I. Terapeutické monitorování psychofarmak z pohledu klinického farmaceuta: doporučení versus praxe. Remedia 2020; 30 : 650–656.
22. Mayerová M, Horská K, Ustohal L. Klozapin: moderní antipsychotikum s dlouhou tradicí. Praha: Galén 2021.
23. Lutz UC, Sirfy A, Wiatr G, et al. Clozapine serum concentrations in dopamimetic psychosis in Parkinson’s disease and related disorders. Eur J Clin Pharmacol 2014; 70(12): 1471–1476.
24. Suchopár J. Kompendium lékových interakcí Infopharm 2005; Praha: Infopharm 2004.
25. Rudolph JL. The Anticholinergic Risk Scale and Anticholinergic Adverse Effects in Older Persons. Arch Intern Med 2008; 168(5): 508.
Štítky
Geriatrie a gerontologie Praktické lékařství pro dospělé Protetika
Článek EditorialČlánek Inkontinence moče ve stáří
Článek vyšel v časopiseGeriatrie a Gerontologie
Nejčtenější tento týden
2022 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Trazodon pohledem praktického lékaře
-
Všechny články tohoto čísla
- Editorial
- Lékové interakce v gerontopsychiatrii – výběr antipsychotik a antidepresiv pro geriatrické pacienty
- Nemelanomové kožní nádory – bazaliom, spinaliom. Přehled o onemocnění a léčbě
- Inkontinence moče ve stáří
- Koagulopatie asociovaná s infekcí covid-19 a riziko tromboembolismu – známe jejich vzájemnou souvislost a následné řešení?
- Midline katétr u geriatrických nemocných v centru následné péče
- Neočekávaný průběh anti Xa aktivity po suicidálním požití rivaroxabanu u staršího nemocného
- Odešel internista a geriatr MUDr. Jan Zeman…
- Geriatrie a Gerontologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nemelanomové kožní nádory – bazaliom, spinaliom. Přehled o onemocnění a léčbě
- Midline katétr u geriatrických nemocných v centru následné péče
- Lékové interakce v gerontopsychiatrii – výběr antipsychotik a antidepresiv pro geriatrické pacienty
- Inkontinence moče ve stáří
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




