-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKoagulopatie asociovaná s infekcí covid-19 a riziko tromboembolismu – známe jejich vzájemnou souvislost a následné řešení?
Coagulopathy associated with COVID-19 infection and risk of thromboembolism – do we know their relationship and subsequent solution?
At the end of 2019, a new coronavirus SARS-CoV-2 was identified, which caused a global pandemic. This acute infectious disease is associated with coagulopathy, which leads to a hypercoagulable state in patients. Coagulopathy in this disease is complex in feature and involves a number of different factors. Patients result in a high risk of venous as well as arterial thrombosis. This finding leads to the inclusion of measures in hospitalized and outpatient patients to reduce the proportion of thromboembolism in COVID-19 infection.
Keywords:
Cytokines – Prophylaxis – coagulopathy – treatment – COVID-19 – thrombosis – risk factors
Autoři: Katarína Bielaková; Ondřej Ludka
Působiště autorů: Klinika interní, geriatrie a praktického lékařství LF MU a FN Brno
Vyšlo v časopise: Geriatrie a Gerontologie 2022, 11, č. 2: 84-89
Kategorie: Přehledový článek
Souhrn
Na konci roku 2019 byl identifikován nový koronavirus SARS-CoV-2, který způsobil vznik celosvětové pandemie. Toto akutní infekční onemocnění je spojeno s koagulopatií, která vede k hyperkoagulačnímu stavu u nemocných. Koagulopatie u tohoto onemocnění má komplexní povahu a podílí se na ní celá řada různých faktorů. U pacientů má za následek vysoké riziko vzniku trombóz v žilním, ale i v tepenném řečišti. Uvedené zjištění vede k zařazení opatření u hospitalizovaných a ambulantních pacientů, s cílem snížit podíl tromboembolismu u infekce covid-19.
Klíčová slova:
cytokiny – trombóza – léčba – rizikové faktory – koagulopatie – COVID-19 – profylaxe
Úvod
Naše společnost čelí celosvětové pandemii, a to od té doby, co byl víc než před 2 lety identifikován nový koronavirus SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2). Světová zdravotnická organizace (WHO) označuje nemoc, kterou způsobuje, za koronavirové onemocnění 2019 (covid-19). K 27. dubnu 2022 již tento virus celosvětově způsobil víc než 510 milionů případů infekce SARS - CoV-2 a byl příčinou víc než 6,2 milionu úmrtí.(1)
Tromboembolismus u nemocných s c ovidem-19
Žilní tromboembolická nemoc (VTE) při infekci covid-19 je přítomna u čtvrtiny až třetiny hospitalizovaných osob, přitom někteří autoři uvádějí ještě vyšší výskyt u pacientů v těžším stavu. U infekce covid - 19 dochází i k trombotickým příhodám v tepenném řečišti (infarkt myokardu, ischemické cévní mozkové příhody, trombózy periferních tepen), nicméně ty se objevují ve výrazně menším počtu.(2)
Podle Zhanga v metaanalýze, která zahrnovala 40 studií s 7966 pacienty hospitalizovanými s covidem-19, byla prevalence žilního tromboembolismu 31 % u pacientů na JIP, přičemž zavedení screeningu vedlo k trojnásobnému zvýšení její detekce.(3)
Zatím nebyl zcela objasněn přesný časový vztah mezi diagnózou covidu-19, rozvojem přidružené koagulopatie a následným výskytem žilního tromboembolismu. Li ve své práci uvádí nezávislou souvislost mezi VTE a delším intervalem od nástupu příznaků do přijetí do nemocnice.( 4) Řada studií na hospitalizovaných pacientech s covidem-19 uvádí progresivní nárůst kumulativní incidence VTE od 7. do 21. dne. Podle nizozemských autorů byl pozorován výskyt kumulativní incidence VTE na JIP 7. den 26 % (95% CI, 17–37), 14. den 47 % (95 % CI, 34–58) a 21. den 59 % (95 % CI, 42–72).(5,6) Další data naznačují, že zejména u pacientů s těžší formou onemocnění zůstává riziko vzniku VTE po delší dobu.(7)
Patofyziologie hyperkoagulačního stavu u covidu-19
Koagulopatie asociovaná s covidem-19 je hyperkoagulační stav, který není zcela pochopen, nicméně důkazy naznačují, že se jedná o komplexní proces.(8) Během infektu se spouští systémová zánětlivá odpověď organismu (SIRS), která má za následek nerovnováhu v homeostáze mezi přirozenými systémy antikoagulace a prokoagulačními faktory. Virem indukovaná cytokinová aktivita zahajuje koagulační kaskádu pomocí prozánětlivých mediátorů, jako jsou interleukiny (zejména IL-6). Následuje zvýšená exprese tkáňového faktoru s aktivací vnější koagulační kaskády. Při infekci covid-19 dochází k přímému poškození endotelu cév a k endoteliální dysfunkci v celé řadě orgánů, co potvrzuje i řada posmrtných studií covidu-19.(9)
Počáteční poškození vedoucí k hyperkoagulaci souvisí s dysregulací systému renin–angiotenzin. Virus SARS-CoV-2 má velkou afinitu k ACE2 (angiotenzin konvertující enzym 2) a váže se na jeho receptory na alveolární endoteliální membráně, čímž spouští intenzivní prozánětlivou odpověď a následně protrombotické prostředí. Tento receptor se taky nachází na endoteliálních buňkách různých orgánů. Vazba SARS-CoV-2 na ACE2 snižuje dostupnost enzymu a narušuje cyklus, kterým degraduje Ang II. Pacienti se zvýšenými hladinami Ang II mají vyšší riziko závažného onemocnění; byla popsána přímá korelace mezi virovou zátěží, poškozením plic a hladinami Ang II. Na rozvoji trombozánětu se podílí četné zánětlivé dráhy, včetně cytokinů, reaktantů akutní fáze a zánětlivého buněčného poškození zprostředkovaného buňkami. Byly popsány zvýšené hladiny IL-6, IL-7, tkáňového nekrotického faktoru a chemokinů, které vytvářejí protrombotické prostředí aktivací monocytů, neutrofilů a endotelu.(10,11) Aktivované monocyty stimulují expresi tkáňového faktoru, který spouští srážecí kaskádu k produkci trombinu, což následně vede k tvorbě trombu, aktivaci krevních destiček a další augmentaci zánětlivých drah.
U covidu-19 byly hlášeny zvýšené hladiny neutrofilních extracelulárních pastí (NETs).(12) Častěji se vyskytují u hospitalizovaných pacientů, zejména těch, kteří vyžadují mechanickou ventilaci. Předpokládá se, že abnormální aktivace neutrofilů a produkce NETs mohou přispívat k cytokinové bouři a nepříznivým následkům těžkého onemocnění. Infekce také způsobuje aktivaci komplementového systému, který hraje zásadní roli u těžkého covidu, potenciálně jako hlavní předchůdce cytokinové bouře.
Rizikové faktory spojené s rizikem vzniku tromboembolismu
Jako významný rizikový faktor spojený s rizikem vzniku VTE se ukázal těžký průběh infekce covid-19. Podle čínské retrospektivní studie (Li a kol.), která zahrnovala celkem 2779 pacientů, bylo riziko vzniku VTE u těchto pacientů 5,9krát vyšší.(4) Zhou a kol. v metaanalýze 34 studií identifikovali řadu komorbidit, které jsou asociované ze závažným průběhem, mezi ně patří chronické plicní onemocnění, arteriální hypertenze, diabetes mellitus, obezita a těžká orgánová dysfunkce kardiální, renální a hepatální.(13) Zvýšený výskyt trombotických příhod u pacientů na JIP není překvapivý, protože kriticky nemocní pacienti jsou náchylní k hyperkoagulaci v důsledku imobilizace, mechanické ventilace, nutriční insuficience a zavedených intervenčních vstupů. Dalším rizikovým faktorem se ukazuje i vyšší věk pacienta.(4) Nádorové onemocnění bylo identifikováno jako nezávislý prediktor VTE, pravděpodobně v důsledku již existující hyperkoagulability.(4)
Klinické projevy tromboembolismu
U pacientů má za následek vysoké riziko vzniku tepenných a žilních trombóz, přičemž tepenné řečiště (infarkt myokardu, ischemické cévní mozkové příhody či trombózy periferních tepen) je méně postiženo. Z tromboembolických komplikací je nejčastější plicní embolie, nicméně se jedná spíš o trombotizaci menších či větších větví plicní tepny, nikoliv o trombus vzniklý v periferních žilách dolních končetin, jako je to u klasické plicní embolie.(14)
Několik studií dokumentovalo výskyt atypické příhody VTE, jako je trombóza mozkových žil, trombóza splanchnického řečiště nebo postižení portální žíly.(15–17) Nezdá se, že by přítomnost trombózy mozkových žil souvisela se závažností infekce covid-19, nakolik byla popsána i u pacientů s mírným onemocněním. Časový sled vzniku trombózy se také liší, přičemž u některých pacientů se projevují mozkové symptomy jako symptomy covidu-19 a u jiných se rozvinou neurologické symptomy až 2 týdny po nástupu jiných symptomů covidu. Je proto vhodné myslet na to, aby i pacienti s neobvyklými příznaky, u kterých byla zjištěna trombóza, byli vyšetření na covid-19, a to i při absenci klasických příznaků koronarovirového infektu.
Laboratorní ukazatele
Hyperkoagulační stav u covidu-19 je spojen se zvýšením hladin D-dimeru, fibrinogenu, faktoru VIII a von Willebrandova faktoru a naopak dochází k poklesu krevních destiček a ke snížení antitrombinu.(18,5) D-dimer byl rozsáhle zkoumán pro svou potenciální užitečnost jako prognostický indikátor VTE u pacientů s covidem-19. Typicky se k vyloučení VTE používá hodnota D-dimeru < 0,5 μg/ml. Práce čínských autorů (Li a kol.) uvedla zvýšené riziko VTE (odds ratio [OR] = 14,18) s hladinami D-dimeru > 2,07 μg/ml.(4)
Práce Al Samkari zjistila, že hladina D-dimeru mezi 1,0 a 2,5 μg/ml byla spojena se zvýšeným rizikem VTE (OR = 3,04), které vzrostlo na OR 6,09, když hladiny přesáhly 2,5 μg/ml.(19) Nicméně je potřeba počítat s omezeností správné interpretace zvýšené hladiny D-dimeru, způsobené průvodními zánětlivými a infekčními procesy probíhajícími u pacientů s covidem-19. Řada studií také uvádí významně vyšší hladiny CRP u těch, u kterých se rozvinula VTE, než u těch, u kterých se nevyskytla. Dujardin ve své práci uvádí, že kombinace zvýšeného D-dimeru > 15 µg/ml s CRP > 280 mg/dl měla pozitivní prediktivní hodnotu 98 % pro VTE.(20)
Je nutné tedy vstupně provést u všech hospitalizovaných pacientů odběr koagulačních parametrů – protrombinového a aktivovaného parciálního tromboplastinového času, fibrinogenu a D-dimerů a klíčové je u pacientů s těžším stavem odběry pravidelně opakovat.(8)
Management VTE
Zvýšené povědomí o riziku VTE u pacientů s covidem-19 ve spojení se laboratorním monitorováním koagulačních a zánětlivých faktorů může vést k jeho časné identifikaci. Není doporučeno provádění rutinního screeningu žilní trombózy pomocí ultrazvukového vyšetření dolních končetin, nicméně musíme myslet na zvýšené riziko, a proto stav pravidelně vyhodnocovat, a pokud máme podezření na VTE, neprodleně ho provést. Spíše by se při rozhodování o zobrazovacích vyšetřeních mělo řídit klinickým podezřením.(21) Zobrazovací metody nemusí být proveditelné ve všech případech, zejména u těch se závažným onemocněním covidu (graf 1). Pokud existuje vysoké klinické podezření, léčba by se neměla odkládat, nakolik prodlení vede k horším výsledkům. Byla zdokumentována souvislost mezi VTE u pacientů s covidem-19 a mortalitou, přičemž četnost dosáhla 39,1 % u pacientů s VTE ve srovnání s 26 % u pacientů bez VTE.(22)
Graf 1. Algoritmus diagnostiky a léčby plicní embolie u pacientů s covidem-19(4) 
AK – antikoagulace, DVT – hluboká žilní trombóza, ECMO – extrakorporální membránová oxygenace, KI – kontraindikace, PE – plicní embolie, PESI – Pulmonary Embolism Severity Index, sPESI – Simplified Pulmonary Embolism Severity Index, TTE – transtorakální echokardiografie. Na zjištění VTE používáme stejné zobrazovací metody jako u pacientů bez infekce covid-19. Je třeba myslet na to, že se jedná o akutní infekční onemocnění, takže na žádankách musíme uvádět, že je pacient v izolačním režimu. V léčbě trombotických komplikací preferujeme LMWH (v terapeutických dávkách), nicméně můžeme využít ve vybraných situacích i UFH, dále DOAC a warfarin. Je vhodné pamatovat při indikaci přímých perorálních antikoagulancií (DOAC) na jejich významné lékové interakce mezi DOAC a jinými léky používanými k léčbě covidu-19.
U pacientů s heparinem indukovanou trombocytopenií v anamnéze lze použít alternativní látky, jako je fondaparinux.(23) Při léčbě obézních pacientů bude nutná úprava dávky na základě indexu tělesné hmotnosti. U masivní plicní embolie je možnost využít systémovou trombolýzu nebo další intervence, jako je perkutánní mechanická trombektomie, chirurgická embolektomie nebo extrakorporální membránová oxygenace (ECMO).
Při zvažování trombolytické léčby je třeba důkladně zvážit riziko krvácení. Riziko krvácení může být zvýšeno u pacientů kriticky nemocných kvůli vysokému výskytu diseminované intravaskulární koagulace, alveolárního poškození a krvácení a renální dysfunkce.(24,25) Studie prokázaly variabilní četnost krvácení v rozmezí od 2,7 % do 21 %, většinou ve skupině pacientů na antikoagulační terapii.(26) Metaanalýza zahrnující 48 studií uvádí souhrnnou incidenci 7,8 % (95% CI, 2,6–15,3 %) krvácení a 3,9 % (95 % CI, 1,2–7,9 %) závažného krvácení u pacientů s covidem-19.(27) Vzhledem ke složitosti těchto pacientů je ideální přístup multidisciplinárního týmu při jejich léčbě, zejména pokud se zvažují intervenční terapie. Takové týmy existují v mnoha nemocničních zařízeních. Kwok a kol. uvedli své zkušenosti s těmito týmy v newyorských nemocnicích během první fáze covidu-19. Během sledovaného období zaznamenali nárůst výskytu plicní embolie, nicméně nižší podíl aktivace multidisciplinárního týmu (26,8 % vs. 64,4 %; p < 0,001).(28) Léčba těchto pacientů byla podobná jako v období před koronavirovou pandemií, přičemž většina z nich byla léčena pouze antikoagulační terapií (89,5 % vs. 86,4 %; p = 0,70). Aktivace týmu odpovědného za léčbu plicní embolie během koronavirové pandemie byla spojena se zkrácenou délkou hospitalizace u pacientů (7,7 ± 7,7 dne vs. 13,2 ± 12,7 dne, p = 0.02).
Prevence TEN u hospitalizovaných pacientů
Optimální profylaxe pro pacienty s covidem-19 zůstává nejasná kvůli nedostatku vysoce kvalitních důkazů.(8) Byly obhajovány agresivní profylaktické a léčebné přístupy, zejména u kriticky nemocných pacientů, ale údaje jsou stále předmětem zkoumání. Automaticky je nevyhnutné u všech hospitalizovaných zavedení nefarmakologických opatření.
Podle doporučeného postupu Společnosti infekčního lékařství, Společnosti pro lékařskou mikrobiologii a Společnosti pro epidemiologii a mikrobiologii ČLS JEP, pokud je pacient s infekcí covid-19 hospitalizován na standardním oddělení a chronicky užívá antikoagulační léčbu, tak v léčbě pokračujeme.(29) V případě, že užívá jen protidestičkovou léčbu, přidáváme k ní profylaktickou dávku LMWH. Každopádně u všech ostatních při přijetí zahájíme profylaktické podávaní LMWH. Dávku redukujeme, pokud má pacient pod 50 kg, dále pokud je přítomna významná trombocytopenie, event. pokročilá renální insuficience. Navyšujeme u pacientů s BMI ≥ 40 kg/m2. LMWH je vhodné vysadit, pokud má pacient trombocytopenii < 25 x 109/l a fibrinogen < 0,5 g/l.(29)
U pacientů na odděleních intenzivní péče je nutno stratifikovat riziko TEN a riziko krvácení. Podáváme profylaktické dávky antikoagulancií (preferujeme LMWH), individuálně navyšujeme o 50–100 % – zejména pokud se jedná o pacienta s BMI ≥ 40 kg/m2 a/nebo je známý závažný trombofilní stav a v případě vstupu (centrální katétr). Je nutné monitorovat parametry koagulace a adekvátně zareagovat na nárůst D-dimeru.
Po propuštění zvažujeme indikaci k farmakologické tromboprofylaxi (nejčastěji LMWH) individuálně. Pokud je pacient ve vysokém riziku (pozitivní anamnéza VTE, klinicky významný trombofilní stav, obezita, aktivní onkologické onemocnění, závažné městnavé srdeční selhávání nebo imobilizace), doporučujeme alespoň na 14 dní (délka závisí na délce rekonvalescence). Můžeme taky využít skóre IMPROVE-VTE, které musí být ≥ 4 body nebo ≥ 2 body při současné elevaci D-dimeru (tab. 1).
Tab. 1. Riziko vzniku tromboembolismu, skórovací systém IMPROV E VT E 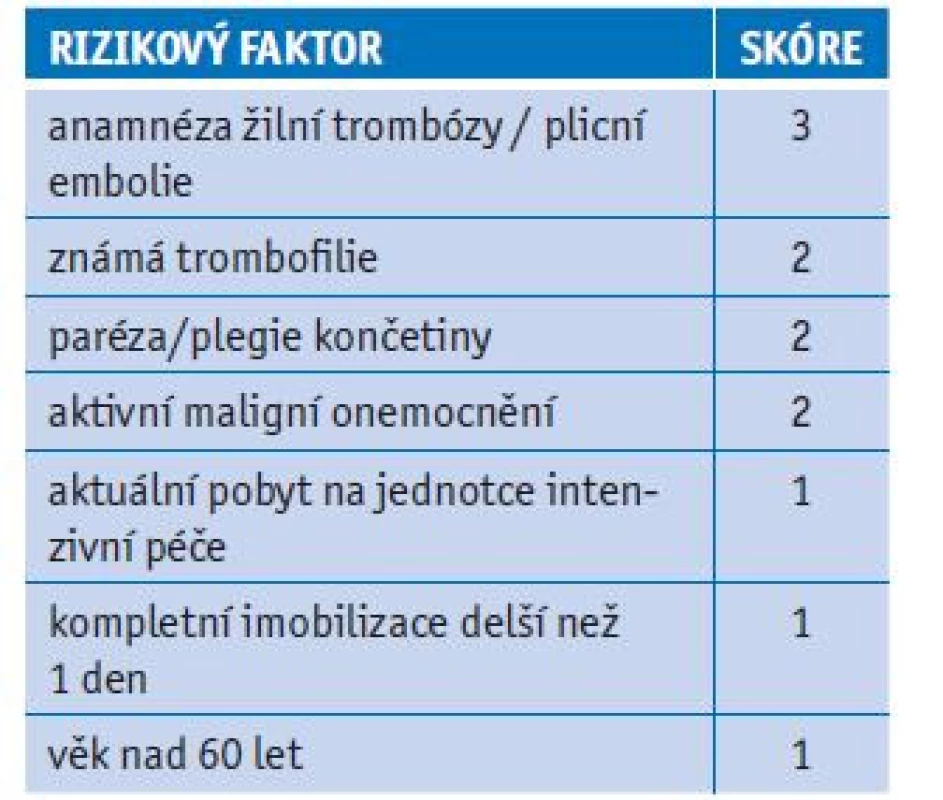
skóre ≥ 4 body: zvýšené riziko vzniku tromboembolické nemoci Prevence TEN u ambulantních pacientů
Podle doporučení Společnosti infekčního lékařství, Společnosti pro lékařskou mikrobiologii a Společnosti pro epidemiologii a mikrobiologii ČLS JEP by pacienti se středně těžkým průběhem v domácí léčbě měli mít zavedené nefarmakologické opatření TEN (hydratace, cvičení dolními končetinami na lůžku, chůze, komprese).(29) V případě, že má pacient přítomen víc než jeden rizikový faktor (vyšší věk, obezita, diabetes mellitus, kouření, dyslipidemie), je vhodné, aby užíval alespoň kyselinu acetylsalicylovou v dávce 100 mg denně.(29) Při indikaci tohoto preparátu musíme myslet na kontraindikace, interakce a riziko krvácení.
Pokud zhodnotíme riziko TEN jako vysoké, indikujeme farmakologickou tromboprofylaxi (preferujeme LMWH). Můžeme použít skórovací systém IMPROVE - VTE (tab. 1) nebo postupovat individuálně. Mezi významné rizikové faktory patří pozitivní anamnéza VTE, významný trombofilní stav, obezita, aktivní onkologické onemocnění, závažné městnavé srdeční selhávání a imobilita. Vždy je přitom nutno posoudit riziko krvácení. LMWH podáváme v profylaktické dávce podle SPC. Zvažujeme redukci u nemocných s hmotností pod 50 kg, s významnou trombocytopenií a pokročilou renální insuficiencí. Naopak zvýšení dávky je vhodné u pacientů s BMI ≥ 40 kg/m2. Délku tromboprofylaxe LMWH přizpůsobujeme závažnosti průběhu onemocnění.
Závěr
U infekce covid-19 je potřeba myslet na to, že hyperkoagulační stav často komplikuje stav pacientů venózními a arteriálními trombózami. Za relativně krátké období se v literatuře objevila celá řada nových poznatků, takže víme, že svoji roli v patofyziologii hraje jistě spuštění zánětlivé reakce, endoteliální infekce a dysregulace systému renin–angiotenzin. Nesmíme taky zapomenout na komplementový systém, cytokinovou bouři a aktivaci tvorby neutrofilních extracelulárních pastí. Vzhledem k tomu, že tyto trombotické komplikace zhoršují prognózu a přispívají k vyšší mortalitě, je nutno na to aktivně myslet a časně je vyloučit. Rozhodující v péči o pacienta s covidem-19 je adekvátní management, adekvátní vedení thromprofylaxe v ambulantní a nemocniční léčbě a v případě klinického podezření okamžité zahájení léčby. Kromě antikoagulační léčby je u masivní plicní embolie možnost využít systémovou trombolýzu nebo další intervence, jako je perkutánní mechanická trombektomie, chirurgická embolektomie nebo extrakorporální membránová oxygenace (ECMO). V managementu péče o tyto pacienty je ideální přístup multidisciplinárního týmu, zejména pokud se zvažují intervenční terapie.
MUDr. Katarína Bielaková, Ph.D., MHA
Promovala v roce 2003 na Fakultě všeobecného lékařství Univerzity v Bratislavě. Absolvovala atestaci z vnitřního lékařství a geriatrie. V roce 2015 ukončila postgraduální studium na Masarykově univerzitě v Brně. Tématem disertační práce bylo Clostridium difficile u geriatrických nemocných. Od roku 2016 je držitelkou funkční licence pro výkon F016 – umělá výživa a metabolická péče. V roce 2019 absolvovala vzdělávací program zaměřený na management ve zdravotnictví (MHA, Master of Healthcare Administration). Je místopředsedkyní České geriatrické společnosti. V současnosti pracuje jako primářka Kliniky interní, geriatrie a praktického lékařství v Brně a jako odborná asistentka na Lékařské fakultě Masarykovy univerzity v Brně.
Práce podpořena projektem specifického výzkumu MUNI/A/1361/2021.
Korespondenční adresa:
MUDr. Katarína Bielaková, Ph.D., MHA
Klinika interní, geriatrie a praktického lékařství
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: Bielakova.Katarina@fnbrno.cz
Zdroje
1. COVID-19 Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University (JHU). Dostupné z: https:// coronavirus.jhu.edu/map.html
2. Ali MAM, Spinler SA. Covid-19 and thrombosis: From bench to bedside. Trends in Cardiovascular Medicine 2021; 31 : 143–160.
3. Zhang R, Ni L, Di X, et al. Systematic review and meta-analysis of the prevalence of venous thromboembolic events in novel coronavirus disease-2019 patients. J Vasc Surg Venous Lymphat Disord 2021; 9(2): 289–298.
4. Li JY, Wang HF, Yin P, et al. Clinical characteristics and risk factors for symptomatic venous thromboembolism in hospitalized COVID-19 patients: a multicenter retrospective study. J Thromb Haemost 2021; 19(4): 1038–1048.
5. Cui S, Chen S, Li X, et al. Prevalence of venous thromboembolism in patients with severe novel coronavirus pneumonia. J Thromb Haemost 2020; 18(6): 1421–1424.
6. Klok FA, Krup M, van der Meer NJM, et al. Confirmation of the high cumulative incidence of thrombotic complications in critically ill ICU patients with COVID-19: An updated analysis. Thromb Res 2020; 191 : 148–150.
7. Middeldorp S, Coppens M, van Haaps TF, et al. Incidence of venous thromboembolism in hospitalized patients with COVID-19. J Thromb Haemost 2020; 18(8): 1995–2002.
8. Ahujaa N, Bhindera J, Nguyena J, et al. Venous thromboembolism in patients with COVID-19 infection: risk factors, prevention, and management. Semin Vasc Surg 2021; 34(3): 101–116.
9. Ackermann M, Verleden SE, Kuehnel M, et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med 2020; 383 : 120–128.
10. Merad M, Martin JC. Author correction: pathological inflammation in patients with COVID-19: a key role for monocytes and macrophages. Nat Rev Immunol 2020; 20(7): 448.
11. Argañaraz GA, Palmeira JF, Argañaraz ER. Phosphatidylserine inside out: a possible underlying mechanism in the inflammation and coagulation abnormalities of COVID-19. Cell Commun Signal 2020; 18(1): 190.
12. Vojáček JF. Trombotické komplikace Covid-19. Krátký přehled současných názorů. Interv Akut Kardiol 2021; 20(2): 98–101.
13. Zhou Y, Yang Q, Chi J, et al. Comorbidities and the risk of severe or fatal outcomes associated with coronavirus disease 2019: a systematic review and meta-analysis. Int J Infect Dis 2020; 99 : 47–56.
14. Bílková S, Hirmerová J. Koagulopatie asociovaná s onemocněním COVID-19. Vnitř Lék 2020; 66(7): 402–408.
15. Dakay K, Cooper J, Bloomfield J, et al. Cerebral venous sinus thrombosis in COVID-19 infection: a case series and review of the literature. J Stroke Cerebrovasc Dis 2021; 30(1): 105434.
16. Tu TM, Goh C, Tan YK, et al. Cerebral venous thrombosis in patients with COVID-19 infection: a case series and systematic review. J Stroke Cerebrovasc Dis 2020; 29(12): 105379.
17. Singh B, Kaur P, Maroules. Splanchnic vein thrombosis in COVID - 19: a review of literature. Dig Liver Dis 2020; 52(12): 1407 – 1409.
18. Choi JJ, Wehmeyer GT, Li HA, et al. D-dimer cut-off points and risk of venous thromboembolism in adult hospitalized patients with COVID-19. Thromb Res 2020; 196 : 318–321.
19. Al-Samkari H, Karp Leaf RS, Dzik WH, et al. COVID-19 and coagulation: bleeding and thrombotic manifestations of SARS-CoV-2 infection. Blood 2020; 136 : 489 – 500.
20. Dujardin RWG, Hilderink BN, Haksteen WE, et al. Biomarkers for the prediction of venous thromboembolism in critically ill COVID-19 patients. Thromb Res 2020; 196 : 308–312.
21. Barnes GD, Burnett A, Allen A, et al. Thromboembolism and anticoagulant therapy during the COVID - 19 pandemic: interim clinical guidance from the anticoagulation forum. J Thromb Thrombolysis 2020; 50(1):72–81.
22. Daughety MM. COVID-19 associated coagulopathy: thrombosis, hemorrhage and mortality rates with an escalated-dose thromboprophylaxis strategy. Thromb Res 2020; 196 : 483–485.
23. Donesu PP, Trujillo TC. Coagulopathy, venous thromboembolism, and anticoagulation in patients with COVID-19. Pharmacotherapy 2020; 40(11): 1130 – 1151
24. Tian S, Xiong Y, Liu H, et al. Pathological study of the 2019 novel coronavirus disease (COVID-19) through postmortem core biopsie. Mod Pathol 2020; 33(6): 1007–1014.
25. Zhou X, Cheby Z, Luo L, et al. Incidence and impact of disseminated intravascular coagulation in COVID-19 a systematic review and meta-analysis. Thromb Res 2021; 201 : 23–29.
26. Fraisse M, Logre E, Pajot O, et al. Thrombotic and hemorrhagic events in critically ill COVID-19 patients: a French monocenter retrospective study. Crit Care 2020; 24(1): 275.
27. Jiménez D, Garcia-Sanchez A, Rali P, et al. Incidence of VTE and bleeding among hospitalized patients with coronavirus disease 2019: a systematic review and meta-analysis. Chest 2021; 159(3): 1182–1196.
28. Kwok B, Brosnahan SB, Amoroso NE, et al. Pulmonary embolism response team activation during the COVID-19 pandemic in a New York City academic hospital: a retrospective cohort analysis. J Thromb Thrombolysis 2021; 51(2): 330 – 338.
29. Štefan M, Chrdle A, Husa P, et al. Covid-19 diagnostika a léčba. Doporučený postup Společnosti infekčního lékařství ČLS JEP. Klinická mikrobiologie a infekční lékařství. 2021; 27(2): 61 – 87.
Štítky
Geriatrie a gerontologie Praktické lékařství pro dospělé Protetika
Článek vyšel v časopiseGeriatrie a Gerontologie
Nejčtenější tento týden
2022 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Trazodon pohledem praktického lékaře
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Editorial
- Lékové interakce v gerontopsychiatrii – výběr antipsychotik a antidepresiv pro geriatrické pacienty
- Nemelanomové kožní nádory – bazaliom, spinaliom. Přehled o onemocnění a léčbě
- Inkontinence moče ve stáří
- Koagulopatie asociovaná s infekcí covid-19 a riziko tromboembolismu – známe jejich vzájemnou souvislost a následné řešení?
- Midline katétr u geriatrických nemocných v centru následné péče
- Neočekávaný průběh anti Xa aktivity po suicidálním požití rivaroxabanu u staršího nemocného
- Odešel internista a geriatr MUDr. Jan Zeman…
- Geriatrie a Gerontologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nemelanomové kožní nádory – bazaliom, spinaliom. Přehled o onemocnění a léčbě
- Midline katétr u geriatrických nemocných v centru následné péče
- Lékové interakce v gerontopsychiatrii – výběr antipsychotik a antidepresiv pro geriatrické pacienty
- Inkontinence moče ve stáří
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




