-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaZávažná diagnóza u geriatrického pacienta – laktátová acidóza asociovaná s metforminem. Pomýšlíme na ni dostatečně?
A serious diagnosis in geriatric patient – metformin-associated lactic acidosis. Do we consider it sufficiently?
Metformin is an oral antidiabetic drug of first choice with a positive effect on type 2 diabetes mellitus control as well as protective action on cardiovascular system. With respect to renal impairment, metformin should be prescribed in reduced doses or is even contraindicated due to high risk of metformin accumulation and/or lactic acidosis development. Till this day, this complication remains a risk especially in geriatric patients with reduced reserve capacity, who often suffer from numerous chronic diseases which can deteriorate due to a minor event. This fact should be remembered by every doctor, who should also be able to decide whether to terminate metformin therapy or not. In this article we present case studies of four patients of metabolic ICU treated with metformin-associated lactic acidosis.
Autoři: Zdeněk Bureš; David Albrecht
Působiště autorů: III. interní gerontometabolická klinika LF UK a FN Hradec Králové
Vyšlo v časopise: Geriatrie a Gerontologie 2021, 10, č. 2: 92-100
Kategorie: Kazuistika
Souhrn
Metformin je perorálním antidiabetikem první volby s příznivým vlivem na průběh diabetes mellitus 2. typu a s pozitivním ovlivněním zvýšeného kardiovaskulárního rizika diabetiků. Metformin je s ohledem na tíži renálního poškození předepisován v redukované dávce či zcela kontraindikován z důvodu možné akumulace metforminu a rizika rozvoje laktátové acidózy. Tato komplikace zůstává dodnes rizikem zejména pro geriatrické pacienty s omezenými tělesnými rezervami a s četnými chronickými onemocněními, jejichž deterioraci může přivodit jinak banální inzult. Na tento fakt by měl pomýšlet každý ošetřující lékař a umět správně rozhodnout o vhodnosti léčby metforminem. V následujícím článku prezentujeme čtyři pacienty metabolické jednotky intenzivní péče naší kliniky, kteří laktátovou acidózu v souvislosti s užíváním metforminu prodělali.
Úvod
Ve věkové skupině pacientů starších 65 let stoupá prevalence diabetu. Tito pacienti tvoří více než polovinu pacientů, kteří navštěvují ambulance praktických lékařů. Výzva ve stanovení cílů léčby diabetu u geriatrického pacienta vyplývá z heterogenity samotného procesu stárnutí a také z omezené dostupnosti klinických údajů pro tuto populaci. Každý lékař by si měl uvědomit úskalí péče o geriatrického pacienta a upřednostňovat individualizovaný léčebný plán tak, aby zajistil adekvátní kontrolu glykemie, aniž by byl pacient vystaven zbytečnému riziku. Starší pacienti s diabetem mají vyšší morbiditu a mortalitu oproti pacientům bez diabetu. Při rozhodování o způsobu léčby a stanovování cílů léčby je nutné zvážit samostatnost, pohybové a mentální schopnosti pacienta. Mezi další rizikové faktory patří polypragmazie, funkční distabilita a geriatrické syndromy – deprese, kognitivní poruchy, pády, poruchy zraku, dehydratace, močová inkontinence a další. Zejména ve skupině geriatrických pacientů je rizikovým faktorem při léčbě diabetu rozvoj hypoglykemie, který je spojen s vážnými následky a je usnadněn několika faktory – sníženou schopností manipulace s léčivými přípravky, nemožností zhodnotit vztah mezi požitými sacharidy a antidiabetickou terapií, rizikem lékových interakcí u polymorbidních pacientů vedoucích k polypragmazii a v neposlední řadě neuropatií se sníženou adrenergní reakcí.
Geriatričtí pacienti tedy tvoří velmi rozmanitou skupinu od zdatných zdravých pracujících jedinců, ke kterým lze terapeuticky přistupovat podobně jako k mladším jedincům, přes křehké pacienty s různě vyjádřenými geriatrickými syndromy až po pacienty s vysokým stupněm involučních změn a zhoršenou adaptabilitou s omezenou tolerancí zátěže. Terapeutické cíle a výběr léků se u jednotlivých skupin liší. Vzhledem k tomu, že se riziko rozvoje hypoglykemie zvyšuje s věkem, je doporučeno využívat především léky s nízkým rizikem vzniku hypoglykemie.(1) V této souvislosti je metformin lékem první volby. Metformin na rozdíl od sekretagogových léčiv nepůsobí přímo na beta buňky pankreatu, a proto nedochází k rychlému uvolňování inzulinu z pankreatu a riziku rozvoje hypoglykemie. Kromě toho jeho minimální vazba na plazmatické proteiny a absence aktivních metabolitů snižuje oproti jiným lékům riziko farmakologických interakcí. Jeho vylučování se děje hlavně ledvinami, metformin se vylučuje glomerulární filtrací, ale také tubulární sekrecí v proximálních tubulech. Použití metforminu u starších pacientů je proto třeba opatrně zvažovat při renálním poškození pro riziko rozvoje laktátové acidózy. Různý stupeň renálního poškození ve skupině geriatrických pacientů je dán samotným věkem a podílí se na něm další onemocnění (diabetická nefropatie, hypertenzní a aterosklerotické poškození ledvin, chronické glomerulonefritidy, chronické intersticiální nefritidy, obstrukční uropatie a další). Tíže renálního poškození nemusí být rozpoznána, protože často vyšetřovaná hodnota sérového kreatininu nemusí odpovídat jeho reálné renální clearance. Evropská léková agentura (EMA, European Medicine Agency) v roce 2016 publikovala závěr, že u pacientů s různým stupněm onemocnění ledvin (CKD 3a a CKD 3b) se mohou léky s metforminem v redukovaném dávkování užívat.(2) Dávkování metforminu v různých stadiích CKD jsou uvedena v tabulce 1. Chronické onemocnění ledvin (CKD), jakož i diabetes mellitus představují významný zdravotnický problém. Jejich výskyt stoupá a mají epidemický rozměr. Prevalence CKD podle National Kidney Foundation se odhaduje na 9–13 %. Pacienti s terminálním selháním ledvin tvoří jen nepatrnou část populace (0,1 %), přičemž převážná většina nemocných se nachází v prvních třech stadiích CKD. Tato stadia jsou riziková a často nediagnostikovaná a mohou projít až do chronického selhání ledvin. V posledních letech stoupá počet pacientů ve věku nad 75 let zařazovaných do dialyzační léčby, a dochází tak k postupné geriatrizaci nefrologie.(3) V Evropě, USA, Austrálii a na Novém Zélandu je diabetes nejčastější příčinou selhání ledvin, která vyžaduje dialyzační léčení. International Diabetes Federation předpokládá nárůst nemocných s diabetem na 552 milionů v roce 2030.(4) Diabetes mellitus postihuje v 7. dekádě až 20 % osob a dalších 20 % má porušenou glukózovou toleranci. V séniu jde převážně o diabetes mellitus 2. typu (nad 70 roků až 95 %). Méně často se setkáváme s diabetiky 1. typu, kteří si onemocnění přinášejí z dřívějších let.(5) Antidiabetická léčba metforminem je proto u geriatrických pacientů s diabetem spojena s významným nebezpečím rozvoje laktátové acidózy.
Tab. 1. Doporučení redukce dávky metforminu s ohledem na funkce ledvin (dle EMA, 2016)(2) 
CKD – chronické onemocnění ledvin Riziko rozvoje laktátové acidózy mimo porušenou funkci ledvin (snížená clearance metforminu ledvinami) a jater (snížená clearance laktátu) zvyšují také stavy, kdy dochází ke zvýšené produkci laktátu (infekce, sepse, šok, chronické srdeční selhávání, tkáňová hypoperfuze, hypoxie, užívání alkoholu, nedostatek thiaminu aj.). Laktátová acidóza je zpravidla provázena oběhovou a metabolickou dekompenzací. Jde o závažný stav, který dosahuje mortality 30 až 50 %, proto je třeba dobře znát kontraindikace podávání metforminu.
Laktát a laktátová acidóza
Metabolismus laktátu je úzce spjat s metabolismem glukózy. Glukóza se za běžných podmínek katabolizuje procesem zvaným glykolýza za vzniku dvou molekul pyruvátu a NADH. Za aerobních podmínek je metabolickým osudem pyruvátu hlavně mitochondriální oxidace (za účasti pyruvátdehydrogenázového komplexu) na oxid uhličitý a vodu za tvorby energie v dýchacím řetězci.
Tento sled reakcí vyžaduje kyslík, pokud však dojde z nějakého důvodu k jeho nedostatku nebo produkce pyruvátu překročí kapacitu oxidačního metabolismu, vzniká za účasti laktátdehydrogenázy a NADH + H+ z pyruvátu redukcí laktát. Tím je zajištěna regenerace NAD+ z NADH, který je koenzymem pro glyceraldehyd-3-fosfátdehydrogenázu, která umožní pokračování glykolýzy a tvorbu ATP. Laktát je následně uvolněn z buňky do krevního oběhu. Vznikající laktát se jednak může zapojit do Coriho cyklu nebo může být metabolizován v tkáních s aerobním metabolismem (srdce, játra). Laktát je důležitým intermediárním zdrojem energie v případě buněčného metabolického stresu. Koncentrace laktátu v krvi odráží rovnováhu mezi jeho produkcí a spotřebou ve tkáních. Normální sérové hladiny jsou v rozmezí 0,5–1,8 mmol/l.(6) Jakékoli metabolické stavy vedoucí ke zvýšení rovnovážného poměru redoxního systému NADH/NAD+ způsobí zvýšení čisté produkce laktátu. To platí nejen pro podmínky hypoxie/anoxie ve všech tkáních, ale dochází k tomu např. při intenzivní svalové práci nebo při metabolismu alkoholu v játrech. Kumulace laktátu v krvi podmiňuje pokles pH. Laktát se totiž uvolňuje z tkání doprovázen protonem, a protože kyselina mléčná je plně disociována při pH nad 6, může nadměrná produkce vést až k metabolické laktátové acidóze. Laktátová acidóza je metabolická acidóza s vysokou hodnotou anion gapu, která vzniká při zvýšené tvorbě laktátu nebo při jeho snížené utilizaci (koncentrace laktátu > 5 mmol/l, pH < 7,35). Laktátová acidóza se ale může vyvinout i u stavů, kdy je oxygenace tkání normální. U některých hypermetabolických stavů může dojít ke zvýšené tvorbě laktátu bez poklesu pH krve. Hladiny laktátemie jsou však obvykle menší než 5 mmol/l. Pravá laktátová acidóza mívá vyšší sérové hladiny laktátu a je zpravidla provázena oběhovou a metabolickou dekompenzací s poklesem pH krve. Laktátovou acidózu můžeme dělit na několik typů. Typ A (anaerobní) je častější, vzniká při tkáňové hypoxii následované rozvojem anaerobní glykolýzy, např. při hypoxemií, anemii, při systémovém šoku s oběhovou nestabilitou a také při otravě oxidem uhelnatým. Typ B (aerobní) je charakterizován stavem, kdy je buď tvorba laktátu zvýšena, nebo sníženo jeho odbourávání v prostředí normální oxygenace tkání. Typ B se dále klasifikuje na typ B1, který souvisí s onemocněním (jaterní selhání, renální selhání, malignity aj.), typ B2 souvisí s toxickým působením některých látek nebo léků (např. alkohol, biguanidy, propofol, valproát, salicyláty, linezolid, isoniazid, aminofylin). Typ B3 se vztahuje k metabolickým onemocněním.(7) U některých případů laktátové acidózy typu B může být přítomna latentní tkáňová hypoperfuze.
Metformin ovlivňuje tvorbu i odstraňování laktátu z krve. U diabetiků se mohou objevit oba typy laktátové acidózy. Incidence laktátové acidózy při léčbě metforminem se odhaduje na 3–10 případů na 100 000 pacientů za rok.(7–10) V jedné nizozemské studii se uvádí až 47 případů na 100 000 pacientů za rok, ale rozvoj laktátové acidózy zde byl připisován základnímu onemocnění.(11) Cochranova databáze z roku 2006 (246 studií) a později i z roku 2010 (347 studií) potvrdila, že užívání samotného metforminu nezvýšilo riziko vzniku laktátové acidózy. Riziko vzniku se zvýšilo pouze tehdy, pokud bylo přítomno akutní renální poškození, jaterní nedostatečnost, hypoxemie a hypotenze.(4)
Metformin a laktátová acidóza
Biguanidové deriváty byly vyvinuty k léčbě diabetes mellitus 2. typu v 50. letech. Většina z těchto derivátů (buformin, fenformin) byla však postupně stažena pro vysoké riziko rozvoje laktátové acidózy. V současné době je k léčbě diabetu indikován pouze metformin, který se stal základním lékem v terapii diabetes mellitus 2. typu.
Mechanismus působení metforminu spočívá ve snížení produkce glukózy v játrech inhibicí glukoneogeneze a glykogenolýzy, dochází ke zlepšení periferního vychytávání glukózy a využití glukózy ve svalech zvýšením citlivosti na inzulin, metformin zvyšuje transportní kapacitu glukózových transportérů (GLUT) a stimuluje intracelulární syntézu glykogenu. Z tohoto důvodu je hypoglykemické riziko spojené s tímto lékem velmi nízké.(12) Metformin se ukázal být účinný při snižování mikrovaskulárních i makrovaskulárních komplikací vyvolaných diabetem. Mimo jiné působí kardioprotektivně, snižuje hladiny triacylglycerolů, LDL cholesterolu, tělesnou hmotnost a plazmatické hladiny některých proinflamatorních molekul.(8)
Předpokládá se, že léčebný účinek metforminu je založen na principu snížení efektivity aerobního metabolismu následovaného poklesem zisku energie a tvorby ATP inhibicí mitochondriálního komplexu I respiračního řetězce. Zvyšuje se koncentrace AMP a následná změna poměru AMP/ATP ovlivňuje AMP-kinázu, enzym centrálně regulující energetické děje v buňce. Dochází ke zvýšenému vstupu energeticky bohatých látek do buněk, zvýšení vstupu glukózy do svalu a v játrech, k omezení syntézy a výdeje glukózy, snížení syntézy triacylglycerolů a zvýšení lipolýzy. Přeměnou glukózy na laktát a následnou přeměnou v Coriho cyklu zpět na glukózu vznikají energetické ztráty. Dochází ke ztrátám 4 molekul ATP na 1 molekulu glukózy. Klinické projevy intoxikace svědčí pro poruchu aerobního metabolismu s omezením zisku energie s korelující sníženou metabolickou produkcí oxidu uhličitého.(13)
Metformin v běžných terapeutických dávkách nezvyšuje hladinu postprandiálního laktátu nebo způsobuje jen mírné zvýšení (obvykle 1–2 mmol/l) na rozdíl od fenforminu, u kterého byl jasně prokázán hyperlaktátemický efekt. Odhadovaná incidence rozvoje laktátové acidózy je u metforminu asi 20× nižší než u zmiňovaného fenforminu.(8)
Při perorálním podání je přibližně 40 % dávky absorbováno v tenkém střevě (duodenum a proximální jejunum) a pouze 10 % je absorbováno v ileu a tlustém střevě. Neabsorbovaný metformin se akumuluje ve sliznici střeva a je nakonec vyloučen stolicí. Současné formulace metforminu mají biologickou dostupnost 50–60 %. Metformin není vázán na plazmatické bílkoviny a je ledvinami eliminován v nezměněné podobě. V případě, že dochází k akumulaci metforminu v plazmě (více než 5 µg/ml), dochází k prodloužení jeho eliminačního poločasu.(8)
Laktátovou acidózu, jež vzniká v souvislosti s užíváním metforminu, lze rozdělit na dva podtypy. Na laktátovou acidózu indukovanou metforminem – MILA (metformin-induced lactic acidosis), tedy acidózu vzniklou v přímé souvislosti s léčbou, resp. intoxikací metforminem. Dále pak na laktátovou acidózu asociovanou s metforminem – MALA (metformin-associated lactic acidosis), tedy laktátovou acidózu u nemocných léčených metforminem, bez přímé patofyziologické souvislosti. MALA má mortalitu 30–50 %.(14,15)
Významnou roli při vzniku laktátové acidózy hrají predisponující faktory a nedodržení kontraindikací podání metforminu. Diabetici, u kterých byl metformin prokazatelně potvrzen jako příčina laktátové acidózy, měli snížené renální funkce nebo hypoxii z důvodu např. srdečního selhání. U hospitalizovaných pacientů jsou tato rizika mnohem častější, proto je třeba znát kontraindikace podávání metforminu.(4) Metformin je nutné vynechat v případě závažného onemocnění spojeného s periferní hypoperfuzí, u dehydratace nebo zvracení. Mezi kontraindikace podávání metforminu patří:
přecitlivělost na léčivou látku nebo kteroukoliv pomocnou látku;
jakýkoliv typ akutní metabolické acidózy (jako např. laktátová acidóza, diabetická ketoacidóza);
závažné renální selhání (CKD 4 a více), akutní stavy s možností změny funkce ledvin (dehydratace, závažná infekce, šok);
akutní nebo chronické onemocnění, které může způsobit tkáňovou hypoxii, jako jsou srdeční nebo respirační selhání, nedávný infarkt myokardu, šok;
jaterní insuficience, akutní intoxikace alkoholem, alkoholismus;
vysadit před podáním jodovaných kontrastních látek i.v., kontrola renálních funkcí po 48 h, nenasazovat dříve;(7)
vysadit v případě chirurgického zákroku s celkovou, spinální nebo epidurální anestezií;
opatrnost je nutná při léčbě nesteroidními antirevmatiky a v případě diuretické léčby.(16)
U diabetiků s chronickou obstrukční plicní nemocí, kteří jsou léčeni metforminem, se může, stejně jako u kardiaků, rozvíjející acidóza projevovat dušností. Mezi nespecifické příznaky pro předávkování metforminem a laktátovou acidózu patří bolesti břicha, nevolnost, zvracení, průjmy a často jsou přítomny i poruchy vědomí. Laboratorně nalézáme hyperlaktátemii (> 5 mmol/l).
Léčba má i dnes neuspokojivé výsledky s přetrvávající vysokou mortalitou. Je nutné léčit příčinu, která laktátovou acidózu vyvolala, se snahou o zajištění dobré tkáňové perfuze. Metabolická acidóza se projevuje nežádoucími účinky na kardiovaskulární systém. Snižuje kontraktilitu myokardu, srdeční výdej, srdeční frekvenci, krevní tlak a perfuzi ledvinami a játry. Zvyšuje se sklon ke komorovým arytmiím. Přehled jednotlivých orgánových projevů metabolické acidózy je uveden v tabulce 2. Intravenózně aplikovaný hydrogenuhličitan zůstává hlavní součástí podpůrné léčby u aerobního typu laktátové acidózy (při pH < 7), přestože může vyvolávat elektrolytovou dysbalanci (hypokalemie a hypokalcemie) s rizikem vzniku „rebound“ metabolické alkalózy s posunem disociační křivky doleva, snížení myokardiální kontraktility aj.(14) Pokud je laktátová acidóza vyvolaná metforminem, je účinná náhrada funkce ledvin. Časná indikace je vhodná z pohledu mortality a morbidity. Lze tak zajistit, mimo eliminaci metforminu a laktátu, časnou korekci acidobazické rovnováhy. Dle tíže stavu nemocného lze volit mezi metodami intermitentními či kontinuálními. Intermitentní hemodialýza je z důvodu většího množství ošetřené krve za jednotku času výhodnější a účinnější. Při oběhové nestabilitě je však výhodnější kontinuální hemodialýza.
Tab. 2. Klinické projevy metabolické acidózy (převzato z Karvunidis et al., 2016)(14) 
Kazuistika 1
První kazuistika popisuje téměř 80letou pacientku E. M. s arteriální hypertenzí, permanentní fibrilací síní, diabetes mellitus 2. typu, hyperlipoproteinemií a hyperurikemií. Na svá chronická onemocnění dlouhodobě užívá rivaroxaban 15 mg 1x denně, kombinovaný preparát linagliptinu/metforminu 2,5/1000 mg 2x denně, glimepirid 3 mg 1x denně, trandolapril 2 mg 1x denně, kombinovaný preparát amilorid/hydrochlorothiazid 5/50 mg 1x denně, verapamil 240 mg 1x denně, allopurinol 300 mg 1x denně, moxonidin 0,4 mg 1x denně a dle potřeby při bolesti meloxikam. Stran rodinné anamnézy nejsou k dispozici žádné informace, další součásti anamnézy bez pozoruhodností.
Nemocná nejdříve navštívila svého praktického lékaře pro bolesti břicha, který těmto nepřisuzoval větší význam. Za dva dny se pacientka dostavila k ambulantnímu vyšetření na pohotovost pro přetrvávající a neustupující bolesti břicha. V laboratorním nálezu byla zjištěna mírná anemie, mírná elevace CRP bez leukocytózy, hyperkalemie (6,2 mmol/l) a elevace dusíkatých katabolitů (kreatinin 148 μmol/l). Na základě provedeného ultrazvukového vyšetření byl stav uzavřen jako akutní divertikulitida a nemocná odeslána s doporučením časné kontroly v chirurgické ambulanci a s antibiotickou léčbou ve složení metronidazol a ciprofloxacin do domácího ošetřování. Po dalších dvou dnech přichází pacientka ke kontrole na akutní chirurgickou ambulanci naší nemocnice. Klinicky dominují přetrvávající bolesti břicha, nově se objevily objemné průjmy bez patologické příměsi, což lékařem hodnoceno v rámci možné dysmikrobie při léčbě antibiotiky. V provedeném kontrolním odběru nalezena další progrese azotemie (kreatinin 254 μmol/l), trvající hyperkalemie (5,6 mmol/l), stav hodnocen jako akutní poškození ledvin prerenální etiologie při dehydrataci, podány infuze krystaloidů, pacientka propuštěna s doporučením vysadit antibiotika pro průjem a s plánem další kontroly v geriatrické ambulanci naší kliniky. Na tuto se dostavila za tři dny po kontrole na chirurgii. Dle manžela pacientky dominuje slabost a objevila se mírná zmatenost. Po celou dobu pacientka přijímala jen malé množství tekutin (do 500 ml/den). Při laboratorní kontrole zjištěna výrazná progrese azotemie (kreatinin 817 μmol/l) s hyperkalemií (6,8 mmol/l). Pacientka odeslána k hospitalizaci na geriatrickou JIP.
Na geriatrické JIP v arteriálních krevních plynech zjištěna významná metabolická acidóza s hyperlaktátemií: pH 7,156, pO2 23,7 kPa, pCO2 2,49 kPa, laktát 9,2 mmol/l, BE -21 mmol/l. Z anamnézy od nemocné doplněno, že po celou dobu probíhajícího infektu užívala pravidelně svou chronickou medikaci. S výhledem potřeby dialyzační léčby pacientka přeložena na metabolickou JIP naší kliniky. Sérová hladina metforminu již toxická (95 000 ng/ml, norm. do 1000 ng/ml). Stav hodnocen jako laktátová acidóza asociovaná s metforminem vzniklá při akutním poškození ledvin (acute on chronic) v rámci akutního infektu, při dehydrataci s průjmy a sníženým příjmem tekutin. Pacientka zajištěna dialyzační kanylou a zahájena akutní léčba intermitentní hemodialýzou. Při zavedené léčbě došlo k eliminaci metforminu a k obnově diurézy s následným rozvojem polyurické fáze renálního selhání s nutností hrazení tekutin infuzemi. Dále však již bez nutnosti užití hemoeliminačních metod. Během další hospitalizace na metabolické JIP pacientka v dobrém stavu, oběhově stabilní a rehabilitující. K další péči překládána na standardní diabetologické oddělení. Souhrnné laboratorní výsledky z průběhu hospitalizace jsou uvedeny v tabulce 3.
Tab. 3. Kazuistika 1 – souhrnné laboratorní výsledky z průběhu hospitalizace 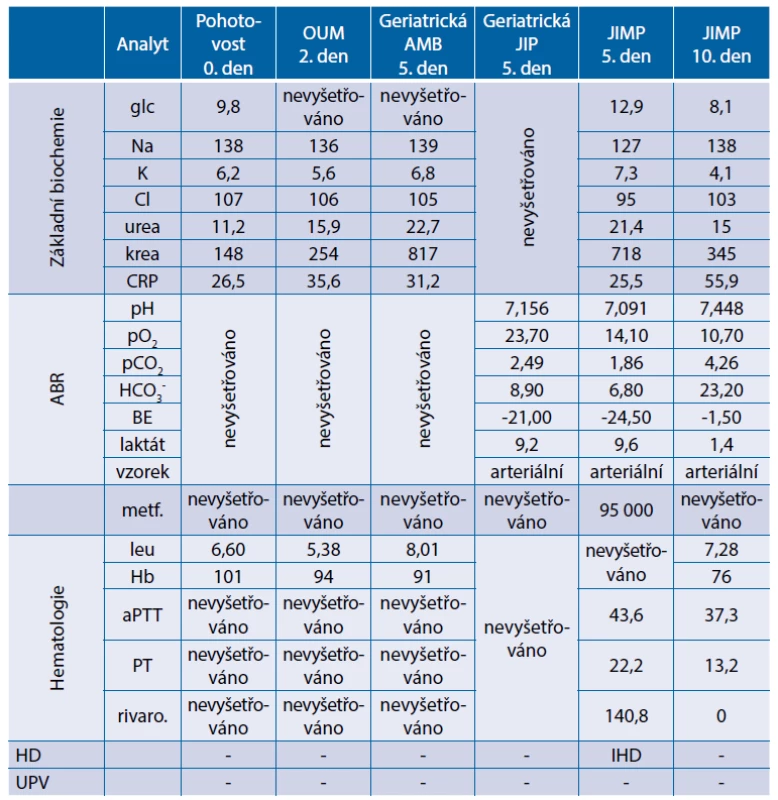
ABR – acidobazická rovnováha; AMB – ambulance; HD – hemodialýza; JIMP – metabolická jednotka intenzivní péče;
OUM – oddělení urgentní medicíny; UPV – umělá plicní ventilaceKazuistika 2
M. K. je 81letý klient domova pro seniory s diabetes mellitus 2. typu, arteriální hypertenzí, po prodělané idiopatické hluboké žilní trombóze a po CMP s reziduální levostrannou spastickou hemiparézou. Dlouhodobě užívající nebivolol 5 mg 1x denně, kyselinu acetylsalicylovou 100 mg 1x denně, metformin v celkové denní dávce 2500 mg, atorvastatin 20 mg 1x denně, kombinovaný preparát perindopril/amlodipin 10/10 mg 1x denně. Dále v případě potřeby metamizol, trospium, bromazepam a levocetrizin. Rodinná anamnéza pozitivní na výskyt tromboembolických příhod.
V noci na pátek byl pacient přivezen posádkou RZP na ambulanci urgentního příjmu pro opakované zvracení. Dle sdělení personálu domova seniorů zvracení snad s příměsí krve, několik dní absence stolice. Ve zvratcích při příjmu na ambulanci krev nezjištěna, charakter spíše atonické tekutiny. Doplněn i test na okultní krvácení ve vzorku zvratků, který byl negativní. V krevním obraze ve srovnání se staršími údaji v nemocničním systému bez zjevné anemizace. Provedeno ultrazvukové a CT vyšetření břicha s negativním nálezem. V krevních odběrech elevace azotemie (kreatinin 227 μmol/l) a hyperkalemie (K 6,3 mmol/l) s leukocytózou (leu 15,5 x 109 / l), CRP nízký. Provedeno vyšetření arteriálních krevních plynů a pacient odeslán s vyloučením krvácení a se závěrem zvracení a prerenální renální selhání na podkladě dehydratace k hospitalizaci na standardní oddělení k rehydratační léčbě. Při přijetí na standardní oddělení a podrobnějším prostudování výsledků analýzy arteriálních krevních plynů byla odhalena těžká metabolická acidóza: pH 7,336, pO2 12 kPa, pCO2 2,68 kPa, HCO3- 14 mmol/l, BE -13,6 mmol/l s vysokou hladinou laktátu 13,8 mmol/l. Pacient přeložen na MJIP. Pacient při přijetí hemodynamicky stabilní. Dovyšetřena hladina metforminu, která vysoká (50 333 ng/ml). Podána alkalizující infuze s hydrogenuhličitanem sodným. Zavedena dialyzační kanyla a zahájena léčba intermitentní hemodialýzou. Celkem provedena 4 hemodialyzační sezení ve 4 dnech. S takto zavedenou terapií došlo k výraznému poklesu hladiny metforminu a laktátu. Pobyt na JIP však komplikován nozokomiální močovou infekcí, pro kterou nasazen cefotaxim. Po 6 dnech byl pacient ve stabilizovaném stavu přeložen k další péči na geriatrickou JIP. Souhrnné laboratorní výsledky z průběhu hospitalizace jsou uvedeny v tabulce 4.
Tab. 4. Kazuistika 2 – souhrnné laboratorní výsledky z průběhu hospitalizace 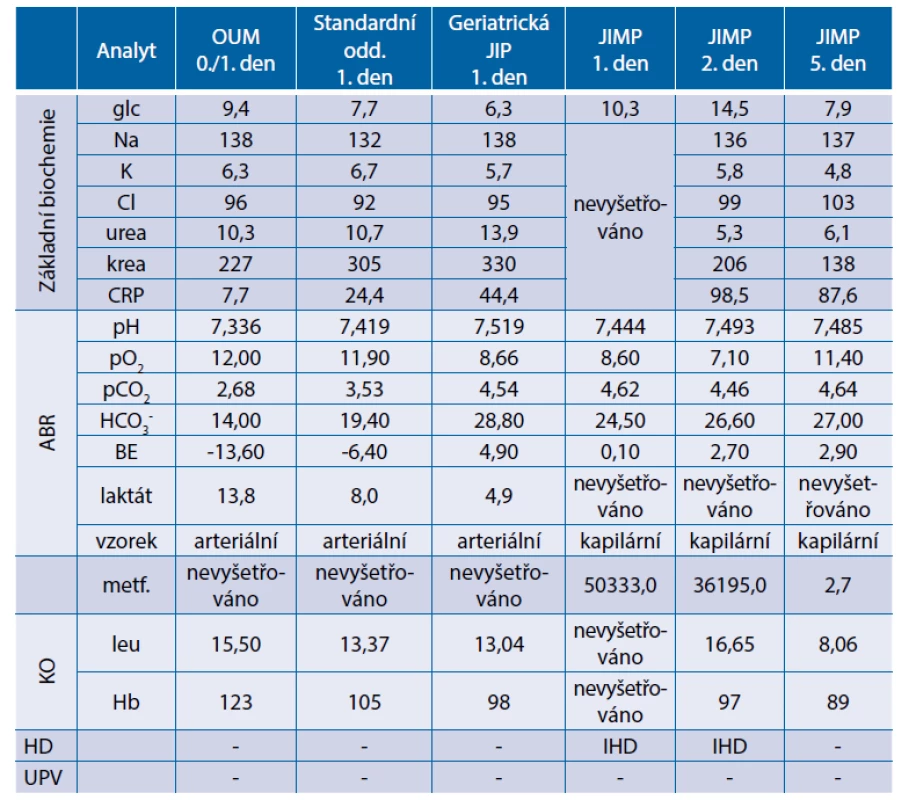
ABR – acidobazická rovnováha; HD – hemodialýza; JIMP – metabolická jednotka intenzivní péče; KO – krevní obraz;
OUM – oddělení urgentní medicíny; UPV – umělá plicní ventilaceKazuistika 3
V. B. je 79letá polymorbidní pacientka s ischemickou chorobou srdeční, po prodělaném infarktu v minulosti, s implantovaným ICD, chronickým srdečním selháním, mitrální insuficiencí, ischemickou chorobou dolních končetin, arteriální hypertenzí a diabetes mellitus 2. typu. V chronické medikaci užívá levothyroxin 100 µg 1x denně, pantoprazol 40 mg 1x denně, 100 mg kyseliny acetylsalicylové 1x denně, bisoprolol 5 mg 1x denně, furosemid 20 mg 1x denně, atorvastatin 80 mg 1x denně, trandolapril 2 mg 1x denně, hydrochlorothiazid 25 mg 1x denně, betahistin 16 mg 1x denně, gliklazid s řízeným uvolňováním 90 mg 1x denně a metformin v celkové denní dávce 3000 mg.
V noci na pátek byla nemocná přivezena posádkou RZP na ambulanci oddělení urgentního příjmu pro asi týden trvající zvracení a dehydrataci s průjmem při počátku obtíží. Klinický nález na břiše při přijetí je klidný. Pro těžkou hypoglykemii vstupně (2 mmol/l), podávána 40% glukóza i.v. V laboratoři zjištěna hyperkalemie (5,9 mmol/l) a hyperazotemie (krea 763 μmol/l), nízký CRP, leukocytóza (15,33 × 109 / l). Na bed-side UZ vyloučena subrenální obstrukce močových cest. V krevním odběru vysoký laktát. Pacientka s obrazem uremie a podezřením na laktátovou acidózu odeslána k hospitalizaci na interní metabolickou JIP naší kliniky. Při přijetí je pacientka somnolentní, probuditelná na oslovení, odpovídající krátkými odpověďmi či kývnutím hlavy, zcela anurická. Ve výsledcích arteriálních krevních plynů zjištěna těžká metabolická acidóza s vysokou hladinou laktátu: pH 6,896, pO2 12 kPa, pCO2 1,6 kPa, HCO3- 3,52 mmol/l, BE -30 mmol/l, laktát 14 mmol/l. Stav hodnocen v první řadě jako akutní gastroenteritida s dehydratací a akutním renálním selháním a laktátovou acidózou asociovanou s metforminem. Vysoká sérová hladina metforminu diagnózu potvrdila (9500 ng/ml). Bezprostředně po přijetí na JIP a zajištění invazí byla zahájena protrahovaná intermitentní hemodialýza současně s šetrnou intravenózní rehydratací. Pro rozvoj respirační insuficience pacientka od přijetí napojena na vysokoprůtokovou nazální oxygenoterapii (HFNO). Tentýž den ve večerních hodinách došlo k další progresi respirační insuficience a pacientka byla napojena na neinvazivní plicní ventilaci (NIV). Pro oběhovou nestabilitu zahájena vazopresorická podpora noradrenalinem. V laboratorních odběrech progredující známky zánětu, doplněn rtg hrudníku s počínajícími infiltráty. Pro vysoký laktát a dále progredující oběhovou nestabilitu doplněno nativní CT trupu, kde potvrzeny plicní infiltráty. Na CT břicha nebyly nalezeny známky střevní ischemie, které by mohly vysvětlovat laktátovou acidózu. Stav uzavírán jako počínající septický šok při komunitní pneumonii a zahájena empirická léčba v kombinaci cefotaxim + klarithromycin. Pro známky akutního srdečního selhávání s elevací NT-proBNP nadále již nepokračováno v infuzní terapii. Následující den pokračuje léčba protrahovanou intermitentní hemodialýzou. Klinicky však dochází k další progresi respirační insuficience s nadále postupující oběhovou nestabilitou s narůstající potřebou noradrenalinu a nutností rozšíření o inotropní podporu dobutaminem při známkách nízkého srdečního výdeje. Terapie dále rozšířena o podporu oběhu argipressinem a zahájeno podávání hydrokortisonu v substituční dávce pro postupné hroucení oběhu nereagující na katecholaminy. Pacientka byla intubována a napojena na umělou plicní ventilaci. Antibiotická terapie eskalována z cefotaximu na meropenem. Režim hemodialýzy změněn z dialýzy intermitentní na kontinuální, s citrátovou regionální antikoagulací. Laboratorně progrese známek zánětu, febrilie, rozvoj koagulopatie se suspektními známkami hypoxického poškození jater. Pro stále rostoucí spotřebu katecholaminů znovu zkoušeny tekutinové výzvy, které přechodně s pozitivním efektem na oběh a ventilaci. Při monitoraci pacientky zachyceny hemodynamicky významné epizody širokokomplexové tachykardie, pro které zahájeno sycení amiodaronem. Tyto paroxysmy hodnoceny v rámci sekundárního ischemického postižení myokardu v terénu intervenčně neřešitelných chronických difuzních aterosklerotických změn na koronárních tepnách. Nelze vyloučit, že v kritickém stavu zde neprobíhá i sekundární akutní koronární syndrom. Pro intoleranci citrátové antikoagulace nadále pokračováno již bez regionální antikoagulace. I přes maximalizovanou terapii stav progreduje do kombinace refrakterního kardiogenního a septického šoku nereagujícího na katecholaminy, s progresí hladiny laktátu v terénu metforminem indukované laktátové acidózy. Dochází k oběhové zástavě, konstatován exitus letalis.
Souhrnné laboratorní výsledky z průběhu hospitalizace jsou uvedeny v tabulce 5.
Tab. 5. Kazuistika 3 – souhrnné laboratorní výsledky z průběhu hospitalizace 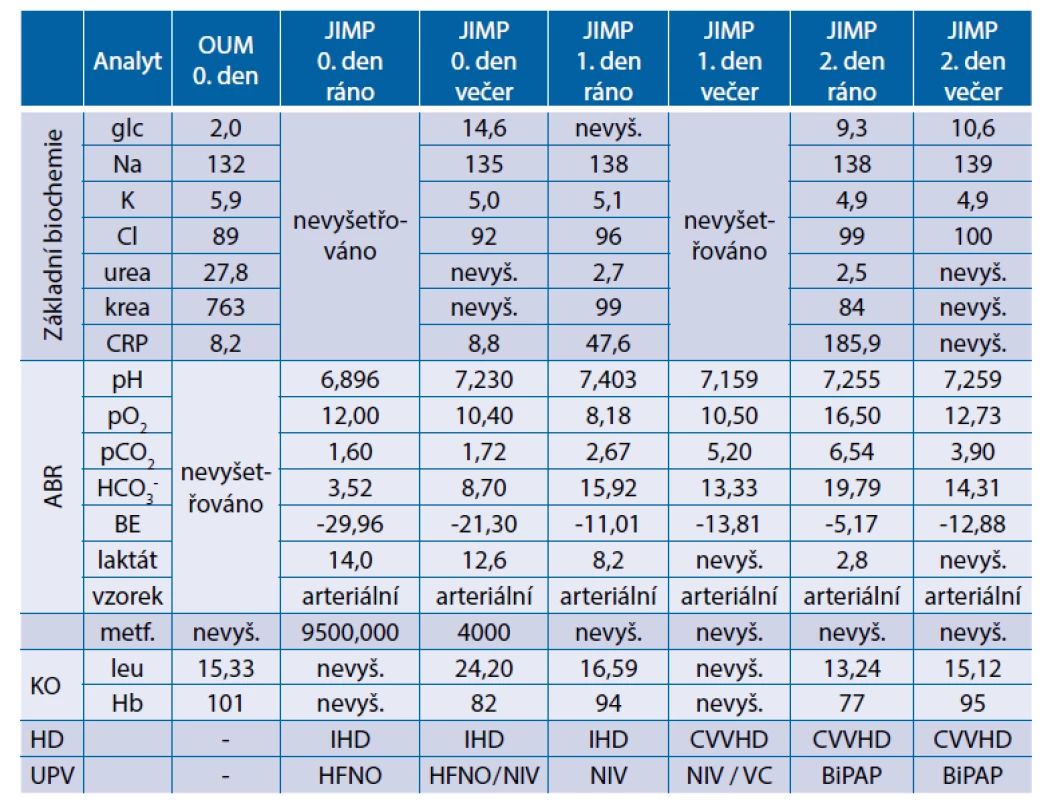
ABR – acidobazická rovnováha; AMB – ambulance; BiPAP – biphasic positive airway pressure; CVVHD – kontinuální venovenózní hemodialýza; HD – hemodialýza; HFNO – vysokoprůtoková nazální oxygenoterapie; JIMP – metabolická jednotka intenzivní péče; KO – krevní obraz; NIV – neinvazivní ventilace; OUM – oddělení urgentní medicíny; UPV – umělá plicní ventilace Kazuistika 4
I. P. je 63letá pacientka dlouhodobě se léčící s diabetes mellitus 2. typu a dyslipidemií. Chronicky užívá kombinovaný preparát inzulinů degludek/liraglutid 50 j. / 1,8 mg 1x denně ráno, kyselinu acetylsalicylovou 100 mg 1x denně, atorvastatin 20 mg x× denně a metformin v celkové denní dávce 2000 mg.
Ve středu časně ráno přichází I. P. na urologickou ambulanci, kde byla již před dvěma dny vyšetřena pro levostrannou renální koliku. Nyní ustoupily kolikovité bolesti v levém boku, nově se však objevily průjmy, horečka, dušnost a od předchozího večera i přes dostatečný příjem tekutin trvající anurie. Ultrazvukovým nálezem byla dilatace ureteru a kalichopánvičkového systému vlevo s možnou příčinou v distální levostranné ureterolitiáze. Stav ponechán ke konzervativnímu řešení pro vysokou šanci na spontánní odchod konkrementu. Pro dušnost pacientku urolog odesílá na interní ambulanci oddělení urgentní medicíny. Zde doplněno CT vyšetření břicha, které potvrzuje ultrazvukový nález urologa. V laboratorních vyšetřeních výrazná elevace známek zánětu (CRP 156,5 mg/l, leukocytóza 30,22 x 109 / l), progrese azotemie (kreatinin 287 μmol/l). Již během observace na ambulanci OUM se u pacientky rozvíjí šokový stav s tachykardií a hypotenzí s nutností tekutinové resuscitace a zahájením oběhové podpory noradrenalinem. Pacientka ihned odeslána k hospitalizaci na interní JIP naší kliniky.
Při přijetí v odebraných arteriálních krevních plynech zjištěna těžká metabolická acidóza s vysokou hladinou laktátu: pH 7,186, pO2 10,2 kPa, pCO2 2,28 kPa, HCO3- 2,28 mmol/l, BE -20,3 mmol/l, laktát 19 mmol/l, patrně v souvislosti s užíváním metforminu při akutní infekci.
Po odebrání materiálu ke kultivačnímu vyšetření a po zavedení invazivních vstupů byla zahájena antibiotická terapie cefotaximem. Zavedením uretrální cévky se podařilo zprůchodnit levý ureter (stent se nedařilo zavést) s odchodem pyurické moči. Pacientka byla napojena na protrahovanou intermitentní hemodialýzu. Od přijetí trvající těžká oběhová nestabilita, která nadále progreduje i po optimalizaci volumové náplně krystaloidy. Oběh podporován kombinací vazopresorů (noradrenalin + argipressin). Pro septickou kardiomyopatii nutná inotropní podpora dobutaminem. Pro prudce se rozvíjející septický šok zahájeno substituční podávání hydrokortisonu a eskalována antibiotická léčba na kombinaci meropenem + vankomycin. Pro zhoršení stavu vědomí a hyposaturace nemocná intubována a napojena na umělou plicní ventilaci. Přetrvává těžká oběhová nestabilita s raketovým nárůstem spotřeby katecholaminů, režim hemodialýzy změněn z intermitentní na kontinuální. Dochází k progresi metabolické acidózy s nutností korekce bikarbonátem. Následující den přetrvává kritický stav pacientky s dalším prohloubením metabolické acidózy a vzestupem laktátemie. Maximalizována oběhová podpora vazopresory, tekutinové výzvy bez efektu, klinicky známky centralizace oběhu. Režim hemodialýzy zkusmo změněn z kontinuální na intermitentní ve snaze o zlepšení eliminace metforminu, jehož hladina přetrvává toxická (mobilizace metforminu z depa v erythrocytech). Přesto nedochází k výraznější úpravě parametrů acidobazické rovnováhy. Po půlnoci téhož dne dochází k prohloubení hypotenze a nástupu bradykardie, za necelé dvě hodiny nastává exitus letalis při refrakterním septickém šoku v kombinaci s metforminem indukovanou laktátovou acidózou.
Souhrnné laboratorní výsledky z průběhu hospitalizace jsou uvedeny v tabulce 6.
Tab. 6. Kazuistika 4 – souhrnné laboratorní výsledky z průběhu hospitalizace 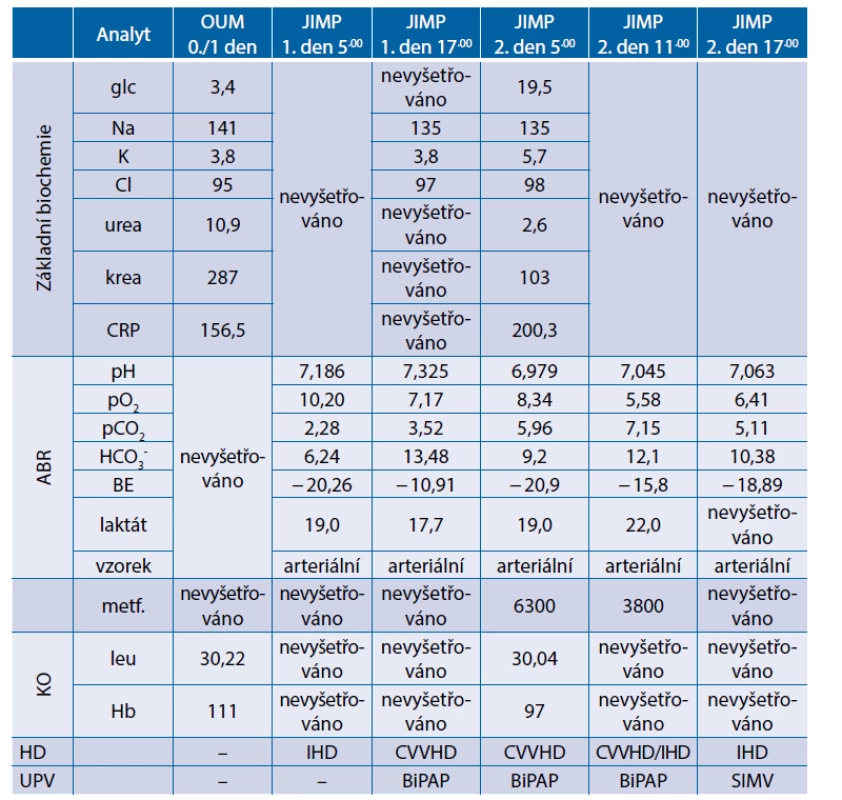
ABR – acidobazická rovnováha; BiPAP – biphasic positive airway pressure; CVVHD – kontinuální venovenózní hemodialýza; HD – hemodialýza; JIMP – metabolická jednotka intenzivní péče; KO – krevní obraz; OUM – oddělení urgentní medicíny; SIMV – synchronized intermittent mandatory ventilation; UPV – umělá plicní ventilace Komentář ke kazuistikám 1 a 2
Na první kazuistice demonstrujeme případ, kdy nemocná pro své obtíže opakovaně navštívila lékaře. Při každé z návštěv bylo provedeno biochemické vyšetření. I přes zřejmou progresi renální insuficience mezi jednotlivými návštěvami a přítomnou hyperkalemii společně s anamnézou dehydratace nebylo žádným z lékařů reagováno vysazením metforminu. Postupně došlo při horšících se renálních funkcích k akumulaci metforminu a při přijetí na JIP již byly vyjádřeny klinické známky intoxikace s téměř stonásobnou sérovou hladinou metforminu vzhledem k terapeutickému rozmezí. Zavedenou hemodialyzační léčbou se podařilo dosáhnout eliminace metforminu a úpravy vnitřního prostředí. Podobně došlo i ve druhé kazuistice k přehlédnutí metabolické acidózy a nebylo na laktátovou acidózu asociovanou s metforminem primárně pomýšleno. V obou popisovaných případech vedl k závažnému stavu pacientů čas, po který i přes relativně banální interkurentní onemocnění potenciálně však ohrožující funkci ledvin nedošlo k přerušení léčby metforminem. Gastrointestinální infekce způsobily pacientům ztráty tekutin průjmy a zvracením, které byly navíc umocněné omezeným příjmem per os. Rychle se tak rozvinulo akutní poškození ledvin prerenálního typu, kvůli němuž došlo k akumulaci metforminu s vyjádřením jeho toxického účinku.
Komentář ke kazuistikám 3 a 4
V případech pacientek v kazuistikách 3 a 4 mělo onemocnění infaustní průběh. Podobně jako v přechozích kazuistikách vedlo infekční onemocnění k dehydrataci s renálním selháním a ke zvýšené akumulaci metforminu s rozvojem laktátové acidózy. Polymorbidní pacientka v kazuistice 3 byla navíc limitována svými chronickými onemocněními a došlo k rozvoji septického a kardiogenního šoku. Pacientka v kazuistice 4 byla mladší a bez výrazných komorbidit, avšak stav v obou případech progredoval do těžkého septického šoku v terénu laktátové acidózy asociované s metforminem s letálním průběhem.
Závěr
Metformin zůstává i přes svou desítky let trvající historii perorálním antidiabetikem první volby u pacientů s diabetes mellitus 2. typu. Přesný mechanismus jeho účinku na zlepšení glukózové tolerance a snížení inzulinové rezistence není dosud zcela objasněn. Současně se však projevují jeho „extraglycidové“ účinky, m. j. úprava hyperandrogenního stavu s hirsutismem, poruchami cyklu a vypadáváním vlasů u žen, pokles kardiovaskulárního rizika u pacientů s aterosklerózou či snížení rizika onemocnění zhoubným nádorem. Zároveň se však dodnes vyskytuje jeho nejzávažnější nežádoucí účinek, jenž se při chybné diagnostice a opožděném zahájení léčby může stát letálním – laktátová acidóza. Její rozvoj je obvykle podmíněn snížením eliminačních funkcí ledvin; pacientům s chronickou renální insuficiencí je tedy metformin nasazován velmi opatrně a v redukovaných dávkách. Zůstává však opomíjeno, že především geriatričtí pacienti, často s diabetem na terapii metforminem, s věkem podmíněnou homeostenózou a křehkou rovnováhou chronických onemocnění jsou k rychlému rozvoji akutního renálního poškození obzvláště náchylní. Jeho příčinou přitom mohou být zdánlivě banální afekce, jako gastrointestinální infekty. Úkolem lékařů dispenzarizujících takovéto pacienty je především důsledná edukace – v případě onemocnění chorobou, která vede k rychlým ztrátám tekutin z organismu, popř. znemožní jejich obvyklý příjem per os, je nutno léčbu metforminem přerušit a vyhledat lékařskou pomoc. Lékaři v primární péči by pak měli nejen u geriatrických pacientů přicházejících s takovýmto akutním problémem pátrat po metforminu (i jiných léčivech podléhajících renální eliminaci), důsledně vyšetřit stav hydratace organismu a renální funkce a umožnit návrat k chronické terapii teprve po jejich uspokojivé korekci.
MUDr. Ing. Zdeněk Bureš
III. interní gerontometabolická klinika
LF UK a FNHK
Sokolská 581, 500 05 Hradec Králové
e-mail: zdenek.bures@student.upce.cz
Zdroje
1. Karen I, Svačina Š, Jurašková B. Diabetes mellitus, léčba u starších pacientů v ČR. Doporučený diagnostický a terapeutický postup pro všeobecné praktické lékaře. Geri a gero 2019; 2 78–95.
2. EMA/868987/2016. Use of metformin to treat diabetes now expanded to patients with moderately reducedkidneyfunction. Dostupné z: www.ema.europa.eu/medicines/ human/referrals/metformin-metformin - containing-medicines.
3. Nováková M. Geriatrický pacient v dialyzační péči – zkušenosti z Centra následné péče FN Motol. Geri a gero 2018; 7(1): 17–20.
4. Borbély Z. Chronická obličková choroba, metformín a laktátová acidóza. Vnitř Lék 2016; (2): 299 – 303.
5. Weber P, Meluzínová H, Prudius D. Diabetes mellitus – geriatrické syndromy, cíle a možnosti léčby ve vyšším věku. Geri a gero 2014; (4): 194–198.
6. Kruse O, Grunnet N, Barfod C. Blood lactate as a predictor for in-hospital mortality in patients admitted acutely to hospital: a systematic review. Scand J Trauma Resusc Emerg Med 2011; (19).
7. Šmahelová A. Metformin a ledviny. Vnitř Lék 2008; (5): 535–540.
8. DeFronzo R, Alexander Fleming G, Chen K, Bicsak TA. Metformin - associated lactic acidosis: Current perspectives on causes and risk. Metabolism 2015; (2): 20–29.
9. Inzucchi SE, Lipska KJ, Mayo H, et al. Metformin in patients with type 2 diabetes and kidney disease: a systematic review. JAMA 2014; (24): 2668–2675.
10 Kezerle, L, Shaleva L, Barski L. Treating the elderly diabetic patient: special considerations. Diabetes Metab Syndr Obes 2014; 7 : 391–400.
11. van Berlo-van de Laar IR, Vermeij CG, Doorenbos CJ. Metformin associated lactic acidosis: incidence and clinical correlation with metformin serum concentration measurements. J Clin Pharm Ther 2011; 36(3): 376 – 382.
12. Onder G, Ortolani E, Pellizzari L. Metformina nell’anziano diabetico: gallina vecchia fa buon brodo. Focus Farmacovigilanza 2016; (3): 9–11.
13. Kubát K, Zbořil M, Semrádová M, Kaňák V. 23 případů metforminem indukované metabolické laktátové acidózy. Klinická Biochemie a Metabolismus 2017; (2): 77–85.
14. Karvunidis, T, Harazím M, Raděj J, et al. Laktátová acidóza asociovanás metforminem–minireview na podkladě kazuistik. Anesteziologie a intenzivní medicína 2016; (4): 243–251.
15. Lalau JP, Arnouts P, Sharif A, De Broe ME. Metformin and other antidiabetic agents in renal failure patients. Kidney Int 2015; (2): 308–322.
16. Uličiansky V, Schroner Z. Metformín u pacientov s chronickým obličkovým a kardiovaskulárnym ochorením. Diabetes a obezita 2019; (37): 45–53.
Štítky
Geriatrie a gerontologie Praktické lékařství pro dospělé Protetika
Článek Dlouhodobá péče v DánskuČlánek EDITORIAL
Článek vyšel v časopiseGeriatrie a Gerontologie
Nejčtenější tento týden
2021 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Trazodon pohledem praktického lékaře
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
-
Všechny články tohoto čísla
- Porucha hlasu jako symptom amyotrofické laterální sklerózy
- Program časné postcovidové péče o geriatrické pacienty
- Dlouhodobá péče v Dánsku
- EDITORIAL
- Právě startují meditalks+ – podcasty pro lékaře.
- Analýza COVID pozitivních pacientů hospitalizovaných v zařízení následné péče
- Implementace paliativní péče u geriatrických pacientů se srdečním selháním
- Léky jako významný rizikový faktor pádu u geriatrických pacientů
- Věkem podmíněné změny struktury funkce myokardu
- Možnosti nového přístupu k posuzování stupně závislosti pro účely příspěvku na péči u osob starších 65 let
- Věkem podmíněná makulární degenerace
- Závažná diagnóza u geriatrického pacienta – laktátová acidóza asociovaná s metforminem. Pomýšlíme na ni dostatečně?
- Geriatrie a Gerontologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Porucha hlasu jako symptom amyotrofické laterální sklerózy
- Závažná diagnóza u geriatrického pacienta – laktátová acidóza asociovaná s metforminem. Pomýšlíme na ni dostatečně?
- Léky jako významný rizikový faktor pádu u geriatrických pacientů
- Věkem podmíněná makulární degenerace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




