-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Věkem podmíněná makulární degenerace
Age-related macular degeneration
Age-related macular degeneration (AMD) is the most common cause of vision loss in people over the age of 65 in developed countries. In most patients, a „dry“ form of AMD is noted, which gradually progresses. Choroidal nonvascular membrane is the main sign of „wet“ form of AMD which is present in 10 % of patients approximately. AMD develops as a result of an interaction between genetic and lifestyle factors of patients. The treatment of the choice of the wet form of AMD is intravitreal anti-VEGF injections, in the case of the dry form of AMD we can choose antioxidants, preparations with lutein and haemorheopheresis. An essential prerequisite for successful treatment is early diagnosis and especially early initiation of the treatment.
Keywords:
age-related macular degeneration – lutein – rheohaemapheresis – ranibizumab – aflibercept – brolucizumab
Autoři: Alexandr Stěpanov
Působiště autorů: Oční klinika LF UK a FN Hradec Králové
Vyšlo v časopise: Geriatrie a Gerontologie 2021, 10, č. 2: 87-91
Kategorie: Přehledový článek
Souhrn
Věkem podmíněná makulární degenerace (VPMD) je ve vyspělých zemích nejčastější příčinou ztráty zraku lidí starších 65 let. U většiny pacientů lze zaznamenat „suchou“ formu VPMD, která pozvolna progreduje. Přibližně u 10 % pacientů se vyvíjí rychle postupující „vlhká“ forma VPMD, jejíž hlavní známkou je přítomnost choroidální nevaskulární membrány. VPMD vzniká na základě spojení genetických faktorů a životního stylu pacienta. Léčbou volby vlhké formy VPMD jsou intravitreální antiVEGF preparáty, v případě suché formy VPMD volíme antioxidanty, preparáty s obsahem luteinu a hemorheoferézu. Zásadním předpokladem úspěšné léčby je včasná diagnostika, a zejména včasné zahájení terapie.
Klíčová slova:
věkem podmíněná makulární degenerace – lutein – hemorheoferéza – ranibizumab – aflibercept – brolucizumab
Úvod
Věkem podmíněná makulární degenerace (VPMD) je degenerativní onemocnění sítnice s maximem změn v makule. Je hlavní příčinou praktické slepoty v populaci starší 65 let ve vyspělých zemích.(1) U většiny pacientů nacházíme pomalu se rozvíjející „suchou“ atrofickou formu VPMD, která je charakterizována změnami v retinálním pigmentovém epitelu (RPE) a tvorbou drúz mezi RPE a Bruchovou membránou (BM). Přibližně u 10 % pacientů se vyvíjí rychle postupující „vlhká“ forma VPMD, její hlavní známkou je přítomnost choroidální nevaskulární membrány (CNV). V takovém případě skončí 80–90 % nemocných praktickou slepotou.
Epidemiologie
Prevalence nemoci je v přímé souvislosti s věkem pacienta. Epidemiologické studie uvádějí výskyt choroby ve věku 52 až 64 let u 1,6 % osob, u pacientů ve věku 65 až 74 let je tímto onemocněním postiženo až 11 % z celkové populace a u lidí ve věku 75 až 85 let je výskyt kolem 27,9 %.(2) Předpokládá se, že v roce 2025 bude postiženo VPMD přibližně 28 milionů obyvatel Evropské unie.(3)
Etiopatogeneze
Hlavním místem postižení při VPMD jsou následující oční struktury: BM, RPE a vrstva choriokapilaris v cévnatce. Nedostatečná degradace během fagocytózy přivádí k ukládání metabolitů na úrovni RPE a BM s následnou tvorbou drúz. Degradace RPE má za následek pokles počtu fotoreceptorů v centrální krajině.(4)
Poruchy v BM souvisejí se vznikem defektů, přes které prorůstají novotvořené cévy z vrstvy choriokapilaris pod RPE, nebo dokonce přes RPE pod sítnici. Vznik CNV souvisí se zvýšením tvorby angiogenních růstových faktorů v RPE a v zevních vrstvách neuroretiny. Přesná etiopatogeneze vzniku CNV není stále pochopena. Růst novotvořených cév podporuje fibroplastickou odpověď tkáně s následným rozvojem fibrovaskulární jizvy. Vzhledem k poruše hematoretinální bariéry vzniká perivaskulární exsudace s následnou ablací RPE a neuroretiny, doprovázenou intraretinálním edémem. Dalším projevem aktivity CNV je subretinální a intraretinální krvácení, které může být komplikováno hemoragickým odchlípením neuroretiny a krvácením do sklivcového prostoru (hemoftalmus).(4)
Rizikové faktory
Je známo, že hlavním rizikovým faktorem onemocnění je věk pacienta.(2) Ohledně rasové predispozice je známo, že výskyt VPMD u pacientů ve věku 45 až 65 let je nejvyšší u bělochů (5,4 %), pak u Číňanů (4,6 %), hispánců (4,2 %) a nejnižší u černochů (2,4 %).(5) Další prokázané rizikové faktory zahrnují dědičnost a kouření.(6) Mezi předpokládané rizikové faktory patří pohlaví, cerebrovaskulární onemocnění, hladina cholesterolu a tuků v krvi, nutriční faktory a antioxidanty, UV záření.
Příznaky onemocnění
Choroba se manifestuje příznaky postižení centrální části sítnice – makuly. Zhoršení centrální zrakové ostrosti souvisí s obtížemi s rozlišováním obličejů lidí v okolí, neschopností řízení motorového vozidla a sledování televize a především se zhoršením práce na blízkou vzdálenost (psaní, čtení, ruční práce…). Příznaky vlhké formy VPMD navíc zahrnují metamorfopsie (pokřivení obrazu) a centrální skotom. Zároveň pacienti vnímají zvýšenou citlivost k oslnění (světloplachost), pokles kontrastní citlivosti a barvocitu. Naštěstí nevzniká úplná slepota, jelikož periferní vidění zůstává zachováno dokonce i v terminálním stadiu choroby.
Klinické změny
Objektivní nález při suché formě VPMD zahrnuje dysgrupace RPE a tvorbu drúz (depozita extracelulárního materiálu) střední (63 až 125 μm) a větší velikosti (> 125 μm) v centrální krajině (obr. 1.). Splývající drúzy jsou často doprovázeny drúzovou ablací RPE a jejich shlukování je považováno za významný rizikový faktor pro přechod choroby ve vlhkou formu.(7)
Obr. 1. Suchá forma VPMD s nahromaděním měkkých i tvrdých drúz a přesuny pigmentu v makule 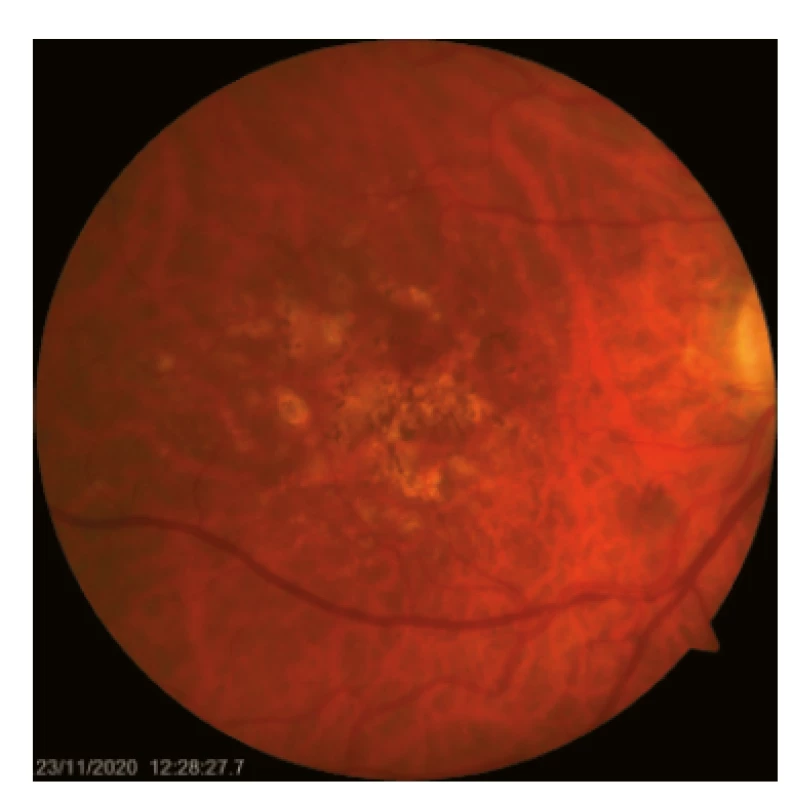
Dysgrupace pigmentu v centrální krajině se projevují jako zóny hyperpigmentací a depigmentací. Významný úbytek buněk RPE a fotoreceptorů v centrální krajině přivádí ke vzniku terminálního stadia suché formy VPMD – geografická atrofie RPE. Hlavním objektivním nálezem vlhké formy VPMD je přítomnost CNV, která se projevuje ablací RPE a/nebo neuroretiny a intra-/subretinálním edémem (obr. 2.).
Obr. 2. Vlhká forma VPMD se subretinálním krvácením 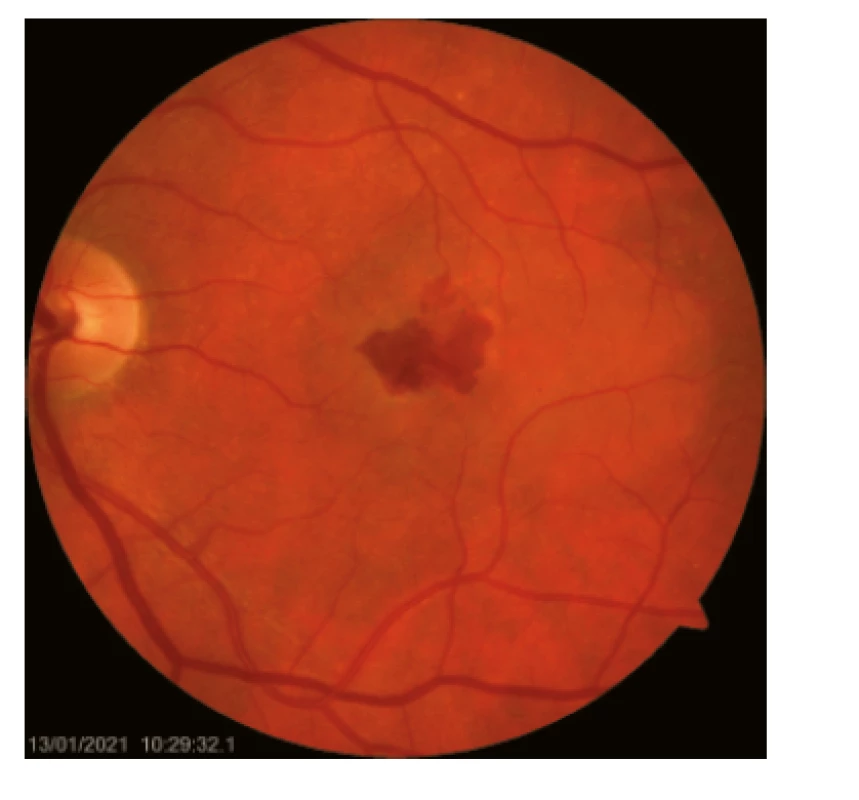
Léčba
Terapie VPMD prodělala v posledních letech významný vývoj. Původním cílem byla jen léčba vlhké formy VPMD, která při přirozeném průběhu vede k centrálnímu skotomu a nevratnému poklesu zrakové ostrosti. Nicméně v průběhu posledních let se terapie zaměřuje i na suchou formu VPMD s cílem zastavit rozvoj onemocnění a přechod ve vlhkou formu VPMD.
Léčba suché formy VPMD
Farmakoterapie
V terapii suché formy VPMD hraje významnou roli preventivní farmakoterapie. Do studie AREDS 1 (Age-related Eye Disease Study 1) bylo zařazeno 3640 pacientů ve věku 55 let a více se suchou formou VPMD. Léčba spočívala v podávání antioxidantů – vitamin E v dávce 400 IU, 500 mg vitaminu C, 15 mg beta-karotenu, 2 mg mědi a 80 mg zinku. V průběhu sledování během 6,3 roku byla těžká ztráta zraku ve skupině pacientů léčených antioxidanty menší o 25 % než v kontrolní skupině.(8) Klinická studie LAST (Lutein Antioxidant Supplementation Trial) prokázala u 90 pacientů s atrofickou formou VPMD v průběhu ročního sledování při podání 10 mg neesterifikovaného luteinu denně zlepšení zraku o jeden řádek ETDRS optotypů. Kromě toho se probandům zlepšila citlivost na kontrast, orientace v prostoru a zvýšila se hustota makulárního pigmentu.(9)
Léčba hemorheoferézou
Hemorheoferéza je léčebná metoda, která může zastavit přechod suché formy VPMD do vlhké formy a stabilizovat, nebo dokonce zlepšit zrakové funkce nemocných.(10,11) První použití této metody bylo zaznamenáno u pacientů s VPMD v roce 2000.(12) Podstatou léčby je filtrace plazmy, která pomocí filtrů odstraní z krve vysokomolekulární, rheologicky aktivní faktory (hlavně lipoproteiny), což má za následek zvýšení transportu přes BM a zlepšení metabolismu mezi RPE a choriokapilaris. Zlepšení výživy buněk RPE a sítnice snižuje ischemii a redukuje produkci VEGF (vascular endothelial growth factor) buňkami RPE. Popsaný mechanismus může zabránit vzniku vlhké formy VPMD. Kromě toho je prokázána nižší viskozita plazmy i celé krve a pokles agregace erytrocytů.(10)
Léčba vlhké formy VPMD
V současné době jsou schváleny pro intravitreální léčbu vlhké formy VPMD následující přípravky: ranibizumab, aflibercept a brolucizumab.
Ranibizumab (Lucentis) je rekombinantní humanizovaná monoklonální protilátka o velikosti 48 kDa postrádající Fc část.(13) Doporučená dávka ranibizumabu je 0,5 mg v jednorázové intravitreálni injekci, tj. v injekci o objemu 0,05 ml. Interval mezi dvěma dávkami ranibizumabu podávanými do stejného oka musí být alespoň 4 týdny. Léčba se zahajuje jednou injekcí opakovaně každý měsíc do dosažení maximální zrakové ostrosti a/nebo do vymizení příznaku aktivity onemocnění, tj. žádná změna zrakové ostrosti a ostatních známek onemocnění v době probíhající léčby. U pacientů s vlhkou formou VPMD mohou být potřeba tři i více po sobě jdoucích injekcí podávaných jednou měsíčně. Následně mají být lékařem určeny intervaly sledování průběhu onemocnění a na základě aktivity onemocnění vyhodnocené podle zrakové ostrosti a/nebo anatomických parametrů navrhnuta i další případná léčba.(14)
V klinické studii The Minimally Classic/Occult Trial of the Anti-VEGF-Antibody Ranibizumab in the Treatment of Neovascular Age-Related Macular Degeneration (MARINA) byla zjištěna u pacientů s minimálně klasickou CNV nebo okultní CNV u VPMD při měsíční aplikaci 0,5 mg ranibizumabu intravitreálně během dvou let ztráta zrakové ostrosti o méně než 15 písmen ETDRS optotypů u 90 % pacientů ve srovnání s 52,9 % neléčených pacientů. Statisticky významné zlepšení zrakové ostrosti o 15 a více písmen bylo zjištěno u 33,3 % očí ve srovnání s 3,8 % u skupiny s placebem.(15) V klinické studii The Anti-VEGF-Antibody for the Treatment of Predominantly Classic Choroidal Neovascularization in Age-Related Macular Degeneration (ANCHOR), která trvala dva roky, byla porovnávána účinnost ranibizumabu v léčbě klasické CNV při VPMD ve srovnání s účinností fotodynamické terapie (PDT) s verteporfinem. Ve skupině léčených měsíční intravitreální injekcí 0,5 mg ranibizumabu bylo 96,4 % pacientů se zhoršením zrakové ostrosti o méně než 15 písmen ETDRS optotypů za jeden rok ve srovnání s 64,3 % pacientů léčených PDT. Statisticky významně se zraková ostrost zlepšila o 15 i více písmen u 40,3 % pacientů léčených 0,5 mg ranibizumabu ve srovnání s 5,6 % pacientů léčených PDT.(16) V roce 2011 aflibercept obdržel schválení FDA pro léčbu neovaskulární VPMD v doporučené dávce 2,0 mg každých 8 týdnů po vstupní nasycovací dávce třech měsíčních aplikací. Klinická účinnost intravitreálního afliberceptu byla podpořena dvěma studiemi – VIEW 1 a VIEW 2 (VEGF Trap-Eye: Investigation of Efficacy and Safety in Wet AMD), které prokázaly rovnocennost účinku afliberceptu ve srovnání s ranibizumabem při menším počtu aplikací účinné látky během roku léčby u 1817 pacientů.(17,18)
Aflibercept (Eylea) je rekombinantní fúzní protein o velikosti 115 kDa, který kombinuje Fc část plné monoklonální protilátky a dvě nejvyšší afinitní domény VEGF receptoru typu 1 (R) a VEGFR2.(19) Po intravitreálním podání působí svými receptory jako návnada pro VEGF A, B a placentární růstový faktor (PlGF) a tím zamezuje jejich působení na receptory endotelových buněk sítnicových a choroidálních cév. Doporučená dávka afliberceptu je 2 mg, což přibližně odpovídá 50 μl. Na počátku léčby afliberceptem se podává jedna injekce každý měsíc ve třech po sobě jdoucích dávkách (stejně jako při terapii ranibizumabem). Léčebný interval se dále prodlužuje na dva měsíce. Na základě léčbou dosažených výsledků vyšetření zraku a/nebo anatomických poměrů zůstává léčebný interval udržován na dvou měsících nebo je dále prodloužen režimem „treat and extend“, kdy se intervaly mezi injekcemi prodlouží o 2 nebo 4 týdny, aby byly udrženy stabilní výsledky vyšetření zraku a/nebo anatomických poměrů. V případě zhoršení výsledků vyšetření zraku a/nebo anatomických poměrů je léčebný interval zkrácen na minimálně dva měsíce během prvních 12 měsíců léčby. Je třeba poznamenat, že méně častý léčebný režim snižuje zátěž pacientů a náklady na zdravotní péči. Studie ALTAIR provedená u 247 japonských pacientů s dosud neléčenou vlhkou formou VPMD ukázala podobné výsledky jako studie VIEW s použitím 3 počátečních injekcí přípravku Eylea 2 mg podávaných měsíčně, dále jedné injekce podávané po dalších 2 měsících s následným pokračováním „treat and extend“ režimem s různými léčebnými intervaly (jejich 2týdenní nebo 4týdenní úprava) až do maximálního intervalu 16 týdnů podle předem stanovených kritérií.(20) V týdnu 52 došlo k průměrnému poklesu centrální retinální tloušťky (CRT) na optické koherenční tomografii (OCT) o -134,4 μm a -126,1 μm pro skupiny s 2týdenní, respektive 4týdenní úpravou intervalu. Podíl pacientů bez tekutiny na OCT v týdnu 52 byl 68,3 % a 69,1 % ve skupinách s 2týdenní, respektive 4týdenní úpravou intervalu. V obou léčebných ramenech byl pokles CRT ve druhém roce studie ALTAIR obecně udržen.
Brolucizumab (Beovu) je jednořetězový fragment protilátky, který inhibuje všechny izoformy VEGF-A.(21) Jeho molekulová hmotnost je 26 kDa ve srovnání s 115 kDa pro aflibercept a 48 kDa pro ranibizumab. Z hlediska molární anti-VEGF-A báze se dávka 6,0 mg 50 μl brolucizumabu rovná přibližně 12násobku dávky 2,0 mg afliberceptu a 22násobku dávky 0,5 mg ranibizumabu.(22) Doporučená dávka je 6 mg brolucizumabu (0,05 ml roztoku) aplikovaná intravitreální injekcí každé 4 týdny (měsíčně) v případě prvních 3 dávek. Následně lékař dle aktivity onemocnění, kterou vyhodnotí podle zrakové ostrosti a/nebo anatomických parametrů, nastaví léčebné intervaly. Posouzení aktivity onemocnění se doporučuje provést 16 týdnů (4 měsíce) po zahájení léčby. U pacientů bez aktivity onemocnění má být zvážena léčba každých 12 týdnů (3 měsíce). U pacientů s aktivitou onemocnění je třeba zvážit léčbu každých 8 týdnů (2 měsíce). Lékař může dále stanovit léčebné intervaly na základě aktivity onemocnění.
Od roku 2020 se brolucizumab začal používat v léčbě vlhké formy VPMD. Jeho účinnost a bezpečnost byla prokázána na základě výsledků klinických studii HAWK a HARRIER. Ve třetí fázi těchto klinických studií bylo zhodnoceno 2824 naivních očí, náhodně vybraných pro léčbu brolucizumabem versus afliberceptem s režimem dávkování afliberceptu každých 8 týdnů po úvodních třech měsíčních dávkách.(23) Pacienti ve skupině s brolucizumabem měli tři nasycovací měsíční dávky, dále byli léčeni každých 12 týdnů s možností změny na 8týdenní interval dávkování v závislosti na klinické odpovědi na danou léčbu. Sledovací období bylo 96 týdnů. Během prvního roku byl u 57 % pacientů ve skupině s brolucizumabem zachován 12týdenní interval léčby, zraková ostrost na konci ročního sledování neměla statisticky signifikantní rozdíl ve srovnání se skupinou pacientů léčených afliberceptem. Ve druhém roce léčby byl u 82 % pacientů, kteří dokončili první rok s čtvrtletním intervalem léčby, zachován 12týdenní interval dávkování brolucizumabu.(24) Podle anatomického nálezu měl brolucizumab statisticky významně lepší výsledky ve srovnání s afliberceptem, kdy o 41 % více očí nemělo známky intraretinální či subretinální tekutiny v časových intervalech 16 týdnů, 48 týdnů a 96 týdnů.
Je důležité zdůraznit, že dostupnost několika anti-VEGF léků na trhu je velkou výhodou pro pacienty, kteří nereagují na již nastavenou léčbu, nebo v případě vzniku tachyfylaxe.
Chirurgická léčba terminálních stadií VPMD
Retinální protézy jsou zařízení, která jsou schopna přeměnit světelný signál přicházející do oblasti oka na elektrický stimul přes zařízení umístěné na sítnici.(25) Retinální protézy se většinou dělí podle umístění na epiretinální, subretinální a suprachoroideální. Epiretinální protézy jsou výhodné z hlediska snazšího operačního přístupu a snadné aktivace gangliových buněk. Naopak nevýhodou je zcela nekontrolovatelné zpracování obrazu sítnicí, kdy jsou kromě samotných gangliových buněk aktivovány často i okolo ležící axony, a signál tak nevypadá jako světelný bod.(26) Opačným příkladem jsou subretinální protézy. Zde se musíme připravit na náročnou operační techniku, nicméně aktivovány jsou zbývající fotoreceptory, ev. RBCs, a signál tedy neobchází zpracování v sítnici.(27) Suprachoroideální implantáty jsou používány méně, především pro operační náročnost a větší vzdálenost elektrod od sítnice. Dnes jsou nejčastěji prezentovány implantáty Argus II (Second Sight, Sylmar, USA), Alpha AMS (Retina Implant AG, Reutlingen, Německo) a Photovoltaic Retinal Implant (PRIMA) Bionic Vision System (Pixium vision, Paříž, Francie).
Další možností chirurgické léčby terminálních stadií VPMD je intraokulární implantace teleskopické intraokulární čočky. Pro pacienty se stabilními formami patologií makuly je určena Schariothova makulární čočka.(28) Jedná se o bifokální nitrooční čočku, která funguje v oku jako lupa, a umožňuje tak pacientům vidět do blízka i bez externích optických či jiných pomůcek. Poskytuje přibližně dvojnásobné zvětšení a tím i zdánlivé přiblížení obrazu. Vkládá se do lépe vidoucího artefakického oka jako tzv. add-on nitrooční čočka. Základem úspěchu je především správná indikace a motivace pacienta k následné rehabilitaci.(29)
Závěr
Věkem podmíněná makulární degenerace vzniká spolupůsobením genetických faktorů a faktorů životního stylu a je v rozvinutých zemích nejčastější příčinou ztráty zraku lidí starších 55 let. Léčba VPMD zaznamenává v posledních dvou desetiletích nebývalý rozvoj. V terapii suché formy VPMD se dostaly do popředí preventivní farmakoterapie a hemorheoferéza. Intravitreálně podávané anti-VEGF léky se staly léčbou první volby několika zrak ohrožujících očních onemocnění spojených s angiogenezí včetně vlhké formy VPMD. V případě rozvoje terminálních stadii této choroby lze použít teleskopické intraokulární čočky a retinální protézy. Zásadním předpokladem úspěšné léčby je včasná diagnostika a zejména včasné zahájení terapie. V opačném případě je léčba minimálně úspěšná, nebo dokonce neúspěšná a její začátek již mnohdy není ani indikován.
MUDr. Alexandr Stěpanov, Ph.D., MBA, FEBO
Oční klinika LF UK a FN Hradec Králové
Sokolská 581, 500 05 Hradec Králové
e-mail: stepanov.doctor@gmail.com
Zdroje
- Seddon JM, Chen CA. The epidemiology of age-related macular degeneration. Int Ophthalmol Clin 2004; 44 : 17–39.
- Kahn HA, Leibowitz HM, Ganley JP, et al. The Framingham Eye Study: I. Outline and major prevalence findings. Am J Epidemiol 1977; 106(1): 17–32.
- Augood CA, Vingerling JR, de Jong PTVM, et al. Prevalence of age-related maculopathy in older Europeans: the European Eye Study (EUREYE). Arch Ophthalmol 2006; 124(4): 529–535.
- Alberti WE, Richard G, Sagerman RH. Age-Related Macular Degeneration: Current Treatment Concepts. 1st ed. Berlin: Springer-Verlag Berlin Heidelberg New York 2001; 207.
- Klein R, Klein BEK, Knudtson MD, et al. Prevalence of age-related macular degeneration in 4 racial/ethnic groups in the Multi-ethnic Study of Atherosclerosis. Ophthalmology 2006; 113(3): 373–380.
- Delcourt C, Diaz JL, Ponton-Sanchez A, et al. Smoking and age-related macular degeneration: the POLA Study. Arch Ophthalmol 1998; 116(8): 1031–1035.
- Zweifel SA, Spaide RF, Curcio CA, et al. Reticular pseudodrusen are subretinal drusenoid deposits. Ophthalmology 2010; 117(2): 303–312.
- Age-related Eye Disease Study Research Group: A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta karotene and zinc for age-related macular degeneration and vision loss. AREDS Report 8. Arch Ophthalmol 2001; 119 : 1417–1436.
- Richer S, Stiles W, Statkute L, et al. Double-masked, placebo-controlled, randomized trial of lutein and antioxidant supplementation in the intervention of atrophic agerelated macular degeneration: the Veterans LAST study (Lutein Antioxidant Supplementation Trial). Optometry 2004; 75 (4): 216–230.
- Klingel R, Fassbender C, Fassbender T, et al. Clinical studies to implement rheopheresis for age-related macular degeneration guided by evidence-basedmedicine. Transf Apher Sci 2003; 29 : 71–84.
- Rencová E, Bláha M, Studnička J, et al. Preservation of the photoreceptor inner/outer segment junction in dry age-related macular degeneration treated by rheohemapheresis. J Ophthalmol 2015; 359747.
- Brunner R, Widder RA, Walter P, et al. Influence of membrane differential filtration on the natural course of age-related macular degeneration: a randomized trial. Retina 2000; 20(5): 483–491.
- Narayanan R, Kuppermann BD, Jones C, et al. Ranibizumab. Nat Rev Drug Discov 2006; 5(10): 815–816.
- Studnička J. Ranibizumab (Lucentis) v léčbě věkem podmíněné makulární degenerace. Čes a Slov Oftal 2009; 65(3): 107–111.
- Brown DM, Kaiser PK, Michels M, et al. Ranibizumab versus verteporfin for neovascular agerelated macular degeneration. N Engl J Med 2006; 355(14): 1432–1444.
- Rosenfeld PJ, Brown DM, Heier JS, et al. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med 2006; 355(14): 1419–1431.
- Spaide R. Ranibizumab according to need: a treatment for agerelated macular degeneration. Am J Ophthalmol 2007; 143(4): 679–680.
- Brown DM, Regillo CD. Anti-VEGF agents in the treatment of neovascular age-related macular degeneration: applying clinical trial results to the treatment of everyday patients. Am J Ophthalmol 2007; 144(4): 627–637.
- Stewart MW, Grippon S, Kirkpatrick P. Aflibercept. Nat Rev Drug Discov 2012; 11(4): 269–270.
- Ohji M, Takahashi K, Okada AA, et al. ALTAIR Investigators. Efficacy and safety of intravitreal aflibercept treat-and-extend regimens in exudative age-related macular degeneration: 52 - and 96-week findings from ALTAIR : a randomized controlled trial. Adv Ther 2020; 37(3): 1173–1187.
- Holz FG, Dugel PU, Weissgerber G, et al. Single-chain antipody fragment VEGF inhibitor rth258 for neovascular age-related macular degeneration: A randomized controlled study. Ophthalmology 2016; 123(5): 1080–1089.
- Tietz J, Schmid G, Konrad J, et al. Affinity and potency of RTH258 (ESBA1008), a novel inhibitor of vascular endothelial growth factor a for the treatment of retinal disorders. Invest Ophthalmol Vis Sci 2015; 56 : 1501.
- Dugel PU, Jaffe GJ, Sallstig P, et al. Brolucizumab versus aflibercept in participants with neovascular age-related macular degeneration: a randomized trial. Ophthalmology 2017; 124(9): 1296–1304.
- Dugel PU, Jaffe GJ, Sallstig P, et al. Brolucizumab versus aflibercept in participants with neovascular age-related macular degeneration: a randomized trial. Ophthalmology 2017; 124(9): 1296–1304.
- Straňák Z, Kousal B, Ardan T, Veith M. Inovativní postupy v léčbě sítnicových onemocnění. Čes a Slov Oftal 2019; 75 (6): 287–295.
- Nanduri D, Fine I, Horsager A, et al. Frequency and amplitude modulation have different effects on the percepts elicited by retinal stimulation. Invest Ophthalmol Vis Sci 2012; 53 : 205–214.
- Lorach H, Goetz G, Smith R, et al. Photovoltaic restoration of sight with high visual acuity. Nat Med 2015; 21 : 476–482.
- Scharioth GB. New Add-on Intraocular lens for patients with age-related macular degeneration. J Cataract Refract Surg 2015; 41 : 1559–1563.
- Nekolová J, Kremláček J, Kuba M, et al. Možnosti zlepšení zrakových funkcí u pacientů se stabilní makulopatií-pilotní výsledky nové studie. Čes a Slov Oftal 2019; 75(3): 130–135.
Štítky
Geriatrie a gerontologie Praktické lékařství pro dospělé Protetika
Článek Dlouhodobá péče v DánskuČlánek EDITORIAL
Článek vyšel v časopiseGeriatrie a Gerontologie
Nejčtenější tento týden
2021 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Mirtazapin v léčbě deprese spojené s nadměrným užíváním alkoholu
-
Všechny články tohoto čísla
- Porucha hlasu jako symptom amyotrofické laterální sklerózy
- Program časné postcovidové péče o geriatrické pacienty
- Dlouhodobá péče v Dánsku
- EDITORIAL
- Právě startují meditalks+ – podcasty pro lékaře.
- Analýza COVID pozitivních pacientů hospitalizovaných v zařízení následné péče
- Implementace paliativní péče u geriatrických pacientů se srdečním selháním
- Léky jako významný rizikový faktor pádu u geriatrických pacientů
- Věkem podmíněné změny struktury funkce myokardu
- Možnosti nového přístupu k posuzování stupně závislosti pro účely příspěvku na péči u osob starších 65 let
- Věkem podmíněná makulární degenerace
- Závažná diagnóza u geriatrického pacienta – laktátová acidóza asociovaná s metforminem. Pomýšlíme na ni dostatečně?
- Geriatrie a Gerontologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Porucha hlasu jako symptom amyotrofické laterální sklerózy
- Závažná diagnóza u geriatrického pacienta – laktátová acidóza asociovaná s metforminem. Pomýšlíme na ni dostatečně?
- Léky jako významný rizikový faktor pádu u geriatrických pacientů
- Věkem podmíněná makulární degenerace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




