-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Věkem podmíněné změny struktury funkce myokardu
Age-related structural and functional changes of myocardium
Aging is a natural process that involves structural and functional changes in several organs. This review focuses on the changes that affect the myocardium. It recalls the basic pathogenetic mechanisms of age-related myocardial dysfunction. It also analyzes the structural changes of the myocardium, which lead to changes in the geometry and function of individual cardiac compartments. It deals with the basic natural changes of the valve system, the overall functional changes of the heart. He also deals with electrophysiological changes associated with age, changes in neuroendocrine mechanisms and the autonomic nervous system. These changes are collectively referred to as the broader term age-related myocardial remodeling.
Keywords:
aging – Myocardium – age-related myocardial remodeling
Autoři: Radek Pudil
Působiště autorů: 1. interní kardioangiologická klinika LF UK a FN Hradec Králové
Vyšlo v časopise: Geriatrie a Gerontologie 2021, 10, č. 2: 74-79
Kategorie: Přehledový článek
Souhrn
Stárnutí je přirozený proces, který zahrnuje strukturální a funkční změny řady orgánů. Tento přehled se soustředí na změny, které postihují myokard. Připomíná základní patogenetické mechanismy věkem podmíněné poruchy funkce myokardu. Dále analyzuje strukturální změny myokardu, které vedou ke změnám geometrie a funkce jednotlivých srdečních oddílů. Zabývá se základními přirozenými změnami chlopenního aparátu, celkovými funkčními změnami činnosti srdce. Dále se věnuje elektrofyziologickým změnám asociovaným s věkem, změnám neuroendokrinních mechanismů a autonomního nervového systému. Tyto změny jsou souhrnně označovány širším pojmem věkem podmíněná remodelace myokardu.
Klíčová slova:
stárnutí – myokard – věkem podmíněná remodelace myokardu
Úvod
Srdeční selhání patří mezi onemocnění, jejichž četnost narůstá s věkem. Odhadovaná prevalence srdečního selhání v běžné populaci je asi 2,2 %. Zatímco ve věkové skupině 45–54 let je to pouze 0,7 %, po 60. roce věku významně narůstá a ve věku nad 75 let dosahuje prevalence manifestního srdečního selhání až 8,4 %.(1,2) V průběhu lidského života dochází k fyziologickým změnám struktury a funkce myokardu, které se velmi významně projevují především ve vyšším věku. Tyto změny vedou ke strukturálním a funkčním změnám myokardu, ovlivňují působení řady faktorů vyvolávajících srdeční selhání a zasahují do patofyziologických mechanismů, jejichž následkem je podstatný nárůst výskytu srdečního selhání u seniorů.
Cílem přehledu je podat základní informace o změnách struktury a funkce myokardu přicházejících s věkem a jejich vlivu na diagnostiku srdečního selhání.
Základní patogenetické mechanismy
Mezi hlavní věkem podmíněné patogenetické mechanismy patří oxidativní stres, dlouhodobě perzistující zánět o nízké intenzitě, porucha funkce mitochondrií, snížená rezistence na stresové podněty, poruchy energetických procesů, porucha proteosyntézy, proces zkracování telomer, epigenetické modifikace včetně nestability genomu, vyčerpání kmenových buněk či abnormality extracelulární matrix. Významnou roli mají komorbidity, jejich počet s věkem narůstá. Celý proces významně ovlivňuje životní styl a farmakoterapie. Hlavní faktory v patogenezi věkem podmíněné remodelace myokardu ukazuje tabulka 1.
Tab. 1. Hlavní faktory v patogenezi věkem podmíněné remodelace myokardu 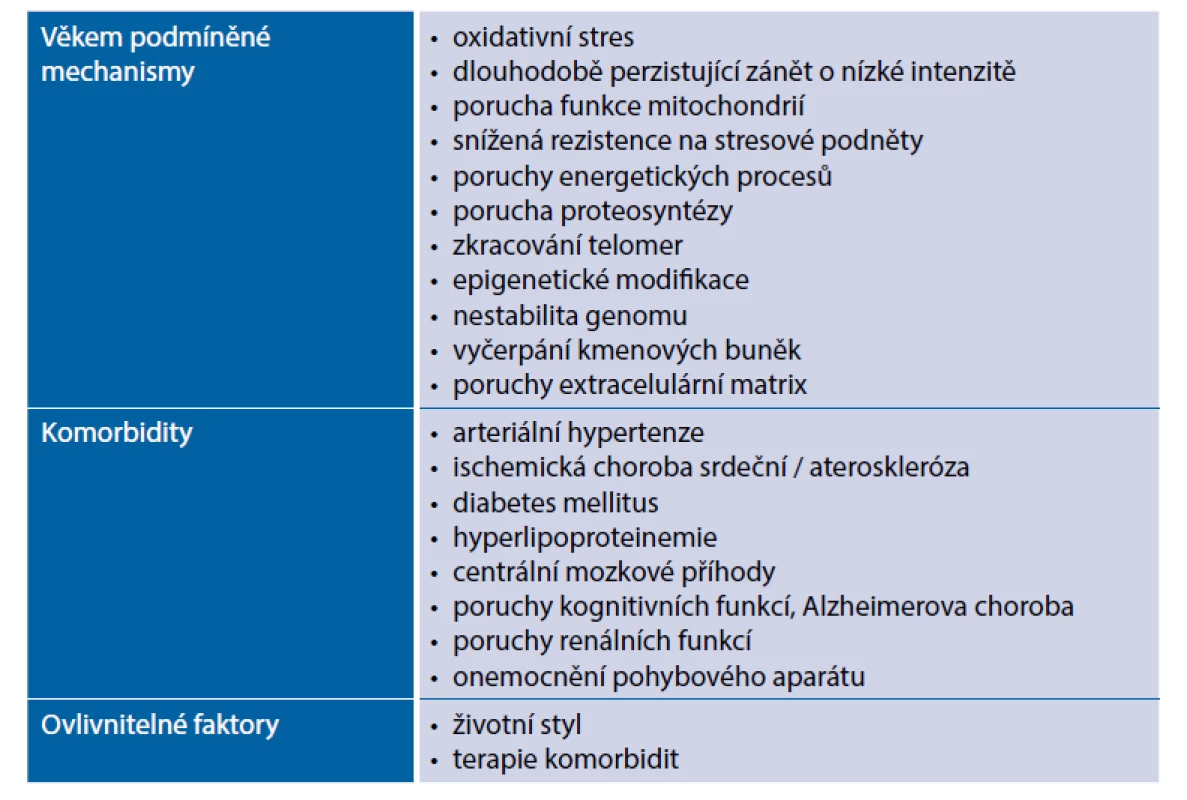
Celulární změny zahrnují také změny ve funkci ostatních buněk v myokardu, především fibroblastů (produkce kolagenních vláken a fibronektinu) a makrofágů (např. ovlivnění funkce matrix metaloproteináz). Tyto změny vedou ke změně struktury extracelulární matrix zahrnující změnu struktury kolagenních vláken (vyšší zastoupení kolagenních vláken typu I), zvýšenou tvorbu příčných můstků mezi těmito vlákny v důsledku změn procesu glykace spojené s kumulací produktů. S věkem dochází ke změnám funkce matrix metaloproteináz a jejich regulačních mechanismů.
Výsledkem je ztráta elasticity a s tím spojený nárůst tuhosti stěny levé komory. Patogenetické mechanismy doplňuje zvýšená akumulace amyloidu v myokardu, který je možné prokázat u více než 25 % pacientů starších 70–80 let. Jde o tzv. wild-type transthyretinovou amyloidózu, která byla dříve označována jako tzv. senilní typ.(3) Ačkoliv může tento typ amyloidózy postihnout kterýkoliv orgán, postižení srdce patří k nejvýznamnějším. V klinickém obraze jde častěji o muže, u kterých se vyvine srdeční selhání, síňové arytmie či poruchy vedení vzruchu. Echokardiografie prokáže snížení ejekční frakce, obraz hypertrofie stěny levé komory. Na elektrokardiogramu nalezneme často nižší voltáž QRS komplexu, obraz tzv. pseudoinfarktu. Častěji nalezneme arytmie (supraventrikulární či atrioventrikulární blokády). Častým nálezem, který upozorní na tuto jednotku, je syndrom karpálního tunelu či neurologické projevy. Postižení myokardu amyloidem je jednoznačně prognosticky negativním faktorem.(4,5)
Výše uvedené procesy jsou doprovázeny strukturálními a funkčními cévními změnami (tzv. vascular aging), ke kterým dochází na podkladě ukládání lipidových částic do stěny cév, rozvoje dysfunkce endotelu a poruch mikrocirkulace.
Strukturální a funkční změny myokardu
Výše uvedené patogenetické mechanismy vedou k rozvoji strukturálních změn myokardu, které se označují jako věkem podmíněná remodelace myokardu (age-related myocardial remodeling). Jde o přirozený proces, který postihuje všechny srdeční oddíly.
Tyto změny představuje především změna geometrie levé komory srdeční, kdy v důsledku zdravého stárnutí dochází k úbytku svaloviny (myokardu) a ke zmenšení objemu levé komory. Mění se poměr masy a objemu levé komory (left ventricle mass/volume ratio). Současně vedou ke vzniku koncentrického typu remodelace levé komory. Zatímco u mužů přetrvává vyšší masa a objemy levé komory, u žen dochází k relativně většímu poklesu objemu levé komory. Tato disproporce se velmi pravděpodobně podílí na vyšším výskytu srdečního selhání se zachovalou funkcí u žen, zatímco u mužů převažuje srdeční selhání se sníženou ejekční frakcí. Důsledkem ztráty poddajnosti levé komory dochází ke zvětšení objemu levé síně, na kterém se může podílet také častější mitrální insuficience.
Výsledky současných studií využívajících echokardiografii a magnetickou rezonanci prokázaly přímou asociaci tohoto poměru s výskytem srdečního selhávání. Dochází ke změnám end-diastolického a end-systolického rozměru levé komory. V důsledku významnějšího poklesu end-diastolického objemu dochází za fyziologických podmínek k mírnému vzestupu ejekční frakce levé komory, na kterém může mít podíl s věkem častější mitrální insuficience. Současně také dochází k rozdílným geometrickým změnám mezi muži a ženami. Morfologické změny levé komory významně ovlivňují její systolickou funkci, která se se zvyšujícím věkem za fyziologických okolností mírně zvyšuje. Podobně byly popsány i geometrické a funkční změny pravostranných oddílů. S věkem dochází k relativně většímu poklesu end-diastolického objemu pravé komory, zatímco end-systolický objem klesá méně. Následkem je mírné zvýšení ejekční frakce pravé komory. Stav je spojen také se zvětšením objemu pravé síně. Podíl na těchto změnách se přisuzuje trikuspidální insuficienci, která je s věkem častější a velmi pravděpodobně je ovlivněna také zvýšením tuhosti stěny pravé komory a cévními změnami plicního řečiště.
Strukturální změny myocytu i extracelulární matrix významně ovlivňují diastolickou funkci levé komory. S věkem dochází k fyziologickému poklesu jednotlivých echokardiografických parametrů, na jejichž základě se určuje přítomnost poruchy diastolické funkce levé komory. Tyto parametry jsou také významně ovlivněny pohlavím a v klinické praxi je potřeba je mít na paměti při dopplerovském hodnocení diastolické funkce levé komory. Fyziologické změny echokardiografických parametrů pro hodnocení diastolické funkce levé komory ukazuje tabulka 2.
Tab. 2. Echokardiografické parametry diastolické funkce levé komory (upraveno dle Ponikowski et al., 2016)(6) 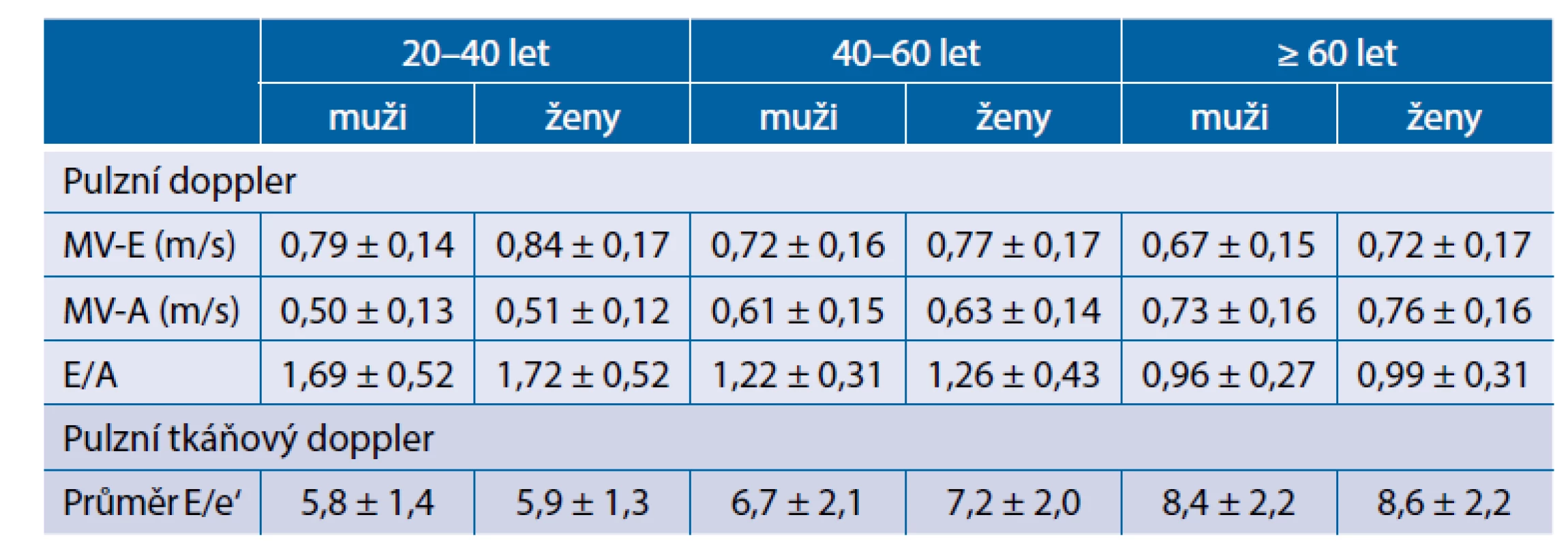
MV-E – transmitrální rychlost vlny E, MV-A – transmitrální rychlost vlny A, E/A – poměr vlny E a A, e‘ – průměrná rychlost vlny e‘ mitrálního anulu Vliv věku na funkční vlastnosti myokardu
Systolická funkce levé komory. Ejekční frakce levé komory a tepový objem levé komory zůstávají s věkem stabilní, v případě vzniku mitrální či aortální insuficience se mohou zvyšovat.(7) U aktivních seniorů mužského pohlaví se mění průběh kontrakce v průběhu izovolumické fáze systoly, u žen tento fenomén nebyl pozorován.(8)
Diastolická funkce levé komory. Pokles diastolické funkce levé komory je normálním věkem podmíněným projevem. První stupeň diastolické dysfunkce levé komory (inverze poměru E/A na mitrální chlopni zjištěná při echokardiografickém vyšetření) je normálním nálezem u mužů i žen starších 60 let. Je projevem snížené poddajnosti stěny levé komory, kdy dochází k poklesu rychlosti pasivního plnění levé komory a k nárůstu vlny A, která představuje aktivní síňový příspěvek (poměr E/A je menší než 1). Snížená poddajnost levé komory je často spojena s nárůstem tlaku uvnitř levé síně, důsledkem je výše zmíněná remodelace levé síně a zvýšení rychlosti vlny A.(9)
Srdeční výdej. V průběhu života dochází také k poklesu srdečního výdeje. Ukazuje se, že maxima srdečního výdeje se dosahuje ve věku kolem 20 let, pak dochází k jeho poklesu s tempem přibližně 1 % za rok.(10)
Maximální tepová frekvence. V průběhu věku dochází k poklesu maximální tepové frekvence, která ovlivňuje maximum srdečního výdeje. Tento pokles je přibližně 1 úder srdce za rok. Tyto změny jsou velmi pravděpodobně spojeny se snížením β-adrenergní odpovědi v průběhu života.(11) S tím je spojena mj. oslabená odpověď baroreceptorů.
Změny srdečních chlopní
Vyšší věk s sebou nese také změny srdečních chlopní. Tyto změny jsou nejvýznamnější na aortální chlopni, jejíž cípy se s věkem mění (ztluštění, jizvení, kalcifikace). Ukazuje se, že hemodynamicky významnými sklerotickými změnami aortální chlopně trpí až 80 % seniorů. Počáteční sklerotické změny cípů aortální chlopně mohou vyústit v hemodynamicky významnou stenózu. Dalším následkem degenerativních změn aortální chlopně může být aortální insuficience. Podle současných dat se mírná až střední aortální insuficience vyskytuje asi u 16 % seniorů.(12)
S věkem dochází ke změnám mitrální chlopně, které zahrnují především degenerativní změny listů chlopně spojené s různým stupněm insuficience, a kalcifikaci mitrálního anulu. Kalcifikace mitrálního anulu se vyskytují častěji u žen (52 %) než u mužů (36 %) a jsou spojeny s vyšší prevalencí fibrilace síní, koronárních příhod, srdečního selhání, endokarditidou a kardioemboligenní příhodou.(13–15)
Elektrofyziologické změny asociované s věkem
Atrofie sinoatriálního uzlu. V průběhu lidského života dochází ke změnám v sinoatriálním uzlu, které jsou dány úbytkem aktivních buněk v důsledku apoptózy. Po 70. roce věku může zůstat pouze 10–20 % z původního počtu buněk. Dalším faktorem, který významně zhoršuje funkci sinoatriálního uzlu, jsou fibrotické změny. Apoptóza a fibrotické změny postihují i ostatní části převodního systému (atrioventrikulární uzel, Hisův svazek a Purkyňova vlákna). Výsledkem je sklon k bradykardii a převodním poruchám. Tyto změny vedou v klinické praxi k častějšímu výskytu dysfunkce sinusového uzlu, která se manifestuje bradykardií, palpitacemi, stavy slabosti, synkopami, snížením tolerance námahy a přetrvávající únavou.(14)
Mění se i průběh akčního potenciálu, který se prodlužuje. Příčinou jsou mj. změny L-typů vápníkových kanálů. Stav vede ke zvýšení koncentrace intracelulárního kalcia, které není včas transportováno ven z buňky a může se také podílet na změně diastolické poddajnosti stěny komory.
Věkem podmíněné změny myokardu se projevují na změně povrchového 12svodového EKG a zahrnují: změny vlny P (prodloužení trvání), dále prodloužení intervalu P–R, Q–T, pokles voltáže QRS komplexu a voltáže vlny T, častější sklon srdeční osy doleva.(16)
S věkem narůstá výskyt síňových a komorových ektopických rytmů. Mezi nejčastější arytmie ve vyšším věku patří fibrilace síní. Její četnost začíná narůstat ve věku nad 65 let, ve věku nad 80 let postihuje více než 9 % populace.(17,18)
Z dalších faktorů, které jsou spojeny s častějším výskytem fibrilace síní, lze jmenovat mužské pohlaví, choroby štítné žlázy, centrální typ obezity, srdeční selhání.(19)
Avšak u zdravě stárnoucí populace se na vzniku fibrilace síní mohou podílet i další faktory: zvětšení objemu síní a fibrózní změny, které postihují síně. Tyto změny jsou podkladem zhoršení elektrických vlastností svaloviny síní. Ztráta síňové kontrakce se může projevit na systolické i diastolické funkci levé komory.
Vliv věku na neurohumorální kontrolní mechanismy
S věkem se zvyšuje produkce natriuretických peptidů (síňový natriuretický peptid, natriuretický peptid typu B). Jedním z důvodů může být snížení citlivosti receptorů cílových tkání.(20) Je současně prokázáno, že tento vzestup je vyšší u žen než u mužů. Tyto informace přinesly studie, které se snažily nalézt optimální cut-off hodnoty, jež by s vysokou senzitivitou a specificitou prokázaly přítomnost srdečního selhání jako příčinu dušnosti. Ukázalo se, že právě věk a ženské pohlaví jsou významnými faktory, které ovlivňují hladinu natriuretických peptidů (BNP i NT-proBNP). Z těchto důvodů byly stanoveny cut-off hladiny natriuretických peptidů vylučující s dostatečnou senzitivitou a specificitou akutní (BNP < 100 pg/ml, NT-proBNP < 300 pg/ml) a chronickou formu srdečního selhání (BNP < 35 pg/ml, NT-proBNP < 125 pg/ml).(6,21)
Věkem podmíněné změny autonomního nervového systému jsou velmi významné. Klidová aktivita sympatického nervového systému s věkem stoupá v důsledku řady mechanismů (např. v důsledku snížení citlivosti α i β receptorů pro katecholaminy, která vede k jejich zvýšené produkci). Stav je provázen zvýšenou hladinou cirkulujících katecholaminů. Důsledkem snížené citlivosti β receptorů sympatiku je například snížení hodnoty maximální tepové frekvence.(22) Tento fenomén se podílí na snížení srdečního výdeje.
Současně dochází ke změnám v oblasti parasympatického nervového systému. Je prokázáno, že s věkem dochází k poklesu aktivity n. vagus. Následkem je pokles variability srdeční frekvence.(23)
Naopak klesá aktivita systému renin–angiotensin–aldosteron. Důsledkem je snížení produkce reninu, angiotensinu a aldosteronu.(24–26) Současně bylo prokázáno, že starší lidé produkují méně aldosteronu než mladší, což zvyšuje riziko hyperkalemie, a to především u pacientů, kteří mají sníženou glomerulární filtraci.(24,27)
Věkem podmíněné změny systému renin–angiotensin–aldosteron jsou výsledkem několika patogenetických mechanismů, mezi které patří věkem podmíněné změny glomerulu (glomeruloskleróza) a nefronu, snížení funkce juxtaglomerulárního aparátu, snížení produkce kalikreinu, který se podílí na syntéze aktivního reninu, a snížená syntéza angiotensinogenu játry.(28)
Následkem těchto změn je snížená schopnost ledvinných tubulů reabsorbovat sodík a snížení schopnosti exkrece draslíku, které mohou vyústit ve zvýšené riziko volumdeplece, hyponatremie a hyperkalemie u starších pacientů. Pro běžnou praxi je třeba mít na mysli, že tento stav mohou prohloubit některé další faktory: terapie inhibitory angiotensin konvertujícího enzymu, blokátory receptorů pro angiotensin, antagonisté mineralokortikoidních receptorů a nesteroidní antirevmatika.(29)
V posledních letech byla publikována zajímavá data o změnách aktivity mineralokortikoidních receptorů (MR), ke kterým dochází v souvislosti s věkem. Vzhledem ke snížení aktivity reninového systému s věkem má hlavní roli v procesu zvýšení aktivity MR kortizol. K expresi MR dochází také extrarenálně (myokard, cévní stěna a tuková tkáň). V těchto tkáních se velmi pravděpodobně podílí na řízení tonu cévní stěny, ovlivňují také strukturální změny cév vedoucí ke zvýšení tuhosti stěny cév a mají řadu dalších metabolických efektů. Ty jsou podkladem kardiometabolických změn asociovaných s hypertenzí, obezitou a diabetem. Tuto dysregulaci je možné příznivě ovlivnit antagonisty mineralokortikoidních receptorů, avšak ve vyšším věku je tato léčba limitována vyšším výskytem nežádoucích účinků (především hyperkalemie).(30,31)
Stárnutí a aerobní pracovní kapacita
S narůstajícím věkem dochází k fyziologickému poklesu aerobní pracovní kapacity. Tento trend dokumentuje pokles maximální spotřeby kyslíku (VO2max). Vysvětlením je pokles dvou základních parametrů: minutového srdečního výdeje a arteriovenózní diference. Minutový srdeční výdej je u zdravých stárnoucích limitován postupným snižováním maximální tepové frekvence. Ukazuje se, že pokles postihuje muže i ženy, je však možné jej ovlivnit pravidelným aerobním tréninkem.(32,33)
Možnosti ovlivnění věkem podmíněné remodelace myokardu
Fyziologické procesy přirozeného stárnutí myokardu v klinické praxi ovlivňují především komorbidity. Mezi ně patří především arteriální hypertenze, ischemická choroba srdeční, hyperlipidemie, diabetes mellitus, obezita, nedostatek fyzické aktivity, kouření, a podobně.
Z toho vyplývají možné terapeutické intervence:
eliminace rizikových faktorů kardiovaskulárních onemocnění (terapie obezity, terapie hyperlipidemie, zvýšení pravidelné fyzické aktivity, dietní a režimová opatření, zákaz kouření);
důsledná terapie komorbidit (z nich především včasná a efektivní terapie arteriální hypertenze, terapie diabetu, terapie ischemické choroby srdeční včetně dosažení maximální revaskularizace);
pravidelná fyzická aktivita s cílem udržení do vysokého věku.
Závěr
Stárnutí kardiovaskulárního systému je fyziologický proces, který zahrnuje morfologické a funkční změny myokardu. Výsledkem je vznik věkem podmíněné remodelace myokardu, která je charakteristická morfologickými a funkčními změnami funkce srdečních oddílů. Projevuje se změnami čerpací funkce myokardu, které mohou ústit vlivem působení dalších patogenetických procesů do srdečního selhání, dále se projevuje změnami chlopenního aparátu se vznikem chlopenních vad a změnami elektrofyziologických vlastností myokardu, které jsou spojeny s vyšším výskytem některých arytmií (např. bradykardií, poruch převodního systému či fibrilace síní). Všechny tyto procesy mohou být významně ovlivněny komorbiditami, které jsou ve vyšším věku častější. Z těchto důvodů je velmi nutné se věnovat prevenci těchto změn.
prof. MUDr. Radek Pudil, Ph.D.
I. interní kardioangiologická klinika LF UK a FN Hradec Králové
Sokolská 581, 500 05 Hradec Králové
e-mail: radek.pudil@fnhk.cz
Zdroje
- Redfield MM, Jacobsen SJ, Burnett JC Jr., et al. Burden of systolic and diastolic ventricular dysfunction in the community: appreciating the scope of the heart failure epidemic. JAMA 2003; 289(2):194–202.
- Magnussen C, Niiranen TJ, Ojeda FM, et al. Sex-specific epidemiology of heart failure risk and mortality in Europe: Results from the BiomarCaRE Consortium. JACC Heart Fail 2019; 7(3): 204–213.
- Gonzalez-Lopez E, Gallego-Delgado M, Guzzo-Merello G, et al. Wild-type transthyretin amyloidosis as a cause of heart failure with preserved ejection fraction. Eur Heart J 2015; 36(38): 2585–2594.
- Gonzalez-Lopez E, Gagliardi C, Dominguez F, et al. Clinical characteristics of wild-type transthyretin cardiac amyloidosis: disproving myths. Eur Heart J 2017; 38(24): 1895–1904.
- Kotecha T, Martinez-Naharro A, Treibel TA, et al. Myocardial edema and prognosis in amyloidosis. J Am Coll Cardiol 2018; 71(25): 2919–2931.
- Ponikowski P, Voors AA, Anker SD, et al. Document R. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail 2016; 18(8): 891–975.
- Ferrari AU, Radaelli A, Centola M. Invited review: aging and the cardiovascular system. J Appl Physiol 2003; 95(6): 2591–2597.
- Ruan Q, Nagueh SF. Effect of age on left ventricular systolic function in humans: a study of systolic isovolumic acceleration rate. Exp Physiol 2005; 90(4): 527–534.
- Arora RR, Machac J, Goldman ME, et al. Atrial kinetics and left ventricular diastolic filling in the healthy elderly. J Am Coll Cardiol 1987; 9(6): 1255–1260.
- Brandfonbrener M, Landowne M, Shock NW. Changes in cardiac output with age. Circulation 1955; 12(4): 557–566.
- Christou DD, Seals DR. Decreased maximal heart rate with aging is related to reduced {beta}-adrenergic responsiveness but is largely explained by a reduction in intrinsic heart rate. J Appl Physiol 2008; 105(1): 24–29.
- Nassimiha D, Aronow WS, Ahn C, Goldman ME. Association of coronary risk factors with progression of valvular aortic stenosis in older persons. Am J Cardiol 2001; 87(11): 1313–1314.
- Aronow WS. Heart disease and aging. Med Clin North Am 2006; 90(5): 849–862.
- Jones SA. Ageing to arrhythmias: conundrums of connections in the ageing heart. J Pharm Pharmacol 2006; 58(12): 1571–1576.
- Karavidas A, Lazaros G, Tsiachris D, Pyrgakis V. Aging and the cardiovascular system. Hellenic J Cardiol 2010; 51(5): 421–427.
- Strait JB, Lakatta EG. Aging-associated cardiovascular changes and their relationship to heart failure. Heart Fail Clin 2012; 8(1): 143–164.
- Wasmer K, Eckardt L, Breithardt G. Predisposing factors for atrial fibrillation in the elderly. J Geriatr Cardiol 2017; 14(3): 179–184.
- Heeringa J, van der Kuip DA, Hofman A, et al. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study. Eur Heart J 2006; 27(8): 949–953.
- Williams B, Mancia G, Spiering W, et al. Practice guidelines for the management of arterial hypertension of the European Society of Hypertension and the European Society of Cardiology: ESH/ESC Task Force for the Management of Arterial Hypertension. J Hypertens 2018; 36(12): 2284–2309.
- Ribera-Casado JM. Ageing and the cardiovascular system. Z Gerontol Geriatr 1999; 32(6): 412–419.
- Mueller C, McDonald K, de Boer RA, et al. Heart Failure Association of the European Society of C. Heart Failure Association of the European Society of Cardiology practical guidance on the use of natriuretic peptide concentrations. Eur J Heart Fail 2019; 21(6): 715–731.
- Hotta H, Uchida S. Aging of the autonomic nervous system and possible improvements in autonomic activity using somatic afferent stimulation. Geriatr Gerontol Int 2010; 10 Suppl 1: S127–136.
- Korkushko OV, Shatilo VB, Plachinda Yu I, Shatilo TV. Autonomic control of cardiac chronotropic function in man as a function of age: assessment by power spectral analysis of heart rate variability. J Auton Nerv Syst 1991; 32(3): 191–198.
- Tsunoda K, Abe K, Goto T, et al. Effect of age on the renin-angiotensin-aldosterone system in normal subjects: simultaneous measurement of active and inactive renin, renin substrate, and aldosterone in plasma. J Clin Endocrinol Metab 1986; 62(2): 384–389.
- Weidmann P, De Myttenaere-Bursztein S, Maxwell MH, de Lima J. Effect on aging on plasma renin and aldosterone in normal man. Kidney Int 1975; 8(5): 325–333.
- Yoon HE, Choi BS. The renin-angiotensin system and aging in the kidney. Korean J Intern Med 2014; 29(3): 291–295.
- Epstein M, Hollenberg NK. Age as a determinant of renal sodium conservation in normal man. J Lab Clin Med 1976; 87(3): 411417.
- Belmin J, Levy BI, Michel JB. Changes in the renin-angiotensin-aldosterone axis in later life. Drugs Aging 1994; 5(5): 391–400.
- Zhou XJ, Saxena R, Liu Z, et al. Renal senescence in 2008: progress and challenges. Int Urol Nephrol 2008; 40(3): 823-839.
- Gorini S, Kim SK, Infante M, et al. Role of aldosterone and mineralocorticoid receptor in cardiovascular aging. Front Endocrinol (Lausanne) 2019; 10 : 584.
- Campino C, Martinez-Aguayo A, Baudrand R, et al. Age-related changes in 11beta-hydroxysteroid dehydrogenase type 2 activity in normotensive subjects. Am J Hypertens 2013; 26(4): 481–487.
- Swinne CJ, Shapiro EP, Lima SD, Fleg JL. Age-associated changes in left ventricular diastolic performance during isometric exercise in normal subjects. Am J Cardiol 1992; 69(8): 823–826.
- Pimentel AE, Gentile CL, Tanaka H, et al. Greater rate of decline in maximal aerobic capacity with age in endurance-trained than in sedentary men. J Appl Physiol 2003; 94(6): 2406–2413.
Štítky
Geriatrie a gerontologie Praktické lékařství pro dospělé Protetika
Článek Dlouhodobá péče v DánskuČlánek EDITORIAL
Článek vyšel v časopiseGeriatrie a Gerontologie
Nejčtenější tento týden
2021 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Trazodon pohledem praktického lékaře
-
Všechny články tohoto čísla
- Porucha hlasu jako symptom amyotrofické laterální sklerózy
- Program časné postcovidové péče o geriatrické pacienty
- Dlouhodobá péče v Dánsku
- EDITORIAL
- Právě startují meditalks+ – podcasty pro lékaře.
- Analýza COVID pozitivních pacientů hospitalizovaných v zařízení následné péče
- Implementace paliativní péče u geriatrických pacientů se srdečním selháním
- Léky jako významný rizikový faktor pádu u geriatrických pacientů
- Věkem podmíněné změny struktury funkce myokardu
- Možnosti nového přístupu k posuzování stupně závislosti pro účely příspěvku na péči u osob starších 65 let
- Věkem podmíněná makulární degenerace
- Závažná diagnóza u geriatrického pacienta – laktátová acidóza asociovaná s metforminem. Pomýšlíme na ni dostatečně?
- Geriatrie a Gerontologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Porucha hlasu jako symptom amyotrofické laterální sklerózy
- Závažná diagnóza u geriatrického pacienta – laktátová acidóza asociovaná s metforminem. Pomýšlíme na ni dostatečně?
- Léky jako významný rizikový faktor pádu u geriatrických pacientů
- Věkem podmíněná makulární degenerace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




