-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
Enterohemorrhagic Escherichia coli as the cause of diarrhea in the Czech Republic, 1965–2013
Aim:
Enterohemorrhagic Escherichia coli (EHEC) is the cause of diarrhea, bloody diarrhea, and haemolytic uremic syndrome (HUS) worldwide. The role of EHEC in the etiology of HUS in the Czech Republic has recently been described, but the prevalence, characteristics, and epidemiology of EHEC causing diarrhea have not been fully known. Therefore, this study analyzed the serotypes, stx genotypes, and virulence factors in EHEC strains isolated in 1965–2013 from patients with diarrhea or bloody diarrhea and their family contacts. In addition, we characterized diagnostically relevant phenotypes of EHEC strains, their antimicrobial susceptibility, seasonal trends, and distribution by administrative region.Material and methods:
Serogrouped E. coli isolates from patients were referred to the National Reference Laboratory (NRL) for E. coli and Shigella for the detection of Stx. Specimens of both human and non-human origin were referred to the NRL for epidemiological investigation. Serotyping was performed by conventional and molecular methods, PCR was applied to stx genotyping and identification of non-stx virulence factors, and standard methods were used for phenotypic analysis and antimicrobial susceptibility testing. The epidemiological link between the human and animal isolates was confirmed using pulsed-field gel electrophoresis (PFGE).Results:
Of 50 EHEC strains, 24 were recovered from patients with diarrhea without blood, 19 from patients with bloody diarrhea, six from family contacts, and one from an epidemiologically linked animal. EHEC cases were reported during the whole year, with peaks in May through October, most often in the Central Bohemian and Hradec Králové Regions. EHEC outbreaks occurred in three families: in one of them sheep-to-human transmission of EHEC was detected. The EHEC strains were assigned to five serotypes, with more than half of them being non-sorbitol fermenting (NSF) O157:H7/NM[fliCH7] and a third being strains O26:H11/NM[fliCH11]; serotypes O111:NM[fliCH8], O118:NM[fliCH25], and O104:H4, similarly to sorbitol-fermenting (SF) strains O157:NM[fliCH7], were rare. Of seven stx genotypes identified, all were present in NSF EHEC O157, two in each of EHEC O26 and O111, and one in each of EHEC O118, O104, and SF O157. All but one strain were Stx producers. Genes encoding other virulence factors including toxins (EHEC-hlyA, cdt-V, and espP) and adhesins (eae, efa1, iha, lpf, and sfpA) were detected in all strains and their occurrence was serotype specific. The most common of these genes were eae encoding adhesin intimin and EHEC-hlyA encoding EHEC hemolysin. All EHEC strains but SF O157 harboured terE encoding tellurite resistance. All strains except NSF EHEC O157 and EHEC O118 fermented sorbitol and produced ß-D-glucuronidase. Most (89.8%) EHEC strains were susceptible to all 12 antimicrobials tested.Conclusion:
EHEC strains cause diarrhea and bloody diarrhea in the Czech Republic. Nevertheless, only a systematic screening of the stool from patients with diarrhea can make it possible to elucidate their actual role in the etiology of diarrheal diseases (as well as HUS) in the Czech Republic and to consider the data in the European context. EHEC cases are reported to the European Centre for Disease Prevention and Control (ECDC) within the Food and Waterborne Diseases Surveillance Network.Key words:
Enterohaemorrhagic Escherichia coli – Shiga toxin – genotype – diarrhea – Czech Republic
Autoři: M. Marejková 1,2; P. Petráš 1
Působiště autorů: Státní zdravotní ústav Praha, Národní referenční laboratoř pro E. coli a shigely 1; Univerzita Karlova Praha, 3. lékařská fakulta 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 3, s. 173-183
Kategorie: Souhrnná sdělení, původní práce, kazuistiky
Souhrn
Cíl práce:
Enterohemoragické Escherichia coli (EHEC) jsou celosvětovými původci průjmu, krvavého průjmu a hemolyticko-uremického syndromu (HUS). Zatímco role EHEC v etiologii HUS v České republice byla popsána v nedávné publikaci, výskyt, vlastnosti a epidemiologie EHEC vyvolávajících průjmová onemocnění nejsou dostatečně známé. V této studii jsme proto analyzovali sérotypy, stx genotypy a faktory virulence kmenů EHEC izolovaných v letech 1965–2013 od pacientů s průjmem, krvavým průjmem a jejich rodinných kontaktů. Dále jsme charakterizovali diagnosticky důležité fenotypy kmenů EHEC, jejich citlivost k antimikrobiálním agens, sezonnost a distribuci podle krajů.Materiál a metody:
Kmeny od pacientů byly zaslány jako izoláty E. coli určené séroskupiny do NRL pro E. coli a shigely k průkazu Stx. V souvislosti s epidemiologickým šetřením byly zaslány do NRL vzorky humánního a nonhumánního původu. Sérotypy byly určeny konvenční a molekulární sérotypizací, stx genotypy a non-stx faktory virulence pomocí PCR, a fenotypy a antimikrobiální citlivost pomocí standardních metod. Epidemiologická souvislost izolátů od zvířete a pacienta byla potvrzena metodou pulzní gelové elektroforézy (PFGE).Výsledky:
Z 50 kmenů EHEC pocházelo 24 od pacientů s průjmem bez krve, 19 od pacientů s krvavým průjmem, 6 od rodinných kontaktů a 1 od epidemiologicky souvisejícího zvířete. Případy EHEC infekcí se vyskytovaly během celého roku, s vrcholem v květnu až říjnu a nejvíce ve Středočeském a Královéhradeckém kraji. Hromadný výskyt infekce EHEC byl zaznamenán ve 3 rodinách a v 1 případě byl prokázán přenos EHEC infekce z ovce na pacienta. Kmeny EHEC patřily k 5 sérotypům, z nichž více než polovinu tvořily sorbitol-neokyselující (NSF) O157:H7/NM[fliCH7] a třetinu kmeny O26:H11/NM[fliCH11]; sérotypy O111:NM[fliCH8], O118:NM[fliCH25] a O104:H4, stejně jako sorbitol-okyselující (SF) kmeny O157:NM[fliCH7], byly vzácné. Z celkem 7 identifikovaných stx genotypů se všech 7 vyskytlo u NSF EHEC O157, 2 u EHEC O26 a O111, a 1 u EHEC O118, O104 a SF O157. Všechny až na 1 kmen produkovaly Stx. Geny kódující další faktory virulence včetně toxinů (EHEC-hlyA, cdt-V, espP) a adhezinů (eae, efa1, iha, lpf, sfpA) byly přítomny u všech kmenů a jejich spektrum bylo sérotyp-specifické. Nejčastější z nich byl eae kódující adhezin intimin a EHEC-hlyA kódující EHEC hemolyzin. Všechny kmeny EHEC kromě SF O157 obsahovaly terE, kódující rezistenci k teluritu. Všechny kmeny kromě NSF EHEC O157 a EHEC O118 okyselovaly sorbitol a produkovaly ß-D-glukuronidázu. Většina EHEC (89,8 %) byla citlivá ke všem 12 sledovaným antimikrobiálním agens.Závěr:
EHEC se vyskytují jako původci průjmu a krvavého průjmu v ČR. Pouze systematický screening těchto patogenů ve stolicích pacientů však umožní odhalit jejich skutečný podíl na etiologii průjmových onemocnění (a rovněž HUS) v ČR, a zařadit tak tato data do evropského kontextu. Onemocnění vyvolaná EHEC jsou hlášena do Evropského centra pro prevenci a kontrolu nemocí (ECDC) v rámci surveillance Food and Waterborne Diseases.Klíčová slova:
enterohemoragická Escherichia coli – Shiga toxin – genotyp – průjem – Česká republikaÚVOD
Enterohemoragické Escherichia coli (EHEC), patogenní skupina Shiga toxin-produkujících E. coli, byly v průběhu posledních 30 let celosvětově identifikovány jako původci průjmu (krvavého či bez příměsi krve) a klasického (tj. diarrhea-associated, D+) hemolyticko-uremického syndromu (HUS) [2, 21]. D+ HUS, klinicky charakterizovaný mikroangiopatickou hemolytickou anémií, trombocytopenií a akutním renálním selháním, se vyvíjí jako systémová komplikace průjmů vyvolaných EHEC především u dětí. Postihuje většinou děti do 5 let a je nejčastější příčinou akutního selhání ledvin v dětském věku [34]. Jeho mortalita se uvádí mezi 3–5%, a až 30 % pacientů má trvalé následky ve formě chronického renálního selhání, hypertenze, proteinurie či neurologického postižení [32]. Onemocnění vyvolaná EHEC začínají typicky za 3–4 dny po infekci jako vodnatý průjem, který během 1–2 dnů přechází v krvavý průjem; HUS se vyvíjí asi za týden po začátku průjmu u 10–15 % pacientů [21, 34].
Klinicky nejdůležitějším a celosvětově rozšířeným EHEC sérotypem je O157:H7, který je nejčastějším původcem sporadických onemocnění, především HUS [21, 34] a vyvolal řadu rozsáhlých epidemií [30]. Kromě toho byla od pacientů s průjmem či HUS izolována celá řada dalších, tzv. non-O157:H7 EHEC sérotypů, z nichž nejčastější jsou O26:H11/NM (nepohyblivé kmeny), O103:H2/NM, O111:H8/NM, O145:H28/NM a O157:NM (sorbitol-okyselující kmeny) [21, 22, 27, 29].
Hlavními faktory virulence EHEC jsou Shiga toxiny (Stx) též označované Verotoxiny (VT) [22, 33]. Existují 2 hlavní typy Stx, Stx1a a Stx2a, v jejichž rámci se rozlišuje několik subtypů (Stx1c, Stx1d, Stx2b, Stx2c, Stx2d, Stx2e, Stx2f a Stx2g) [33]. U kmenů vyvolávajících lidská onemocnění se vyskytují nejčastěji Stx1a, Stx2a, Stx1c, Stx2b, Stx2c, a Stx2d [16, 27, 33, 38]. Stx, produkované EHEC kolonizujícími tlusté střevo, jsou absorbovány do krevního oběhu a transportovány do mikrovaskulatury ledvin, střeva a centrálního nervového systému, kde působí poškození endotelu [2, 21]. Kromě toho může Stx působit i přímé poškození střevních epitelových buněk [9]. EHEC produkují i řadu dalších toxinů, které mohou hrát roli v patogenezi onemocnění, jako jsou EHEC hemolyzin (EHEC-Hly), cytoletální distendující toxin (CDT-V), cytotoxin subtiláza a serin proteáza EspP [6, 17, 21]. Střevní kolonizace je umožněna řadou fimbriálních a nefimbriálních adhezinů, z nichž nejlépe prostudovaným je intimin kódovaný eae genem. Další adheziny EHEC jsou Efa1 (EHEC factor for adherence), Saa (Stx-producing E. coli autoagglutinating adhesin), LPF (long polar fimbriae), Iha (iron-regulated gene A homologue adhesin) a Sfp fimbriae [36].
Nejdůležitějším rezervoárem EHEC je hovězí dobytek [1, 2, 13, 21]. Dále byly EHEC izolovány od ovcí, koz, koní, psů, prasat, drůbeže, vysoké zvěře, lišek, hlodavců a ptáků [2, 21]. Klasickým způsobem přenosu EHEC na člověka je konzumace kontaminovaných a tepelně nedostatečně opracovaných potravin živočišného původu, jako jsou nepropečené hamburgery nebo nepasterizované mléko či výrobky z něj [21, 30]. Stále častěji se vyskytují lidská onemocnění i po požití potravin rostlinného původu, zejména kontaminové syrové zeleniny jako např. hlávkového salátu, špenátu, výhonků (ředkviček, vojtěšky, pískavice řecké seno) a ovoce, respektive ovocných produktů (meloun, jahody, nepasterizovaný jablečný džus) [2, 8, 21, 30]. Význam přenosu kontaminovanými klíčky byl dokumentován v zatím nejzávažnější epidemii EHEC [8], vyvolané v roce 2011 E. coli O104:H4, která je hybridem EHEC (produkce Stx2) a enteroagregativní E. coli (agregativní adherence ke střevnímu epitelu) [5]. Tato epidemie postihla přes 4 000 osob v 16 zemích Evropy a USA [12] a jejími typickými rysy byla vysoká frekvence progrese do HUS (~22 %), častý výskyt neurologických komplikací a výrazná převaha žen (především mladšího a středního věku) [12, 19]. Kromě potravin i kontaminovaná pitná voda a koupání ve vodních zdrojích kontaminovaných zvířecím trusem vedly ke vzniku epidemií a sporadických infekcí [21, 30]. Vzhledem k nízké infekční dávce EHEC (< 50 bakterií) [2] je důležitým způsobem šíření též fekálně-orální přenos z člověka na člověka nebo ze zvířat na člověka [2, 21, 30].
V České republice (ČR) byly EHEC identifikovány jako původci průjmů a HUS již od konce 80. let [3, 7, 23, 24, 25]. Zatímco aktuální data o EHEC jako původcích HUS byla Národní referenční laboratoří (NRL) pro E. coli a shigely publikována v roce 2013 [27], novější informace o úloze EHEC v etiologii průjmů v ČR, vlastnostech těchto patogenů a epidemiologii EHEC infekcí chybí. V této studii jsme proto zjišťovali sérotypy, genotypové a fenotypové vlastnosti kmenů EHEC izolovaných od pacientů s průjmem a rodinných kontaktů. Dále jsme retrospektivně vyšetřili na produkci Stx izoláty E. coli od pacientů s průjmem zaslaných do NRL v předchozích letech (počínaje rokem 1965) a charakterizovali genotypy a fenotypy Stx-pozitivních kmenů. Všechny kmeny byly též testovány na citlivost k antibiotikům. Kromě lidských izolátů byl vyšetřen i epidemiologicky související kmen EHEC izolovaný od zvířete.
MATERIÁL A METODY
Definice onemocnění, pacienti a bakteriální kmeny
Průjem byl definován jako ≥ 3 řídké stolice za den a krvavý průjem jako průjem s viditelnou příměsí krve ve stolici. Z celkem 50 kmenů EHEC analyzovaných v této studii bylo 49 izolováno od pacientů s průjmem (n = 43) a rodinných kontaktů (n = 6) v letech 1965–2013 a 1 kmen pocházel od ovce, která byla identifikována jako zdroj infekce EHEC. Charakteristiky pacientů a kontaktů jsou uvedeny v tabulce 1.
Tab. 1. Charakteristiky 43 pacientů a 6 rodinných kontaktů s diagnostikovanou infekcí EHEC Table 1. Characteristics of 43 patients and six family contacts diagnosed with EHEC 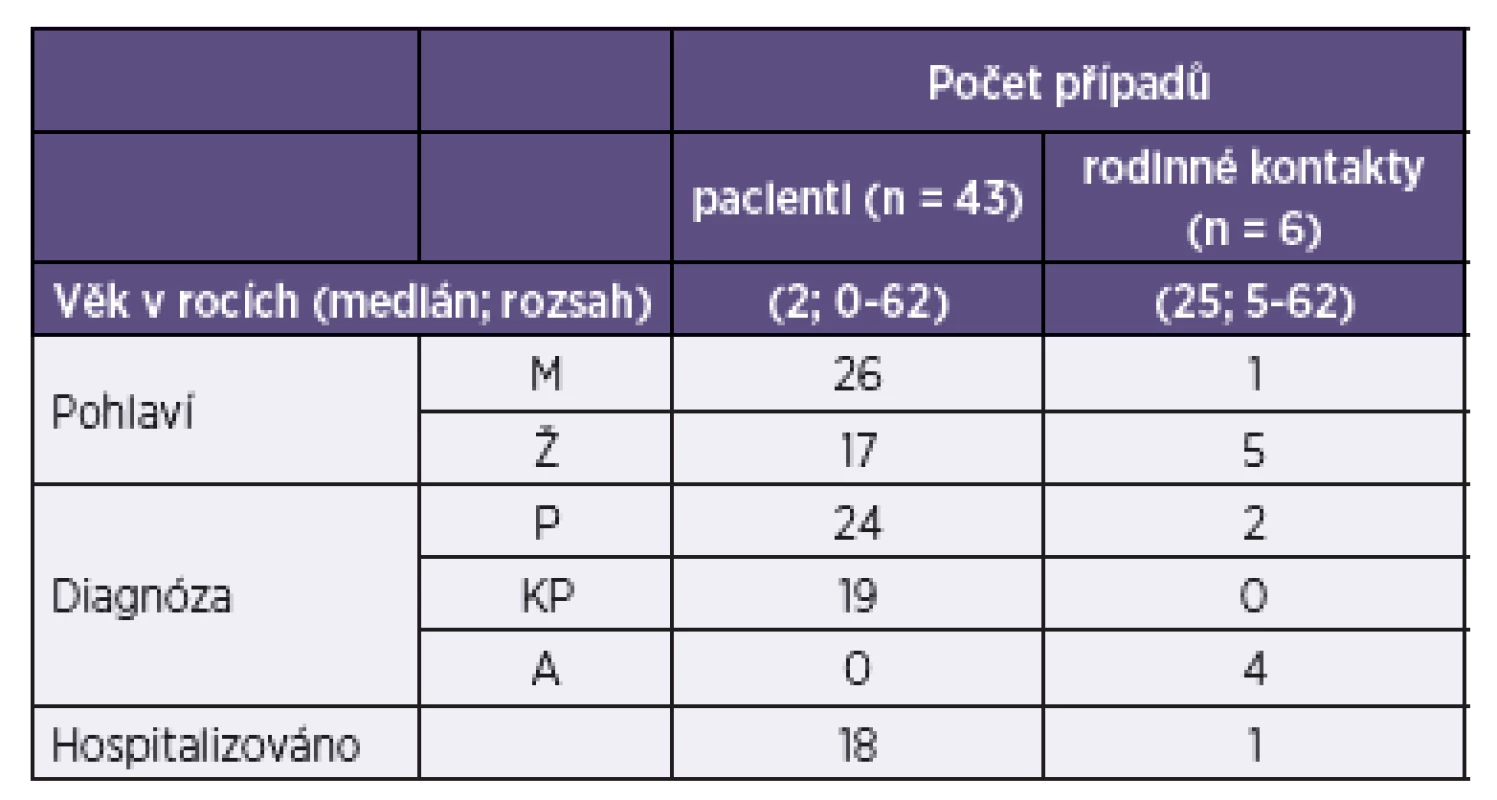
Legenda: aP – průjem bez příměsi krve, KP – průjem s viditelnou příměsí krve, A – asymptomatický průběh Legend: aP – diarrhea without blood; KP – diarrhea with visible blood; A – asymptomatic infection Čtyřicet dva kmenů EHEC, izolovaných ze stolic pacientů v 20 klinických mikrobiologických laboratořích, bylo zasláno jako izoláty E. coli určené séroskupiny do NRL k průkazu Stx. U všech s výjimkou 1 kmene (E. coli O145, u kterého byla v NRL zjištěna séroskupina O118), byla identifikovaná séroskupina v NRL potvrzena. U těchto 42 případů se jednalo o tuzemskou infekci. Jeden další kmen byl izolován v NRL ze stolice pacientky, která přicestovala do ČR z Německa, kde se nakazila epidemickým kmenem O104:H4 [28].
V souvislosti s epidemiologickým šetřením bylo z Krajských hygienických stanic a Zdravotních ústavů v letech 2006–2013 do NRL zasláno 68 vzorků humánního i nonhumánního původu. Z toho 33 pocházelo od rodinných kontaktů (27 stolic, 5 rektálních výtěrů a 1 izolát E. coli O157). Dále bylo zasláno 12 vzorků feces od zvířat (6 ovcí, 5 koní a 1 pes); 1 vzorek vody; 13 izolátů E. coli z vody a 9 izolátů z písku na dětském hřišti bez určené séroskupiny.
Detekce EHEC ve vzorcích humánního a nonhumánního původu
Detekce EHEC ve stolicích osob a zvířat vyšetřených v NRL a následná izolace kmenů EHEC byla provedena pomocí metod popsaných v naší předchozí studii [27]. Tyto zahrnovaly pomožení v Hajna bujonu (Conda, Španělsko) s novobiocinem (Oxoid, Velká Británie) s následnou imunomagnetickou separací pomocí Dynabeads EPEC/VTEC O157, O26 a O111 (Invitrogen, Norsko) a izolací kmenů na sorbitol MacConkey agaru (SMAC) (Oxoid, Velká Británie), cefixim-teluritovém SMAC (CT-SMAC) (Oxoid) a enterohemolyzinovém (EHLY) agaru (Oxoid) [27]. Vzorek vody o objemu 5 litrů byl přefiltrován membránovým filtrem (velikost pórů 0.45 µm) a filtr byl dále zpracován stejným způsobem jako stolice.
Kmeny byly potvrzeny jako E. coli biochemicky (API 20E; bioMérieux, Francie) a pomocí MALDI-TOF analýzy (Microflex LT, Bruker Daltonics, Německo). Výsledky biochemických testů byly odečítány za 24 hodin. Pohyblivost byla zjišťována zkumavkovou metodou a sledována po dobu 10 dnů.
Sérotypizace EHEC izolátů
Fenotypový průkaz somatického (O) a bičíkového (H) antigenu byl prováděn sklíčkovou aglutinací s komerčními antiséry (Denka Seiken, Japonsko; Sifin, Německo; SSI, Dánsko). Přítomnost O antigenů detekovaných konvenční sérotypizací (O26, O111, O157, O118) byla ověřena pomocí PCR [26, 27]. fliC geny kódující hlavní podjednotku H antigenu byly subtypovány metodou RFLP (restriction fragment length polymorphism) pomocí endonukleázy HhaI (New England Biolabs, USA), jak bylo popsáno v naší předchozí studii [27]. Kmeny E. coli, použité jako kontroly v molekulární typizaci O a H antigenů, pocházely z České národní sbírky typových kultur (CNCTC) SZÚ, Praha.
stx genotypizace a průkaz genů kódujících faktory virulence
Všechny kmeny byly testovány na přítomnost stx1a a stx2a genů a jejich subtypů (stx1c, stx2b, stx2c, stx2d, stx2e, stx2f) pomocí publikovaných protokolů založených na PCR (cykler MyCycler Thermal Cycler, Bio-Rad, USA) nebo PCR-RFLP [16, 33]. K průkazu genů kódujících další EHEC toxiny (cdt-V, EHEC-hlyA), serin proteázu EspP (espP), adheziny (eae, efa1, lpfAO26, lpfAO157OI-141, lpfAO157OI-154, iha, sfpA), sekreční systém typu II (etpD), rezistenci k teluritu (terE), produkci ureázy (ureD) a příjem železa (irp2, fyuA) byly užity PCR protokoly popsané v předchozích publikacích [7, 20, 27, 38]. Subtypizace eae a espP byla provedena jako v naší předchozí studii [27].
Fenotypizace
Schopnost kmenů okyselovat sorbitol byla testována na médiu SMAC a rezistence k teluritu na CT-SMAC. Okyselování sorbitolu bylo ověřeno pomocí API 20E testu, který byl též použít k průkazu okyselování ramnózy, produkce lyzin dekarboxylázy a ureázy. Produkce β-D-glukuronidázy byla detekována pomocí COLItestu (Erba Lachema, ČR). Produkce EHEC-Hly byla testována na EHLY agaru a schopnost hemolýzy na běžném krevním agaru Columbia (Oxoid) po inkubaci přes noc. Produkce Stx1a a Stx2a byla detekována reverzní pasivní aglutinací s latexovými částicemi senzibilizovanými anti-Stx1a nebo anti-Stx2a protilátkou pomocí kitu VTEC-RPLA Seiken (Denka Seiken). Biologická aktivita Stx byla ověřena testem cytotoxicity na buněčné kultuře Vero [22].
Citlivost k antibiotikům
Citlivost k ampicilinu, cefotaximu, ceftazidimu, gentamicinu, trimethoprim/sulfamethoxazolu, ciprofloxacinu, amikacinu, meropenemu, piperacilin/tazobactamu, tigecyclinu, chloramfenikolu a nitrofurantoinu (disky Oxoid) byla testována pomocí diskové difuzní metody s použitím standardních postupů [15].
Pulzní gelová elektoroforéza (PFGE)
PFGE bakteriální DNA štěpené makrorestrikčním enzymem XbaI (Promega, USA) byla provedena podle protokolu PulseNet [31]. Pulzní profily byly vyhodnoceny pomocí softwaru BioNumerics (verze 5.1)
VÝSLEDKY
Sérotypy a fliC genotypy kmenů EHEC
Čtyřicet devět kmenů EHEC izolovaných od pacientů s průjmem a jejich kontaktů patřilo k 5 sérotypům. Více než polovinu (55,1 %) tvořily NSF EHEC O157:H7/NM a téměř jednu třetinu (32,7 %) EHEC O26:H11/NM. Kmeny dalších 3 sérotypů a SF EHEC O157:NM se vyskytovaly vzácně (tab. 2). U všech kmenů byla přítomnost určeného O antigenu ověřena pomocí PCR. Ze 49 kmenů bylo 31 (63,3 %) nepohyblivých (tab. 3). fliC-RFLP analýza prokázala, že v séroskupinách O157 a O26 sdílely pohyblivé i nepohyblivé kmeny vždy stejný fliC gen (fliC kódující H7 u O157 a fliC kódující H11 u O26). Nepohyblivé kmeny séroskupiny O111 obsahovaly fliC kódující H8 a kmen O118:NM fliC kódující H25 (viz tab. 2, obrázek 1). Vzhledem k tomu, že každá z identifikovaných O séroskupin obsahovala vždy pouze jeden H antigenní typ, budeme dále používat pouze označení O skupin.
Obr. 1. Srovnání HhaI <i>fli</i>C-RFLP profilů nepohyblivých (NM) kmenů EHEC séroskupin identifikovaných v této studii s kontrolními kmeny odpovídajícího H antigenu. V drahách 2–9 jsou <i>fli</i>C-RFLP profily těchto kmenů: 2, O157:NM [<i>fli</i>CH7]; 3, U 5/41 (E. coli O1:K1:H7); 4, O26:NM [<i>fli</i>CH11]; 5, Su 4321/41 (E. coli O13:11L:H11); 6, O111:NM [<i>fli</i>CH8]; 7, Ap. 320c (E. coli O2:-:H8); 8, O118:NM [<i>fli</i>CH25]; 9, N 234 (E. coli O13:-:H25). Dráhy 1 a 10 obsahují marker (DNA marker 200-1500; Top-Bio, Česká republika). Fig. 1. The comparison of the HhaI fliC-RFLP profiles of the non-motile (NM) strains of EHEC of serogroups identified in this study with those of H antigen-matched controls Lanes 2–9: fliC-RFLP profiles of the following strains: 2, O157:NM [fliCH7]; 3, U 5/41 (<i>E. coli</i> O1:K1:H7); 4, O26:NM [fliCH11]; 5, Su 4321/41 (<i>E. coli</i> O13:11L:H11); 6, O111:NM [fliCH8]; 7, Ap. 320c (<i>E. coli</i>O2:-:H8); 8, O118:NM [fliCH25]; 9, N 234 (<i>E. coli</i> O13:-:H25). Lanes 1 and 10 show a marker (DNA marker 200-1500; Top-Bio, Czech Republic). ![Srovnání HhaI <i>fli</i>C-RFLP profilů nepohyblivých (NM) kmenů EHEC séroskupin identifikovaných v této studii s kontrolními kmeny odpovídajícího H antigenu. V drahách 2–9 jsou <i>fli</i>C-RFLP profily těchto kmenů: 2, O157:NM [<i>fli</i>CH7]; 3, U 5/41 (E. coli O1:K1:H7); 4, O26:NM [<i>fli</i>CH11]; 5, Su 4321/41 (E. coli O13:11L:H11); 6, O111:NM [<i>fli</i>CH8]; 7, Ap. 320c (E. coli O2:-:H8); 8, O118:NM [<i>fli</i>CH25]; 9, N 234 (E. coli O13:-:H25). Dráhy 1 a 10 obsahují marker (DNA marker 200-1500; Top-Bio, Česká republika).
Fig. 1. The comparison of the HhaI fliC-RFLP profiles of the non-motile (NM) strains of EHEC of serogroups identified in this study with those of H antigen-matched controls Lanes 2–9: fliC-RFLP profiles of the following strains: 2, O157:NM [fliCH7]; 3, U 5/41 (<i>E. coli</i> O1:K1:H7); 4, O26:NM [fliCH11]; 5, Su 4321/41 (<i>E. coli</i> O13:11L:H11); 6, O111:NM [fliCH8]; 7, Ap. 320c (<i>E. coli</i>O2:-:H8); 8, O118:NM [fliCH25]; 9, N 234 (<i>E. coli</i> O13:-:H25). Lanes 1 and 10 show a marker (DNA marker 200-1500; Top-Bio, Czech Republic).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e1beacfa160d6229f5f17662167af01f.png)
Tab. 2. Sérotypy a geny kódující faktory virulence u 49 kmenů EHEC izolovaných od pacientů s průjmem, krvavým průjmem a jejich kontaktů v ČR Table 2. Serotypes and genes encoding virulence factors in 49 EHEC strains isolated from patients with diarrhea or bloody diarrhea and their contacts in the Czech Republic 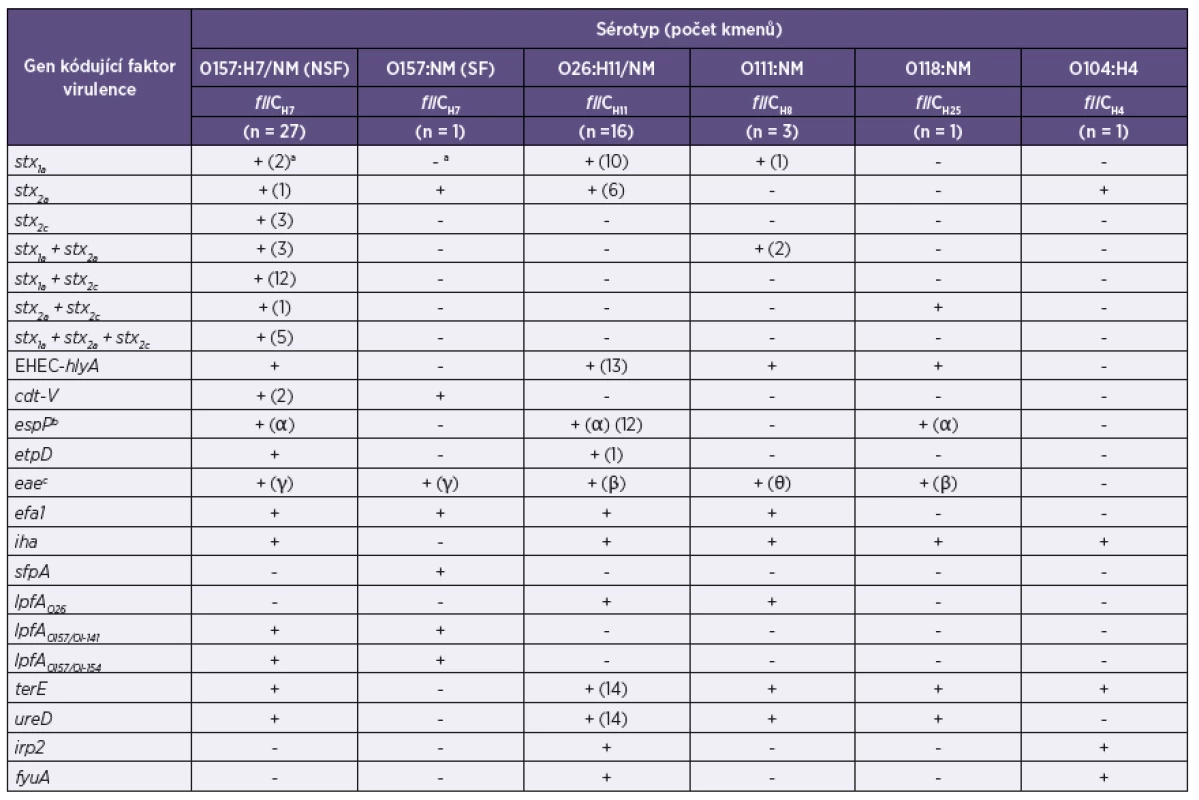
Legenda: a+, gen byl přítomen (pokud gen nebyl přítomen u všech kmenů, číslo v závorce udává počet pozitivních kmenů); -, gen nebyl přítomen. bespP subtypy jsou uvedeny v závorce. ceae subtypy jsou uvedeny v závorce. Legend: a+ – gene was detected (the number in parentheses indicates the number of positive strains); - – gene was not detected. bespP – subtypes are given in parentheses. ceae – subtypes are given in parentheses. Tab. 3. Diagnosticky důležité fenotypy kmenů EHEC izolovaných od 49 pacientů s průjmem, krvavým průjmem a jejich kontaktů v ČR Table 3. Diagnostically relevant phenotypes of EHEC strains isolated from 49 patients with diarrhea or bloody diarrhea and their contacts in the Czech Republic 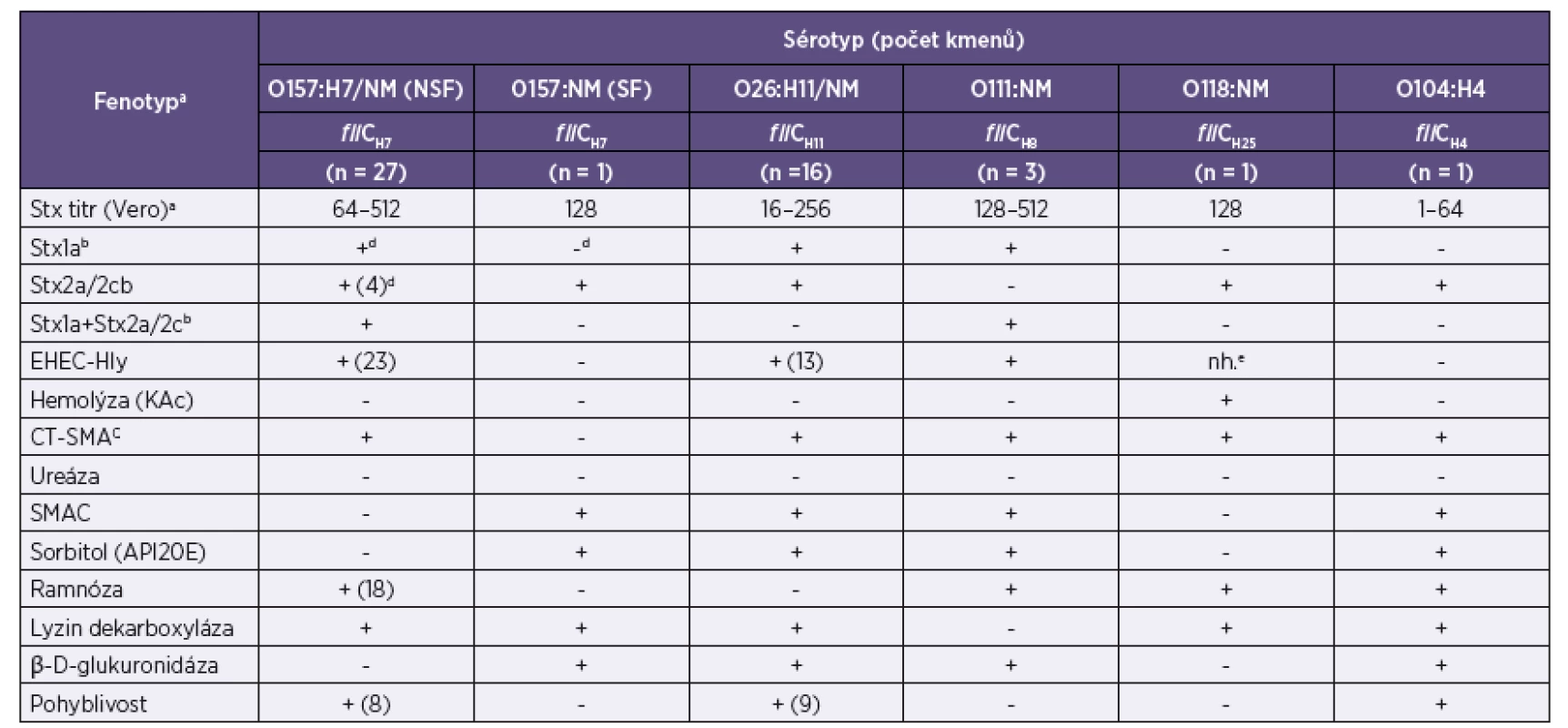
Legenda: aNejvyšší ředění supernatantu, které vyvolalo po 3 dnech cytotoxický efekt u 50 % Vero buněk. bProdukce Stx s použitím VTEC-RPLA kitu; cKA, běžný krevní agar Columbia d+, fenotyp prokázán (číslo v závorce udává počet pozitivních kmenů v případě, že fenotyp nebyl přítomen u všech kmenů); -, fenotyp neprokázán enh., nehodnotitelné Legend: aThe highest supernatant dilution that produced a cytotoxic effect on 50 % of Vero cells within three days of exposure. b Stx production tested using the VTEC-RPLA kit. cKA – common Columbia blood agar. d+ – phenotype was determined (the number in parentheses indicates the number of positive strains); - – phenotype not determined. enh. – unreadable result Geny kódující faktory virulence EHEC
Čtyřicet devět EHEC izolátů patřilo celkem k 7 stx genotypům. Všech 7 genotypů bylo identifikováno u NSF EHEC O157 a 2 různé stx genotypy u EHEC O26 a O111. SF EHEC O157 a EHEC O104 obsahovaly pouze stx2a a EHEC O118 stx2a+stx2c (viz tab. 2, obrázek 2).
Obr. 2. Příklady subtypizace stx2a a stx2c pomocí RFLP s použitím restrikční endonukleázy HaeIII u studovaných kmenů EHEC V dráhách 2–7 jsou <i>stx</i>-RFLP profily těchto kmenů: 2, SF O157:NM (<i>stx</i><sup>2a</sup>); 3, O104:H4 (<i>stx</i><sup>2a</sup>); 4, NSF O157:H7 (<i>stx</i><sup>2c</sup>), 5, NSF O157:NM (<i>stx</i><sup>2c</sup>); 6, NSF O157: NM (<i>stx</i><sup>2a</sup>+ <i>stx</i><sup>2c</sup>), 7, O118:NM (<i>stx</i><sup>2a</sup>+ <i>stx</i><sup>2c</sup>). Dráhy 1 a 8 obsahují marker (Top-Bio). Fig. 2. Examples of stx2a and stx2c subtyping by RFLP with the use of the restriction endonuclease HaeIII in the study EHEC strains Lanes 2–7: stx-RFLP profiles of the following strains: 2, SF O157:NM (stx2a); 3, O104:H4 (stx2a); 4, NSF O157:H7 (stx2c), 5, NSF O157:NM (stx2c); 6, NSF O157: NM (stx2a+ stx2c), 7, O118:NM (stx2a+ stx2c). Lanes 1 and 8. 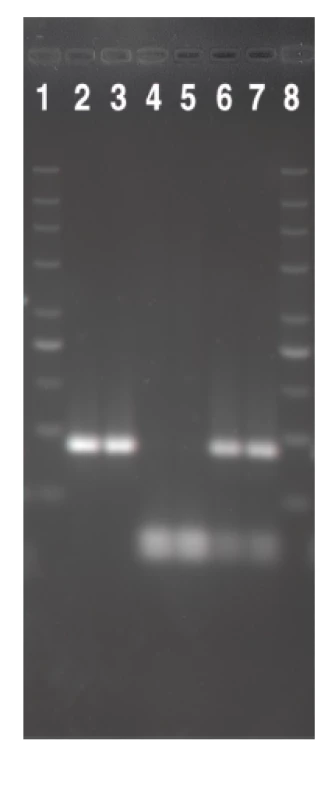
Všechny EHEC NSF O157, O111 a O118 a většina (81,3 %) EHEC O26 obsahovala gen kódující EHEC-Hly, který nebyl přítomen u SF EHEC O157 a EHEC O104. cdt-V kódující CDT-V byl nalezen u 2 NSF a u SF O157 kmene. Všechny NSF EHEC O157, 75 % EHEC O26 a EHEC O118 obsahovaly gen kódující EspPα, silně proteolytickou formu serin proteázy EspP. etpD, kódující sekreční systém typu II u E. coli, byl přítomen u všech NSF EHEC O157 a u 1 ze 16 EHEC O26. Tento etpD-pozitivní EHEC O26 též obsahoval EHEC-hlyA, ale nikoliv espP a katP (gen kódující katalázu-peroxidázu) [Marejková, nepublikovaná data], a patřil tak na základě této typické kombinace plazmidových genů k novému, vysoce virulentnímu klonu EHEC O26, který je rozšířen jako původce HUS v Evropě [4] včetně České republiky [27, 29, 39] (viz tab. 2).
Všechny kmeny EHEC, kromě O104, obsahovaly eae gen kódující intimin; subtyp eae byl sérotyp-specifický. Všechny eae-pozitivní kmeny, s výjimkou O118, též obsahovaly gen kódující adhezin Efa1. Gen iha, kódující adhezin Iha, byl přítomen u všech kmenů kromě SF O157, který naopak jako jediný obsahoval sfpA kódující Sfp fimbrie. Geny kódující různé typy LPF byly nalezeny pouze u kmenů určitých sérotypů. Všechny kmeny, s výjimkou SF O157 a dvou EHEC O26, obsahovaly terE gen, kódující rezistenci k teluritu. Všechny terE-pozitivní kmeny, kromě O104, obsahovaly ureD gen kódující produkci ureázy. Geny irp2 a fyuA, které jsou součástí systému kódujícího příjem železa [20], byly nalezeny pouze u EHEC O26 a O104 (tab. 2).
Diagnosticky důležité fenotypy EHEC
Čtyřicet osm ze 49 EHEC izolátů produkovalo Stx, který vyvolal cytotoxický efekt na kultuře Vero buněk (tab. 3, obr. 3). U 1 kmene (NSF O157 od pacienta s nekrvavým průjmem) nebyl stx2a gen exprimován. Produkce Stx1a a Stx2a byla ověřena metodou RPLA, kterou byl rovněž detekován i Stx2c. EHEC-Hly byl produkován všemi kmeny, které obsahovaly gen EHEC-hlyA s výjimkou 4 NSF EHEC O157. Kmeny produkující EHEC-Hly vyvolaly po inkubaci přes noc úzkou zónu neúplné hemolýzy na EHLY agaru, ale netvořily hemolýzu na běžném krevním agaru (obr. 4). Na krevním agaru hemolyzoval pouze jediný kmen, EHEC O118, u kterého nebylo možné rozlišit, zda hemolýza pozorovaná na EHLY agaru byla způsobena EHEC-Hly nebo hemolyzinem hemolyzujícím na krevním agaru. Všechny terE-pozitivní kmeny rostly na médiu CT-SMAC, ale žádný z ureD-pozitivních kmenů neprodukoval ureázu. Kmeny všech séroskupin, kromě NSF O157 a O118, produkovaly β-D-glukuronidázu a tato vlastnost korelovala se schopností okyselovat sorbitol. Kmeny séroskupin O26, SF O157 a třetina NSF O157 kmenů neokyselovaly ramnózu. Všechny EHEC kromě O111 produkovaly lyzin dekarboxylázu (viz tab. 3).
Obr. 3a, b. Cytotoxický účinek Stx na buňky linie Vero A. Kultura Vero buněk po 3 dnech inkubace se supernatantem kmene EHEC (> 90 % cytotoxicita). B. Kontrolní buňky kultivované po stejnou dobu v buněčném mediu. Buňky jsou barveny 0,1% krystalovou violetí. Zvětšení = 50krát Fig. 3a, b. Cytotoxic effect of Stx on Vero cell line A. Vero cell culture after three days of incubation with EHEC supernatant (> 90 % cytotoxicity). B. Control cells cultured in cell medium for an equally long period. Cells stained with 0.1% crystal violet. Magnification 50 x 
Obr. 4. EHEC-Hly fenotyp kmene EHEC na EHLY agaru (A) ve srovnání s absencí hemolýzy u stejného kmene na běžném krevním agaru (B) Fig. 4. EHEC-Hly phenotype of the EHEC strain on EHLY agar (A) in comparison with no haemolysis with the same strain on common blood agar (B) 
Citlivost EHEC izolátů k antibiotikům
Všechny EHEC O157 (NSF i SF), O118, O111 a 12 ze 16 EHEC O26 byly citlivé ke všem 12 testovaným antimikrobiálním agens. Zbylé 4 EHEC O26 byly rezistentní k ampicilinu a 1 z nich též k chloramfenikolu. Kmen O104 produkoval shodně s německým epidemickým kmenem [5], širokospektrou ß-laktamázu (byl rezistentní k ampicilinu, cefotaximu, ceftazidimu, piperacilin/tazobaktamu a citlivý k meropenemu) a byl též rezistentní k trimetoprim-sulfometoxazolu.
Sezonnost a distribuce EHEC dle krajů
Průjmová onemocnění vyvolaná EHEC se vyskytovala v průběhu celého roku s nejvyšším záchytem v květnu až říjnu. I když kmeny některých sérotypů byly izolovány pouze v létě (O111) nebo pouze v zimě (SF O157), tyto výsledky mohou být zkreslené malým počtem izolátů. Sezonnost nebyla pozorována u NSF EHEC O157, které tvořily více než polovinu takto analyzovaných kmenů a u EHEC O26 (graf 1).
Graf 1. Sezonní distribuce 33 kmenů EHEC izolovaných od pacientů a jejich kontaktů, 1965–2013 Legenda: Sezonnost byla vypočtena z data prvních příznaků. Starší případy, u kterých tato informace nebyla dohledána, a asymptomatické rodinné kontakty zařazeny nejsou. Chart 1. Seasonal distribution of 33 EHEC isolates from patients and their contacts, 1965–2013 Legend: The seasonal distribution was derived from the date of the first symptoms. Older cases for which the date could not be retrieved and asymptomatic family contacts are not included. 
Kartogram 1A. Distribuce 38 kmenů EHEC izolovaných od pacientů s průjmem, krvavým průjmem a rodinných kontaktů dle krajů, 1965-2013 Legenda: Starší případy, u kterých informace o bydlišti pacientů nebyla dohledána, zařazeny nejsou. Nejvíce případů bylo zaznamenáno ve Středočeském a Královéhradeckém kraji, a dále v kraji v Libereckém, Moravskoslezském a v Praze (Kartogram 1A). Pro srovnání uvádíme distribuci kmenů EHEC, včetně případů HUS, za období 1965–2013 (Kartogram 1B). Cartogram 1A. Distribution of 38 EHEC isolates from patients with diarrhea or bloody diarrhea and family contacts by administrative region, 1965–2013 Legend: Older cases for which the patient domicile could not be retrieved are not included. The highest numbers of cases were reported in in the Central Bohemian and Hradec Králové Regions, followed by the Liberec and Moravian-Silesian Regions and Prague (Cartogram 1A). The distribution of EHEC strains including HUS cases is shown for comparison, 1965–2013 (Cartogram 1B). 
Vlastnosti kmenů EHEC izolovaných od pacientů s HUS byly publikovány v předchozí studii [27], avšak bez dokumentace rozdělení případů podle krajů. Z grafu distribuce séroskupin EHEC lze konstatovat, že pouze séroskupina O157 se vyskytovala ve většině krajů; EHEC O26 byly zaslány ze 6 ze 14 krajů a ostatní séroskupiny se vyskytovaly ojediněle v různých krajích (graf 2).
Graf 2. Distribuce séroskupin 38 kmenů EHEC izolovaných od pacientů a jejich kontaktů (1965–2013) podle krajů Chart 2. Serogroup distribution of 38 kmenů EHEC isolates from patients and their contacts by administrative region, 1965–2013 
Kartogram 1B. Distribuce 75 kmenů EHEC izolovaných od pacientů s průjmem, krvavým průjmem a HUS včetně rodinných kontaktů dle krajů, 1965–2013 Legenda: Vlastnosti kmenů EHEC izolovaných od pacientů s HUS byly publikovány v předchozí studii [27], avšak bez dokumentace jejich krajové distribuce. Starší případy, u kterých informace o bydlišti pacientů nebyla dohledána, zařazeny nejsou. Cartogram 1B. Distribution of 75 EHEC isolates from patients with diarrhea, bloody diarrhea, or HUS and from family contacts by administrative region, 1965–2013 Legend: Characteristics of EHEC isolates from patients with HUS were reported previously [27], but without data on their distribution by administrative region. Older cases for which the patient domicile could not be retrieved are not included. ![Kartogram 1B. Distribuce 75 kmenů EHEC izolovaných od pacientů s průjmem, krvavým průjmem a HUS včetně rodinných kontaktů dle krajů, 1965–2013
Legenda:
Vlastnosti kmenů EHEC izolovaných od pacientů s HUS byly publikovány v předchozí studii [27], avšak bez dokumentace jejich krajové distribuce. Starší případy, u kterých informace o bydlišti pacientů nebyla dohledána, zařazeny nejsou.
Cartogram 1B. Distribution of 75 EHEC isolates from patients with diarrhea, bloody diarrhea, or HUS and from family contacts by administrative region, 1965–2013
Legend:
Characteristics of EHEC isolates from patients with HUS were reported previously [27], but without data on their distribution by administrative region. Older cases for which the patient domicile could not be retrieved are not included.](https://pl-master.mdcdn.cz/media/image/019160838ba5b1e00b2c881f81a0b58d.png?version=1537791971)
Rodinné výskyty EHEC
Od roku 2006 jsme v NRL pro E. coli a shigely sledovali nosičství EHEC v rodinách pacientů. V letech 2006–2013 NRL identifikovala 26 kmenů EHEC izolovaných od pacientů s průjmem nebo krvavým průjmem a u 9 z těchto 26 případů byly provedeny odběry stolic rodinných kontaktů (celkem 33 osob). Rodinný výskyt EHEC byl prokázán ve 3 případech. V těchto 3 rodinách byla přítomnost kmene EHEC stejného sérotypu, stx genotypu a virulenčního profilu, jaký byl izolován od pacienta, prokázána též u sourozenců, rodičů nebo prarodičů. Z toho dvě osoby měly průjem bez příměsi krve a u čtyř se jednalo o bezpříznakové nosičství. U 2 kontaktů s průjmem onemocnění začalo za 9 a 11 dnů po začátku onemocnění u primárního případu, což svědčí spíše pro mezilidský přenos infekce v rodinách než pro společný zdroj infekce (tab. 4). Epidemiologická souvislost izolátů v jednotlivých rodinných výskytech byla potvrzena metodou PFGE (data nejsou prezentována).
Tab. 4. Případy rodinných výskytů infekce EHEC identifikované v letech 2006–2013 Table 4. Family outbreaks of EHEC infection, cases reported in 2006–2013 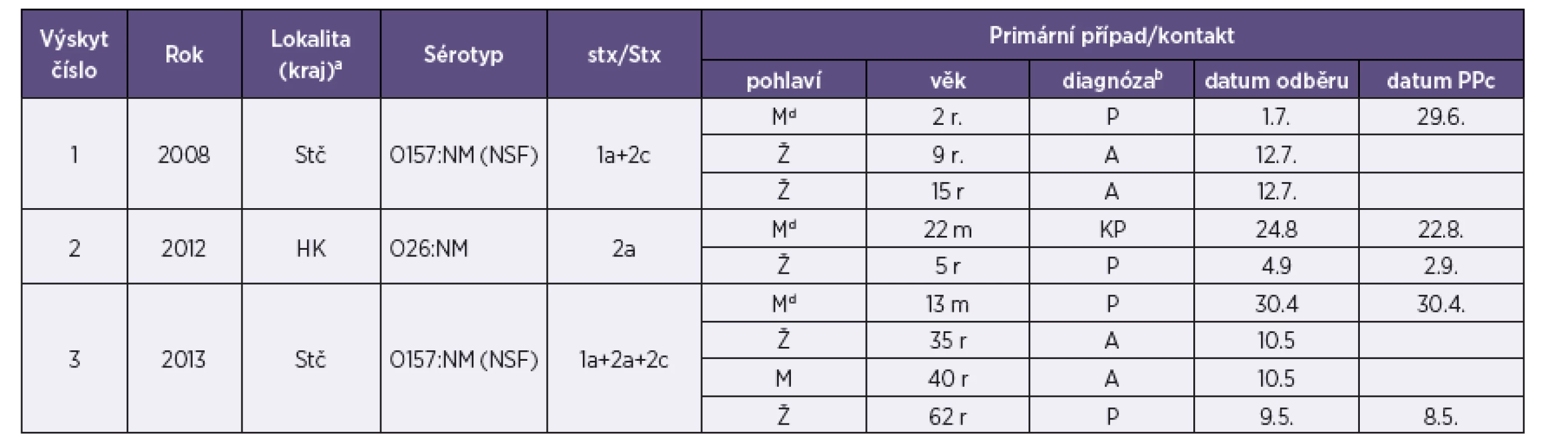
Legenda: aKraj: Stč – Středočeský, HK – Královéhradecký bP – průjem bez příměsi krve, A – asymptomatický průběh, KP – průjem s viditelnou příměsí krve cDatum prvních příznaků (průjem) dPrimární případy onemocnění („index cases“) v jednotlivých rodinách r – roky, m – měsíce Legend: aRegion: Stč – Central Bohemian Region, HK – Hradec Králové Region. bP – diarrhea without blood, A – asymptomatic infection, KP – diarrhea with visible blood. cDate of the first symptoms (diarrhea). dIndex cases in families. r –years, m – month Přenos EHEC infekce ze zvířat na člověka
Z 35 vzorků nonhumánního původu, zaslaných do NRL v letech 2006–2013 v rámci epidemiologického šetření u 6 případů infekce EHEC, se v jednom případě podařilo prokázat přenos EHEC, a to z domácího zvířete na člověka v roce 2011. Kmeny NSF EHEC O157:NM byly izolovány ze stolice 13měsíčního chlapce s krvavým průjmem a jedné ze 6 ovcí, které chovali rodiče dítěte na rodinné farmě v Libereckém kraji. Tyto kmeny vykazovaly stejné stx genotypy, faktory virulence a fenotypy; jejich epidemiologická souvislost byla potvrzena metodou PFGE (obr. 5). Dítě se mohlo nakazit přímým kontaktem s ovcemi, konzumací mléčných produktů nebo předměty kontaminovanými ovčím trusem.
Obr. 3. PFGE kmenů NSF EHEC O157 izolovaných ze stolice dítěte s krvavým průjmem a trusu ovce z rodinné farmy. V dráhách 1-4 jsou PFGE profily těchto kmenů: 1-2, kmen od pacienta; 3-4, kmen od ovce. Dráha 5 obsahuje referenční kmen Salmonella Braenderup H9812. Fig. 5. PFGE patterns of NSF EHEC O157 isolates from the stool of a child with bloody diarrhea and from the feces of a family farm sheep Lanes 1–4: PFGE profiles of the following strains: 1–2, strain from the patient, 3–4 L 0 strain from the sheep. Lane 5: reference strain Salmonella Braenderup H9812. 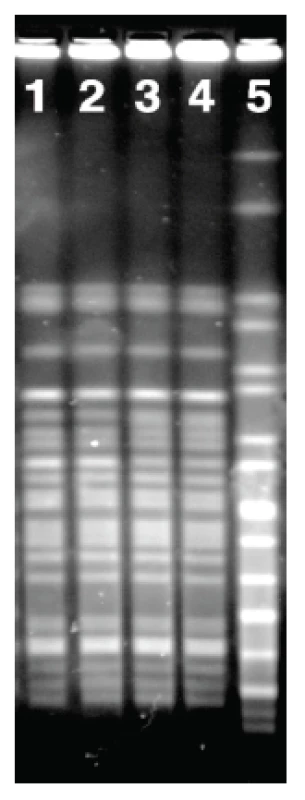
V roce 1998 byl v ČR popsán přenos infekce SF EHEC O157:NM z krávy na dvě děti (sourozenci) [7]. Součástí studovaného souboru je kmen izolovaný od jednoho z nich, 6letého chlapce s průjmem.
Doba nosičství EHEC
Od 9 ze 49 osob s prokázanou infekcí EHEC (18,4 %; 4 „index cases“ a 5 kontaktů) byly do NRL zaslány stolice z kontrolních odběrů. S výjimkou 1 pacienta (první kontrolní odběr s negativním nálezem zaslán teprve po 21 dnech) byly první kontrolní odběry provedeny do 15 dnů od prvního odběru. V 6 případech, kde byl první kontrolní odběr pozitivní, byly do NRL zaslány i další kontrolní odběry stolic (2–8 u jednotlivých osob). To umožnilo určit dobu nosičství EHEC a tato se pohybovala v rozmezí od 9 do 68 dnů (medián 22 dnů) – tabulka 5. V dalších 2 případech byl první kontrolní odběr negativní.
Tab. 5. Doba nosičství EHEC u 6 sledovaných případů Table 5. EHEC carriership duration in six patients 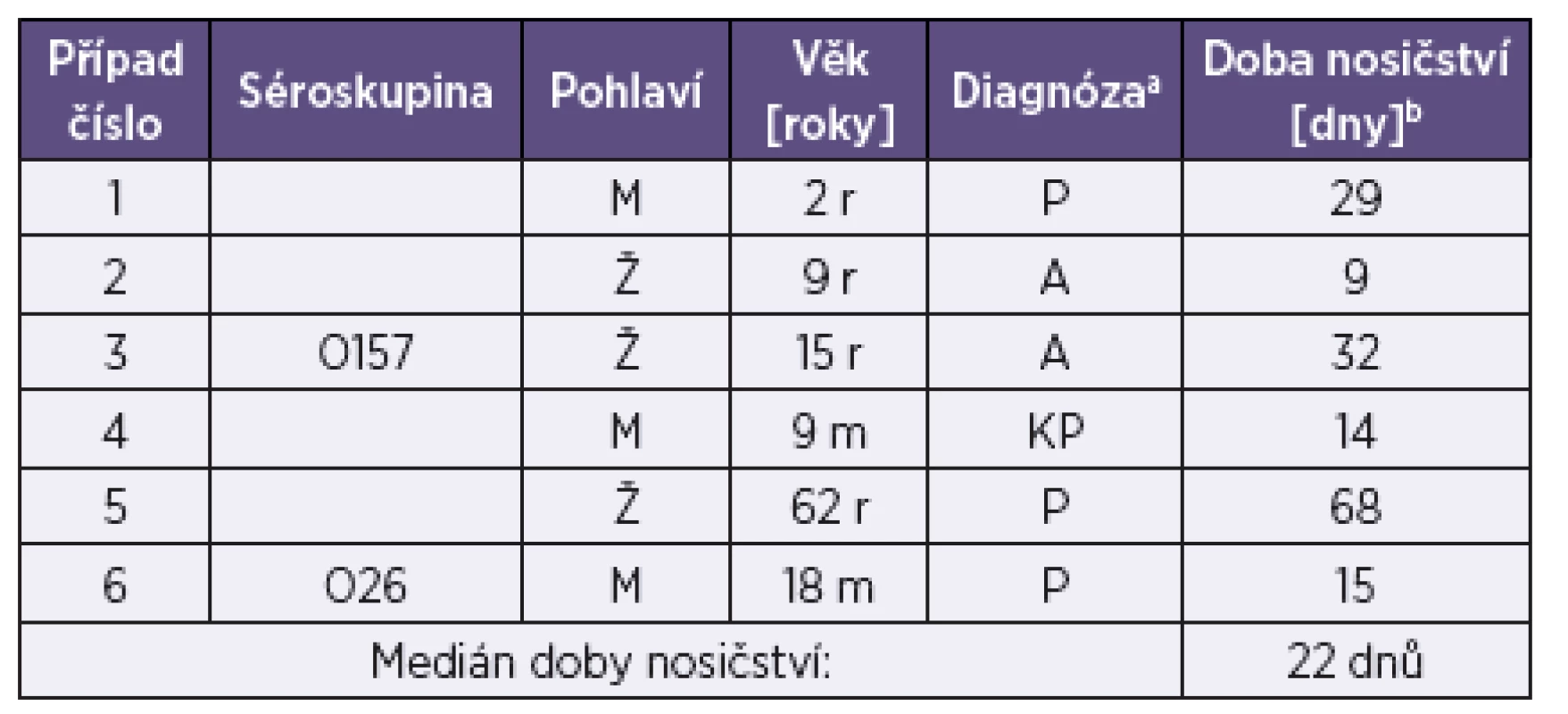
aP – průjem bez příměsi krve, A – asymptomatický průběh, KP – průjem s viditelnou příměsí krve bDoba mezi prvním odběrem a posledním kontrolním odběrem s pozitivním nálezem EHEC r – roky, m – měsíce Legend: aP – diarrhea without blood, A – asymptomatic infection, KP – diarrhea with visible blood bTime from the first and the last control EHEC-positive samples. r –years, m – month Za zmínku stojí zjištění, že v případě, kde byl jako první kontrolní odběr místo vzorku stolice omylem zaslán pouze rektální výtěr, byl tento negativní, avšak vzorek stolice zaslaný o 3 dny později, stejně jako další 2 vzorky stolice zaslané v rozmezí následujících 14 dnů, byly pozitivní. Toto pozorování ukazuje na důležitost zasílání vzorku celé stolice (velikosti asi 3 lískových oříšků) ne pouze rektálního výtěru, na průkaz EHEC. Důvodem je skutečnost, že množství EHEC ve stolici po začátku klinických příznaků rychle klesá [35], a proto pravděpodobnost úspěšné izolace EHEC ze vzorku celé stolice je větší, zvláště u pozdních (včetně kontrolních) odběrů.
DISKUSE
Tato studie ukazuje, že stejně jako je tomu v jiných zemích [4, 11, 14, 21, 38], EHEC se vyskytují jako původci průjmu a krvavého průjmu i v ČR. Naše studie měla však určitá omezení vyplývající ze současného přístupu ke sledování EHEC infekcí v ČR. Mikrobiologické laboratoře zde jsou povinny podle vyhlášky č. 473/2008 Sb. „o systému epidemiologické bdělosti pro vybrané infekce“ ve znění novely č. 275/2010 Sb. zasílat do NRL pro E. coli a shigely na průkaz Stx suspektní izoláty EHEC, zejména séroskupin O157, O26, O103, O111 a O145, které jsou sice nejčastější, ale zdaleka ne všechny popsané v souvislosti s výskytem průjmového onemocnění [11, 14, 21, 38]. Tato skutečnost se odráží na spektru identifikovaných séroskupin EHEC, kde 47 ze 49 lidských izolátů (95,9 %) patřilo k séroskupinám O157, O26 a O111 (viz tab. 2). Jediné 2 výjimky byly kmeny séroskupin O118 a O104, které byly rozpoznány jako EHEC díky tomu, že první z nich byl zaslán do NRL jako suspektní E. coli O145 a druhý byl izolován od pacientky s podezřením na infekci německým epidemickým kmenem [28]. EHEC séroskupin O103 a O145 nebyly v ČR jako původci průjmu (bez progrese do HUS) identifikovány. To může být ovlivněno i tím, že testování těchto séroskupin nebylo součásti rutinní diagnostiky většiny laboratoří, a tudíž jsou tyto kmeny do NRL k průkazu Stx zasílány v nižší frekvenci než je to u O157 a O26. Skutečnost, že nejvyšší počet případů pochází ze Středočeského kraje (Kartogram 1A), může být ovlivněna lepší dostupností do NRL a navýšením počtu případů o rodinné kontakty (dva z rodinných výskytů byly ve Středočeském kraji). Dále se nabízí otázka, do jaké míry jsou mezikrajové rozdíly v četnosti případů EHEC, jak se jeví v naší studii, způsobeny nedůsledným zasíláním suspektních kmenů EHEC. V této souvislosti bychom chtěli apelovat na všechny mikrobiologické laboratoře, aby v souladu s Vyhláškou 473/2008 Sb. ve znění novely 275/2010 Sb. důsledně zasílaly do NRL k průkazu Stx všechny suspektní izoláty EHEC.
Z hlediska laboratorní diagnostiky EHEC bychom chtěli zdůraznit několik důležitých aspektů. Za prvé, molekulární sérotypizace, obzvláště fliC-RFLP, přináší spolehlivý a rychlý způsob, jak detekovat H antigeny zejména u nepohyblivých kmenů. Toto je zvláště důležité při epidemiologických šetřeních, kdy rychlá předběžná informace o stejných fliC-RFLP profilech nepohyblivých kmenů EHEC izolovaných z různých zdrojů je východiskem pro jejich další, podrobné srovnání pomocí molekulárních metod včetně PFGE. Za druhé, fenotypy EHEC, které jsou důležité z diagnostického hlediska, zahrnují:
- a) okyselování sorbitolu a produkci β-D-glukuronidázy,
- b) okyselování ramnózy,
- c) produkci EHEC-Hly,
- d) rezistenci k teluritu.
Neschopnost „klasických“ (tj. NSF) EHEC O157:H7/NM okyselovat sorbitol umožňuje snadnou detekci těchto kmenů na SMAC, kde rostou v bezbarvých koloniích, na rozdíl od naprosté většiny kmenů E. coli běžné střevní flóry, které okyselují sorbitol a rostou v růžových koloniích. Zajímavé je, že neschopnost okyselovat sorbitol jsme pozorovali i u kmene sérotypu O118:NM, který s NSF EHEC O157 sdílel též jejich druhou typickou vlastnost, tj. neschopnost produkovat β-D-glukuronidázu (viz tab. 3). Na základě tohoto pozorování bychom chtěli zdůraznit, že sorbitol-negativní a β-D-glukuronidáza-negativní kmeny EHEC nelze automaticky považovat za E. coli O157:H7, nýbrž v každém jednotlivém případě je nutné provést určení O antigenu. Podobně jako neschopnost NSF EHEC O157 okyselovat sorbitol, byla typickým znakem všech EHEC O26 neschopnost okyselovat ramnózu (viz tab. 3). Na základě této vlastnosti, pozorované i v jiných studiích, byla vyvinuta selektivně-diagnostická půda pro předběžnou detekci EHEC O26:H11 [18].
Produkce EHEC-Hly, který vyvolává neúplnou hemolýzu na EHLY agaru (agar s promytými erytrocyty a obsahem CaCl2), ale ne na běžném krevním agaru, je charakteristickým fenotypem nejčastějších EHEC vyvolávajících lidská onemocnění [21, 27]. Tento fenotyp se nevyskytuje u běžné střevní flóry, a proto umožňuje snadnou izolaci EHEC z primokultur stolic. Výjimku tvoří SF EHEC O157, které přesto, že EHEC-hlyA obvykle obsahují [27], tento gen většinou neexprimují. Na rozdíl od kmenů E. coli, vyvolávajících mimostřevní onemocnění, které často hemolyzují na běžném krevním agaru, je tento jev u EHEC naprosto vzácný (viz tab. 3). V praxi toto znamená, že kmeny E. coli, které vyvolávají hemolýzu na běžném krevním agaru nejsou, až na vzácné výjimky, suspektní EHEC. Rezistence k teluritu, která se projevuje schopností růst na CT-SMAC, byla pozorována u všech kmenů EHEC s výjimkou dvou O26 a SF O157 (viz tab. 3). Schopnost většiny EHEC patřících k „top five“ sérotypům růst na CT-SMAC, kde je růst normální střevní flóry výrazně omezen, usnadňuje izolaci těchto kmenů z primokultur stolic.
Podobně jako jsme pozorovali v předchozí studii u kmenů EHEC izolovaných od pacientů s HUS [27], byla i zde naprostá většina EHEC izolátů (44 ze 49, tj. 89,8 %) citlivá ke všem 12 testovaným antimikrobiálním agens. Tyto výsledky jsou v souladu se studiemi z jiných zemí [10, 14, 38]. Širokospektrá ß-laktamáza, která byla zjištěna u EHEC O26 v Belgii [10], byla v našem souboru identifikována pouze u EHEC O104:H4. I přes dobrou citlivost většiny kmenů EHEC k antimikrobiálním látkám není jejich užívání k léčbě pacientů se suspektní či prokázanou infekcí EHEC doporučeno, protože zvláště některá antibiotika indukují produkci Stx a/nebo jeho uvolňování ve střevě pacientů a zvyšují tak riziko progrese do stadia HUS [37].
Za zmínku stojí zjištění dlouhodobého nosičství EHEC některými pacienty a kontakty. Vylučování EHEC O157:H7 se uvádí u nekomplikovaného průjmu průměrně 13 dnů, u HUS až 21 dnů [2]. Ve srovnání s tímto jsme v našem souboru prokázali podstatně delší dobu vylučování (od 1 do > 2 měsíců) u poloviny sledovaných osob. I když toto pozorování je omezené malým souborem, který jsme takto měli možnost sledovat, je z něj zřejmé, že dlouhodobé vylučování EHEC se vyskytuje u dětí i dospělých, a to jak u pacientů s manifestním onemocněním, tak i u osob bezpříznakových (viz tab. 5). Vzhledem k velmi nízké infekční dávce EHEC [2, 21] jsou tito nosiči závažnými potencionálními zdroji infekce pro své okolí. Prakticky to znamená nutnost důsledného sledování vylučování kmene EHEC a vyloučení osob s pozitivním nálezem z návštěvy dětských kolektivů a styku s potravinami až do vymizení patogena ze stolice.
ZÁVĚR
EHEC se vyskytují jako původci průjmu a krvavého průjmu v ČR. Pouze systematický skríning těchto patogenů ve stolicích pacientů však umožní odhalit jejich skutečný podíl na etiologii průjmových onemocnění (a rovněž HUS) v ČR a zařadit tak tato data do evropského kontextu. Onemocnění vyvolaná EHEC jsou hlášena do Evropského centra pro prevenci a kontrolu nemocí (ECDC) v rámci surveillance Food and Waterborne Diseases.
Poděkování
Obrovské poděkování patří paní doc. Dr. Martině Bielaszewské z Ústavu hygieny Univerzity v Münsteru za intenzivní, dlouhodobou a nezištnou pomoc NRL pro E. coli a shigely, za cenné rady při přípravě tohoto rukopisu a též za provedení pokusů na Vero buňkách. Prof. Dr. Dr. h.c. Helge Karchovi, řediteli Ústavu hygieny Univerzity v Münsteru a vedoucímu německé Konziliární laboratoře pro HUS děkujeme za opakované umožnění stáže Moniky Marejkové.
Autoři děkují dr. Čestmíru Benešovi a dr. Marku Malému za poskytnutí dat z EPIDATu a za zhotovení kartogramů. Dr. Jaroslavu Šaškovi děkujeme za primární zpracování vzorků vody.
Poděkování patří i všem kolegům z mikrobiologických laboratoří v celé České republice za zasílání vzorků i epidemiologům na všech úrovních a všem pracovníkům hygienické služby za epidemiologická šetření jednotlivých případů, včetně zajišťování kontaktů. V neposlední řadě děkujeme všem spolupracovníkům z CEM, především paní Miluši Vašákové, za technickou asistenci.
Do redakce došlo dne 12 2. 2014.
Adresa pro korespondenci:
Ing. Monika Marejková
NRL pro E. coli a shigely
Státní zdravotní ústav
Šrobárova 48, 100 42 Praha 10
e-mail: monmarej@szu.cz
Zdroje
1. Alexa P, Konstantinova L, Zajacova-Sramkova Z. Faecal shedding of verotoxigenic Escherichia coli in cattle in the Czech Republic. Veterinární Medicina, 2011;56 : 149–155.
2. Ambrožová H, Marejková M. Enterohaemorrhagic Escherichia coli - dangerous new pathogens. Cas Lek Cesk, 2012;151(11):514–518.
3. Bielaszewska M, Janda J. Mikrobiologické aspekty infekce kmeny E. coli produkujícími verotoxin u dětí s hemolyticko-uremickým syndromem. Cesk Epidemiol Mikrobiol Imunol, 1989;38 : 237–244.
4. Bielaszewska M, Mellmann A, Bletz S, et al. Enterohemorrhagic Escherichia coli O26:H11/H - : A new virulent clone emerges in Europe. Clin Infect Dis, 2013;56 : 1373–1381.
5. Bielaszewska M, Mellmann A, Zhang W, et al. Characterisation of the Escherichia coli strain associated with an outbreak of haemolytic uraemic syndrome in Germany, 2011: a microbiological study. Lancet Infect Dis, 2011;11 : 671–676.
6. Bielaszewska M, Rüter C, Kunsmann L, et al. Enterohemorrhagic Escherichia coli hemolysin employs outer membrane vesicles to target mitochondria and cause endothelial and epithelial apoptosis. PLoS Pathog, 2013;9(12):e1003797.
7. Bielaszewska M, Schmidt H, Liesegang A, et al. Cattle can be a reservoir of sorbitol-fermenting Shiga toxin-producing Escherichia coli O157:H - strains and a source of human diseases. J Clin Microbiol, 2000;38(9):3470–3473.
8. Buchholz U, Bernard H, Werber D, et al. German outbreak of Escherichia coli O104:H4 associated with sprouts. N Engl J Med, 2011;365(19):1763–1770.
9. Bunger JC, Melton-Celsa AR, O'Brien AD. Shiga toxin type 2dact displays increased binding to globotriaosylceramide in vitro and increased lethality in mice after activation by elastase. Toxins (Basel), 2013;5(11):2074–92. doi: 10.3390/toxins5112074.
10. Buvens G, Bogaerts P, Glupczynski Y, et al. Antimicrobial resistance testing of verocytotoxin-producing Escherichia coli and first description of TEM-52 extended-spectrum ß-lactamase in serogroup O26. Antimicrob Agents Chemother, 2010;54(11):4907–4909.
11. Buvens G, De Gheldre Y, Dediste A, et al. Incidence and virulence determinants of verocytotoxin-producing Escherichia coli infections in the Brussels-Capital Region, Belgium, in 2008-2010. J Clin Microbiol, 2012;50 : 1336–1345.
12. Centers for Disease Control and Prevention (CDC). Outbreak of Escherichia coli O104:H4 Infections Associated with Sprout Consumption - Europe and North America, May-July 2011. MMWR Morb Mortal Wkly Rep, 2013;62(50):1029–1031.
13. Čížek A, Dolejská M, Novotná R, et al. Survey of Shiga toxigenic Escherichia coli O157 and drug-resistant coliform bacteria from in-line milk filters on dairy farms in the Czech Republic. J Appl Microbiol, 2007;104 : 852–860.
14. Eklund M, Scheutz F, Siitonen A. Clinical isolates of non-O157 Shiga toxin-producing Escherichia coli: serotypes, virulence characteristics, and molecular profiles of strains of the same serotype. J Clin Microbiol, 2001;39 : 2829–2834.
15. EUCAST committees and subcommittees. European Committee on Antimicrobial Susceptibility Testing. EUCAST SOP 4.1, 2013. Dostupný na www: http://www.eucast.org.
16. Friedrich AW, Bielaszewska M, Zhang W, et al. Escherichia coli harboring Shiga toxin 2 gene variants: frequency and association with clinical symptoms. J Infect Dis, 2002;185 : 74–84.
17. Friedrich AW, Lu S, Bielaszewska M, et al. Cytolethal distending toxin in Escherichia coli O157:H7: spectrum of conservation, structure, and endothelial toxicity. J Clin Microbiol, 2006;44(5): 1844–1846.
18. Hiramatsu R, Matsumoto M, Miwa Y, et al. Characterization of Shiga toxin-producing Escherichia coli O26 strains and establishment of selective isolation media for these strains. J Clin Microbiol, 2002;40 : 922–925.
19. Karch H, Denamur E, Dobrindt U, et al. The enemy within us: lessons from the 2011 European Escherichia coli O104:H4 outbreak. EMBO Mol Med, 2012;4(9):841–848.
20. Karch H, Schubert S, Zhang D, et al. A genomic island, termed high-pathogenicity island, is present in certain non-O157 Shiga toxin-producing Escherichia coli clonal lineages. Infect Immun, 1999;67 : 5994–6001.
21. Karch H, Tarr PI, Bielaszewska M. Enterohaemorrhagic Escherichia coli in human medicine. Int J Med Microbiol, 2005;295(6-7):405–418.
22. Karmali MA, Petric M, Lim C, et al. The association between hemolytic uremic syndrome and infection by Verotoxin-producing Escherichia coli. J Infect Dis, 1985;151 : 775–782.
23. Lhotová H. Hemolyticko-uremický syndrom u dítěte vyvolaný verotoxigenním kmenem Escherichia coli O26. Zprávy CEM (SZÚ, Praha), 1999;8(11):426.
24. Lhotová H, Bielaszewska M, Kopalová E, et al. Haemolyticko-uremický syndrom – mikrobiologické šetření. Cesk Epid Mikrobiol Imunol, 1990;39(1):13–20.
25. Lhotová H, Ševčíková A. Závažný průběh hemolyticko-uremického syndromu u dítěte vyvolaný kmenem E. coli O157:H7 produkujícím verocytotoxin. Zprávy CEM (SZÚ, Praha), 2000;9(10):405–406.
26. Liu Y, Fratamico P, Debroy C, et al. DNA sequencing and identification of serogroup-specific genes in the Escherichia coli O118 O antigen gene cluster and demonstration of antigenic diversity but only minor variation in DNA sequence of the O antigen clusters of E. coli O118 and O151. Foodborne Pathog Dis, 2008;5(4):449–457.
27. Marejková M, Bláhová K, Janda J, et al. Enterohemorrhagic Escherichia coli as causes of hemolytic uremic syndrome in the Czech Republic. PLoS One, 2013;8(9):e73927.
28. Marejková M, Roháčová H, Reisingerová M, et al. An imported case of bloody diarrhea in the Czech Republic caused by a hybrid enteroaggregative hemorrhagic Escherichia coli (EAHEC) O104:H4 strain associated with the large outbreak in Germany, May 2011. Folia Microbiol (Praha), 2012;57(2):85–89.
29. Marejková M, Zieg J, Dušek J, et al. Smrtelný případ diareapozitivního hemolyticko-uremického syndromu vyvolaného enterohemoragickou E. coli O26. Zprávy EM (SZÚ, Praha) 2009;18(6):212–214.
30. Rangel JM, Sparling PH, et al. Epidemiology of Escherichia coli O157:H7 outbreaks, United States, 1982–2002. Emerg Infect Dis, 2005;11 : 603–609.
31. Ribot EM, Fair MA, Gautom R, et al. Standardization of pulsed-field gel electrophoresis protocols for the subtyping of Escherichia coli O157:H7, Salmonella, and Shigella for PulseNet. Foodborne Pathog Dis, 2006;3 : 59–67.
32. Rosales A, Hofer J, Zimmerhackl LB, et al. Need for long-term follow-up in enterohemorrhagic Escherichia coli - associated hemolytic uremic syndrome due to late-emerging sequelae. Clin Infect Dis, 2012;54 : 1413–1421.
33. Scheutz F, Teel LD, Beutin L, et al. Multicenter evaluation of a sequence-based protocol for subtyping Shiga toxins and standardizing Stx nomenclature. J Clin Microbiol, 2012;50 : 2951–2963.
34. Tarr PI, Gordon CA, Chandler WL. Shiga toxin-producing Escherichia coli and haemolytic uraemic syndrome. Lancet, 2005;365 : 1073–1086.
35. Tarr PI, Neill MA, Clausen CR, et al. Escherichia coli O157:H7 and the hemolytic uremic syndrome: importance of early cultures in establishing the etiology. J Infect Dis, 1990;162 : 553–556.
36. Torres AG, Zhou X, Kaper JB. Adherence of diarrheagenic Escherichia coli strains to epithelial cells. Infect Immun, 2005; 73(1):18–29.
37. Wong CS, Jelacic S, Habeeb RL, et al. The risk of the hemolytic-uremic syndrome after antibiotic treatment of Escherichia coli O157:H7 infections. N Engl J Med, 2000;342 : 1930–1936.
38. Zhang W, Nadirk J, Kossow A, et al. Phylogeny and phenotypes of clinical and environmental Shiga toxin-producing Escherichia coli O174. Environ Microbiol, 2013; Aug 1. doi: 10.1111/1462-2920.12234. [Epub ahead of print]
39. Zieg J, Dusek J, Marejkova M, et al. Fatal case of diarrhea-associated hemolytic uremic syndrome with severe neurologic involvement. Pediatr Int, 2012;54 : 166–167.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2014 Číslo 3- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Věnování doc. MUDr. Heleně Hupkové, Ph.D. in memoriam
- Klinická a mikrobiologická charakteristika závažných infekcií spôsobených streptokokmi skupiny A
- Vplyv prípravkov určených na dezinfekciu kože, slizníc a rán na životaschopnosť biofilmovej formy rastu mikroorganizmov izolovaných od pacientov s katétrovými infekciami
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Rezistence k erytromycinu, ciprofloxacinu a k tetracyklinu u humánních izolátů Campylobacter spp. v České republice, vyšetřená standardní metodou EUCAST
- Výskyt a vlastnosti baktérií Staphylococcus aureus ve vepřovém mase
- Identifikace izolátů Mycobacterium spp. pomocí MALDI-TOF hmotnostní spektrometrie
- Profesionálna TBC na Slovensku a v Českej republike
- Infekce vyvoláné lidskými alfa herpetickými viry
- Protikladný vývoj trendů incidence kapavky a syfilis ve východočeském regionu – 30 let surveillance
- Avidita antifosfolipidových protilátek – naše současné znalosti
- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Výskyt a charakteristika termotolerantních kampylobakterů v potravinovém řetězci člověka
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
- Význam očkování proti chřipce u osob s kardiovaskulárním onemocněním
- Zhodnocení významu ready-made spaceru s gentamicinem ve vztahu k bakteriologickým nálezům u pacientů s infekcí kloubní náhrady
- Q-horečka jako profesionální onemocnění vedoucí k invaliditě – kazuistika
- Návrat spalniček do Ústeckého kraje
- Vzpomínka na nedožité 90. narozeniny MUDr. Miroslava Přívory, CSc.
- Vzpomínka na nedožité 90. narozeniny prof. MUDr. Bohumila Ticháčka, DrSc.
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Infekce vyvoláné lidskými alfa herpetickými viry
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



