-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zhodnocení významu ready-made spaceru s gentamicinem ve vztahu k bakteriologickým nálezům u pacientů s infekcí kloubní náhrady
Evaluation of the importance of a ready-made, gentamicin-impregnated spacer in relation to bacteriological findings in patients with periprosthetic joint infections
Background:
Periprosthetic infection is a serious complication in total hip and knee arthroplasty. The complex therapeutic approach within two-stage reimplantation includes the use of antibiotic-impregnated spacers (temporary joint replacements). The aim of this paper was to evaluate bacteriological findings in selected patients with periprosthetic infection in whom a ready-made gentamicin-impregnated spacer was used to treat the infection.Materials and methods:
Between 2008 and 2012, a ready-made, gentamicin-impregnated cement spacer was used in 24 patients to treat periprosthetic hip or knee infection within two-stage reimplantation. All components of the prosthesis and periprosthetic tissue samples were sent for microbiological examination at the first revision surgery, while at the second revision surgery, the spacer and surrounding tissue samples were sent in. In six patients with an inserted knee spacer, the level of gentamicin in the joint fluid was measured. Subsequently, the patients were regularly monitored.Results:
Twenty-two (92%) of 24 patients were bacteriologically positive by culture. The most commonly detected causative agents were coagulase-negative staphylococci. Other isolates were Staphylococcus aureus, Corynebacterium, anaerobic bacteria, and Salmonella serotype Enteritidis. Nineteen (76%) of 25 primary pathogens were gentamicin sensitive. Spacers from two patients were culture positive for coagulase-negative staphylococci that tested resistant to gentamicin. During the follow-up of at least two years, none of the patients developed another periprosthetic infection.Conclusion:
The success rate of two-stage-reimplantation total hip and knee arthroplasty using ready-made, gentamicin-impregnated spacers was 100 % in our cohort of patients; no other periprosthetic infection was reported during the follow-up of at least two years. From the bacteriological results, it appears that the ready-made, gentamicin-impregnated spacer only covers 76 % of the range of the causative agents. The solution would be to use a spacer impregnated with a combination of vancomycin and gentamicin that would be effective against all cultured species.Keywords:
total hip arthroplasty – total knee arthroplasty – periprosthetic joint infection – two-stage reimplantation – gentamicin-impregnated spacer
Autoři: T. Proček 1; Lenka Ryšková 2
; T. Kučera 1; J. Šrot 1; P. Šponer 1; J. Gallo 3; L. Plíšková 4
Působiště autorů: Ortopedická klinika FN a LF UK Hradec Králové 1; Ústav klinické mikrobiologie FN a LF UK Hradec Králové 2; Ortopedická klinika LF UP a FN Olomouc 3; Ústav klinické biochemie a diagnostiky FN a LF UK Hradec Králové 4
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 3, s. 254-260
Kategorie: Souhrnná sdělení, původní práce, kazuistiky
Souhrn
Cíl práce:
Periprotetické infekce jsou závažnou komplikací totálních endoprotéz (TEP) kyčelního a kolenního kloubu. Součástí komplexního terapeutického přístupu v rámci dvojdobé reimplantace je použití spacerů (dočasné kloubní náhrady) s obsahem antibiotik. Cílem této práce bylo zhodnotit bakteriologické nálezy u vybraných pacientů s periprotetickou infekcí, u kterých byl použit komerčně připravený spacer s gentamicinem.Materiál a metodika:
V letech 2008–2012 byl použit u 24 pacientů při ošetření infekce kloubní náhrady kyčelního nebo kolenního kloubu – v rámci dvojdobé reimplantace – ready-made cementový spacer s gentamicinem. K mikrobiologickému vyšetření byly z první revize odeslány všechny komponenty endoprotézy a vzorky periprotetické tkáně, v druhé době pak spacer a vzorky okolní tkáně. U šesti pacientů se zavedeným spacerem kolenního kloubu byla měřena hladinu gentamicinu v kloubní tekutině. Pacienti byli následně pravidelně sledováni.Výsledky:
Výsledkem bakteriologického vyšetření byl kultivační průkaz agens v 22 případech z 24 (92 %). Nejčastěji byly vykultivovány koaguláza-negativní stafylokoky, dále byl izolován Staphylococcus aureus, korynebakteria, anaerobní bakterie a Salmonella Enteritidis, citlivých ke gentamicinu bylo 19 z 25 prokázaných agens (76 %). Kultivační vyšetření spacerů bylo pozitivní u dvou pacientů, vykultivovány byly koaguláza-negativní stafylokoky, v obou případech rezistentní ke gentamicinu. Po dobu sledování (minimálně 2 roky) pacientů nedošlo u žádného z nich k rozvoji další periprotetické infekce.Závěr:
Úspěšnost reimplantací TEP kyčelního a kolenního kloubu ve dvojdobém rytmu s užitím ready-made spacerů s gentamicinem byla v našem souboru 100 %, po dobu minimálně dvou let nedošlo v našem souboru pacientů k zaznamenání dalšího periprotetického infektu. Z hodnocení nálezů bakteriologického vyšetření našeho souboru vyplývá, že ready-made spacer s gentamicinem pokrývá pouze 76 % spektra původců. Řešením by bylo použití spaceru nasyceného kombinací vankomycinu a gentamicinu, které by zajistilo antimikrobiální působení vůči všem vykultivovaným agens.Klíčová slova:
totální endoprotéza kyčelního kloubu – totální endoprotéza kolenního kloubu – infekce kloubní náhrady – dvojdobá reimplantace – spacer s gentamicinemÚVOD
Periprotetické infekce neboli infekce kloubní náhrady (IKN) jsou způsobeny infikováním povrchu endoprotézy bakteriemi a jejich množením. Tento infekční proces současně poškozuje okolní tkáně a působí pacientovi obtíže, které vyústí až k nutnosti chirurgické revize. Aktuální odhady prevalence IKN se pohybují u náhrady kyčelního kloubu mezi 0,5 až 3 %, u náhrady kolenního kloubu mezi 1 až 5 %. Infekční komplikace totálních endoprotéz (TEP) kyčelního a kolenního kloubu tudíž představují závažnou a diskutovanou problematiku jak z hlediska medicínského, tak ekonomického [1, 2, 3]. U většiny infekcí kloubních náhrad je nutné vyjmout infikovaný implantát a provést radikální debridement infikovaných a nekrotických tkání.
Dlouhou dobu se diskutuje o tom, jestli je možné ve stejné době – po kompletním přerouškování pacienta a výměně nástrojů – přistoupit k reimplantaci definitivní protézy (tzv. jednodobá reimplantace), anebo je lepší osadit prostor po vyjmutí kloubní náhrady cementovým spacerem a v druhé době pak přistoupit k reimplantaci (tzv. dvojdobá reimplantace). Metaanalýzy studií naznačují, že dvoudobá operace je univerzálnějším a o něco spolehlivějším výkonem ve srovnání s jednodobým postupem. U dvoudobé reimplantace se nejdříve odstraní implantát a okolní infikované tkáně. Vzorky odebraného materiálu včetně extrahovaných částí kloubní náhrady se zasílají k mikrobiologickému vyšetření, s cílem prokázat etiologické agens. Poté následuje terapie antibiotiky po dobu minimálně 6 týdnů a průběžná kontrola úspěšnosti léčby na základě klinických, laboratorních a zobrazovacích metod. V druhé době se pak přistupuje k reimplantaci do relativně bezpečného terénu [1, 2, 4].
I přes tato opatření patří revizní operace mezi velmi rizikové s ohledem na možnou recidivu infektu. Mezi současné snahy proto patří inovace revizních postupů o další kroky, které mohou riziko infektu snížit. Garvin a Hanssen zpracovali data z 29 prací a zjistili, že samotná dvoustupňová reimplantace bez použití cementu nasyceného antibiotiky měla terapeutický úspěch v 82 %, při jejich použití se úspěšnost eradikace infekce zvýšila na 91 % [5]. Léčba periprotetických infekcí lokálními nosiči antibiotik umožňuje dosáhnout místně vysoké koncentrace antibiotik, které několikanásobně převyšují minimální inhibiční koncentrace (MIC) případných patogenních agens. Antibiotikum pak může působit jak na planktonické formy bakterií, tak i na bakterie ve formě biofilmu. Slibnou metodou je použití tzv. spacerů (výplně dutiny vzniklé po extrakci implantátu) s obsahem antibiotik. Spacery představují nosiče antibiotik, ze kterých dochází k jejich lokálnímu uvolňování v koncentraci vyšší, než by bylo možné dosáhnout systémovým podáním, a také mají funkci mechanickou – vyplní dutinu po odstraněné protéze mezi první a druhou operační dobou, čímž umožní zachovat délku končetiny, případně dovolí pohyb kloubu v určitém rozsahu a zabrání vrůstání vazivové tkáně do kloubu [6, 7, 8, 9]. Dříve se začaly používat tzv. hand-made spacery, které se připravují peroperačně přímo na sále smícháním zvoleného antibiotika a kostního polymetylmetakrylátového cementu. Antibiotické vlastnosti hand-made spacerů jsou však nekonstantní, závislé na technice výroby, např. způsobu míchání a vzniklé konzistenci cementu. Nevýhodou je rovněž možnost jejich luxace nebo eroze kosti při ne zcela hladkém povrchu. Tato rizika jsou eliminována firemně vyráběnými spacery, tzv. ready-made, které mají tvar podobný endoprotéze [10, 11, 12].
Peroperačně se k cementu přidávají různá antibiotika. Obecně by měla být termostabilní, protože polymerizace cementu je exotermická reakce, při které se uvolňuje teplo. Také by tato antibiotika měla být rozpustná ve vodě, aby mohlo docházet k uvolňování antibiotika do okolní tkáně. Nejčastěji se používá tobramycin, gentamicin, vankomycin a některé cefalosporiny [6, 13, 14]. Zvolené antibiotikum by mělo pokrýt co nejširší spektrum možných patogenů, což u periprotetických infekcí tvoří především grampozitivní bakterie – Staphylococcus aureus a koaguláza-negativní stafylokoky. U pacientů se známým původcem IKN je při výrobě hand-made spaceru možné zvolit antibiotikum k nasycení cementu cíleně, u komerčně připravených spacerů tato možnost chybí. Otázkou tedy zůstává, zda komerčně připravené spacery obsahující konkrétní antibiotikum s jeho předem daným obsahem vyhovují požadavkům konkrétního pacienta [11, 15].
Cílem této práce bylo u vybraných pacientů s infekcí kloubní náhrady, u kterých byl použit komerčně připravený spacer s gentamicinem, zhodnotit kultivovaná etiologická agens a jejich citlivost ke gentamicinu obsaženém ve spaceru, dále pak vyhodnotit bakteriální nálezy z extrahovaných ready-made spacerů a úspěšnost operační revize.
MATERIÁL A METODIKA
V období mezi lednem 2008 a červnem 2012 byl na Ortopedické klinice Fakultní nemocnice v Hradci Králové použit u 24 pacientů (10 mužů a 14 žen) k ošetření periprotetické infekce v oblasti kyčle a kolena v rámci dvojdobé reimplantace cementový ready-made spacer s gentamicinem (Synicem®, produkt francouzské firmy Synimed). Do studie byli náhodně zařazeni pacienti s prokázanou periprotetickou infekcí, kteří zároveň splňovali kritéria implantace ready-made spaceru. Diagnóza IKN byla založena na známkách periprotetické infekce, a to klinických (bolest, zvýšená teplota, lokální známky infekce), laboratorních (CRP, FW, leukocytóza, přítomnost zánětlivého výpotku) a radiologických (patologická osteolýza v okolí TEP, uvolnění implantátu). Infekce byla klasifikována podle nejčastěji používané koncepce infekcí kloubních náhrad Marka B. Coventryho z Mayo kliniky, uvedeno v tabulce 1 [16]. V našem souboru byli 4 pacienti s I. typem (akutní pooperační infekce), 14 pacientů s II. typem (chronická infekce), 5 pacientů s III. typem (hematogenní infekce) a 1 pacient s V. typem infekce (přímé rozšíření infekce z okolí). Průměrný věk pacientů byl při implantaci spaceru 65,3 roků (věkové rozmezí 46–83; medián 62,5 roku). Kritériem pro implantaci spaceru byla pacientova schopnost spolupracovat a vertikalizovat, dále stabilita kostního lůžka acetabula a trochanterické oblasti, suficientní pelvifemorální svalstvo a snášenlivost gentamicinu.
Tab. 1. Patogenetická klasifikace infekcí kloubních náhrad Table 1. Pathogenetic classification of priprosthetic joint infections 
Ready-made spacer
Ve studii byly použity spacery vyrobené z vysoce porózního kostního polymetylmetakrylátového cementu impregnovaného gentamicinem – Synicem® (obr. 1 a 2). Kyčelní spacer obsahuje 2,12 g gentamicinu, obsah gentamicinu v kolenním spaceru je 3,38 g. Podle výrobce spacery Synicem® vykazují bifázický profil uvolňování antibiotika – po iniciálním uvolnění vysokých koncentrací (koncentrační vrchol je mezi 24–48 hodinami) následuje fáze nižšího, postupného uvolňování antibiotika do okolí spaceru. Spacery kyčelního kloubu a kolenního kloubu jsou z mechanického hlediska navrženy tak, aby vydržely in situ minimálně 6 měsíců [9].
Obr. 1. Rentgenový snímek implantovaného ready-made spaceru kyčelního kloubu. Významnou výhodou je zachování délky končetiny. Fig 1. An X-ray of an implanted ready-made total hip spacer, having the advantage of preserving limb length. 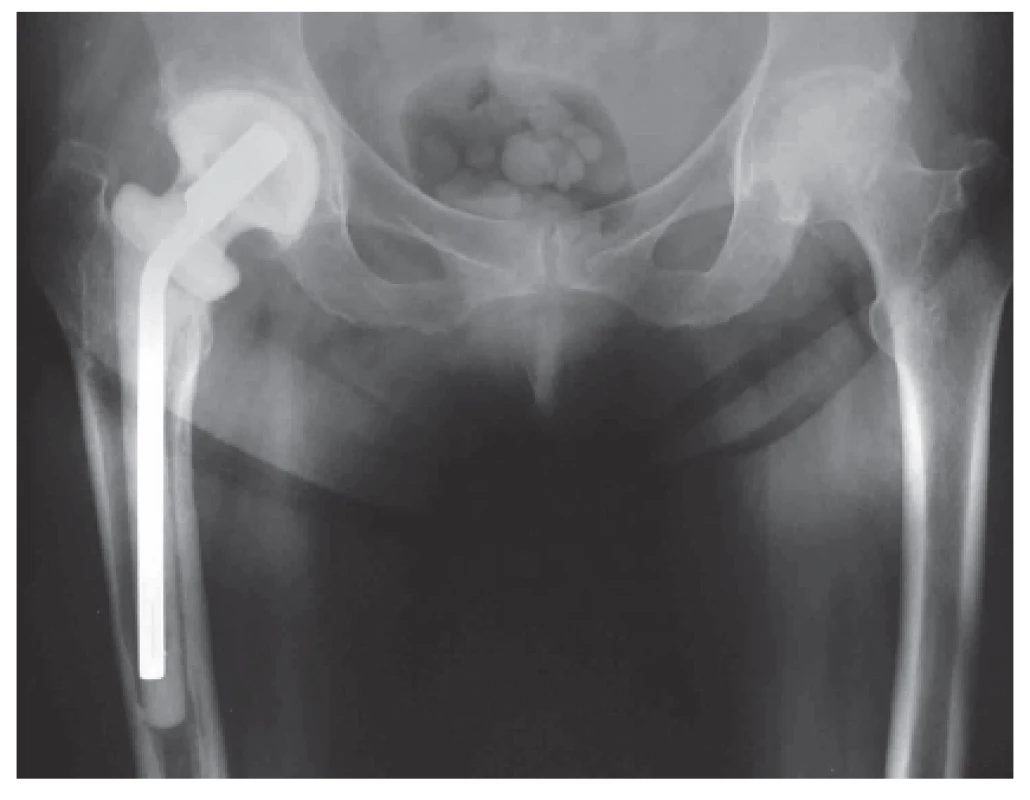
Obr. 2. Peroperační snímek implantovaného kolenního spaceru Synicem<sup>®</sup> Fig 2. Perioperative photo of an implanted Synicem<sup>®</sup> knee spacer 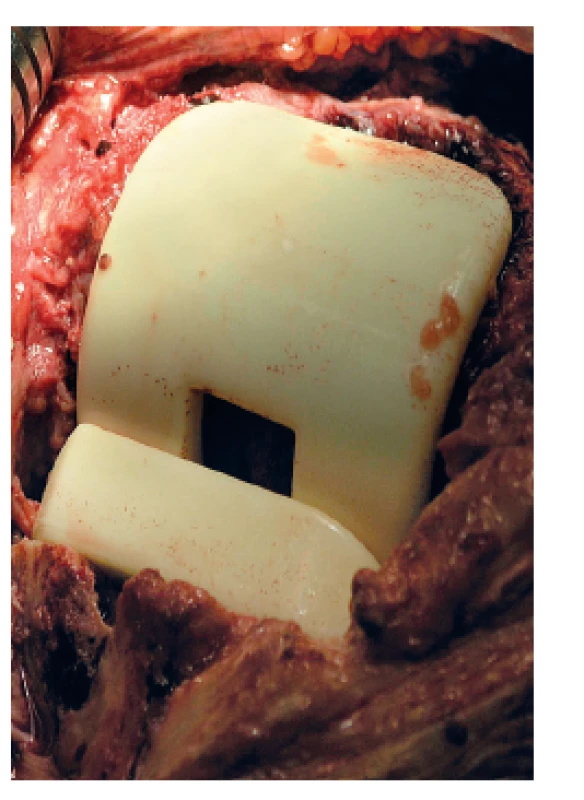
Operace
U všech pacientů byl tedy zvolen postup dvojdobé reimplantace s využitím spaceru jako výplně místa vzniklého po extrakci endoprotézy mezi první a druhou operační dobou. V první době byl extrahován infikovaný implantát a bylo provedeno rozsáhlé debridement infekčním zánětem postižené či nekrotické tkáně.
K mikrobiologickému vyšetření byly odeslány všechny komponenty endoprotézy a minimálně čtyři vzorky periprotetické tkáně (odběry z kloubního pseudopouzdra a obou kostních konců původního kloubu). Pokud byl přítomen výpotek, odesílal se rovněž k mikrobiologickému vyšetření.
Po vyčištění kostního lůžka a měkkých tkání byl proveden výplach koncentrovaným roztokem Betadine. Do takto připraveného terénu byl implantován výše popsaný „ready-made“ spacer, který se u kyčelních kloubů doplnil cementovým límcem k zajištění rotační stability (použitý cement – Palacos® R + G, Heraeus, Německo). Peroperačně byl zaveden jeden Redonův drén, který se ponechával v místě po dva pooperační dny.
Ihned po odebrání vzorků na mikrobiologické vyšetření byla zahájena intravenózní antibiotická terapie. Empiricky se volila kombinace oxacilin s gentamicinem, v případech, kdy už bylo etiologické agens známo, se podávala cílená antibiotická terapie. Celková doba parenterálního podávání antibiotik byla dva týdny, dále následovala perorální léčba čtyři až šest týdnů s cílem překlenout období normalizace laboratorních známek zánětu alespoň o tři týdny.
Rehabilitace operovaných pacientů a nácvik chůze se zahajoval v první pooperační den. Zátěž operované končetiny byla až do reimplantace limitovaná, maximálně do hmotnosti operované končetiny.
K reimplantaci nové TEP se přistoupilo ve chvíli, kdy měl pacient opakovaně negativní laboratorní markery zánětu (FW, CRP) a negativní klinický nález (chybění známek zánětu), nejdříve však za 3 měsíce od implantace spaceru. Interval mezi první a druhou dobou byl průměrně 14 týdnů (12–20 týdnů).
Ve druhé době (při reimplantaci TEP) byl na mikrobiologické vyšetření odeslán extrahovaný spacer uložený do sterilních rukavic a sterilního boxu. Pečlivě jsme dbali na to, aby při odběru anebo transportu nemohlo dojít ke kontaminaci vzorků.
Pacienti byli po operaci pravidelně sledováni v endoprotetické poradně po dobu 24 měsíců až 6 let (medián 40 měsíců).
Bakteriologické vyšetření vzorků odebraných v první a druhé době chirurgické revize
K bakteriologickému vyšetření byly z první revize odeslány extrahované komponenty endoprotézy a vzorky periprotetické tkáně, z druhé revize se k vyšetření zasílal extrahovaný spacer.
Materiál byl zpracován v laboratoři Ústavu klinické mikrobiologie FN a LF UK Hradec Králové (dále jen ÚKM) okamžitě po přijetí. Zpracování probíhalo v laminárním boxu. Tkáně z okolí infikovaného kloubu byly před naočkováním kultivačních médií homogenizovány, extrahované komponenty kloubních náhrad a spacery byly zpracovány sonikační metodou v ultrazvukové lázni po dobu 5 minut – podle metody publikované autory Pilnáček a Bébrová [17]. Sonikát (fyziologický roztok, do kterého se uvolnily případné mikroorganismy z biofilmu na povrchu umělého materiálu), tkáně a tekutiny byl očkovány na sadu kultivačních médií zvolených tak, aby byl umožněn průkaz pravděpodobných etiologických agens. Použita byla následující kultivační média: krevní agar, modifikovaný čokoládový agar, MacConkeyův agar, Schaedlerův agar pro záchyt anaerobních mikroorganismů, Sabouraudův agar pro záchyt kvasinek, játrový bujón a hemokultivační lahvičky BD BACTEC® Anaerobic.
Kultivační média byla inkubována při 37 °C v aerobním i anaerobním prostředí po dobu 10 dnů. Hemokultivační lahvičky byly vloženy do poloautomatického hemokultivačního přístroje BACTEC®. V případě pozitivního kultivačního nálezu byl izolát následně identifikován pomocí bakteriologických identifikačních metod (barvení podle Grama, produkce plazmakoagulázy, VITEK identifikační testy pro podrobnou identifikaci grampozitivních, gramnegativních a anaerobních bakterií) a byla stanovena jeho citlivost k antibiotikům – metodou kvalitativní (diskový difuzní test) a kvantitativní (mikrodiluční metoda pro stanovení minimálních inhibičních koncentrací nebo pomocí E-testu, proužku nasyceného antibiotikem v koncentračním gradientu). V případech, kdy běžnou kultivací nebyl původce infekce zjištěn, bylo vyšetření doplněno o průkaz bakteriální DNA metodou PCR (použity primery z oblasti 16SrRNA, která je společná všem bakteriím). V případě pozitivního nálezu bakteriální DNA může být druh bakterie určen sekvenční analýzou. 16SrRNA PCR je úmyslně nastavena na nižší citlivost než specifické průkazy DNA jednotlivých bakterií z důvodu záchytu možné bakteriální kontaminace.
Měření hladin gentamicinu
Pacienti, u kterých jsme měřili hladiny gentamycinu, byli vybráni do studie podle následujících kritérií: kompliance, souhlas s opakovanou punkcí kolenního kloubu a souhlas se zasláním vzorků punktátu do laboratoře na zpracování měřených parametrů. Celkem se podařilo do studie zařadit šest pacientů se zavedeným spacerem kolenního kloubu, u kterých byla měřena hladinu gentamicinu v kloubní tekutině.
První měření se prováděla z tekutiny odebrané z drénu 24 a 48 hodin po operaci. Další vzorky byly získány punkcí kolenního kloubu 5. a 12. pooperační den. Kvantitativní stanovení hladiny gentamicinu bylo provedeno metodou fluorescenční-polarizační imunoanalýzy na přístroji Integra 400 Plus analyzer (Roche Diagnostics GmbH) v laboratoři Ústavu klinické biochemie a diagnostiky FN a LF UK Hradec Králové (ÚKBD).
VÝSLEDKY
Výsledkem bakteriologického vyšetření bylo vykultivování možného etiologického agens v 22 případech z 24 (92 %), z toho ve třech případech byly vykultivovány dvě bakterie (tab. 2). Nejčastějším původcem kloubní infekce byly stafylokoky – 4krát byl prokázán Staphylococcus aureus, v 10 případech bylo vykultivováno celkem 13 koaguláza-negativních stafylokoků (třikrát v rámci duální infekce), jednalo se o druhy Staphylococcus epidermidis, S. hominis, S. lugdunensis. Mezi další vykultivované patogeny patřily korynebakteria a anaerobní bakterie – propionibakteria a peptostreptokoky. V jednom případě byla vykultivována i Salmonella Enteritidis.
Tab. 2. Soubor pacientů a výsledky kultivačního vyšetření Table 2. A cohort of patients with culture results 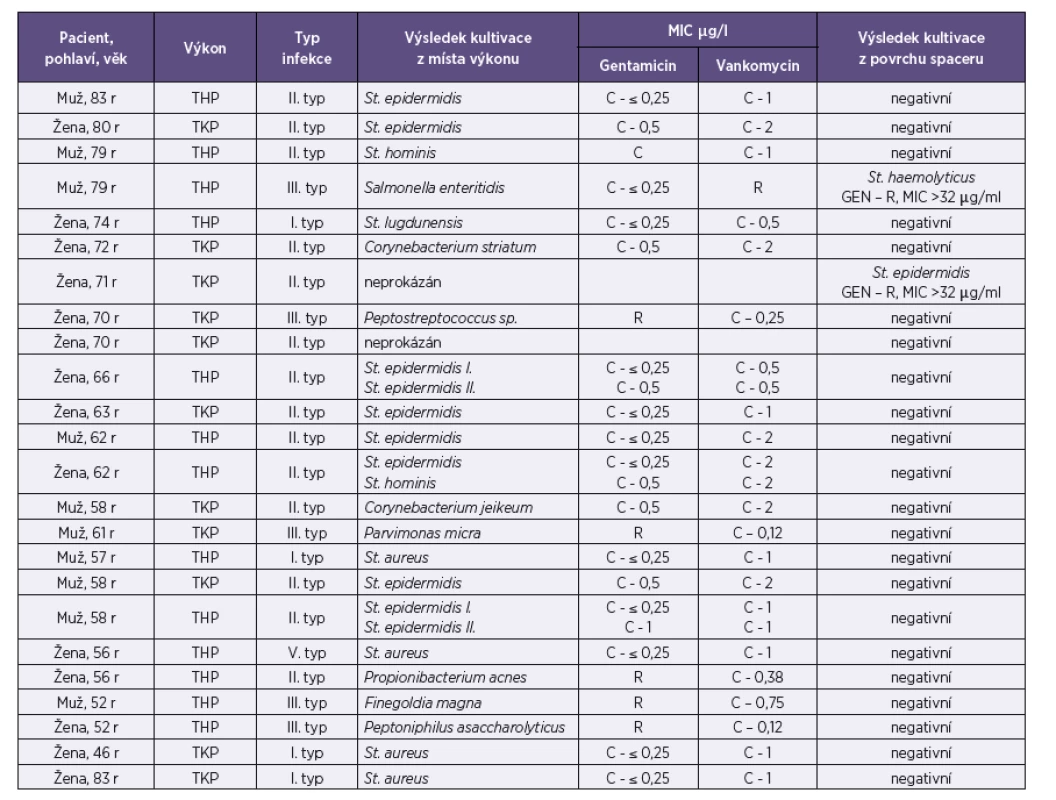
Vysvětlivky: MIC: minimální inhibiční koncentrace, THP – totální endoprotéza kyčle, TKP – totální endoprotéza kolene, r – roků, GEN – gentamicin, C – citlivý, R –rezistentní U dvou pacientů (8 %) se původce infekce určit nepodařilo. V prvním případě se jednalo o pacienta, který k nám byl přeložen z jiného pracoviště a už týden před překladem dostával parenterálně antibiotika, aniž by došlo k odběru materiálu ke kultivaci. Druhý pacient byl primárně operovaný na našem pracovišti. Výsledek kultivace byl negativní, přestože mu byla nasazena antibiotika až po odběrech vzorků na mikrobiologické vyšetření. V těchto případech, kdy běžnou kultivací nebyl zjištěn původce infekce, bylo spektrum vyšetření rozšířeno o průkaz bakteriální DNA metodu PCR. V obou případech bylo prokázáno pouze malé množství bakteriální DNA, které už se vzhledem k nízké kvantitě nepodařilo sekvenční analýzou dále specifikovat.
U všech vykultivovaných patogenů byly provedeny testy ke zjištění jejich citlivosti k antibiotikům. Devatenáct z pětadvaceti vykultivovaných možných etiologických agens (všechny kmeny stafylokoků, korynebakteria, Salmonella Enteritidis) bylo citlivých ke gentamicinu (76 %), zbylých šest původců tvořila skupina anaerobních bakterií, které se považují vůči gentamicinu za primárně rezistentní.
Při kultivačním vyšetřením spacerů extrahovaných v druhé době nebylo v žádném případě vykultivováno původní agens – ani ze skupiny bakterií citlivých ke gentamicinu, ani ze skupiny bakterií ke gentamicinu rezistentních. U dvou pacientů však byly ze spaceru vykultivovány koaguláza-negativní stafylokoky, v obou případech rezistentní ke gentamicinu.
Délka sledování pacientů našeho souboru se pohybovala v rozmezí 24 měsíců až 6 let (medián 40 měsíců). Během této doby nedošlo u žádného z pacientů k rozvoji nové periprotetické infekce, ani k recidivě té původní.
Výsledky měření gentamicinu uvolňovaného ze spaceru do kloubní tekutiny ukazují, že podle očekávání nejvyšší hladiny byly naměřeny za 24 hod. a v dalších dnech došlo k jejich postupnému snižování, po 12 dnech byly hladiny gentamicinu stále u všech 6 pacientů měřitelné (graf 1). Hladiny naměřené v úvodním měření dosahovaly průměrně hodnoty 395 µg/ml, což několikanásobně převyšuje MIC citlivých kmenů. Po 12 dnech od implantace spaceru byly hladiny průměrně 48 µg/ml, stále ještě vysoko nad MIC citlivých kmenů.
Graf 1. Výsledky měření hladin gentamicinu v kloubní tekutině Fig 1. Joint fluid gentamicin levels 
DISKUSE
Nejrozšířenější metodou léčby infekcí kloubních náhrad je dvoudobá reimplantace. Je ale také známo, že riziko rozvoje infektu je v už jednou revidovaném kloubu vyšší než u primoimplantace a s každou další revizí vzrůstá [18]. Toto riziko se v jednotlivých studiích liší, ale průměrně se pohybuje u první reimplantace kyčelního kloubu okolo 7,4 % a u první reimplantace kolenního kloubu okolo 11 % [13]. Bylo prezentováno, že toto riziko rozvoje infekce kloubní náhrady je sníženo, pokud se systémové podání antibiotik kombinuje s lokálním podáním. Spacery jsou výhodné z důvodu vyplnění dutiny po extrakci infikovaných komponent kloubní protézy a zároveň slouží jako nosiče antibiotik. Problémem by mohlo být antibiotikum použité při výrobě spaceru s ohledem na spektrum pokrytých patogenů.
V našem souboru pacientů se nám podařilo prokázat možné etiologické agens u 22 z 24 pacientů, což je v souladu s recentní literaturou, kde se uvádí 10–30 % neobjasněných případů v závislosti na použitých metodách [19]. PCR vyšetření si své místo v diagnostice IKN zatím spíše hledá, většinou se nepoužívá rutinně. Tato metoda je spojena sice s vysokou senzitivitou, ale také s falešnou pozitivitou vzorků a problémy s interpretací [20]. Slibné se zdá její uplatnění v diagnostice kostních infektů, kde už došlo k zahájení antibiotické terapie. Na našem pracovišti se používá cíleně jen k vyšetření kultivačně negativních vzorků. U uvedených dvou případů kultivačně neprokázaných infekcí bohužel nedokázala etiologické agens také objasnit, pravděpodobně pro nízkou kvantitu DNA.
Mezi etiologickými agens se v našem souboru vyskytovaly především grampozitivní bakterie, nejčastěji z nich pak stafylokoky, korynebakteria, propionibakteria. Pouze u jednoho pacienta jsme izolovali bakterii Salmonella Enteritidis jako zástupce gramnegativních mikroorganismů. Nález konkrétních agens většinou odpovídal typu infekce tak, jak je to popisováno v literatuře – Staphylococcus aureus byl jako patogen prokázán většinou u časných nebo hematogenních infekcí, naopak koaguláza-negativní stafylokoky, korynebakteria a propionibakteria jako méně virulentní bakterie, součást běžné kožní mikroflóry, pak byly izolovány u případů pozdní chronické infekce [21]. Zachytili jsme také agens infikující kloubní protézu hematogenní cestou – z primárního infekčního ložiska. Ve třech případech (12,5 %) byla prokázána polymikrobiální infekce, podobné procento jako v práci Galla [22], kde ji prokázali v 14,3 %.
U izolovaných agens jsme analyzovali jejich citlivost ke gentamicinu. Aminoglykosidy jsou baktericidní antibiotika inhibující bakteriální proteosyntézu ireverzibilní vazbou na 30S ribosomální podjednotku. Cílové místo aminoglykosidů je tedy umístěno intracelulárně a je nutný průnik antibiotika do buňky, tento proces je aerobní. Aminoglykosidy v anaerobním prostředí nemohou dosáhnout svého cílového místa, a proto jsou neúčinné vůči anaerobním bakteriím [23]. V našem souboru 25 izolovaných etiologických bylo 6 anaerobních bakterií – peptostreptokoky a propionibakteria, které se považují za primárně rezistentní vůči gentamicinu. Všechny tyto anaerobní izoláty však byly citlivé k vankomycinu, tudíž použití spaceru obsahujícího vankomycin a gentamicin současně by přineslo výhodu antimikrobiálního působení vůči všem vykultivovaným agens.
Uvolňování antibiotik z povrchu cementového spaceru in vivo by se mělo podobat uvolňování in vitro. Avšak reálná situace je vždy výrazně komplexnější a v in vitro modelech jsme se jí zatím pouze přiblížili. Vliv mají nejen odlišné reologické podmínky, ale také biologicky a biochemicky aktivní molekuly. Podle výrobce se ze spaceru Synicem® během prvních 24–48 hodin uvolňují vysoké koncentrace gentamicinu, které se v následujících dnech a týdnech výrazně snižují. To odpovídá naší koncentrační křivce (graf 1), kterou jsme vytvořili na základě stanovení koncentrace gentamicinu v odpadu z kloubu, respektive z kloubního aspirátu stejně jako ve většině recentních prací hodnotících uvolňování antibiotik z kostního cementu [8, 14]. Pozoruhodné je, že Mutimer et al. [8] zjistili v kloubní tekutině odebírané při reimplantaci TEP kolena, kdy medián času mezi první a druhou operací byl 99 dnů, hladiny gentamicinu okolo 0,46 mg/l, což jsou stále ještě inhibiční koncentrace u citlivých bakterií.
K reimplantaci definitivní protézy se u dvoustupňové revize přistupuje po určitém mezidobí, které slouží k terapii infektu antibiotiky a obnově tkáňové integrity po proběhlé infekci. K ověření úzdravy a bezinfekčnosti kloubního prostoru máme k dispozici tradiční metody k identifikaci zánětu (klinické vyšetření, laboratorní vyšetření), avšak jejich spolehlivost je podle některých prací před reimplantací nižší [24]. V této souvislosti se jeví vícečetné tkáňové odběry a vzorky z povrchu spaceru jako velmi praktické, i když výsledky jsou známy až po operaci. Jsou týmy, které přínos rutinních kultivací při reimplantaci finální protézy zpochybňují poukazem na jejich nízkou užitečnost. Například Bejon et al. [18] uvádí 14 % pozitivních kultivací z rutinních odběrů prováděných při reimplantací TEP. Tyto nálezy však – stejně jako v práci Ouředníka [15], který uvádí kultivační nález u 20 z 50 extrahovaných spacerů, rozhodně nepodmiňovaly selhání terapeutického postupu. Kultivační vyšetření spacerů extrahovaných v druhé době – před implantací nové trvalé kloubní protézy – bylo v našem souboru pacientů pozitivní pouze ve dvou případech (8 %), přičemž kultivační vyšetření okolních tkání bylo negativní. Rozdíl v pozitivitě kultivačního vyšetření spaceru v naší práci a práci Ouředníka, při použití stejné sonikační metody, je poměrně vysoký (32 %). Tento rozdíl by se mohl vysvětlit tím, že v práci Ouředníka byly použity hand-made spacery vyrobené přímo na operačním sále, zatímco my jsme použili továrně vyráběné ready-made spacery, které umožňují zkrácení operačního času o dobu nutnou ke zhotovení spaceru na sále a tím i zkracují dobu možného zanesení bakterií do operačního pole.
U obou pacientů, u kterých byl kultivační záchyt ze spacerů, se nejednalo o původní agens. Vykultivovány byly koaguláza-negativní stafylokoky, v obou případech rezistentní ke gentamicinu. Hodnocení těchto nálezů je poměrně obtížné – mohlo se jednat o kontaminaci vzorků vzniklou při odběru materiálu nebo při jeho zpracování v laboratoři. Zároveň se však mohlo jednat o záchyt mikrobů, které kolonizovaly povrch spaceru už při implantaci v první době a jejich rezistence ke gentamicinu jim dovolila přežít až do extrakce spaceru. Je však zřejmé, že tyto mikroby nevyvolaly infekci okolních tkání, protože to by se pravděpodobně projevilo kultivačním záchytem stejného agens i z tkáně v okolí spaceru, eventuálně nakonec i recidivou kloubních obtíží, tyto však u pacientů pravidelně sledovaných v poradně pro kostní infekty nebyly ani u jednoho pacienta po dobu minimálně 2 let zaznamenány.
ZÁVĚR
Na celkovém úspěchu dvojdobé reimplantace se podílí komplexní přístup, tedy odstranění všech infikovaných a nekrotických hmot v kombinaci s implantací cementového spaceru a dlouhodobé podáváním adekvátních antibiotik. Úspěšnost reimplantaci TEP kyčle a kolena ve dvojdobém rytmu s užitím ready-made spacerů s gentamicinem byla v našem souboru 100%, protože po dobu minimálně dvou let nedošlo v našem souboru pacientů k zaznamenání dalšího periprotetického infektu.
Zhodnocením nálezů bakteriologického vyšetření jsme zjistili, že ready-made spacer s gentamicinem pokrývá pouze 76 % spektra námi prokázaných etiologických agens periprotetických infekcí v souboru našich pacientů. Řešením by bylo použití spaceru nasyceného kombinací vankomycinu a gentamicinu, které by zajistilo antimikrobiální působení vůči všem vykultivovaným agens.
Poděkování: Práce vznikla za podpory programu PRVOUK P 37/04, MZ ČR - RVO (FNHK, 00179906) a za Institucionální podpory MZ ČR č.1RVO-FNOL2013.
Do redakce došlo dne 21. 2. 2014.
Adresa pro korespondenci:
MUDr. Tomáš Proček
Ortopedická klinika FN a LF UK Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: tomas.procek@fnhk.cz
Zdroje
1. Jahoda D, Landor I, Pokorný D, Judl T, et al. Současné trendy v léčbě infikované aloplastiky. Ortopedie, 2011;5 : 179–185.
2. Pignatti G, Nitta S, Rani N, Dallari D, et al. Two stage hip revision in periprosthetic infection: Results of 41 cases. The Open Orthopaedics Journal, 2010;4 : 193–200.
3. Tsukuyama DT, Estrada R, Gustilo R. Infection after total hip arthroplasty. A study of the treatment of one hundred and six infections. J Bone Joint Sur., 1996;78-4 : 512–523.
4. Winkler H, Stoiber A, Kaudela K, Winter F. One stage uncemented revision of infected total hip replacement using cancellous allograft bone impregnated with antibiotics. J Bone Jt Surg, 2008;90(12):1580–1584.
5. Garvin K, Hanssen A. Infection after total hip arthroplasty: Past, present and future. J Bone Joint Surg, 1995;77(10):1576–1588.
6. Anagnostakos K, Furst O, Kelm J. Antibiotic-impregnated PMMA hip spacers: Current status. Acta Orthop, 2006;77(4):628–637.
7. Buchholz HW, Engelbrecht H. Depot effects of various antibiotics mixed with Palacos resins. Chirurg, 1970;41 : 511–515.
8. Mutimer J, Gillespie G, Lovering AM, Porteous AJ. Measurements of in vivo intra-articular gentamicin levels from antibiotic loaded articulating spacers in revision total knee replacement. The Knee, 2009;16 : 39–41.
9. Baleani M, Traina F, Toni A. The Mechanical behaviour of pre-formed hip spacer. Hip International, 2003;13(3):159–162.
10. D’Angelo F, Negri L, Binda T, Zatti G et al. The use of a preformed spacer in two-stage revision of infected hip arthroplasties. Musculoskelet Surg, 2011;10(5):12306-011.
11. D’Angelo F, Negri L, Zatti G, Grassi F. Two-stage revision surgery to treat an infected hip implant. A comparison between a custom-made spacer and a pre-formed one. Chir Organi Mov, 2005;90(3):271–279.
12. Leunig M, Chosa E, Speck M, Ganz R. A cement spacer for two-stage revision of infected implants of the hip joint. Int Orthop, 1998;22(4):209–214.
13. Gallo J, Smižanský M, Radová L, Potomková J. Porovnání léčebných postupů používaných v terapii infekce kloubních náhrad kyčle a kolena. Acta Chir Orthop Traum Čech, 2009;76 : 302–309.
14. Gallo J, Bogdanová K, Šiller M, Švábová M et al. Mikrobiologické a farmakologické vlastnosti kostního cementu VancogenX. Acta Chir Orthop Traum Čech, 2013;80 : 69–79.
15. Ouředník J, Pilnáček J, Eliášová G. Bakteriální nálezy ze sonikovaných spacerů impregnovaných gentamycinem. Ortopedie, 2010;4 : 232–235.
16. Coventry M. Treatment of infections occuring in total hip surgery. Orthop Clin North Am, 1975;6(4):991–1003.
17. Pilnáček J, Bébrová E. Problémy v přístupu k infikované TEP a mikrobiologická diagnostika infikované TEP – sonikace. Ortopedie, 2011;4 : 162-168.
18. Bejon P, Berendt A, Atkins L, Green N et al. Two-stage revision for prosthetic joint infection: Predictors of outcome and the role of reimplantation microbiology. J Antimicrob Chemother, 2010;65 : 569–575.
19. Corvec S, Portillo ME, Pasticci BM, Borenz O, et al. Epidemiology and new developments in the diagnosis of prosthetic joint infection. Int J Artif Organs, 2012;35 : 932–934.
20. Gallo J, Raska M, Dendis M. Molecular diagnosis of prosthetic joint infection. A review of evidence. Biomed Papers, 2004;148(2):123–129.
21. Schäfer P, Fink B, Sandow D, Marqull A, et al. Prolonged bacterial culture to identify late periprosthetic joint infection: a promising strategy. Clin Infect Dis, 2008;47 : 1403–1409.
22. Gallo J, Kolár M, Koukalová D, Sauer P, et al. Bakteriální původci periprotetických infekcí a možnosti jejich diagnostiky. Klin Mikrobiol Infekc Lek, 2006;12 : 117–123.
23. Finch RG, Geenwood D, Norrby SR, Whitley RJ. Antibiotic and Chemotherapy. Ninth edition, Elsevier, 2010, 900 s, ISBN 978-0-7020-4064-1.
24. Kusuma SK, Ward J, Jacofsky M, Sporer SM, et al. What is the role of serological testing between stages of two-stage reconstruction of the infected prosthetic knee? Clin Orthop Relat Res, 2011;469(4):1002–1008.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2014 Číslo 3- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Věnování doc. MUDr. Heleně Hupkové, Ph.D. in memoriam
- Klinická a mikrobiologická charakteristika závažných infekcií spôsobených streptokokmi skupiny A
- Vplyv prípravkov určených na dezinfekciu kože, slizníc a rán na životaschopnosť biofilmovej formy rastu mikroorganizmov izolovaných od pacientov s katétrovými infekciami
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Rezistence k erytromycinu, ciprofloxacinu a k tetracyklinu u humánních izolátů Campylobacter spp. v České republice, vyšetřená standardní metodou EUCAST
- Výskyt a vlastnosti baktérií Staphylococcus aureus ve vepřovém mase
- Identifikace izolátů Mycobacterium spp. pomocí MALDI-TOF hmotnostní spektrometrie
- Profesionálna TBC na Slovensku a v Českej republike
- Infekce vyvoláné lidskými alfa herpetickými viry
- Protikladný vývoj trendů incidence kapavky a syfilis ve východočeském regionu – 30 let surveillance
- Avidita antifosfolipidových protilátek – naše současné znalosti
- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Výskyt a charakteristika termotolerantních kampylobakterů v potravinovém řetězci člověka
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
- Význam očkování proti chřipce u osob s kardiovaskulárním onemocněním
- Zhodnocení významu ready-made spaceru s gentamicinem ve vztahu k bakteriologickým nálezům u pacientů s infekcí kloubní náhrady
- Q-horečka jako profesionální onemocnění vedoucí k invaliditě – kazuistika
- Návrat spalniček do Ústeckého kraje
- Vzpomínka na nedožité 90. narozeniny MUDr. Miroslava Přívory, CSc.
- Vzpomínka na nedožité 90. narozeniny prof. MUDr. Bohumila Ticháčka, DrSc.
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Infekce vyvoláné lidskými alfa herpetickými viry
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



