-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Výskyt Candida dubliniensis v klinickém materiálu a možnosti její identifikace
Candida dubliniensis in clinical specimens and possibilities for identification
Study objective:
The species Candida dubliniensis shares a wide range of phenotypic characteristics with Candida albicans, the most common yeast species isolated from clinical specimens. This is a considerable complication for the detection and identification of Candida dubliniensis from clinical specimens. The lack of data on the incidence of C. dubliniensis in the Czech Republic was the motivation behind the efforts to detect this pathogen in specimens analyzed at the Institute for Microbiology, Faculty of Medicine Masaryk University and St. Anne's Faculty Hospital in Brno. Another aim was to test the reliability of the culture methods used.Material and methods:
Altogether 2260 yeast isolates initially identified as C. albicans were analysed. To differentiate C. dubliniensis from C. albicans, four phenotypic methods were used: colour-based differentiation on CHROMagar Candida medium, culture on medium with 6.5% of NaCl, growth at 42 °C, and colony characteristics on Staib agar. To verify the results, the Bichro-Dubli Fumouze latex agglutination test and species-specific polymerase chain reactions (PCR) were used.Results:
Using phenotypic methods, latex agglutination, and PCR, 50 (2.2%) strains from the study set were assigned to C. dubliniensis. Most (31) C. dubliniensis isolates were recovered from the respiratory tract and the remaining others were three urine isolates, four stool isolates, one central venous catheter isolate, and one blood isolate. With the exception of colour-based differentiation on CHROMagar Candida medium showing a specificity of 85.5%, all the culture methods used have a high sensitivity and a high specificity.Conclusion:
Identification of C. dubliniensis as C. albicans was confirmed in various clinical specimens, most often from the upper respiratory tract. The colour-based differentiation of C. dubliniensis from C. albicans on chromogenic CHROMagar Candida medium can only be recommended as a screening test for the differentiation of C. dubliniensis from other species of the genus Candida. The remaining three methods are highly reliable. The final identification should be based on a combination of these methods, with the species-specific PCR or latex agglutination test used for verification.Keywords:
Candida dubliniensis – phenotypic methods – identification – clinical specimens
Autoři: M. Mahelová; F. Růžička
Působiště autorů: Mikrobiologický Ústav, Lékařská fakulta, Masarykova univerzita a FN u sv. Anny v Brně
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 2, s. 125-129
Kategorie: Souhrnná sdělení, původní práce, kazuistiky
Souhrn
Cíl práce:
Druh Candida dubliniensis sdílí celou řadu fenotypových charakteristik s nejčastěji izolovanou kvasinkou z klinického materiálu, kterou je Candida albicans. To značně komplikuje jeho správnou identifikaci a záchyt v klinickém materiálu. Nedostatek informací o výskytu C. dubliniensis v České republice byl motivací ke zjištění jejího zastoupení ve vzorcích vyšetřených v Mikrobiologickém ústavu LF MU a FN u sv. Anny v Brně. Součástí práce je také posouzení spolehlivosti použitých kultivačních metod.Materiál a metodika:
Celkem bylo vyšetřeno 2260 izolátů kvasinek určených původně jako C. albicans. Pro odlišení C. dubliniensis a C. albicans byly použity čtyři kultivační metody – hodnocení barvy kolonií na médiu CHROMagar Candida, kultivace na médiu s 6,5 % NaCl, růst při 42 °C a charakter kolonií na Staibově agaru. K verifikaci výsledků byla použita jednak latexová aglutinace pomocí soupravy Bichro-Dubli Fumouze, jednak druhově specifická polymerázová řetězová reakce (PCR).Výsledky:
Z testovaného souboru bylo pomocí fenotypových metod, latexové aglutinace a PCR identifikováno 50 kmenů C. dubliniensis. To odpovídá 2,2 % z celkového počtu izolátů. Většina izolátů C. dubliniensis pocházela z dýchacích cest (31), zbytek byl získán z moči (3), stolice (4), z cévky (1) a jeden kmen byl zachycen z krve. S výjimkou hodnocení barvy kolonií na CHROMagaru Candida, u kterého byla specificita pouhých 85,5 %, vykazovaly všechny ostatní kultivační metody vysoké procento citlivosti a specificity.Závěr:
Byl potvrzen výskyt C. dubliniensis mezi izoláty C. albicans v různých klinických materiálech, nejčastěji pocházely tyto kmeny z horních cest dýchacích. Rozlišení C. dubliniensis od C. albicans na základě barvy kolonií na chromogenním médiu CHROMagar Candida lze doporučit pouze jako screeningový test pro odlišení od ostatních druhů rodu Candida. Zbylé metody poskytují vysoké procento spolehlivosti. Konečná identifikace by měla raději vždy spočívat na použití kombinací těchto metod, případně lze výsledek verifikovat pomocí druhově specifické PCR nebo latexové aglutinace.Klíčová slova:
Candida dubliniensis – fenotypové metody – identifikace – klinický materiálÚVOD
Infekce způsobené kvasinkami rodu Candida představují závažný medicínský problém. Ačkoliv nejčastěji izolovaným druhem z klinického materiálu zůstává stále Candida albicans, v posledních letech nabývají více na významu také tzv. druhy non-albicans. Jedním z nich je také Candida dubliniensis. Tato kvasinka, která je fenotypově i genotypově velmi podobná druhu Candida albicans, byla poprvé popsána jako samostatný druh až v roce 1995 Sullivanem et al. na University of Dublin. Šlo o soubor izolátů z orofaryngeální oblasti převážně HIV pozitivních osob [1]. Sekvenováním genomu C. dubliniensis a jeho porovnání s genomem C. albicans byla zjištěna značná genetická podobnost obou druhů. Konkrétně 96,3 % genů těchto dvou druhů je z více než 80 % totožných a 98 % genů má blízký fylogenetický vztah [2].
Mnohé práce dokazují, že se jedná o celosvětově rozšířený druh s různou prevalencí v klinickém materiálu v závislosti na epidemiologickém profilu vyšetřených pacientů. Nejčastěji je C. dubliniensis prokazována v dýchacích cestách u HIV pozitivních, méně často i u HIV negativních či u relativně zdravých osob [3].
Vedle záchytu z dýchacích cest byla C. dubliniensis izolována také z dalších klinických materiálů a podobně jako u C. albicans byl prokázán její podíl na vzniku povrchových i orgánových či systémových mykóz [4].
Zajímavá je izolace C. dubliniensis z vnějšího prostředí. Konkrétně izolace tohoto druhu z povrchu klíšťat Ixodes uriae získaných z útesů pokrytých výkaly mořských ptáků (Alkoun úzkozobý – Uria Arge) [5].
Pro zjištění přesného klinického významu a výskytu kvasinky C. dubliniensis v klinickém materiálu je zapotřebí její správná a rychlá identifikace. Ta je komplikována podobností většiny fenotypových vlastností C. dubliniensis s C. albicans, a proto bývá C. dubliniensis v rutinních mikrobiologických laboratořích často chybně identifikována [6]. Oba druhy jsou totiž jako jediné z rodu Candida schopny vytvářet chlamydospóry a zárodečné klíčky, čehož bylo dříve využíváno právě pro identifikaci druhu C. albicans. Také na běžných médiích používaných ke kultivaci kvasinek, a to včetně chromogenních médií, je obtížné tyto dva druhy odlišit [1].
Řádná identifikace umožňuje správné zhodnocení klinického významu C. dubliniensis a je důležitá pro nasazení adekvátní léčby. U C. dubliniensis totiž dochází k častějšímu a snazšímu rozvoji rezistence k azolovým antimykotikům, především k flukonazolu. Rezistenci k flukonazolu poprvé popsanou v roce 1997 [7] později potvrdily i další práce [8, 9]. U původně citlivých klinických izolátů byla prokázána schopnost rychlého rozvoje rezistence po působení flukonazolem in vitro. Také po léčbě pacientů flukonazolem byl zaznamenán nárůst rezistentních kmenů [7].
Během posledních let proto byla vyvinuta celá řada kultivačních metod, které umožňují více či méně spolehlivé rozlišení těchto kvasinek. Patří mezi ně například kultivace při 42 °C, případně 45 °C [10], uspořádání a produkce chlamydospór [11], rozdílný charakter kolonií po kultivaci na médiích s různými rostlinnými extrakty – Staibův agar [11], agar se slunečnicovými [12] nebo hořčičnými semeny [13] či s přídavkem tabáku [14]. Růst C. dubliniensis na médiích inhibuje vyšší koncentrace solí [15] nebo také neschopnost kmenů asimilovat xylózu [16]. Vzhledem k výskytu falešně pozitivních i falešně negativních výsledků u výše uvedených metod se ke konfirmaci identifikace využívají spolehlivější molekulárně biologické metody či průkaz specifického povrchového antigenu, např. latexovou aglutinací [17].
Mezi molekulárně biologické metody, které mohou být použity k odlišení C. albicans a C. dubliniensis patří RFLP (polymorfismus délky restrikčních fragmentů), RAPD (náhodná amplifikace polymorfní DNA) či PFGE (pulzní gelová elektroforéza) [3]. Většina těchto metod je časově náročná, a tudíž nevhodná pro rutinní analýzu většího počtu kmenů. Nejvhodnější metodou z hlediska času i finanční náročnosti se zdá být polymerázová řetězová reakce (PCR). Bylo popsáno několik genů, které se u těchto dvou druhů liší a které lze amplifikovat pomocí PCR. Jedním z nich je například phr1 u C. albicans a jeho homolog Cdphr1 u C. dubliniensis [18], hwp1 u C. albicans a jeho homolog u C. dubliniensis [19] či rozdíly v intronu genu act1 [20].
Mezi další možnosti identifikace s dobrou odlišovací schopností, které byly popsány v posledních letech, patří hmotnostní spektrometrie MALDI-TOF MS (Matrix assisted laser desorption-ionization - time of flight mass spectrometry) [21], případně také izolelektrická fokusace využívající rozdílů v izoelektrických bodech mezi těmito druhy [22]. Jedná se však o techniky, které jsou časově či technicky náročné a nejsou dostupné všem laboratořím.
Cílem této práce je hodnocení lokálního výskytu C. dubliniensis a popis jejího zastoupení v různých typech klinického materiálu. Dále byla v rámci této práce hodnocena spolehlivost čtyř kultivačních metod a navrženo vhodné diagnostické schéma pro rutinní použití v klinicko-mikrobiologické laboratoři.
MATERIÁL A METODY
Do testovaného souboru bylo zařazeno 2260 izolátů, které byly rutinně určeny jako C. albicans na základě tvorby zelených kolonií na CHROMagaru Candida (CHROMagar, Francie). Tyto kmeny byly v letech 2010 a 2011 izolovány z různých klinických materiálů v Mikrobiologickém ústavu LF MU a FN u sv. Anny v Brně. Dále byly použity C. dubliniensis CBS 7987 (Centraalbureau voor Schimmelcultures) a CCY 29-177-1 (Culture Collection of Yeasts), a C. albicans CCM 8261 a CCM 8320 (Czech Collection of Microorganisms, Česká sbírka mikroorganismů) jako kontrolní kmeny.
Pro zjištění přítomnosti C. dubliniensis byly všechny izoláty testovány pomocí čtyř fenotypových kultivačních metod:
- a) Inhibice růstu při 42 °C [10] byla ověřena 48hodinovou kultivací kmenů na Sabouradově agaru (Merck KGaA, Německo) při této teplotě. Kmeny, které nevykazovaly růst za daných podmínek, byly předběžně určeny jako C. dubliniensis. Ty, které rostly, byly určeny jako C. albicans.
- b) Byl hodnocen charakter růstu na Staibově agaru obsahující extrakt z rozdrcených semen rostliny Guizotia abyssinica [11]. Po 48hodinové inkubaci při 37 °C rostou na tomto médiu kmeny C. albicans ve formě hladkých kolonií, zatímco kmeny C. dubliniensis tvoří výrazné pseudomycelium a jejich kolonie jsou tedy drsné s paprsčitými okraji (obr. 1).
- c) K testování inhibice růstu zvýšenou koncentrací solí byl použit Sabouraudův agar (Merck KGaA, Německo) s přídavkem 6,5 % NaCl [23]. Deset mikrolitrů suspenze testovaného izolátu ve fyziologickém roztoku (0,2 McF) bylo napipetováno na dané médium. Inhibice růstu byla hodnocena po sedmidenní inkubaci při 37 °C.
- d) Barva kolonií byla hodnocena po 48hodinové kultivaci kmenů při 37 °C na médiu CHROMagar Candida (CHROMagar, Francie). Izoláty s tmavě zelenou barvou kolonií byly považovány za C. dubliniensis, izoláty se světle zelenou barvou byly předběžně určeny jako C. albicans [24].
Obr. 1. Vzhled kolonií C. dubliniensis na Staibově agaru Fig 1. The apperarance of C. dubliniensis colonies on Staib medium 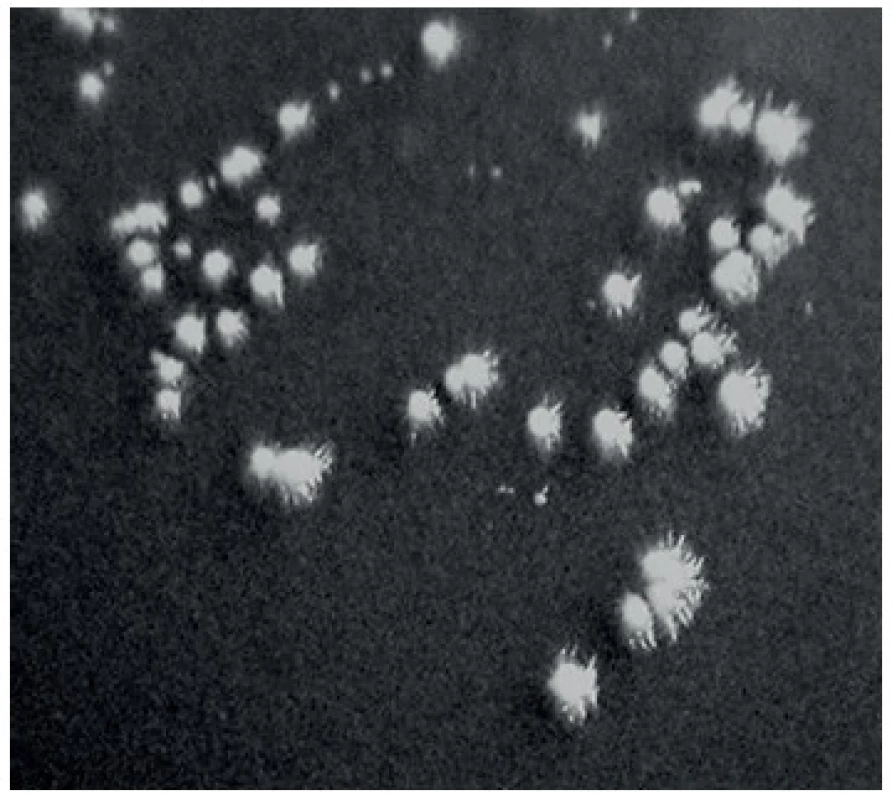
Dále byl k identifikaci použit také test latexové aglutinace pomocí komerční soupravy Bichro-Dubli Fumouze (Fumouze Diagnostics, France). Izoláty C. dubliniensis vytváří po rozmíchání v reakční směsi viditelné fialové shluky [17].
Pro konfirmaci výsledků byla použita druhově specifická polymerázová řetězová reakce [20]. Z 48hodinové kultury testované kvasinky na Sabouraudově agaru byly 1–2 kolonie resuspendovány v 75 µl sterilní vody a zahřáty na 95 °C (10 min.). Po centrifugování (14 000 g/7 min.) bylo odebráno 50 µl supernatantu obsahující DNA. Pro PCR byly použity dva páry primerů – univerzální a druhově specifické [20]. Reakční směs o celkovém objemu 25 µl obsahovala 12,5 µl master mix (PPP Master Mix, Top-Bio, s.r.o.), 100 mM každého primeru, a 1 µl templátové DNA. Podmínky reakce byly následující: úvodní denaturace (95 °C/5 min.), 30 cyklů denaturace (95 °C/1 min.), připojení primerů (59 °C/30 s) a prodlužování řetězce (72 °C/30 s), konečná prodlužovací fáze při 72 °C po dobu 10 min. (Termocycler PTC-200, MJ Research, USA). Produkty reakce byly detekovány agarózovou gelovou elektroforézou a vizualizovány UV transluminátorem (UVT-20 M, Herolab GmbH Laborgeräte, Německo). U C. albicans byla výsledkem PCR přítomnost jednoho pruhu (614 bp), zatímco izoláty C. dubliniensis tvořily dva produkty (614 bp a 288 bp) (obr. 2).
Obr. 2. Výsledek gelové elektroforézy produktů PCR Fig 2. The result of gel electrophoresis of PCR products 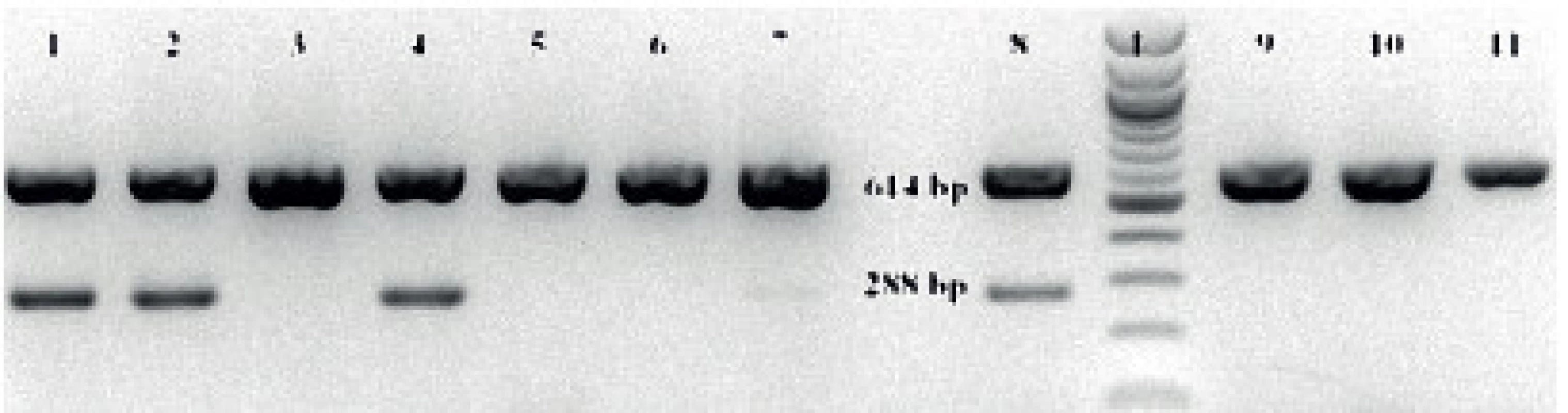
Legenda: 1, 2, 4, 7, 8 C. dubliniensis 3, 5, 6, 9, 10, 11 C. albicans L – hmotnostní marker (100–000 bp) Legend: 1, 2, 4, 7, 8 C. dubliniensis 3, 5, 6, 9, 10, 11 C. albicans L – mass marker VÝSLEDKY
Z testovaných 2260 izolátů určených primárně jako C. albicans bylo 50 (2,2 %) reidentifikováno jako druh C. dubliniensis. Čtyři z těchto kmenů rostly ve směsi s C. albicans.
Nejvíce izolátů pocházelo z dutiny ústní a z horních cest dýchacích, ze kterých byla více než polovina z celkového počtu (31). Z dolních cest dýchacích bylo zachyceno 10 izolátů. Ostatní kmeny pocházely ze stolice (4), moče (3), z povrchu centrálního žilního katétru (1) a z hemokultury (1).
Izoláty C. dubliniensis pocházely od 42 pacientů. Od 6 pacientů byly získány dva (4 pacienti) nebo tři izoláty (2 pacienti), které pocházely z různých klinických materiálů nebo byly izolovány v různém časovém horizontu. U dvou pacientů se jednalo o izoláty z totožných klinických materiálů, ale s odstupem minimálně tří měsíců. Jeden z pacientů měl kolonizované horní i dolní dýchací cesty a moč, další moč a hemokulturu a u jiného byl získán izolát z dýchacích cest a centrálního žilního katétru.
Výsledky spolehlivosti použitých metod zachycuje tabulka 1. Ta ukazuje, že nejvyšší stupeň spolehlivosti poskytuje hodnocení vzhledu kolonií C. dubliniensis na Staibově agaru s 96% citlivostí a 99% specificitou. Hodnocení inhibice růstu při 42 °C a růst na médiu s 6,5 % NaCl dávají velmi podobné výsledky. U těchto tří metod byly zachyceny falešně negativní výsledky (2 pro Staibův agar, 4 pro médium s NaCl i inhibici růstu při 42 °C), a falešně pozitivní výsledky u inhibice růstu při 42 °C (n = 40) a tvorby drsných kolonií na Staibově agaru (n = 18). U CHROMagaru Candida můžeme pozorovat 96% citlivost, ale nižší hodnotu specificity (85,5 %), což je důsledek vysokého počtu falešně pozitivních výsledků (n = 320).
Tab. 1. Srovnání použitých metod Table 1. Comparison of used methods 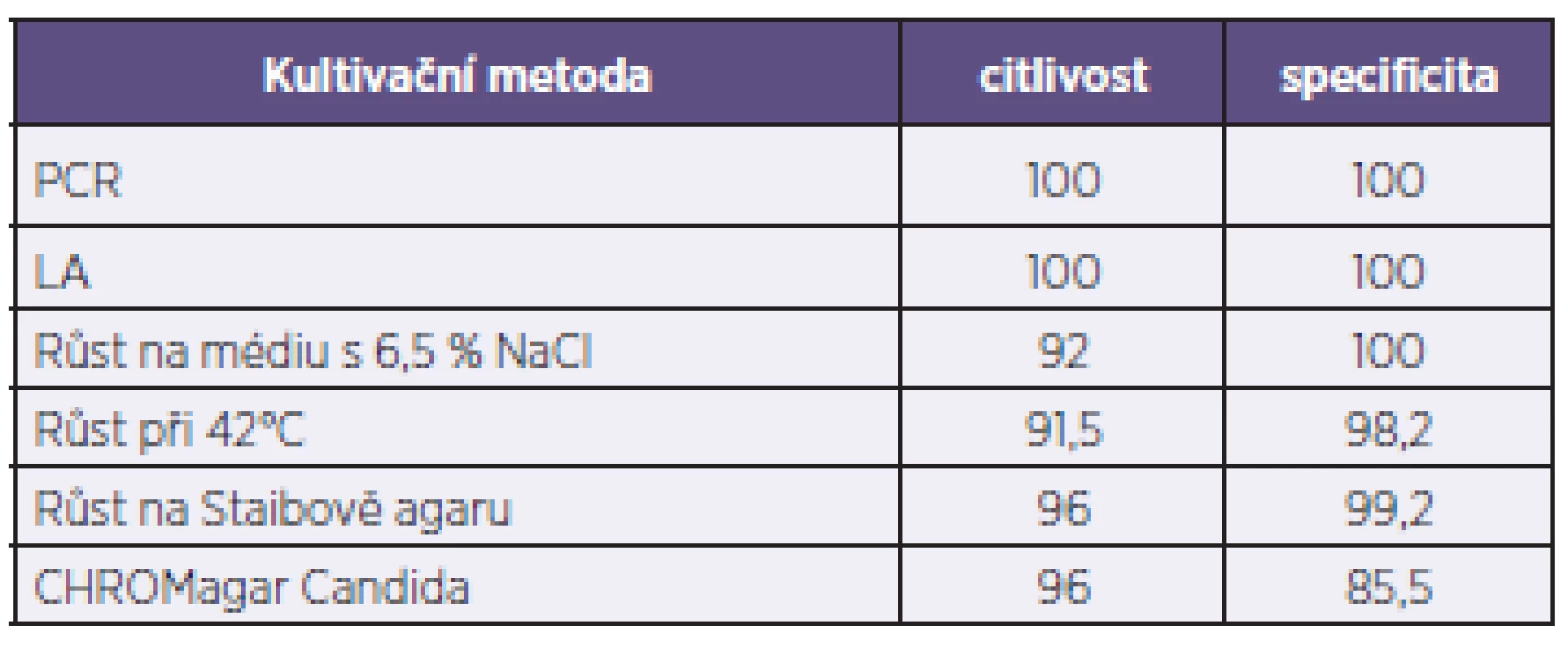
DISKUSE
V celé řadě epidemiologických studií byla prokázána prevalence u HIV pozitivních v širokém rozmezí 1,2–48 %. U HIV negativních osob je výskyt C. dubliniensis obvykle nižší, 1,6–9 % [8, 25, 26]. Na druhou stranu Bilgnaut et al. [27] překvapivě zjistili u zdravé bělošské populace v Jihoafrické republice vyšší záchyt této kvasinky než u HIV pozitivních osob, naopak u černošské populace byl vyšší záchyt u HIV pozitivních. Relativně vysoká prevalence je zaznamenávána také u osob s cystickou fibrózou [28], diabetes mellitus [29] či s onkologickými diagnózami [30, 31].
U testovaných izolátů převládal výskyt kmenů C. dubliniensis v dutině ústní a horních cestách dýchacích (n = 31). Vyšší výskyt byl zaznamenán také u kmenů získaných z dolních cest dýchacích a plic (n = 10). Nejčastěji pochází kmeny C. dubliniensis z ústní dutiny a faryngu, jakožto původci slizničních kandidóz [7, 32].
Přítomnost tohoto druhu byla prokázána i z dalších klinických materiálů, např. ze stolice, moče, kůže, hemokultur či centrálního nervového systému. Výskyt v těchto materiálech je daleko nižší než v dýchacích cestách [31].
V testovaném souboru byl zachycen relativně vysoký počet kmenů C. dubliniensis také z jiných klinických materiálů než z dýchacích cest, jednalo se o moč (n = 3) a stolici (n = 4).
Izolace C. dubliniensis z moče byla popsána také v jiných publikacích [31]. Mimoto byla C. dubliniensis již dříve prokázána také jako kolonizátor močových katétrů, na kterých je dokonce schopna vytvářet biofilm [33]. Rimek et al. [34] se zaměřili na výskyt C. dubliniensis ve vzorcích stolice německé populace se zjištěním, že 2,7 % kmenů určených původně jako C. albicans náleželo ve skutečnosti ke druhu C. dubliniensis. Procentuální zastoupení C. dubliniensis ze stolice v našem souboru je 2,9 % (3 izoláty C. dubliniensis ze 104 izolátů C. albicans).
Izolace dvou kmenů z krevního řečiště (katétru a hemokultury) od dvou různých pacientů dokazuje možnost účasti těchto kvasinek také na rozvoji závažných invazivních onemocnění. V literatuře bylo popsáno několik případů katétrových sepsí způsobených C. dubliniensis a izolace této kvasinky z hemokultur [31, 35]. Výskyt C. dubliniensis byl zaznamenán také u dalších invazivních infekcí, např. u případů meningitidy [36], endokarditidy [37] či osteomyelitidy [38].
Tři z pacientů, od kterých pocházely izoláty C. dubliniensis, byli nejspíše postupně kolonizováni C. dubliniensis, protože izoláty byly získány z různých klinických materiálů. U jednoho z nich se jednalo o izoláty z krku, sputa a moče během jednoho měsíce. U dalšího pacienta byla prokázána kolonizace krku a za 7 dní byla kvasinka C. dubliniensis izolována také z centrálního žilního katétru. U třetího pacienta byla tato kvasinka získána z moče a hemokultury ve stejný den odběru. Tyto údaje jen dokazují, že kvasinka C. dubliniensis může být původcem také invazivních život ohrožujících mykóz i v našich podmínkách, a proto má správné dourčení tohoto druhu v laboratořích lékařské mikrobiologie určitě význam.
Kultivace na médiu se zvýšenou koncentrací NaCl poskytovala výsledky s 92% citlivostí a 100% specificitou, což bylo dáno čtyřmi falešně negativními a nulovým počtem falešně pozitivních výsledků. Falešně pozitivní výsledky byly důsledkem smíšených kultur C. dubliniensis s C. albicans. Jiné publikace [15, 23] prokázaly 100% citlivost i specificitu, což bylo však nejspíše dáno tím, že autoři testovali již čisté kultury kmenů C. dubliniensis. Jednou z dalších nevýhod této metody může být poněkud složitější příprava vzorků a také delší doba kultivace, s čímž souvisí i prodloužená doba identifikace. Tento aspekt společně s nemožností diferenciace C. albicans a C. dubliniensis na tomto médiu je příčinou nepříliš praktického použití této metody v rutinní diagnostice.
Růst na Staibově agaru je jednoduchá, nepříliš nákladná metoda, která by mohla být použita pro snadný a rychlý screening. Její mírnou nevýhodou je pouze nízký počet falešně pozitivních a falešně negativních výsledků mírně snižující citlivost (96%) a specificitu metody (99,2%). Také jiné publikace potvrzují sníženou spolehlivost metody s určitým procentem falešně pozitivních i falešně negativních výsledků [39]. Výhodou je však oproti ostatním dvěma fenotypovým metodám možnost dobrého rozlišení C. albicans a C. dubliniensis na základě rozdílného vzhledu kolonií.
U inhibice růstu při 42 °C jsme pozorovali falešně negativní (n = 4) a především falešně pozitivní výsledky (n = 40). Falešně negativní výsledky byly stejně jako u kultivace na médiu s NaCl způsobeny přítomností smíšených kultur. Naše výsledky se shodují s těmi od jiných autorů, kteří také pozorovali výsledky s vyšší specificitou a nižší citlivostí [40]. Mnohé práce se mimo jiné zabývaly tím, zda je spolehlivější použití teploty 42 °C nebo 45 °C, jejich výsledky se od sebe poněkud liší. Pinjon et al. [41] sice došli k závěru, že kultivace při 45 °C je pro odlišení C. dubliniensis a C. albicans přesnější, avšak jiné publikace naopak poukazují na vysoké procento falešně pozitivních výsledků při použití této teploty [42]. Jiní [40] poukazují na nižší procento falešně pozitivních výsledků při použití 42 °C.
Díky vysokému počtu falešně pozitivních výsledků (n = 320) u kultivace na médiu CHROMagar Candida lze tuto metodu doporučit pouze pro odlišení zeleně pigmentujících kvasinek od ostatních druhů rodu Candida. I když citlivost této metody vyšla díky nulovému počtu falešně negativních výsledků 100%, specificita pro tuto metodu je v porovnání s ostatními kultivačními metodami mnohem nižší (85,5%). Také jiní autoři poukazují na určité procento falešně pozitivních výsledků [20]. Na rozdíl od některých publikací [10] se však u našich izolátů neobjevil ani jeden falešně negativní výsledek a všechny kmeny C. dubliniensis rostly na médiu CHROMagar Candida s tmavě zelenou pigmentací. Za ztrátu schopnosti izolátů C. dubliniensis tvořit tmavě zelené kolonie je s největší pravděpodobností zodpovědné opakované zamražování a uchovávání kultur [24]. Všechny naše izoláty byly získány z primokultur, což může být vysvětlením, proč ani jeden z nich netvořil světle zelené kolonie.
ZÁVĚRY
Rutinní dourčování C. dubliniensis v klinických laboratořích by mohlo přispět k objasnění skutečného výskytu této kvasinky a ke zjištění její incidence v klinickém materiálu. Ukazuje se, že C. dubliniensis může být původcem jak běžných mykóz, tak také závažných invazivních kandidóz. Vzhledem k jejímu vyššímu potenciálu rozvoje rezistence k některým antimykotikům je potřebné její přesné dourčení.
Kombinace více fenotypových metod může dobře posloužit jako levná a dostupná alternativa pro identifikaci C. dubliniensis v laboratořích, které nemají možnost provádět molekulárněbiologické metody. Je však potřeba vzít v úvahu také smíšené kultury C. albicans a C. dubliniensis, což může zkreslit výsledek některých fenotypových metod. Další dobře dostupnou metodou může být samozřejmě latexová aglutinace, jejíž nevýhodou může být vyšší cena.
Poděkování: Tato práce byla podpořena grantem GAČR P205/11/1687 a IGA MZ NS-9678.
Do redakce došlo dne 3. 11. 2013.
Adresa pro korespondenci:
Mgr. Martina Mahelová
Mikrobiologický ústav, LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: 150878@mail.muni.cz
Doc. MUDr. Filip Růžička, Ph.D.
Mikrobiologický ústav, LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: fruzic@fnusa.cz
Zdroje
1. Sullivan DJ, Westerneng TJ, Haynes KA, Bennett DE, Coleman DC. Candida dubliniensis sp. nov.: phenotypic and molecular characterization of a novel species associated with oral candidosis in HIV-infected individuals. Mikrobiology, 1995;141 : 1507–1521.
2. Jackson AP, Gamble JA, Yeomans T, Moran GP, Saunders D, et al. Comparative genomics of the fungal pathogens Candida dubliniensis and Candida albicans. Genome Res, 2009;19 : 2231–2244.
3. Loreto ES, Scheid LA, Nogueira CW, Zeni G, et al. Candida dubliniensis: epidemiology and phenotypic methods for identification. Mycopathologia, 2010;169 : 431–443.
4. Sullivan DJ, Moran GP, Coleman DC. Candida dubliniensis: ten years on. FEMS Microbiol Lett, 2005;253 : 9–17.
5. Nunn MA, Schäefer SM, Petrou MA, Brown JR. Environmental source of Candida dubliniensis. Emerg Infect Dis, 2007;13 : 747–750.
6. Pfaller MA, Woosley LN, Messer SA, Jones RN, Castanheira M. Significance of molecular identification and antifungal susceptibility of clinically significant yeasts and moulds in a global antifungal surveillance programme. Mycopathologia, 2012;174 : 259–271.
7. Moran GP, Sullivan DJ, Henman MC, McCreary CE, et al. Antifungal drug susceptibilities of oral Candida dubliniensis isolates from human immunodeficiency virus (HIV)-infected and non-HIV-infected subjects and generation of stable fluconazole-resistant derivatives in vitro. Antimicrob Agents Chemother, 1997;41 : 617–623.
8. Fotedar R, Al Hedaithy SS. Prevalence of Candida dubliniensis among germ tube-positive yeasts recovered from the respiratory specimens in HIV-negative patients. Mycoses, 2004;47 : 150–155.
9. Scheid LA, Mario DA, Kubiça TF, Santurio JM, Alves SH. In vitro activities of antifungal agents alone and in combination against fluconazole-susceptible and -resistant strains of Candida dubliniensis. Braz J Infect Dis, 2012;16 : 78–81.
10. Alvarez MI, Suárez BL, Caicedo LD. Isolation of Candida dubliniensis for the first time in Cali, Colombia, and its identification with phenotyping methods. Mycopathologia, 2009; 167 : 19-24.
11. Staib P, Morschhäuser J. Chlamydospore formation on Staib agar as a species-specific characteristic of Candida dubliniensis. Mycoses, 1999;42 : 521–524.
12. Khan ZU, Ahmad S, Mokaddas E, Chandy R. Simplified sunflower (Helianthus annuus) seed agar for differentiation of Candida dubliniensis from Candida albicans. Clin Microbiol Infect, 2004;10 : 590–592.
13. Girish Kumar CP, Menon T, Prabu D, Nandhakumar B. Chlamydosporulation of Candida albicans and Candida dubliniensis on mustard agar. Mycoses, 2007;50 : 71–73.
14. Khan ZU, Ahmad S, Mokaddas E, Chandy R. Tobacco agar, a new medium for differentiating Candida dubliniensis from Candida albicans. J Clin Microbio, 2004;42 : 4796–4798.
15. Chowdhary A, Randhawa HS, Kowshik T, Kathuria S, et al. Application of hypertonic Sabouraud glucose agar for differentiation of Candida dubliniensis from Candida albicans. Diagn Microbiol Infect Dis, 2011;69 : 440–442.
16. Khan Z, Ahmad S, Chandy R, Joseph L. A simple xylose-based agar medium for the differentiation of Candida dubliniensis and Candida albicans. Diagn Microbiol Infect Dis, 2012;72 : 285–287.
17. Chryssanthou E, Fernandez V, Petrini B. Performance of commercial latex agglutination tests for the differentiation of Candida dubliniensis and Candida albicans in routine diagnostics. APMIS, 2007;115 : 1281–1284.
18. Kurzai O, Heinz WJ, Sullivan DJ, Coleman DC et al. Rapid PCR test for discriminating between Candida albicans and Candida dubliniensis isolates using primers derived from the pH-regulated PHR1 and PHR2 genes of C. albicans. J Clin Microbiol, 1999;37 : 1587–1590.
19. Romeo O, Racco C, Criseo G. Amplification of the hyphal wall protein 1 gene to distinguish Candida albicans from Candida dubliniensis. J Clin Microbiol, 2006;44 : 2590–2592.
20. Mähnß B, Stehr F, Schäfer W, Neuber K. Comparison of standard phenotypic assays with a PCR method to discriminate Candida albicans and C. dubliniensis. Mycoses, 2005;48 : 55–61.
21. Hof H, Eigner U, Maier T, Staib P. Differentiation of Candida dubliniensis from Candida albicans by means of MALDI-TOF mass spectrometry. Clin Lab, 2012;58 : 927–931.
22. Horká M, Růzicka F, Holá V, Slais K. Separation of similar yeast strains by IEF techniques. Electrophoresis, 2009;30 : 2134–2141.
23. Akgül O, Cerikçioğlu, N. Hypertonic sabouraud dextrose agar as a substrate for differentiation of Candida dubliniensis. Mycopathologia, 2009;167 : 357–379.
24. Hospenthal, DR, Beckius, ML, Floyd, KL, Horvath, LL, Murray, CK. Presumptive identification of Candida species other than C. albicans, C. krusei, and C. tropicalis with the chromogenic medium CHROMagar Candida. Ann Clin Microbiol Antimicrob, 2006;5 : 1.
25. Ge, YP, He, GX, Lin, T, Lu, GX et al. First isolation of Candida dubliniensis from oral cavities of dermatological patients in Nanjing, China. Mycopathologia, 2011;172 : 465–471.
26. Marcos-Arias C, Vicente JL, Sahand IH, Eguia A, De-Juan A et al. Isolation of Candida dubliniensis in denture stomatitis. Arch Oral Biol, 2009;54 : 127–131.
27. Blignaut E, Pujol C, Joly S, Soll DR. Racial distribution of Candida dubliniensis colonization among South Africans. J Clin Microbiol, 2003;41 : 1838–1842.
28. Peltroche-Llacsahuanga H, Döhmen H, Haase G. Recovery of Candida dubliniensis from sputum of cystic fibrosis patients. Mycoses, 2002;45 : 15–18.
29. Willis AM, Coulter WA, Sullivan DJ, Coleman DC et al. Isolation of C. dubliniensis from insulin-using diabetes mellitus patients. J Oral Pathol Med, 2000;29 : 86–90.
30. Mokaddas E, Khan ZU, Ahmad. Prevalence of Candida dubliniensis among cancer patients in Kuwait: a 5-year retrospective study. Mycoses, 2011;54 : 29–34.
31. Meis JF, Ruhnke M, De Pauw BE, Odds FC, et al. Candida dubliniensis candidemia in patients with chemotherapy-induced neutropenia and bone marrow transplantation. Emerg Infect Dis, 1999;5 : 150–153.
32. Owotade FJ, Patel M, Ralephenya TR, Vergotine G. Oral Candida colonization in HIV-positive women: associated factors and changes following antiretroviral therapy. J Med Microbiol, 2013;62 : 126–132.
33. Růžička F, Holá V, Mahelová M, Procházková A. Kvasinková kolonizace močových katétrů a význam tvorby biofilmu. Klin Mikrobiol Infekc Lek, 2012;18 : 115–119.
34. Rimek D. Prevalence, phenotypic identification, and antimycotic susceptibility of Candida dubliniensis from fecal samples of outpatients in Thuringia/Germany. In The 17th Congress of The International Society for Human and Animal Mycology, Tokyo, 2009 : 57.
35. Lai Cc, Tsai HY, Chang TC, Hsueh PR. Catheter-related fungemia caused by Candida dubliniensis. J MicrobioL Immunol Infect, 2012;46 : 306–308.
36. van Hal SJ, Stark D, Harkness J, Marriott D. Candida dubliniensis meningitis as delayed sequela of treated C. dubliniensis fungemia. Emerg Infect Dis, 2008;14 : 327–329.
37. Carr MJ, Clarke S, O’Connell F, Sullivan DJ, et al. First reported case of endocarditis caused by Candida dubliniensis. J Clin Microbiol, 2005;43 : 3023–3026.
38. Wellinghausen N, Moericke A, Bundschuh S, Friedrich W, et al. Multifocal osteomyelitis caused by Candida dubliniensis. J Med Microbiol, 2009;58 : 386–390.
39. Pasligh J, Radecke C, Fleischhacker M, Ruhnke M. Comparison of phenotypic methods for the identification of Candida dubliniensis. J Microbiol Immunol Infect, 2010;43 : 147–154.
40. Us E, Cengiz SA. Prevalence and phenotypic evaluation of Candida dubliniensis in pregnant women with vulvovaginal candidosis in a university hospital in Ankara. Mycoses, 2007;50 : 13–20.
41. Pinjon E, Sullivan D, Salkin I, Shanley D, Coleman D. Simple, inexpensive, reliable method for differentiation of Candida dubliniensis from Candida albicans. J Clin Microbiol, 1998;36 : 2093–2095.
42. Gales AC, Pfaller MA, Houston AK, Joly S, Sullivan DJ, et al. Identification of Candida dubliniensis based on temperature and utilization of xylose and alpha-methyl-D-glucoside as determined with the API 20C AUX and vitek YBC systems. J Clin Microbiol, 1999;37 : 3804–3808.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2014 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Očekávané pokrytí kmenů novou proteinovou meningokokovou vakcínou v České republice
- Bodové prevalenčné sledovanie nozokomiálnych nákaz na Slovensku – súčasť projektu Európskej únie
- Nozokomiální přenos listeriózy
- Diverzita humánních izolátů salmonel v Jihomoravském kraji v letech 2009–2012
- Post-mortem analýza průlomové infekce Candida albicans při léčbě echinokandiny u pacienta po transplantaci kmenových buněk krvetvorby
- Výskyt Candida dubliniensis v klinickém materiálu a možnosti její identifikace
- Přirozené protilátky proti α(1,3) galaktosylovému epitopu v séru nemocných s maligními nádory
- CDT toxíny
- Zhodnocení významu ready-made spaceru s gentamicinem ve vztahu k bakteriologickým nálezům u pacientů s infekcí kloubní náhrady
- Q-horečka jako profesionální onemocnění vedoucí k invaliditě – kazuistika
- Návrat spalniček do Ústeckého kraje
- Vzpomínka na nedožité 90. narozeniny MUDr. Miroslava Přívory, CSc.
- Vzpomínka na nedožité 90. narozeniny prof. MUDr. Bohumila Ticháčka, DrSc.
- Fylogenetická a molekulární analýza virů chřipky A/H1N1pdm izolovaných v epidemické sezoně 2012/2013 od pacientů hospitalizovaných s příznaky ILI
- Virové gastroenteritidy v regionu východních Čech
- Studie o výskytu protilátek viru hepatitidy E ve dvou oblastech České republiky
- Růst prevalence syfilis u žen ve východočeském regionu – 30 let sledování
- Diagnostika Clostridium difficile infekcí – porovnávací studie dvou imunoenzymatických metod s konfirmací pomocí PCR a kultivace s následnou ribotypizací kmene*
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Výskyt Candida dubliniensis v klinickém materiálu a možnosti její identifikace
- Bodové prevalenčné sledovanie nozokomiálnych nákaz na Slovensku – súčasť projektu Európskej únie
- Q-horečka jako profesionální onemocnění vedoucí k invaliditě – kazuistika
- Diagnostika Clostridium difficile infekcí – porovnávací studie dvou imunoenzymatických metod s konfirmací pomocí PCR a kultivace s následnou ribotypizací kmene*
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



