-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Realimentační syndrom
Refeeding syndrome
In recent months, the number of newly diagnosed juveniles with a psychiatric diagnosis appears to be increasing. Similarly, individuals with a relapse of their mental illness, which includes eating disorders, are more likely to show up in paediatric departments. However, these patients are at risk of refeeding syndrome (RS). The article discusses pathophysiological mechanisms of RS, since their understanding is essential for properly conducted prevention and treatment.
Keywords:
anorexia nervosa – hypokalaemia – hypophosphataemia – eating disorder – refeeding syndrome
Autoři: Bernášková Klára 1; David Jan 2
Působiště autorů: Ústav patofyziologie 3. lékařské fakulty Univerzity Karlovy, Praha 1; Pediatrická klinika 2. lékařské fakulty a Fakultní nemocnice v Motole, Praha 2
Vyšlo v časopise: Čes-slov Pediat 2022; 77 (3): 166-169.
Kategorie: Patofyziologie v pediatrii
Souhrn
Z klinické praxe posledních měsíců se zdá, že počet nově diagnostikovaných mladistvých s psychiatrickou diagnózou narůstá. Stejně tak se častěji v ambulancích i na lůžkových odděleních objevují jedinci s relapsem duševní nemoci, mezi které patří i poruchy příjmu potravy. Tito pacienti jsou však při agresivní iniciální realimentaci ohroženi tzv. realimentačním (refeeding) syndromem (RS). Předkládaný článek pojednává o patofyziologických mechanismech RS, neboť jejich pochopení je zásadním předpokladem správně vedené prevence a léčby.
Klíčová slova:
mentální anorexie – refeeding syndrom – hypokalémie – porucha příjmu potravy – hypofosfatemie
Úvod
Z klinické praxe posledních měsíců se zdá, že počet nově diagnostikovaných mladistvých s psychiatrickou diagnózou narůstá. Stejně tak se častěji v ambulancích i na lůžkových odděleních objevují jedinci s relapsem duševní nemoci, mezi které patří i poruchy příjmu potravy. Tito pacienti jsou však při agresivní iniciální realimentaci ohroženi tzv. realimentačním (refeeding) syndromem (RS). Pojďme se podívat na tento problém z patofyziologického hlediska.
Hladovění
Metabolický stav během mentální anorexie odpovídá prostému proteino-energetickému hladovění. Pro jednodušší pochopení rozvoje změn při realimentaci je výhodné si zopakovat, jaké změny metabolismu probíhají při nedostatečném příjmu potravy.
Při krátkodobém hladovění (24 až 72 hodin) musí být kryt výkon organismu z jeho vlastních rezerv. Nejdříve se spotřebuje glukóza naposledy přijatá potravou a pak se glykemie udržuje několika mechanismy. Vlivem glukagonu se štěpí jaterní škrob glykogen (glykogenolýza) až do jeho spotřebování (za 24 až 48 hodin) a poté se zvyšuje tvorba glukózy glukoneogenezí.(1) Glukoneogenezi podporuje kromě glukagonu také kortizol, který má proteokatabolický a lipolytický efekt, aby se rychle zabezpečil dostatek potřebných substrátů. V prvních třech až sedmi dnech tak kromě zásob glykogenu ubývá také svalová hmota, která je hlavním zdrojem glukoplastických aminokyselin (leucin, izoleucin, valin).
Pokud hladovění pokračuje, přetrvává vysoká koncentrace glukagonu a snižuje se koncentrace inzulinu, hlavního anabolického hormonu. Aktivuje se ketogeneze v játrech a energetický metabolismus se orientuje na oxidaci tuků. Hlavním zdrojem energie se v tuto dobu stávají mastné kyseliny a ketolátky (především β-hydroxy-butyrát a α-keto-glutarát). Ty využívá jako zdroj energie především nervová tkáň. Některé tkáně však potřebují glukózu i nadále (částečně centrální nervový systém, dřeň ledvin a erytrocyty).(2) V této fázi hladovění se výrazně snižuje bazální metabolismus (o 25 až 40 %). Tato změna je umožněna sníženou sekrecí hormonů štítné žlázy a přeměnou již uvolněných hormonů na nefunkční metabolity. Mluvíme o adaptovaném hladovění. U zdravého jedince dochází k maximální adaptaci na hladovění zpravidla za sedm dní. Adaptace je zprostředkována právě poklesem hladiny inzulinu a trijodtyroninu.(3)
Pokud pacient hladoví dále a vyčerpají se i zásoby tuku (kolem 30 dnů), plynule dochází k přechodu na stresový metabolismus (tzv. stresové hladovění) s výraznou a často nedostatečně krytou potřebou bílkovin. Vyplavuje se stresový hormon kortizol, který má velmi silné proteokatabolické účinky. Hlavním zdrojem energie se stávají bílkoviny. Krok za krokem ubývá funkční tkáně, což postihuje i důležité systémy, například kardiovaskulární (úbytek svalové hmoty myokardu),(4,5) a dokonce může dojít i k atrofii mozkové kůry.(6) Stresové hladovění nastoupí dříve, pokud je stav pacienta komplikován zánětlivým onemocněním nebo úrazem.
U malých dětí probíhá celý cyklus rychleji, protože mají menší zásoby jaterního glykogenu, tuku i bílkovin.( 7) Navíc může být spotřeba živin zvýšena v prudkém období růstu.(3) Tabulka 1 přináší změny metabolismu v čase při probíhajícím hladovění.(3,6,7)
Tab. 1. Změny metabolismu při hladovění – průběh v čase, upraveno dle(3,6,7) 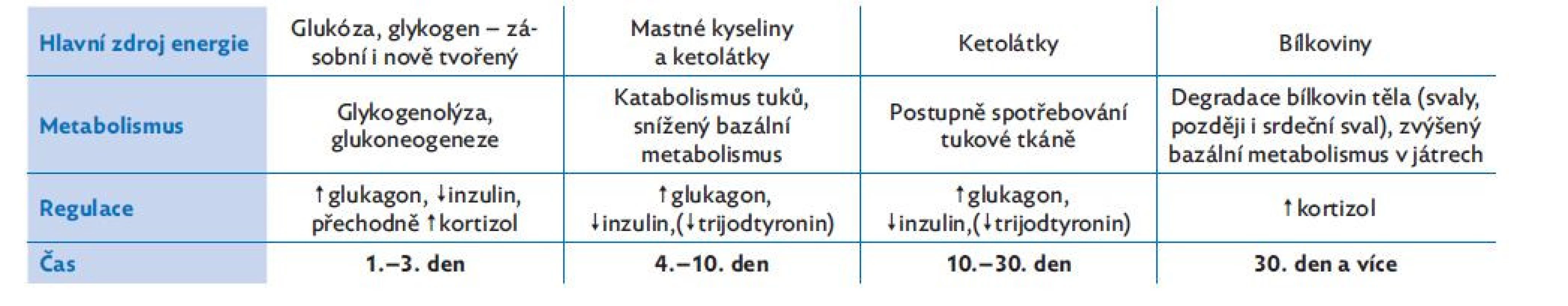
Se změnami metabolismu (glukoneogeneze i ketogeneze) se současně mění složení intracelulárního prostředí. Na buněčné úrovni se spotřebovávají makroergní fosfátové vazby, nezbytné pro intermediální metabolismus a také pro udržování acidobazické rovnováhy a metabolismu elektrolytů. Výrazně se snižuje především kalium, magnezium a fosfáty.( 4) Přes výraznou depleci v organismu zůstávají sérové koncentrace iontů většinou zachovány, a to díky snaze udržet homeostázu přestupem nitrobuněčných iontů do extracelulárního prostředí.
Realimentace
Při obnovení energetického příjmu (realimentaci) po delším hladovění dochází k závažným metabolickým změnám, které mohou vést až ke smrti. Tyto změny byly poprvé popsány jako RS v roce 1940.(7) Může se vyskytnout zejména u pacientů s poruchami příjmu potravy (zejména s body mass indexem – BMI < 15 kg/m2), v malnutrici či s nádorovým onemocněním.(7)
Dodnes však není RS přesně definován, což komplikuje jeho sledování a statistiku. Principem RS jsou těžké elektrolytové změny, metabolické abnormality a přesuny tekutin provázené velmi variabilními klinickými příznaky.(1) RS je proto zatím neurčitě definován jako metabolické a klinické změny vyvolané agresivní realimentací podvyživených pacientů.(2,7,8) Obecný přehled základních klinických příznaků RS přináší tabulka 2.(3)
Tab. 2. Obecný přehled klinických projevů realimentačního syndromu, upraveno dle(3) 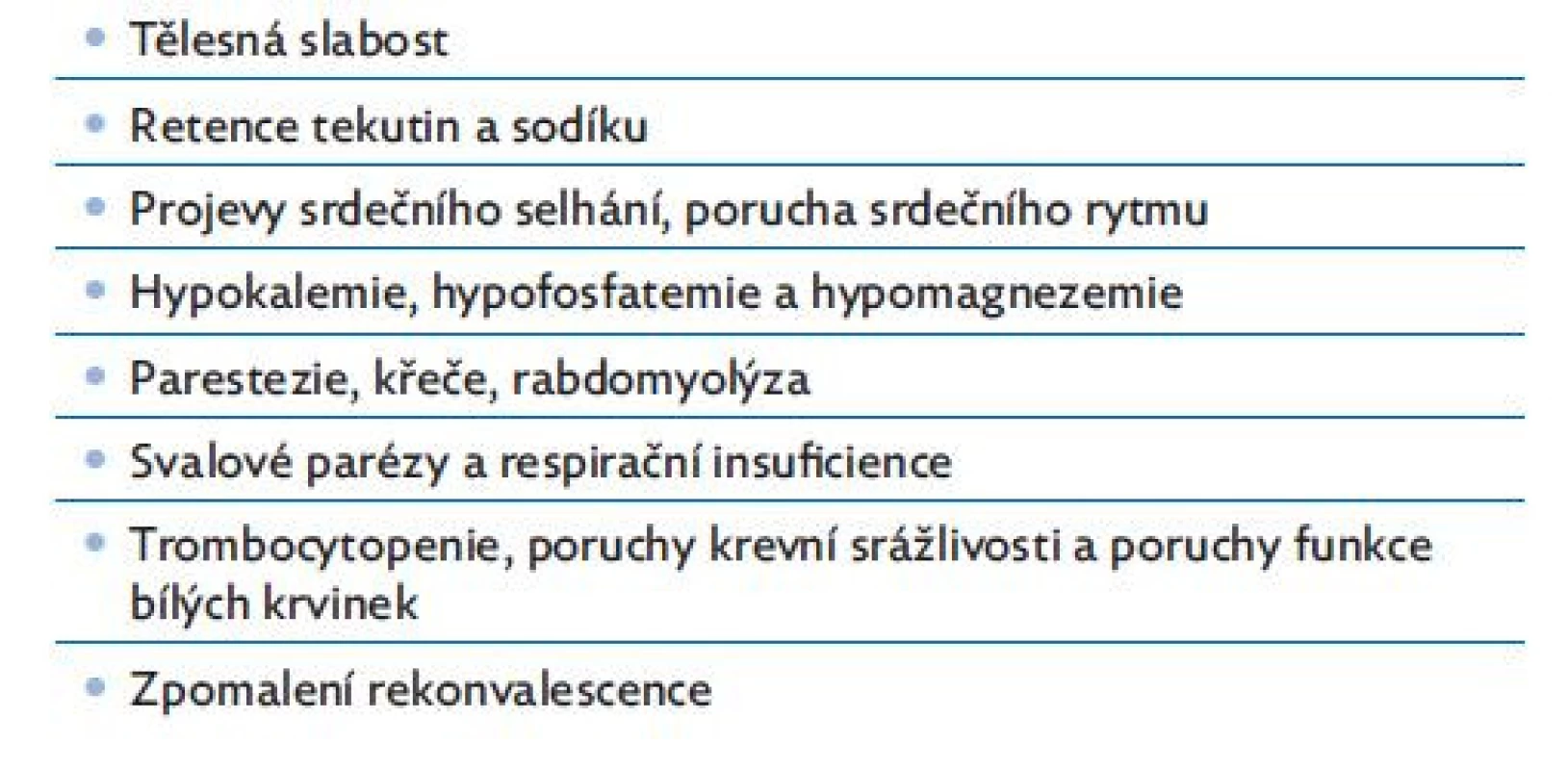
Během prostého hladovění dochází nejen k depleci energetických zásob, ale i k nedostatku vitaminů a minerálů. Znakem, který je přítomen při zavedení výživy téměř u všech pacientů, je hypofosfatemie (často pod hodnotou 0,5 mmol/l), hypokalemie a hypomagnezemie. Důležitější než jejich hodnota je ale pro symptomatologii rychlost jejich poklesu.(1) Současně vzniká deplece vitaminu B1 (thiaminu) a poruchy sodíkové a vodní rovnováhy.
Obnovení přísunu sacharidů v rámci realimentace zvýší glykemii, která stimuluje sekreci inzulinu. Inzulin aktivuje anabolické pochody v buňkách a zvýšením metabolického obratu zvýší spotřebu intracelulárních iontů, hlavně fosfátů, draslíku a magnezia, které se dějů účastní. Ionty se za přítomnosti inzulinu přesunou do buněk a extracelulárně se jejich koncentrace sníží, což způsobí rozvoj příznaků RS.(1)
Výskyt hypofosfatemie se uvádí ve zhruba 6 % případů realimentace pacientů s mentální anorexií.(9) Její vývoj bývá považován za hlavní indikátor rozvoje RS. Právě fosfor představuje minerál, který je zodpovědný za většinu klinických projevů RS. Při realimentaci se rychle zvýší metabolismus v játrech, který mění dodanou glukózu na glykogen a bílkoviny a spotřebovává přitom velké množství fosfátů v podobě adenosintrifosfátu (ATP ).(4) Hypofosfatemie způsobuje příznaky poruch funkce svalů, např. poruchy koordinace až svalovou slabost a paralýzu. Týká se to i dýchacích svalů, kde může vést nejen k jejich dysfunkci, ale v závažných případech až k akutnímu respiračnímu selhání při snížení aktivity bránice. Stejně tak může způsobit srdeční selhání, neboť snižuje srdeční kontraktilitu a může přivodit srdeční dysrytmie. Deficit fosforu také snižuje tvorbu 2,3-difosfoglycerátu (2,3-DPG), který je potřebný k efektivnímu uvolňování kyslíku z hemoglobinu. Dochází tak k horší dodávce kyslíku do periferních tkání a vzniká tkáňová hypoxie.(10) Nedostatek fosfátů ovlivňuje nepřímo i dráždivost tkání, protože je ve formě ATP potřeba pro udržování iontové rovnováhy na membráně a tím i klidového membránového potenciálu. Může tedy způsobit i změny chování, dezorientaci a agresivitu.(1,2)
Draslík je iont, který je nesmírně důležitý pro metabolismus buněk, pro syntézu glykogenu a bílkovin a udržování klidového membránového potenciálu. Je významný také pro hojení. Hypokalemie způsobuje hyperpolarizaci buněk, což snižuje jejich dráždivost, a kromě nevolnosti a zvracení vede ke svalové slabosti (včetně dýchacích svalů) a vyvolává poruchy srdeční vodivosti a kontraktility. V důsledku hypokalemie vznikají poruchy srdečního rytmu, které mohou být i život ohrožující a způsobit náhlou smrt (fibrilace komor). Zvracení, které může při hypokalemii vzniknout, navíc kalemii dále snižuje.(2)
Magnezium je druhý nejčastější intracelulární prvek. Je kofaktorem mnoha nitrobuněčných enzymů, včetně metabolismu sacharidů a tvorby ATP . Kromě toho je také důležitý pro strukturu nukleových kyselin a ribosomů. Hypomagnezemie způsobuje neuromuskulární poruchy (třes, tetanii, svalovou únavu), ovlivňuje činnost centrálního nervového systému (může vyvolat změny mentálního stavu až kóma) a může způsobit poruchy srdečního rytmu.(7) Nízká hladina magnezia navíc zvyšuje ztráty kalia v distálním tubulu ledvin. Může být tedy příčinou refrakterní hypokalemie, která se upraví až po normalizaci magnezemie.(1)
Thiamin (vitamin B1) je při dlouhodobém hladovění také výrazně snížen. Je jako kofaktor zodpovědný za metabolismus sacharidů a syntézu ATP . Při nedostatku thiaminu se hromadí pyruvát (konečný produkt glykolýzy), který se mění na laktát, a vzniká laktátová acidóza. Nedostatek thiaminu může způsobit Wernickeovu encefalopatii (suchá forma beri-beri s ataxiemi, paresteziemi a poruchami centrálního nervového systému) nebo srdeční formu beri-beri (mokrá, s otoky a hromaděním tekutiny v tělních dutinách a selháním srdce). Zásoby thiaminu mohou být vyčerpány už po čtyřech týdnech sníženého příjmu potravy, někdy i rychleji. Vzhledem k tomu, že je thiamin potřeba pro metabolismus cukrů, je u rizikových pacientů doporučeno doplňovat ho ještě před vlastní realimentací.(1)
Zvýšení hladiny inzulinu na začátku zavedení výživy sníží vylučování sodíku v distální části nefronu. Následuje retence vody osmotickými silami a přetížení organismu tekutinami se vznikem plicního otoku a kardiální dekompenzace.(1,2) Přehled konkrétních klinických projevů realimentace a jejich příčin uvádí tabulka 3.(3,6,7)
Tab. 3. Klinické projevy realimentace a jejich příčiny, upraveno dle(3,6,7) 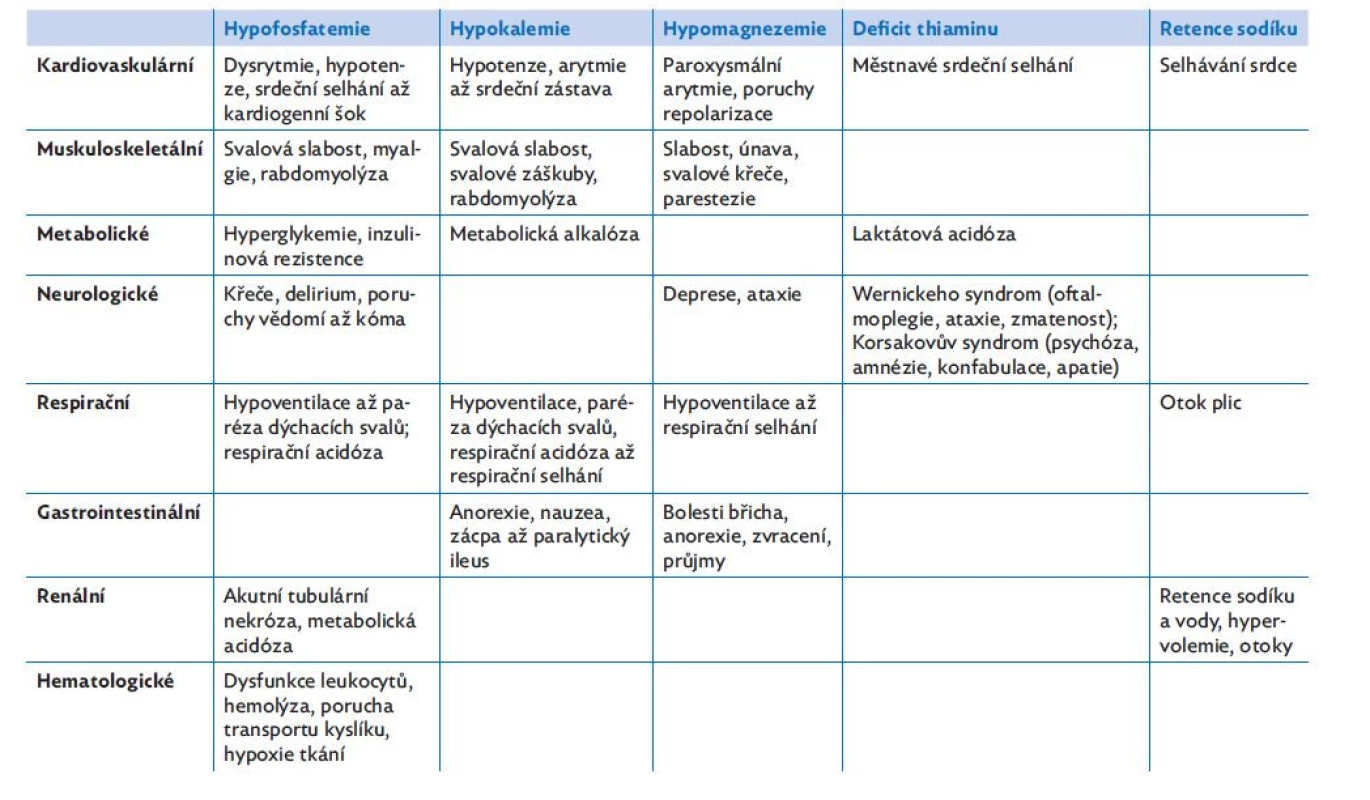
Nutno též připomenout, že riziko rozvoje RS vzniká i u „non-anorektických“ pacientů. Recentně publikovaná doporučení uvádějí vhodnost vyhledávání těchto rizikových hospitalizovaných pacientů, u nichž se RS může rozvinout.(11) K tomu lze využít specifická screeningová kritéria (např. významný nechtěný úbytek hmotnosti, anamnéza abúzu návykových látek apod.). U takto vybraných pacientů je nutno následně správně vést nutriční podporu s cílem prevence rozvoje RS.(11,12)
Závěr
Vzhledem k závažnosti důsledků realimentace je jistě namístě snaha jim předejít. Důležité je nejdříve identifikovat pacienta, u kterého by se mohl realimentační syndrom vyvinout (hmotnostní úbytek nad 10 %, nízký BMI, hladovění déle než 7–10 dní, chronické onemocnění).(12) Významnou zásadou je začít opatrně a pokračovat pomalu („start low and go slow“). Nutriční podpora by měla být první den kolem jedné třetiny odhadnuté cílové dávky a měla by se postupně zvyšovat během tří až pěti dnů. Ionty by se měly začít terapeuticky korigovat ještě před realimentací a během ní neustále kontrolovat.
Korespondenční adresa:
MUDr. Jan David, Ph.D.
Pediatrická klinika 2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha
Zdroje
1. Ševela S, et al. Realimentační syndrom. Čas lék čes 2016; 155(2): 34–40.
2. Kraft MD, Btaiche IF, Sacks GS. Review of the refeeding syndrome. Nutr Clin Pract 2005; 20(6): 625–633.
3. Szitányi P, Těšínský P. Současné trendy v klinické výživě a intenzivní metabolické péči. Praha: Institut postgraduálního vzdělávání ve zdravotnictví. 2013.
4. Plášek J, Hrabovský V, Martínek A. Refeeding syndrom – skrytá klinická hrozba. Interní Med 2010; 12(9): 439–441.
5. Cahill GF. Starvation in man. N Engl J Med 1970; 282(12): 668–675.
6. Mitchell JE, Peterson CB. Anorexia nervosa. N Engl J Med 2020; 382(14): 1343–1351.
7. Pulcini CD, Zettle S, Srinath A. Refeeding syndrome. Pediatr Rev 2016; 37(12): 516–523.
8. Friedli N, Stanga Z, Sobotka L, et al. Revisiting the refeeding syndrome: Results of a systematic review. Nutrition 2017; 35 : 151–160.
9. Ornstein RM, Golden NH, Jacobson MS, Shenker IR. Hypophosphatemia during nutritional rehabilitation in anorexia nervosa: implications for refeeding and monitoring. J Adolesc Health 2003; 32(1): 83–88.
10. Boateng AA, Sriram K, Meguid MM, Crook M. Refeeding syndrome: treatment considerations based on collective analysis of literature case reports. Nutrition 2010; 26(2): 156–167.
11. Friedli N, Stanga Z, Culkin A, et al. Management and prevention of refeeding syndrome in medical inpatients: An evidence-based and consensus-supported algorithm. Nutrition 2018; 47 : 13–20.
12. Karásková E, Vydra D, Smolka V, et al. Refeeding syndrom v dětském věku. Ces-slov Pediat 2014; 69(6): 363–369.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Co jsme psaliČlánek Invazivní meningokokové onemocnění – závažná nemoc, u níž rozhoduje čas. Ochranou je očkováníČlánek EditorialČlánek Poruchy autistického spektraČlánek Vplyv lockdownu a online výučby počas pandémie covidu-19 na duševné zdravie slovenských adolescentovČlánek Vážný průběh akutní infekce SARS-CoV-2 u pacientů na Pediatrické klinice Fakultní nemocnice v MotoleČlánek Pediatrická poezie
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2022 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Dopis z Ukrajiny českým a slovenským pediatrům
- Co jsme psali
- Invazivní meningokokové onemocnění – závažná nemoc, u níž rozhoduje čas. Ochranou je očkování
- Editorial
- Suicidalita a sebepoškozování v dětství a adolescenci – aktuální situace
- Suicidalita u detí a adolescentov – rizikové faktory a dopad pandémie covidu-19
- Poruchy autistického spektra
- Vplyv lockdownu a online výučby počas pandémie covidu-19 na duševné zdravie slovenských adolescentov
- U adolescentiek s mentálnou anorexiou počet cirkulujúcich krvných buniek asociuje s denzitou kostného minerálu
- Realimentační syndrom
- Pohlavní/rodová neshoda v dětství
- Vážný průběh akutní infekce SARS-CoV-2 u pacientů na Pediatrické klinice Fakultní nemocnice v Motole
- Profesor Nevoral oslavil osmdesáté narozeniny
- Pediatrická poezie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Poruchy autistického spektra
- Pohlavní/rodová neshoda v dětství
- Suicidalita a sebepoškozování v dětství a adolescenci – aktuální situace
- Realimentační syndrom
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



