-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Ľudský mikrobióm a renálne ochorenia u detí
The human microbiome and kidney diseases in children
The microbiome is a complex structure consisting of all bacteria, viruses, fungi and other microorganisms which colonize the surfaces and mucous membranes of the human body. There exists a specific and symbiotic relationship between the microbiome and the human body, both sides can benefit greatly from this relationship. Alterations of the normal microbiome composition can lead to various pathological conditions. The kidneys and gut micriobiome both produce several molecules which can regulate each other’s function in a positive or negative way. Are human urine and the mucous membranes of our urinary tract really sterile as suggested by the Human Microbiome project? Is it possible that there is a connection between the composition of the intestinal microbiome and the development of urinary tract infections in children? The therapy using fecal microbial transplantation has great results in patients with Clostridium difficile gut infections, but can it regulate the course of urinary tract infections in humans, too?
Keywords:
Urinary tract infections – gut microbiome – urobiome – colorenal axis
Autoři: J. Krajčír 1; B. Piteková 1; M. Chromek 2; Ľ. Podracká 1
Působiště autorů: Detská klinika, Národný ústav detských chorôb a Lekárska fakulta Univerzity Komenského, Bratislava, Slovensko 1; Jednotka detskej nefrológie, Detská nemocnica Astrid Lindgrenovej, Karolínska univerzitná nemocnica a Karolinska Inštitút, Štokholm, Švédsko 2
Vyšlo v časopise: Čes-slov Pediat 2021; 76 (7): 382-391.
Kategorie: Přehledový článek
Souhrn
Mikrobióm je komplexný ekosystém všetkých baktérií, vírusov, húb a iných mikroorganizmov, ktoré osídľujú povrchy a sliznice ľudského tela. Medzi mikrobiómom a našim telom existuje špecifický symbiotický vzťah, z ktorého môžu profitovať obe strany. Odchýlky od normálneho zloženia mikrobiómu však môžu spôsobiť viaceré patologické stavy. Obličky a črevný mikrobióm tvoria rôzne molekuly, prostredníctvom ktorých môžu ovplyvňovať svoju funkciu v pozitívnom aj negatívnom zmysle. Sú moč a sliznice močových ciest u človeka naozaj sterilné, ako to predpokladal the Human Microbiome project? Existuje vzťah medzi zložením črevného mikrobiómu a rizikom vzniku infekcií močových ciest u detí? Liečba fekálnou mikrobiálnou transplantáciou má vynikajúce výsledky u pacientov s klostrídiovými črevnými infekciami, dokáže však reagulovať aj priebeh infekcií močových ciest?
Klíčová slova:
mikrobióm čreva – urobióm – kolo-renálna os – infekcie močových ciest
HUMÁNNY MIKROBIÓM
Roky je známe, že povrchy kože a slizníc ľudského tela osídľuje približne 3,8 x 1013 mikroorganizmov, čím sa počet mikróbov približuje počtu všetkých buniek ľudského organizmu [1]. Ľudský mikrobióm obsahuje genetický pool baktérií, Achaea, húb, vírusov a iných mikróbov [2]. V procese evolúcie sa medzi mikróbmi a ľudským organizmom vyvinul veľmi špecifický, dynamický a symbiotický vzťah, z ktorého významne profitujú obidve strany. V ostatnej dekáde sa realizovali viaceré metagenomické analýzy, ktoré umožnili lepšie pochopiť komplexný vplyv mikroorganizmov na ľudské zdravie aj chorobnosť [1].
Prirodzený mikrobióm je stabilný ekosystém poskytujúci ľudskému organizmu viaceré benefity – tvorí pre človeka dôležité látky (mastné kyseliny s krátkym reťazcom), metabolizuje málo stráviteľné polysacharidy, eliminuje toxické produkty, zabezpečuje normálny vývin hostiteľského imunitného systému (proliferácia a diferenciácia T-lymfocytov, B-lymfocytov, plazmatických buniek) a chráni pred osídlením povrchu tela patogénnymi kmeňmi mikróbov. Je preto logické, že odchýlky od normálneho zloženia mikrobiómu (dysmikróbia, dysbióza) môžu byť príčinou vzniku viacerých ochorení, medzi ktoré sa radia zápalové ochorenia čreva (IBD, inflammatory bowel disease), colon irritable, obezita, autoimunitné ochorenia, alergie, patológie mozgového tkaniva, depresia, autizmus a v neposlednom rade aj ochorenia obličiek [1, 3, 4].
Donedávna sa predpokladalo, že novorodenec sa rodí so sterilným črevom. Najnovšie výskumy však tento mýtus vyvrátili. V placente, pupočníkovom povrazci a v plodovej vode novorodencov bol detegovaný špecifický mikrobióm, ktorý je charakterizovaný malým množstvom mikroorganizmov, nízkou biodiverzitou a dominantným zastúpením proteobaktérií. Podobné zloženie mikrobiómu sa pozorovalo aj v smolke novorodencov, preto sa predpokladá, že dochádza k translokácií mikroorganizmov cez feto-maternálnu bariéru [5, 6]. Intímne „biologické“ spojenie medzi organizmom matky a dieťaťa pokračuje po pôrode aktom dojčenia. V treťom až štvrtom dni života dieťaťa dochádza k prvej signifikantnej zmene mikrobiómu čreva, ktorý sa podobá zloženiu mikrobiómu kolostra. Dominantnou sa stáva „mliečna baktéria“ Bifidobacterium [4, 5]. Druhá zmena nastáva počas zavádzania nemliečnych príkrmov do stravy v 4.–6. mesiaci života dieťaťa, kedy dominujú kmene Bacteroidetes a Firmicutes [4]. Mierne zmeny pokračujú až do veku troch rokov života dieťaťa, kedy sa črevný mikrobióm stáva skutočne stabilným ekosystémom (obr. 1). U ľudí sa pozorovali tri typy črevných mikrobiómov (tzv. „enterotypy“) podľa prevládajúceho kmeňa mikroorganizmov – Bacteroides, Prevotella alebo Firmicutes. Vývin črevného mikrobiómu u detí závisí od spôsobu pôrodu (cisársky rez alebo vaginálny pôrod), stravy dieťaťa (dojčenie alebo mliečne formuly), času ukončenia dojčenia a zavádzania tuhej stravy a od užívania antibiotickej liečby [4].
Obr. 1. Detailná zmena skladby črevného mikrobiómu v rôznych etapách života dieťaťa (upravené podľa Vasylyeva a kol., 2016).
Fig. 1. Detailed change of gut microbiome composition during various stages of life (modified according to Vasylyeva et al., 2016).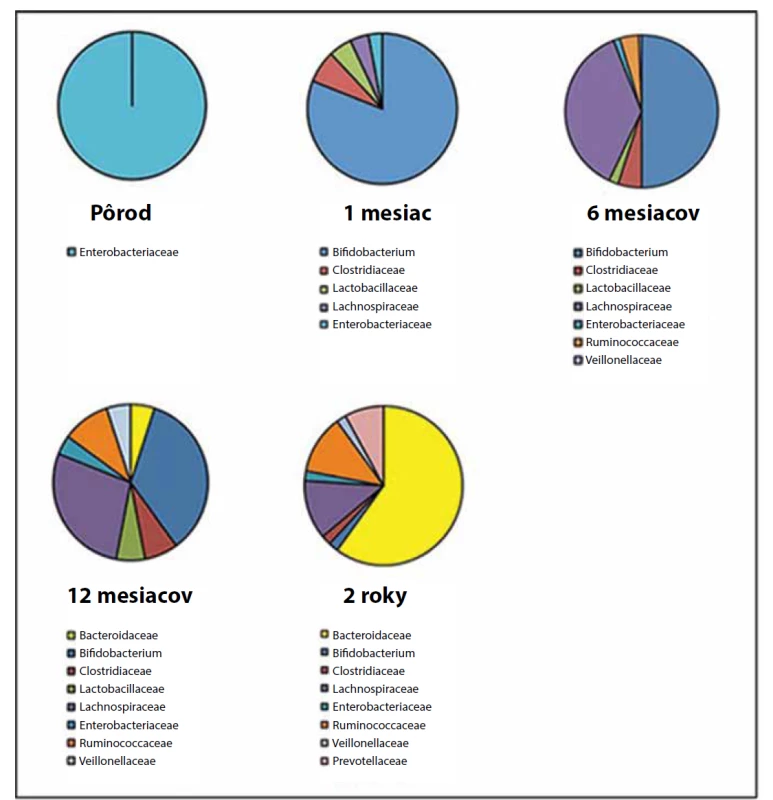
KOLO-RENÁLNA OS
Vzťah medzi črevným mikrobiómom a obličkami je obojstranný a v literatúre sa označuje ako „kolo-renálna os“. Zmeny črevného mikrobiómu môžu byť jedným z dôležitých článkov v patogenéze ochorení obličiek a naopak, niektoré ochorenia obličiek môžu prispievať k narušeniu zloženia črevného mikrobiómu. Presný mechanizmus kooperácie sa zatiaľ jednoznačne nepotvrdil, no postulované sú viaceré hypotézy [1].
a) Zloženie mikrobiómu a jeho vplyv na funkciu obličiek
Predpokladá sa, že črevný mikrobióm ovplyvňuje funkciu obličiek a v nich usadených imunitných buniek prostredníctvom tvorby mastných kyselín s krátkym rťazcom (SCFAs, short chain fatty acids), najmä acetátu, propionátu a butyrátu. Mikroorganizmy v čreve tvoria SCFAs ako koncové produkty fermentácie vlákniny zo stravy a uvoľňujú ich do systémovej cirkulácie. SCFAs inhibujú deacyláciu histónov (remodelácia chromatínu), ovplyvňujú mnohé procesy vrodenej aj získanej imunity, inhibujú maturáciu dendritických buniek a inhibujú schopnosť týchto buniek indukovať proliferáciu CD4+ a CD8+ lymfocytov (protizápalový efekt), stimulujú tvorbu antimikrobiálnych peptidov (napr. katelicidínu) epitelovými bunkami v hrubom čreve a podobne [7–9]. Zaujímavé objavy podnietili sériu experimentov, ktoré študovali efekt SCFAs v uremickom millieu. U myší s experimentálnym modelom akútneho poškodenia obličiek sa po aplikácií acetátu, propionátu a butyrátu pozorovalo zlepšenie funkcie a viability obličiek, znížila sa systémová zápalová odpoveď, bunkový oxidačný stres, bunková infiltrácia a apoptóza. SCFAs tiež zmierňujú účinky hypoxie v epitelových bunkách obličiek tým, že zvyšujú biogenézu mitochondrií. Na druhej strane sa pozorovala zvýšená aktivita autofágických procesov [8].
Na prítomnosť SCFAs odpovedajú receptory exprimované v obličkovom tkanive, napr. Olfr78 (olfactory receptor 78) a Gpr41 (G protein-coupled receptor 41). Olfr78 sa nachádza v juxtaglomerulárnom aparáte obličky, kde reguluje sekréciu renínu ako odpoveď na zvýšenú koncentráciu SCFAs. Olfr78 sú spolu s Gpr41 exprimované aj v endoteli malých systémových ciev, kde regulujú cievnu rezistenciu. Podávanie SCFAs v animálnych modeloch vyvolalo akútne zníženie tlaku krvi [10]. Liečba antibiotikami u myší naopak výrazne zredukovala biomasu mikroorganizmov v mikrobióme, produkciu SCFAs a zvýšila krvný tlak [11].
Intestinálny mikrobióm nemusí mať vždy len pozitívne účinky na obličky. Trimetylamín-N-oxid (TMAO) je vedľajší produkt metabolizmu fosfatidylcholínu v črevnom mikrobióme. Jeho zvýšené plazmatické koncentrácie sa spájajú s významným rizikom kardiovaskulárnych príhod a smrti. TMAO navyše prispieva k vzniku tubulointersticiálnej fibrózy obličiek u obéznych myší [7]. Pacienti s chronickými nefropatiami a vysokou plazmatickou koncentráciou TMAO sa priemerne dožívajú nižšieho veku v porovnaní s chorými, ktorí majú normálne hodnoty TMAO. U hemodialyzovaných pacientov s vysokým TMAO sa pozorovalo vyššie riziko zástavy srdca a vyššia celková mortalita ako u chorých s nižšími koncentráciami TMAO [7]. Za fyziologických okolností črevný mikrobióm produkuje uremické toxíny (indoxyl sulfát, p-kresyl sulfát a iné), ktoré sa absorbujú do krvi a následne vylúčia obličkami. V prípade, že je mikrobióm patologicky zmenený, môže tvorba toxínov excesívne stúpať a početné metabolity poškodzujú renálne tubulárne bunky a tak urýchľujú progresiu chronického obličkového zlyhania [12]. Vysoké koncentrácie p-krezolu v sére sú spojené s vyššou mortalitou hemodialyzovaných pacientov [7].
U detí sa pozorovali možné funkčné prepojenia medzi zložením črevného mikrobiómu a tvorbou močových konkrementov s prevahou oxalátu vápenatého. Pacienti s nefrolitiázou majú menej rôznorodý črevný mikrobióm v porovnaní so zdravými jedincami. Chýbajúce bakteriálne kmene, ktoré produkujú butyrát alebo degradujú oxaláty, môžu vysvetlovať skorý nástup formácie oxalátových kameňov u týchto pacientov [13].
b) Renálne ochorenia a ich vplyv na zmeny mikrobiómu čreva
Ako sme uviedli vyššie, nielen mikrobióm ovplyvňuje funkcie obličiek, ale aj obličky a ich patológie môžu významne modifikovať zloženie a funkciu mikrobiómu [1]. Urémia, metabolická acidóza, retencia tekutín, kongescia v črevných cievach, časté užívanie antibiotík, perorálneho železa, poruchy renín-angiotenzín-aldosterónového systému a iné faktory, ktoré sprevádzajú chronické nefropatie a najmä koncové štádium obličkového zlyhania (ESRD), spôsobujú zmeny zastúpenia jednotlivých skupín mikroorganizmov [14]. Pri urémii sa v čreve výrazne zvyšuje podiel potenciálne patogénnych mikróbov (Brachybacterium, Catenibacterium, Enterobacteriaceae, Halomonadaceae, Moraxellaceae) a znižuje sa kolonizácia mikróbmi, ktoré prevažujú za fyziologických okolností (Lactobacillaceae, Prevotellaceae) [15]. U uremických pacientov sa na rozdiel od zdravých ľudí pozorovala aj masívna kolonizácia duodéna a jejuna aeróbnymi aj anaeróbnymi mikroorganizmami [16]. Metabolické zmeny pri urémii podporujú prerastanie patogénnych kmeňov mikroorganizmov, pričom sa v mikrobióme môže tvoriť veľké množstvo endotoxínu. Endotoxín (hydrofóbna kotva lipopolysacharidu) spúšťa v ľudskom organizme silnú zápalovú odpoveď. Intestinálny mikrobióm navyše fermentuje bielkoviny prítomné v čreve – ide o proces, pri ktorom sa vytvára aj skupina toxických metabolitov (uremických toxínov), napr. p-krezol sulfát a indoxyl sulfát. Porucha črevnej bariéry („leaky gut syndrome“) pri chronickom obličkovom zlyhaní podporuje prestup endotoxínu, p-krezol sulfátu a indoxyl sulfátu do systémovej cirkulácie, čím prispieva k uremickej toxicite, zvýšenej zápalovej aktivite a k progresii chronického obličkového zlyhania a asociovaným kardiovaskulárnym komplikáciám (obr. 2 a 3) [6, 16]. Pri chronickom obličkovom zlyhaní sa veľmi často vyskytuje aj nedostatok vitamínov K a D, čo sa môže tiež čiastočne pripísať vplyvu črevnej dysbiózy [6].
Obr. 2. Koncept vzájomného vzťahu medzi zlyhávajúcimi obličkami a črevným mikrobiómom. Vľavo – Za fyziologických okolností dominancia symbiotických baktérií, prítomnosť intaktnej črevnej bariéry, tvorba defenzínov, hlienu, integrita črevnej sliznice a sekrécie imoglobulínu A (IgA) podporujú symbiózu medzi hostiteľským organizmom a jeho intestinálnym mikrobiómom. Intramurálna imunita kontroluje prerastanie patobiontov v lumene gastrointestinálneho traktu. Vpravo – Metabolické zmeny asociované s progresiou chronického obličkového zlyhávania do ESRD (end-stage renal disease) menia rovnováhu medzi symbiontmi a patobiontmi v prospech prerastania patobiontov (dysbióza). Prerastanie patobiontov indukuje zápal a poškodenie bariérovej funkcie čreva („leaky gut syndrome“), čím dochádza ku zvýšenému prestupu bakteriálnych komponentov a tiež živých baktérií do vnútorného prostredia ľudského organizmu. Tento proces aktivuje imunitu charakterizovanú produkciou proinflamatórnych cytokínov (systémový zápal) a modifikujú sa viaceré procesy počas chronického obličkového zlyhávania – progresia, akcelerovaná aterogenéza a strata bielkovín (upravené podľa Anders a kol., 2013).
Fig. 2. Concept of the mutual relationship between the failing kidneys and gut microbiome. Left – Under physiological circumstances the dominance of symbiotic bacteria, presence of intact intestinal wall, defensins and mucus production, integrity of mucous membranes and immunoglobulin A (IgA) secretion support the symbiosis between the host and its intestinal microbiome. The intramural immunity controls the pathobiont overgrowth in the lumen of the gastrointestinal tract. Right – The metabolic changes associated with CKD (chronic kidney disease) into ESRD (end-stage renal disease) change the equilibrium between the symbionts and pathobionts in favor of the pathobionts (dysbiosis). The overgrowth of pathobionts induces inflammation and damage of the intestinal barrier function („leaky gut syndrome“), which causes increased translocation of bacterial components and living bacteria inside into the human organism. This proces activates the immunity characterised by proinflammatory cytokines production (systemic inflammation) and modifies various processes during during CKD – its progression, accelerated atherogenesis and protein loss (modified according to Anders et al., 2013).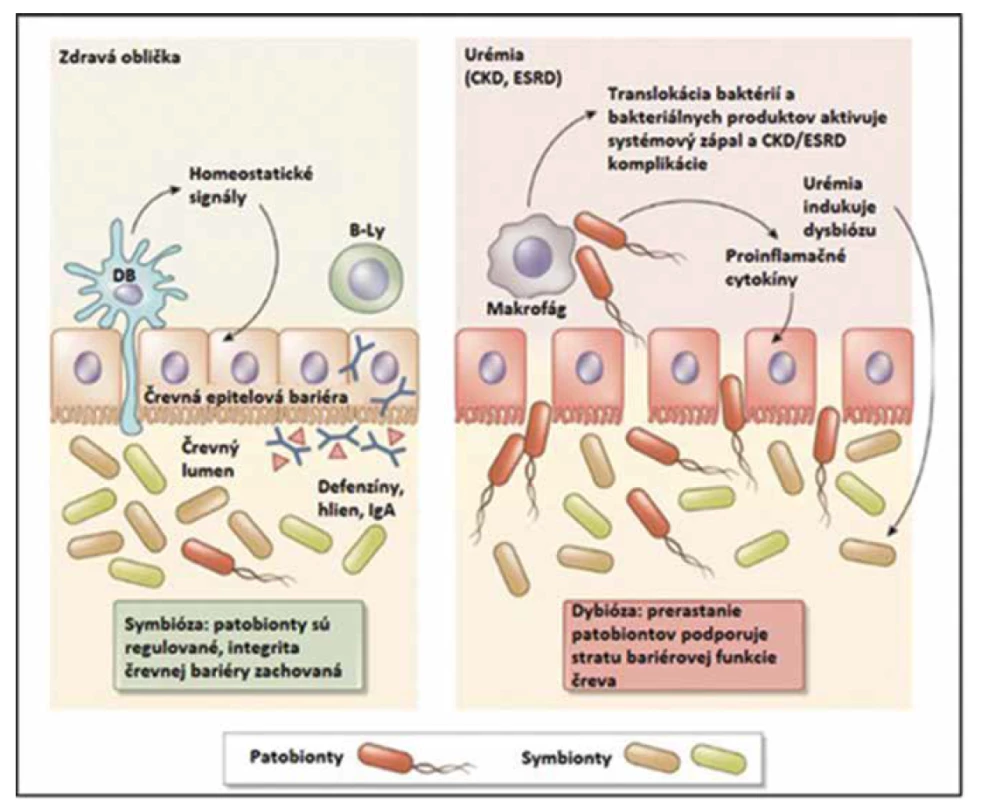
Skratky: DB – dendritická bunka, B-Ly – B-lymfocyt, IgA – imunoglobulín A, CKD – chronické zlyhávanie obličky (chronic kidney disease), ESRD – end-stage renal disease
Abbreviations: DB – dendritic cell, B-Ly – B-lymphocyte, IgA – immunoglobulin A, CKD – chronic kidney disease, ESRD – end-stage renal diseaseObr. 3. Humánny črevný mikrobióm je domovom obrovského množstva baktérií, ktoré tvoria intestinálny rezervoár až 1 gramu endotoxínu. Zmeny črevného mikrobiómu a porucha intestinálnej bariéry u pacientov s chronickým obličkovým zlyhaním (CKD/ /ESRD) sa spájajú s endotoxémiou a akumuláciou mikrobiálnych uremických toxínov, čo vedie k inzulínovej rezistencii, PEW (protein energy wasting), imunitnej dysregulácii a ateroskleróze (upravené podľa Ramezani a kol., 2014).
Fig. 3. The human microbiome is home to a large amount of bacteria which produce the intestinal reservoir of 1 gram of endotoxin. Changes of intestinal microbiome and intestinal barrier disorder in patients with chronic kidney disease/end-stage renal disease (CKD/ESRD) are linked to endotoxemia and microbial uremic toxins accumulation, which leads to insulin resistance, PEW (protein energy wasting), immune dysregulation and atherosclerosis (modified according to Ramezani et al., 2014).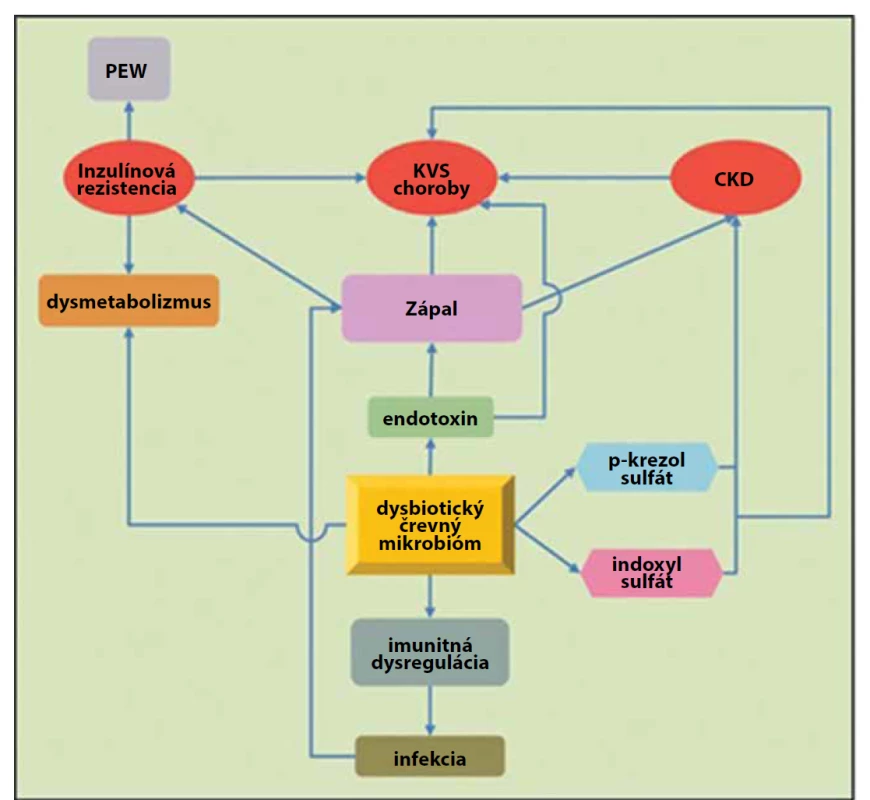
Skratky: PEW – protein energy wasting, KVS choroby – kardiovaskulárne choroby, CKD – chronické zlyhanie obličiek (chronic kidney disease)
Abbreviations: PEW – protein energy wasting, KVS choroby – cardiovascular diseases, CKD – chronic kidney diseaseNielen samotné ochorenie, ale aj rôzny spôsob liečby pacientov s chronickým obličkovým zlyhávaním a ESRD sa môže prejaviť zmenou kompozície črevného mikrobiómu u detí. Crespo-Salgado a jej vedecký tím porovnávali štyri skupiny probandov – pacientov s chronickým obličkovým zlyhávaním na peritoneálnej dialýze, deti na hemodialýze, deti po transplantácii obličky a kontrolnú skupinu zdravých pediatrických pacientov. Pozorovali aj zmeny sérových koncentrácii C-reaktívneho proteínu (CRP), D-laktátu, p-krezyl sulfátu a indoxyl sulfátu v týchto skupinách [17]. V porovnaní s kontrolou u pacientov s peritoneálnou dialýzou dochádza k relatívnemu zníženiu zastúpenia Firmicutes a Actinobacteria a výraznému navýšeniu množstva Enterobacteriaceae. V skupine detí na hemodialýze zas dochádza k relatívne početnejšiemu zastúpeniu Bacteroidetes. Pri porovnaní hemodialýzy a peritoneálnej dialýzy sa pozorovalo zvýšené percento proteobaktérií v skupine deti na peritoneálnej dialýze, čo môže byť spojené aj so zvýšenou suplementáciou perorálnym železom u týchto pacientov. Bifidobaktérie sú signifikantne menej zastúpené v črevnom mikrobióme detí na peritoneálnej dialýze a tiež po transplantácii obličky. Alfa diverzita (počet prítomných bakteriálnych druhov) sa znížila u pacientov na peritoneálnej dialýze a po transplantácii obličky. Pacienti s ESRD majú zvýšené sérové koncentrácie p-krezyl sulfátu a indoxyl sulfátu. Dáta z tejto štúdie nepredpokladajú, že by existovala korelácia medzi alfa diverzitou črevného mikrobiómu a koncentráciami CRP, D-laktátu alebo uremických toxínov v sére. Renálna transplantácia spôsobuje normalizáciu uremických toxínov (p-krezyl sulfátu a indoxyl sulfátu), avšak sama o sebe pravdepodobne nedokáže zvrátiť zníženú bakteriálnu diverzitu [17].
V klinike sa skúšali viaceré intervencie, pomocou ktorých sa vedci snažili obnoviť črevnú symbiózu, neutralizovať bakteriálny endotoxín alebo adsorbovať uremické toxíny vyprodukované patologicky zmeneným črevným mikrobiómom pri chronickom obličkovom zlyhaní a ESRD. Animálne aj humánne experimenty podporujú tvrdenie, že prebiotiká a probiotiká by mohli mať terapetický účinok pri udržiavaní metabolicky balansovaného črevného mikrobiómu a pri spomalení progresie chronického obličkového zlyhania a uremických komplikácií [16]. Prebiotiká sú ľudským organizmom nestráviteľné súčasti stravy, ktoré stimulujú rast a aktivitu jednej baktérie alebo malej skupiny baktérií v hrubom čreve. Zástupcami prebiotík sú napríklad inulín, frukto-, galakto-, sója - alebo xylo-oligosacharidy a pyrodextríny. Prebiotiká u ľudí podporujú rast bifidobaktérií a laktobacilov, čím nepriamo potláčajú aktivitu ostatných baktérií, napr. Bacteroides, klostrídií a enterobaktérií. Predbežné výsledky štúdii naznačujú, že inulín podporuje rast bifidobaktérií, pomáha pri redukcii hmotnosti, redukuje zápal a zlepšuje metabolické funkcie v organizme. Probiotiká sú zasa prípravky obsahujúce živé baktérie (bifidobaktérie, laktobacily alebo streptokoky), ktoré priamo menia zloženie črevného mikrobiómu a ovplyvňujú zápalovú aktivitu [16].
Primárny nefrotický syndróm je najčastejšie ochorenie glomerulov v populácii detských pacientov. Predpokladá sa, že dysfunkcia Treg (T-regulačných) lymfocytov hrá kľúčovú úlohu v patogenéze nefrotického syndrómu, aj keď nie je úplne presne známe, akým spôsobom sa poškodzujú podocyty glomerulov a čo vyvoláva proteinúriu. Existujú dve hypotézy – Treg môžu redukovať oxidatívny efekt cirkulujúcich buniek počas skorej imunitnej odpovede, ktorý je toxický pre podocyty, alebo Treg suprimujú overexpresiu CD80 receptorov na podocytoch [18]. Je pravdepodobné, že aj črevná dysbióza prispieva k imunologickej dysregulácii. Štúdia Kanga a jeho spolupracovníkov sledovala zmeny črevného mikrobiómu u detí pred začatím terapie a po 4 týždňoch iniciálnej liečby perorálnym prednizónom, vitamínom D a CaCO3, v období prvej remisii ochorenia. Diverzita črevného mikrobiómu sa počas liečby primárneho nefrotického syndrómu zásadne nezmenila. Zaujímavosťou však je, že počas liečby dochádza k navýšeniu množstva baktérií produkujúcich mastné kyseliny s krátkym reťazcom (SCFAs), napr. Romboutsia, Stomatobaculum a Cloacibacillus [19]. SCFAs, ktoré sú syntetizované v črevnom mikrobióme, indukujú diferenciáciu Treg lymfocytov [18]. Zároveň dochádza k zníženiu aktivity v metabolizme zlúčenín selénu (ktoré môže následne prispievať k poruche udržiavania redoxnej homeostázy v bunkách a ku zníženiu imunitnej odpovede), k zníženej biosyntéze izoflavonoidov (zhoršenie antioxidačného statusu je nepriaznivé pre obličky) a k poruchám vo fosfatidyl-inozitolovom signálnom systéme (porucha bunkovej signalizácie a prenosu látok cez bunkové membrány) [19]. V inej klinickej štúdii sa pozorovalo, že črevná dysbióza spôsobujúca pokles tvorby butyrátu môže byť spojená s defektnou indukciou a diferenciáciou periférnych Treg, čo by mohlo vyústiť do relapsu idiopatického nefrotického syndrómu. Metagenomické analýzy črevného mikrobiómu preukázali signifikantne nižšie množstvo butyrát-produkujúcich baktérii aj fekálneho butyrátu u detí s relapsom nefrotického syndrómu ako u zdravých detí alebo u detí bez relapsu ochorenia. CirkulujúceTreg lymfocyty boli znížené v skupine pacientov s relapsom aj bez relapsu idiopatického nefrotického syndrómu [18, 20].
U detí s chronickými nefropatiami sa často vyžaduje aj špecifické stravovanie (napr. potraviny s nízkym obsahom draslíka, fosforu, soli alebo nižší príjem tekutín), ktoré v kombinácii s liečbou významne prispieva k abnormálnej črevnej mikrobiálnej populácii a môže tiež oslabiť intestinálnu bariéru [6, 15].
Osobitnú pozornosť nefrológov si vyžadujú predčasní novorodenci. Je dobre známe, že predčasne narodené deti majú nižší absolútny počet nefrónov, vyššie percento nezrelých nefrónov a vyššie riziko rýchlej progresie chronického obličkového zlyhania oproti donoseným deťom. Tento fakt vplýva aj na vývoj črevného mikrobiómu. Nezrelosť čreva a jeho mikrobiómu sa môže dať do súvislosti s predčasnou ruptúrou plodových membrán, infekciami matky, cisárskym rezom, perinatálnym a postnatálnym podávaním širokospektrálnych antibiotík a iných liečiv (ktoré môžu navyše ovplyvňovať aj permeabilitu črevnej bariéry), neadekvátnou výživou a vystavením organizmu rezistentným mikroorganizmom počas dlhodobých hospitalizácií. V porovnaní so skupinou donosených detí, ktoré sa narodili prirodzenou vaginálnou cestou, sa u predčasne narodených detí pozorovalo zvýšené zastúpenie enterokokov, enterobakterov, laktobacilov, stafylokokov a relatívne malé množstvo kmeňov Bifidobacterium, Bacteroides a Atopobium [6].
Západný spôsob života s vysokou konzumpciou soli významne prispieva k rozvoju hypertenzie a kardiovaskulárnych ochorení. Vysoký príjem soli môže navyše podporovať autoimunitné reakcie indukciou T-helperových buniek (Th17), čo tiež prispieva k hypertenzii. Indukcia Th17 buniek závisí aj od črevnej mikrobioty. V myšacích modeloch sa preukázalo, že vysoký príjem soli v strave ovplyvňuje zloženie črevnej mikrobioty – najmä depléciou Lactobacillus murinus. Experimentálna liečba myší pomocou L. murinus, zdá sa, pomáha predchádzať vzniku „salt-sensitive“ hypertenzie prostredníctvom modulácie Th17 buniek. Analogické výsledky autori dokázali aj v pilotnej humánnej štúdii [21]. Existuje obrovské množstvo prác, ktoré pojednávajú o možnom vzťahu renálnych ochorení a zmien črevnej mikrobióty, väčšinou však ide o experimentálne, nie humánne štúdie. V ostatných rokoch sme sa obohatili množstvom nových informácií, no viacero klinických aspektov stále zostáva neznámych, preto je možné súhlasiť s autorom nasledujúceho textu – „zostáva nejasným, či zmeny v mikrobióme a asociovaných metabolitoch sú výsledkom alebo naopak hnacou silou ochorení uropoetického traktu“ [22].
UROBIÓM
V urológii a nefrológii sa ešte donedávna platila dogma, že moč a sliznice močových ciest zdravých ľudí sú úplne sterilné. Preto sa sledovanie mikrobiómu močových ciest iniciálne nezahrnulo ani do prelomového projektu the Human Microbiome Project v roku 2008 [23]. Vďaka rýchlym pokrokom v metódach sekvenovania ďalšej generácie sa napokon táto desaťročia zaužívaná dogma vyvrátila. Napriek tomu, že kultivácia moču sa stále považuje za excelentnú analytickú metódu na identifikáciu rýchlo-rastúcich a prototypických uropatogénov, má svoje diagnostické obmedzenia a limitácie. Klasická kultivácia nedokáže zachytiť množstvo pomaly rastúcich alebo anaeróbnych mikroorganizmov („uncultivated microorganisms“), ako napr. Corynebacterium alebo Ureaplasma species. Sekvenovaním bakteriálnej 16S rRNA a pomocou EQUC (enhanced quantitative urine culture) možno identifikovať u každého človeka obrovské množstvo mikrobiálnych organizmov, ktoré vytvárajú špecifický močový mikrobióm (tzv. urobióm) [23, 24]. Limitáciou metódy využívajúcej sekvenovanie bakteriálnej 16S rRNA je fakt, že nerozlišuje medzi žijúcimi, mŕtvymi alebo rozpadnutými baktériami. Na druhej strane, aj mŕtve a rozpadnuté baktérie boli raz v ľudskom tele živé, a preto prispievali k tvorbe mikrobiómu močových ciest. Sekvenovanie nám teda dokáže poskytnúť informácie, ktoré by sme klasickou kultiváciou alebo pomocou EQUC nedokázali získať [25]. Na základe osobných skúseností spoluautorov možno konštatovať, že v dnešnej dobe sa 16S rRNA sekvenovanie využíva na diagnostikovanie vzoriek z rôznych tkanív a telesných tekutín na viacerých európskych pracoviskách. Použitie tejto metodiky pri vzorkách moču sa na väčšine z nich stále považuje za experimentálne, no v praxi môže byť užitočným pomocníkom pri diagnostike komplikovanejších stavov, kedy klasická kultivácia moču je negatívna a 16S rRNA identifikuje patogén zodpovedný za klinický obraz.
Urobióm je prítomný v močových cestách každého človeka, dokonca aj u novorodencov. U detí do 24 mesiacov veku sú v urobióme zastúpené najmä Prevotella, Peptoniphilus, Escherichia, Veilonella a Finegoldia. U detí s infekciami močových ciest sa percentuálne zastúpenie Escherichia coli signifikantne zvyšuje. Deti, ktoré užívali antibiotiká dva týždne pred odberom moču, mali relatívne vyššie zastúpenie baktérií rodu Achromobacter [26]. Vekom sa postupne mení skladba urobiómu, u dospelých zdravých ľudí sú najčastejšie detegované baktérie Lactobacillus, Streptococcus, Prevotella a Gardnerella [25]. Zloženie urobióm u žien a mužov sa líši. Ženy majú zväčša heterogénnejšiu populáciu mikroorganizmov s dominantnou baktériou Lactobacillus, kým u mužov je najviac zastúpené Corynebacterium [27]. K miernym zmenám dochádza aj starnutím organizmu [25, 28]. Vo všeobecnosti platí, že rozdiely v záchyte mikroorganizmov môžu byť podmienené aj metódou odberu moču, pričom najspoľahlivejšia je suprapubická aspirácia a na druhom mieste transuretrálna katetrizácia, pri ktorých dochádza k minimálnej vulvovaginálnej kontaminácii [25].
INFEKCIE MOČOVÝCH CIEST
Patogenéza infekcií močových ciest sa vysvetľuje ascendentným šírením mikroorganizmov v močovom trakte. Keďže väčšina patogénnych baktérií pochádza z čreva, diverzita črevného mikrobiómu môže mať potenciálnu úlohu pri vzniku infekcií močových ciest [29]. Dokumentuje to aj fínska prospektívna štúdia z roku 2018, ktorá porovnávala črevný mikrobióm pediatrických pacientov s febrilnými infekciami močových ciest s intestinálnym mikrobiómom zdravých detí. Zistilo sa, že pacienti s prebiehajúcou infekciou močových ciest majú vyššie relatívne zastúpenie Escherichia coli (1,9 %) oproti kontrolnej skupine zdravých jedincov (0,5 %). Koncentrácie železa a laktoferínu v stolici v obidvoch skupinách detí boli porovnateľné. Profilácia črevného mikrobiómu preukázala signifikantné rozdiely v bakteriálnych kmeňoch medzi skupinami, čo podporuje asociáciu medzi vnútorným prostredím čreva a rizikom infekcií močových ciest u detí [29, 30].
V zaujímavej štúdií Magruder a spol. prospektívne sledovali vzťah medzi zložením črevného mikrobiómu u pacientov s transplantovanou obličkou a rizikom vzniku bakteriúrie a infekcie močových ciest. Už jednopercentné navýšenie relatívneho zastúpenia escherichií v črevnom mikrobióme zvyšuje riziko vzniku bakteriúrie a infekcií močových ciest spôsobených escherichiou. Rovnako jednopercentné zvýšenie relatívneho zastúpenia enterokokov v intestinánej mikrobiote je nezávislým rizikovým faktorom vzniku enterokokovej bakteriúrie, cystitídy alebo pyelonefritídy. Všetky tieto výsledky podporujú existenciu kolorenálnej osi a naznačujú, že modulácia črevného mikrobiómu by mohla byť novou stratégiou v prevencii infekcií močových ciest [29, 31].
Nedávne výskumy preukázali, že nielen črevný, ale aj vaginálny a hlavne močový mikrobióm môžu mať signifikantný vplyv na reguláciu patologických procesov v močových cestách [32]. Komenzálne baktérie žijúce na slizniciach močových ciest môžu inhibovať alebo blokovať rast uropatogénnych baktérii tvorbou inhibičných alebo baktericídnych molekúl. Vďačným príkladom sú laktobacily, nakoľko dokážu predchádzať adherencii, rastu a kolonizácii uropatogénnych baktérií. Ich antibakteriálna aktivita sa dá podobne ako v genitálnom trakte vysvetliť miernou acidifikáciou slizníc, inhibíciou adhézie patogénov, tvorbou antibakteriálnych metabolitov (peroxid vodíka, bakteriocín a iné), produkciou vitamínov, imunomodulátorov a tiež synergickou aktivitou s imunitným systémom hostiteľa [24, 33]. Je tiež známe, že baktérie s vysokou produkciou mastných kyselín s krátkym reťazcom (SCFAs) môžu stimulovať lokálnu produkciu antimikrobiálneho katelicidínu v epitelových bunkách močových ciest, čím zvyšujú odolnosť močového traktu voči uropatogénnym baktériám [34]. Tieto poznatky sú využiteľné najmä pri rekurentných infekciách močových ciest. S každou novou infekciou rastie rezistencia vyvolávajúcich mikroorganizmov na používané antibiotiká, čo komplikuje liečbu týchto pacientov. Hľadajú sa preto nové alternatívy účinnej terapie.
Fekálna mikrobiálna transplantácia (FMT) je úspešnou metódou liečby u pacientov s rekurentnými infekciami vyvolanými Clostridium difficile, nakoľko prispieva k normalizácii črevného mikrobiómu a eradikácii patologických kmeňov baktérií. Tariq a spol. sledovali vplyv FMT na frekvenciu výskytu infekcií močových ciest u pacientov, ktorí rok pred výkonom FMT (kvôli rekurentným klostrídiovým črevným infekciám) prekonali 3 alebo viac epizód infekcií močových ciest [35]. Je zaujímavé, že u chorých s klostrídiovou infekciou, ktorí podstúpili FMT, došlo k sigifikantnému poklesu výskytu infekcií močových ciest aj zníženiu rezistencie mikroorganizmov voči používaným antibiotikám. Predpokladá sa, že „presýtenie“ čreva zdravými mikrobiálnymi kmeňmi pomocou fekálnej mikrobiálnej transplantácie dekolonizuje multirezistentné mikrobiálne kmene a znižuje riziko rekurentných infekcií močových ciest. Kolonizácia čreva multirezistentnou Escherichiou coli typ ST131 sa znížila a naopak, stúpla kolonizácia menej patogénnymi typmi E. coli alebo inými komenzálmi. Napriek limitáciám tejto štúdie (malý počet probandov), majú jej výsledky pozitívne ohlasy vo vedeckej obci a v budúcnosti po detailnejšom preskúmaní tohto fenoménu môžu viesť k zníženému používaniu antibiotík, zníženiu morbidity a tiež ceny liečby rekurentných infekcií močových ciest [35].
V podobnom duchu sa začali klinické štúdie, ktoré mali za úlohu zistiť vplyv „močovej transfúzie“ na rekurenciu infekcií močových ciest. Epidemiologické a placebom-kontrolované štúdie demonštrovali, že arteficiálne navodenie asymptomatickej bakteriúrie (dnes najpoužívanejším kmeňom je Escherichia coli 83972) chráni hostiteľa pred symptomatickými infekciami spôsobenými virulentnejšími kmeňmi mikroorganizmov. Inokulačný protokol je štandardizovaný a výsledky sú reprodukovateľné aj u ďalších pacientov. Prvým krokom je liečba vhodnými antibiotikami, ktorá zabezpečí sterilizáciu moču. Po presne predpísanom čase sa realizuje katetrizácia močového mechúra, pôvodný moč sa vyprázdni a následne sa do mechúra instiluje 30 ml roztoku s E. coli 83972 (105 CFU/ml). V závislosti od výsledku sa procedúra môže opakovať počas nasledujúcich troch dní. Procedúra je bezpečná a pacienti uvádzajú v relatívne krátkom čase vymiznutie symptómov infekcií močových ciest [36].
V laickej aj odbornej verejnosti je už dlhodobo zaužívaný postulát, že brusnicový džús a prípravky s brusnicovým extraktom by mohli byť užitočným pomocníkom pri znižovaní rekurencií infekcií močových ciest. Nedávna in vitro štúdia napríklad poukazuje na zistenie, že určité oligosacharidy v brusniciach by mohli byť zodpovedné za zníženú tvorbu biofilmu uropatogénnou E. coli. Oligosacharidy však nedokázali inhibovať bakteriálny rast [37]. Podávanie brusnicového džúsu alebo tabliet s brusnicovým extraktom a jeho efekt pri rekurentných infekciách močových ciest (najmä pri rekurentnej cystitíde) boli sledované v mnohých klinických a placebom-kontrolovaných štúdiach u dospelých aj pediatrických pacientov. Výsledky takejto „alternatívnej“ terapie však nie sú jednoznačné a rutinne sa neodporúčajú [38, 39].
ZÁVER
Medzi mikroorganizmami a ľudským organizmom existuje veľmi špecifický, dynamický a symbiotický vzťah, vzájomne sa môžu pozitívne aj negatívne ovplyvňovať. Črevný mikrobióm a obličky u človeka intenzívne komunikujú („kolo-renálna os“) – napr. prostredníctvom tvorby SCFAs je možné regulovať krvný tlak, zvýšená produkcia TMAO zasa môže prispievať k zvýšenej morbidite. Dnes už je známe, že sliznice močových ciest a moč nie sú sterilné, ale osídľuje ich veľké množstvo mikróbov (tzv. urobióm), u detí sú najčastejšími Prevotella, Peptoniphilus, Escherichia, Veilonella a Finegoldia. Ľudský intestinálny mikrobióm aj urobióm môžu hrať patogenetickú úlohu pri infekciách močových ciest. Existujú dôkazy, že zmena zloženia a relatívneho zastúpenia bakteriálnych kmeňov v črevnom mikrobióme môže zvyšovať riziko bakteriúrie a infekcií močových ciest u detí.
Modulácia črevného mikrobiómu môže byť novou stratégiou v prevencii infekcií močových ciest. V retrospektívnej štúdii sa pozorovalo, že u pacientov s klostrídiovou infekciou liečených fekálnou mikrobiálnou transplantáciou sa znížil výskyt infekcií močových ciest a rezistencia mikroorganizmov voči používaným antibiotikám. Presýtenie čreva zdravými mikróbmi pomocou fekálnej mikrobiálnej transplantácie pravdepodobne dekolonizuje multirezistentné mikrobiálne kmene a tým znižuje riziko rekurencie infekcií močových ciest.
Článok vznikol za podpory grantu VEGA 1/0311/21.
Došlo: 1. 3. 2021
Přijato: 2. 6. 2021
Korespondující autorka:
Prof. MUDr. Ľudmila Podracká, CSc.
Detská klinika
Národný ústav detských chorôb
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: podracká12@yahoo.com
Zdroje
1. Rabb H, Pluznick J, Noel S. The microbiome and acute kidney injury. Nephron 2018; 140 (2): 120–123.
2. Jagodzinski A, Zielinska E, Laczmanski L, Hirnle L. The early years of life. Are they influenced by our microbiome? Ginekol Pol 2019; 90 (4): 228–232.
3. Young VB. The role of the microbiome in human health and disease: an introduction for clinicians. BMJ 2017; 356: j831.
4. Tanaka M, Nakayama J. Development of the gut microbiota in infancy and its impact on health in later life. Allergol Int 2017; 66 (4): 515–522.
5. Collado MC, Rautava S, Aakko J, et al. Human gut colonisation may be initiated in utero by distinct microbial communities in the placenta and amniotic fluid. Sci Rep 2016 Mar 22; 6 : 23129.
6. Vasylyeva TL, Singh R. Gut microbiome and kidney disease in pediatrics: does connection exist? Front Microbiol 2016; 7 : 235.
7. Gong J, Noel S, Pluznick JL, et al. Gut microbiota-kidney crosstalk in acute kidney injury. Semin Nephrol 2019; 39 (1): 107–116.
8. Andrade-Oliveira V, Amano MT, Correa-Costa M, et al. Gut bacteria products prevent AKI induced by ischemia-reperfusion. J Am Soc Nephrol 2015; 26 (8): 1877–1888.
9. Schauber J, Svanholm C, Termén S, et al. Expression of the cathelicidin LL-37 is modulated by short chain fatty acids in colonocytes: relevance of signalling pathways. Gut 2003 May; 52 (5): 735–441.
10. Natarajan N, Hori D, Flavahan S, et al. Microbial short chain fatty acid metabolites lower blood pressure via endothelial G protein-coupled receptor 41. Physiol Genomics 2016; 48 (11): 826–834.
11. Pluznick JL, Protzko RJ, Gevorgyan H, et al. Olfactory receptor responding to gut microbiota-derived signals plays a role in renin secretion and blood pressure regulation. Proc Natl Acad Sci U S A 2013; 110 (11): 4410–4415.
12. Satoh M, Hayashi H, Watanabe M, et al. Uremic toxins overload accelerates renal damage in a rat model of chronic renal failure. Nephron Exp Nephrol 2003; 95 (3): e111–e118.
13. Denburg MR, Koepsell K, Lee JJ, et al. Perturbations of the gut microbiome and metabolome in children with calcium oxalate kidney stone disease. J Am Soc Nephrol 2020 Jun; 31 (6): 1358–1369.
14. Anders HJ, Andersen K, Stecher B. The intestinal microbiota, a leaky gut, and abnormal immunity in kidney disease. Kidney Int 2013 Jun; 83 (6): 1010–1016.
15. Vaziri ND, Wong J, Pahl M, et al. Chronic kidney disease alters intestinal microbial flora. Kidney Int 2013; 83 (2): 308–315.
16. Ramezani A, Raj DS. The gut microbiome, kidney disease, and targeted interventions. J Am Soc Nephrol 2014; 25 (4): 657–670.
17. Crespo-Salgado J, Vehaskari VM, Stewart T, et al. Intestinal microbiota in pediatric patients with end stage renal disease: a Midwest Pediatric Nephrology Consortium study. Microbiome 2016; 4 : 50.
18. Crespo-Salgado J, Stewart T, Aviles DH. Does dysbiosis in intestinal microbiome plays a role in children with relapsing idiopathic nephrotic syndrome? Am J Nephrol 2018; 47 (3): 162–163.
19. Kang Y, Feng D, Law HK, et al. Compositional alterations of gut microbiota in children with primary nephrotic syndrome after initial therapy. BMC Nephrol 2019; 20 : 434.
20. Tsuji S, Suruda C, Hashiyada M, et al. Gut microbiota dysbiosis in children with relapsing idiopathic nephrotic syndrome. Am J Nephrol 2018; 47 : 164–170.
21. Wilck N, Matus MG, Kearney SM, et al. Salt-responsive gut commensal modulates TH17 axis and disease. Nature 2017; 551 (7682): 585–589.
22. Jones-Freeman B, Chonwerawong M, Marcelino VR, et al. The microbiome and host mucosal interactions in urinary tract diseases. Mucosal Immunol 2021; 14 : 779–792. https://doi.org/10.1038/ s41385-020-00372-5.
23. Magistro G, Stief CG. The urinary tract microbiome: the answer to all our open questions? Eur Urol Focus 2019 Jan; 5 (1): 36–38.
24. Lee KW, Song HY, Kim YH. The microbiome in urological diseases. Investig Clin Urol 2020; 61 (4): 338–348.
25. Aragón IM, Herrera-Imbroda B, Queipo-Ortuño MI, et al. The urinary tract microbiome in health and disease. Eur Urol Focus 2018 Jan; 4 (1): 128–138.
26. Kinneman L, Zhu W, Wong WSW, et al. Assessment of the urinary microbiome in children younger than 48 months. Pediatr Infect Dis J 2020 Jul; 39 (7): 565–570.
27. Gerber D, Forster CS, Hsieh M. The role of the genitourinary microbiome in pediatric urology: a review. Curr Urol Rep 2018; 19 (1): 13.
28. Siddiqui H, Nederbragt AJ, Lagesen K, et al. Assessing diversity of the female urine microbiota by high throughput sequencing of 16S rDNA amplicons. BMC Microbiol 2011; 11 : 244.
29. Piteková B, Podracká Ľ. Črevná mikrobiota a infekcie močových ciest u detí. Lek Obz 2020, 69 (10): 339–340.
30. Paalanne N, Husso A, Salo J, Pieviläinen O, et al. Intestinal microbiome as a risk factor for urinary tract infections in children. Eur J Clin Microbiol Infect Dis 2018 Oct; 37 (10): 1881–1891.
31. Magruder M, Sholi AN, Gong C, et al. Gut uropathogen abundance is a risk factor for development of bacteriuria and urinary tract infection. Nat Commun 2019 Dec 4; 10 (1): 5521.
32. Flores-Mireles AL, Walker JN, Caparon M, Hultgren SJ. Urinary tract infections: epidemiology, mechanisms of infection and treatment options. Nat Rev Microbiol 2015; 13 (5): 269–284.
33. Iannitti T, Palmieri B. Therapeutical use of probiotic formulations in clinical practice. Clin Nutr 2010; 29 (6): 701–725.
34. Chromek M, Slamová Z, Bergman P, et al. The antimicrobial peptide cathelicidin protects the urinary tract against invasive bacterial infection. Nat Med 2006 Jun; 12 (6): 636–641.
35. Tariq R, Pardi DS, Tosh PK, et al. Fecal microbiota transplantation for recurrent Clostridium difficile infection reduces recurrent urinary tract infection frequency. Clin Infect Dis 2017 Oct 30; 65 (10): 1745–1747.
36. Wullt B, Svanborg C. Deliberate establishment of asymptomatic bacteriuria – A novel strategy to prevent recurrent UTI. Pathogens 2016; 5 (3): 52.
37. Sun J, Marais JP, Khoo C, et al. Cranberry (Vaccinium macrocarpon) oligosaccharides decrease biofilm formation by uropathogenic Escherichia coli. J Funct Foods 2015; 17 : 235–242.
38. Hisano M, Bruschini H, Nicodemo AC, Srougi M. Cranberries and lower urinary tract infection prevention. Clinics (Sao Paulo) 2012; 67 (6): 661–668.
39. Uptodate.com (2021).
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2021 Číslo 7- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Nová stratégia liečby X-viazanej hypofosfatemickej rachitídy
- Funkce kongenitální solitární ledviny u dětí – srovnání glomerulární filtrace dle kreatininu a dle cystatinu C
- Nezapomínejme na meningokoka
- Laryngomalacie – kdy je vhodná chirurgická léčba?
- Ľudský mikrobióm a renálne ochorenia u detí
- Neoperačná liečba pectus excavatum u detí
- Resuscitace a podpora poporodní adaptace novorozence 2021
- Stanovisko mezioborového panelu ČLS JEP ke strategii adaptace České republiky na epidemii onemocnění COVID-19
- Lekár, vedec, pedagóg – vzácne 85. životné jubileum profesora MUDr. Jána Buchanca, DrSc.
- Z histórie medicíny: Ebersov papyrus
- XXXIII. SLOVENSKO-POĽSKÉ VOJTEKOVE-RUDNIKOVE DNI DETSKEJ PNEUMOFTIZEOLÓGIE A IMUNOALERGOLÓGIE
- XXVI. Luhačovické pediatrické dny – správa z konferencie
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Laryngomalacie – kdy je vhodná chirurgická léčba?
- Resuscitace a podpora poporodní adaptace novorozence 2021
- Neoperačná liečba pectus excavatum u detí
- Nová stratégia liečby X-viazanej hypofosfatemickej rachitídy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



