-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAnalgetický potenciál různých typů cukerných roztoků v prevenci procedurální bolesti u zralých novorozenců
The analgesic potential of different types of sugar solutions in prevention of procedural pain in term infants
Background:
In the prevention of procedural pain in neonates of all gestational categories mainly sugar solutions of different types and concentrations are used. Even though this method studying the effect of sugar solutions in concentrations from 5 to 66% has been certified by series of works, no gold standard has been established. An alternative to the use of sugar solutions is breast milk or sensory saturation (complex effect on sensory perceptions of the child).Methods:
In the present paper, we evaluated parameters of electrical skin conductance (ESC) in a group of full-term or near-term infants in a well-defined painful complaint, which was capillary blood sampling for mandatory screening.Results and conclusion:
We evaluated the effectiveness of four different concentrations of sugar solutions, widely available and used in clinical practice. We have shown that there are statistically significant differences between genders in selected parameters of the electrical conductivity of the skin as well as differences in the change of character behavior in response to a painful stimulus. We found statistically significant differences in the analgesic effect of certain types and concentrations of sugar solutions.Key words:
electrical skin conductance, infants, pain, algesimetry, analgesic effect
Autoři: J. Macko 1; P. Humpolíček 2; D. Moravčíková 3; M. Kotíková 1
Působiště autorů: Novorozenecké oddělení Krajské nemocnice T. Bati, Zlín primář MUDr. J. Macko 1; Centrum polymerních materiálů, Fakulta technologická, Univerzita Tomáše Bati, Zlín vedoucí doc. Ing. R. Čermák, Ph. D. 2; Ústav porodní asistence, Institut zdravotnických studií, Univerzita Tomáše Bati, Zlín vedoucí Mgr. L. Reslerová, Ph. D. 3
Vyšlo v časopise: Čes-slov Pediat 2013; 68 (4): 234-245.
Kategorie: Původní práce
Souhrn
Úvod:
V prevenci procedurální bolesti u novorozenců všech gestačních kategorií se přednostně uplatňují cukerné roztoky různých typů a koncentrací. Pro tento postup, i když ověřený řadou prací, neexistuje zlatý standard a v publikacích, které o této problematice pojednávají, se používají cukerné roztoky koncentrací od 5 do 66 %. Mimo aplikaci cukerných roztoků se jako alternativa uplatňuje použití mateřského mléka, případně senzorická saturace (komplexní působení na smyslové vjemy dítěte).Metody:
V předkládané práci hodnotíme vliv cukerných roztoků na vnímání bolesti měřené pomocí parametrů ESC u skupiny donošených či téměř donošených novorozenců při přesně definovaném bolestivém stimulu, kterým byl odběr kapilární krve na povinná screeningová vyšetření.Výsledky a závěry:
Ve studii byla hodnocena efektivita čtyř různých koncentrací cukerných roztoků, běžně dostupných a používaných v klinické praxi. Prokázali jsme, že existují statisticky průkazné rozdíly mezi pohlavími u vybraných parametrů elektrické kožní vodivosti i rozdíly ve změně charakteru chování v reakci na bolestivý podnět. Zjistili jsme statisticky významné rozdíly v analgetickém účinku některých typů a koncentrací cukerných roztoků.Klíčová slova:
elektrická vodivost kůže, novorozenci, bolest, algezimetrie, analgetický efektÚvod
Bolest u novorozenců je velmi nežádoucí nejen z etických a humánních důvodů, ale také proto, že zejména prolongovaná bolest může vést k inhibici růstu a vývoje dítěte a může být spojována se zvýšenou morbiditou a mortalitou novorozenců [1, 2, 3, 4, 5, 6]. Potřeba objektivního hodnocení bolesti je doložena skutečností, že v uplynulých 25 letech bylo publikováno více než 40 skórovacích schémat a hodnotících škál bolesti [7, 8]. Jen některé z nich byly obecně uznány jako validní. Obecnou charakteristikou validních schémat je implementace behaviorálních a fyziologických parametrů. Některá schémata navíc zařazují biologické a konceptuální faktory [9, 10]. Přesto je však zřejmé, že exaktní měření bolesti u neverbálních pacientů je stále nedokonalé. Bolest a agitovanost či stres nejsou někdy optimálně rozlišitelné a navíc stále chybí validní měření chronické bolesti [11, 12, 13].
Je tedy možno konstatovat, že v současné době neexistuje zlatý standard pro měření a hodnocení bolesti u těchto pacientů. Neschopnost či nemožnost verbalizovat bolest ovšem neznamená, že jedinec bolest necítí či nevnímá. Naopak se jeví jako velmi pravděpodobné, že schopnost percipovat nociceptivní stimuly jako bolestivé má již plod, a to přibližně od 20. týdne gestace [14, 15, 16, 54], tedy od okamžiku, kdy je prokázána funkční schopnost a zralost subkortikálních center v mozku, především tzv. subplate zone (obr. 1) [17, 55].
Obr. 1. Kortikální neuronální migrace. (Pearson BJ, Doe CQ. Annual Review of Cell and Developmental Biology 2004; Vol. 20: 619–647). 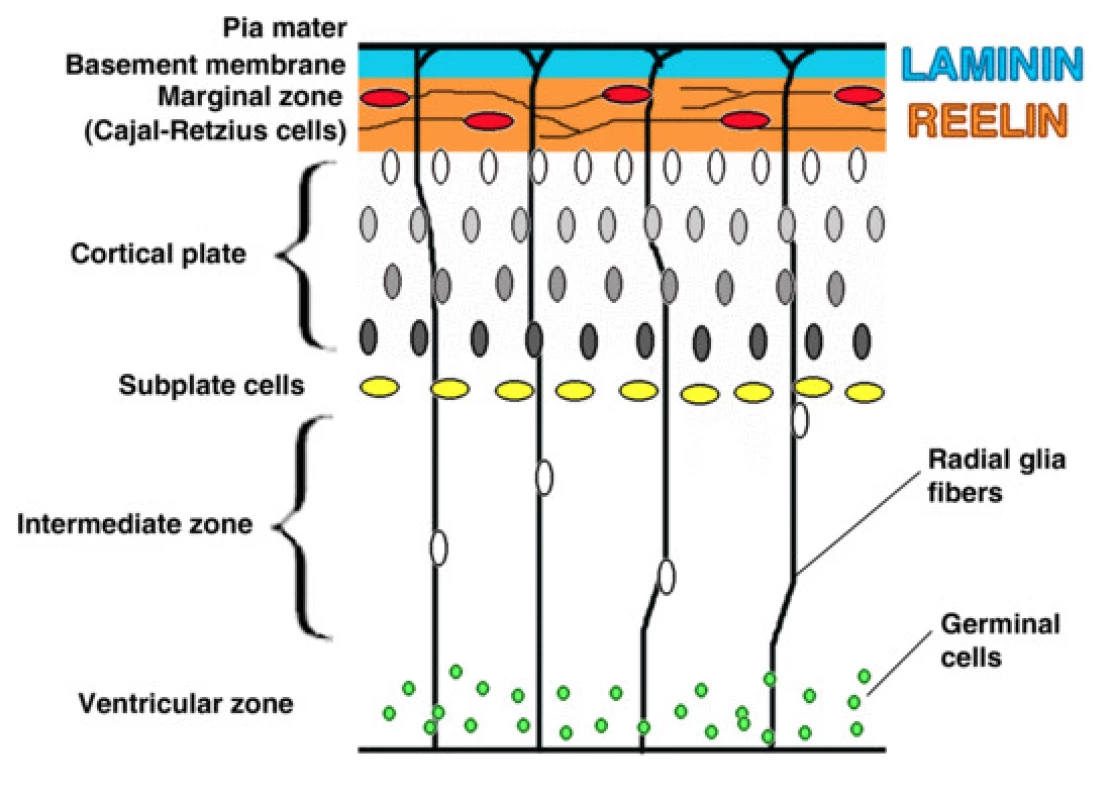
Na základě předchozích studií [18, 19, 20] se jako objektivní metoda pro měření a hodnocení bolesti u novorozenců jeví měření změn elektrické kožní vodivosti (Skin Conductivity Algesimetry). Tato metoda se ukázala využitelnou například pro individuální posouzení vhodné dávky anestetických preparátů [21]. Metoda také poskytla téměř 90% senzitivitu a specificitu pro dospělé pacienty v celkové anestezii [22].
Principem této metody jsou reakce sympatického nervového systému [23, 24, 25], vzniklé v důsledku bolestivých změn. Tyto změny způsobují uvolnění acetylcholinu, který působí na muskarinové receptory. Díky tomu nejsou změny kožní vodivosti ovlivněny nervosvalovými blokátory či aktivátory adrenergních receptorů ani hemodynamickou variabilitou [26, 27]. Následkem působení acetylcholinu dochází k plnění potních žláz (s maximem hustoty na palmární straně ruky a plantární straně nohy), což má za následek zvýšení kožní vodivosti v této oblasti [28]. Měřitelným projevem je pak snížení odporu kůže až do okamžiku reabsorpce potu. Tento proces je zaznamenán jako vrchol (peak) vodivosti. Jeho velikost (amplituda) závisí na intenzitě aktivace sympatiku. Změny v elektrické kožní vodivosti probíhají téměř okamžitě v reakci na bolestivý stimul, tedy do 0,7–2 sekund po impulzu [29]. Specifičnost této metody je založena na stimulu, který vyvolává bolestivou reakci novorozence a spouští aktivitu sympatického nervového systému. Měření elektrické kožní vodivosti (electrical skin conductivity, ESC) je tedy metodou hodnocení bolestivé odpovědi a emocionálního stavu novorozence. Změny parametrů ESC reflektují stav či úroveň vědomí a chování novorozence [30, 31].
Od poloviny 80. let minulého století jsou publikovány práce, hodnotící rozdíly v reakci na bolestivé podněty u mužů a žen. Teprve o 10 let později se objevují práce, které tuto problematiku hodnotí u novorozenců. Ve většině prací je pohlaví dítěte uváděno jako demografický či konceptuální faktor, nikoli jako proměnný faktor, který je předmětem zkoumání. Nicméně je možno konstatovat, že výsledky v několika málo pracech, které rozdíly v percepci bolesti u novorozených chlapců a děvčat hodnotí, jsou značně nejednoznačné, především proto, že práce používají rozdílnou metodiku hodnocení a bolest je hodnocena rozdílnými skórovacími škálami a změnami nestejných fyziologických parametrů.
Cílem této práce bylo:
- ověřit validitu parametrů ESC pro hodnocení percepce bolesti u zralých či téměř zralých novorozenců;
- zhodnotit analgetický efekt jednotlivých typů cukerných roztoků měřením parametrů ESC;
- stanovit případné rozdíly v analgetickém působení roztoků ve vztahu k pohlaví.
Materiál a metodika
Soubor pacientů
Práce byla zaměřena na novorozence donošené či téměř donošené (37 + 5 – 41 + 3 týdny gravidity při narození), hospitalizované na oddělení rooming-in neonatologického oddělení Krajské nemocnice T. Bati, a.s., ve Zlíně. Všechny děti se narodily v první polovině roku 2012 na výše zmíněném pracovišti a před jejich zařazením do studie byl od rodičů získán informovaný souhlas s provedením měření. Etická komise Krajské nemocnice Tomáše Bati ze Zlíně vyslovila souhlas s provedením práce. Do souboru bylo zařazeno 150 dětí, finálně bylo hodnoceno 122 dětí (66 chlapců a 56 děvčat). Osmadvacet dětí nebylo hodnoceno, jednak pro výrazný neklid dítěte před zahájením měření, jednak pro extrémní hodnoty měřených parametrů. Porodní hmotnost (PH) novorozenců dosahovala v průměru 3380 g (2630–4400 g). Ve všech případech se jednalo o novorozence s bezproblémovou poporodní adaptací, bez biochemických a klinických známek asfyxie. Žádný z novorozenců nebyl léčen pro akutní onemocnění a nedostával žádnou analgetickou či sedativní medikaci.
U novorozenců byly hodnoceny parametry ESC, konkrétně: Peaks per second – Hz (PpS), Area under curve – µS/s (AUC) a Area small peaks – µS/s (ASP), před a v průběhu uniformního bolestivého stimulu, kterým byl kapilární odběr krve na povinný biochemický a endokrinologický screening. Měření bylo realizováno v období 36 až 129 hodin po narození, vždy v ranních hodinách, kdy byli novorozenci umístěni v postýlkách v temperované místnosti (24–25 °C). Novorozenci byli krmeni nejméně 75 minut před vlastní procedurou.
Ve studii byly použity cukerné roztoky s různým objemem v závislosti na porodní hmotnosti novorozence: 1) 0,3 ml u dětí s porodní hmotností mezi 2–3 kg, 2) 0,4 ml u dětí s porodní hmotností mezi 3–4 kg a 3) 0,5 ml u dětí s porodní hmotností nad 4 kg. Použili jsme roztoky následujících typů a koncentrací: 20% a 40% glukóza (20G, 40G) a 25% a 50% sacharóza (25S a 50S).
Fyzikální princip
Vlastní provedení metody spočívá v měření bolestivé odpovědi hodnocením jednotlivých parametrů ESC pomocí algezimetru. V prezentované práci byl použit přístroj MedStorm algezimetr (obr. 3), pracující na principu měření intenzity bolestí a jejího trvání pomocí změn elektrické vodivosti kůže, a to v reálném čase jako odpověď na bolestivý stimul. K měření se standardně využívá tří samolepicích AgCL elektrod: C – current (žlutá), R – reference (modrá) a M – measure (černá), které jsou připevněny na kůži do míst s maximální hustotou potních žláz – u novorozenců na plosku nohy (obr. 2). Pro měření je rozhodující plocha kůže pod měřicí elektrodou M, neboť hodnota vodivosti reflektuje množství a aktivitu potních žláz právě pod touto elektrodou.
Obr. 2. Zapojení měřicích elektrod na dolní končetinu dítěte. User Manual, Med-Storm Stress DetectorTM, Med- Storm Innovation AS, Version 1.0 English (Europe), Part number 4001. Dostupné na: <http://www.med-storm.com/pdf/1342-5MA001-22%20Manual.pdf> 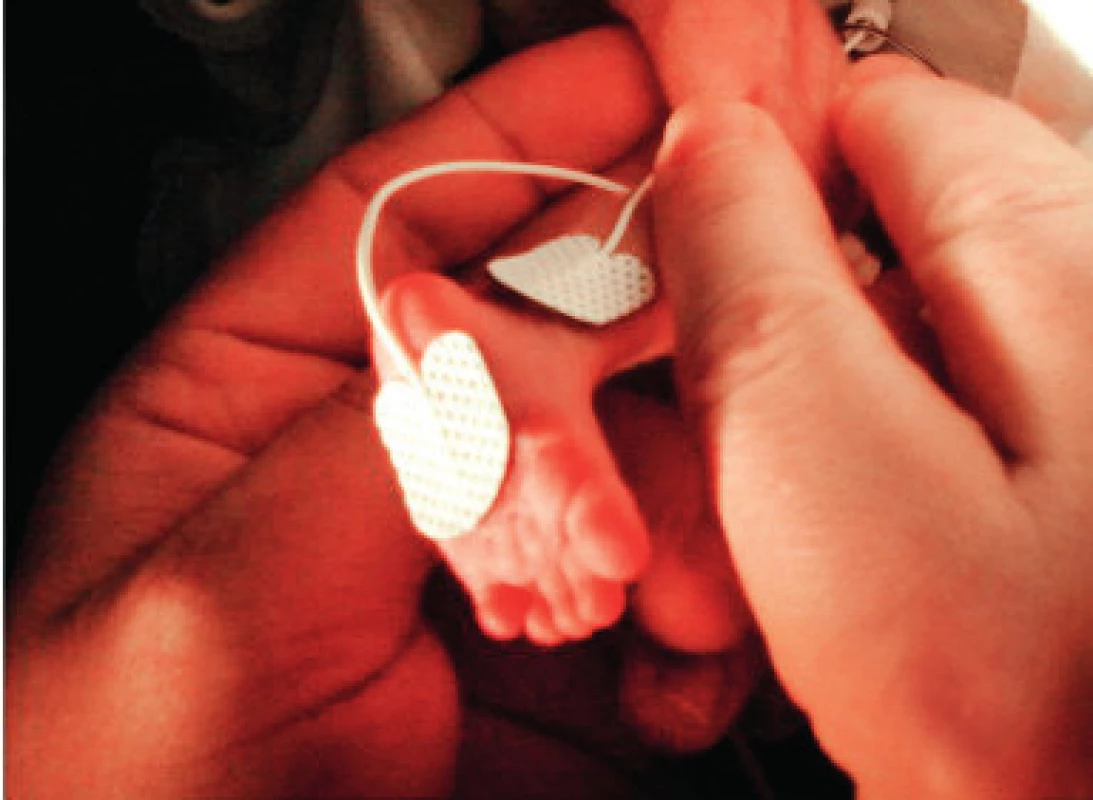
Obr. 3. Přístroj Algezimetr MedStorm. User Manual, Med-Storm Stress DetectorTM, Med- Storm Innovation AS, Version 1.0 English (Europe), Part number 4001. Dostupné na: <http://www.med-storm.com/pdf/1342-5MA001-22%20Manual.pdf> 
Přístroj umožňuje měření v tzv. „preterm“ modu, který je určen pro novorozence a vyhodnocuje následující parametry: Peaks per second – Hz (PpS), Area under curve – µS/s (AUC), Area small peaks – µS/s (ASP) a Area huge peaks – µS/s (AHP). Jednotkou vodivosti je jeden mikrosiemens (µS/s). Měřenou periodou je nejčastěji doba 15 sekund a aktualizace hodnot probíhá každou sekundu (obr. 4).
Obr. 4. Grafické vyjádření průběhu měření parametrů ESC. User Manual, Med-Storm Stress DetectorTM, Med- Storm nnovation AS, Version 1.0 English (Europe), Part number 4001. Dostupné na: <http://www.medstorm.com/pdf/1342-5MA001-22%20Manual.pdf> 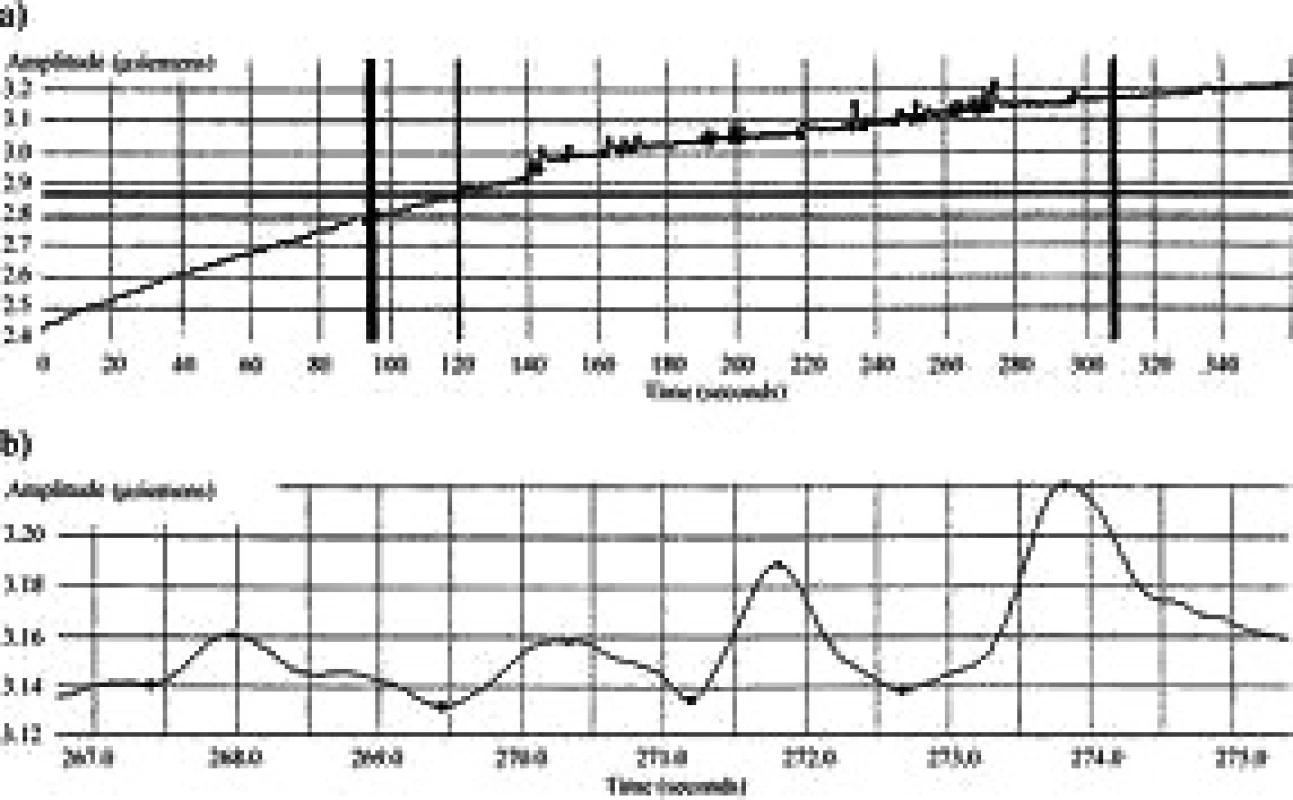
Měřicí jednotka zpracovává údaje z elektrod C a R a využívá zpětnovazebný mechanismus tak, aby na základě získaných údajů bylo zajištěno dodání konstantního a přesného střídavého napětí mezi elektrody M a R. Tento zpětný proud z měřicí elektrody je zaznamenáván a jeho hodnoty představují přímou informaci o vodivosti kůže. Software má schopnost odfiltrovat artefakty a šum ze zaznamenaných hodnot střídavého napětí tak, aby byly zaznamenány co nejpřesnější informace o vodivosti kůže. Systém je schopen měřit hodnoty vodivosti v rozsahu 1–200 µS s úrovní šumu pod 0,002 µS. Současně má měřicí jednotka schopnost zaznamenávat chyby v měření, jako jsou odlepení elektrody, interference s jinými elektrickými přístroji, případně použití elektrokoagulace. Přístroj je schválen Evropskou komisí pro vyhlášení shody (Declaration of Conformity).
Experimentální uspořádání
Před vlastním měřením byla provedena identifikace pacienta, ploska nohy byla předem očištěna fyziologickým roztokem a dále následovala instalace elektrod do definovaných oblastí. Nakonec byly do softwarového programu MedStorm vloženy základní údaje o pacientovi – iniciály, datum měření, gestační věk v době porodu, věk po narození a hodnota stavu vědomí a chování novorozence po-dle Prechtlovy stupnice behaviorálního stavu (Qualitative Assessment of General Movements and Neurobehavioural Scale) [32]. Příprava novorozence trvala zhruba 3 minuty před samotným bolestivým stimulem. Vlastní měření je možno popsat v následujících fázích:
V první fázi, trvající 15–30 sekund, bylo provedeno klidové měření parametrů ESC. Všechny neklidné děti, ohodnoceny podle Prechtlovy stupnice chování a stavu vědomí stupněm 3 a více (tedy neklidné, s živou spontánní motorikou, plačící), nebyly do studie zařazeny.
Přibližně po 1–2 minutách byl novorozencům na šidítku nebo vatové štětičce podán přesně definovaný objem sladkého roztoku různého typu. Osoba podávající novorozenci cukerný roztok neznala jeho typ ani koncentraci.
Druhá fáze následovala za 60–90 sekund po podání cukerného roztoku. Důvodem tohoto časového odstupu je předpokládaná doba trvání nástupu jeho analgetického účinku. V této fázi byl proveden vpich do patičky dítěte pro odběr kapilární krve. Vpich byl proveden kovovou lancetou (Dahlhausen Germany) na kontralaterální končetině, než byly umístěny elektrody. V okamžiku vpichu byl spuštěn záznam na přístroji pro měření parametrů ESC, jež trvalo opět 15–30 sekund.
Zaznamenávané parametry
Jak již je uvedeno výše, jedním z parametrů rozhodujícím o zařazení dítěte do studie bylo hodnocení stavu vědomí a chování podle Prechtlovy stupnice. Podle této škály jsou novorozenci rozděleni do 5 kategorií odpovídajícího behaviorálního stavu. Abychom předešli zkreslení výsledků, byli do studie zařazeni pouze novorozenci s hodnotou 1 nebo 2, kde jsou do 1. kategorie zařazeny děti, které mají zavřené oči, pravidelně dýchají a nevyskytují se u nich aktivní pohyby a do 2. kategorie spadají děti, které mají rovněž zavřené oči, ale nepravidelně dýchají a jsou u nich patrné drobné pohyby, především končetin [33].
Podstatou studie bylo měření bolestivé odpovědi hodnocením jednotlivých parametrů elektrické kožní vodivosti v modu „preterm“, tj. PpS, AUC a ASP, případně AHP s vědomím, že dominantním parametrem s nejvyšší specificitou a senzitivitou je parametr počtu vrcholů změn elektrické kožní vodivosti za sekundu (peaks per sec – PpS).
Matematicko-statistické vyhodnocení
Pomocí Q testu byli ze statistického šetření vyloučeni novorozenci, u nichž byl některý ze stanovených parametrů odchýlen. Grafy a základní statistické parametry byly stanoveny pomocí programu STATISTICA. Ve stejném programu byly vypočteny také hodnoty Spearmanova korelačního koeficientu. Ke stanovení vlivu jednotlivých parametrů na hodnotu ASP a PpS byl použit smíšený lineární model (Mixed Linear Model) v programu SAS pro Windows verze 9.1.2. Jako pevné efekty byly použity: gestační týden a interakce mezi fází pokusu a hodnotou stavu chování a vědomí podle Prechtlovy škály (dále Prechtl). Jako náhodný efekt byl použit vliv jedince.
Výsledky
Pomocí Pearsonových korelačních koefi-cientů byl vyhodnocen vztah mezi parametrem kožní vodivosti (PpS) v první fázi měření a zjištěnou hodnotou ukazatele stavu chování a vědomí (Prechtl) ve fázi 1 a 2.
Z dat uvedených v tabulce 1 je zřejmá korelace mezi hodnotami ukazatele Prechtl v jednotlivých fázích. Také mezí hodnotou PpS existuje statisticky průkazná korelace k hodnotě Prechtl v 1. fázi. Naproti tomu s hodnotou Prechtl v 2. fázi nebyla nalezena statisticky průkazná korelace s parametrem PpS.
Tab. 1. Pearsonovy korelační koeficienty pro vztah mezi hodnotou parametru PpS a stavem vědomí a chování. 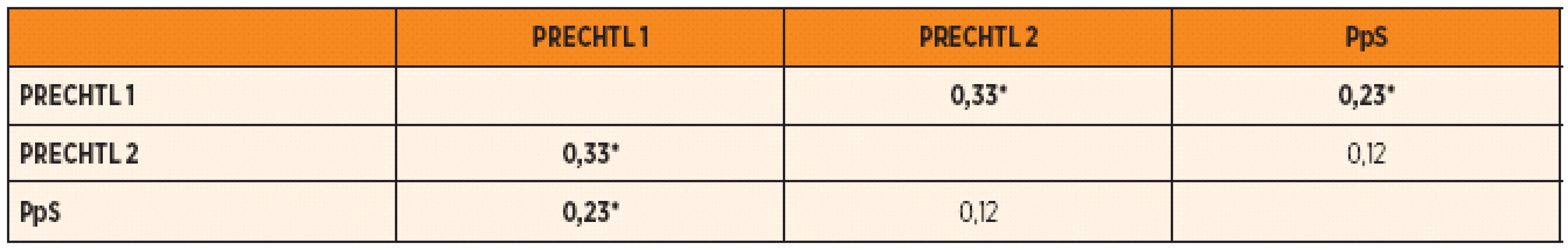
Poznámka: Označené korelace jsou vysoce průkazné na hladině p <0,01. PpS – peaks per sec – počty vrcholů elektrické kožní vodivosti za sekundu, Prechtl – stav, úroveň bdělosti a chování podle Prechtla V první části tabulky 2 jsou uvedeny rozdíly hodnot parametrů kožní vodivosti mezi druhou a první fází pokusu (AHP 2–1; ASP 2–1; PS 2–1; AUC 2–1), stejně jako u hodnoty parametru Prechtl (Prechtl 2–1) při zohlednění vlivu pohlaví. Z tabulky je zřejmé, že existují statisticky průkazné rozdíly mezi pohlavími u parametrů AHP 2–1; AUC 2–1 a Prechtl 2–1. U parametrů AHP 2–1 a AUC 2–1 jsou významně vyšší naměřené hodnoty u chlapců, zatímco u parametru Prechtl 2–1 je možné pozorovat opačný trend. Zdá se tedy, že chlapci na bolestivý stimul více reagují změnou parametrů kožní vodivosti, zatímco dívky změnou chování, která je vyjádřena hodnotou podle Prechtlovy stupnice.
Tab. 2. Vliv pohlaví na hodnoty rozdílů parametrů ESC mezi jednotlivými fázemi (LSM ± SD). 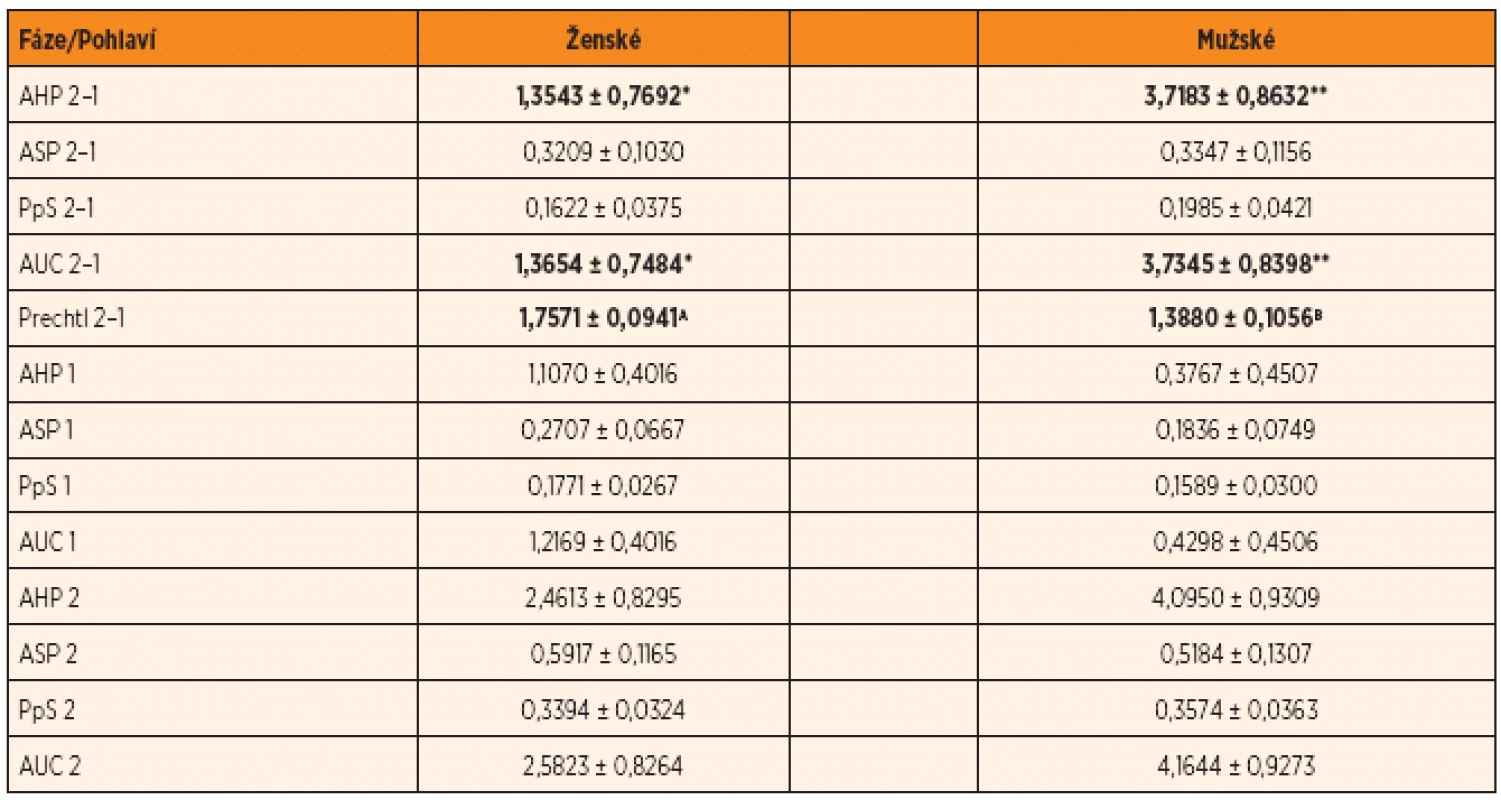
Poznámka: Rozdílné indexy v řádcích určují statisticky průkazné rozdíly p <0,01 (A, B) a p <0,05 (*, **). AHP – area huge peaks, ASP – area small peaks, PpS – peaks per sec, AUC – area under curve V dalších dvou částech tabulky 2 jsou uvedeny rozdíly sledovaných parametrů kožní vodivosti (AHP, ASP, PS, AUC) v rámci jednotlivých fází pokusu (tedy nikoliv posun mezi fázemi). Na rozdíl od změny v uvedených parametrech detekovaných v případě posunu hodnot mezi fázemi, jakožto reakce na bolestivý podnět, nebyly v tomto případě zaznamenány žádné rozdíly mezi pohlavími. Lze tedy konstatovat, že zatímco v samotných hodnotách parametrů kožní vodivosti nejsou rozdíly mezi pohlavími v klidové první fázi (fáze 1) či fázi bolestivého stimulu (fáze 2), liší se jednotlivá pohlaví v reakci na bolestivý stimul, vyjádřenou posunem hodnot kožní vodivosti.
Tabulka 3 uvádí vliv různých typů a koncentrací cukerných roztoků na hodnoty kožní vodivosti a úrovně stavu vědomí a chování podle Prechtla jednak vyjádřením rozdílu (posunu) mezi jednotlivými fázemi, jednak v rámci jednotlivých fází. Stejně jako v případě pohlaví (tab. 2) je možné detekovat statisticky průkazné rozdíly pouze v případě posunů hodnot mezi jednotlivými fázemi. V případě hodnoty ASP 2–1 se jedná o významný rozdíl mezi hodnotami 20G a 50S oproti hodnotám 25S a 40G. Novorozenci s 20G a 50S vykazovali výrazně odlišné hodnoty (20G – 0,5432; 50S – 0,5496) ve srovnání s 25S (0,1104) a 40G (0,1081). V případě parametru PS 2–1 byl pak detekován statisticky průkazný rozdíl mezi hodnotou 20G (0,0962) a hodnotou 50S (0,2640).
Tab. 3. Vliv typu a koncentrace sladkého roztoku na vybrané hodnoty parametrů ESC a úrovně stavu vědomí a chování (Prechtl) v jednotlivých fázích a rozdíly mezi fázemi (LSM ± SD). 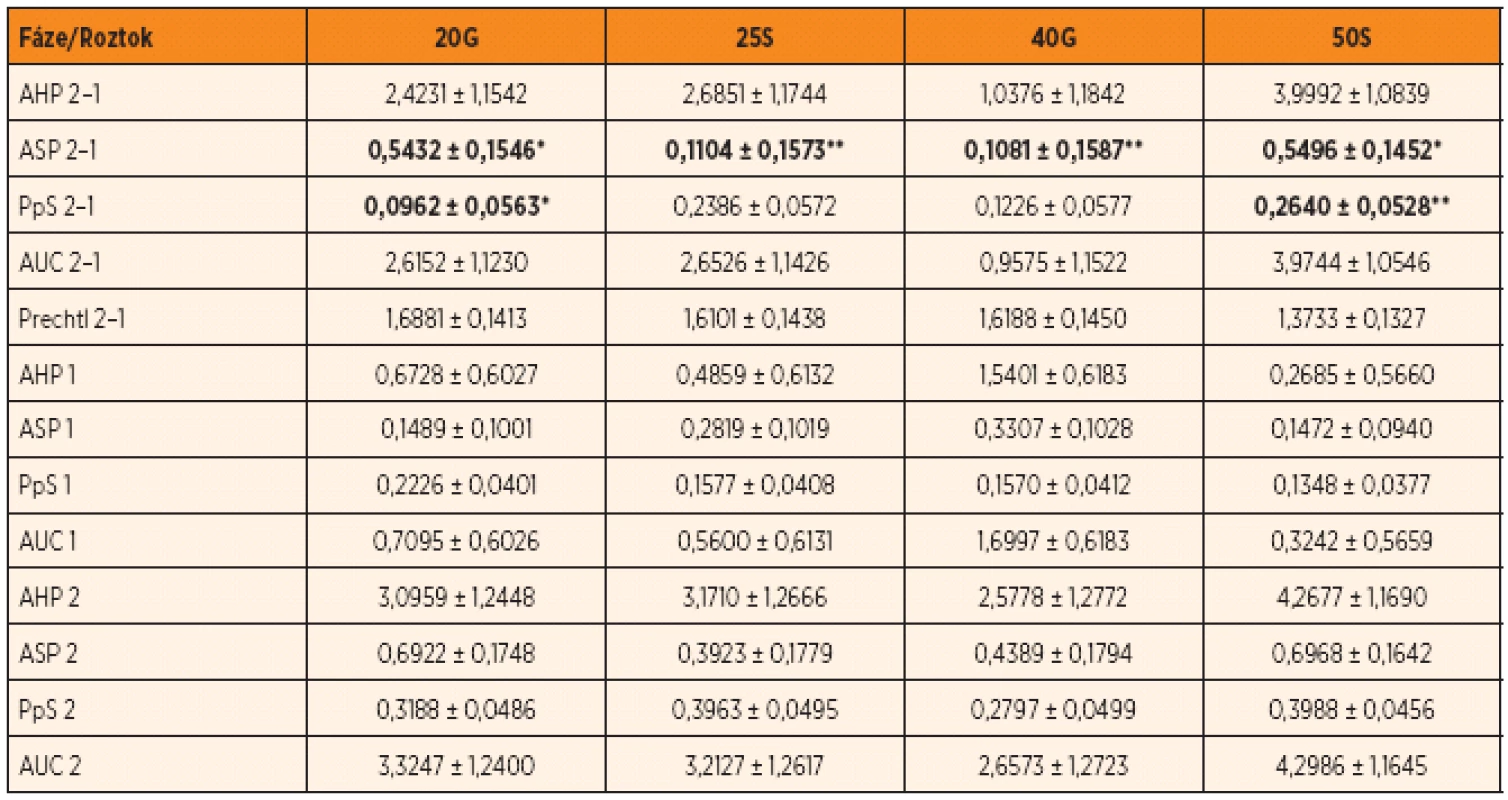
Poznámka: Rozdílné indexy v řádcích určují statisticky průkazné rozdíly p <0,05 (*, **). AHP – area huge peaks, ASP – area small peaks, PpS – peaks per sec, AUC – area under curve, Prechtl – úroveň stavu vědomí a chování Diskuze
Analgetické působení některých cukerných roztoků u dětí je popsáno v několika desítkách prací [33, 34, 35, 36, 37]. Mechanismus působení cukerných roztoků není zcela jednoznačně objasněn. Je velmi pravděpodobné, že se děje na několika úrovních, a to jak inhibicí bolestivé aference, tak i potencí descendentních inhibičních impulzů. Bylo prokázáno, že po podání cukerných roztoků se zvyšuje exprese opioidních receptorů v určitých oblastech mozku [38]. Efekt různých druhů cukerných roztoků na expresi opioidních receptorů je rozličný, čímž je možno vysvětlit rozdíly v účinnosti různých typů cukerných roztoků. Nejpotentnější analgetický efekt má sacharóza a glukóza, které byly zvoleny i pro účely naší studie. Tento analgetický efekt lze (alespoň částečně) blokovat antagonisty opiátových receptorů. Spekuluje se tedy o tom, že analgetický efekt sacharózy a glukózy je zprostředkován přímou aktivací opioidních receptorů. Tento efekt byl experimentálně zkoumán na žábách Xenopus laevis či myších mláďatech [39, 40]. V preklinických studiích bylo opakovaně prokázáno, že intraorální aplikace sladkého roztoku u krys výrazně zvyšuje práh bolesti. Je známo, že u dětí matek závislých na metadonu podání sladkého roztoku nesnižuje délku ani intenzitu pláče, zatímco u zdravých dětí ano [41]. Dalším mechanismem působení sladkých roztoků je zvýšení exprese dopaminergních mesolimbických neuronů [42]. Byl prokázán i vznik závislosti na příjmu sladké potravy, ne nepodobný závislosti na návykových látkách (významně se zvyšuje vazebná kapacita dopaminergních receptorů a µ opioidních receptorů po dlouhodobém přísunu vyšších koncetrací sladkých látek) [43].
Dále po podání cukerných roztoků byla pozorována a prokázána zvýšená aktivita oblasti nucleus raphe magnus (jádro v mozkovém kmeni), což je důležité jádro aktivace descendentních inhibičních neuronálních drah [44, 45]. Konečně po podání sladkých substancí dochází ke zvýšení plazmatické hladiny inzulinu, u něhož je analgetický účinek znám. Mechanismus není zcela jasně objasněn [40].
Je bezpečně prokázáno, že perorální aplikace sacharózy a glukózy v dávkách od 0,05–2 ml efektivně snižuje bolestivé vnímání u imunizace a odběru kapilární krve, stejně tak u cirkumcize [37, 46]. Objemy cukerných roztoků, které byly aplikovány novorozencům, jsou v souladu s protokolem prevence procedurální bolesti daného oddělení, kde byla studie realizována.
Řada prací pak srovnávala analgetický efekt sladkého roztoku, mateřského mléka a fyziologického roztoku, a to jak s či bez současného nenutritivního sání. Všechna data ukazují, že analgetický efekt je zprostředkován sladkými vjemy, sladké roztoky jsou účinnější než mateřské mléko či fyziologický roztok [35, 36, 47].
Rovněž byla prokázána i diference pohlaví v odpovědi na bolestivý podnět, kdy je tento rozdíl dán velmi pravděpodobně odlišnou kapacitou produkce endorfinů a enkefalinů. Hlavním místem produkce těchto látek je oblast nucleus raphe dorsalis, nucleus raphe magnus a oblast periakveduktální šedi.
Ve své předchozí práci [48] jsme prokázali validitu hodnocení bolestivé odpovědi u novorozenců různých gestačních kategorií měřením parametrů ESC. Prokázali jsme, že děti různého gestačního stáří reagují na definovaný bolestivý podnět srovnatelnou odpovědí (srovnatelnými změnami parametrů ESC). Jako analgetickou substanci jsme použili pouze jeden typ a koncentraci sladkého roztoku.
V prezentované práci jsme hodnotili analgetický potenciál různých typů a koncentrací sladkých substancí s vědomím, že jednoznačná doporučení v tomto směru nebyla dosud publikována. Z výsledků naší práce v tomto směru vyplývá, že rozdíly v analgetickém působení námi použitých roztoků existují, resp. existují rozdíly v hodnocení bolestivé odpovědi, měřené změnami parametrů ESC.
Nejčastěji používanými analgeticky působícími roztoky pro prevenci procedurální bolesti u novorozenců jsou sacharóza a mateřské mléko. Méně je využívána glukóza, ačkoli se jedná o běžně dostupnou a relativně levnou substanci. Pro rozdíly v analgetické efektivitě glukózy a sacharózy neexistuje jasné vysvětlení, z našich výsledků na relativně malém souboru dětí nelze vyvozovat jednoznačné závěry či doporučení pro použití konkrétního typu či koncentrace sladkého roztoku. Je možné uvažovat o rozdílech v metabolizaci obou substancí (monosacharid vs. disacharid), avšak prací, které konkrétně tyto rozdíly hodnotí, je publikováno velmi málo [49].
U dospělých pacientů byly prokázany rozdíly v bolestivé odpovědi u mužů a žen, tyto rozdíly byly reportovány pacienty samotnými. Současně bylo konstatováno, že jednoznačné vysvětlení pro tyto rozdíly je obtížné najít [50].
Guinsburg v roce 2000 [51] konstatovala, že rozdíly v odpovědi na bolest mezi pohlavími existují i u novorozenců, byly měřeny behaviorální parametry (skórovací škály NFCS – Neonatal Facial Coding System a NIPS – Neonatal Infant Pain Score ) u novorozenců, narozených mezi 28. a 42. týdnem těhotenství. Novorozené dívky vykazovaly vyšší hodnoty obou skórovacích škál v odpovědi na kapilární odběr krve.
Grunau [52] prokázala rozdíly v rychlosti nástupu, trvání a charakteristikách pláče u novorozených chlapců a děvčat v odpovědi na bolestivý stimul. V této práci chlapci vykazovali rychlejší nástup pláče a jeho delší trvání.
Výsledky dosud publikovaných prací jsou velmi rozdílné a nelze z jejich výsledků jednoznačně konstatovat statisticky významné závěry a doporučení. Je pouze obecně konstatováno, že pokud rozdíly v percepci, zpracování a odpovědi na bolestivý podnět mezi novorozenými chlapci a děvčaty existují, pak tyto rozdíly mohou být částečně vysvětleny biologickými charakteristikami vnímání bolesti u rozdílných pohlaví. Práce hodnotí odpověď na bolest rozdílnými parametry, skórovacími škálami, pracují s dětmi různého gestačního stáří a postnatálního věku. Významnou roli jistě hraje i předchozí bolestivá zkušenost dítěte, délka pobytu na jednotce intenzivní péče, množství předchozích bolestivých podnětů, jejich intenzita a délka trvání.
Jsme si vědomi jistých limitů naší práce. Především jsme neidentifikovali kontrolní soubor dětí, kterým by byl bolestivý podnět aplikován bez předchozího podání analgeticky působící substance. Srovnáváme tak soubory dětí, které ve všech případech analgeticky působící roztok dostaly. Na pracovišti autora je však od roku 2009 aplikován a striktně dodržován protokol prevence procedurální bolesti [53], proto jsme všem dětem sladkou substanci v souladu s tímto protokolem podali. Považujeme za eticky diskutabilní nepodat analgetikum v situaci, kdy je dostupné a indikované.
Limitujícím faktorem je rovněž skutečnost, že jsme použili pouze jednu metodu hodnocení bolestivé odpovědi. Tou je, resp. jsou parametry elektrické vodivosti kůže. Z publikovaných prací vyplývá, že výsledky jsou rozdílné, pokud srovnáváme více parametrů bolestivé odpovědi novorozence na přesně definovaný bolestivý stimul (beha-viorální, fyziologické faktory, analýzu pláče apod.).
Závěr
Měřením analgetického efektu různých typů cukerných roztoků, po přesně definovaném bolestivém podnětu u zralých novorozenců, byla prokázána rozdílná účinnost jednotlivých typů cukerných roztoků. Reakce na bolestivý stimul byla stanovena pomocí parametrů elektrické kožní vodivosti. Ve studovaném souboru dětí existovaly také významné rozdíly mezi chlapci a děvčaty v reakci na bolestivý stimul. Tento rozdíl byl jak ve změně elektrické kožní vodivosti, tak v behaviorálním stavu novorozence.
Je možno konstatovat, že dosud neexistují jednoznačná mezinárodní doporučení pro aplikaci cukerných roztoků. V prevenci procedurální bolesti jsou používány roztoky různých koncentrací a typů. Stejně tak nebyla dosud publikována doporučení s případným zohledněním pohlaví. Rovněž jednotlivé i denní dávky sladkých substancí nejsou zřetelně doporučeny. S ohledem na výše uvedené skutečnosti se zdají prvotní výsledky naší studie zajímavé, především pak fakt, že naznačují, že analgetický efekt různých typů cukerných roztoků, hodnocený parametry elektrické kožní vodivosti, může být statisticky významně odlišný. Stejně tak může být odlišná reaktivita chlapců a děvčat na bolestivý stimul.
Došlo: 30. 1. 2013
Přijato: 3. 4. 2013
MUDr. Jozef Macko
Krajská nemocnice Tomáše Bati
Novorozenecké oddělení
Havlíčkovo nábřeží 600
762 75 Zlín
e-mail: macko@bnzlin.cz
Zdroje
1. Melzack R, Wall PD. Pain mechasnism: A new theory. Science 1965; 150 : 171–179.
2. Anand KJS, Hickey PR. Pain and its effects in the human neonate and fetus. N Engl J Med 1987; 317 (21): 1321–1329.
3. Lowrey CL, Hardman MP, Manning N, et al. Neurodevelopmental changes of fetal pain. Semin Perinatol 2007; 31 : 275–282.
4. Derbyshire SWG, Fitzgerald M. The painful consequences of neonatal nociceptive input. Pain 2010; 150 : 220–221.
5. Als H, Duffy FH, McAnulty GB, et al. Early experience alters brain function and structure. Pediatrics 2004; 113 : 846–857.
6. Stevens B, McGrath P, Gibbins S, et al. Procedural pain in newborns at risk for neurological impairment. Pain 2003; 105 : 27–35.
7. Hudson-Barr D, Capper-Michel B, Lambert S, et al. Validation of the pain assessment in neonates (PAIN) scale with the neonatal infant pain scale (NIPS). Neonatal Netw 2002; 21 (6): 15–21.
8. van Dijk M, deBoer JB, Koot HM, et al. The reliability and validity of the COMFORT scale as postoperative pain instrument in 0 to 3 year old infants. Pain 2000; 84 : 367–377.
9. Peters JW, Koot HM, Grunau RE, et al. Neonatal facial coding system for assessing postoperative pain in infants; item reduction is valid and feasible. Clin J Pain 2003; 19 : 353–363.
10. Fitzgerald M, Shaw A, MacIntosh. Postnatal development of the cutaneous flexor reflex: Comparative study of preterm infants and newborn rat pups. Dev Med Child Neurol 1991; 30 : 520–526.
11. Stevens B, Gibbins S, Franck LS. Treatment of pain in the neonatal intensive care unit. Pediatr Clin N Am 2000; 47 (3): 633–650.
12. Bellieni CV, Bagnoli F, Buonocore G. Alone no more: Pain in premature infants. Ethics Med 2003; 19 (1): 5–10.
13. Chiswick ML. Assessment of pain in neonates. Lancet 2000; 355 : 6–8.
14. Anand KJS. The neuroanatomy, neurophysiology, and neurochemistry of pain, stress, and analgesia in newborns and children. Pediatr Clin N Am 1989; 36 (4): 795–822.
15. Smith RP, Gitau R, Glover V, et al. Pain and stress in the human fetus. Eur J Obstet Gynecol Reprod Biol 2000; 92 (1): 161–165.
16. Glover V. The fetus may feel pain from 20 weeks. (The fetal pain controversy.) Conscience 2003; 35 (3), Vol. 25: No. 3. ISSN: 0740-6835.
17. Anand KJS, Hickey PR. Pain and its effects in the human neonate and fetus. N Engl J Med 1987; 317 : 1321–1329.
18. Abu-Saad HH, Bours JJW, Stevens B, et al. Assess-ment of pain in the neonate. Semin Perinatol 1998; 22 : 402–416.
19. Storm H. Skin conductance and the stress response from heel stisk in preterm infants. Arch Dis Child Fetal Neonatal Ed 2000; 83 (2): F143–F147.
20. Gjerstad AN, Wagner K, Henrichsen T, et al. Skin conductance versus the modified COMFORT sedation score as a measure of discomfort in artificially ventilated children. Pediatrics 2008; 122: e848–e853.
21. Storm H, Shafiei M, Myre K, et al. Palmar skin conductance compared to a developed stress score and to noxious and awakeness stimuli on patiens in anaesthesia to study the sensitivity and specificity of skin conductance. Acta Anaesth Scand 2005; 49 : 798–804.
22. Storm H, Skorpen F, Klepstad P, et. al. Genetic variations influence the skin conductance response to nociceptive pain in anesthetized patiens. Abstract accepted ISAP, Orlando; 2008.
23. Edelberg R. Electrical properities of the skin. In: Brown CC (ed). Methods in Psychophysiology. Baltimore, MD: Williams &Wilkins; 1967 : 1–53.
24. Hagbarth KE, Halin RG, Hongell A, et al. General characteristics of sympatethic activity in human skin nerves. Acta Physiol Scand 1972; 84 (2): 164–176.
25. Wallin BG, Sundlöf G, Delius W. The effect of karotid sinus nerve stimulations on muscle and skin nerve sympathetic activity in man. Pflugers Arch 1975; 358 (2): 101–110.
26. Gladman G, Chiswick ML. Skin conductance and arousal in the newborn infant. Arch Dis Child 1990; 65 : 1063–1066.
27. Macefield VG, Wallin BG. The change in behavior of single sympathetic outflow in normotensive human sweat glands. J Auton Nerv Syst 1996; 14 : 277–286.
28. Lindberg L, Wallin G. Sympathetic skin nerve discharges in relation to amplitude of skin resistence response. Psychophysiology 1981; 18 (3): 268–270.
29. Hellerud BC, Storm H. Skin conductance and behaviour during sensory stimulation of preterm and term infants. Early Hum Dev 2006; 70 : 35–46.
30. Golianu B, Krane E, Seybold J, et al. Non-pharmagological techniques for pain management for pain in neonates. Semin Perinatol 2007; 31 (5): 318–322.
31. Prechtl HFR. The Neurological Examination of the Full Term Newborn Infant. 2nd ed. London: Lippincott, 1977.
32. Prechtl HFR. The behavioural states of the newborn infant (a review). Brain Res 1974; 76 (2): 185–212.
33. Stevens B, Yamada J, Ohlsson A. Sucrose for analgesia in newborn infants undergoing painful procedures. Cochrane Database Syst Rev 2004;(3):CD 001069.
34. Gibbins S, Stevens B. The influence of gestational age on the efficacy and short-term safety of sucrose for procedural pain relief. Adv Neonatal Care 2003; 3 (5): 241–249.
35. Jonhston CC, Stremler R, Horton L, et al. Effect of repeated doses of sucrose during heel stick procedure in preterm neonates. Biol Neonate 1999; 75 (3): 160–166.
36. Stevens B, Jonhson C, Franck L, et al. The efficacy of developmentally sensitive interventions and sucrose for relieving procedural pain in very low birth weight neonates. Nurs Res 1999; 48 (1): 35–43.
37. Bucher HU, Moser T, Von Siebenthal K, et al. Sucrose reduces pain reaction to heel lancing in preterm infants: Placebo controlled randomized and masked study. Pediatr Res 1995; 38 (3): 332–335.
38. Lindh V, Wicklund U. The role of endigenous opioids in mediating pain reduction by orally administered glucose among newborns. Pediatrics 2005; 115 (4): 1004–1007.
39. Spangler R, Wittkowski KM, Goddard NL. Opiate-like effects of sugar on gene expression in reward areas of the rat brain. Brain Res Mol Brain Res 2004; 124 (2): 134–142.
40. Brase DA, Han YH, Dewey WL. Effects of glucose and diabetes on bindingof naloxone and dihydromorphine to opiate receptors in mouse brain. Diabetes 1987; 36 : 1173–1177.
41. Blass EM, Ciaramitaro V. A new look to some old mechanisms in human newborns: taste and tactile determinants of state, affect and action. Monogr Soc Res Child Dev 1994; 59 (1): I–V, 1–81.
42. Woolf CJ, Ma Q. Nociceptors--noxious stimulus detectors. Neuron 2007; 55 (3): 353–364.
43. Colantuoni C, Schwenker J, McCarthy J, et al. Excessive sugar intake alters binding to dopamine and mu-opioid receptors in the brain. Neuroreport 2001; 12 : 3549–3552.
44. Cregg R, Momin A, Rugiero F, et al. Pain chanellopathies. J Physiol 2010; 588 : 1897–1904.
45. Fields HL, Basbaum AI. Central nervous system mechanisms of pain modulation. In: Wall PD (ed). Textbook of Pain. Churchill Livingstone, 1999 : 309–329.
46. Haouari N, Wood C, Griffiths G, et al. The analgesic effect of sucrose in full term iinfants: a randomized controlled trial. BMJ 1995; 310 : 1498–1500.
47. Harrison D, Boyce S, Loughnan P, et al. Skin conductance as a measure of pain and stress in hospitalised infants. Early Hum Dev 2008; 82 : 603–608.
48. Macko J, a kol. Změny elektrické kožní vodivosti v důsledku bolestivého stimulu u novorozenců různých gestačních kategorií a srovnání se změnami vybraných fyziologických parametrů. Čes-slov Pediat 2011; 66 (6): 363–371.
49. Carbajal R, Chauvet X, Couderc S, Olivier-Martin M. Randomized trial of analgesic effect of sucrose, glucose and pacifiers in term neonates. BMJ 1999; 319 : 1393–1397.
50. Riley JL, Robinson ME, Wise EA, Myers CD, Fillingim RB. Sex differencies in the perception of noxious stimuli: a metaanalysis. Pain 1998; 74 : 181–187.
51. Gunsburg R, Peres CDA, de Almeida MF, et al. Differences in pain expression between male and female newborn infants. Pain 2000; 85 : 127–133.
52. Grunau RVE, Craig KD. Facial activity as a measure of neonatal pain expression. Adv Pain Res 1990; 5 : 147–156.
53. Macko J, a kol. Procedurální bolest novorozence – možnosti prevence a tišení. Čes-slov Pediat 2010; 65 (10): 584–591.
54. Rokyta R. Fetal pain. Neuroendocrinology Letters 2008; 29 (6): 807–814.
55. Rokyta R, Fricová J. Ontogeny of the pain. Physiol Res 2012; 61 (Suppl 1): 109–122.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2013 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Prevalencia nadhmotnosti a obezity u študentov bratislavských stredných škôl – predbežné výsledky štúdie „Rešpekt pre zdravie“
- Kineticky řízená léčba gentamicinem u kriticky nemocných septických nedonošených novorozenců v prvním týdnu života – otevřená prospektivní studie (část I)
- XV. Hradecké pediatrické dny 2013
- Analgetický potenciál různých typů cukerných roztoků v prevenci procedurální bolesti u zralých novorozenců
- Snídaně jako determinanta hmotnosti u dětí ve věku 9–10 let
- Možnosti ovplyvnenia recidivujúcich infekcií dýchacích ciest prírodnou imunomodulačnou liečbou
- Vliv jodového stavu a mateřských tyreopatií na vývoj štítné žlázy a jeho poruchy u plodu a novorozence
- Diagnostika a intervence u zdravých dětí, jejichž sourozenec je vážně nemocný
- Hazard a obec
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Možnosti ovplyvnenia recidivujúcich infekcií dýchacích ciest prírodnou imunomodulačnou liečbou
- Diagnostika a intervence u zdravých dětí, jejichž sourozenec je vážně nemocný
- Analgetický potenciál různých typů cukerných roztoků v prevenci procedurální bolesti u zralých novorozenců
- Snídaně jako determinanta hmotnosti u dětí ve věku 9–10 let
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



