-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Přehled pacientů s diagnózou X-vázaného lymfoproliferativního onemocnění (XLP) diagnostikovaných v České republice a na Slovensku
A survey of patients diagnosed with X-linked lymphoproliferation disease (XLP) in the Czech Republic and Slovakia
X-linked lymphoproliferative disease (XLP) is a rare primary immunodeficiency with incidence 1–3 patients in a million boys. The condition is caused by a defect either in SH2D1A (XLP-1) or BIRC4 (XLP-2) gene. Most of the clinical symptoms overlap in both of the variants of the disease (e.g. fulminant infectious mononucleosis, haemophagocytic lymphohistiocytis – HLH, impairment of immunoglobulin production), other signs are typical only for the particular disease variant (e.g. malignant lymphoma in XLP-1, hemorrhagic colitis in XLP-2). Aplastic anaemia, vasculitis, chronic gastritis and skin ailment manifest rarely. The only causal therapy is haematopoietic stem cell transplantation (HSCT).
In the Czech Republic there have been so far diagnosed 7 patients with XLP-1 and one patient with XLP-2. The patients were born in between 1961 and 2005. The disease manifested with median 4.5 years of age (range 19 months to 16 years). Two patients died due to fulminant HLH, one patient died during HSCT. One patient underwent successful HSCT, whereas other 4 living patients have not been transplanted. Median of age of the living patients is 22 years (range 17–27 years).
In the text the authors summarize the current opinion on the pathophysiology, diagnostics and treatment of XLP. The course of the disease in the patients treated in the Czech Republic and Slovakia is presented.Key words:
X-linked lymphoproliferative disease, primary immunodeficiency, haematopoietic stem cell transplantation, SAP, XIAP
Autoři: E. Mejstříková 1; T. Freiberger 2,3; A. Šedivá 4; P. Čižnár 5; P. Švec 6; O. Hrušák 1; D. Sumerauer 1; E. Kabíčková 1; P. Keslová 1; R. Formánková 1; M. Suková 1; P. Sedláček 1; J. Starý 1; A. Janda 7
Působiště autorů: Klinika dětské hematologie a onkologie UK 2. LF a FN Motol, Praha přednosta prof. MUDr. J. Starý, DrSc. 1; Ústav klinické imunologie a alergologie, Fakultní nemocnice U sv. Anny, Lékařská fakulta Masarykovy univerzity, Brno přednosta prof. MUDr. J. Litzman, CSc. 2; Genetická laboratoř, Centrum kardiovaskulární a transplantační chirurgie, Brno ředitel doc. MUDr. P. Němec, CSc. 3; Ústav imunologie UK 2. LF a FN Motol, Praha přednostka prof. MUDr. J. Bartůňková, DrSc., MBA 4; 1. Detská klinika Lekárskej fakulty Univerzity Komenského a DFNsP, Bratislava prednostka doc. MUDr. O. Červeňová, CSc. 5; Klinika detskej hematológie a onkológie Lekárskej fakulty Univerzity Komenského a DFNsP, Bratislava prednostka doc. MUDr. E. Kaiserová, CSc. 6; Centre of Chronic Immunodeficiency (CCI), University Medical Centre and University of Freiburg, Freiburg im Breisgau, Německo 7
Vyšlo v časopise: Čes-slov Pediat 2013; 68 (2): 67-77.
Kategorie: Původní práce
Souhrn
X-lymfoproliferativní syndrom (XLP) je vzácná vrozená imunodeficience vyskytující se s incidencí 1–3 nemocných na 1 milion chlapců. Příčinou onemocnění je poškození genu SH2D1A (u XLP-1), resp. BIRC4 (u XLP-2). Většina klinických příznaků se u obou podjednotek překrývá (např. těžce probíhají infekční mononukléoza, resp. hemofagocytující lymfohistiocytóza – HLH, porucha tvorby imunoglobulinů), jiné jsou typické pouze pro jednotlivé podjednotky (např. maligní lymfom u XLP-1, hemoragická kolitida u XLP-2). Mezi vzácnější projevy patří aplastická anemie, vaskulitida, chronická gastritida a kožní obtíže. Jedinou kauzální léčbou je transplantace hematopoetických buněk (HSCT).
V České a Slovenské republice bylo dosud diagnostikováno 7 pacientů s XLP-1 a jeden pacient s XLP-2. Pacienti se narodili v rozmezí let 1961–2005, onemocnění se u nich projevilo s mediánem 4,5 let věku (19 měsíců – 16 let). Dva pacienti zemřeli na následky akutně probíhající HLH, jeden pacient zemřel při HSCT. Jeden pacient podstoupil úspěšnou HSCT, další 4 žijící pacienti nebyli transplantováni. Medián věku žijících pacientů je 22 let (17–27 let).
Autoři v textu shrnují poznatky o patofyziologii, diagnostice a léčbě XLP a popisují průběh onemocnění pacientů léčených v našich zemích.Klíčová slova:
X-lymfoproliferativní syndrom, primární imunodeficience, transplantace hematopoetických buněk, SAP, XIAPÚVOD
X-lymfoproliferativní syndrom je vzácné vrozené onemocnění charakterizované extrémní citlivostí k infekci virem Epsteina-Barrové (EBV). Tato infekce často vede k rozvoji fulminantní infekční mononukleózy (FIM), resp. syndromu hemofagocytující lymfohistio-cytózy (HLH), způsobeného masivní nekontrolovanou aktivací T lymfocytů a makrofágů. Jedná se o život ohrožující stav, který se projevuje horečkou s (hepato)splenomegalií, lymfadenopatií, krvácivými projevy, postižením centrálního nervového systému (CNS) a provázený laboratorním obrazem progredující pancytopenie se snížením sérové hladiny fibrinogenu, zvýšením hladin feritinu a triacyl-glycerolů. Specifickým markerem HLH je nález hemofagocytujících makrofágů v kostní dřeni nebo slezině a aktivace cytotoxických lymfocytů [1]. Kromě HLH je u pacientů často přítomna porucha produkce protilátek. U většiny pacientů se v průběhu života rozvine hypogamaglobulinemie. Ostatní projevy nemoci jsou vzácnější (graf 1) [2, 3].
Graf 1. Klinické příznaky X-vázaného lymfoproliferativního onemocnění. Údaje v procentech na ose X jsou adaptovány z práce Pachlopnik-Schmid et al. [4], n (XLP-1) = 30, n (XLP-2) = 33 ![Klinické příznaky X-vázaného lymfoproliferativního onemocnění. Údaje v procentech na ose X jsou adaptovány z práce Pachlopnik-Schmid et al. [4], n (XLP-1) = 30, n (XLP-2) = 33](https://pl-master.mdcdn.cz/media/image/92c5e53f443d5ff7fc4249f3f663629b.jpg?version=1537795324)
Jednou z příčin XLP je mutace v genu SH2D1A kódující malý (16 kD) adaptorový protein SAP (Signaling Lymphocyte Activation Molecule (SLAM) – Associated Protein), který hraje důležitou roli v signalizaci receptorů ze skupiny SLAM. Tato varianta onemocnění se označuje XLP-1. XLP-2 je podmíněno poškozením anti-apo-ptotického proteinu XIAP (X-linked inhibitor of apoptosis) kódovaného genem BIRC4. Oba geny jsou umístěny na chromozomu X [2–4].
XLP-1
Adaptorový protein SAP je přítomen především v T, NK a tzv. NKT buňkách rozpoznávající glykosfingolipidové antigeny prezentované CD1d molekulou [2, 5, 6]. Hlavní funkcí proteinu je přenos signálu ze SLAM receptorů (SLAM/CD150, 2B4/CD244, Ly-9/CD229, NTB-A, CD84, CRACC/CD319), které hrají významnou signalizační úlohu u buněk hematopoetického původu. Kromě molekuly 2B4/CD244 slouží všechny molekuly zároveň i jako ligandy (self-ligands). SAP hraje roli v produkci Th2 cytokinů, při cytotoxicitě CD8poz T lymfocytů a NK buněk, ve vývoji NKT buněk, interakci T a B lymfocytů, tvorbě germinálních center v lymfatických orgánech a při regulaci aktivace T lymfocytů [2, 7]. Poškození funkce SAP proteinu tak představuje komplexní poruchu signalizace, která se projevuje přímo v buňkách, které protein za normálních okolností exprimují (T, NK, NKT buňky), ale i u ostatních lymfocytárních subpopulací (např. B buněk). Tento efekt je dán poruchou komunikace mezi jednotlivými buňkami.
Narušení mezibuněčné interakce lze demonstrovat na příkladu EBV infekce. EB virus napadá B buňky, které v reakci na tuto infekci zvyšují mnohonásobně povrchovou expresi molekuly CD48. Tato molekula se váže na receptor 2B4/CD244 na cytotoxických buňkách (T a NK buňky) a skrze SAP v souhře s dalšími receptory spouští cytotoxickou reakci vedoucí k eliminaci infikované B buňky. V případě absence SAP proteinu vysílá receptor 2B4/CD244 do nitra buňky negativní signál, který cytotoxický proces inhibuje. EBV infekce se tak může vymknout kontrole [8].
Kromě fulminantně probíhající primoinfekce EB virem jsou další typickou manifestací maligní lymfom (typicky B buněčného původu) a kombinovaný variabilní imunodeficit (CVID, Common Variable ImmunoDeficiency). Tyto příznaky nemusí vždy vznikat v kauzální souvislosti s infekcí EBV [9, 10]. Se zvyšující se dostupností molekulárně genetické diagnostiky je nalézáno poškození genu SH2D1A i v případě širšího spektra imunopatologických onemocnění, např. u CNS vaskulitidy [11], chronické aktivní gastritidy [12], juvenilní revmatoidní artritidy [13] a aplastické anemie [10, 14].
XLP-2
XLP-2 je způsoben poruchou proteinu XIAP [15], jehož funkce se od SAP proteinu diametrálně liší. XIAP patří do širší rodiny IAP (inhibitor of apoptosis protein) molekul. XIAP blokuje apoptózu inhibicí aktivovaných kaspáz. Kromě této funkce je XIAP zapojen do řady signalizačních drah (např. metabolismus mědi, aktivace NFκB, MAP (Mitogen Activated Pathway) a TGFβ [15]. Na rozdíl od proteinu SAP se XIAP vyskytuje ve většině buněk organismu. Zvýšená exprese XIAP u řady nádorů přispívá k chemorezistenci tkáně a má negativní prognostickou hodnotu [16]. V současné době probíhají klinické studie s několika terapeutiky inhibujícími tento protein [17]. Vzhledem k roli, kterou XIAP hraje při rozvoji XLP, lze očekávat, že použití blokátorů XIAP bude mít zásadní nežádoucí účinky [18]. Stejně jako v případě XLP-1 je i u XLP-2 typickým a nejzávažnějším projevem nemoci HLH. Patofyziologický mechanismus není dosud vysvětlen. U velké části pacientů lze již v předchorobí HLH identifikovat významnou splenomegalii. Na rozdíl od XLP-1 nebyl zatím u žádného pacienta s XLP-2 popsán maligní lymfom. Porucha produkce imunoglobulinů u XLP-2 se zdá být častěji tranzientní, pravděpodobně související s poškozením imunitního systému při atace HLH či následkem imunosuprese [2]. Jsou ale popsáni i pacienti dlouhodobě vyžadující substituci imunoglobulinů podobně jako v případě XLP-1 [4]. Někteří pacienti trpí chronickou hemoragickou kolitidou [4].
DIAGNOSTIKA
Při podezření na XLP je na prvním místě v diagnostice intracelulární detekce příslušných proteinů, a to buď pomocí průtokové cytometrie nebo western blotu. Výhodou cytometrického vyšetření je relativní nenáročnost testu, získání okamžitého výsledku a možnost identifikace nosiček postiženého genu. Toto vyšetření však neposkytuje žádné informace o funkčnosti daného proteinu. V případě missense mutace v genu kódující protein, která neovlivňuje jeho expresi, může tak být toto vyšetření falešně negativní (protein je detekován, je však nefunkční). Dalším vyšetřením je průkaz NKT buněk pomocí průtokové cytometrie. U obou typů onemocnění jsou počty těchto buněk sníženy, v případě XLP-1 většinou chybí úplně. Tento test je však poměrně málo citlivý, protože počet NKT buněk je i u zdravých jedinců velmi malý (v řádu desetin procent z lymfocytů).
SAP i XIAP hrají mimo jiné důležitou roli při udržení homeostázy T lymfocytů pomocí apoptózy. Toho lze diagnosticky využít pomocí in vitro testu apoptózy při aktivaci T lymfocytů (AICD – Activation Induced Cell Death nebo RICD – Reactivation Induced Cell Death). V případě SAP deficitu je počet buněk vstupujících do apoptózy snížen, v případě XIAP deficitu je tomu přesně naopak. U XLP-1 lze in vitro testovat schopnost aktivovaných cytotoxických buněk (T a NK buňky) likvidovat infikované B buňky (v autologním nebo alogenním systému). U pacientů je tato schopnost snížena. Všechny tyto testy jsou technicky náročné a lze je provádět pouze ve specializovaném centru.
K definitivnímu stanovení diagnózy je nutné molekulárně genetické vyšetření (nyní dostupné i v České republice, v genetické laboratoři CKTCH Brno). V případě potřeby je možné provést i prenatální vyšetření.
LÉČBA
Léčba pacientů s XLP-1 závisí na klinické prezentaci onemocnění. Pacienti s hypogamaglobulinemií by měli být substituováni. Tato léčba však nezabrání primoinfekci EBV [2]. U několika pacientů s prokázaným XLP-1, kteří byli prospektivně monitorováni, byla úspěšně použita anti-CD20 monoklonální protilátka (rituximab) k zastavení rozvoje EBV infekce [19]. V případě aktivní HLH je nutné použít standardní léčebné protokoly, tj. kombinaci etoposidu, dexamethasonu a cyklosporinu A [20, 21]. Jedinou kauzální léčbou XLP-1 je v současnosti HSCT. Nedávno publikovaná studie retrospektivně popisující klinický průběh u 91 pacientů s XLP-1 ukázala 81% přežití při této léčbě [3]. Překvapivým nálezem v této studii byla však relativně příznivá prognóza i pacientů, kteří nebyli transplantováni (63% přežití). Tento údaj se však nevztahuje na pacienty, kteří prodělali HLH. Z této skupiny přežilo bez HSCT pouze 19 % pacientů. U těchto pacientů je tedy indikace k HSCT nesporná, u ostatních je HSCT taká doporučována, jasný konsenzus však chybí.
Vzhledem k malému počtu dosud identifikovaných pacientů s XLP-2 není optimální terapie u této skupiny známa. U XLP-2 pacientů se často rozvine HLH, ve velkém procentu případů také dochází k recidivám. Stejně jako u XLP-1 probíhá léčba HLH podle zavedených protokolů. Ačkoli je HLH život ohrožující stav, dosavadní data ukazují, že mortalita je v průběhu HLH u pacientů s XLP-2 nižší než u XLP-1 [2, 3]. Použití rituximabu může být u EBV infekce i u těchto pacientů přínosné [22]. Údajů o prognóze pacientů s XLP-2 je v tuto chvíli málo. V práci, která onemocnění poprvé popsala, se uvádí úmrtí 25 % pacientů v rozmezí 6 měsíců až 41 let. Příčinou byla ve všech případech HLH. Jeden pacient zemřel v průběhu HSCT [15]. V novější práci stejné autorské skupiny se již uvádí úmrtí 40 % pacientů v rozmezí 1 měsíce až 52 let [4]. Indikační kritéria HSCT nejsou dosud jasná. Některá centra přistupují k transplantaci vždy, pokud je dostupný vhodný dárce. Přednost je dávána méně toxickému (redukovanému) přípravnému režimu [2].
KAZUISTIKY
V následující části stručně představujeme pacienty s X-vázaným lymfoproliferativním syndromem (XLP-1 i XLP-2), kteří byli diagnostikováni na území České a Slovenské republiky (tab. 1). Jednotlivé rodiny jsou označeny písmeny, postižení jedinci čísly. Informace o rodině A a B byla nedávno částečně publikována [10].
Tab. 1. Charakteristika českých a slovenských pacientů s X-vázaným lymfoproliferativním onemocnění (XLP), n = 8. 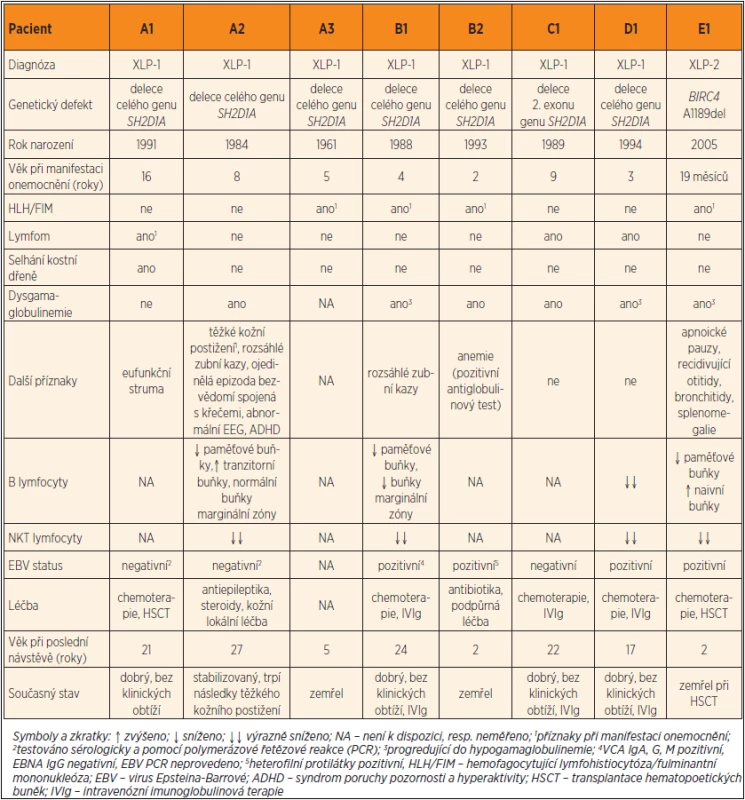
Pacient A1
U pacienta A1 se v 16 letech věku v průběhu 1 měsíce rozvinula krční, axilární a abdominální lymfadenopatie (obr. 1), chlapec byl zvýšeně unavený, ubýval na hmotnosti, noční poty ani febrilie nebyly přítomny. Dále byl zjištěn ascites a rychle progredující pleu-rální výpotek. Histopatologické vyšetření exstirpované axilární uzliny potvrdilo diagnózu lymfomu Burkittova typu s typickou translokací t(8;14). Chlapec byl léčen podle protokolu BFM 04 B-NHL, dosáhl remise. Za tři měsíce po ukončení léčby se objevila výrazná pancytopenie. Pomocí FDG-PET/CT byla vyloučena recidiva lymfomu. Cytologie a histologie z trepanobiopsie kostní dřeně potvrdila diagnózu těžkého selhání kostní dřeně. Molekulárně genetické vyšetření SH2D1A, které potvrdilo diagnózu XLP-1, bylo indikováno na základě atypické asociace lymfomu a selhání kostní dřeně. Jako standardní léčebný postup u selhání kostní dřeně byl pacient indikován k HSCT od HLA-identického bratra (HLA shoda 9/10), u něhož byla předem vyloučena mutace v SH2D1A genu. V současné době je pacient téměř 4 roky po nekomplikované transplantaci, zdráv a bez jakékoli léčby.
Obr. 1. CT snímek při diagnóze Burkitt-like lymfomu u pacienta A1. Na snímku je patrná krční, axilární a abdominální lymfadenopatie a ascites. Fig. 1. CT imaging in patient A1 with the diagnosis of Burkitt-like lymphoma. The image shows cervical, axillary and abdominal lymphadenopathy and ascites. 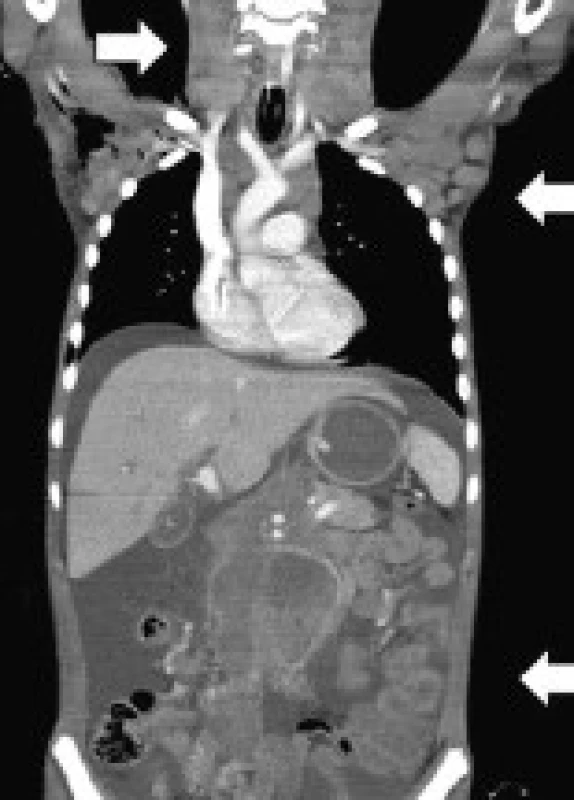
V rámci genetického vyšetření dalších rodinných příslušníků bylo zjištěno stejné genetické postižení u maternálního bratrance (pacient A2), který však neměl typické příznaky XLP-1.
Pacient A2
Pacient A2, výše zmíněný maternální bratranec pacienta A1, prodělal ve 3 letech věku epizodu krátkého bezvědomí. Na základě abnormálního nálezu při elektroencefalografickém vyšetření (EEG) byla zahájena antiepileptická terapie. Kraniální CT bylo bez patologického nálezu. Neurologické obtíže se již neopakovaly. Antiepileptická léčba byla ukončena ve 13 letech života. Po vysazení léčby byl chlapec i nadále bez neurologických příznaků. V raném dětství se u chlapce manifestoval syndrom poruchy pozornosti a hyperaktivity (ADHD), dyslexie a dysgrafie. Psychomotorický vývoj byl opožděn. Nicméně při testování ve 26 letech věku byly jeho kognitivní a intelektuální schopnosti, paměť a emocionální reakce v mezích normy.
V 8 letech věku se u něho objevila atrofie kůže a šupinatění na dorzálních partiích rukou a nohou spojené s depigmentací na končetinách a trupu. Byla stanovena diagnóza psoriázy. Po histologickém vyšetření postižené kůže byla diagnóza změněna na sclerodermia-like syndrom. Podezření na idio-synkrastickou reakci způsobenou užíváním antiepiletik (karbamazepin, fenobarbital, valproát) se nepotvrdilo. Dva roky po začátku kožních obtíží progredovaly eflorescence do drobných kapkových depigmentací kolem kloubů spojené s puchýři na akrálních částech končetin. Závažnost postižení kulminovalo ve 13 letech věku. Vzhledem k bulóznímu charakteru lézí byla zvažována diagnóza dystrofické formy bulózní epidermolýzy. Laboratorní vyšetření nicméně toto podezření nepotvrdilo. Chlapec byl léčen lokální terapií a intermitentně systémovými kortikoidy. Kožní projevy oscilovaly s tendencí ke zlepšování a stabilizaci. Postupně však došlo k těžkému jizvení podkožní tkáně vedoucí k restrikci pohybu v kloubech pod postiženou tkání (lokty, kolena, drobné klouby rukou) a těžké mutilaci rukou a nohou (obr. 2). Sliznice byly po celou dobu intaktní. V současné době je potřeba lokální péče o postiženou kůži, jiná terapie není nutná.
Obr. 2. a, b. Reziduální kožní postižení u pacienta A2 ve věku 26 let. Fig. 2a, b. Residual skin affection in patient A2 at the age of 26 years. 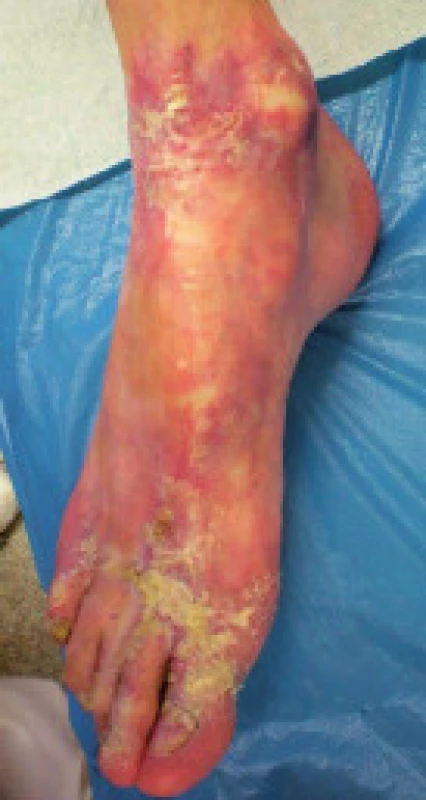
Pacient A3
Zpětně bylo zjištěno, že v rodině A byl další postižený chlapec, a to maternální strýc pacienta A1. Narodil se v roce 1961 a zemřel na jaterní selhání pod obrazem FIM ve věku 5 let.
Pacient B1
U pacienta B1 se ve 4 letech věku manifestovala těžká bronchopneumonie, fluidothorax a hepatomegalie, následované multiorgánovým selháním. Přítomnost aktivovaných histiocytů v ascitu vedla k diagnóze maligní histiocytózy a pacient byl urgentně léčen kombinovanou chemoterapií. Chlapec byl indikován k HSCT, ta však byla rodiči odmítnuta. V průběhu několika měsíců po ukončení chemoterapie se manifestovala panhypogamaglobulinemie. Od té doby je nutná imunoglobulinová substituce. Molekulárně genetické vyšetření potvrdilo diagnózu XLP-1.
Pacient B2
Mladší bratr pacienta B1 zemřel na multiorgánové selhání pod obrazem HLH/FIM ve 2 letech věku.
Pacient C1
Chlapec byl v 9 letech hospitalizován pro příznaky akutní břišní příhody s perforací terminálního ilea. Byl zjištěn B-buněčný NHL lymfom, léčený podle protokolu NHL-BFM 95. Následně byla genetickým vyšetřením potvrzena diagnóza XLP-1 a pacient byl indikován k HSCT, k výkonu však nedošlo. Zprvu se nepodařilo najít vhodného dárce, později byla transplantace odmítána rodiči i pacientem. V současnosti je chlapcův celkový stav dobrý, je prakticky bez obtíží, studuje na vysoké škole. Vzhledem k hypogamaglobulinemii je u něho zavedena domácí subkutánní substituční imunoglobulinová léčba.
Pacient D1
U pacienta D1 byl ve 3 letech věku zjištěn v oblasti radix mesenterii v dutině břišní zralý lymfom Burkittova typu. Chlapec byl léčen podle protokolu NHL-BFM 90, dosáhl remise. Ve 12 letech věku se objevil opět Burkittův lymfom v břišní dutině, translokace t(8,14) nebyla přítomna. Léčba probíhala podle protokolu NHL-BFM 95, chlapec opět dosáhl remise. V 16 letech věku se u pacienta manifestovala infekční mononukleóza (febrilie, krční lymfadenopatie, faryngitida, hepatosplenomegalie s hepatopatií, prchavý exantém a prolongovaná únava), při pravděpodobné EBV infekci. Pozoruhodný byl nález velmi malého počtu B-buněčných prekurzorů v kostní dřeni a téměř úplné chybění B lymfocytů v periferní krvi, výrazná neutropenie a relativní eozinofilie. Po stanovení diagnózy XLP-1 pomocí molekulárně genetického vyšetření byl chlapec indikován k HSCT. Tento postup však nebyl rodiči schválen. Nyní je chlapec bez klinických obtíží, léčen pravidelnou substituční imunoglobulinovou terapií.
Pacient E1
Poslední chlapec z našeho souboru se narodil ve 35. týdnu gravidity, poporodní adaptace byla komplikována přechodnou hypotonií a akrocyanózou. V 6 týdnech věku se u něho objevily poruchy vědomí s apnoickými pauzami. Sonografické vyšetření srdce neprokázalo strukturální abnormalitu, EEG vyšetření mozku bylo s normálním nálezem. Do 19 měsíců věku byl chlapec přibližně 10krát léčen antibiotiky pro opakované respirační infekty a více jak 20krát u něho byla provedena paracentéza pro hnisavou otitidu. Ve 13 měsících podstoupil adenotomii, o měsíc později byla provedena oboustranná mastoidektomie. V roce věku byla u chlapce zjištěna splenomegalie. Velikost sleziny se následně normalizovala, chlapec nebyl v této době podrobněji vyšetřen.
V 19 měsících věku se v odstupu několika hodin po očkování (Prevenar, Infanrix) objevila pyretická reakce. Po přechodném poklesu následoval opětovný vzestup teplot doprovázený febrilními křečemi. Byla zjištěna progredující hepatosplenomegalie, anemie, trombocytopenie, laboratorní obraz postupně splnil kritéria HLH. Na základě sérologických a PCR testů byla potvrzena aktivní EBV infekce. Byla stanovena diagnóza EBV-asociované HLH a chlapec byl léčen kombinovanou cytotoxickou léčbou podle protokolu HLH 2004 [21]. Stav se částečně zlepšil (vymizení teplot, ústup splenomegalie, úprava cytopenie), EBV infekce však zůstávala vysoce aktivní. Jednorázově byl podán rituximab. Vzhledem k přetrvávající aktivitě onemocnění byla indikována alogenní HSCT od nepříbuzného dárce. Molekulárně genetické vyšetření vyloučilo postižení SH2D1A, trvající podezření na XLP vedlo k vyšetření genu BIRC4. Nález mutace v tomto genu potvrdil diagnózu XLP-2 a vedl k redukci původně plánované intenzity přípravného režimu s vyloučením busulfanu (Fludara, Melfalan, Campath). I přes tuto úpravu léčby pacient zemřel 13 dní po převodu štěpu pod obrazem multiorgánového selhání na podkladě kombinace toxicity přípravného režimu a aktivity HLH.
DISKUSE
X-vázaný lymfoproliferativní syndrom má variabilní průběh a jeho klinické projevy mohou být velmi různorodé, a to i při zcela stejném genetickém postižení v rámci jedné rodiny (viz rodina A).
U všech našich pacientů, kteří prodělali FIM/HLH, byla zjištěna přítomnost EBV. Tato infekce není nezbytnou podmínkou vzniku FIM/HLH, ale je u těchto pacientů častější, jak ukazují Booth et al. [3]: z pacientů, kteří prodělali FIM/HLH, bylo 64 % EBV-pozitivních a 21 % EBV-negativních (u ostatních nebyla informace o EBV k dispozici). Dlouhodobá prognóza pacientů infikovaných EBV i bez této infekce se zdá být ale podle údajů v této studii stejná.
Pacient D1, u kterého byl opakovaně diagnostikován NHL lymfom Burkittova typu (ve 3 a 12 letech), prodělal v 16 letech infekční mononukleózu. Průběh onemocnění byl překvapivě mírný, chlapec nebyl transplantován a nyní, přibližně rok po manifestaci infekce, je v pořádku. Příznivější průběh EBV infekce byl nejspíše spojen s absencí B lymfocytů (0,2 % CD19+ z lymfocytů při absolutním počtu lymfocytů 3,0 x 109/l).
Pozoruhodným nálezem v našem souboru je vysoká frekvence rozsáhlých delecí X chromozomu postihující u některých pacientů celý gen SH2D1A (tab. 1).
Nejzajímavější a novou skutečností jsou kožní projevy XLP u pacienta A2. V dostupné literatuře jsou k dispozici pouze kusé zprávy o kožním postižení u pacientů s XLP-1, např. kožní lichenifikace, depigmentace a psoriáza [3, 23]. Spojitost těžkého bulózního kožního onemocnění s XLP nebyla dosud popsána. Předpokládáme, že kožní defekt u pacienta A2 je autoimunitního původu a je spojen s dysregulací imunitního systému při deficitu SAP proteinu. V době analýzy nebyly u pacienta lokálně ani systémově zjištěny žádné autoprotilátky. Důvodem je zřejmě to, že analýza byla provedena až několik let po období největších obtíží a v té době byly kožní změny již reziduální. Hypotetická přechodná přítomnost autoprotilátek může být vysvětlena narušením homeostázy B lymfocytů. Hypergamaglobulinemie postupně progredující do hypogamaglobulinemie je známým příznakem XLP-1. Autoreaktivní klony B lymfocytů mohou pravděpodobně vymizet společně s ostatními B lymfocyty.
Celkové přežití našich pacientů s XLP-1, kteří nepodstoupili HSCT, odpovídá publikovaným údajům (4/6, tj. 66 %) [3]. Po FIM/HLH dlouhodobě přežívá 1 netransplantovaný pacient (1/3), Booth et al. uvádí 19% přežití. Pacienti, kteří neprodělali FIM/HLH a nepodstoupili HSCT, přežívají všichni (3/3). Dva pacienti zemřeli pod obrazem FIM/HLH krátce po manifestaci onemocnění (v letech 1966 a 1995). Další pacient (XLP-2), který podstoupil HSCT, zemřel následkem vysoké aktivity nemoci a toxicity léčby. Snížená tolerance cytotoxické léčby je pravděpodobně podmíněna vlastním onemocněním; bezpečnější je použití režimu s redukovanou intenzitou [24].
Diagnóza XLP-1/2 by měla být zvážena u chlapců s klasickými příznaky onemocnění (s poruchou tvorby protilátek či fulminantní infekční mononukleózou, resp. HLH), ale také v případě méně častých příznaků, jako je opakovaná diagnóza NHL, případně asociovaného s těžkou aplastickou anemií, resp. selháním kostní dřeně. Nově je také nutné zvažovat diagnózu XLP i u atypického kožního poškození. Po stanovení diagnózy je vhodné pozitivní jedince dlouhodobě sledovat, a to i v případě, že jsou asymptomatičtí nebo mají nezvyklé příznaky.
Poděkování
Práce byla financována grantem IGA NT13271 a CZ.1.05/1.1.00/02.0068 a částečně také podpořena v rámci projektu koncepčního rozvoje výzkumné organizace 00064203. Dr. Janda je stipendistou fellowship programu Evropské společnosti pro imunodeficience (ESID) financované firmou Baxter.
Došlo: 23. 6. 2012
Přijato: 4. 10. 2012
MUDr. Aleš Janda, MSc., PhD.
Centre of Chronic Immunodeficiency (CCI)
University of Freiburg
Breisacher Str. 117
79106 Freiburg im Breisgau
Německo
e-mail: ales.janda@uniklinik-freiburg.de
Zdroje
1. Suková M, et al. Hemophagocytic lymphohistiocytosis syndrome. Hemofagocytující lymfohistiocytóza. Vnitř Lék 2010; 56 (Suppl 2): 2S157–2S169.
2. Filipovich AH, et al. X-linked lymphoproliferative syndromes: brothers or distant cousins? Blood 2010; 116 (18): 3398–3408.
3. Booth C, et al. X-linked lymphoproliferative disease due to SAP/SH2D1A deficiency: a multicenter study on the manifestations, management and outcome of the disease. Blood 2011; 117 (1): 53–62.
4. Pachlopnik Schmid J, et al. Clinical similarities and differences of patients with X-linked lymphoproliferative syndrome type 1 (XLP-1/SAP-deficiency) versus type 2 (XLP-2/XIAP-deficiency). Blood 2011; 117 (5):1522–1529.
5. Sayos J, et al. The X-linked lymphoproliferative-disease gene product SAP regulates signals induced through the co-receptor SLAM. Nature 1998; 395 (6701): 462–469.
6. Bolino A, et al. A new candidate region for the positional cloning of the XLP gene. Eur J Hum Genet 1998; 6 (5): 509–517.
7. Snow AL, et al. Restimulation-induced apoptosis of T cells is impaired in patients with X-linked lymphoproliferative disease caused by SAP deficiency. J Clin Invest 2009; 119 (10): 2976–2989.
8. Dong Z, Veillette A. How do SAP family deficiencies compromise immunity? Trends Immunol 2010 Aug; 31 (8): 295–302.
9. Strahm B, et al. Recurrent B-cell non-Hodgkin‘s lymphoma in two brothers with X-linked lymphoproliferative disease without evidence for Epstein-Barr virus infection. Brit J Haematol 2000; 108 (2): 377–382.
10. Mejstrikova E, et al. Skin lesions in a boy with X-linked lymphoproliferative disorder: comparison of 5 SH2D1A deletion cases. Pediatrics 2012; 129 (2): e523–528.
11. Talaat KR, et al. Lymphocytic vasculitis involving the central nervous system occurs in patients with X-linked lymphoproliferative disease in the absence of Epstein-Barr virus infection. Pediatr Blood Cancer 2009; 53 (6): 1120–1123.
12. Rougemont AL, et al. Chronic active gastritis in X-linked lymphoproliferative disease. Am J Surg Pathol 2008; 32 (2): 323–328.
13. Eckrich MJ, et al. A unique clinical presentation of X-linked lymphoproliferative syndrome with a novel mutation in SH2D1A and review of the literature. J Pediatr Hematol Oncol 2011; 33 (1): e39–42.
14. Purtilo DT. X-linked lymphoproliferative syndrome. An immunodeficiency disorder with acquired agammaglobulinemia, fatal infectious mononucleosis, or malignant lymphoma. Arch Pathol Lab Med 1981; 105 (3): 119–121.
15. Rigaud S, et al. XIAP deficiency in humans causes an X-linked lymphoproliferative syndrome. Nature 2006; 444 (7115): 110–114.
16. Kashkar H. X-linked inhibitor of apoptosis: a chemoresistance factor or a hollow promise. Clin Cancer Res 2010; 16 (18): 4496–4502.
17. Flygare JA, et al. Discovery of a potent small-molecule antagonist of inhibitor of apoptosis (IAP) proteins and clinical candidate for the treatment of cancer (GDC-0152). J Med Chem 2012; 55 (9): 4101–4113.
18. Latour S. Natural killer T cells and X-linked lymphoproliferative syndrome. Current Opinion in Allergy and Clinical Immunology 2007; 7 (6): 510–514.
19. Milone MC, et al. Treatment of primary Epstein-Barr virus infection in patients with X-linked lymphoproliferative disease using B-cell-directed therapy. Blood 2005; 105 (3): 994–996.
20. Henter JI, et al. Treatment of hemophagocytic lymphohistiocytosis with HLH-94 immunochemotherapy and bone marrow transplantation. Blood 2002; 100 (7): 2367–2373.
21. Henter JI, et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis. Pediatr Blood Cancer 2007; 48 (2): 124–131.
22. Marsh RA, et al. XIAP deficiency: a unique primary immunodeficiency best classified as X-linked familial hemophagocytic lymphohistiocytosis and not as X-linked lymphoproliferative disease. Blood 2010; 116 (7): 1079–1082.
23. Grosieux C, et al. Cutaneous and neurologic vasculitis disclosing EBV-selective immunodeficiency. Ann Dermatol Venereol 1996; 123 (6–7): 387–392.
24. Marsh RA, et al. Allogeneic hematopoietic cell transplantation for XIAP deficiency: an international survey reveals poor outcomes. Blood 2012; 121 (6): 877–883.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Dievča s karyotypom 46, XY
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2013 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Deficit transkripčního faktoru GATA-2: nová imunodeficience se širokým fenotypovým spektrem. První pacienti diagnostikovaní v České republice a přehled literatury
- Dievča s karyotypom 46, XY
- Vývoj střevní mikroflóry a rizika používání probiotik u imunosuprimovaných dětí
- Adrenarché praecox (předčasné pubické a/nebo axilární ochlupení)
- Telarché praecox (předčasný vývoj prsů)
-
Peter J. Adasek, MD,
jmenován profesorem na Lékařské fakultě v Coloradu, USA - Přehled pacientů s diagnózou X-vázaného lymfoproliferativního onemocnění (XLP) diagnostikovaných v České republice a na Slovensku
- Emoční reakce vyvolaná textovými zdravotními varováními na obalech tabákových výrobků u dětí staršího školního věku a adolescentů
- Súvis génových polymorfizmov glutatión S-transferázy T1 a M1 s mikroalbuminúriou a incipientnou nefropatiou u detí s diabetes mellitus 1. typu
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Telarché praecox (předčasný vývoj prsů)
- Adrenarché praecox (předčasné pubické a/nebo axilární ochlupení)
- Dievča s karyotypom 46, XY
- Vývoj střevní mikroflóry a rizika používání probiotik u imunosuprimovaných dětí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




