-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vliv menarché na hladinu cholesterolemie u adolescentních dívek s familiární hypercholesterolemií
The influence of menarche of high cholesterol level in adolescent girls with familial hypercholesterolemia
Menarche (first menstruation hemorrhage) due to increasing levels of sexual hormones decrease the total cholesterol level (TCH) in some girls with familial hypercholesterolemia (FH) up to 3–5 mmol/l. In the past this experience resulted in recommendation to begin with the pharmacological therapy of FH in girls only after menarche. Our experience however does not correspond to that.
In 20 girls at the age of 10–16 years diagnosed FH we had a chance to follow cholesterolemia in the course of their pharmacological therapy and in the last 20 years we observed the following relations to menarche:
- a) In 70% of patients with marked entry hypercholesterolemia (>8.0 mmol/l TCH) the decreased levels were fund to be only transitory and after several menstruation ccles the level of TCH returned to original high levels if the pharmacological therapy was not applied.
- b) In 30% of patients with inconspicuous hypercholesterolemia (6–8.0 mmol/l) half of them experienced lasting normal level of TCH which did not require pharmacological treatment. In the remaining 15% of girls with inconspicuous TCH level gradually increasing after several menstruations cycles to previous high levels and these patients require permanent pharmacological, optimally combined, therapy (ezetimib + statin).
Conclusion:
Our experience suggests a new recommendation to begin pharmacological therapy of FH in selected female patients with marked form of HC documented by mutation of LDL-receptor as early as in 8 years of life in the same was recommended in boys.Key words:
familial hypercholesterolemia, menarche, high cholesterol level changes after menarche, adolescent girls
Autoři: J. Hyánek 1; L. Dubská 1; V. Martiníková 1; J. Privarová 1; H. Přindišová 2; M. Zagyiová 1; L. Táborský 1
Působiště autorů: Metabolická ambulance a Oddělení klinické biochemie, hematologie, imunologie, Nemocnice Na Homolce, Praha primář MUDr. L. Táborský 1; Radiodiagnostické oddělení, Nemocnice Na Homolce, Prahaprimář prof. MUDr. J. Vymazal, DrSc. 2
Vyšlo v časopise: Čes-slov Pediat 2013; 68 (1): 12-19.
Kategorie: Původní práce
Souhrn
Menarché (první menstruační krvácení) vlivem zvyšujících se hladin pohlavních hormonů snižuje hladinu celkového cholesterolu (CCh) u některých děvčat s familiární hypercholesterolemií (FH) o 3–5 mmol/l. Tato zkušenost vedla v minulosti k doporučení zahajovat medikamentózní léčbu FH děvčat až po menarché. Naše zkušenosti však tomu neodpovídají.
U 20 děvčat ve věku 10–16 let s diagnostikovanou FH jsme měli možnost sledovat cholesterolemii v průběhu monitorování jejich medikamentózní léčby a za posledních 20 let jsme nalezli tyto závislosti na menarché:
- a) U 70 % pacientek s výraznou vstupní hypercholesterolemií (>8,0 mmol/l CCh) je snížení hladiny jenom tranzitorní a po několika menstruačních cyklech se hodnoty CCh opět navracejí bez medikamentózní léčby na původní vysoké hodnoty.
- b) U 15 % pacientek s nevýraznou hypercholesterolemií (6–8,0 mmol/l) dochází u poloviny dívek k trvalé normalizaci hladiny CCh, která přetrvává a nevyžaduje další medikamentózní léčbu. U zbylých 15 % dívek se hladina CCh po několika menstruačních cyklech pomalu zvyšuje na původní hodnoty a tyto pacientky vyžadují trvalou medikamentózní léčbu – nejlépe kombinovanou (ezetimib + statin).
Závěr:
Podle našich zkušeností se nabízí nové doporučení zahajovat medikamentózní léčbu FH u vybraných pa-cientek s výraznou formou FH doloženou závažnou mutací LDL-receptoru už od 8 let věku, jako je doporučována u chlapců.Klíčová slova:
familiární hypercholesterolemie, menarché, změny cholesterolemie po menarché, adolescentkyÚVOD
U dospívajících dívek v naší populace dochází k prvému menstruačnímu krvácení (menarché) mezi 10.–15. rokem a cyklická funkce neuroendokrinního systému hypothalamus-hypofýza-ovarium vyzrává ještě další 3–4 roky po menarché [1]. Počátek produkce estrogenů v ovariích (gonadarché) je vyvolán gonadotropními hormony. V dalším pohlavním vývoji je dospívání dívek ovlivňováno opakovaným vzestupem hladin FSH; zvýšení LH koinciduje až se samotným menarché. Těmto změnám odpovídají i individuální a poměrně nevýrazné změny lipidového spektra vyvolávané především estrogeny [7]. Už v pubertálním období se mírně liší cholesterolové hladiny děvčat a chlapců (graf 1). Zatímco u děvčat dochází postupně k mírnému poklesu, u chlapců průměrná cholesterolemie začíná narůstat a posléze převyšuje průměrné hodnoty děvčat. Menarché je výrazem velkých metabolických změn v celotělové rovnováze cholesterolu u adolescentních dívek pro výrazný nárust pohlavních hormonů, především estrogenů, které hladinu cholesterolu ovlivňují více než progesteron. Studie o těchto vlivech jsou velmi sporé. Odkazujeme proto na přehledné referáty Cibuly a Marka [2, 3]. Samotný estrogen působí metabolickou cestou zvýšení HDL, spolu s progestinem však působí cestou snížení LDL cholesterolu. Tímto faktem se vysvětluje i odlišné aterosklerotické poškození cév podle pohlaví: preference poškození velkých cév u žen a naopak poškození malých (koronárních) cév u mužů [4].
Graf 1. T ypické změny cholesterolemie v průběhu adolescence u chlapců a děvčat. 
Ve srovnání s výraznými změnami hladin pohlavních hormonů je menstruační cyklus provázen jen poměrně mírnými oscilacemi cholesterolemie (graf 2). Hormonální vyzrávání adolescentek probíhá podle individuálních a zřejmě geneticky podmíněných závislostí a my, protože nejsou dostatečně známé, je musíme než respektovat a podle dostupného spektra diagnostických metabolitů medikamentózní léčbu FH individuálně indikovat a zajišťovat. Např. aktivita PCSK9, která podle posledních poznatků rozhoduje o regulaci LDL-receptorů, během puberty ještě kolísá a dosahuje maxima teprve ve 13 letech – tedy většinou už po menarché [5].
Graf 2. Hormonální a metabolické změny v průběhu menstruačního cyklu (upraveno podle učebnice Hořejšího; cit. 1). 
Podle dosavadních doporučení pro medikamentózní léčbu familiární hypercholesterolemie (FH) u adolescentních děvčat je doporučováno její nasazení až po menarché, protože se „věří“ a očekává vlivem estrogenů spontánní pokles cholesterolemie [6, 7, 9, 10, 11, 12, 13]. Soustavně však nebyl vliv menarché na hladiny cholesterolemie sledován ani publikován.
Po dobu posledních 19 let, kdy byl v ČR zaveden nejprve fakultativní a potom obligatorní selektivní screening na zvýšené hladiny cholesterolu u dětí narozených v rizikových rodinách s výrazným kardiovaskulárním onemocněním [8], se nám daří metabolicky monitorovat hypercholesterolemii před a po menarché u více než 25 adolescentek na medikamentózní léčbě a můžeme proto předložit tuto první zprávu o získaných zkušenostech. Pro neúplná data bylo 5 pacientek ze studie vyřazeno (diabetes, hormonální antikoncepce, obezita).
PACIENTI A METODY
Dvacet dívek ve věku 10–16 let s prokázanou FH bylo podrobně metabolicky monitorováno během medikamentózní léčby v premenarchálním a postmenarchálním období; denní stabilizovaný příjem cholesterolu v přirozené potravě byl 300–350 mg. V kontrolní skupině bylo 53 dívek stejného věku z pražských škol vyšetřených při preventivních prohlídkách. Diagnóza FH byla stanovena na základě podrobného vyšetření rodinné anamnézy, sestavení nejméně třígeneračního rodokmenu a určení rizika rodinného výskytu kardiovaskulárního onemocnění (>30 Score) alespoň u jednoho z rodičů. Dále byla diagnóza ověřena pozitivními metabolickými a molekulárně genetickými markery: celkový cholesterol (CCh) >6,0 mmol/l; apoB >1,2 g/l; sdLDL >0,9 mmol/l; Lp(a) >0,5 g/l; pozitivní molekulárně genetický nález deficitu LDL-receptorů; nález pozitivity polymorfismu apo E3/4 nebo E4/4; u vybraných pacientek měření tloušťky intimální stěny a. carotis com. spolu s a. femoralis na přístroji Vigmed Sound.
Rutinní biochemické, hematologické a imunologické vyšetření bylo prováděno na analyzátorech Synchron LX20 Beckman-Coulter, Advia 120 Bayer; Lp(a), apoB, apoA1 imunochemicky na Immulite nebo Immage Immunochemistry System (Beckman-Coulter); sdLDL testem „sLDL-EX Seiken“; LH, FSH, estradiol, progesteron RIA metodikou a IRMA metodikou. Molekulárně genetická analýza genových mutací pro LDL-receptory (LDL-R) byla vyšetřena laskavostí agentury MedPed Brno (MUDr. Freiberger). Přehled dosud nalézaných mutací LDL-R u našich pacientů je uveden v tabulce 1. S grantovou podporou byly vyšetřovány i prekurzory syntézy cholesterolu a fytosteroly GC/MS metodou na analyzátoru Finnigan 120. Monitorace výšky a hmotnosti na PC programu „Růst“ (Krásničanová-Lesný, 2002); sexuální zrání bylo určováno podle Tannera a spol., 1974; kožní řasa měřena kaliperem Best.
Tab. 1. Seznam všech dosud nalezených mutací LDL-receptorů u pacientů s familární hypercholesterolemií z naší metabolické ambulance v letech 1999–2011 (n = 169). 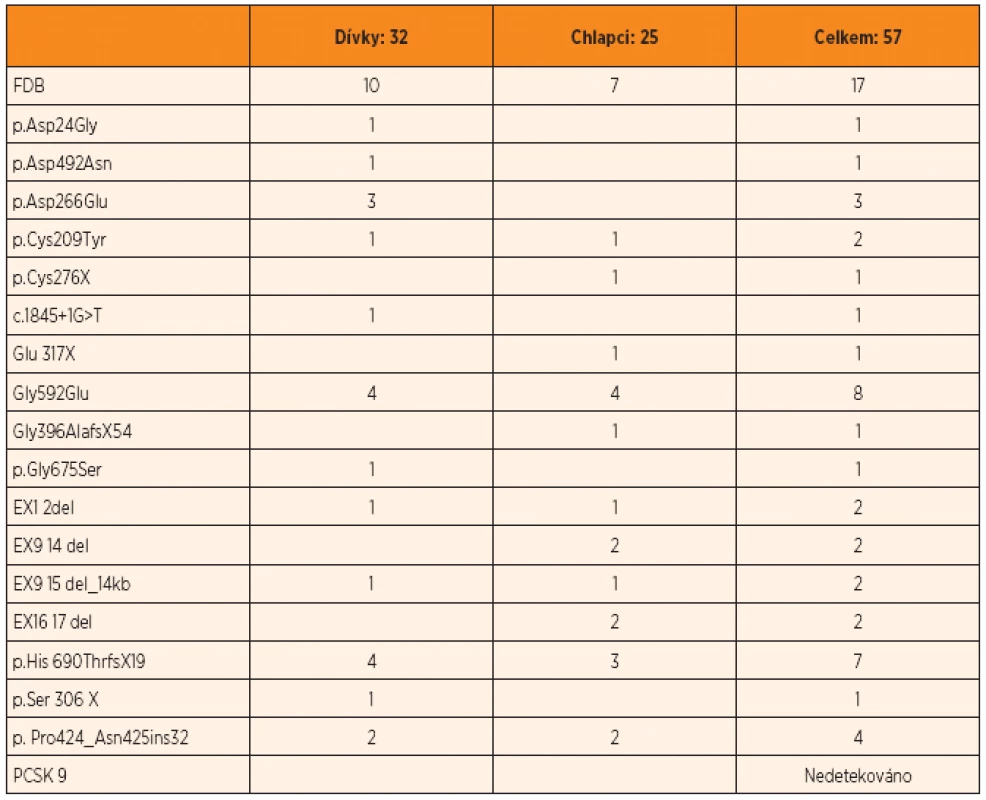
Kombinovaná medikamentózní léčba (ML) FH u adolescentek byla vedena simvastatinem (5–10 mg v kombinaci s ezetimibem 5–10 mg/d); ML byla podrobně popsána v roce 2006 v Čes.-slov. pediatrii [14].
Statistická analýza metabolických markerů byla prováděna chí-kvadrát testem a t-testem při statistické významnosti p <0,05; dvoufaktorová analýza programem ANOVA a histogramy programem MEDCALC 8.1.1.
VÝSLEDKY
Grafický záznam monitorovaných hladin cholesterolemie u všech sledovaných adolescentek v perimenarchálním období je uveden na grafu 3 (M – označuje aktuální cholesterolemii bez medikamentózní léčby v okamžiku nástupu menarché). Z dlouhodobých monitorovacích grafů hladin cholesterolemie je patrno, že u 70 % pacientek se vstupní hladinou CCh >10 mmol/l (tj. heterozygotek pro deficit LDL-R a u homozygotky pro deficit apoB (FDB)) je pokles CCh vlivem menarché sice dosti zřetelný – max. o 3–5 mmol/l, ale přechodný; po několika menstruačních cyklech se hladiny CCh bez ML navrací k jejich původním vysokým vstupním hodnotám. Takto se manifestovaly zejména mutace pro LDL-R: p.Asp266Glu; p.Cys209Tyr; c.2064del; c.1272ins96 a také FDB (graf 4).
Graf 3. Změny cholesterolemie u souboru všech adolescentek s familiární hypercholesterolemií během perimenarchálního období (M – menarché). 
Graf 4. Změny cholesterolemie u adolescentek s familiární hypercholesterolemií, kde byly nalezeny závažné mutace LDL-receptorů v průběhu perimenarchálního období (M – menarché). 
U 30 % hypercholesterolemických adolescentek s nižší vstupní hladinou CCh (6–8 mmol/l), u kterých byla často diagnóza FH doložena jen pozitivním anamnestickým a metabolickým vyšetřením s negativním nálezem genové mutace pro LDL-R, poklesla hladina CCh po menarché až k normálním terapeu-tickým hladinám, tj. 4,8 mmol/l (graf 5). Její změny po dalších menstruačních cyklech je možno rozdělit do dvou skupin. Jedna polovina adolescentek (15 %) setrvávala v dalším vývoji na normálních hladinách CCh i bez ML, zatímco druhá polovina adolescentek (15 %) i bez závislosti na výsledku molekulárně genetického vyšetření se vracela k původním vysokým hodnotám a musela být opět navedena na původní ML. Praktické příklady monitorování cholesterolemie u homozygotky pro FDB a další heterozygotky s významnou mutací LDL-receptoru jsou uvedeny v grafech 6 a 7.
Graf 5. Monitorovaná cholesterolemie u adolescentek s familiární hypercholesterolemií, kde nebyly prokázány závažné mutace LDL-receptorů v perimenarchálním období (M – menarché). 
Graf 6. Příklad monitorované cholesterolemie u pacientky s deficitem LDL-receptoru (homozygotní mutace FDB). 
Graf 7. Praktické monitorování cholesterolemie u pacientky s heterozygotním deficitem LDL-receptoru (mutace c.1272_1273ins96). 
Sledovali jsme změny hypercholesterolemie v průběhu menarché také v závislosti na polymorfismu apoE (2/4, 3/4, 4/4), ale žádnou významnou změnu jsme nepozorovali. Je zajímavé, že i další sledované lipidové markery (TAG a Lp(a)) žádné podobné změny u našich pacientek vlivem menarché nevykazovaly. Statistické významné změny IMT během ML popisované Wiegmanem a spol. jsme u většiny našich pacientek dostupnou technikou nemohli potvrdit.
DISKUSE
Z našeho stále jen relativně malého souboru adolescentních pacientek vyplývá, že hormonální nástup skutečně ovlivňuje hladinu cholesterolemie, ale přímý a dlouhodobý kauzální vztah hladiny estrogenů vůči cholesterolu je velmi individuální a zkušenostmi od jiných autorů k diskusi jej nemůžeme doložit. Jejich účinek se zřetelně odvíjí od vážnosti metabolické poruchy = výšky vstupní hladiny CCh. Je zřejmě jenom přechodný u pacientek s výrazně zvýšeným CCh v závislosti na zbylé funkční aktivitě prokázaného deficitu LDL-R. U skupiny pacientek s mírnější hypercholesterolemií bez pozitivního molekulárně genetického nálezu předpokládáme kromě hormonálního účinku především další významné kompenzační mechanismy hladiny cholesterolu uplatňující se nejméně na 3 geneticky nezávislých regulačních úrovních (receptory, syntéza a absorpce cholesterolu). A nebo spektrum molekulárně genetických a metabolických metod používaných dosud pro vyšetřování našich adolescentek není ještě dostatečně dokonalé, aby nám odhalilo všechny možné další metabolické a molekulárně genetické vlivy, které se na regulaci hypercholesterolemie podílejí. V odborné literatuře jsme dosud podobné údaje pro porovnání k diskusi zatím nenalezli.
Přísná nízkocholesterolová dieta (<300 mg cholesterolu v přirozené potravě/den) vyvolává u pacientek s prokázanou FH zvýšenou cholesterologenezi, jak poznáváme z vysoké lathosterolemie a desmosterolemie, a paradoxně zvyšuje hladinu CCh v krvi.
U 3 sledovaných předškolních dětí, kterým zemřel otec nebo bratr na infarkt, vyvolaly úzkostlivé matky přísnou nízkocholesterolovou dietou až zástavu růstu, jak jsme mohli pozorovat z oploštění růstových křivek našich monitorovacích grafů! Běžné dietní omezování cholesterolu v potravě zůstává vyhrazeno jen pro alimentární hypercholesterolemii (z přejídání), která je v našich ambulancích stále častá, je provázená mírnou hypertriglyceridemií, ale vyžaduje jako každá jiná metabolická porucha dokonalou diferenciální diagnózu [14].
ZÁVĚR
Naše nálezy dokládají menší význam hormonálního účinku menarché na dědičnou hypercholesterolemii, než se předpokládalo. Většina našich pacientek s FH doloženou metabolickým profilem a nálezem významné genové mutace pro LDL-R proto vyžaduje jak dokonalou diferenciální diagnostiku, tak včasnou medikamentózní léčbu stejně jako je tomu u chlapců, tj. už od 8 let věku [6, 7, 14, 15, 16, 17].
Seznam použitých zkratek:
apoE – apolipoprotein E
CCh – celkový cholesterol
FDB – familial decifiency of binding ligand for apo B
FH – familial hypercholesterolemia, familiární hypercholesterolemie
FSH – folikuly stimulující hormon
IMT – intima media thickness, tloušťka vnitřní medie a. carotis com. (CIMT)
KVO – kardiovaskulární onemocnění
LDL-R – receptor pro LDL-cholesterol
LH – luteotropní hormon
Lp(a) – lipoprotein(a), referenční hodnota <0,3 g/l
PCSK9 – Proprotein Convertase Subtilisin/Kexin type 9
sdLDL – small density LDL-cholesterol, malé denzní částice LDL-cholesterolu, referenční hodnota 0,13–1,7 mmol/l
TC – total cholesterol, celkový cholesterol
Poděkování: Autoři děkují doc. MUDr. Janě Hamanové, CSc., za cenné připomínky při přípravě rukopisu.
Práce byla podpořena granty IGA NA 7452-3, Evrop. soc. fondy (esf), Státní rozpočet ČR.
Došlo: 20. 2. 2012
Přijato: 29. 9. 2012
Prof. MUDr. Josef Hyánek, DrSc.
Metabolická ambulance
Nemocnice Na Homolce
Roentgenova 2
150 30 Praha 5
e-mail: josef.hyanek@homolka.cz
Zdroje
1. Hořejší J. Dětská gynekologie. Praha: SPN, 1990.
2. Cibula D. Hormonální substituční léčba. Remedia 2001 : 321–333.
3. Marek J, Hána V, Kršek M. Jak ovlivňují kortikoidy, růstový hormon a estrogeny lipidy a aterosklerózu. Vnitř Lék 2007; 53 : 386–390.
4. Blankenhorn RH, Hodis HN, et al. Arterial imaging and atherosclerosis reversal. J Arterioscl Thromb 1994; 14 : 177–189.
5. Baass A, Dubuc G, Trembley M, et al. Plasma PCSKG is associated with age, sex,and multiple metabolic markers in a population-based sample of children and adults. Clin Chem 2009; 55 : 1637–1645.
6. Gidding SS, Dennison B, Birch LL, et al. Dietary recommendations for children and adolescents. Consensus statement from the American Heart Association. Circulation 2005;112 : 2061–2075.
7. Gidding SS. The rationale for lowering serum cholesterol levels in American children. Amer J Dis Child 1993; 147 : 386–398.
8. Nařízení vlády ČR č. 149/1994 Sb. Zdravotní řád.Věstník MZ ČR, část 7, par. 4, písmeno c.
9. Newman TB. Problems with the report on the expert panel on blood cholesterol levels in children an adolescents. Arch Pediat Adolesc Med 1995; 149 : 241–247.
10. Stožický F, et al. Metodické doporučení pro selektivní screening a léčbu dětí a adolescentů s dyslipidemií se zaměřením na prevenci aterosklerózy. Čes-slov Pediat 1998; 53 : 186–189.
11. Šamámek M, Urbanová Z. Ateroskleroza u dětí a adolescentů. Praha: Grada, 2005.
12. Urbanová Z, Šamánek M, Češka R. Diagnostika a léčba dyslipidemií u dětí a dospívajících. Doporučení výboru ČsATS. Čes-slov Pediat 2008; 63 : 164–172.
13. National Cholesterol Education Program. Report of the expert panel on blood cholesterol levels in children and adolescents. Pediatrics 1992; 89 : 484–515.
14. Hyánek J, et al. 10leté zkušenosti s medikamentózní léčbou familiární hypercholesterolemie u dětí a adolescentů. Čes-slov Pediat 2006; 61 : 404–412.
15. de Jongh S, Ose L, Szamosi T, Gagne C, Lambert M, et al. Efficacy and safety of statin therapy in children with familial hypercholesterolemia: a randomized, double-blind, placebo controlled trial with simvastatin. Circulation 2002; 106 : 2231–2237.
16. Rodenburg J, Vissers MN, Wiegman A, van Trot-senburg VP, et al. Statin treatment in children with familial hypercholesterolemia. The younger, the better. Circulation 2007; 116 : 664–668.
17. Wiegman A, Hutten BA, deGroot E, et al. Efficacy and safety of statin therapy in children with familial hyper-cholesterolemia: a randomized controlled trial. JAMA 2004; 292 : 331–337.
18. Hyánek J, Pehal F, Dubská L, et al. Praktické zkušenosti s rutinním využitím vybraných necholesterolových sterolů (zvláště lathosterolu a kampesterolu) při diferencování dietní a medikamentózní léčby hypercholesterolemií u dětí a adolescentů. Klin Biochem Metab 2011; 19 (40): 136–142.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2013 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Vliv menarché na hladinu cholesterolemie u adolescentních dívek s familiární hypercholesterolemií
- Somatický vývoj a úrazy u dětí v období pubertálního spurtu – nové poznatky o významu dynamiky růstu a podmíněnosti úrazového rizika u současné populace
- Význam časné diagnostiky dědičných metabolických poruch s manifestací v novorozeneckém věku
- X. Slovenský pediatrický kongres
- Analýza rizikových faktorů suicidálního jednání v dětství a adolescenci
- Masivní plicní embolie jako první příznak nefrotického syndromu u 18leté pacientky
- Sekundárne malignity u pediatrických pacientov po transplantácii kmeňových krvotvorných buniek
- Tělesná aktivita a návykové nemoci: překvapivá zjištění
- Nové tváře mitochondriálního onemocnění u dětí
- Recenze
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nové tváře mitochondriálního onemocnění u dětí
- Masivní plicní embolie jako první příznak nefrotického syndromu u 18leté pacientky
- Význam časné diagnostiky dědičných metabolických poruch s manifestací v novorozeneckém věku
- Somatický vývoj a úrazy u dětí v období pubertálního spurtu – nové poznatky o významu dynamiky růstu a podmíněnosti úrazového rizika u současné populace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



