-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam časné diagnostiky dědičných metabolických poruch s manifestací v novorozeneckém věku
Importance of early diagnostics of inherited metabolic disorders in neonatal age
More than one quarter of 900 known inherited metabolic disorders (IMD) may manifest in the neonatal age. Their diagnostics is demanding. The correct and early diagnosis with subsequent therapy introduction may have a substantial impact on further prognosis of the child.
Case reports of three children with manifestation of IMD in neonatal age and late diagnosis are presented. On contrary, assessment of early diagnosis saved favourable prognosis of the child with galactosemia and enabled the early introduc-tion of adequate therapy in a child with alpha-1-antitrypsin deficit. The first girl with methymalonic aciduria manifested sepsis-like state with hyperventilation, consciousness disorder and seizures, severe metabolic acidosis and hyperammonemia. The liver failure was the main symptom of the girl with galactosemia. The boy from the third case report with glycogenosis type Ib showed repeated hypoglycamiae. The leading symptom of mitochondrial disorder in the fourth newborn – with ATP synthesis deficiency due to mutation in TMEM70 gene was the hypertrophic cardiomyopathy. The alpha-1-antitrypsin deficit was determined in the fifth boy with hepatopathy. The acute and life-threatening state typically occurs after period of relative health in acute intoxication type of IMD. The relations of ketonuria and significant metabolic acidosis or hyperammonemia are often present. The selective IMD screening or comprehensive metabolic investigation in the specialized center is indicated in case of suspicion on IMD based on clinical and laboratory signs. Early assessment of diagnosis of potentially treatable IMD plays an enourmous role in further prognosis of the child.Key words:
inherited metabolic disorders, neonate
Autoři: M. Magner 1; P. Ješina 2; P. Klement 1; D. Lorenčík 1; V. Vobruba 1; J. Zeman 1,2; T. Honzík 1,2
Působiště autorů: Klinika dětského a dorostového lékařství UK 1. LF a VFN, Prahapřednosta prof. MUDr. J. Zeman, DrSc. 1; Ústav dědičných metabolických poruch UK 1. LF a VFN, Prahapřednosta prof. MUDr. V. Kožich, CSc. 2
Vyšlo v časopise: Čes-slov Pediat 2013; 68 (1): 3-11.
Kategorie: Původní práce
Souhrn
V novorozeneckém věku se může manifestovat až jedna čtvrtina z více než 900 dosud známých dědičných metabolických poruch (DMP). Jejich diagnostika je náročná. A přitom právě časná diagnóza a zahájení terapie může mít zcela zásadní význam pro další prognózu dítěte.
V práci jsou uvedeny kazuistiky tří dětí, u kterých se dědičné metabolické onemocnění manifestovalo v novorozeneckém věku a stanovení diagnózy bylo pozdní. Naopak časné určení diagnózy u dalších dvou dětí znamenalo pro dítě s galaktosemií příznivou prognózu do budoucnosti a v případě dítěte s deficitem alfa-1-antitrypsinu umožnilo zahájení odpovídající terapie. První dívka s metylmalonovou acidurii se manifestovala stavem podobným sepsi s hyperventilací, poruchou vědomí a křečemi při závažné metabolické acidóze a hyperamonemii. V popředí onemocnění dívky s klasickou formou galaktosemie stálo jaterní selhání. Glykogenóza typu Ib se u chlapce ze třetí kazuistiky projevila opakovanými hypoglykemiemi. Vedoucím příznakem mitochondriálního onemocnění – deficitu ATP syntázy při mutaci v genu TMEM70 u čtvrtého novorozence byla hypertrofická kardiomyopatie. U pátého dítěte s hepatopatií byl stanoven deficit alfa-1-antitrypsinu. DMP akutního intoxikačního typu s život ohrožujícím stavem se typicky rozvíjí po období relativního zdraví. Často je přítomno spojení ketonurie a významné metabolické acidózy nebo hyperamonemie. Při podezření na DMP je potřebné na základě klinických a laboratorních symptomů indikovat selektivní screening DMP, ev. po domluvě komplexní metabolické vyšetření na specializovaném pracovišti. Časné určení diagnózy potenciálně léčitelné DMP má na další prognózu dítěte zcela zásadní vliv.Klíčová slova:
dědičné metabolické poruchy, novorozenecÚVOD
Diagnostika dědičných metabolických poruch (DMP) v novorozeneckém věku je zvláště náročná pro manifestaci nespecifických příznaků, které mohou imitovat častější diagnózy, jako novorozeneckou sepsi, hypoxicko-ischemickou encefalopatii nebo komplikace nedonošenosti. Včasná diagnostika je přitom pro prognózu léčitelných nebo léčbou ovlivnitelných DMP zcela zásadní. U dětí s neléčitelnými poruchami metabolismu a nepříznivou prognózou je význam diagnostiky v nabídnutí genetického poradenství rodině.
Cílem této práce je na případech pěti dětí zdůraznit význam časné diagnostiky pro pozdější prognózu dítěte. Kazuistiky byly vybrány tak, aby ilustrovaly spektrum manifestace DMP v novorozeneckém věku, tedy především a) akutní intoxikační typ DMP, b) poruchy energetického metabolismu buňky. Kazuistiky jsou doplněny o stručnou metabolickou diferenciální diagnostiku podle hlavního příznaku, kterým se dítě manifestovalo: sepsi podobný stav s poruchou vědomí, akutní jaterní selhání, hypoglykemie, hypertrofická kardiomyopatie a chronická hepatopatie. V diskusi přinášíme stručnou informaci o stabilizaci pacienta, dalším diagnostickém a terapeutickém postupu. Pro nedostatek prostoru jsme vynechali širší informaci o patofyziologii onemocnění.
AKUTNÍ INTOXIKAČNÍ TYP DMP
- stavy podobné sepsi s poruchou vědomí, příp. křečemi
- s jaterním selháním
Kazuistika č. 1
Donošená eutrofická dívka se pro nepostupující porod rodila sekcí, poporodní adaptace byla bez komplikací. Pro ikterus byla od třetího dne indikována fototerapie. Čtvrtý den života byla dívka neklidná s hyperpnoe, hůře pila z prsu, dále vyšetřována ale nebyla. Pátý den života konstatuje lékař při vizitě prošednutí, hyperventilaci, tachykardii, hypotonii a výrazný váhový úbytek 15 %. Manifestovaly se křeče reagující na terapii fenobarbitalem. Pro významnou hyperamonemii (hladina amoniaku 1260 µmol/l; norma v novorozeneckém věku do 80 µmol/l) byl domluven překlad na naše pracoviště. Dívka byla zaintubována, zahájena antibiotická terapie. Naše vstupní vyšetření ukázala významnou hyperamonemii 4600 µmol/l, metabolickou acidózu s pH 7,037 (7,35–7,44), BE -24,2 mmol/l (-2,5–2,5), leukopenii 3,2 ...2,1 x 109/l (4,5–23,1 x 109/l), renální sel-hávání s ureou 11,7 mmol/l (1,7–5), kreatinin 115 µmol/l (12–48), koagulopatii (INR 1,4, norma 0,8–1,25, APTT 78,1 s, norma 26–40), hypernatremii (151 mmol/l, norma 135–146) a hepatopatii (ALT 0,7 µkat/l, norma do 0,73, AST 3 µkat/l, norma do 1,21). Metabolické vyšetření na biochemické úrovni potvrdilo diagnózu metylmalonové acidurie (hladina kyseliny metylmalonové v plazmě 2149 µmol/l, normálně negativní, hladina kyseliny metylmalonové v moči 1832 mg/g kreatininu, kontroly pod 15). Byla zahájená léčba hyperamonemie podáním argininchloridu, natrium benzoátu, změnou diety a kontinuální venovenózní hemodiafiltrací. Spolu s amoniakem došlo k poklesu kyseliny metylmalonové. Sekundární mitochondriální porucha provázaná hyperlaktacidemií a omezenou tolerancí glukózy odezněla do 2 týdnů od zahájení terapie. Od devátého dne byla zahájena enterální výživa s omezením přívodu přirozené bílkoviny a suplementací preparátem esenciálních aminokyselin, MCT oleje a minerálů při zachování bohatého kalorického příjmu. Z důvodu závažné hyperamonemie v novorozeneckém věku došlo k rozvoji těžké encefalopatie s hlubokou psychomotorickou retardací. V průběhu prvního roku života se rozvinula epilepsie charakteru infantilních spazmů s korelátem hypsarytmie, kterou se podařilo zvládnout terapií ACTH. Onemocnění bylo doprovázeno opakovanými metabolickými rozvraty, dívka zemřela ve věku 5 let.
Kazuistika č. 2
Hraničně zralá dívka s porodní délkou 50 cm a hmotností 3450 g z první fyziologické gravidity se rodila po odtoku zkalené plodové vody, poporodní adaptace byla v normě. Již druhý den se rozvíjí nekonjugovaná hyperbilirubinemie s nutností fototerapie, při které dívka dostávala jako dokrm ke kojení mléčnou formuli. V dalším průběhu došlo k 15% váhovému úbytku, rozvoji hepatomegalie (+3 cm) s elevací jaterních testů (ALT 5,1 µkat/l, norma do 0,73, AST 3,5 µkat/l, norma do 1,21), těžkou smíšenou koagulopatií (Quick 3,32, norma 0,8–1,25), k metabolické acidóze (pH 7,299, norma 7,35–7,44; BE -9,2, norma -2,5–2,5) a hypoglykemiím (2,7…1,6 mmol/l; norma 2,5–4,2). Bylo indikováno selektivní metabolické vyšetření a pro suspektní galaktosemii při nálezu zvýšeného vylučování galaktitolu v moči a zvýšené hladiny galaktózy a galaktóza-1-fosfátu v erytrocytech byl 4. den života domluven překlad na KDDL. Bylo ukončeno kojení, podána infuze glukózy, opakovaně podávány K vitamin a plazma. Na terapii a po zavedení bezlaktózové diety došlo k úpravě laboratorních nálezů, přetrvává mírně zvýšené vylučování galaktitolu močí. Diagnóza klasické galaktosemie byla potvrzena na genetické úrovni. Ve věku 4 měsíců dívka prospívala, psychomotorický vývoj byl v normě, zavedli jsme příkrmy. Do budoucnosti lze očekávat mírnou mentální retardaci a periferní ovariální selhání.
Komentář:
Encefalopatií s odmítáním kojení, hypotonií, hyperventilací a poruchou vědomí, tedy stavem imitujícím celkovou infekci, se projeví tzv. akutně intoxikační typ DMP. Do této skupiny patří i organické acidurie [1]. Jedná se o skupinu nemocí s poruchou metabolismu aminokyselin s rozvětveným řetězcem. V novorozeneckém věku se projeví především metylmalonová acidurie (viz kazustika č. 1), propionová acidurie a nemoc javorového sirupu. Manifestace nastává typicky po krátkém bezpříznakovém období (většinou hodiny až dny po porodu), mohou se objevit křeče, progrese do kómatu, apnoické pauzy. V laboratoři nacházíme extrémní metabolickou acidózu většinou s výraznou hyperamonemií, s pozitivitou ketolátek a s tendencí k nízkým hladinám glukózy v krvi, leukopenii a trombocytopenii, přítomna může být hepatopatie.
U všech novorozenců musíme při stavech podobných sepsi s poruchou vědomí a s rozvojem hepatopatie pomýšlet na poruchy cyklu močoviny [2]. Je to skupina 6 enzymopatií, které vedou k poruše detoxikace amoniaku. Nejčastější je porucha na úrovni ornithintranskarbamylázy (OTC). Kromě rychlého rozvoje ztráty vědomí a svalové hypotonie se mohou objevit křeče a hepatomegalie. V laboratoři nacházíme hepatopatii a vysokou hladinu amoniaku, v metabolickém vyšetření zvýšené vylučování kyseliny orotové močí, vysokou hladinu aminokyselin glutaminu, glutamátu a nízkou koncentraci argininu a citrulinu v krvi.
Po delší době hladovění s rozvojem katabolického stavu se hepatopatií mohou v novorozeneckém věku manifestovat i poruchy beta-oxidace mastných kyselin (BOX) [3]. Tato skupina onemocnění se může projevit již prenatálně rozvojem dilatační kardiomyopatie nebo u matky rozvojem syndromu HELLP (maternální hemolýza, jaterní dysfunkce a snížený počet trombocytů) a AFLP (akutní jaterní steatóza s vazbou na těhotenství). V novorozeneckém věku se onemocnění BOX může projevit akutní metabolickou dekompenzací nejčastěji s hypoketotickou hypoglykemií s poruchou vědomí až do obrazu Reye-like syndromu, může imitovat syndrom náhlého úmrtí kojence SIDS.
Při stavu podobnému sepsi s dominujícím jaterním selháním je nutno mj. pomýšlet i na galaktosemii (viz kazuistika č. 2). Při klasické galaktosemii se onemocnění projeví většinou mezi 3.–7. dnem života kombinovanou přímou a nepřímou hyperbilirubinemií, progredující hepatopatií, významnou koagulopatií a hypoglykemiemi. V době stanovení diagnózy může být přítomná katarakta. Diagnosticky se měří koncentrace galaktitolu v moči, koncentrace galaktózy a galaktóza-1-fosfátu v erytrocytech, enzymologické vyšetření v erytrocytech, molekulárně genetické vyšetření. Průběh onemocnění je dietní léčbou s mlékem bez obsahu mléčného cukru dobře ovlivnitelný, ale dlouhodobá prognóza postižených dětí nemusí být vždy příznivá, a to i s ohledem na postižení dítěte již transplacentárním přenosem galaktózy v průběhu těhotenství a pro možnost přeměny glukózy na galaktózu v organismu samotném („self-intoxication“) [4].
Hypoglykemie
Kazuistika č. 3
U eutrofického donošeného chlapce z druhého fyziologického těhotenství s nevýznamnou rodinnou anamnézou se po dobré poporodní adaptaci objevila koncem prvního dne tachykardie a tachypnoe, byla zjištěna glykemie 0,45 mmol/l (norma 2,5–4,2). Chlapec byl přeložen na spádové pracoviště, kde byla dále zjištěna výrazná laktátová acidóza (laktát 13 mmol/l, norma do 2,3) a uremie (kreatinin 130 µmol/l a urea 17 mmol/l). Laboratorní nálezy nesvědčily pro infekci, hladina amoniaku byla v normě. Bylo indikováno základní metabolické vyšetření se zaměřením na akutní intoxikační typ DMP, ve kterém bylo zjištěno zvýšené vylučování laktátu v moči. Kontrola nálezu a širší metabolické vyšetření nebyly přes doporučení provedeny. Kardiologické i ultrasonografické vyšetření byla v normě. Stav se klinicky i laboratorně na infuzní terapii upravil, chlapec byl převeden na perorální příjem, na kterém již další glykemie nebyly kontrolovány. Po propuštění prospíval, ale přetrvávala hypotonie. Ve věku 3 měsíců byl hospitalizován pro zvýšenou spavost, subfebrilie a horší perorální příjem. Klinicky byla přítomna hepatomegalie, laboratorně byla zjištěna hypoglykemie 2,9 mmol/l (norma 3,3–5,4), mírná hepatopatie ALT 1,2 µkat/l (norma do 0,85), AST 1,8 µkat/l (0,27–0,97), hypertriacyl-glycerolemie 7,5 mmol/l (norma 2,6–4,2). Byl domluven překlad na KDDL. V laboratoři byly přítomny opakované asymptomatické hypoglykemie nalačno vyžadující kombinaci infuze glukózy a kontinuální stravu nazogastrickou sondou. V ultrasonografickém vyšetření byla kromě hepatomegalie přítomna i nefromegalie. Endokrinologické vyšetření ze séra odebraného v době hypoglykemie bylo opakovaně negativní. Chlapec měl dlouho febrilie s negativním mikrobiologickým a sérologickým vyšetřením a cyklickou neutropenii, což spolu s klinickým průběhem onemocnění, hepato - a nefromegalií, hypoglykemiemi, hepatopatií a laktátovou acidózou vedlo k podezření na glykogenózu typu Ib, která byla potvrzena na molekulárně genetické úrovni. U chlapce byla zavedena frekventní strava s přídavkem Gustinu přes den. V noci je mléko s glukopurem podáváno kontinuálně enteropumpou cestou výživové gastrostomie. Jeho mentální vývoj je nyní v šesti letech i přes nepoznané těžké hypoglykemie v časném kojeneckém věku výborný.
Komentář:
Při průkazu opakovaných hypoglykemií sdružených s hepatopatií, hypertriacylglycerolemií a laktátovou acidózou je nutno vyloučit glykogenózu typu I. Ta se již v novorozeneckém projeví těžkými hypoglykemiemi, které mohou vyústit v křeče. Postupně progreduje hepatomegalie. Často nacházíme hypertriacylgly-cerolemii, hyperurikemii a zvýšenou hladinu laktátu. Terapie spočívá ve frekventní stravě s omezením příjmu živočišných tuků, laktózy, sacharózy a fruktózy. Diagnostika se provádí molekulárně genetickým vyšetřením.
Z metabolických onemocnění se může hypoglykemie kromě glykogenóz vyskytnout u všech metabolických nemocí malých molekul, tedy u akutního intoxikačního typu (viz příslušnou kapitolu). Je třeba však upozornit, že nejčastější příčinou rozvoje novorozeneckých hypoglykemií je kongenitální nebo přechodný hyperinzulinismus (blíže viz [5]).
Hypertrofická kardiomyopatie
Kazuistika č. 4
Průběh druhého těhotenství zdravé matky byl komplikován opakovaným nálezem suspektní křivky na kardiotokografu od 34. gestačního týdne. Přes přítomnost oligohydramnionu a těžké intrauterinní růstové retardace byl chlapec porozen až v termínu. Postnatální průběh byl komplikován rozvojem oboustranných spontánních pneumothoraxů a diagnózou hypertrofické kardiomyopatie. Dalším nálezem byla hypospadie. Podezření na DMP bylo vysloveno až ve věku 4 měsíců, kdy se u chlapce po 12hodinovém lačnění při operaci tříselné kýly rozvinul metabolický rozvrat s laktátovou acidózou a hyperamonemií (BE -22, norma -2,5–2,5, laktát 12 mmol/l, norma do 2,3, amoniak 185...350 µmol/l, norma do 60). Tou dobou již bylo přítomno mírné opoždění psychomotorického vývoje. Klinické příznaky, tedy zejména intrauterinní růstová retardace, kardiomyopatie, hypotonie, hypospadie a laboratorní nálezy hyperamonemie a 3-metylglutakonové acidurie ve vyšetření organických kyselin v moči, nás vedly k podezření na poruchu ATP syntázy při deficitu proteinu Tmem70. Toto autozomálně recesivně děděné mitochondriální onemocnění bylo následně prokázáno na molekulárně genetické úrovni, rodiče jsou zdraví přenašeči. Energetická potřeba byla hrazena zejména vysokým přívodem tukové emulze, tolerance glukózy byla snížena. Hyperamonemii se podařilo stabilizovat i pomocí benzoátu sodného.
Komentář:
V případě kardiomyopatie u novorozence musíme na prvním místě vyloučit diabetickou fetopatii, vrozenou srdeční vadu nebo následek prodělané myokarditidy v intrauterinním vývoji. Mezi klasické DMP s projevy hypertrofické či dilatační kardiomyopatie a srdečního selhání patří poruchy beta-oxidace mastných kyselin a karnitinová deficience [3, 6]. Druhou velkou skupinou DMP s projevy hypertrofické (méně často dilatativní) kardiomyopatie jsou mitochondriální onemocnění. V našem souboru 129 novorozenců s mitochondriálním onemocněním s manifestací v novorozeneckém věku byla kardiomyopatie přítomna ve 40 % [7, 8]. Nejednalo se o izolovaný příznak, ve všech případech byla kardiomyopatie doprovázena hypotonií a/nebo encefalopatií. Kardiomyopatie je spolu s těžkou hypotonií a kardiomegalií typickým příznakem i infantilní formy glykogenózy II. typu – Pompeho nemoci [9]. Manifestace kardiomyopatie se může vyskytovat i u poruchy glykosylace proteinů [10, 11] a genetických onemocnění, jako je Beckwithův-Wiedemannův syndrom [12] nebo syndrom Noonanové [13].
Hepatopatie a hepatomegalie
Kazuistika č. 5
Přenášený chlapec z první fyziologické gravidity zdravých nepříbuzných rodičů se narodil s hraniční trofikou 2780 g a porodní délkou 48 cm. Měl pupečník kolem krku, poporodní adaptace byla mírně prodloužena. V porodnici mírný ikterus bez nutnosti fototerapie. Praktický lékař odeslal plně kojené dítě k hospitalizaci pro progresi ikteru a neprospívání ve věku jednoho měsíce. Laboratorně byla vyjádřena konjugovaná hyperbilirubinemie (bilirubin 117,3 µmol/l, norma do 17,0, přímý bilirubin 70,1 µmol/l, ALT 2,17 µkat/l, norma do 0,60, AST 3,00 µkat/l, norma do 0,63, GGT 7,70 µkat/l, norma do 0,39, ALP 13,06 µkat/l, norma do 6,20). Stolice 4–5krát denně řidší, zelené barvy, acholickou stolici neměl. Ultrasonografické vyšetření bylo v normě. Sérologická vyšetření na hepatotropní viry byla negativní, ale chlapec měl významně sníženou hladinu alfa-1-antitrypsinu. Molekulárně genetické vyšetření ukázalo, že chlapec má ZZ genotyp pro alfa-1-antitrypsinový deficit, který u chlapce vysvětluje etiologii jaterního onemocnění. Oba rodiče jsou heterozygoti. Dnes již 7letý chlapec má na terapii kyselinou ursodeoxycholovou jenom mírnou hepatopatii, plicní funkce jsou v pořádku. Prospívá dobře, psychomotorický vývoj je v normě.
Komentář:
V diferenciální diagnostice hepatopatie musíme nejdříve vyloučit infekční etiologii (zejména CMV infekce). Mezi častější příčiny cholestatické hepatopatie patří deficit alfa-1-antitrypsinu. K těm vzácnějším příčinám progresivního jaterního postižení a/nebo hepatomegalie v novorozeneckém věku patří Niemannova-Pickova choroba typ C (cholestatická hepatopatie, hepatosplenomegalie, hyperbilirubinemie) [14], poruchy glykosylace proteinů (smíšená koagulopatie, cutis laxa, atypická distribuce tuku, invertace mamil) [10], Wolmanova choroba (deficit kyselé lipázy, průjmy, protein losing enteropatie) [15], peroxizomální poruchy (kraniofaciální dysmorfie, hypotonie) [16], progresivní familiární intrahepatální cholestáza (PFIC1; typ s nezvýšeným GGT – Byler disease) [17], Alagillův syndrom a neonatální hemochromatóza [18]. Hepatosplenomegalie může být u novorozence příznakem Gaucherovy nemoci [19]. U akutního jaterního selhání je nutno pomýšlet na akutní intoxikační typ DMP, zejména galaktosemii a tyrosinemii I. typu (viz příslušnou kapitolu).
DISKUSE
Dědičné metabolické poruchy (DMP) představují různorodou skupinu onemocnění, jejichž společným rysem je přítomnost biochemických či enzymatických odchylek zjistitelných pouze speciálním vyšetřením. Závažnost klinických příznaků u dětí s DMP závisí na typu molekulárního defektu a na zbytkové aktivitě postiženého enzymu. Nejčastěji se jedná o onemocnění s autozomálně recesivním typem dědičnosti, častý je přenos gonozomálně recesivní či maternální (mutace v mitochondriální DNA). V současné době je již známo více než 900 dědičných metabolických poruch, v novorozeneckém věku se projeví téměř jedna čtvrtina [20, 21]. Dědičné metabolické poruchy tak musí patřit do široké diferenciální diagnostiky každého nemocného novorozence, u kterého byla vyloučena sepse a jehož příznaky neodpovídají čisté hypoxicko-ischemické encefalopatii či běžným komplikacím nedonošenosti.
Časná diagnostika DMP v novorozeneckém věku může mít zcela zásadní roli pro další prognózu dítěte. V první kazuistice se jednalo o dítě s metylmalonovou acidurií. Opožděné vyšetření acidobazické rovnováhy a amoniaku při manifestaci prvních příznaků dráždivosti a hyperventilace pro dívku znamenalo nevratnou těžkou encefalopatii z důvodu těžké hyperamonemie při pozdním zahájení terapie. Naopak časná diagnostika a zahájení terapie u dívky s galaktosemií ve druhé uvedené kazuistice znamenaly příznivou prognózu quod vitam i dalšího vývoje. U chlapce s glykogenózou typu Ib ve třetí kazuistice bylo chybou nedostatečné vyšetření hypoglykemií. Nebyla provedena kontrola patologického nálezu zvýšeného vylučování laktátu v moči, která by spolu s hypoglykemiemi mohla vést k podezření na glykogenózu I. typu. Hrubou chybou u chlapce s těžkými hypoglykemiemi bylo nezměření glykemií po vysazení parenterální infuze s glukózou. Jenom šťastnou náhodou se u chlapce nerozvinula psychomotorická retardace při opakovaných těžkých hypoglykemiích v novorozeneckém a časném kojeneckém věku až do stanovení diagnózy. Důsledným vyšetřením nedonošeného chlapce s mitochondriálním onemocněním projevujícím se intrauterinní růstovou retardací, hypospadií a zejména kardiomyopatií ve čtvrté kazuistice se mohlo předejít metabolickému rozvratu s laktátovou acidózou a hyperamonemií. Určení diagnózy u chlapce z poslední páté kazuistiky pomohlo nasadit příslušnou terapii a zpomalit tak progresi jaterního postižení.
Nejčastějšími příznaky DMP u novorozenců jsou odmítání pití, zvracení, termolabilita, hypotonie/hypertonie, křeče, apatie/irritabilita, porucha vědomí, hepatomegalie, ikterus, někdy rozvoj hydropsu plodu a intrauterinní růstová retardace. Tyto příznaky jsou však nespecifické a můžeme je pozorovat i u celé řady častějších diagnóz, jako jsou hypoxicko-ischemická encefalopatie, komplikace nedonošenosti, krvácení do CNS či adnátní sepse. Komplikující je fakt, že některé DMP se často kombinují s dalšími onemocněními. Např. u klasické galaktosemie se často rozvine sepse etiologie Escherichia coli, závažná koagulopatie u hepatorenální tyrosinemie může napodobovat diseminovanou intravaskulární koagulopatii a poruchy cyklu močoviny, nebo organické acidurie svým obrazem profuzního zvracení mohou vést k podezření na vrozenou vývojovou vadu gastrointestinálního traktu. Častým znakem DMP v novorozeneckém věku je rozvinutí akutního a život ohrožujícího stavu po období relativního zdraví v trvání 12 hodin, nejčastěji však 2–5 dnů s vazbou na zahájení kojení [20].
K diferenciálnědiagnostické rozvaze kromě důkladného zhodnocení anamnézy a fyzikálního vyšetření přispěje vyšetření acidobazické rovnováhy, hladiny laktátu a glykemie, jaterních testů, bilirubinu, koagulací, amoniaku, kreatinkinázy a ketonurie (za fyziologických podmínek prostého hladovění není schopen novorozenec ketolátky vytvořit). O DMP se jedná prakticky vždy, pokud je přítomná u novorozence ketonurie a významná metabolická acidóza či hyperamonemie. Nezbytné pro diagnózu některých DMP je vyšetření mozkomíšního moku. Cenné informace poskytnou výsledky novorozeneckého screeningu a selektivního screeningu DMP. V současné době se v ČR provádí screening fenylketonurie, tří onemocnění patřících mezi organické acidurie (glutarová acidurie 1. typu, leucinóza, isovalerová acidurie) a šesti poruch beta-oxidace mastných kyselin [22, 23]. Od října 2012se v rámci pilotního projektu, po informovaném souhlasu rodičů, novorozenecký screening rozšiřuje o další onemocnění, mezi která patří tyrosinemie I. typu, poruchy metabolismu sirných aminokyselin včetně poruch metabolismu vitaminu B12, deficit biotinidázy a některé poruchy cyklu močoviny.
Terapeuticky by u novorozence s podezřením na DMP měl být zastaven příjem bílkovin (vysazeno kojení) a zajištěn dostatečný kalorický příjem formou koncentrované glukózy ve snaze zabránit katabolismu. V případě potřeby může být nutná podpora životních funkcí, umělá plicní ventilace, případně např. hemodiafiltrace v případě výrazné hyperamonemie. Další specializovanou terapii možno aplikovat až po výsledcích základního statimového selektivního screeningu. Zavedení této terapie je vhodné po konzultaci nebo překladu na specializované pracoviště.
I přes nové poznatky základního a aplikovaného výzkumu je léčitelných či léčbou ovlivnitelných pouze přibližně 20 % DMP. Podmínkou úspěšné léčby je však především včasná diagnostika DMP. V případě nemoci neléčitelné je rychlá diagnostika důležitá pro optimalizaci symptomatické léčby, odhalení přidružených komplikací základní choroby a pro genetické poradenství a prenatální diagnostiku v postižených rodinách.
ZÁVĚR
Na DMP u novorozence musíme myslet vždy, pokud se akutní a život ohrožující stav rozvine po období relativního zdraví, často je přítomna vazba na zahájení kojení. O DMP se jedná prakticky vždy, pokud je u novorozence přítomná ketonurie a významná metabolická acidóza, hyperamonemie či myopatie. Při hypoglykemiích je nutné vyloučit endokrinologickou příčinu, provést odběr krve a moči v době hypoglykemie.
K indikaci selektivního screeningu je nutná kompletní klinická informace i s rozšířeným laboratorním vyšetřením s hladinou glykemie, jaterních testů, kreatinkinázy, koagulace, amoniaku, laktátu, acidobazické rovnováhy a ketolátek v moči. Základní terapie do stanovení diagnózy spočívá v podání infuze glukózy a podpoře životních funkcí.
Tab. 1. Typická manifestace vybraných dědičných metabolických poruch s akutní manifestací v novorozeneckém věku. 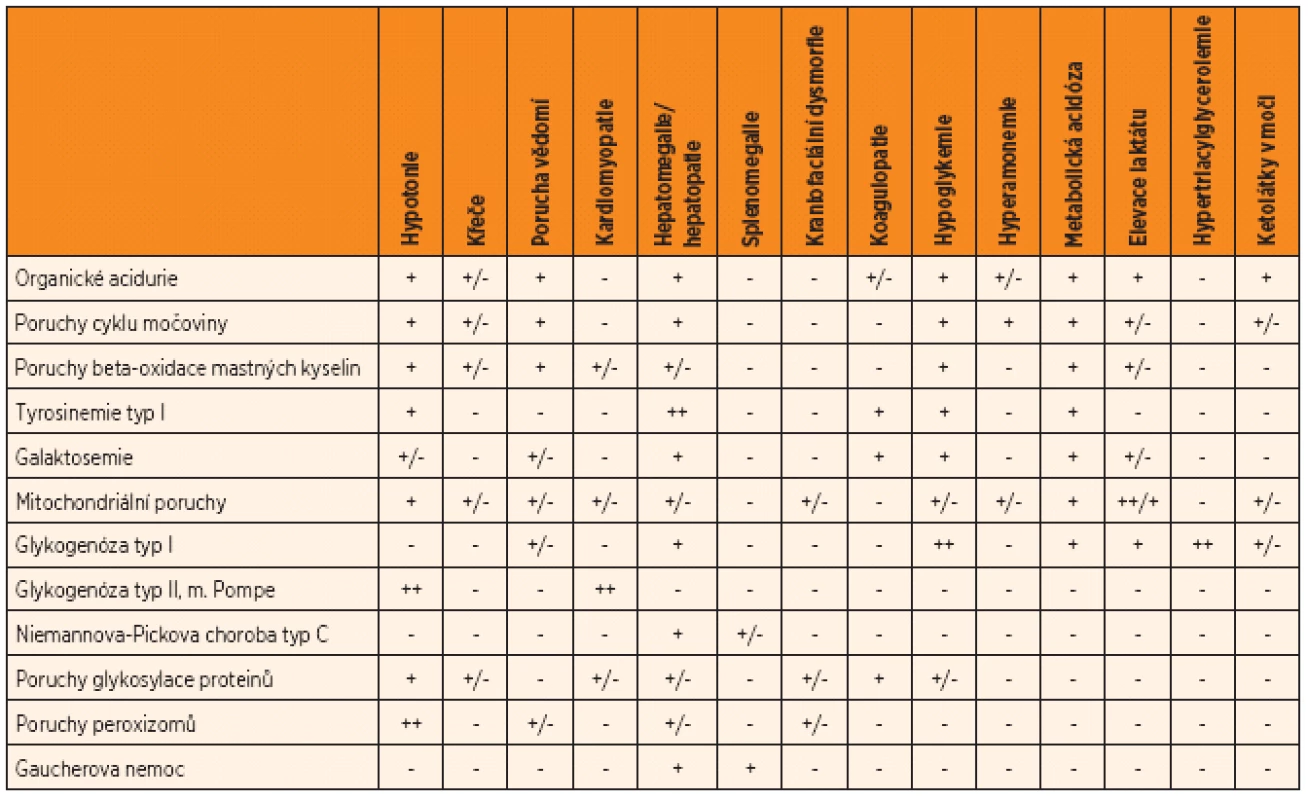
++ charakteristický příznak; + příznak většinou přítomný; +/- příznak se může vyskytovat; - příznak není pro danou skupinu onemocnění typický Práce byla podpořena grantem IGA MZ ČR NT/11186-5/2010, RVO-VFN64165/2012 a UNCE 204011.
Došlo: 19. 6. 2012
Přijato: 15. 10. 2012
Korespondující autor:
doc. MUDr. Tomáš Honzík, Ph.D.
Klinika dětského a dorostového lékařství
UK 1. LF a VFN
Ke Karlovu 2, 121 00 Praha 2
e-mail: tomas.honzik@vfn.cz
Zdroje
1. Pospíšilová E, Mrázová L, Klement P, et al. Methylmalo-nová acidémie: Klinická, biochemická a molekulárně biologická studie. Čes-slov Pediat 2006; 4 : 190–198.
2. Dvořáková L, Hřebíček M, Vlášková H, et al. Význam molekulárně genetického vyšetření pro diagnostiku a genetické poradenství v rodinách s hyperamonémií a deficitem ornithin-karbamoyltransferázy. Čes-slov Pediat 2010; 10 : 575–579.
3. Zeman J, Kmoch S, Ondrová L, et al. Poruchy „medium chain“ acyl-CoA dehydrogenázy (MCAD) a „long chain“ 3-OH-acyl-CoA dehydrogenázy (LCHAD): Klinická, biochemická a molekulárně biologická studie u 10 dětí. Čes-slov Pediat 1998; 5 : 251–255.
4. Berry GT. Galactosemia: when is it a newborn screening emergency? Mol Genet Metab 2012 May; 106 : 7–11.
5. Honzík T, Kytnarová K. Diferenciální diagnostika hypoglykemických stavů v dětském věku. Vox Pediatriae 2009; 1 : 17–21.
6. Kabíček P, Chrastina P, Dvořáková L, et al. Rabdo-myolýza po fyzické námaze – benigní nález nebo projev závažného onemocnění? Prakt Lék 2006; 7 : 393–395.
7. Honzík T, Tesařová M, Hansíková H, et al. Klinické příznaky a laboratorní data u 75 dětí s neonatální manifestací mitochondriálního onemocnění: návrh diagnostických algoritmů. Čes-slov Pediat 2010; 7–8 : 422–431.
8. Honzik T, Tesarova M, Magner M, et al. Neonatal onset of mitochondrial disorders in 129 patients: clinical and laboratory characteristics and a new approach to diagnosis. J Inherit Metab Dis Metab Dis 2012 [Epub ahead of print].
9. Šťastná S, Pešková K, Elleder M, et al. Glykogenóza typu II – Infantilní forma (morbus Pompe) v české a slovenské populaci. Čes-slov Pediat 2003; 7 : 436–440.
10. Honzík T, Hansíková H, Flachsová E, et al. Klinické projevy a výsledky metabolických a molekulárních analýz u 8 dětí s dědičnou poruchou glykosylace proteinů typ I. Čes-slov Pediat 2003; 7 : 456–460.
11. Magner M, Veselá K, Hansíková H, et al. Kazuistika dívky s dědičnou poruchou glykosylace. Pediatr praxi 2009; 5 : 329–330.
12. Cohen Jr MM. Beckwith-Wiedemann syndrome: Historical, clinicopathological and ethiopathogenetic perspectives. Pediatric and Developmental Pathology 2005; 3 : 287–304.
13. Hoban R, Roberts AE, Demmer L, et al. Noonan syndrome due to a SHOC2 mutation presenting with fetal distress and fatal hypertrophic cardiomyopathy in a premature infant. Am J Med Genet A 2012; v tisku.
14. Dvorakova L, Sikora J, Hrebicek M, et al. Subclinical course of adult visceral Niemann-Pick type C1 disease. A rare or underdiagnosed disorder? J Inherit Metab Dis 2006; 4 : 591.
15. Smolka V. Nemoc ze střádání esterů cholesterolu – Efekt dlouhodobé léčby lovastatinem. Čes Slov Gastroenterol Hepatol 2007; 1 : 30–33.
16. Chandoga J, Petrovic R. Peroxizómové dedičné metabolické choroby. Čas Lék čes 2001; 21 : 651–657.
17. Kotalová R, Cebecauerová D, Knisely AS, et al. Progressive familial intrahepatic cholestasis – Manifestations and diagnosis in infancy. Čes-slov Pediat 2006; 4 : 200–206.
18. Seemanová E. Alagilleův syndrom – Arteriohepatická dysplazie. Čes-slov Pediat 2003; 6 : 381–383.
19. Malinová V, Poupětová H, Dvořáková L, et al. Enzyme replacement therapy for Gaucher disease in twin pregnancy. Int J Gynaecol Obstet 2009; 1 : 64–66.
20. Honzík T. Klinické příznaky dědičných metabolických poruch u dětí. Pediatr praxi 2011; 5 : 314–319.
21. Kožich V, Zeman J. Dědičné metabolické poruchy v pediatrii. Postgraduální medicína 2010; 7 : 793–800.
22. Votava F, Kožich V, Šťastná S, et al. Novorozenecký screening v České republice. Postgraduální medicína 2010; 12(7): 785–791.
23. Vinohradská H, Kožich V, Adam T, et al. Změna systému novorozeneckého screeningu v České republice. Vox Pediatriae 2010; 10 (3).
Štítky
Gynekologie a porodnictví Interní lékařství Neonatologie Neurologie Pediatrie Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2013 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
-
Všechny články tohoto čísla
- Vliv menarché na hladinu cholesterolemie u adolescentních dívek s familiární hypercholesterolemií
- Somatický vývoj a úrazy u dětí v období pubertálního spurtu – nové poznatky o významu dynamiky růstu a podmíněnosti úrazového rizika u současné populace
- Význam časné diagnostiky dědičných metabolických poruch s manifestací v novorozeneckém věku
- X. Slovenský pediatrický kongres
- Analýza rizikových faktorů suicidálního jednání v dětství a adolescenci
- Masivní plicní embolie jako první příznak nefrotického syndromu u 18leté pacientky
- Sekundárne malignity u pediatrických pacientov po transplantácii kmeňových krvotvorných buniek
- Tělesná aktivita a návykové nemoci: překvapivá zjištění
- Nové tváře mitochondriálního onemocnění u dětí
- Recenze
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nové tváře mitochondriálního onemocnění u dětí
- Masivní plicní embolie jako první příznak nefrotického syndromu u 18leté pacientky
- Význam časné diagnostiky dědičných metabolických poruch s manifestací v novorozeneckém věku
- Somatický vývoj a úrazy u dětí v období pubertálního spurtu – nové poznatky o významu dynamiky růstu a podmíněnosti úrazového rizika u současné populace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



