-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Trombóza v dětském věku
Autoři: I. Hadačová
Působiště autorů: Oddělení klinické hematologie FN Motol, Praha
Vyšlo v časopise: Čes-slov Pediat 2012; 67 (2): 115-121.
Kategorie: Vybrané kapitoly z nové učebnice Klinická pediatrie
ÚVOD
Na vzniku trombózy se účastní tři základní faktory (Virchowova triáda):
- poškození cévního endotelu
- zpomalení krevního toku
- dysbalance v systému srážení krve
V běžné populaci se předpokládá roční výskyt kolem 2,5 případů ischemických cévních mozkových příhod (CMP) a jedné žilní trombózy na 100 000 dětí. U hospitalizovaných dětí se výskyt trombotických stavů odhaduje na 5 : 10 000. Zvláště rizikové jsou věkové skupiny novorozenců, kojenců a dospívajících.
TEN představuje významný rizikový faktor, zvyšující celkovou mortalitu a druhotnou morbiditu. Na mortalitě se podílí plicní embolizace, život ohrožující je i intrakardiální lokalizace trombu. Pozdní komplikaci představuje potrombotický syndrom, to je otok a bolestivost končetiny, pigmentace a kožní změny vedoucí až k ulceraci. Vznik trombózy má u dětí téměř vždy známou příčinu. Včasná eliminace rizikových faktorů anebo zavedení preventivní antikoagulační léčby může rozvoji TEN zabránit. Rozhodování o vhodnosti antikoagulační léčby někdy ztěžuje oprávněná obava z krvácení, nutnost průběžných laboratorních kontrol, nevýhodná je i parenterální cesta aplikace některých léků.
1. VROZENÉ TROMBOFILNÍ STAVY
Vrozené trombofilní stavy představují trvalý rizikový faktor ke vzniku trombózy. Je to však pouze dispozice, která sama trombózu nevyvolá. Poskytuje pouze vhodný terén, ve kterém při působení získaných faktorů může trombóza vzniknout. K těmto faktorům patří u dětí trauma, některé typy operačních zákroků, zejména ve spojení s dlouhodobou imobilizací, protrahovaný septický stav, zvláště pak při nedostatečné hydrataci, obezita a u dospívajících dívek užívání hormonální antikoncepce (HAK).
Trombóza vzniká častěji u dětí s nefrotickým syndromem, v průběhu některých systémových autoimunitních onemocnění nebo vrozených srdečních vad. V rizikových situacích je pak vhodné zvážit, zda nezajistit dítě antikoagulační prevencí. Vždy by to mělo být po dohodě s hematologickým pracovištěm, které diagnózu vrozeného trombofilního stavu provedlo. Před paušálním zajišťováním všech operačních zákroků lze varovat právě s ohledem na riziko krvácení.
1.1. Leidenská mutace (Faktor V Leiden, FVQ 506)
Tato bodová mutace v genu pro faktor V způsobuje rezistenci k aktivovanému proteinu C a je nejčastější vrozenou trombofilní dispozicí. Leidenská mutace je dominantně dědičná. V naší populaci je asi 5 % nosičů této vlohy. Většina z nich je takzvaných bezpříznakových nosičů, to znamená, že během života trombózu neprodělají.
Z dostupných studií vyplývá, že mezi dětmi, které prodělaly trombózu, je 10–50 % nosičů Leidenské mutace. Výrazně zvýšené riziko trombózy mají nosičky této vlohy, pokud užívají HAK.
1.2. Protrombinová mutace (FII G20210A)
Protrombinová mutace je v naší populaci zastoupena asi 2 %, děti mají vyšší četnost zejména arteriálních trombóz v oblasti CNS.
1.3. Deficit antitrombinu
Antitrombin (AT) je bílkovina produkovaná v játrech. Je to hlavní koagulační inhibitor. Heterozygotní nosiči deficience AT mají hladinu pod 50 % a mají tendenci ke vzniku žilní trombózy. U dětí se trombóza může objevit už okolo desátého roku věku. Homozygotní forma je téměř vždy neslučitelná se životem, vzácně se může projevit brzy po narození rozsáhlými trombózami.
1.4. Deficit proteinu C
Protein C (PC) je rovněž produkovaný v játrech, aktivita je závislá na přítomnosti K vitaminu. Dědičnost je většinou autozomálně dominantní s inkompletní penetrancí. Heterozygoti mají obvykle sníženou aktivitu, aktivita při dolní hranici normy ale heterozygotní nosičství nevylučuje. Žilní trombóza se u těchto nosičů může objevit v dětském věku. Homozygotní nosičství se obvykle projeví brzy po narození purpurou fulminans. K léčbě této závažné formy onemocnění je k dispozici koncentrát proteinu C.
1.5. Deficit proteinu S
Protein S (PS) je stejně jako PC produkován játry, aktivita je závislá na přítomnosti K vitaminu. V plazmě je jednak volný, jednak vázaný na C4-vazný protein. Aktivní je volná forma. Klinický obraz je stejný jako u nedostatku PC, deficit proteinu S se ale může podílet i na vzniku arteriální trombózy. Při zahájení léčby warfarinem se u deficitu PC a PS může objevit warfarinová kožní nekróza.
1.6. Hyperhomocysteinémie
Hyperhomocysteinémie (HHC) je u dospělých nezávislým rizikovým faktorem pro arteriální i žilní trombózu. U dětí se může podílet na vzniku trombózy v oblasti CNS i žilní trombózy. Těžkou formu HHC způsobuje mutace v genu pro cystathion beta syntetázu. Mutace v genu pro tetrahydrofolát reduktázu je s HHC spojena výjimečně, většinou pouze v homozygotní formě.
1.7. Lipoprotein (a)
Vysoká hladina lipoproteinu (a) je dalším mírným rizikovým faktorem vzniku trombózy, u dětí jde většinou o trombózu žilní.
2. ZÍSKANÉ TROMBOFILNÍ STAVY
Trombóza u dětí vzniká nejčastěji v souvislosti se zavedením centrálního žilního katétru. Méně častá, klinicky ale významná je trombóza jako součást antifosfolipidového syndromu. Rizikovým faktorem u dívek je hormonální antikoncepce. Kontraceptiva obsahující estrogeny zvyšují riziko žilní TEN v běžné populaci asi čtyřnásobně, u pacientek s některou z vrozených trombofilií (zejména s Leidenskou mutací) 30–50násobně. Děti s proteinurií při nefrotickém syndromu ztrácejí do moči koagulační inhibitory, zejména AT. Trombóza při nefrotickém syndromu bývá jak žilní, tak arteriální. Septický stav a některé chronické zánětlivé stavy – například autoimunitní onemocnění nebo zánětlivá onemocnění střeva, např. Crohnova choroba – jsou dalším rizikovým faktorem žilní trombózy. U nádorových onemocnění se uplatňuje tlak nádoru na cévy, s výraznou dysbalancí v systému srážení je spojena například léčba L-asparaginázou nebo vysokými dávkami kortikoidů.
Trombózou jsou dále ohroženi pacienti s některými vrozenými srdečními vadami nebo cévními malformacemi. K rizikovým faktorům patří obezita, imobilizace, fixace končetiny nebo delší cestování (let nad 6 hodin nebo cesta autobusem přes noc bez přestávky). Rizikovým faktorem je i nedostatečná hydratace. Při pátrání po důvodu vzniku trombózy se velmi často setkáváme s kombinací více než dvou rizikových faktorů.
2.1. Centrální žilní katétr
CŽK je u dětí vůbec nejčastější příčinou vzniku trombózy. Katétr představuje cizí povrch, poškozuje cévní stěnu, narušuje plynulý tok krve. Některé infundované roztoky dráždí cévní endotel. Nejvíce jsou trombózou v souvislosti s CŽK ohroženi pacienti na úplné parenterální výživě, na hemodialýze a děti do jednoho roku života.
V souvislosti s CŽK rozeznáváme dva typy trombotických komplikací:
- okluzi katétru,
- hlubokou žilní trombózu spojenou s CŽK.
Při okluzi katétru se koagulum vytvoří v lumen nebo při konci katétru a nelne ke stěně cévy. Ve většině případů lze katétr zprůchodnit propláchnutím fyziologickým roztokem, při neúspěchu se nabízí možnost lokální trombolytické léčby.
Žilní trombóza v místě zavedeného katétru nasedá na cévní stěnu a postiženou cévu částečně nebo úplně uzavírá. Tato trombóza bývá asymptomatická (asi 20krát častěji než symptomatická!). K akutním klinickým příznakům patří otok, bolestivost nebo změna barvy dané končetiny, bolesti hlavy, otoky obličeje. Rozsáhlá trombóza může vyústit v syndrom duté žíly nebo v chylothorax. Vznik kolaterálního oběhu je příznakem pozdním.
Každou trombózu na podkladě CŽK – tedy i asymptomatickou – může komplikovat plicní embolizace nebo potrombotický syndrom.
Ke zprůchodnění CŽK používáme lokální nebo celkovou trombolytickou léčbu rekombinantním tkáňovým aktivátorem plazminogenu (t-PA) nebo streptokinázou. Velmi často postačí i dostatečně intenzivní antikoagulační léčba heparinem. Důležitou součástí prevence trombotizace CŽK je dodržování zásad jeho správného užívání. Indikaci preventivní antikoagulační léčby je třeba posuzovat individuálně. Pacient by měl být vždy zajištěn, pokud již trombózu v minulosti prodělal nebo má dvě a více závažných rizik pro vznik TEN.
2.2. Antifosfolipidový syndrom
Antifosfolipidový syndrom (APS) je charakterizován
- přítomností antifosfolipidové protilátky (aPLA),
- venózní či arteriální trombózou nebo opakovanou reprodukční ztrátou.
Sekundární APS se vyskytuje často v souvislosti se systémovými autoimunitními chorobami, zejména s lupus erythematodes (SLE). Pokud se APS manifestuje izolovaně, tedy bez projevů autoimunitního onemocnění, jedná se o tzv. primární APS. Pouhý průkaz aPLA bez průvodních klinických příznaků nelze označit jako APS.
Antifosfolipidové protilátky jsou zaměřené proti fosfolipidům. Pro diagnostiku APS je důležitá přítomnost:
- lupus antikoagulans (LA)
- antikardiolipinové protilátky (aCLA)
- protilátky proti beta 2 glykoproteinu I (β 2-GPI)
U dětí je poměrně častá přechodná přítomnost aPLA po virovém onemocnění, po očkování. Vídáme ji také v souvislosti s léčbou chlorpromazinem, prokainamidem, fenytoinem, interferonem alfa, amoxycilinem nebo chinidinem. Asi 5 % zdravé populace má prokazatelné aPLA v nízkých titrech.
Trombóza venózní či arteriální může postihovat cévy jakéhokoli kalibru. Kromě klasické hluboké žilní trombózy dolních nebo horních končetin jsou často postiženy cévy mozku, koronární arterie, plicní cévy, žíly jaterní a ledvinné, cévy oka a nadledvin, povrchní kožní cévy nebo srdeční chlopně. Trombóza často vzniká bez jasné vyvolávající příčiny, má tendenci k recidivám (přitom často v různé lokalizaci), a to i na standardní antikoagulační léčbě.
Mechanismus vzniku trombózy u APS není zcela jasný. Velmi pravděpodobná je interference aPLA v systému proteinu C. Významná je i aktivace trombocytů, interference aPLA s inhibitory asociovanými s fosfolipidy, defekty fibrinolýzy a aktivace endotelu.
Opakované reprodukční ztráty naplňují diagnostická kritéria APS, pokud jde o jeden a více spontánních abortů po 10. týdnu gravidity, anebo jedno a více před 34. gestačním týdnem narozené, jinak zdravé dítě (při těžké eklampsii nebo placentární insuficienci), anebo 3 a více nejasných potratů do 10. týdne gravidity.
Klinický obraz
Kromě žilní či arteriální trombózy mohou klinický obraz APS doplňovat ještě další příznaky:
- netrombotické neurologické příznaky (komplikovaná migréna, chorea, křeče, transverzální myelitida, Guillainův-Barréův syndrom, demence)
- hematologické abnormality (trombocytopenie, Coombsova pozitivní hemolytická anemie)
- livedo reticularis
- adrenální insuficience
- avaskulární nekróza kosti
- plicní hypertenze
Vzácně se APS projevuje krvácením, a to buď spojeným s trombocytopenií, nebo přítomností protilátky proti protrombinu. Tato protilátka vytváří komplex s protrombinem, to vede ke zvýšení clearance protrombinu a hypoprotrombinémii s výrazným prodloužením protrombinového testu (PT).
Katastrofická forma APS probíhá jako fulminantní multiorgánové selhání s tvorbou mikrotrombů v cirkulaci, renálním selháním, encefalopatií, získaným syndromem respirační tísně, srdečním selháním, kožními změnami a trombocytopenií. Většina těchto pacientů má preexistující autoimunitní onemocnění.
Laboratorní vyšetření
ACLA a anti β 2-GPI vyšetřujeme pomocí ELISA testů, význam mají protilátky ve třídě IgG a IgM. LA prodlužuje na fosfolipidech závislé koagulační testy, hlavně APTT, méně i PT. Vzhledem k tomu, že jen některé reagencie pro stanovení APTT jsou dobře citlivé k přítomnosti LA, je nutno si pamatovat, že normální hodnota APTT ještě přítomnost LA nevylučuje. Větší výpovědní hodnotu má tento test při použití reagencie citlivé k přítomnosti lupus antikoagulans (LA APTT).
K dalším používaným testům patří kaolinový test (Kaolin Clotting Time – KCT), ředěný protrombinový test (dilute Prothrombine Time – dPT), ředěný Russell Viper Venom test (dilute Russell Viper Venom Time – dRVVT). Při patologických výsledcích těchto testů se musí vyloučit deficience koagulačních faktorů nebo přítomnost specifického inhibitoru některého z faktorů.
Léčba
U pacientů s primárním APS a žilní trombózou je doporučena léčba heparinem s převedením na warfarin, nebo léčba nízkomolekulárním heparinem (LMWH), délka léčby je individuální, většinou ale trvá minimálně 6 měsíců. U arteriální trombózy lze použít pro dlouhodobou léčbu kyselinu acetylsalicylovou. U pacientů se sekundárním APS je riziko recidivy trombózy výrazně zvýšeno, antikoagulační léčba tedy musí být dlouhodobá. Vždy je vhodná konzultace s hematologem ohledně volby vhodného preparátu, délky léčby a laboratorní kontroly.
Imunosupresivní léčba základního autoimunitního onemocnění není prevencí vzniku trombóz vyvolaných sekundárním APS. Výjimkou je katastrofický APS, který vyžaduje agresivní imunosupresi. Zde je namístě i plazmaferéza a po zvládnutí akutního stadia podávání vysokých dávek imunoglobulinů (IVIG) nebo cyklofosfamidu v měsíčních intervalech.
U pacientů s autoimunitním onemocněním a pozitivitou aPLA bez přítomnosti klinických příznaků APS je možné podávat kyselinu acetylsalicylovou v dávce 1–2 mg/kg denně nebo obden (maximální dávka 100 mg denně). Pokud je přítomno minimálně jedno další vrozené či získané trombofilní riziko, lze zvážit preventivní podávání warfarinu nebo LMWH.
Asymptomatická přítomnost aPLA zasluhuje pouze další sledování. Přetrvává-li nález déle než 3 měsíce nebo se střídají období negativity a pozitivity, indikujeme podrobnější imunologické vyšetření. Část těchto pacientů může mít i slabě pozitivní antinukleární protilátku (ANA). Přechodná pozitivita ANA ještě neznamená, že se u daného jedince jedná o systémové autoimunitní onemocnění.
Prevence
Je vhodné vyloučit další rizikové faktory trombózy (kouření, orální kontraceptiva, hypertenze, hyperlipidémie). Současně by měl být pacient vyšetřen na přítomnost dalších vrozených a získaných trombofilních faktorů.
3. ANTIKOAGULAČNÍ LÉČBA
Většina zásad antikoagulační léčby u dětí se odvozuje ze zkušeností u dospělých pacientů. Je však velká snaha zavést protokoly přizpůsobené dětskému věku, vycházející z odlišností koagulačního systému zejména u malých dětí. Na podkladě klinických studií byla vypracována některá obecná doporučení.
3.1. Standardní heparin
Heparin je mukopolysachardid, který společně s antitrombinem neutralizuje aktivitu některých enzymů koagulační kaskády. Za fyziologických podmínek antitrombin neutralizuje pouze trombin a aktivovaný faktor X. V přítomnosti heparinu je tato reakce urychlena a navíc jsou inhibovány faktory IXa, XIa a XIIa. Účinek heparinu může být významně oslaben v případě nízké plazmatické koncentrace AT. Léčbu standardním heparinem zahajujeme úvodním bolusem a pokračujeme kontinuální infuzí. Kontrolu provádíme pomocí APTT, u dětí lze s výhodou použít i anti Xa test.
Úvodní bolus (při zahájení léčby):
- 75 U/kg i.v. během 10 minut
Udržovací dávka:
- děti do 1 roku věku: 28 U/kg/h
- děti nad 1 rok věku: 20 U/kg/h (dospělí 18 U/kg/h)
Kontrolní APTT se provádí 4 hodiny po zahájení léčby (ne dříve!).
Koncentrace roztoku s heparinem:
- děti pod 10 kg: 80 U/ml
- děti nad 10 kg: 40 U/ml
! Děti s restrikcí tekutin a novorozenci mohou dostat koncentrovanější roztok!
Léčebné rozmezí APTT 60–85 s by mělo odpovídat hodnotě anti Xa 0,4–0,7 U/ml, dávku upravujeme podle návodu v tabulce 1.
Tab. 1. Úprava dávky SH podle hodnoty APTT. 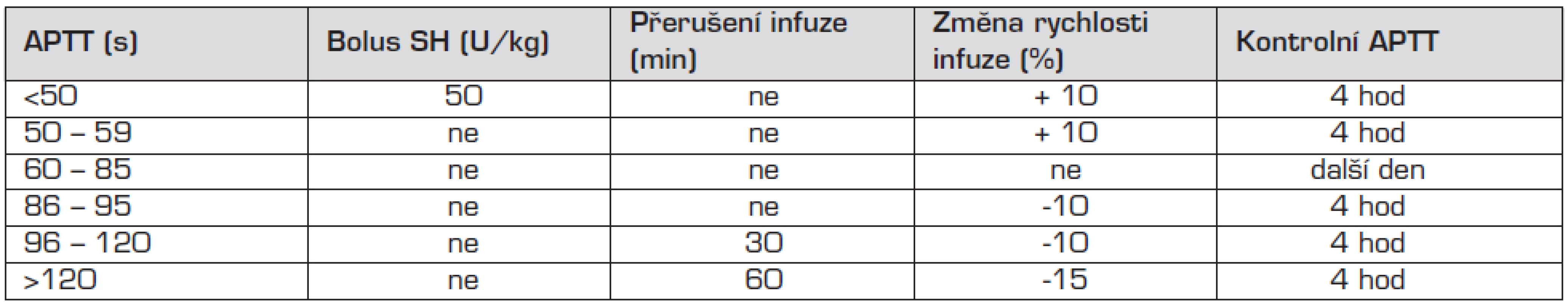
APTT – aktivovaný parciální tromboplastinový test, SH – standardní heparin Podávání heparinu je spojeno s rizikem krvácení, proto je nutná průběžná monitorace účinnosti dávky. Při krvácení způsobeném předávkováním heparinu podáváme jako antidotum protamin 1 mg na 100 IU heparinu podaného v průběhu posledních dvou hodin.
Heparinem indukovaná trombocytopenie je další možnou komplikací. Při dlouhodobém podávání heparinu může dojít k projevům osteoporózy.
3.2. Nízkomolekulární heparin
Nízkomolekulární heparin (LMWH) vzniká fragmentací standardního heparinu. LMWH, na rozdíl od standardního heparinu, inhibuje účinky zejména aktivovaného faktoru X (Xa) a méně trombinu. Jeho velkou výhodou je delší poločas účinku, stabilnější farmakokinetika a tím i nižší potřeba monitorování účinku, možnost subkutánního podávání a menší riziko krvácení. Pro uvedené vlastnosti LMWH v posledních letech u dětí nahrazuje standardní heparin. Profylaktická dávka LMWH se pohybuje v rozmezí 100–150 IU/kg/24 h nejčastěji v jedné podkožní injekci, u dětí do jednoho roku je vhodnější podat 50–75 IU/kg/12 h. Při léčbě trombózy je podávána dávka 100–150 IU/kg/12 h, opět nejčastěji formou podkožní injekce.
Účinnost léčby LMWH je monitorována stanovením hladiny anti Xa. Odběr žilní krve má být prováděn za 4 hodiny po aplikaci (při zahájení léčby až po 2. dávce). Návod pro úpravu dávkování je uveden v tabulce 2
Tab. 2. Úprava dávky LMWH podle hodnoty anti Xa. 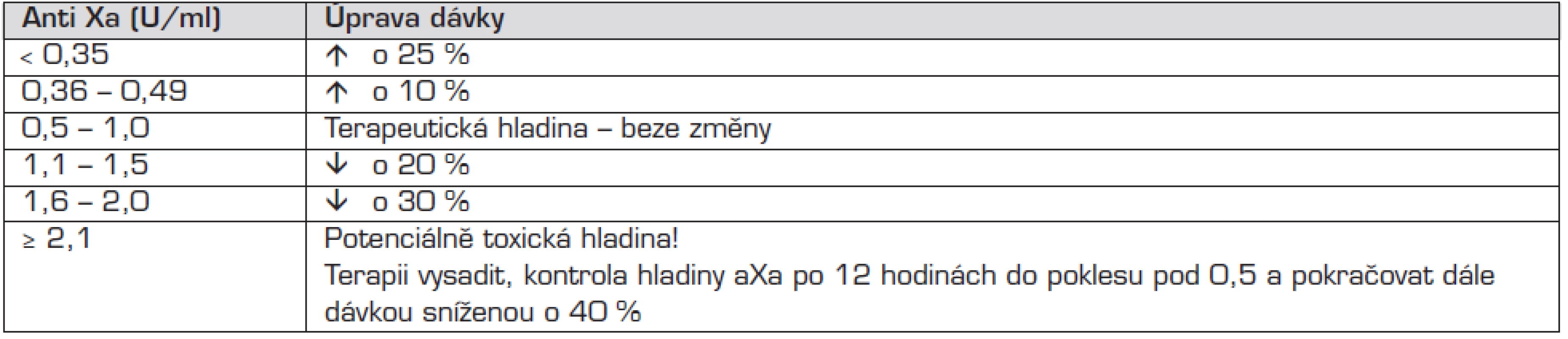
LMWH – nízkomolekulární heparin Antidotum je stejně jako u standardního heparinu protamin, podává se v dávce 1 mg/100 IU naposledy podaného LMWH. Neutralizace aXa aktivity je jen částečná, proto nelze předpokládat úplné zrušení antikoagulačního efektu jako u standardního heparinu.
3.3. Warfarin
Warfarin je antagonista vitaminu K, v jeho přítomnosti se v játrech tvoří koagulačně neaktivní faktory II, VII, IX a X a inhibitory – protein C a S. Pro kontrolu účinnosti užíváme protrombinový test (PT) vyjádřený hodnotou INR.
Terapeutickým rozmezím pro děti s žilní trombózou je hodnota INR 2–3, pro děti s mechanickou chlopní srdeční 2,5–3,5 ( – 4). Léčbu warfarinem zahajujeme úvodní dávkou 0,2 mg/kg v jedné denní dávce, maximální denní dávka je 10 mg. U pacientů s těžší jaterní lézí, při deficitu PC nebo PS či u nemocných po Fontanově operaci je úvodní dávka 0,1 mg/kg (maximální denní dávka 5 mg). Udržovací dávka se řídí podle hodnoty INR, návod na úpravu dávkování je v tabulce 3.
Tab. 3. Udržovací dávka warfarinu podle hodnoty INR. 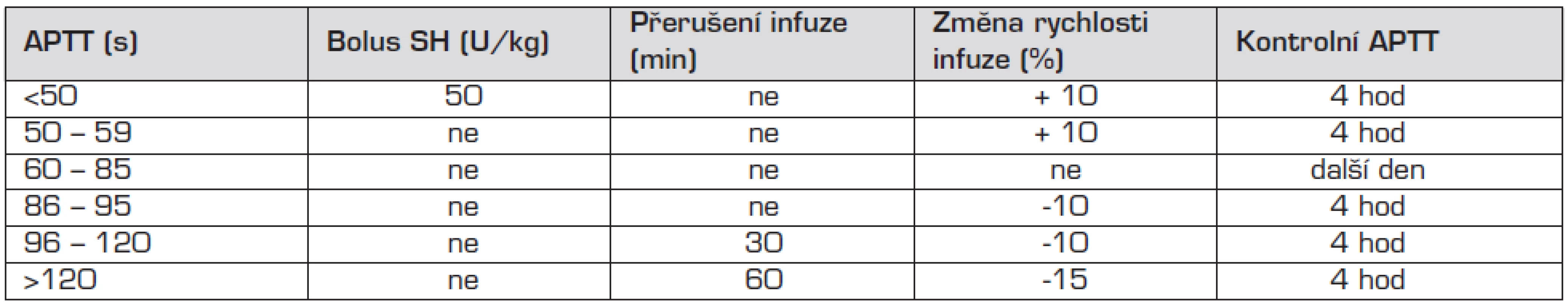
INR – mezinárodní normalizovaný poměr Po dosažení požadované hodnoty INR ve dvou následujících odběrech postupně prodlužujeme interval kontrol až na cílový interval. Ten by neměl být delší než 4 týdny. Zahájení léčby warfarinem musí být pokryto současnou léčbou heparinem. Heparin vysazujeme až při dosažení požadované hodnoty INR ve dvou následujících odběrech. Při výkyvech hodnot INR během dlouhodobé léčby postupujeme podle tabulky 4.
Tab. 4. Dávkování warafrinu v průběhu dlouhodobé léčby. 
INR – mezinárodní normalizovaný poměr Každý pacient na warfarinu má mít u sebe legitimaci s údaji o důvodu léčby a její délce, krevní skupině, užitém preparátu, jeho dávce a aktuální hodnotě INR. Nemělo by chybět jméno a telefon ošetřujícího lékaře. Délka a intenzita antikoagulace je dána základním onemocněním a určuje ji specialista (hematolog, kardiolog). Pravidelné kontroly INR provádí praktický lékař, event. spádové lůžkové oddělení. Warfarin vždy vysazujeme postupně během 2 až 3 týdnů. Náhlé vysazení je spojeno s větším rizikem recidivy trombózy.
Zrušení antikoagulačního účinku warfarinu:
V průběhu antikoagulační léčby warfarinem je někdy nutné zrušit její účinek. Záleží pak na tom, jde-li o přerušení plánované, či akutní.
Při plánovaném přerušení léčby udržujeme během posledních dvou kontrol pacienta při dolní hranici požadované hodnoty INR. 72 hodin před výkonem warfarin vysadíme a od následujícího dne, tj. 48 hodin před výkonem, zajistíme heparinem v preventivní dávce. Výhodnější je LMWH, ten podáváme naposledy den před výkonem ráno. Další dávku aplikujeme až večer po výkonu. Na warfarin pak převedeme pacienta po dohodě s chirurgem, jakmile pomine riziko krvácení. Pokud se nám nedařilo držet INR při dolní hranici požadované hodnoty a je riziko, že by účinek do 72 hodin nevymizel, vysadíme warfarin již 5 dnů před výkonem. Další postup je stejný. Neklesne-li 12 hodin před výkonem INR pod 1,4 (u operací s vysokým rizikem krvácení pod 1,2), podáme malou dávku Kanavitu (2–5 kapek per os nebo 0,5–2 mg podkožní injekcí, u starších dětí lze i pomalu nitrožilně). Před vyšší dávkou je nutno varovat, zamezili bychom na delší dobu dobrému účinku warfarinu.
Při náhlé potřebě zrušení antikoagulačního účinku warfarinu – např. před akutním operačním zákrokem – vysadíme warfarin a podáme Kanavit. Jeho účinek se dostaví za 4–6 hodin. Je-li třeba připravit pacienta k výkonu ihned, aplikujeme mraženou plazmu, případně protrombinový koncentrát. Dalším důvodem k rychlému zrušení účinku warfarinu může být závažné krvácení. Není-li život ohrožující, podáme Kanavit a mraženou plazmu 20 ml/kg. U život ohrožujícího krvácení podáme Kanavit 5 mg pomalu nitrožilně (během 10–20 minut) a protrombinový koncentrát v dávce 50 U/kg. Další antikoagulační léčbu zahajujeme vždy okamžitě poté, jakmile pomine riziko krvácení.
3.4. Doporučené režimy antikoagulační léčby
3.4.1. Novorozenci
Při trombóze v souvislosti s žilním katétrem (centrálním nebo umbilikálním) katétr odstraníme, je-li to možné až po 3–5 dnech antikoagulační léčby. U trombózy menšího rozsahu (v souvislosti nebo bez souvislosti s žilním katétrem) je možné zahájit antikoagulační léčbu nebo vyčkat za radiologické kontroly a léčbu zahájit až při progresi nálezu. Rozsáhlejší trombóza a zejména trombóza s rizikem poškození orgánu vyžaduje léčbu. Volíme buď LMWH v dávce 150 IU po 12 hodinách s úpravou dávky do požadovaného rozmezí aXa 0,5–1 U/ml nebo standardní heparin v kontinuální infuzi s požadovaným rozmezím aXa 0,35–0,7 U/ml nebo tomu odpovídající hodnotou APTT. Léčba by měla trvat 6 týdnů až 3 měsíce, při zavedeném katétru pokračujeme dále v preventivním režimu do jeho vynětí (LMWH 75 IU po 12 hodinách, rozmezí 0,2–0,4 U/ml).
3.4.2. Děti s trombózou bez souvislosti s CŽK
Léčbu zahajujeme LMWH nebo standardním heparinem na dobu 5–10 dnů, LMWH v dávce 100 až 150 IU po 12 hodinách s požadovaným rozmezím aXa 0,5–1 U/ml, standardní heparin v kontinuální infuzi, rozmezí aXa 0,35–0,7 U/ml nebo APTT R 1,5–2,5, to odpovídá času 60–85 s. Na warfarin je možné převádět od 1. dne, léčba heparinem se pak ukončí po dosažení požadovaného rozmezí INR 2–3 ve dvou následujících odběrech. Při obtížích s dosažením stabilní požadované hodnoty INR je lékem volby pro dlouhodobou léčbu LMWH. Léčbu warfarinem nezahajujeme u pacientů, kde je zvýšené riziko krvácení nebo je plánován v krátké době chirurgický zákrok. Léčba by měla trvat u idiopatické trombózy 6 měsíců, u indukované trombózy 3 měsíce (není-li již přítomen vyvolávající faktor). Při nedostatečné rekanalizaci před plánovaným ukončením léčby je vhodné pokračovat další 3 měsíce.
Při přetrvávání vyvolávajícího faktoru při dobré rekanalizaci se doporučuje pokračovat v preventivním režimu (LMWH 1krát denně, aXa 0,2–0,4 U/ml nebo warfarin s INR 1,5–1,9).
Pozor: Při rozsáhlé trombóze nebo trombóze žil dolních končetin zasahující nad tříselný vaz u mladistvých pacientů je vhodné kontaktovat specializované pracoviště ohledně možnosti lokální trombolytické léčby.
3.4.3. Děti s trombózou v souvislosti s CŽK
Katétr odstraníme, je-li nepotřebný nebo nefunkční – lépe teprve po 3–5 dnech po zahájení antikoagulační léčby. Je-li funkční, je možné jej ponechat in situ. Léčbu zahajujeme LMWH nebo standardním heparinem, LMWH v dávce 100–150 IU po 12 hodinách s požadovaným rozmezím aXa 0,5–1 U/ml, standardní heparin v kontinuální infuzi, rozmezí aXa 0,35–0,7 U/ml nebo APTT R 1,5–2,5, to odpovídá času 60–85 s.
Pro dlouhodobou léčbu je k dispozici warfarin nebo LMWH. Léčba by měla trvat při odstraněném katétru 3 měsíce, při ponechaném katétru je vhodné pokračovat po 3 měsících v preventivním režimu (LMWH 1krát denně, aXa 0,2–0,4 U/ml nebo warfarin s INR 1,5–1,9). Při recidivě trombózy v době preventivného režimu zahajujeme znovu léčbu a v té pokračujeme do odstranění katétru.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2012 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Postižení kardiovaskulárního systému u Turnerova syndromu
- Duševní poruchy s převahou somatických příznaků
- Trombóza v dětském věku
- K historii pediatrické hematologie od poloviny dvacátého století
- Půl století s dětskou kardiologií
- Vzpomínky pediatra na nebezpečné situace pro pacienty a lékaře
- Co uvolnit a proč?
- Je ambulantní porod v České republice vhodnou alternativou?
- Významné životní jubileum paní docentky MUDr. Evy Pařízkové, CSc
- Pozdrav a přání všeho dobrého Jaroslavu Wiedermannovi
- X. český pediatrický kongres s mezinárodní účastí, Liberec
- XVI. česko-slovenský hematologický a transfuziologický sjezd 6.–8. září 2012
- Růst a pubertální vývoj u dětí s intrauterinní růstovou retardací v moravské větvi studie ELSPAC
- Transplantace hematopoetických buněk u pěti pacientů s chronickou granulomatózní nemocí v České republice
- Rizikové faktory pro vznik tromboembolické nemoci u dospívajících v Jihomoravském kraji v letech 2004–2010
- Případ akcidentální otravy chlapců veterinárním anestetikem
- Neobvyklá príčina patologickej fraktúry u 18-ročnej pacientky
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Trombóza v dětském věku
- Duševní poruchy s převahou somatických příznaků
- Transplantace hematopoetických buněk u pěti pacientů s chronickou granulomatózní nemocí v České republice
- Postižení kardiovaskulárního systému u Turnerova syndromu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



