-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Ligneózna konjunktivitída, hydrocefalus a protrahované respiračné infekcie u pacienta s deficitom plazminogénu
Ligneous conjunctivitis, hydrocephalus and protracted respiration infections in a patient with plasminogen deficit
We report a rare case of an infant with internal hydrocephalus, pseudomembranous conjunctivitis and recurrent respiratory infections associated with plasminogen deficiency. Both, systemic and topical treatment were ineffective. Repeated attempts on ventriculoperitoneal shunting had to be performed due to non-inflammatory obstruction of drainage system. Pseudomembranous conjunctivitis was the most prominent clinical finding. Bilateral thick yellow fibrin membranes on the palpebral surfaces were present. Suspicion of defective fibrinolysis was supported by histological finding of „pure“ fibrin from the conjunctivas coating membranes. Severely reduced activity of plasminogen (14.4%, norm 75–150%) was confirmed.
Plasminogen deficit type I is a rare systemic disease characterized by a marked defect of extracellular fibrinolysis that leads to the formation of ligneous (fibrin rich) pseudomembranes at mucosae. Most common clinical manifestation is ligneous conjunctivitis, although pseudomembranes can also form in respiratory tract, gastrointestinal tract etc. Diagnosis of hypoplasminogenemia is based on typical clinical manifestation and evidence of quantitative or qualitative defect of plasminogen activity. Treatment of ligneous conjunctivitis is intricate; topical plasminogen concentrate holds promise. In systemic affection, replacement therapy with human plasminogen can be efficient.Key words:
plasminogen deficit, ligneous conjunctivitis, pseudomembranes, congenital hydrocephalus
Autoři: J. Čižmár; J. Behúnová; Ľ. Podracká
Působiště autorů: I. Klinika detí a dorastu LF UPJŠ a DFN, Košice, prednosta prof. MUDr. Ľ. Podracká, CSc.
Vyšlo v časopise: Čes-slov Pediat 2012; 67 (1): 38-42.
Kategorie: Kazuistika
Souhrn
Autori prezentujú vzácnu kazuistiku dojčaťa s kongenitálnym hydrocefalom, pseudomembranóznou konjunktivitídou a protrahovanými respiračnými infekciami, asociovanú s vrodeným deficitom plazminogénu. Komplexná liečba bola neúčinná. Pre nezápalovú obštrukciu sa museli vykonať opakované ventrikuloperitoneálne shunty. V klinike dominovala pseudomembranózna konjunktivitída s hrubými náletmi fibrínu. Podozrenie na defektnú fibrinolýzu podporoval histologický nález „čistého“ fibrínu v membránach. Cielené vyšetrenie potvrdilo extrémne nízku aktivitu plazminogénu (14,4 %, norma 75–150 %).
Deficit plazminogénu typ I je vzácne systémové ochorenie charakterizované poruchou extracelulárnej fibrinolýzy s tvorbou ligneóznych (na fibrín bohatých) pseudomembrán na povrchu slizníc. Najčastejším klinickým prejavom deficitu plazminogénu typu I je ligneózna konjunktivitída, ale postihnuté môžu byť aj iné orgány. Diagnózu potvrdí dôkaz kvantitatívnej resp. kvalitatívnej poruchy plazminogénu. Liečba ligneóznej konjunktivitídy je torpídna, priaznivý efekt majú očné kvapky s obsahom ľudského plazminogénu. Pri systémovom postihnutí môže byť účinná substitúcia ľudského plazminogénu.Kľúčové slová:
deficit plazminogénu, ligneózna konjunktivitída, pseudomembrány, kongenitálny hydrocefalusÚvod
Ligneózna konjunktivitída je vzácna forma chronickej pseudomembranóznej konjunktivitídy, ktorá sa v svetovej literatúre spája s deficitom plazminogénu typu I. Hoci sa tvorba pseudomembrán manifestuje predovšetkým na spojovkách očí, pablany sa môžu tvoriť aj v gastrointestinálnom trakte, bronchiálnom systéme, genitálnom trakte a na koži. Zriedkavejšie sa deficit plazminogénu typu I spája s kongenitálnym hydrocefalom, no patofyziologický mechanizmus jeho vzniku nie je celkom objasnený.
V tejto kazuistike prezentujeme prípad dojčaťa s ligneóznou konjunktivitídou, kongenitálnym hydrocefalom, s protrahovanými respiračnými infekciami a s dokázaným závažným deficitom plazminogénu.
Kazuistika
Pacienta preložili na našu kliniku hneď po narodení pre kongenitálny hydrocefalus. V rodinnej anamnéze bola udaná závažná porucha sluchu u oboch rodičov a spontánny potrat u matky. Jeden starší súrodenec je zdravý. Chlapec sa narodil v 38. gestačnom týždni s normálnou pôrodnou hmotnosťou a dĺžkou (3020 g, 47 cm), pôrod sekciou bol indikovaný pre prenatálne zistený hydrocefalus. Po pôrode sa USG vyšetrením potvrdila Dandy-Walkerova anomália s progredujúcim 4-komorovým hydrocefalom. Očné pozadie a vyšetrenie likvoru boli negatívne. Pacient prekonal novorodeneckú hyperbilirubinémiu s maximom 242 μmol/l, ktorá po symptomatickej liečbe pozvoľne ustúpila. Dva týždne po narodení sa prvýkrát zjavila obojstranná konjunktivitída, ktorá sa hodnotila podľa „hnisavého“ výtoku z očí ako mukopurulentná. Kultivačne sa vypestoval Staphylococcus haemolyticus, preto sa podávali lokálne antibiotiká podľa citlivosti.
Na 16. deň života sa pre progresiu hydrocefalu pacientovi zaviedla ventrikuloperitoneálna drenáž, ktorá však pre (nezápalovú!) obštrukciu už po mesiaci zlyhala. Aj ďalšie ventrikuloperitoneálne shunty (celkovo 4-krát!) fungovali iba krátkodobo a pre „upchatie“ odvodného systému opätovne zlyhávali (obr. 1). Koža nad operačnou ranou sa hojila len pomaly, dlho secernovala, následne došlo k rozpadu tkaniva nad drenážou a po ventrikulitíde. Okrem uvedených komplikácií u pacienta takmer počas celej hospitalizácie dominovali protrahované infekcie dýchacích ciest (rinitídy, bronchitídy s hyperviskóznym tracheobronchiálnym a nazofaryngeálnym sekrétom, 1x atypická bronchopneumónia (obr. 2)), a najmä úporná obojstranná konjunktivitída (obr. 3), ktoré napriek cielenej ATB a symptomatickej liečbe neustupovali.
Obr. 1. CT mozgu: výrazná dilatácia supratentoriálnych oddielov komorového systému a redukcia mozgového parenchýmu. Fig. 1. Brain CT: marked dilation of supratentorial parts of the chamber system and reduction of the brain parenchyma. 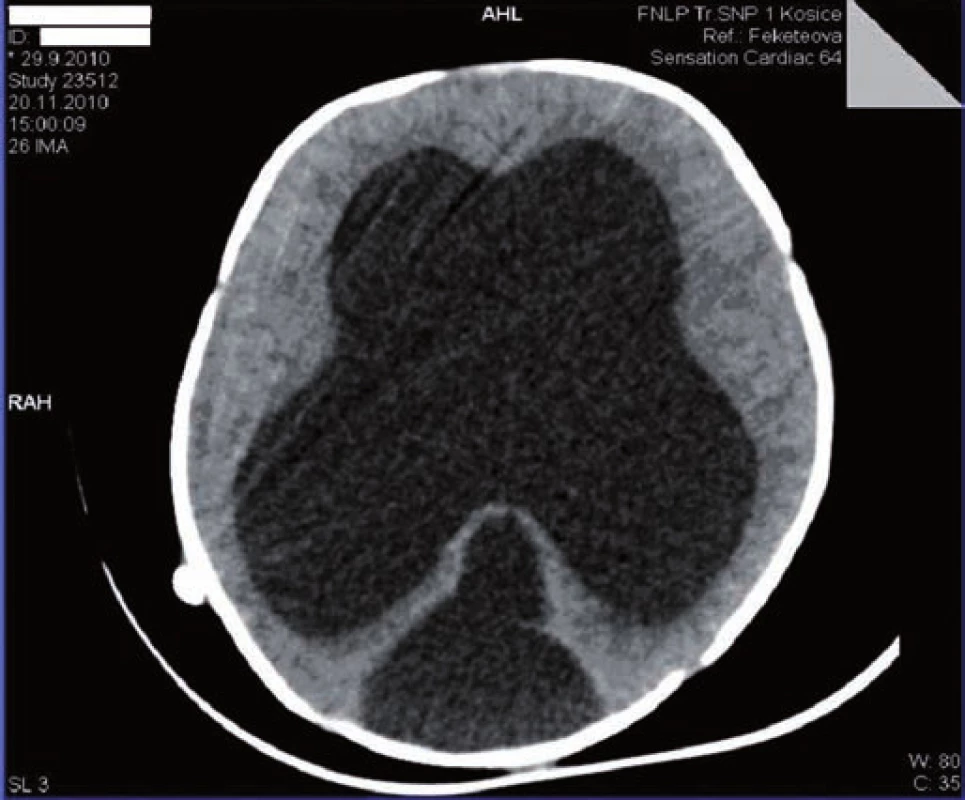
Obr. 2. RTG hrudníka: diskrétne splývavé polosýte tiene voštinovitej kresby obojstranne v horných pľucnych poliach – atypická pneumónia. Fig. 2. X-ray of the chest: discrete blended half-tone shades of the honeycomb design bilaterally in upper pulmonary fields – atypical pneumonia. 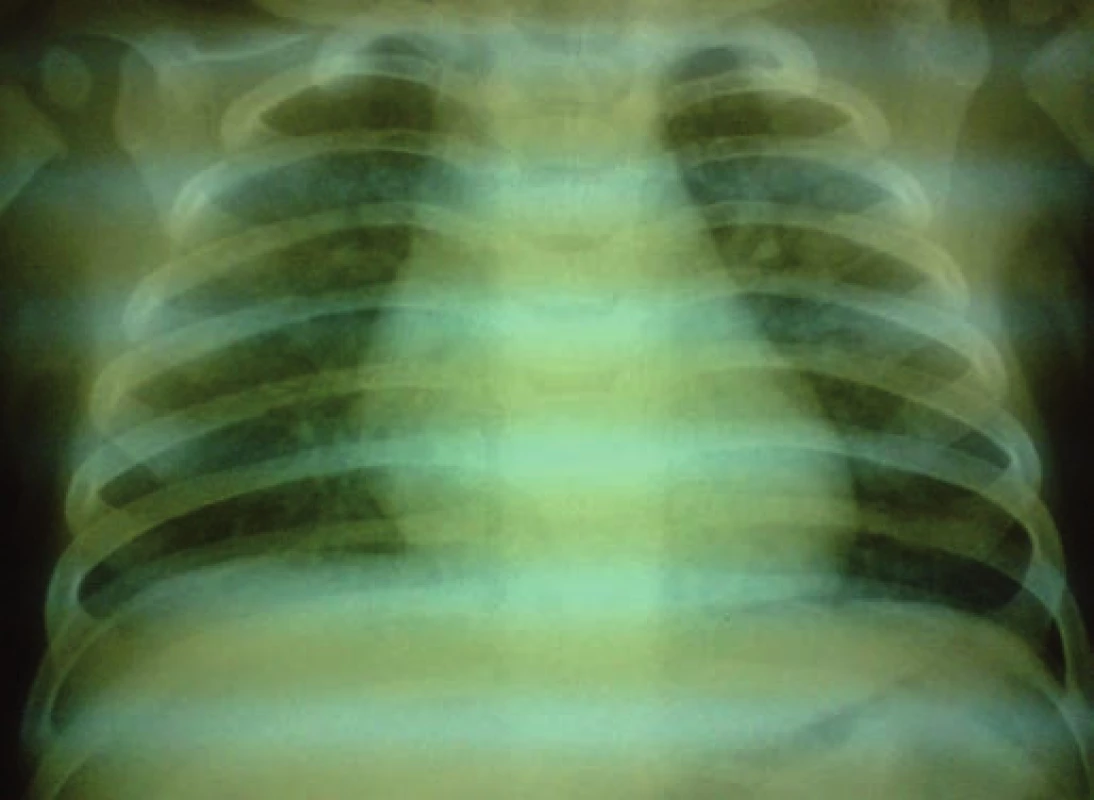
Obr. 3. Ligneózna konjunktivitída. Fig. 3. Ligneous conjunctivitis. 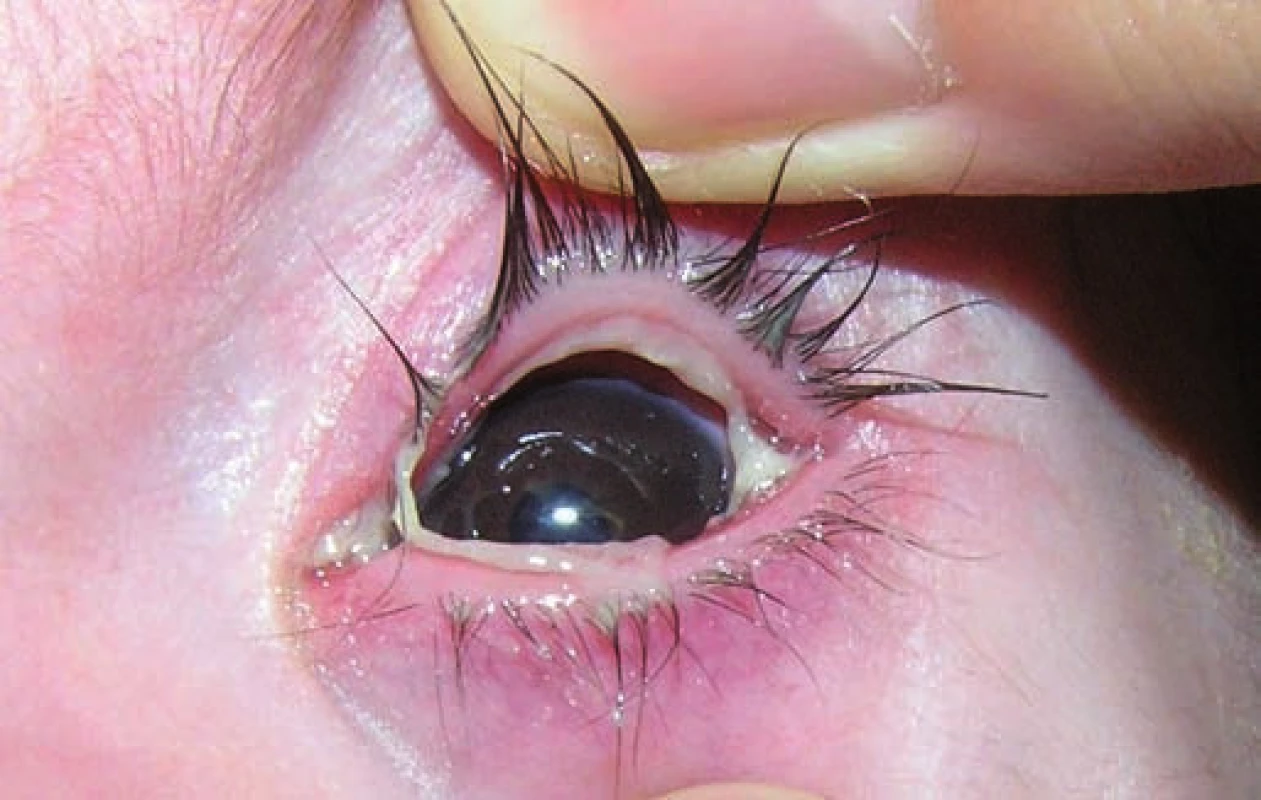
Sérologické a kultivačné vyšetrenia boli negatívne (RSV, adeno, chrípka A, B, herpes simplex, CMV, EBV, mycoplasma pneumoniae, chlamydia pneumoniae a trachomatis, HIV, lues, toxoplazma, rubeola, pneumocystis carinii). Najnápadnejším klinickým nálezom bola konjunktivitída progredujúca až do pseudomembranóznej formy. Dieťa malo na obidvoch spojovkách viditeľné hrubé žltkavé nálety fibrínu, ktoré sa dali odstrániť len chirurgicky (oftalmológ opakovane realizoval znesenie membrán). Kultivácie zo spojovkového vaku boli okrem úvodných nálezov (Staphylococcus haemolyticus a Staphylococcus epidermidis MRSE) negatívne. Lokálna aplikácia početných antibiotík a kortikoidov bola absolútne neúčinná, konjunktivitída neustúpila ani po výplachoch slzných kanálikov. Príčinu pretrvávajúceho torpídneho stavu neobjasnilo ani dôkladné mikroskopické vyšetrenie rohovky. V membránach sa histologickým vyšetrením prekvapivo nedokázali žiadne zápalové bunky či mikroorganizmy, len „čistý“ fibrín. Zápalové markery (Leu, CRP, prokalcitonín) boli zvýšené len počas ventrikulitídy, inak napriek nelepšiacemu sa klinickému obrazu ostávali nízke. Základná biochémia bola bez patologických posunov, vrátane α1AT. Skríningové hemokoagulačné parametre boli v norme, ukazovatele celulárnej a humorálnej imunity nesvedčili pre primárny imunodeficit. Špecifické IgE na kravské mlieko boli negatívne, Cl v pote vylúčili cystickú fibrózu (13,9 … 12,7 mmol/l). Na USG brucha sa okrem miernej splenomegálie nezobrazili žiadne patologické echo zmeny, karyotyp bol podľa očakávania normálny mužský, 46,XY.
V ďalšom diferenciálno-diagnostickom postupe sme pátrali po príčine, ktorá by vysvetlila torpídny „(pseudo)membránový“ zápal spojoviek i dýchacích ciest nereagujúci na cielenú antibiotickú či komplexnú symptomatickú liečbu. S podobnými systémovými príznakmi sa v literatúre viažu zriedkavé kazuistiky ligneóznej konjunktivitídy u chorých s dokázaným deficitom plazminogénu typ I. Podozrenie na defektnú fibrinolýzu už čiastočne podporoval histologický nález „čistého“ fibrínu zo vzorky membrán husto pokrývajúcich obidve spojovky. Tento predpoklad definitívne potvrdilo vyšetrenie aktivity plazminogénu v plazme nášho pacienta chromogénnou metódou, ktoré odhalilo extrémne nízku hodnotu plazminogénu: 14,4 % (norma 75–150 %).
Diskusia
Ťažká hypoplazminogenémia (HPG) a/alebo deficit plazminogénu (PLG) typ I je systémové ochorenie charakterizované výraznou poruchou extracelulárnej fibrinolýzy, ktorá vedie k vytvoreniu ligneóznych (na fibrín bohatých) pseudomembrán na slizniciach pri hojení rán.
Deficit plazminogénu sa delí na kvantitatívny (typ I) a kvalitatívny (typ II). Tento patologický stav je spôsobený 2 mutáciami v géne pre plazminogén, chromozómový lokus 6q26. Pacient môže byť homozygot alebo zložený heterozygot, dedičnosť je teda autozómovo recesívna, hoci sa výskyt väčšiny prípadov v rodinách vzhľadom na zriedkavosť uvádza ako sporadický. Mutácie PLG génu môžu mať za následok kvantitatívny aj kvalitatívny nedostatok plazminogénu. Jedinci s heterozygotnou HPG (s hodnotu PLG a jeho aktivitou okolo 50 %) sú asymptomatickí, bez klinických prejavov svedčiacich pre poruchu extracelulárnej fibrinolýzy. Pri dysplazminogenémii (DPG, typ II deficitu plazminogénu) sú hodnoty PLG normálne, alebo len mierne znížené, avšak funkčná aktivita PLG je výrazne znížená. Incidencia heterozygotov pre hypoplazminogenémiu sa odhaduje na 0,35 % u kaukazskej rasy v Minnesote, USA [1], 0,13 % v južnom Nemecku [2], 0,26 % v Škótsku [3] a 0,42 % v Japonsku [4]. Odhadovaná prevalencia ligneóznej konjunktivitídy je 1,1/100 000 [5].
Stupeň deficitu plazminogénu u pacientov varíruje (viaceré štúdie udávajú široké rozmedzie od 4 až do 50 % normy, pričom rôznorodosť klinických príznakov koreluje so stupňom deficitu plazminogénu). Prvé klinické symptómy sa zvyčajne manifestujú už v rannom detstve, ale môžu prepuknúť v ktoromkoľvek veku. Môžu ich provokovať opakované mikrotraumy (prach, cudzie teleso), chirurgické výkony, či lokálny zápal. Najčastejším zjavným klinickým prejavom HPG je pseudomembranózny zápal spojoviek – ligneózna konjunktivitída, ktorá postihuje až 80 % pacientov s hypoplazminogenémiou. Ide o zriedkavú formu konjunktivitídy charakterizovanú začervenaním spojoviek s tendenciou k tvorbe žltavo sfarbených pseudomembrán hrubej až „drevitej“ konzistencie na vnútornom povrchu mihalníc, ktoré nahrádzajú mukózu [6]. Po mechanickom poškodení spojovkovej mukózy dochádza k exsudácii plazmatických proteínov a tvorbe fibrínu, ktorý pri nedostatku plazminogénu vytvára pseudomembrány a konjunktivitídu. U nášho pacienta sa pseudomembranózna ligneózna konjunktivitída vyvinula už v prvom mesiaci života, zrejme pre závažnú hypoplazminogénémiu (len 14 % aktivity). Provokujúcim inzultom mohol byť stafylokokový zápal spojoviek krátko po narodení.
V ťažkých prípadoch môžu pseudomembrány pokrývať aj sliznice ústnej dutiny (ligneózna periodontitída), gastrointestinálneho traktu (duodenálne vredy), dýchacích ciest (pseudomembranózna laryngitída, bronchitída a pneumónia) a ženských pohlavných orgánov (zápaly pošvy, cervixu, maternice vajíčkovodov a vaječníkov). Vzácne býva postihnutý centrálny nervový systém (obštrukčný hydrocefalus, Dandy-Walkerova malformácia). Patomechanizmus nie je presne objasnený, ale špekuluje sa, že depozície fibrínu v komorovom systéme môžu spôsobiť poruchu cirkulácie likvoru v oblasti akveduktu [7]. V svetovom písomníctve bolo doteraz publikovaných menej ako 20 prípadov detí s hydrocefalom asociovaným s kongenitálnym deficitom plazminogénu. Títo jedinci majú podstatne častejšie pooperačné komplikácie a malfunkciu ventrikuloperitoneálnej drenáže v dôsledku porušenej absorpčnej schopnosti peritonea, preto si vyžadujú osobitný manažment [8]. Nemeckí autori opisujú vzácne kazuistiky dvoch detí s početnými výmenami VP drenáže a trombózami katétra ventrikuloatriálneho shuntu. Korekciu hydrocefalu dosiahli až vytvorením ventrikulocholecystického shuntu, ktorý odporúčajú na včasné neurochirurgické riešenie hydrocefalu u detí s kongenitálnym deficitom plazminogénu. Aj u nášho pacienta došlo krátko po zavedení ventrikuloperitoneálneho shuntu k jeho zlyhaniu, a neskôr sa stav ešte skomplikoval ventrikulitídami a ďalšími obštrukciami drenáže.
Natívny plazminogén sa syntetizuje hlavne v pečeni, a to v dvoch formách – ako Glu - a Lys-plazminogén. Glu-plazminogén má na svojom N-terminálnom konci kyselinu glutámovú a jeho polčas rozpadu je 2,2 dňa. Alternatívny Lys-plazminogén, ktorý na N-terminálnom konci obsahuje reziduum lyzínu, sa nachádza v cirkulácii v oveľa nižšej koncentrácii ako Glu-plazminogén a má tiež kratší polčas rozpadu – 0,8 dňa [9]. Obe formy plazminogénu sa môžu použiť ako náhrada pri jeho deficite. Plazminogén cirkuluje v krvi a jeho aktivátory – tPA (tkanivový aktivátor plazminogénu) a uPA (aktivátor plazminogénu typu urokinázy) ho konvertujú na plazmín, ktorý je dôležitý fibrinolytický enzým. Väčšie množstvo plazmínu sa nachádza tiež v extracelulárnej matrix. Hoci plazmín má dobre definované miesto v hemostáze, má aj ďalšie homeostatické funkcie v organizme, vrátane dôležitej úlohy pri hojení rán. Po poškodení tkanivových buniek dochádza k tvorbe extracelulárnej matrix bohatej na fibrín, pri degradácii ktorého plní dôležitú úlohu plazmín. Plazmín priamo rozkladá fibrín a iné glykoproteíny, aktivuje viaceré metaloproteinázy extracelulárnej matrix a stimuluje uvoľňovanie TGFβ [10].
Pacienti s deficitom plazminogénu majú oslabenú schopnosť hojenia rán, čo sa najviac prejaví na slizničných membránach s nedostatočnou proteolytickou kapacitou, typicky na spojovkách oka. U zdravých jedincov sa aktivátory plazminogénu uvoľňujú z rohovky do sĺz [11], štiepia plazminogén na plazmín, ktorý rýchlo čistí rohovku a bráni ukladaniu fibrínu. Tento očisťovací mechanizmus oka u pacientov s deficitom plazminogénu chýba, čo vyvoláva tvorbu na fibrín bohatých membrán. Potvrdzujú to aj experimentálne výskumy u myší s vyradeným génom pre plazminogén, u ktorých sa vyvinula ligneózna konjunktivitída podobná ako u ľudí [12]. Z patofyziologického hľadiska je zaujímavé, že ani ťažká hypoplazminogenémia nemusí predstavovať rizikový faktor pre trombofíliu a intravaskulárnu trombózu [13]. To naznačuje prítomnosť alternatívneho systému pre rozpustenie intravaskulárneho fibrínu, ktorý nie je aktívny v extracelulárnom kompartmente [7].
Diagnóza kongenitálnej hypoplazminogenémie sa opiera o typické klinické prejavy a laboratórny dôkaz kvantitatívnej, resp. kvalitatívnej poruchy aktivity PLG (norma 75–150 %). Diagnózu definitívne potvrdí analýza génu pre PLG, avšak molekulárna genetika nie je bežne dostupná. Prenatálna diagnostika je možná v rodinách s už známou a dokázanou mutáciou PLG génu.
Liečba sa zameriava najmä na terapiu ligneóznej konjunktivitídy. Prvá správa o troch deťoch úspešne liečených plazminogénom v očných kvapkách bola publikovaná v roku 2002 [14]. A hoci „plazminogénové“ kvapky sú schválené európskou komisiou od augusta 2007, dostupnosť tohto „orphan drug“ produktu je stále obmedzená. Medzi iné skúšané liečebné postupy patrí čerstvo zmrazená plazma, štandardný heparín v kombinácii s lokálnymi kortikosteroidmi alebo alfa-chymotrypsínom, a lokálne (alebo systémové) imunosupresíva (cyklosporín A, azatioprin). Klinické výsledky opakovaného chirurgického odstránenia pseudomembrán, ev. iných typov mechanickej manipulácie sú rozporné. Týmto postupom sa však odporúča vyhnúť, lebo hrozí riziko vážneho poškodenia rohovky až slepoty v dôsledku zjazvenia, vaskularizácie, keratomalácie a perforácie [15]. Navyše, znesenie pseudomembrán prinesie len krátkodobý efekt. Demonštruje to aj kazuistika nášho pacienta. Po chirurgickom odstránení pablán došlo v priebehu niekoľkých dní k rapídnej “de novo” tvorbe pseudomembrán, ktoré opätovne prekrývali obidve spojovky očí. Lepšie výsledky sa pozorovali pri dlhodobej substitúcii čerstvo zmrazenej plazmy pred a po chirurgickom stiahnutí pablán [16, 17]. Aj anekdotálne údaje so skúšaním hormonálnej liečby (levonorgestrel, etinylestradiol, vysoké dávky kortikosteroidov) priniesli len čiastočné úspechy [15].
U pacientov so systémovým multiorgánovým postihnutím by kauzálnou terapiou mohla byť náhrada plazminogénu. Dokumentuje to dlhodobá niekoľkomesačná substitúcia lys-plazminogénu, ktorá viedla k regresii ligneóznej konjunktivitídy, k úprave hyperviskóznej sekrécie z dýchacích ciest a lepšiemu hojeniu rán [7]. Limitáciou je však potreba opakovaných infúzií plazminogénu pre jeho krátky polčas rozpadu. Ďalším obmedzením je technická náročnosť, pre ktorú sa purifikovaný plazminogénový koncentrát prestal vyrábať. Preto je dnes liečba týchto chorých len symptomatická.
Záver
Závažný kvantitatívny deficit plazminogénu (typ I) je veľmi vzácne ochorenie. Najtypickejším klinickým prejavom je ligneózna konjunktivitída, ako to bolo aj u nášho pacienta. Podstatou choroby je nedostatočná degradácia fibrínu s jeho nadmernou tvorbou a následnou poruchou hojenia rán.
Genetická diagnostika a liečba je vzhľadom na zriedkavosť prípadov značne obmedzená. Perspektívnou modalitou je lokálna liečba ligneóznej konjunktivitídy očnými kvapkami s obsahom ľudského plazminogénu. Pri systémovom postihnutí môže byť účinná intravenózna substitúcia ľudského plazminogénu, ale tá v súčasnosti nie je v klinickej praxi dostupná.
Došlo: 30. 7. 2011
Přijato: 31. 8. 2011
Prof. MUDr. Ľudmila Podracká, CSc.
1. Klinika derí a dorastu UPJŠ LF a DFN
Tr. SNP 1
040 66 Košice
Slovenská republika
e-mail: ludmila.podracka@upjs.sk
Zdroje
1. Dykes D, Polesky H. Incindence of the PLG *Q0 allele in human populations. In: Mayr W, ed. Advanced in Forensic Haemogenetics. Berlin: Springer, 1988 : 261–264.
2. Weidinger S, PatutschnickW, Schwarzfischer F. Further evidence of a silent plasminogen (PLG) allele in two paternity cases. Z Rechtsmed 1988; 101 : 99–104.
3. Tait RC, Walker ID, Conkie JA, et al. Isolated familial plasminogen deficiency may not be a risk factor for thrombosis. Thromb Haemost 1996; 76 : 1004–1008.
4. Okamoto A, Sakata T, Mannami T, et al. Population-based distribution of plasminogen activity and estimated prevalence and relevance to thrombotic diseases of plasminogen deficiency in the Japanese: the Suita Study. J Thromb Haemost 2003; 1 : 2397–2403.
5. http://www.orpha.net/orphacom/cahiers/docs/GB/Prevalence_of_rare_diseases_by_alphabetical_list.pdf.
6. Thachil J, Reeves G, Kaye S. Ligneous conjunctivitis with plasminogen deficiency. Br J Haematol. 2009 May; 145(3): 269.
7. Schott D, Dempfle CE, Beck P, et al. Therapy with a purified plasminogen concentrate in an infant with ligneous conjunctivitis and homozygous plasminogen deficiency. Engl J Med 1998; 339(23): 1679–1689.
8. Weinzierl MR, Collmann H, Korinth MC, et al. Management of hydrocephalus in children with plasminogen deficiency. Eur J Pediatr Surg 2007 Apr; 17(2): 124–128.
9. Mehta R, Shapiro AD. Plasminogen deficiency. Haemophilia 2008; 14 : 1261–1268.
10. Booth NA, Bachmann F. Plasminogen-plasmin system. In: Coleman RW, Marder VJ, Clowes AW, et al. Hemostasis and Thrombosis: Basic Principles and Clinical Practice. Philadelphia: Lippincott Williams & Wilkins, 2006 : 335–364.
11. Mirshahi S, Soria J, Nelles L, Soria C, Faure JP, Pouliguen Y, Mirshahi M. Plasminogen activators in human corneal fibroblasts: secretion, cellular localization, and regulation. Fibrinolysis 1996; 10 : 255–262.
12. Ploplis VA, Carmeliet P, Vazirzadeh S, et al. Effects of disruption of the plasminogen gene on thrombosis, growth, and health in mice. Circulation 1995; 92 : 2585–2593.
13. Shigekiyo T, Uno Y, Tomonari A, et al. Type I congenital plasminogen deficiency is not a risk factor for thrombosis. Thromb Haemost 1992; 67 : 189–192.
14. Watts P, Suresh P, Mezer E, et al. Effective treatment of ligneous conjunctivitis with topical plasminogen. Am J Ophthalmol 2002; 133 : 451–455.
15. Schuster V, Hügle B, Tefs K. Plasminogen deficiency. J Thromb Haemost 2007; 5 : 2315–2322.
16. Lee WB, Himmel K. Fresh froyen plasma treatment of ligneous conjunctivitis: use of heparin and allogenic serum. Cornea 2009 Jan; 28(1): 122–123.
17. Gurlu VP, Demir M, Alimgil ML, et al. Systemic and topical fresh-frozen plasma treatment in a newborn with ligneous conjunctivitis. Cornea 2008 May; 27(4): 501–503.
18. Scully C, Allen C, Erseven G, et al. Oral lesions indicative of plasminogen deficiency (hypoplasminogenemia). Oral Surg Oral Med Oral Pathol 2001; 91 : 334–337.
19. Tefs K, Gueorguieva M, Klammt J, et al. Molecular and clinical spectrum of type I plasminogen deficiency: a series of 50 patients. Blood 2006; 108 : 3021–3026.
20. Suzuki T, Ikewaki J, Iwata H, et al. The first two Japanese cases of severe type I congenital plasminogen deficiency with ligneous conjunctivitis: Succesful treatment with direct thrombin inhibitor and fresh plasma. Am J Hematol 2009; 84 : 363–365.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Parenterální výživa
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2012 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Vliv matrixových metaloproteináz na hojení ran po operaci vrozeného rozštěpu rtu
- Koncentrácia olova v krvi a alergénová senzibilizácia detí predškolského veku v dvoch regiónoch Slovenska
- Thymidin kináza – vhodný marker pro diagnostiku a sledování leukémií dětského věku
- Nárast polinózy u školskej mládeže v meste a na vidieku za posledných 20 rokov (1988–2009)
- Prevalence a typ anémie v době stanovení diagnózy nespecifického střevního zánětu u dětí
- Mikrodeleční syndrom Xp21: Závažná příčina selhání nadledvin, svalové dystrofie, poruchy hladin krevních lipidů a vývojové retardace u dvouměsíčního neprospívajícího kojence
- Ostravský den preventivní pediatrie 16. března 2012, Ostrava (Clarion Congress Hotel)
- Ligneózna konjunktivitída, hydrocefalus a protrahované respiračné infekcie u pacienta s deficitom plazminogénu
- Cmúľanie prstov a jeho vplyv na vývoj tváre a dutiny ústnej v detskom veku
- Ovlivnění bolesti při stomatologickém ošetření dětí
- Parenterální výživa
- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Perspektiva dětské lůžkové péče v České republice v roce 2011
- Zkušenosti s dlouhodobou neakutní péčí o dítě s postižením ve Strančicích
- Nedožitých 89 rokov profesora Birčáka
- XVII. Moravskoslezské pediatrické dny s mezinárodní účastí
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Parenterální výživa
- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Ovlivnění bolesti při stomatologickém ošetření dětí
- Cmúľanie prstov a jeho vplyv na vývoj tváre a dutiny ústnej v detskom veku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



