-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKoncentrácia olova v krvi a alergénová senzibilizácia detí predškolského veku v dvoch regiónoch Slovenska
The concentration of lead in blood and allergic sensitization in children of pre-school age from two regions of Slovakia
Aim:
To evaluate the association between the exposure to lead (Pb) and presence of specific antibodies (sIgE) against the most common inhalant and food allergens in children from Bratislava and Stara Lubovna.Methodology:
Within the APVT project „Prenatal/postnatal exposure to xenobiotics and development of allergic diseases in early childhood“, 2005–2008, children were annually examined by the allergist, sample of child venous blood was taken and the questionnaire was completed by mother of a child. The concentrations of lead in blood were measured using atomic absoption spectrometry in 4-years old children and the levels of specific antibodies against the most common food (fx5) and inhalant allergens (Phadiatop) were determined using UniCAP®Specific IgE Fluoroenzymeimmunoassay method, RAST FEIA in 5-years old children.Results:
The concentration of blood Pb in children was within the range of 10,88–65,23 µg/l. Higher Pb concentrations were found in children from Stara Lubovna (24,47 µg/l), if compared to Bratislava (22,79 µg/l), although the difference was not statistically significant. In Bratislava, children had significantly higher prevalence of positive levels of sIgE against inhalant allergens, if compared to Stara Lubovna (18.3% vs. 6.7%; OR 3.143 (95% CI: 1.09–9.03)). There were no differences in sensitization against food allergens between the two regions.Conclusion:
We did not find a significant relationship between blood Pb concentrations in children and sensitization to the most common inhalant and food allergens, although there was a trend towards higher Pb concentrations in children with positive specific antibodies against inhalant and food allergens.Key words:
pre-schoolaged children, Bratislava, Stara Lubovna, exposure to lead, sensitization against inhalant and food allergens
Autoři: Babjaková J.1 ,2; Ľ. Palkovičová 2; H. Patayová 2; K. Rausová 2; S. Wimmerová 3
; M. Ursínyová 4; Z. Hušeková 4; P. Čižnár 5
Působiště autorů: Ústav hygieny, Lekárska fakulta Univerzity Komenského, Bratislava, prednosta prof. MUDr. Ľ. Ševčíková, CSc., Oddelenie environmentálnej medicíny, Fakulta verejného zdravotníctva Slovenskej zdravotníckej univerzity, Bratislava , vedúca MUDr. Ľ. Palk 1
Vyšlo v časopise: Čes-slov Pediat 2012; 67 (1): 15-22.
Kategorie: Původní práce
Souhrn
Účel štúdie:
Zistiť vzťah medzi expozíciou olovu (Pb) a prítomnosťou špecifických IgE (šIgE) proti najčastejším inhalačným a potravinovým alergénom u detí z Bratislavy a zo Starej Ľubovne.Metódy:
V rámci APVT projektu „Prenatálna/postnatálna expozícia xenobiotikám a vývoj alergických ochorení u detí v predškolskom veku“, ktorý prebiehal v rokoch 2005–2008, boli deti každoročne vyšetrené alergológom s následným odberom vzorky venóznej krvi a vyplnením dotazníka. U 4-ročných detí boli stanovené koncentrácie Pb v krvi metódou atómovej absorpčnej spektrometrie a u 5-ročných detí stanovené hladiny špecifických protilátok proti najčastejším potravinovým (fx5) a inhalačným alergénom (Phadiatop) použitím UniCAP®Specific IgE Fluoroenzymeimmunoassay, RAST FEIA.Výsledky:
Koncentrácie Pb v krvi detí boli v rozsahu 10,88–65,23 µg/l. Vyššie priemerné koncentrácie Pb sme zistili v krvi detí zo Starej Ľubovne (24,47 µg/l) v porovnaní s Bratislavou (22,79 µg/l), bez štatistickej významnosti. V Bratislave sme zistili významne vyšší podiel detí senzibilizovaných proti inhalačným alergénom v porovnaní so Starou Ľubovňou (18,3 % vs. 6,7 %; OR 3,143 (95% CI: 1,09–9,03)). Medzi regiónmi nebol štatisticky významný rozdiel v senizibilizácii detí proti potravinovým alergénom.Záver:
Nezistili sme štatisticky významný vzťah medzi expozíciou Pb a senzibilizáciou proti najčastejším inhalačným a potravinovým alergénom, no u detí, ktoré mali pozitívne špecifické protilátky proti inhalačným aj potravinovým alergénom, sme zistili viac hodnôt nad mediánom koncentrácií Pb (22,91 µg/l), ako u nesenzibilizovaných detí (Phadiatop: 58,8 % vs. 41,2 %; Fx5 : 63,6 % vs. 36,4 %).Kľúčové slová:
deti v predškolskom veku, Bratislava, Stará Ľubovňa, expozícia olovu, senzibilizácia proti potravinovým a inhalačným alergénomÚVOD
Znečistenie životného prostredia má preukázateľne škodlivé účinky na ľudské zdravie [1, 2, 3]. Environmentálne faktory predstavujú rôzne faktory prostredia, ktoré buď môžu priamo spustiť alergickú reakciu vyúsťujúcu do alergického ochorenia, alebo môžu podporiť jeho vznik [4, 5, 6].
Pre detskú populáciu, v porovnaní s dospelými jedincami, predstavuje znečistenie životného prostredia výraznejšie zdravotné riziko z mnohých dôvodov. Deti trávia vonku viac času, pričom sú väčšinou fyzicky aktívne pri hrách a športe (teda pri aktivitách spojených so zvýšenou ventiláciou), vdychujú väčší objem vzduchu na jednotku telesnej hmotnosti (t.j. majú vyšší príjem dávky škodliviny na 1 kg hmotnosti), detský imunitný a dýchací systém sú stále vo vývoji a dieťa má odlišné cesty absorpcie a tkanivovej distribúcie. Navyše, biotransformačná a eliminačná schopnosť detského organizmu je rozdielna v závislosti od veku, taktiež je prítomná fyziologická nezrelosť homeostatických a detoxikačných mechanizmov, dýchajú viac ústami ako nosom a následne sa xenobiotiká môžu dostať hlbšie do dýchacích ciest, a tým zhoršujú a spomaľujú samočistenie dýchacích ciest [7, 8, 9].
Atopia (atopická forma alergie) je definovaná podľa EAACI (European Academy of Allergy and Clinical Immunology) ako „...sklon produkovať IgE protilátky ako odpoveď na nízke dávky alergénov, zvyčajne proteínov...“. Všeobecne sa akceptuje polygénový charakter dedičnosti s rôznou penetranciou génov. V súčasnosti pribúda údajov o úlohe epigenetiky a o epigeneticky podmienenej aktivácii génov pri vzniku atopie [10].
Expozícia olovu patrí medzi početné environmentálne rizikové faktory zvažované v súvislosti s atopiou [11]. Olovo (Pb) patrí medzi kumulatívne toxické kovy, ktoré sú všadeprítomné v životnom prostredí a pochádzajú z prírodných aj antropogénnych zdrojov. Ľudská populácia sa s nimi do kontaktu dostáva prostredníctvom potravy, vody a vzduchom – inhaláciou aj ingesciou [12]. Olovo sa po vstupe do organizmu respiračným alebo gastrointestinálnym traktom krvou (nasledujúc distribúciu kalcia) distribuuje do orgánov a tkanív (obličky, pečeň, mozog, slezina, svaly, srdce) a po niekoľkých týždňoch sa deponuje do kostí a zubov, odkiaľ sa môže uvoľňovať [13]. Absorpcia Pb do organizmu je ovplyvnená mnohými faktormi, napr. zložením stravy, množstvom prijímaných antagonistov kalcia a železa, veľkosťou častíc polietavého prachu, pričom vyššia absorpcia tohto toxického kovu bola zistená u detí v porovnaní s dospelými (50 % vs. 5–10 %). Exkrécia olova z organizmu je pomalá a dlhodobá, 75–80 % vstrebaného olova sa vylučuje močom, menej zažívacím traktom [14].
Limitná hladina Pb v krvi, ktorá môže spôsobovať patologickú odpoveď ľudského organizmu, sa v minulosti mnohokrát zmenila. Centrum pre kontrolu a prevenciu chorôb v USA (CDC – Centers for Diseases Control and Prevention) [15] a Svetová zdravotnícka organizácia (WHO) [16] stanovili koncentráciu olova 10 μg/dl ako hodnotu, od ktorej je doporučený častejší skríning detí (tzv. action level). Avšak v posledných rokoch prevláda názor, že neexistuje tzv. „bezpečná“ hladina Pb v krvi, teda neexistuje hladina, ktorá nemá negatívny vplyv na zdravie [17, 18, 19]. Vplyv účinku Pb na zdravie človeka je zdokumentovaný na rôznych úrovniach poškodenia ľudských tkanív, orgánov a systémov [14, 20, 21, 22].
Pomerne málo sa vie o účinkoch Pb na vyvíjajúci sa imunitný systém. K extrapolácii údajov zo štúdií na zvieratách na človeka je potrebné pristupovať opatrne, vzhľadom k rôznorodosti imunologických funkcií a tiež rozdielnej citlivosti voči imunotoxicite Pb v závislosti od zvieracieho druhu a pohlavia [13, 23]. Snyder a kol. zaznamenali u novonarodených myší exponovaných transplacentárne alebo počas laktácie olovu výrazne vyššie koncentrácie IgE v sére ako u neexponovanej skupiny [24]. Expozícia Pb u ľudí pravdepodobne ovplyvňuje bunkové komponenty imunity, zatiaľ čo vplyv na humorálnu zložku imunity je menej významný [13]. Informácie o pôsobení olova na imunitný systém u detí sú obmedzené.
Existuje individuálna variabilita v náchylnosti jedinca na poškodenie organizmu vplyvom olova, ktorá závisí od toxikokinetických a toxikodynamických charakteristík jedinca, od polymorfizmu génov zodpovedných za metabolizmus xenobiotík, a súvisí aj s odlišnosťami medzi pohlaviami, a v neposlednej miere so spolupôsobením ďalších látok zo životného prostredia [19].
Nakoľko v posledných desaťročiach došlo k vzostupu atopických ochorení a na ich multifaktoriálnej etiopatogenéze sa podieľajú aj faktory životného prostredia, vrátane jeho znečistenia, v našej práci sme sa zamerali na zhodnotenie vzťahu medzi expozíciou olovu zo životného prostredia a alergénovou senzibilizáciou detí predškolského veku.
METÓDY
V rokoch 2005–2008 na Slovensku prebiehal projekt „Prenatálna/postnatálna expozícia xenobiotikám a vývoj alergických ochorení u detí v predškolskom veku“ (č. APVT-21-016504), ktorý bol zameraný na objasnenie spolupôsobenia environmentálnych faktorov, predovšetkým prenatálnej/ /postnatálnej expozície vybraným organochlórovaným zlúčeninám, toxickým kovom a respirabilným časticiam v ovzduší a genetických faktorov na vznik a manifestáciu alergických ochorení u detí v predškolskom veku. Na základe rozdielov v environmentálnej charakteristike regiónov boli do projektu vybrané regióny Bratislava a Stará Ľubovňa, ktoré sa líšia rozsahom urbanizácie, rozsahom priemyselnej aktivity, ale aj socio-ekonomickými charakteristikami. Projekt nadviazal na medzinárodný EÚ projekt Plutocracy (č. QLK4-CT-2000-00279), ktorý sledoval matky a ich deti do 2 rokov veku.
Pokračujúca kohorta detí vo veku 3, 4 a 5 rokov bola v oboch regiónoch opakovane vyšetrená v alergologickej ambulancii miestnym alergológom, pričom súčasťou vyšetrenia bolo vyplnenie klinického dotazníka lekárom a odber vzorky venóznej krvi dieťaťa. Zároveň spolu s matkou lekár overil a doplnil všeobecný dotazník, ktorý bol rodičom zaslaný poštou. Všeobecný dotazník bol zameraný na údaje týkajúce sa vývoja dieťaťa, jeho zdravotný stav, stravovanie, alergologickú anamnézu, charakteristiku domácnosti a expozíciu fajčeniu.
Hladiny špecifických protilátok (šIgE) proti najčastejším potravinovým alergénom (fx5) a najbežnejším inhalačným alergénom (Phadiatop) boli stanovené metódou UniCAP®Specific IgE Fluoroenzymeimmunoassay, RAST FEIA (Pharmacia Diagnostics AB, Uppsala, Sweden) v Laboratóriu environmentálnej imunológie na Oddelení environmentálnej medicíny SZU. Alergénová senzibilizácia (pozitivita šIgE) bola definovaná ako koncentrácia protilátok ≥0,35 kU/L (radioalergosorbentový test RAST, trieda ≥I).
Koncentrácie Pb v krvi boli stanovené metódou elektrotermickej atómovej absorpčnej spektrometrie (AAS) v Laboratóriu toxických a esenciálnych prvkov na Oddelení environmentálnej medicíny SZU. Metóda bola validovaná certifikovaným referenčným materiálom Seronorm TM Trace Elements Whole Blood – Level 1 a Level 2, Nycomed, Norway [12].
Pre potreby tejto štúdie sme spracovali dáta zo všeobecných dotazníkov a stanovili sme špecifické protilátky proti najčastejším inhalačným a potravinovým alergénom u 5-ročných detí (n = 161). Vzhľadom na skutočnosť, že projekt, z ktorého sme vychádzali, bol rozsiahly a zahŕňal každoročne aj ďalšie odbery krvi detí na iné analýzy, kvantitatívne stanovenie olova v krvi detí bolo realizované v 4. roku života detí (n = 167). Medzi 4.–5. rokom sa u detí stravovacie návyky ani spôsoby správania výrazne nemenia a rovnako nedošlo k výraznejšej zmene kvality prostredia v regiónoch a tak sme predpokladali, že expozícia detí olovu a teda aj koncentrácia olova v krvi detí bola v oboch rokoch porovnateľná.
Pri štatistickom hodnotení výsledkov sme použili Kolmogorov-Smirnov test a Sharpiro-Wilksov test na hodnotenie normality rozloženia dát, pre zistenie vzťahov medzi kvalitatívnymi premennými chí-kvadrátový test v kontingenčných tabuľkách, v prípade malých čísel sme použili Fisherov exaktný test. Pre zistenie vzťahu medzi kvantitatívnymi premennými sme použili neparametrický Mann-Whitneyho test – všetky testy na hladine významnosti α = 0,05, s použitím softvéru SPSS, verzia 16.
VÝSLEDKY
Celkovo u 150 detí sa stanovili koncentrácie olova v krvi a súčasne aj hladiny špecifických IgE proti inhalačným a potravinovým alergénom (Bratislava n = 60, Stará Ľubovňa n = 90). V súbore bolo 82 dievčat a 68 chlapcov, z toho v Bratislave 32 (53,3 %) dievčat a 28 (46,7 %) chlapcov, v Starej Ľubovni 50 (55,6 %) dievčat a 40 (44,4 %) chlapcov. Nezistili sme rozdiel v zastúpení pohlavia, ani v hmotnosti a výške detí medzi oboma regiónmi. Priemerný vek matiek pri pôrode daného dieťaťa bol 28 rokov v oboch regiónoch (tab. 1).
Tab. 1. Charakteristika kohorty detí v Bratislave (BA) a Starej Ľubovni (SĽ) – hmotnosť a výška detí, vek matky. 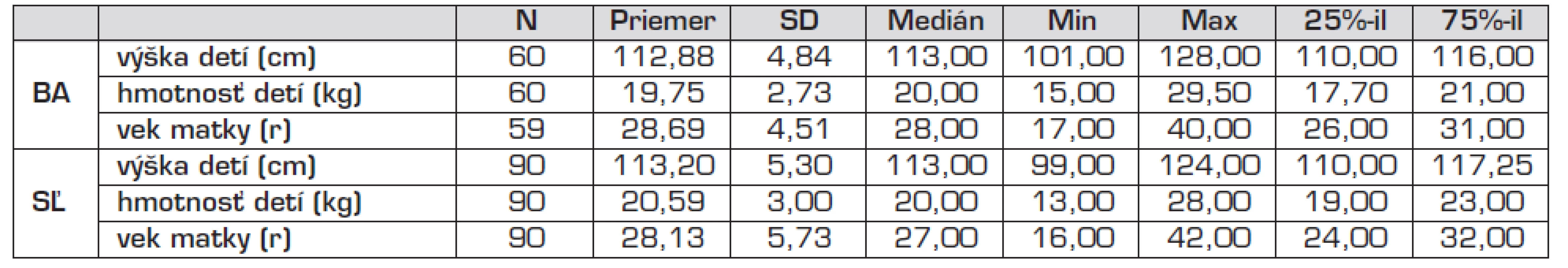
V Bratislave malo viac matiek vysokoškolské vzdelanie ako v Starej Ľubovni (55 % vs. 13,3 %), naopak matky so základným a stredoškolským vzdelaním bez maturity žili častejšie v Starej Ľubovni (p <0,001). V Bratislave 33,3 % matiek dojčilo svoje deti viac ako pol roka (7–12 mesiacov), 37,2 % dokonca dlhšie ako rok; v Starej Ľubovni dojčilo deti 7–12 mesiacov len 14,8 % matiek. Nezistili sme rozdiel v počte osôb fajčiacich v spoločnej domácnosti medzi regiónmi. Deti v Bratislave bývali prevažne v byte, častejšie pri rušnej komunikácii (t.j. do vzdialenosti 100 metrov od cesty, po ktorej prejde viac ako 20 vozidiel za hodinu) a častejšie chovali domáce zviera v byte (34,5 % vs. 11,1 %) v porovnaní s deťmi zo Starej Ľubovne (p <0,001; p = 0,018; p <0,001).
V Bratislave bol vyšší počet detí s pozitívnou rodinnou anamnézou alergie (aspoň jedna pozitívna odpoveď o prítomnosti lekárom potvrdeného alergického ochorenia u rodičov) v porovnaní so Starou Ľubovňou (62,1 % vs. 48,9 %). Deti v našom súbore prekonali za posledných 12 mesiacov v piatom roku života priemerne 3 akútne infekcie dýchacích ciest, bez výrazného rozdielu medzi regiónmi. U detí v Starej Ľubovni sme zistili častejšie užívanie ATB za posledný rok (p <0,001; tab. 2). Priemerný počet užívaní ATB v Bratislave bol 1krát/rok, v Starej Ľubovni 2krát/rok.
Tab. 2. Charakteristika vybraných rizikových/ochranných faktorov v kohorte detí. 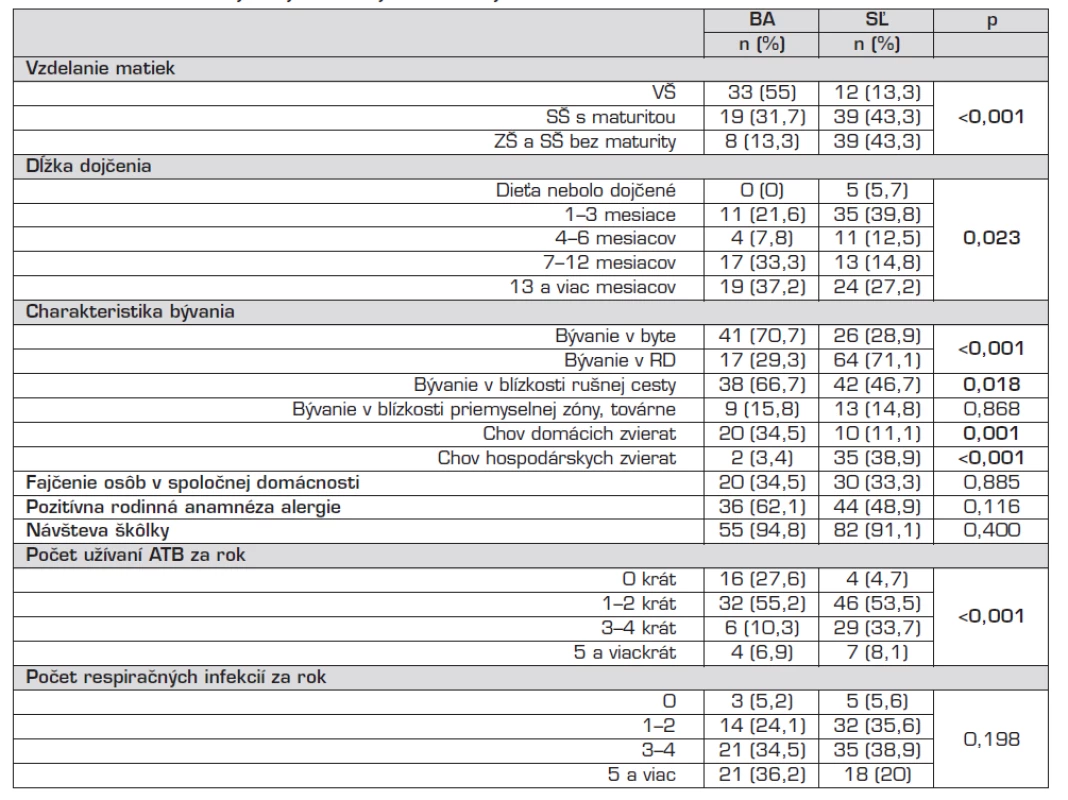
Koncentrácie Pb v krvi detí sa pohybovali v rozpätí 10,88–296,11 μg/l, medián koncentrácií Pb bol 22,951 μg/l (tab. 3). Po vyradení jednej neobvykle vysokej a opakovane nameranej hodnoty v regióne Stará Ľubovňa (296,11 μg/l) boli hodnoty minimálnej a maximálnej koncentrácie Pb v krvi detí v rozsahu 10,88–65,23 μg/l.
Tab. 3. Koncentrácie olova (Pb) v krvi 4-ročných detí [μg/l]. ![Koncentrácie olova (Pb) v krvi 4-ročných detí [μg/l].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/14aad75a211739db593c3fd442b55ecc.png)
Napriek tomu, že základná charakteristika oboch regiónov bola výrazne odlišná („čistý“ vs. priemyselný región), mierne vyššie koncentrácie Pb sme zistili v krvi detí zo Starej Ľubovne v porovnaní s Bratislavou, ale bez štatistickej významnosti (priemerné koncentrácie olova v krvi detí z Bratislavy boli 22,79 μg/l vs. Stará Ľubovňa 24,47 μg/l).
Rozdiel v koncentrácii Pb v krvi medzi dievčatami a chlapcami nebol štatisticky významný. Koncentrácia Pb v krvi detí nebola ovplyvnená expozíciou tabakovému dymu, dĺžkou dojčenia dieťaťa, zvykom dieťaťa cmúľať si prsty, ani charakteristikou bydliska. Štatisticky významne vyššie hodnoty Pb sme zistili v krvi detí, ktoré bývali v rodinnom dome, v porovnaní s deťmi žijúcimi v byte (p = 0,026).
Celkový počet senzibilizovaných detí (detí s pozitívnymi šIgE) proti inhalačným alergénom bol 17 zo 150 (11,3 %) (tab. 4). V Bratislave sme zistili štatisticky významne vyšší podiel detí senzibilizovaných proti inhalačným alergénom v porovnaní so Starou Ľubovňou (18,3 % vs. 6,7 %; OR 3,143 (95% CI: 1,09–9,03); p = 0,027). Celkový počet senzibilizovaných detí proti potravinovým alergénom bol 11 (7,3 %) (Bratislava 8,3 % vs. Stará Ľubovňa 6,7 %), rozdiel medzi regiónmi sa nepotvrdil.
Tab. 4. Pozitivita špecifických IgE (šIgE) proti najčastejším potravinovým (Fx5) a inhalačným alergénom (Phadiatop) u 5-ročných detí. 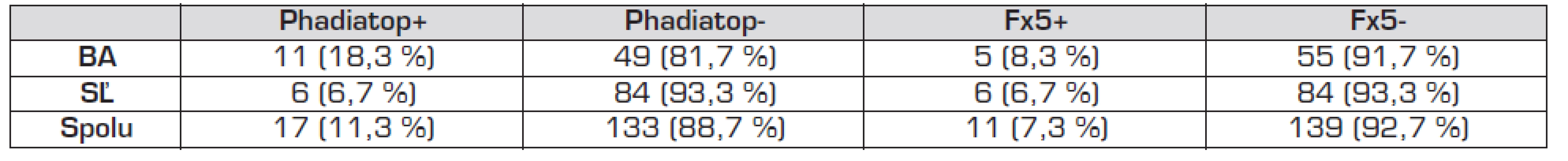
Phadiatop –špecifické IgE (šIgE) proti najčastejším inhalačným alergénom Fx5 –špecifické IgE (šIgE) proti najčastejším potravinovým alergénom V našom súbore sme nezistili významný vzťah medzi expozíciou detí Pb a prítomnosťou špecifických IgE proti najčastejším inhalačným alergénom v sére detí. Na druhej strane, u detí, ktoré boli senzibilizované proti inhalačným alergénom, sme zistili viac jedincov, u ktorých hodnoty Pb v krvi prekračovali zistené mediánové koncentrácie (22,91 μg/l), ako u detí bez alergénovej senzibilizácie (Phadiatop: 58,8 % vs. 41,2 %; graf 1).
Graf 1. Špecifická senzibilizácia voči inhalačným alergénom (Phadiatop) vo vzťahu k mediánu koncentrácií Pb v krvi detí (22,91 μg/l). 
Obdobne u detí senzibilizovaných proti najčastejším potravinovým alergénom bolo viac detí s hodnotami olova v krvi nad mediánom koncentrácií (63,6 %), v porovnaní s deťmi bez alergénovej senzibilizácie (36,4 %; graf 2).
Graf 2. Špecifická senzibilizácia voči potravinovým alergénom (Fx5) vo vzťahu k mediánu koncentrácií Pb v krvi detí (22,91 μg/l). 
DISKUSIA
Naše výsledky prinášajú poznatky o individuálnej expozícii olovu a alergénovej senzibilizácii detí predškolského veku žijúcich v dvoch regiónoch Slovenska s rozličným stupňom znečistenia prostredia. Pôvodný predpoklad, že dva regióny s rozdielnou kvalitou životného prostredia budú znamenať taktiež rozdielnu expozíciu olovu, sa nepotvrdil. Náznak vzťahu medzi plumbémiou a imunitnými parametrami sa objavil až po vytvorení nových súborov podľa koncentrácií olova v krvi detí (nad a pod mediánom).
Koncentrácie Pb v krvi u 4-ročných detí sa v našom súbore pohybovali v rozpätí 10,88–65,23 μg/l, medián koncentrácií Pb bol 22,91 μg/l, priemer 23,80 μg/l. Hodnota pre obsah Pb v krvi detí, od ktorej sa už odporúča skríning, je 100 μg/l, resp. 10 μg/dl [1, 15, 16], v našom súbore bola koncentrácia olova v krvi detí pod touto hraničnou úrovňou, s výnimkou jednej hodnoty. Viacerí autori však predpokladajú, že neexistuje koncentrácia olova v krvi detí, ktorá by nemala škodlivý efekt na ich zdravotný stav [17, 18].
V posledných rokoch došlo k viacerým pozitívnym zmenám vplývajúcim na zníženie expozície olova v životnom prostredí – používanie bezolovnatých benzínov a katalyzátorov vo vozidlách od r. 1992 a tiež sa realizovali rozsiahle rekonštrukcie odlučovacích zariadení v priemysle, došlo k zmene používaných surovín, resp. odstavili sa niektoré zastarané neefektívne priemyselné technológie, zmenilo sa aj geografické rozloženie kontaminácie [25, 26].
V Českej republike vykazuje koncentrácia v krvi dospelej a detskej populácie od roku 2001 významný zostupný trend. Podľa Černej a kol. (2009) medzi rokmi 2006 a 2008 došlo u 8–10-ročných detí k zníženiu strednej hodnoty o 9 μg/l [27]. Gump a kol. vo svojej štúdii zaznamenali priemernú koncentráciu Pb v krvi 9-ročných amerických detí 46,2 μg/l [28]. Centers for Diseases Control and Prevention CDC udáva v USA pokles geometrického priemeru koncentrácie olova v krvi 6–19-ročných detí zo 17 μg/l (v rokoch 1991–1994) na 11 μg/l (v rokoch 1999–2002) [29]. Link a kol. uvádzajú v Nemecku koncentráciu Pb v krvi 10-ročných detí 20,7 μg/l (medián), 0,5 % detí malo koncentráciu olova v krvi nad 100 μg/l [10]. Hladíková a kol. zistili v rokoch 1994–1996 v súbore 9 až 10-ročných detí z rôznych oblastí Slovenska priemernú koncentráciu Pb 39 μg/l, medián 34,1 μg/l, pričom koncentrácie Pb v krvi boli nižšie u dievčat (34,7 μg/l) ako u chlapcov (42,9 μg/l) a zároveň vyššie koncentrácie Pb v krvi mali deti žijúce v domácnostiach, kde používali na kúrenie uhlie, konzumovali zeleninu a ovocie prevažne z vlastných zdrojov a používali vodu zo studne [30]. V našej kohorte detí sme uvedené rozdiely nepotvrdili. Zistili sme vyššie hodnoty Pb v krvi detí, ktoré bývali v rodinnom dome. V súčasnosti sú zvýšenou expozíciou Pb ohrození hlavne obyvatelia žijúci v starých domoch, kde môžu byť ešte rozvody vody z olovených komponentov a na stenách nátery z práškových farieb (niektoré druhy obsahovali olovo), pričom olovo sa uvoľňuje najmä pri búraní starých domov nalakovaných farbami obsahujúcich olovo [31]. Toto by mohla byť jedna z príčin vyšších koncentrácií olova v krvi detí zo Starej Ľubovne. Ako ďalšia pravdepodobná príčina sa javí častejšie kúrenie uhlím v domácnostiach v Starej Ľubovni a rozdielne správanie sa detí vo vidieckom prostredí [32].
Všeobecne je akceptované zistenie, že u fajčiarov je hladina Pb v krvi vyššia ako u nefajčiarov [33]. My sme v našom súbore detí nezistili vplyv expozície tabakovému dymu na koncentráciu olova v krvi detí. Expozícia tabakovému dymu bola definovaná ako fajčenie matky, otca, alebo iného člena domácnosti.
U detí v predškolskom veku sú informácie o alergénovej senzibilizácii pomerne sporadické. Zistili sme rozdielnu mieru alergickej senzibilizácie detí v závislosti od bydliska v mestskom a vidieckom regióne, pričom viac detí senzibilizovaných voči inhalačným alergénom bolo v Bratislave, v porovnaní so Starou Ľubovňou. Tento rozdiel sme nepotvrdili pri senzibilizácii na potravinové alergény. Avšak pozitívne testy na alergiu (krvné testy, skin prick testy) odrážajú iba prítomnosť alergénovo špecifických IgE (t.j. senzibilizáciu), čo neznamená nevyhnutne klinicky manifestné alergické ochorenie [34]. Senzibilizácia je prítomná aj u časti klinicky zdravých jedincov, Hlavatá a kol. uvádzajú 26 % pozitívnych kožných testov u 5-ročných nealergikov [35].
Za diagnostické kritérium atopie sa považuje dôkaz senzibilizácie na ubikvitárne alergény v životnom prostredí (t.j. prítomnosť alergénovo špecifických protilátok). U 5-ročných detí sme zisťovali alergickú senzibilizáciu stanovením hladiny špecifických IgE protilátok proti najčastejším potravinovým (Fx5) a inhalačným alergénom (Phadiatop). Podľa zistení Link a kol. sa prevalencia atopickej senzibilizácie u viac ako 10 000 10-ročných detí z Nemecka pohybovala okolo 35 % počas rokov 1996–2003 [8]. V Bratislave sme v 5. roku života zistili významne vyšší podiel detí s alergickou senzibilizáciou proti inhalačným alergénom oproti Starej Ľubovni; v Bratislave malo pozitívne protilátky proti inhalačným alergénom 16,2 % detí, v Starej Ľubovni 7,4 % detí, v Bratislave malo pozitívne protilátky proti potravinovým alergénom 8,3 % detí, v Starej Ľubovni 6,7 % detí.
Všeobecne sa prevaha rizikových faktorov a absencia protektívnych faktorov počas prvých rokov života považujú za dôležité pri vzniku alergickej senzibilizácie a pri orgánovo-špecifickom zápalovom poškodení, ktoré predisponuje na ochorenia ako napr. astma [36, 37]. Deti v Starej Ľubovni mali viac starších súrodencov, vyšší počet členov rodiny, častejšie prichádzali do kontaktu s hospodárskymi zvieratami a viac sa pohybovali v maštali, čo sú všetko faktory s predpokladaným protektívnym účinkom voči vzniku atopie. Výsledok porovnania rodín detí z Bratislavy a Starej Ľubovne skôr hovorí v prospech „hygienickej hypotézy“ alergických ochorení; a aj my sme zaznamenali signifikantné rozdiely v životnom štýle sledovaných skupín detí.
V našej štúdii sme nezistili významný vzťah medzi koncentráciou Pb v krvi detí a prítomnosťou špecifických IgE u detí, aj keď u súboru detí z oboch regiónov senzibilizovaných proti inhalačným aj potravinovým alergénom sme zistili vyšší výskyt hodnôt nad mediánom koncentrácií Pb v porovnaní s deťmi bez alergickej senzibilizácie.
Účinok olova na imunitný systém preukázali viaceré štúdie; išlo hlavne o zmeny hladín imunoglobulínov IgA, IgM a IgE a zmeny počtu B lymfocytov po expozícii olovu [38, 39, 40, 41, 43]. Reigart a Graher nezistili rozdiel v hladine imunoglobulínov IgM, IgG, IgA medzi deťmi s odlišnými koncentráciami olova v krvi [38]. Lutz a kol. a Karmaus a kol. naopak zistili, že hladiny celkového IgE pozitívne korelovali so zvýšenými koncentráciami Pb v krvi detí [39, 40]. V štúdii Lutz a kol. boli zahrnuté 9-mesačné až 6-ročné deti z mestskej oblasti v Missouri v USA a koncentrácia olova v ich krvi sa pohybovala v rozpätí 10–450 μg/l [39]. Podľa Karmausa a kol. v skupine detí s koncentráciami Pb v krvi nad 28 μg/l boli zistené vyššie hladiny IgE ako u skupiny s nižšími koncentráciami [39]. U 3–6-ročných čínskych detí Sun a kol. nezaznamenali významný vzťah medzi hladinami protilátok a koncentráciami olova v krvi detí. Avšak keď kohortu rozdelili podľa pohlavia, u dievčat boli protilátky IgM a IgG významne nižšie a IgE boli významne vyššie pri vyšších koncentráciách Pb v krvi, v porovnaní s chlapcami (nad 0,48 μmol/l, t.j. 99,3 μg/l) [41]. Annesi-Maesano potvrdili vzťah medzi koncentráciou Pb vo vlasoch detí a hladinami IgE v pupočníkovej krvi [42]. Tieto dáta naznačujú, že Pb by mohlo hrať úlohu v procese stimulácie tvorby IgE a takto sa spolupodieľať na vývoji alergických ochorení [40].
Naše výsledky túto hypotézu priamo nepodporujú, i keď sme zistili určitý trend k vyšším koncentráciám Pb u senzibilizovaných detí v našom súbore. Na druhej strane nie je však možné vylúčiť, že rozdielne hodnoty Pb v našom súbore senzibilizovaných detí môžu byť následkom rozdielneho modelu správania sa týchto detí, a teda sú len sprievodným javom bez priameho dopadu na senzibilizáciu detí.
ZÁVER
Napriek tomu, že sme nenašli štatisticky významný vzťah medzi expozíciou detí Pb a prítomnosťou špecifických IgE proti najčastejším inhalačným a potravinovým alergénom v sére 5-ročných detí, zistili sme u detí, ktoré mali pozitívne špecifické protilátky proti inhalačným aj potravinovým alergénom, viac prípadov, kedy sa stanovili koncentrácie Pb v krvi nad zistenou mediánovou hodnotou v porovnaní so sledovaným súborom nesenzibilizovaných detí.
Sme si vedomí obmedzení pri interpretácii výsledkov v dôsledku nízkeho počtu senzibilizovaných detí v našej štúdii, či nemožnosti stanovenia všetkých sledovaných parametrov v rovnakom čase.
Poďakovanie
Projekt Prenatálna/postnatálna expozícia xenobiotikám a vývoj alergických ochorení u detí v predškolskom veku bol finančne podporený grantom číslo APVT-21-016504 z Agentúry na podporu výskumu a vývoja a 5FP EÚ projektom PLUTOCRACY č. QLK4-CT-2000-00279. Naše poďakovanie patrí aj spolupracujúcim regionálnym alergológom z Bratislavy a Starej Ľubovne a ich zdravotníckemu personálu – MUDr. Anne Kovalíkovej, MUDr. Beate Slezákovej a pani Pavlíne Rinkovskej.
Došlo: 9. 6. 2011
Přijato: 25. 10. 2011
MUDr. Jana Babjaková, PhD.
Ústav hygieny
Lekárska fakulta Univerzity Komenského
Špitálska 24
813 72 Bratislava
Slovenská republika
e-mail: jana.babjakova@fmed.uniba.sk
Zdroje
1. WHO. Air quality guidelines for particulate matter, ozone, nitrogen dioxide and sulphur dioxide. Global update 2005. Summary of risk assessment. World Health Organization. Available: http://www. who.int/phe/air/aqg2006execsum.pdf [accessed 6 March 2007].
2. Smith KR, Corvalan CF, Kjellstrom T. How much global ill health is attributable to environmental factors? Epidemiology 1999; 10 : 573–584.
3. WHO. Almost a quarter of all disease caused by environmental exposure. Geneva: World Health Organization, 2006.
4. Ferenčík M, Rovenský J, Shoenfeld Y, et al. Imunitný systém – dobrý obranca, ale aj možný diverzant, Vydanie prvé. Bratislava: Slovac Academic Press, s.r.o., 2004 : 165–204.
5. Behrendt H. Environmental factors as determinants of allergy development. MMW Fortschr Med 2006; 148(29–30): 32–33.
6. Tanaka K, Miyake Y, Kiyohara C. Environmental factors and allergic disorders. Allergol Int 2007; 56(4): 363–396.
7. Dluholucký S. Životné prostredie a dieťa. Život Prostr 2002; 36 : 3.
8. Link B, Gabrio T, Piechotowski I, et al. Baden-Wuettemberg environmental health survey from 1996 to 2003: Toxic metals in blood and urine of children. Int J Hyg Environ Health 2007; 210 : 357–371.
9. Wigle DT, Arbuckle TE, Turner MC, et al. Epidemiologic evidence of relationships between reproductive and child health outcomes and environmental chemical contaminants. J Toxicol Environ Health B Crit Rev 2008; 11(5–6): 373–387.
10. North ML, Ellis AK. The role of epigenetics in the developmental origins of allergic disease. Ann Allergy Asthma Immunol 2011 May; 106(5): 355–361.
11. Hlavatá A, Čižnár P, Benedeková M. Environmentálne rizikové faktory atopie u detí. Čes-slov Pediat 2007; 62(12): 674–683.
12. Ursínyová M, Hladíková V. Stanovenie olova v krvi metódou AAS. Chem Listy 1995; 89 : 388–392.
13. Agency for Toxic Substances and Disease Registry (ATSDR) Available: http:// www.atsdr.cdc.gov/ [accessed 14 December 2010].
14. Stuchlíková H, Dvořák P, Remešová S, et al. Závažná intoxikácia olovom z keramické čajové konvice u desetileté dívky. Čes-slov Pediat 2006; 61(12): 692–696.
15. CDC. Preventing Lead Poisoning in Young Children U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control Publication date: 10/01/1991, Available: http://wonder.cdc.gov/wonder/prevguid/p0000029/p0000029.asp [accessed 14 November 2009].
16. WHO. Environmental Health Criteria 165—Inorganic Lead. Geneva: International Programme on Chemical Safety, World Health Organization, 1995.
17. Lanphear BP, Hornung R, Khoury J. Low-level environmental lead exposure and children´s intellectual function: An international pooled analysis. Environ Health Perspect 2005; 113 : 894–899.
18. Surkan PJ, Zhang A, Trachtenberg F. Neuropsychological function in children with blood lead levels <10 μg/dl. Neurotoxicology 2007; 28 (6):1170-1177.
19. Bellinger DC. Lead. Pediatrics 2004; 113(4): 1016–1020.
20. JuskoTA, Henderson ChR, Lanphear B. Blood lead concentrations <10 μg/dl and child intelligence at 6 years of age. Environ Health Perspect 2008; 116 : 243–248.
21. Hornung RW, Lanphear BP, Dietrich KN. Age of greatest susceptibility to childhood lead exposure: a new statistical approach. Environ Health Perspect 2009; 117(8): 1309–1312.
22. Florea AM, Busselberg D. Occurrence, use and potential toxic effects of metals and metal compounds. Biometals 2006; 19(4): 419–427.
23. Bunn TL, Parsons PJ, Kao E. Exposure to lead during critical windows of embryonic development: Differential immunotoxic outcome based on stage of exposure and gender. Toxicological Sciences 2001; 64 : 57–66.
24. Snyder JE, Filipov NM, Parsons PJ. The efficiency of maternal transfer of lead and its influence on plasma IgE and splenic cellularity of mice. Toxicol Sci 2000; 57 : 87–94.
25. MŽP SR, Správa o stave životného prostredia. Slovenská agentúra životného prostredia, 2007. Available: http://enviroportal.sk/pdf/spravy_zp/2007-sk/2_Zlozky. pdf //. [accessed 14 september 2011].
26. Dluholucký S, Orosová J. Dieťa a olovo I., II. Čes-slov Pediat 1981; 36 : 333, 389.
27. Černá M, Kazmarová H, Kratenová J, Kratzer K, Ruprich J, Šmerhovsky Z, Zimová M. Systém monitorování zdravotního stavu obyvatelstva České republiky ve vztahu k životnímu prostředí. Souhrnná zpráva za rok 2008. Praha: SZÚ, 2009.
28. Gump BB, Stewart P, Reihman J, et al. Prenatal and early childhood blood lead levels and cardiovascular functioning in 9½ year old children. Neurotoxicology and Teratology 2005; 27 : 655–665.
29. CDC. 2005. Pediatric and Pregnancy Nutrition Surveillance System. Atlanta: Centers for Disease Control and Prevention. Available: http://www.cdc.gov/ pednss/how_to/interpret_data/case_studies/breastfeeding/what.htm [accessed 14 November 2009].
30. Hladíková V, Ursínyová M, Šovčíková E. Children´s blood lead levels in relation to the selected environmental risk factors. In: Proceedings of the International Symposium on Environmental Epidemiology in Central and Eastern Europe: Critical Issues for Improving Health. Smolenice, Slovak Republic, 1997 : 64–66.
31. Morelli V, Zoorob R. In: Chey H, Buchanan S. Toxins in everyday life. Primary care: Clinics in Office Practice 2008; 35(4): 707–723.
32. Ursínyová V, Hladíková M. Lead in he environment of Cenral Europe. In: Markert B, Friese K. Trace Elements – Their Distribution and Effects in the Environment. Elsevier Science B.V, chapter 4, 2000 : 109–134.
33. Elinder CG, Friberg L, Lind B, et al. Lead and cadmium levels in blood samples from the general population of Sweden. Environ Res 1983; 30(1): 233–253.
34. Cox L, Williams B, Sicherer S. Pearls and pitfalls of allergy diagnostic testing: report from the American College of Allergy, Asthma and Immunology/ American Academy of Allergy, Asthma and Immunology Specific IgE Test Task Force. Ann Allergy Asthma Immunol 2008; 101(6): 580–592.
35. Hlavatá A, Čižnár P, Palkovičová Ľ. Výskyt a rizikové faktory alergických ochorení u detí predškolského veku v priemyselnom a vidieckom regióne Slovenska. Čes-slov Pediat 2008; 63(12): 668–676.
36. Alfvén T, Braun-Fahrlander C, Brunekreef B. Allergic diseases and atopic sensitization in children related to farming and anthroposophic lifestyle – The PARSIFAL study. Eur J Allergy Clin Immunol 2006; 61 : 414–421.
37. Wong GWK, Chow CM. Childhood asthma epidemiology: Insights from comparative studies of rural and urban populations. Pediatr Pulmology 2008; 43 : 107–116.
38. Reigart JR, Graber CD. Evaluation of the humoral immune response of children with low level lead exposure. Bull Environ Contam Toxicol 1976; 16 : 112–117.
39. Lutz PM, Wilson TJ, Ireland J. Elevated imunoglobin E (IgE) levels in children with exposure to environmental lead. Toxicology1999; 134 : 63–78.
40. Karmaus W, Brooks KR, NebetWitten J, et al. Immune function biomarkers in children exposed to lead and organochlorine compounds: a cross-sectional study. Environ Health 2005; 4(5): 1–10.
41. Sun L, Hu J, Zhao Z, et al. Influence of exposure to environmental lead on serum immunoglobulin in preschool children. Environ Res 2003; 92 : 124–128.
42. Annesi-Maesano I, Pollitt R, King G. In utero exposure to lead and cord blood total IgE. Is there a connection? Allergy 2003; 58(7): 589–594.
43. Sarasua SM, Vogt RF, Henderson LO, et al. Serum immunoglobulins and lymphocyte subset distributions in children and adults living in communities assessed for lead and cadmium exposure. J Toxicol Environ Health Part A 2000; 60 : 1–15.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Parenterální výživa
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2012 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Vliv matrixových metaloproteináz na hojení ran po operaci vrozeného rozštěpu rtu
- Koncentrácia olova v krvi a alergénová senzibilizácia detí predškolského veku v dvoch regiónoch Slovenska
- Thymidin kináza – vhodný marker pro diagnostiku a sledování leukémií dětského věku
- Nárast polinózy u školskej mládeže v meste a na vidieku za posledných 20 rokov (1988–2009)
- Prevalence a typ anémie v době stanovení diagnózy nespecifického střevního zánětu u dětí
- Mikrodeleční syndrom Xp21: Závažná příčina selhání nadledvin, svalové dystrofie, poruchy hladin krevních lipidů a vývojové retardace u dvouměsíčního neprospívajícího kojence
- Ostravský den preventivní pediatrie 16. března 2012, Ostrava (Clarion Congress Hotel)
- Ligneózna konjunktivitída, hydrocefalus a protrahované respiračné infekcie u pacienta s deficitom plazminogénu
- Cmúľanie prstov a jeho vplyv na vývoj tváre a dutiny ústnej v detskom veku
- Ovlivnění bolesti při stomatologickém ošetření dětí
- Parenterální výživa
- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Perspektiva dětské lůžkové péče v České republice v roce 2011
- Zkušenosti s dlouhodobou neakutní péčí o dítě s postižením ve Strančicích
- Nedožitých 89 rokov profesora Birčáka
- XVII. Moravskoslezské pediatrické dny s mezinárodní účastí
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Parenterální výživa
- Kdy vyšetřovat vrozená trombofilní rizika u dětí?
- Ovlivnění bolesti při stomatologickém ošetření dětí
- Cmúľanie prstov a jeho vplyv na vývoj tváre a dutiny ústnej v detskom veku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



