-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKrvácení po porodu / potratu – praktické poznámky k vyšetření bioptického materiálu
Bleeding after childbirth / miscarriage - practical notes on the examination of biopsy material
Postpartum haemorrhage is a significant cause of maternal morbidity and mortality worldwide. The pathologist encounters only a limited spectrum of causes leading to postpartum haemorrhage. The most common causes are retained placenta and placental site subinvolution. Both of these lesions can be diagnosed from material obtained by uterine curettage. Morbidly adherent placenta (placenta accreta spectrum) is a less frequent subject of investigation, the diagnosis of which can be reliably established only on the basis of histological examination of uterine specimens after hysterectomy.
Keywords:
Postpartum hemorrhage – placenta accreta spectrum – retained placenta – placental site subinvolution
Autoři: Šárka Hadravská 1,2; Vladimír Korečko 3; Magdaléna Daumová 1,2
Působiště autorů: Šiklův ústav patologie LFP UK a FN Plzeň 1; Bioptická laboratoř s. r. o., Plzeň 2; Gynekologicko-porodnická klinika LFP UK a FN Plzeň 3
Vyšlo v časopise: Čes.-slov. Patol., 59, 2023, No. 2, p. 55-59
Kategorie: Přehledový článek
Souhrn
Poporodní krvácení je celosvětově významnou příčinou mateřské morbidity a mortality. Patolog se v praxi setkává pouze s omezeným spektrem příčin, které k poporodnímu krvácení vedou. Nejčastěji se jedná o retinované části placenty a plodových obalů (residua post partum / post abortum) nebo o subinvoluci cév v místě lůžka placenty (placental site subinvolution). Obě tyto diagnózy mohou být stanoveny z bioptického materiálu získaného kyretáží dutiny děložní. Méně častým předmětem vyšetření jsou placenty patologicky adherující k děložní stěně (tzv. placenta accreta spectrum), jejichž diagnózu lze spolehlivě stanovit pouze na základě histologického vyšetření vzorků z dělohy po hysterektomii.
Klíčová slova:
poporodní krvácení – residua post partum – placental site subinvolution – placenta accreta spectrum
Poporodní krvácení vyžaduje specializovanou lékařskou péči, která v některých případech zahrnuje i instrumentální revizi dutiny děložní. Závažné a život ohrožující krevní ztráty (nad 1000 ml, resp. nad 1500 ml) mohou být po vyčerpání všech terapeutických možností indikací k provedení hysterektomie (1). Krvácení komplikuje až 6 % porodů a zdá se, že jeho incidence mírně stoupá (2-5).
Z časového hlediska můžeme poporodní krvácení rozdělit na krvácení časné, během prvních 24 hodin po porodu, a na krvácení pozdní, které se objevuje v horizontu 24 hodin až 6 týdnů po porodu. Rizikových faktorů je celá řada. Obecně můžeme říci, že ke krvácení v poporodním obdobní dochází při poruše alespoň jednoho ze čtyř faktorů, které jsou označovány jako 4T: Tonus (hypotonie / atonie dělohy), Trauma (porodní poranění), Tkáň (zadržení částí placenty) a Trombin (poruchy krevní srážlivosti) (6) (Tab. 1).
Tab. 1. Možné příčiny krvácení po porodu / potratu. 
Mezi nejčastější stavy, které lze histologicky verifikovat, patří zadržené části placenty a plodových obalů (residua post partum), subinvoluce cév lůžka placenty (placental site subinvolution) a placenta zvýšeně adherující k děložní stěně (tzv. placenta accreta spectrum).
Residua post partum / residua post abortum
Retence částí placenty nebo plodových obalů komplikuje až 3,3 % vaginálních porodů. Krvácení se může objevit časně po porodu, ale i po několika týdnech (7,8). Mezi rizikové faktory patří preeklampsie, předchozí císařský řez, věk matky nad 30 let, potrat nebo porod mrtvého plodu, předčasný porod, anamnéza reziduí po předchozím porodu, abnormální tvar dělohy (uterus sub/septus, uterus bicornis) či samotné placenty (placenta succenturiata, placenta biloba) (9-11), případně i protrahované podávání oxytocinu během porodu (12).
Pokud je placenta zaslána patologovi k vyšetření, její spodina bývá potrhaná, s čerstvými krevními koaguly. Výjimečně lze identifikovat i chybění celého kotyledonu (obr. 1). Tento nález by měl být součástí makroskopického popisu a měl by být zmíněn i v závěru bioptického vyšetření placenty, což by mělo klinického lékaře na možnost případných reziduí upozornit. Materiál získaný kyretáží dutiny děložní je obvykle hojně krevnatý a mikroskopicky v něm nacházíme regresivně změněné části placentární tkáně (obr. 2) (13). V případě, že je v kompletně zpracovaném materiálu mikroskopicky zastižena pouze těhotenská decidua, nelze diagnózu poporodních reziduí stanovit.
Obr. 1. Chybění celého placentárního kotyledonu. 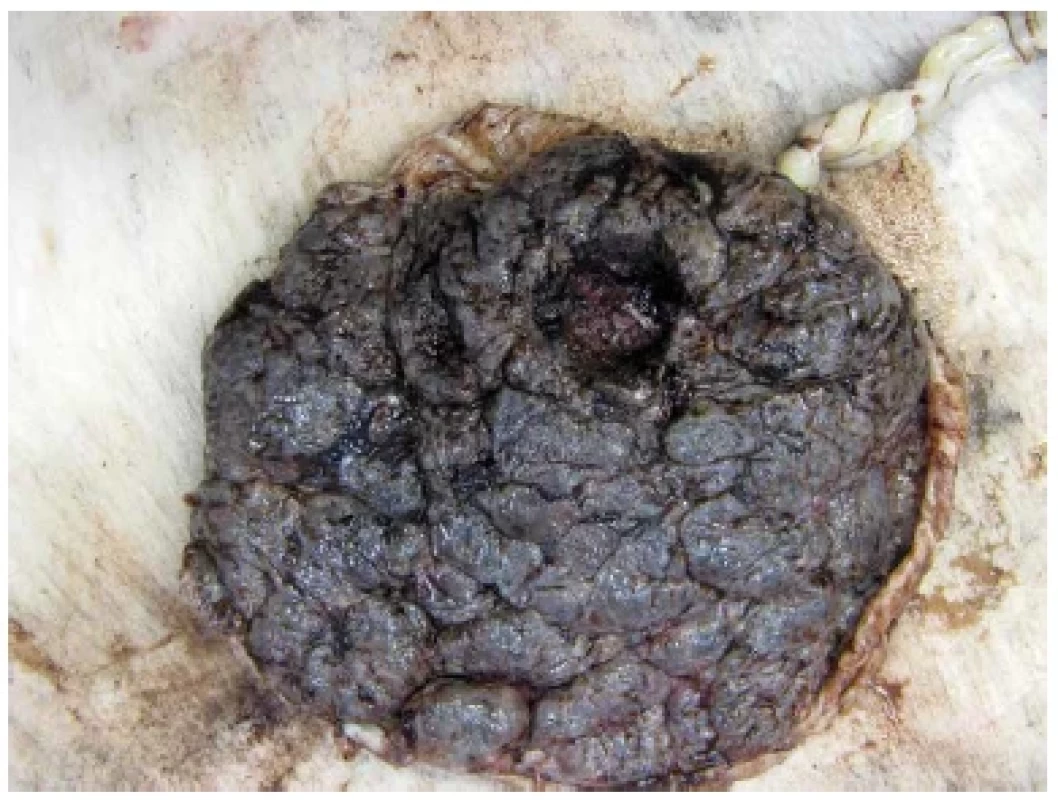
Obr. 2. Residua post partum. Těhotenská decidua a regresivně změněné části placentární tkáně (HE, 100x). 
Subinvoluce cév placentárního lůžka
(Placental site subinvolution)
Porucha involuce cév děložní stěny je poměrně častou příčinou poporodního krvácení, které se objevuje obvykle dva a více týdnů po porodu. Dostačujícím terapeutickým výkonem je ve většině případů kyretáž dutiny děložní (14-16).
V časných fázích těhotenství migruje extravilózní cytotrofoblast do spirálních arterií, což vede k jejich fyziologické remodelaci zajišťující vysoký průtok krevním řečištěm při nízkém odporu cévní stěny, a tím k adekvátnímu krevnímu zásobení placenty a plodu. Po porodu dochází během několika dní k trombotizaci široce dilatovaných uteroplacentárních cév, zániku extravilózního trofoblastu, regeneraci cévní stěny a jejich postupné konstrikci. Předpokládá se, že v patogenezi subinvoluce spirálních arterií hraje roli prodloužené přežívání trofoblastu v jejich stěnách (17).
Při histologickém vyšetření je materiál hojně krevnatý a nenacházíme v něm choriové klky. Ve vzorcích jsou přítomny útržky myometria s široce dilatovanými cévami se silnou stěnou, které postrádají endotelovou výstelku. Stěny těchto cév mohou být hyalinizované a ložiskově v nich můžeme identifikovat polygonální buňky extravilózního trofoblastu s objemnou cytoplasmou a vezikulárními jádry. Některé tyto cévy jsou volně průchodné, v jiných jsou přítomny tromby různého stáří. V materiálu současně nacházíme cévy, které podlehly fyziologické involuci (obr. 3) (18). Spirální arterie jsou za normálních okolností průchodné méně než 24 hodin po porodu, proto nelze stanovit diagnózu subinvoluce cév v bioptickém materiálu získaném do 24 hodin po porodu. Imunohistochemické vyšetření může být užitečné v nejasných případech. V materiálu lze prokázat absenci endotelových buněk v cévách, které nepodlehly involuci (ztráta exprese CD31) a přítomnost peri - a endovaskulárního trofoblastu (pozitivní průkaz nízkomolekulárních cytokeratinů). Zajímavostí je i zvýšená exprese antiapoptotického onkoproteinu bcl-2 v trofoblastu přítomném ve stěnách cév se známkami subinvoluce (19). Nicméně v praxi není ke stanovení diagnózy imunohistochemické vyšetření nezbytné.
Obr. 3. Subinvoluce cév lůžka placenty (placental site subinvolution). Útržky myometria, v němž současně nacházíme volně průchodné i fyziologicky uzavřené uteroplacentární cévy (HE, 50x). 
Velmi vzácně je tento stav příčinou závažného krvácení, které je po vyčerpání všech terapeutických možností indikací k hysterektomii. V takovémto případě lze pouhým okem pozorovat výrazně dilatované a někdy i částečně trombotizované cévy v místě lůžka placenty (obr. 4) (15).
Obr. 4. Subinvoluce cév lůžka placenty (placental site subinvolution). Makroskopicky patrné dilatované cévy v místě lůžka placenty. 
Placenta zvýšeně adherující k děložní stěně
Jednotky spadající do této kategorie (tzv. placenta accreta spectrum) představují významnou příčinu mateřské i fetální morbidity a mortality a jsou jednou z nejčastějších indikací k chirurgickým výkonům včetně hysterektomie (20). V současné době bylo vydáno několik analogických klasifikačních systémů (21,22), které by při hodnocení těchto lézí měly být užívány (Tab. 2).
Tab. 2. Placenta accreta spectrum – FIGO klasifikace, 2019 (21). 
Tyto patologické jednotky jsou diagnostikovány s incidencí 1 : 500 – 700 porodů. Současný nárůst kopíruje stoupající trend porodů císařským řezem, které jsou považovány za jeden z hlavních rizikových faktorů. Dalším známým rizikovým faktorem je inzerce placenty v dolním děložním segmentu (placenta preavia) (23,24).
Zvýšená adheze placenty ke stěně děložní je způsobena defektní decidualizací endometria nejčastěji v důsledku předchozích terapeutických výkonů (císařský řez, resekce leiomyomu, opakované kyretáže dutiny děložní) (25,26). V patogenezi se pravděpodobně kromě těchto mechanických faktorů uplatňují i další procesy, včetně procesů imunopatologických. Některé studie poukazují na zvýšený počet regulačních mateřských T-lymfocytů v deciduy, jejichž působení by mohlo vést k patologické invazi extravilózního trofoblastu do myometria (27,28). Podle jiné teorie je příčinou abnormální vaskularizace, resp. nedokonalá remodelace cév, která je spojená se sekundární lokální hypoxií, která vede k nedokonalé decidualizaci endometria (29). Vzhledem k tomu, že až v 18 % případů je diagnóza stanovena u žen bez jakýchkoli rizikových faktorů, lze předpokládat i spoluúčast vlivů genetických (30).
Základním mikroskopickým znakem patologicky adherujících placent je absence (popř. výrazné ztenčení) bazální deciduy. V případě akrétní placenty jsou choriové klky od myometria často separovány pouze tenkou vrstvou fibrinu, v němž jsou rozptýleny buňky extravilózního trofoblastu, které mohou připomínat buňky deciduální (obr. 5). K jejich odlišení může posloužit imunohistochemické vyšetření (pozitivní průkaz CD10 v buňkách deciduy a negativní průkaz v buňkách trofoblastu) (obr. 6). Poměrně často jsou k histologickému vyšetření zasílány placenty s klinickou diagnózou „placenta adherens“, „v.s. placenta partim accreta“ apod. Tyto placenty bývají často výrazně potrhané a v některých případech jejich rekonstrukce není vůbec možná. Ačkoli je chybění bazální deciduy u těchto placent velmi častým nálezem, nemůže být jednoznačně interpretováno jako spolehlivý diagnostický znak akrétní placenty. Nicméně při znalosti klinických údajů je možné v závěru bioptického vyšetření placenty vyslovit podezření na tuto možnost. Placenta increta a placenta percreta jsou charakterizovány prorůstáním placentární tkáně do myometria včetně cév (obr. 7A,B), resp. na serózní povrch dělohy nebo do okolních orgánů (obr. 8A,B) (20). S postpartálním krvácením se však v těchto případech setkáváme vzácně, neboť těhotné ženy jsou při potvrzení či pouhém podezření na akrétní placentu referovány do perinatologického centra, kde je možné zajistit multioborový tým s bohatými zkušenostmi s řešením těchto patologických stavů.
Obr. 5. Placenta accreta. Choriové klky jsou od myometria odděleny pouze vrstvou fibrinu, v němž jsou rozptýleny buňky extravilózního trofoblastu (HE, 200x). 
Obr. 6. Absence bazální deciduy – negativní imunohistochemický průkaz antigenu CD10 (CD10, 100x). 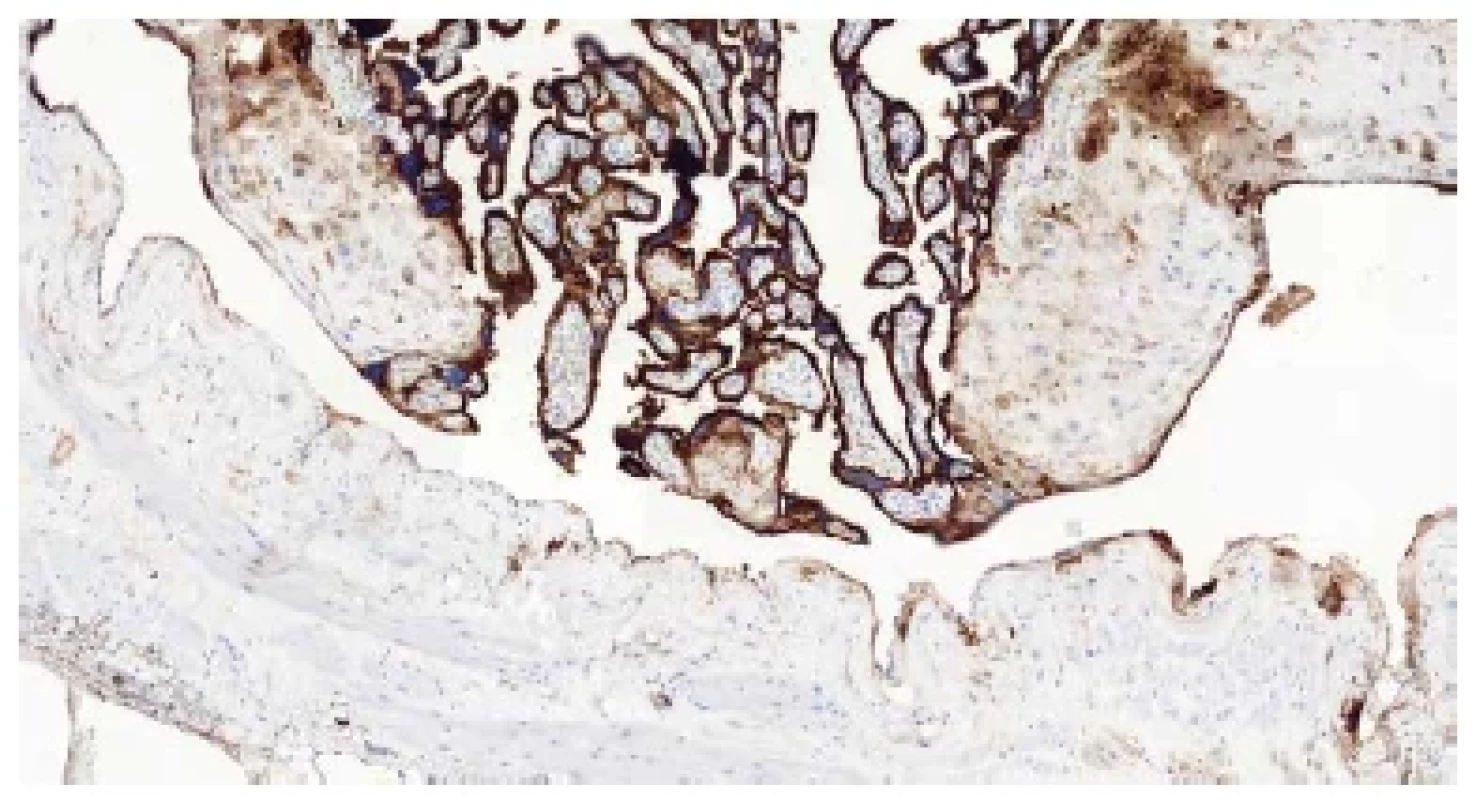
Obr. 7. A: Placenta increta. Řezy děložní stěnou s patrným prorůstáním placenty do myometria. B: Placenta increta. Choriové klky v žíle stěny děložní (HE, 200x). 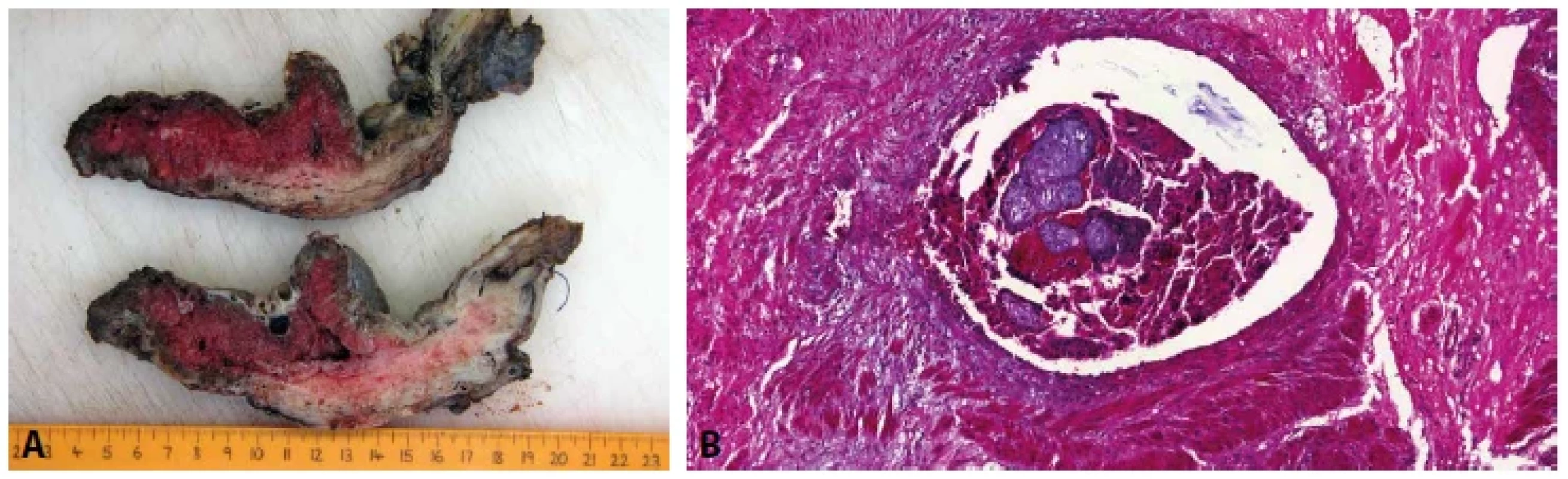
Obr. 8. A: Placenta percreta. Prorůstání placenty přes serózní povrch dělohy. B: Placenta percreta. Prorůstání placenty do stěny močového měchýře (grade 3b dle klasifikace FIGO, 2019) (HE, 20x). 
ZÁVĚR
Patolog se v praxi setkává pouze s omezeným spektrem příčin krvácení po porodu / potratu. Nejčastěji se jedná o residua post partum. Tuto diagnózu lze stanovit pouze za předpokladu, že součástí materiálu jsou části placentární tkáně. Druhou nejčastější diagnózou je subinvoluce cév placentárního lůžka. Oba zmíněné stavy lze úspěšně řešit kyretáží dutiny děložní. Jakkoli jsou tyto zákroky terapeuticky účinné, mohou být predispozicí k daleko závažnějším stavům v podobě patologické adheze placenty ke stěně děložní (tzv. placenta accreta spectrum) v dalších graviditách.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i spoluautorů.
Adresa pro korespondenci:
MUDr. Šárka Hadravská, MIAC
Bioptická laboratoř s.r.o.
Mikulášské nám. 4
326 00 Plzeň
e-mail: hadravska@biopticka.czCesk Patol 2023; 59(2): 55–59
Zdroje
1. Hancock A, Weeks AD, Lavender DT. Is accurate and reliable blood loss estimation the ‘crucial step’ in early detection of postpartum haemorrhage: an integrative review of the literature. BMC Pregnancy Chilbirth 2015; 15): 230.
2. Carroli G, Cuesta C, Abalos E, Gulmezoglu AM. Epidemiology of postpartum haemorrhage: a systematic review. Best Pract Res Clin Obstet Gynaecol 2008; 22(6): 999-1012.
3. Lu MC, Fridman M, Korst LM, et al. Variations in the incidence of postpartum hemorrhage across hospitals in California. Matern Child Health 2005; 9(3): 297-306.
4. Callaghan WM, Kuklina EV, Berg CJ. Trends in postpartum hemorrhage: United States, 1994-2006. Am J Obstet Gynecol 2010; 202(4): 353 e351-356.
5. Kramer MS, Berg C, Abenhaim H, et al. Incidence, risk factors, and temporal trends in severe postpartum hemorrhage. Am J Obstet Gynecol 2013; 209(5): 449 e441-447.
6. Ramanathan G, Arulkumaran S. Postpartum hemorrhage. J Obstet Gynaecol Can 2006; 28(11): 967-973.
7. Weeks AD. The retained placenta. Best Pract Res Clin Obstet Gynaecol 2008; 22(6): 1103 - 1117.
8. Cheung WM, Hawkes A, Ibish S, Weeks AD. The retained placenta: historical and geographical rate variations. J Obstet Gynaecol 2011; 31(1): 37-42.
9. Khong TY, Khong TK. Delayed postpartum hemorrhage: a morphologic study of causes and their relation to other pregnancy disorders. Obstet Gynecol 1993; 82(1): 17-22.
10. Coviello EM, Grantz KL, Huang CC, Kelly TE, Landy HJ. Risk factors for retained placenta. Am J Obstet Gynecol 2015; 213(6): 864 e861 - 864 e811.
11. Endler M, Saltvedt S, Cnattingius S, Stephansson O, Wikstrom AK. Retained placenta is associated with pre-eclampsia, stillbirth, giving birth to a small-for-gestational - age infant, and spontaneous preterm birth: a national register-based study. BJOG 2014; 121(12): 1462-1470.
12. Endler M, Grunewald C, Saltvedt S. Epidemiology of retained placenta: oxytocin as an independent risk factor. Obstet Gynecol 2012; 119(4): 801-809.
13. Endler M, Saltvedt S, Papadogiannakis N. Macroscopic and histological characteristics of retained placenta: A prospectively collected case-control study. Placenta 2016; 41): 39 - 44.
14. Weydert JA, Benda JA. Subinvolution of the placental site as an anatomic cause of postpartum uterine bleeding: a review. Arch Pathol Lab Med 2006; 130(10): 1538-1542.
15. Kavalar R, Arko D, Fokter Dovnik N, Takac I. Subinvolution of placental bed vessels: case report and review of the literature. Wien Klin Wochenschr 2012; 124(19-20): 725-730.
16. Costa MA, Calejo LI, Martinez-de-oliveira J, Laurini R. Late-onset postpartum hemorrhage from placental bed subinvolution: a case report. J Reprod Med 2005; 50(7): 557 - 560.
17. Lyall F. Priming and remodelling of human placental bed spiral arteries during pregnancy - a review. Placenta 2005; 26 Suppl A): S31 - 36.
18. Al-Mehaisen L, Al-Kuran O, Amarin ZO, Matalka I, Beitawi S, Muhtaseb A. Secondary postpartum hemorrhage following placental site vessel subinvolution: a case report. Arch Gynecol Obstet 2008; 278(6): 585-587.
19. Khong TY, Abdul Rahman H. Bcl-2 expression delays postpartum involution of pregnancy - induced vascular changes in the human placental bed. Int J Gynecol Pathol 1997; 16(2): 138-142.
20. Morlando M, Collins S. Placenta Accreta Spectrum Disorders: Challenges, Risks, and Management Strategies. Int J Womens Health 2020; 12): 1033-1045.
21. Jauniaux E, Ayres-de-Campos D, Langhoff - Roos J, et al. FIGO classification for the clinical diagnosis of placenta accreta spectrum disorders. Int J Gynaecol Obstet 2019; 146(1): 20-24.
22. Hecht JL, Baergen R, Ernst LM, et al. Classification and reporting guidelines for the pathology diagnosis of placenta accreta spectrum (PAS) disorders: recommendations from an expert panel. Mod Pathol 2020; 33(12): 2382-2396.
23. Wu S, Kocherginsky M, Hibbard JU. Abnormal placentation: twenty-year analysis. Am J Obstet Gynecol 2005; 192(5): 1458-1461.
24. Silver RM, Landon MB, Rouse DJ, et al. Maternal morbidity associated with multiple repeat cesarean deliveries. Obstet Gynecol 2006; 107(6): 1226-1232.
25. Tantbirojn P, Crum CP, Parast MM. Pathophysiology of placenta creta: the role of decidua and extravillous trophoblast. Placenta 2008; 29(7): 639-645.
26. Gargett CE, Nguyen HP, Ye L. Endometrial regeneration and endometrial stem/progenitor cells. Rev Endocr Metab Disorder 2012; 13(4): 235-251
. 27. Laban M, Ibrahim EA, Elsafty MS, Hassanin AS. Placenta accreta is associated with decreased decidual natural killer (dNK) cells population: a comparative pilot study. Eur J Obstet Gynecol Reprod Biol 2014; 181): 284 - 288.
28. Schwede S, Alfer J, von Rango U. Differences in regulatory T-cell and dendritic cell pattern in decidual tissue of placenta accreta/ increta cases. Placenta 2014; 35(6): 378-385.
29. Gellersen B, Brosens IA, Brosens JJ. Decidualization of the human endometrium: mechanisms, functions, and clinical perspectives. Semin Reprod Med 2007; 25(6): 445-453.
30. Bailit JL, Grobman WA, Rice MM, et al. Morbidly adherent placenta treatments and outcomes. Obstet Gynecol 2015; 125(3): 683-689.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2023 Číslo 2-
Všechny články tohoto čísla
- Mola či nemola, toť otázka
- Na patologii mě baví, jak to dohromady pasuje a když nepasuje, tak člověk musí přemýšlet proč
- Monitor aneb nemělo by vám uniknout, že...
- Mola hydatidosa
- Krvácení po porodu / potratu – praktické poznámky k vyšetření bioptického materiálu
- Spontánní potrat v prvním trimestru gravidity
- Molekulární diagnostika kompletní a parciální hydatidózní moly
- Kostní dysplázie: přehled problematiky a deset let zkušeností s diagnostikou u plodů a novorozenců
- Kazuistika: Akutní poškození ledvin s progresí do chronicity u starší pacientky
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mola hydatidosa
- Spontánní potrat v prvním trimestru gravidity
- Kostní dysplázie: přehled problematiky a deset let zkušeností s diagnostikou u plodů a novorozenců
- Molekulární diagnostika kompletní a parciální hydatidózní moly
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



