-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Úloha patologa v chirurgickém stagingu karcinomu děložního hrdla
The role of a pathologist in surgical staging for carcinoma of the cervix uteri
The incidence of cervical cancer is high in the Czech Republic. Altogether 822 new cases were found in this country during 2016 which means the incidence 15,3 new diseases / 100,000 women. FIGO (Fédération Internationale de Gynécologie et d´Obstétrique) staging of carcinoma for the cervix was changed as follows. Lateral extension measurement is removed in the stage IA, the only criterion is the measured deepest invasion <5.0 mm. Stage IB was divided into three subgroups; IB1 - tumors ≤ 2,0 cm in greatest diameter; IB2 - tumors size ≥ 2,0 až < 4,0 cm; IB3 - tumors ≥ 4 cm. Stage IIIC includes an assessment of pelvic and paraaortic lymph nodes; IIIC1 if only pelvic lymph nodes are involved, IIIC2 if paraaortic nodes are infiltrated.
The role of a patologist in surgical staging of a disease is irreplaceable. Sentinel lymph node (SLN) biopsy has been increasingly used in the management of early-stages cervical cancer instead of systematic pelvic lymph node dissection. New European guidelines recommend performing SLN biopsy as the first step of the surgical staging in all early stages of cervical cancer (except IA1) and submitting the SLN for intraoperative assessment to triage patients towards radical surgery or chemoradiotherapy. SLN biopsy with definitive histological assessment by ultrastaging is considered to be more accurate in the assessment of all pelvic lymph nodes involvement than a complete systematic pelvic lymph node dissection.
This approach in surgical staging and other aspects related to pathologic evaluation of the disease are discussed. The aim of this article is to give a overview of mentioned issues.
Keywords:
FIGO – cervical cancer
Autoři: Borek Sehnal 1; Iva Kinkorová Luňáčková 2; Michal Zikán 1; Emanuela Kmoníčková 3; Jiří Sláma 4
Působiště autorů: Onkogynekologické centrum, Gynekologicko-porodnická klinika, Nemocnice Na Bulovce a 1. lékařské fakulty Univerzity Karlovy, Praha 1; Bioptická laboratoř s. r. o., Plzeň 2; Ústav radiační onkologie, Komplexní onkologické centrum, Nemocnice Na Bulovce, Praha 3; Onkogynekologické centrum, Gynekologicko-porodnická klinika Všeobecné fakultní nemocnice a 1. lékařské fakulty Univerzity Karlovy, Praha 4
Vyšlo v časopise: Čes.-slov. Patol., 56, 2020, No. 1, p. 38-44
Kategorie: Přehledový článek
Souhrn
Incidence cervikálního karcinomu je v České republice vysoká. Během roku 2016 bylo v České republice zjištěno celkem 822 nových případů. což znamená incidenci 15,3 nových onemocnění / 100 000 žen. FIGO (Fédération Internationale de Gynécologie et d´Obstétrique) staging karcinomu děložního hrdla byl změněn následovně. Ve stadiu IA byl zrušen laterální rozměr tumoru, jediným kritériem je hloubka stromální invaze <5,0 mm. Stadium IB bylo rozděleno do 3 substadií; IB1 - nádory v největším rozměru ≤ 2,0 cm; IB2 - nádory velikosti ≥ 2,0 až < 4,0 cm; IB3 - nádory ≥ 4 cm. Stadium IIIC zahrnuje zhodnocení pánevních a paraaortálních lymfatických uzlin; IIIC1 pokud jsou zasaženy pouze pánevní lymfatické uzliny, IIIC2 pokud jsou infiltrovány paraaortální lymfatické uzliny.
Úloha patologa je v chirurgickém stagingu onemocnění nezastupitelná. Biopsie sentinelové lymfatické uzliny (SLN) se stále více uplatňuje v managementu časných stadií cervikálního karcinomu místo systematické pánevní lymfadenektomie. Nové evropské guidelines doporučují provedení biopsie SLN jako první krok chirurgického stagingu všech časných stadií cervikálního karcinomu (mimo IA1) a peroperační vyšetření SLN k rozčlenění pacientek k radikální chirurgii nebo chemoradioterapii. Biopsie SLN s definitivním histologickým vyšetřením pomocí ultrastagingu je považována za přesnější v hodnocení postižení všech pánevních lymfatických uzlin než úplná systematická pánevní lymfadenektomie. Je diskutován tento přístup v chirurgickém stagingu i další aspekty spojené s patologickým zhodnocením onemocnění. Cílem tohoto článku je podat přehled zmíněné problematiky.
Klíčová slova:
Cervical cancer – FIGO – surgical staging – pathologic evaluation – sentinel lymph node – ultrastaging
Karcinom děložního hrdla je u žen celosvětově čtvrtým nejčastějším zhoubným nádorem a dokonce druhým nejčastějším zhoubným nádorem v nízce a středně příjmových zemích (1). V České republice byla v roce 2016 hlášena incidence na 15,3 nových onemocnění / 100 tis. žen (822 nových případů) (2). Navíc celková prevalence tohoto onemocnění v ČR stále narůstá (3). Hlavním důvodem vysoké incidence je nízká účast žen na preventivních gynekologických prohlídkách, která jen mírně převyšuje 50 %, přestože od roku 2014 bylo zahájeno adresné zvaní zdravotními pojišťovnami (4).
Dominantní terapií jsou u nádorů omezených na hrdlo děložní radikální chirurgické operace s velmi dobrými výsledky. Recentní randomizovaná studie zjistila recidivu pouze u 3,5 % z 312 pacientek s lokálními nádory po laparotomických operacích s délkou sledování 4,5 roku (5). Typ a rozsah operace je indikován na základě přítomnosti rizikových faktorů, které většinou stanovuje histopatolog a jeho úloha je při indikaci terapeutického postupu nezastupitelná.
Jedním z úkolů Mezinárodní federace gynekologie a porodnictví FIGO (Fédération Internationale de Gynécologie et d´Obstétrique) je aktualizovat stagingové systémy ženských zhoubných nádorů, aby jednotlivá stadia odrážela přesnější prognózu onemocnění a indikaci ke konkrétní léčbě. Poslední revize stagingu karcinomu děložního hrdla byla schválena 4. dubna 2018 a posléze představena organizacím AJCC (American Joint Committe on Cancer) a UICC (International Union Against Cancer) na jejich každoročním zasedání v Ženevě (6). Stagingový systém karcinomu děložního hrdla FIGO 2018 a jeho srovnání s klasifikací FIGO 2009 a TNM 2010 zobrazuje tabulka 1. Společnost ESGO (European Society of Gynaecological Oncology) pod vedením tehdejšího prezidenta profesora Davida Cibuly iniciovala vznik aktualizovaných doporučení pro diagnostiku, léčbu a sledování pacientek se zhoubným nádorem děložního hrdla. Tato doporučení vznikla ve spolupráci a byla odsouhlasena společnostmi ESTRO (European Society for Radiotherapy and Oncology) a ESP (European Society of Pathology). Součástí doporučených postupů je i podrobný popis požadavků na histopatologické vyšetření preparátů včetně imunohistochemie a vzor výstupní zprávy (7).
Tab. 1. Staging karcinomu děložního hrdla (6). 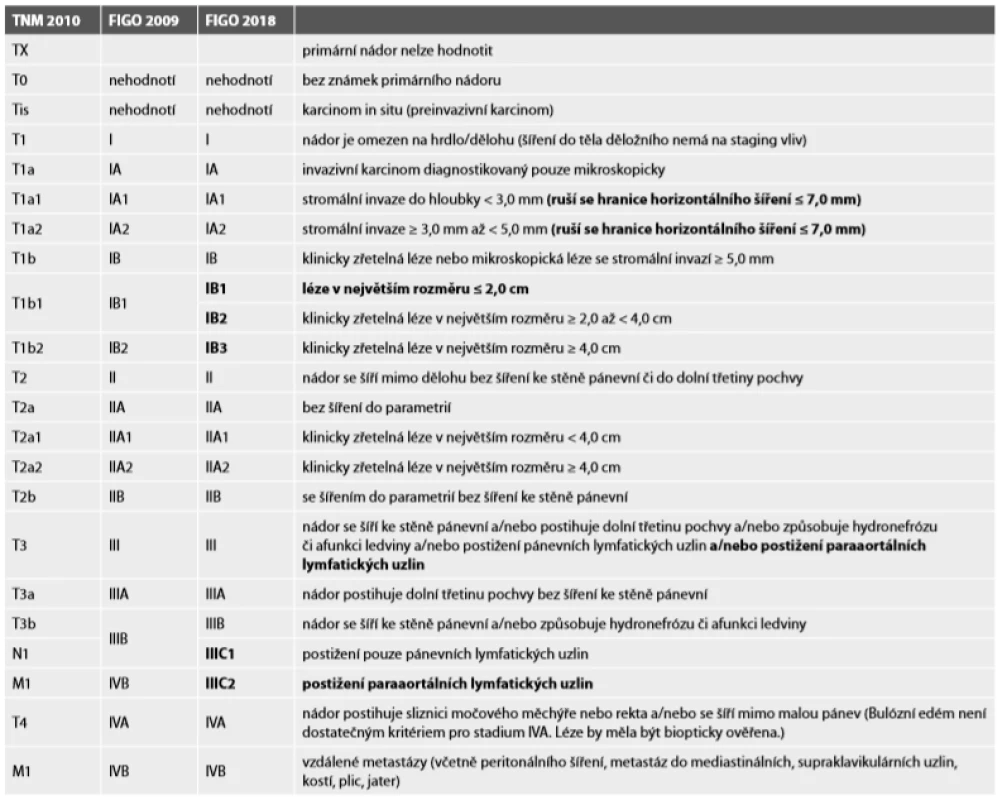
pozn. změny FIGO 2018 oproti FIGO 2009 jsou zvýrazněny STADIUM IA
Stadium IA je definováno jako invazivní nádor s nejhlubší invazí pod 5,0 mm a může být diagnostikován pouze mikroskopicky. U stadia IA se ruší hranice horizontálního šíření do 7,0 mm, rozhodujícím kriteriem je pouze hloubka stromální invaze (6). Stadium IA by mělo být stanoveno podrobným histologickým vyšetřením konizátu děložního hrdla. V našich podmínkách se často označují všechny excizní metody děložního hrdla pojmem konizace, nicméně podle rozsahu transformační zóny a histologického typu prekancerózy je možné provést excizi i ve tvaru válce (cylindru) nebo ve tvaru v tzv. „cowboy hat“ (elektrickou kličkou se excidují dva vzorky, první větší z ektocervixu a druhý menší z endocervixu) (8). Vedle velikosti nádoru změřeného ve třech rozměrech (dva určující horizontální rozsah, jeden hloubku invaze) je právě hloubka invaze další významný rizikový faktor. Měří se od bazální membrány epitelu (povrchového či krypty), ze kterého invazivní karcinom vzniká, k nejhlubšímu bodu invaze. V některých případech (exofyticky rostoucí nebo ulcerované nádory) je měření hloubky invaze obtížné a terminologicky je než „hloubka invaze“ vhodnější použít „tloušťka nádoru“. Pro účely stagingu je „tloušťka nádoru“ ekvivalentní hloubce invaze (8). Ani další významný rizikový faktor (přítomnost vaskulární nebo lymfangioinvaze) nemění stadium onemocnění, ale významně ovlivňuje management léčby a musí být v bioptickém protokolu jasně zmíněn (Tab. 2). V současné době není opodstatněné imunohistochemicky rozlišovat mezi postižením krevních a lymfatických cév (8).
Tab. 2. Doporučený rozsah chirurgického výkonu podle kriterií ESGO-ESTRO-ESP (7). 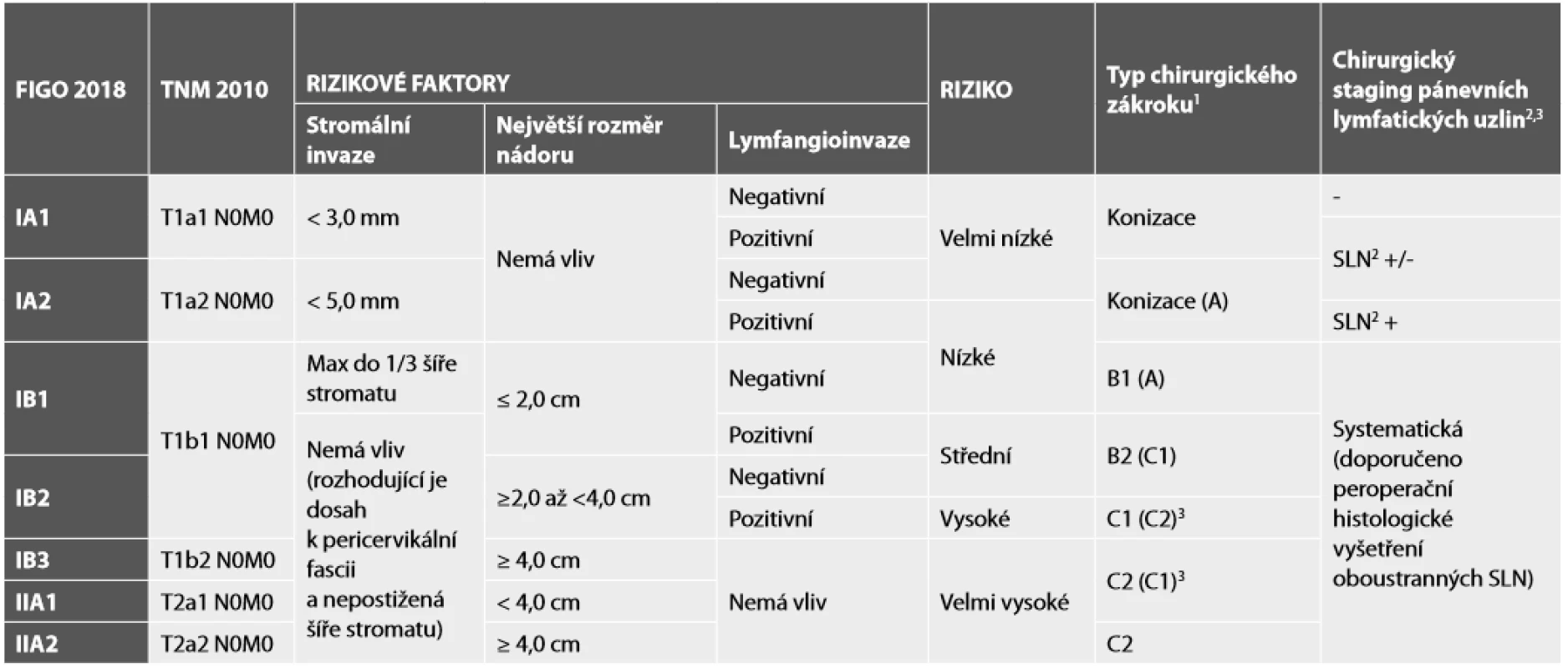
1Písmena značí typ radikální hysterektomie na základě klasifikace podle Querleu-Morrow (9). V závorce je uveden akceptovatelný alternativní chirurgický výkon.
2SLN – sentinelové lymfatické uzliny, minimálně by měla být získána jedna uzlina z obou polovin pánve
3V případě velkého (bulky) tumoru je možné provést nerve-sparing hysterektomii C1, pouze pokud není dosah tumoru k pericervikální fascii. Podle nálezu lze výkon i stranově kombinovat (např. vlevo C1 a vpravo C2)Management léčby by měl být individualizován na základě věku, přání otěhotnět a přítomnosti lymfovaskulární invaze (LVSI). Konizace je ve stadiu IA dostatečným chirurgickým zákrokem (Tab. 2). Hysterektomie může být provedena, ale nezlepšuje onkologické výsledky. V případě přítomnosti prekurzorové léze (HSIL, AIS, SMILE) je povinné zmínit přítomnost i této léze v resekčním okraji a je doporučeno uvést přesný údaj o minimální vzdálenosti léze od okraje (8). Totéž platí i u popisu invazivního nádoru. Vyšetření lymfatických uzlin může být provedeno ve stadiu IA1 při přítomnosti LVSI a ve stadiu IA2 bez LVSI, ale mělo by být provedeno ve stadiu IA2 s LVSI. Oboustranná biopsie sentinelové lymfatické uzliny (SLN) je dostatečnou metodou (Tab. 2) (7).
STADIUM IB
Nádor je omezen na dělohu, šíření z hrdla do těla děložního nemá na staging vliv. Stadium IB zahrnuje tumory s hloubkou invaze 5,0 mm a více, ale nově se dělí na 3 substadia, novinkou je další členění pro tumory v největším rozměru 2,0 cm nebo méně (Tab. 1) (6). Cílem léčby je nekombinovat radikální hysterektomii (odstranění dělohy včetně závěsného aparátu - parametrií) a radioterapii, protože kombinace obou modalit výrazně zvyšuje morbiditu pacientky. Radikální chirurgická léčba je preferována, typ radikální hysterektomie je indikován na základě přítomnosti rizikových faktorů, které většinou stanovuje histopatolog (Tab 2). Typy radikálních hysterektomií zobrazuje tabulka 3 (9). U stadia IB1 (rozměr do 2 cm) a histologicky méně agresivních nádorů (skvamózní, adenoskvamózní nebo adenokarcinom obvyklého typu) je možné provést fertilitu zachovávající operaci (trachelektomie) (7). Při histologickém vyšetření se kromě vlastní velikosti nádoru posuzuje lokalizace nádoru, vztah k chirurgickým resekčním okrajům, vztah k okolním anatomickým strukturám (poševní manžeta, parametria), postižení dolního děložního segmentu a děložního těla (7,8). V případě hodnocení vzorků z více chirurgických zákroků (předchozí konizace, rekonizace, trachelektomie) by měla být zohledněna velikost nádoru v předchozím preparátu při určení celkové velikosti nádoru. Toto nabývá obzvláště na významu, pokud jsou jednotlivé preparáty odeslány do různých histopatologických laboratoři (7). U velkých nádorů by měl být histologicky zpracován minimálně 1 blok na 1 cm největšího rozměru tumoru, v případě malých nádorů by mělo být vyšetřeno celé děložní hrdlo (7). Kromě měření rozměrů děložního hrdla je potřeba také změřit minimální a maximální délku poševní manžety (je-li přítomna) (8). Rozměr parametrií by měl být zaznamenán ve dvou rozměrech a parametria by měla být kompletně histologicky vyšetřena. Při průkazu postižení lymfatických uzlin, invaze do parametrií a/nebo dosahu nádoru k chirurgickému okraji preparátu z definitivního histologického vyšetření je indikována adjuvantní chemoradioterapie (7).
Tab. 3. Typy radikální hysterektomie na základě klasifikace podle Querleu-Morrow (9). 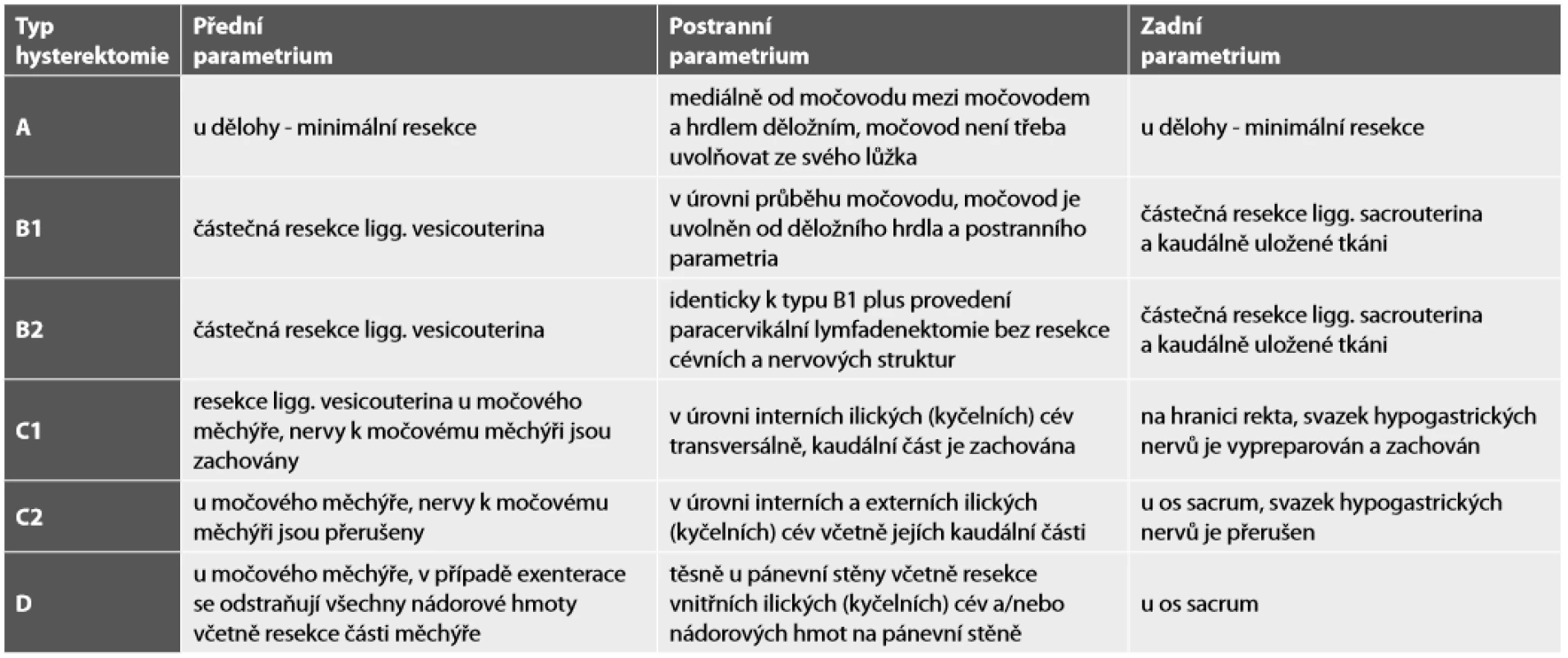
Pozn.: Typ hysterektomie A odpovídá tzv. extrafasciální hysterektomii. Standardem chirurgického stagingu je systematická pánevní lymfadenektomie, ale peroperační a následné podrobné definitivní histologické vyšetření sentinelové lymfatické uzliny (SLN) z obou stran pánve je doporučeno. Při peroperačním zjištění postižení SLN se mění stadium onemocnění, operace by měla být přerušena a pacientka odeslána k primární chemoradioterapii. Je ale možné provést paraaortální lymfadenektomii alespoň do úrovně odstupu a. mesenterica inferior k upřesnění stadia (IIIC1 vs. IIIC2). Peroperační histologické vyšetření SLN (může být více uzlin než jedna z každé strany) je vždy kompromisem mezi přesností na straně jedné a časovým faktorem s potenciální ztrátou materiálu pro detailní definitivní histologické vyšetření na straně druhé. SLN by měla být opatrně oddisekována z okolního tuku a vyšetřena ve 1 – 2 řezech. V případě zvětšené postižené SLN je dostačující jeden řez a okolní tuková tkáň by měla být zachována ke zhodnocení extrakapsulárního šíření (10).
Všechny LN získané z operace by měly být odeslány k histologickému vyšetření (7). Stav lymfatických uzlin je u pacientek s karcinomem děložního hrdla jeden z nejvýznamnějších prognostických faktorů. Povinné parametry při hodnocení lymfatických uzlin zahrnují jejich počet, lokalizaci a počet pozitivních uzlin v jednotlivých lokalitách. Velikost metastáz a extrakapsulární šíření jsou nepovinné údaje (8). Při nálezu makroskopicky postižené LN je dostatečným postupem provést reprezentativní řez z uzliny k histologickému vyšetření. V případě makroskopicky nesuspektních LN by každá uzlina měla být vyšetřena v řezech po 2 mm a každý blok obarven hematoxylin-eosinem a histologicky vyšetřen (7).
STADIUM II
Nádor se šíří mimo dělohu bez šíření ke stěně pánevní či do dolní třetiny pochvy. Stadium II zůstává beze změny (6). Léčba stadia IIA (pokud je šíření pouze do horní třetiny pochvy) je většinou primárně chirurgická (Tab. 2) se stejnými požadavky na histopatologické vyšetření jako u stadia IB. Neoadjuvantní chemoterapie v případě velkých bulky tumorů s rozměrem nad 4 cm není před chirurgickým výkonem doporučena, nemění prognózu onemocnění (7). Léčba stadia IIB (šíření do parametrií přes pericervikální fascii) je založena na primární chemoterapii a konkomitantní brachy - a teleradioterapii. Radikální chirurgie je určitou alternativou u pacientek s iniciální invazí tumoru do parametrií a je vyhrazena jen zkušeným operačním týmům. Kvalita chirurgického výkonu včetně resekce parametrií je zásadní. Je doporučeno peroperační histologické zhodnocení SLN a v případě jejího postižení operaci ukončit a pacientku odeslat k primární chemoradioterapii. Paraaortální lymfadenektomie alespoň do úrovně odstupu a. mesenterica inferior může být provedena k chirurgické verifikaci stadia a určení rozsahu ozařovacího pole (7).
STADIUM III
Nádor se šíří ke stěně pánevní a/nebo postihuje dolní třetinu pochvy a/nebo způsobuje hydronefrózu či afunkci ledviny a/nebo jsou postiženy pánevní lymfatické uzliny a/nebo paraaortální lymfatické uzliny. Průkaz hydronefrózy nebo afunkční ledviny řadí onemocnění minimálně do stadia IIIB bez ohledu na další konsekvence. Podobně postižení pánevních nebo paraaortálních (suprapánevních) lymfatických uzlin (LN) řadí onemocnění do stadia IIIC (6). Novinkou je vytvoření substadií IIIC1 (postižení pouze pánevních LN, tzn. paracervikální; parametriální; obturatorní,ilické zevní, vnitřní (hypogastrické) a společné; presakrální; laterální sakrální) a IIIC2 (postižení paraaortálních LN). V předchozím stagingovém systému bylo postižení paraaortálních LN klasifikováno jako vzdálená metastáza a bylo řazeno do stadia IVB. Při označení stadia IIIC by se měla uvádět metoda průkazu postižení LN přidáním písmene „r“ v případě zobrazovací metody a písmene „p“ v případě chirurgického (patologického) stagingu (např. IIIC2r nebo IIIC2p). Vždy by měla být uvedena technika zobrazovací metody nebo patologického vyšetření, v případě nejasností se uvádí nižší stadium (6).
U pacientek ve stadiu III je léčebnou metodou první volby primární konkomitantní chemoterapie a kombinovaná radioterapie (brachyterapie a zevní radioterapie). V případě postižení paraaortálních lymfatických uzlin se ozařuje i tato oblast včetně odstupu renálních žil. Paraaortální lymfadenektomie alespoň do úrovně odstupu a. mesenterica inferior může být provedena k chirurgické verifikaci stadia a určení rozsahu ozařovacího pole. Chirurgické odstranění zvětšených lymfatických uzlin v pánvi může být bráno v úvahu jako alternativa v rámci debulkingu onemocnění (7).
STADIUM IV
Nádor postihuje sliznici močového měchýře nebo rekta a/nebo se šíří mimo malou pánev. Stadium IV zůstává beze změny. Pro průkaz stadia IVA (postižení sliznice močového měchýře nebo rekta) je podle doporučení FIGO nutné histologické ověření (6). Potenciální šíření nádoru mimo dělohu by mělo být biopticky ověřeno pomocí biopsie tlustou jehlou (Tru-Cut). Metodika tohoto zákroku byla v české literatuře již popsána (11). U pacientek ve stadiu IVA je léčebnou metodou první volby zevní radioterapie či chemoradioterapie, brachyterapie není indikována vzhledem k vysokému riziku vzniku vesikovaginální nebo rektovaginální píštěle. Ve vybraných případech může být určitou alternativou chirurgická exenterace pánve u pacientek bez postižení lymfatických uzlin (T4 N0 M0). Biologická léčba bevacizumabem jako doplněk standardní chemotherapie je doporučena u pacientek s dobrým performance status v pokročilých stadiích. Paliativní radioterapie je indikována v případě vaginálního krvácení nebo pánevní bolesti zvláště u pacientek, které ještě nebyly ozářeny (7).
DISKUZE
Mezi hlavní cíle dobrého stagingového systému patří stanovit odhad prognózy onemocnění, usnadnit plánování terapie a umožnit výměnu relevantních informací mezi onkologickými centry celého světa (např. srovnání účinnosti rozdílných léčebných postupů) (12). První stagingový systém gynekologických nádorů byl vypracován pro karcinom děložního hrdla na přelomu 20. století, od té doby prošel 9 revizemi. Pacientky s karcinomem děložního hrdla by měly být primárně klasifikovány podle TNM systému, ale FIGO staging by měl být vždy také uveden (7). V současnosti FIGO striktně nedoporučuje žádnou zobrazovací metodu a konečné stadium by mělo být určeno až na základě výsledku všech vyšetření (6). Chirurgický (patologický) staging je významně přesnější než klinický určený na základě zobrazovacích metod. Např. v randomizované studii chirurgický staging s histologickým vyšetřením lymfatických uzlin zhoršil stadium (up-staging) u 33 % pacientek s pokročilým nádorem (IIB - IV) ve srovnání s radiologickým stagingem (13).
Postupy ESGO-ESTRO-ESP doporučují detekovat a odeslat SLN na peroperační histologické vyšetření (frozen section) jako první krok u primárně operabilních nádorů a podle výsledku indikovat pacientky k primární operaci nebo primární chemoradioterapii (7). Bohužel peroperační histologické vyšetření SLN není v průkazu metastáz příliš senzitivní (14-18). Metastázy v LN jsou definovány jako tumorózní hmoty rozměru nad 2,0 mm (MAC) a mikrometastázy jako nádorová infiltrace velikosti 0,2 – 2,0 mm (MIC). Ložiska v LN pod 0,2 mm jsou uváděny jako izolované nádorové buňky (ITC), které je možno diagnostikovat i ze základního barvení, ale imunohistochemické vyšetření jejich průkaz výrazně usnadní (počet buněk není definován) (8,14).
V prvotních datech studie SENTICOL nebyly zachyceny peroperačně metastázy v 15 z 20 případů pozitivních uzlin (z toho 3x MAC) (15). Také v kanadské studii na 211 pacientkách celkem u 10 ze 13 pacientek s pozitivními SLN (1x MAC) nebyl nádor histologicky peroperačně v SLN zachycen (16). V české studii na 225 pacientkách byla metastáza v SLN peroperačně detekována pouze u 39 ze 73 případů (8x MAC) (17). Významně lepší 89% senzitivitu zaznamenala pouze francouzská studie na 94 pacientkách (18).
Zatímco histopatologické vyšetření SLN fixované ve formolu a zalité v parafinu ideálně s ultrastagingem (prokrojení ve 4 úrovních po 200 μm či 250 μm a v každé úrovni se zhotovením řezu obarveného hematoxylin-eosinem a vyšetřeného s protilátkou proti cytokeratinům) je dnes již často standardním diagnostickým postupem, peroperační vyšetření SLN je dosud metodou experimentální s různou metodikou na různých pracovištích. Limitace vyšetření vyplývá z omezených možností prokrájení lymfatické uzliny při peroperačním histopatologickém protokolu a z potenciální ztráty materiálu pro následné definitivní zpracování (8,14). Na druhou stranu, histologické vyšetření SLN ultrastagingem zhodnotí přesněji stav lymfatických uzlin včetně záchytu MIC a ITC než systematická pánevní lymfadenektomie. Senzitiva záchytu nádorové infiltrace v pánevních uzlinách je při vyšetření SLN vysoká (10,19,20). Ve francouzské studii byla zjištěna 100% senzitiva záchytu a nebyl zaznamenán žádný falešně negativní záchyt při detekci SLN z obou stran pánve (19). Největší retrospektivní studie (645 pacientek) publikovala senzitivitu záchytu 91 % v celé kohortě a 97 % u pacientek se SLN z obou stran pánve. Kupodivu v 18 případech (2,8 %) byly SLN negativní, ale metastáza byla přítomna v jiné LN. U jiných 23 pacientek (3,6 %) s prokázanou MIC nebo ITC v SLN byly nalezeny metastázy v dalších pánevních LN (20).
Nález MAC i MIC v lymfatických uzlinách má vliv na prognózu onemocnění obdobný. Význam přítomnosti MIC zhodnotila studie na 83 pacientkách s negativními pánevními LN ze standardního histologického vyšetření. Retrospektivně byly všechny získané LN histologicky podrobně vyšetřeny technikou ultrastagingu. Přítomnost MIC byla odhalena jako nejvýznamnější rizikový faktor pro rekurenci onemocnění (OR = 11,73) ve srovnání s hloubkou stromální invaze (OR = 1,16), velikostí nádoru (OR = 4,42) a přítomností LVSI (OR =1,19) (21). Velikost metastázy v LN nemění staging a pravděpodobně ani prognózu onemocnění, ale je doporučeno tuto velikost udávat (8). Zatímco přítomnost MAC a MIC v LN je významným rizikovým faktorem, mají poměrně vzácné ITC dosud nejasný biologický potenciál a ITC se klasifikují v kategorii pN0(i+) (8,14). Vzhledem k raritním nálezům ITC a nejasnému prognostickému významu se u těchto pacientek doporučuje adjuvantní radioterapie ve stejném režimu jako u pacientek s MIC a MAC v lymfatických uzlinách (10).
Klinická praxe se pomalu mění od systematické pánevní lymfadenektomie k oboustranné biopsii SLN. Výhodou je snížení morbidity, možnost peroperačního histologického vyšetření a podrobného definitivního histologického vyšetření ultrastagingem, který odhalí postižení uzlin až u dalších 15 - 50 % pacientek (10). Předpokladem do budoucna v případě nahrazení systematické pánevní lymfadenektomie pouze vyšetřením SLN je nutnost standardizace protokolu pro histologický ultrastaging SLN a pouhé vyšetření SLN je v současnosti vyhrazeno pro klinické studie (SENTICOL III, SENTIX) (10). Zařazení vyšetření sentinelových lymfatických uzlin do stagingu může být dalším tématem k diskuzi.
Některé studie prokázaly, že měření objemu nádoru je parametr s vyšší výpovědní hodnotou než měření nádoru ve dvou rozměrech. Podle těchto studií časné nádory s objemem < 420 mm3 nejsou spojeny s metastázami do lymfatických uzlin. Tento parametr je používán spíše výjimečně a uvádění objemu nádoru není součástí stagingu ani standardního bioptického vyšetření (8). Ani nádorové postižení děložního těla nemění staging. Ukazuje se však, že má prognostický význam (zvýšené riziko postižení paraaortálních lymfatických uzlin a ovarií) a mělo by být popsáno (8). Výskyt extrapelvických metastáz (zejména v paraaortálních lymfatických uzlinách) se u pacientek s lokálně pokročilým onemocněním pohybuje v rozmezí 10 - 30 % (22). Paraaortální lymfadenektomie alespoň do úrovně odstupu a. mesenterica inferior může být u lokálně pokročilých nádorů s nesuspektními lymfatickými uzlinami provedena k chirurgické verifikace stadia (7).
Podle doporučení ICCR (International Collaboration on Cancer Reporting ) je určení gradingu nádoru pouze doporučený parametr, ale měl by být standardní součástí histologického vyšetření. Navíc v současnosti neexistuje jednotný a všeobecně akceptovaný systém, který by byl použitelný pro grading dlaždicobuněčných i adenokarcinomů a neexistuje ani žádné jednoznačné doporučení (8). Klinický význam gradingu nebyl jednoznačně prokázán a ani nemění na rozdíl od průkazu LVSI rozsah chirurgického zákroku (Tab. 2).
Změna s největším dopadem pro klinickou praxi je rozdělení stadia IB do 3 substadií (Tab. 1). Velikost tumoru patří spolu s hloubkou stromální invaze a přítomností LVSI k největším rizikovým faktorům. Nová definice stadia IB1 (největší rozměr do 2,0 cm) odráží výsledky recentních studií a také nové doporučené postupy ESGO-ESTRO-ESP (7). Recidivy nádorů s největším rozměrem 2,0 cm jsou signifikatně méně časté než u nádorů s největším rozměrem 2,0 – 4,0 cm (6,23,24). Pro nádory stadia IB1 bez dalších rizikových faktorů je neradikální operace bez resekce parametrií dostatečnou alternativou (7,23,24).
Tématem k diskuzi může být zařazení postižení ovarií do stagingového systému. Postižení ovarií se u časných stadií cervikálního karcinomu vyskytuje poměrně zřídka - v méně než 1 % případů dlaždicobuněčného a v méně než 5 % případů u ostatních histologických typů nádorů a je často spojeno s přítomností jiných rizikových faktorů. Zatím neexistují jednoznačně vypovídající data o vlivu postižení ovarií nádorem na dobu pětiletého přežití a v současnosti nemění stadium onemocnění (6).
ZÁVĚR
Účel stagingového systému je poskytnout klasifikaci šíření tumoru, aby jednotlivým stadiím odpovídaly určité modality terapie. Konečné stadium onemocnění musí být stanoveno na podkladě výsledků všech vyšetření (klinické, patologické, zobrazovací). Úloha patologa je při chirurgickém stagingu nezastupitelná. Změny ve stagingu FIGO budou v určité modifikované formě převzaty organizacemi UICC a AJCC do stagingového systému TNM, aby oba systémy byly co nejvíce identické. Absence vyšetření sentinelových uzlin odráží limity diagnostiky v řadě zemí zejména třetího světa a je námětem k dalším diskuzím.
Seznam zkratek
- A, B1, B2, C1, C2 – typ radikální hysterektomie na základě klasifikace podle Querleu-Morrow (9)
- AIS – adenocarcinoma in situ, cervikální žlazová intraepiteliání léze, žlazová prekanceróza
- AJCC – American Joint Committe on Cancer, Americký společný výbor pro malignity
- ESGO – European Society of Gynaecological Oncology, Evropská společnost pro gynekologickou onkologii
- ESP – European Society of Pathology, Evropská patologická společnost
- ESTRO – European Society for Radiotherapy and Oncology, Evropská společnost pro radioterapii a onkologii
- FIGO – Fédération Internationale de Gynécologie et d´Obstétrique, The International Federation of Gynecology and Obstetrics, Mezinárodní federace gynekologie a porodnictví
- HSIL – high grade squamous intraepithelial lesion, těžká skvamózní intraepiteliální léze
- ICCR – International Collaboration on Cancer Reporting
- ITC – isolated tumor cells, izolované nádorové buňky
- LN – lymph nodes, lymfatické uzliny
- LSIL – low grade squamous intraepithelial lesion, lehká skvamózní intraepiteliální léze
- LVSI – lymphatic vascular space invasion, nádorová lymfovaskulární invaze
- SCC – squamous cell carcinoma, dlaždicobuněčný karcinom
- SENTICOL – mezinárodní, randomizovaná multicentrická, zaslepená studie. Randomizuje pacientky s karcinomem hrdla dělohy ve stadiích IA1 s LVSI až IIA1 a s nerizikovým histiotypem a s peroperačně negativní histologií sentinelových uzlin do dvou stejně velkých skupin - pouze s odstraněním sentinelové uzliny a se systematickou pánevní lymfadenektomií. Sleduje frekvenci recidiv po dobu 3 let a porovnává kvalitu života v obou skupinách.
- SENTIX – SENTinel lymph node in cervIX cancer; prospektivní, multicentrická studie. Hodnotí, zda méně radikální chirurgie pouze s odstraněním sentinelové uzliny je non-inferiorní k chirurgické systematické pánevní lymfadenektomii. Sleduje frekvenci recidiv po dobu 7 let a posuzuje prevalenci lymfedému dolních končetin.
- SLN – sentinel lymph node, sentinelová lymfatická uzlina
- SMILE – Stratified Mucin-producing Intraepithelial LEsion, stratifikovaná mucin produkující intraepiteliální léze (premaligní léze s překryvnými rysy mezi dlaždicobuněčnou a žlázovou lézí)
- TNM – tumor-node-metastasis, klasifikační systém zhoubných nádorů
- TRU-CUT (core-cut) – biopsie tlustou jehlou
- UICC – International Union Against Cancer, Mezinárodní výbor proti rakovině
PODĚKOVÁNÍ
Práce byla podpořena projektem UNCE 204065 Karlovy Univerzity.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
as. MUDr. Borek Sehnal, Ph.D.
Gynekologicko-porodnická klinika 1. LF UK
Nemocnice Na Bulovce
Budínova 2, 180 81 Praha 8
Tel. 604 270 364
e-mail: boreksehnal@seznam.cz
Zdroje
- Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of cancer incidence and mortality for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68, 394–424.
- Svod.cz [internetova stranka]. Český národní webový portál epidemiologie nádorů. Systém pro vizualizaci onkologických dat. Institut biostatistiky a analýz Lékařské a Přírodovědecké fakulty Masarykovy univerzity (IBA MU). Dostupný z: http://www.svod.cz.
- Kinkorová Luňáčková I, Májek O. Karcinom děložního hrdla v ČR a možnosti jeho prevence. Česk Patol 2018; 63(4): 164-168.
- Sláma J. Současné limity prevence karcinomu děložního hrdla v České republice. Čes Gynek 2017; 82(6): 482-486.
- Ramirez PT, Frumovitz M, Pareja R, et al. Minimally Invasive versus Abdominal Radical Hysterectomy for Cervical Cancer. N Engl J Med 2018; 379(20): 1895-1904.
- Bhatla N, Berek JS, Cuello Fredes M, et al. Revised FIGO staging for carcinoma of the cervix uteri. Int J Gynaecol Obstet 2019; 145(1): 129-135.
- Cibula D, Pötter R, Planchamp F, et al. The European Society of Gynaecological Oncology/European Society for Radiotherapy and Oncology/European Society of Pathology guidelines for the management of patients with cervical cancer. Virchows Arch 2018; 472(6): 919-936.
- Dundr P, Němejcová K. Prekancerózy a karcinomy děložního hrdla. Doporučený postup pro bioptické vyšetření. Společnost českých patologů 2018, 1 - 20. Dostupné z: http://www.patologie.info/standardy/
- Querleu D, Cibula D, Abu-Rustum NR. 2017 Update on the Querleu-Morrow Classification of Radical Hysterectomy. Ann Surg Oncol 2017; 24(11): 3406-3412.
- Cibula D, McCluggage WG. Sentinel lymph node (SLN) concept in cervical cancer: Current limitations and unanswered questions. Gynecol Oncol 2019; 152(1): 202-207.
- Zikán M. Volba vhodné bioptické metody u primárně inoperabilního nebo recidivujícího zhoubného nádoru a metodika bioptického odběru. Čes Gynek 2014; 79(6): 487-90.
- Sehnal B, Driák D, Kmoníčková E, et al. Současná klasifikace zhoubných nádorů v onkogynekologii – část I. Čes Gynek 2011; 76 (4): 279-284.
- Tsunoda AT, Marnitz S, Soares Nunes J, et al. Incidence of Histologically Proven Pelvic and Para-Aortic Lymph Node Metastases and Rate of Upstaging in Patients with Locally Advanced Cervical Cancer: Results of a Prospective Randomized Trial. Oncology 2017; 92(4): 213-220.
- Škapa P, Pluta M. Peroperační biopsie v gynekopatologii. Česk Patol 2018; 54(3): 105-118.
- Lecuru FR, McCormack M, Hillemanns P, et al. SENTICOL III: an international validation study of sentinel node biopsy in early cervical cancer. A GINECO, ENGOT, GCIG and multicenter study. Int J Gynecol Cancer 2019; pii: ijgc-2019-000332.
- Roy M, Bouchard-Fortier G, Popa I, et al. Value of sentinel node mapping in cancer of the cervix. Gynecol Oncol 2011; 122(2): 269-274.
- Slama J, Dundr P, Dusek L, Cibula D. High false negative rate of frozen section examination of sentinel lymph nodes in patients with cervical cancer. Gynecol Oncol 2013; 129(2): 384–388.
- Martínez A, Mery E, Filleron T, Boileau L, Ferron G, Querleu D. Accuracy of intraoperative pathological examination of SLN in cervical cancer. Gynecol Oncol 2013; 130(3): 525–529.
- Brar H, Hogen L, Covens A. Cost-effectiveness of sentinel node biopsy and pathological ultrastaging in patients with early-stage cervical cancer. Cancer 2017; 123(10): 1751–1759.
- Cibula D, Abu-Rustum NR, Dusek L, et al. Bilateral ultrastaging of sentinel lymph node in cervical cancer: lowering the false-negative rate and improving the detection of micrometastasis. Gynecol Oncol 2012; 127(3): 462–466.
- Colturato LF, Signorini Filho RC, Fernandes RC, Gebrim LH, Oliani AH. Lymph node micrometastases in initial stage cervical cancer and tumoral recurrence. Int J Gynaecol Obstet 2016;133(1): 69-75.
- Fischerová D, Cibula D. Role ultrazvuku ve stagingu zhoubného nádoru děložního hrdla (doporučení Evropské onkologické, radiační, a patologické společnosti). Čes Gynek 2019; 84(1): 40–48.
- Baiocchi G, de Brot L, Faloppa CC, et al. Is parametrectomy always necessary in early-stage cervical cancer? Gynecol Oncol 2017; 146(1): 16-19.
- Sláma J, Černý A, Dušek L, et al. Results of less radical fertility-sparing procedures with omitted parametrectomy for cervical cancer: 5 years of experience. Gynecol Oncol 2016; 142(3): 401-404.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2020 Číslo 1-
Všechny články tohoto čísla
- Prof. MUDr. Zdeňka Vernerová, CSc.
- Novinky v klinické diagnostice ischemické choroby srdeční a aktuální doporučené terapeutické postupy
- Diferenciální diagnostika tumorózních lézí srdce
- Aktuální nomenklatura a histopatologická kritéria pro hodnocení nezánětlivých degenerativních onemocnění aorty
- Deset let redakční práce a změny do budoucna
- Echinococcus multilocularis: Diagnostický problém v punkční biopsii jater - kazuistika
- Vzácný podtyp papilárního renálního karcinomu (kazuistika)
- Úloha patologa v chirurgickém stagingu karcinomu děložního hrdla
- PŘEDSTAVUJEME NOVÉ EDITORY
- Rosai and Ackerman’s Surgical Pathology
- Prof. Dr. Leo Taussig - zapomenutý průkopník komplexní cytologie mozkomíšního moku
- Jessenius o srdci
- Spomienka na prof. MUDr. Štefana Kopeckého, PhD.
- Monitor aneb nemělo by Vám uniknout, že...
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika tumorózních lézí srdce
- PŘEDSTAVUJEME NOVÉ EDITORY
- Echinococcus multilocularis: Diagnostický problém v punkční biopsii jater - kazuistika
- Novinky v klinické diagnostice ischemické choroby srdeční a aktuální doporučené terapeutické postupy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



