-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diferenciální diagnostika tumorózních lézí srdce
Differential diagnosis of heart tumours
Cardiac tumours represent a wide spectrum of neoplastic and non-neoplastic masses. Plenty of them, especially primary cardiac neoplasias, are rare diseases. Last revision of WHO classification introduced several changes in their histopathological assessment. Furthermore, an increasing amount of knowledge in molecular characteristics of the tumours bolstered discussion about the classification of primary cardiac sarcomas and primary intimal sarcoma of the heart became a hot topic of last years.
This work aims at individual neoplastic and non-neoplastic cardiac tumours with focus at their characteristic histopathological features and main differential diagnoses.
Keywords:
differential diagnosis – cardiac tumours – primary intimal sarcoma of the heart
Autoři: Adéla Matějková 1; Ondřej Fabián 2
Působiště autorů: Fingerlandův ústav patologie LF UK a FN, Hradec Králové 1; Ústav patologie a molekulární medicíny 2. LF UK a FN Motol, Praha 2
Vyšlo v časopise: Čes.-slov. Patol., 56, 2020, No. 1, p. 18-25
Kategorie: Přehledový článek
Souhrn
Tumorózní léze srdce zahrnují pestrou paletu nádorových i nenádorových afekcí. Vzácnými jsou zejména primární nádory srdce v jejichž hodnocení bylo provedeno při poslední revizi WHO klasifikace několik změn. Rozšíření znalostí v oblasti molekulárních charakteristik nádorů rozvířilo diskuzi ohledně klasifikace některých srdečních sarkomů. Do popředí zájmu se dostal především primární intimální sarkom srdce.
Tento přehledový článek se věnuje jednotlivým nádorovým i nenádorovým lézím se zaměřením na popis jejich charakteristických znaků a základní diferenciální diagnostiku.
Klíčová slova:
diferenciálna diagnóza
Nádorová onemocnění srdce, obzvláště pokud máme na mysli primární nádorová onemocnění, jsou velmi vzácná. Jejich diagnostika a léčba se dočkaly většího rozmachu až v polovině 20. století v souvislosti s rozvojem kardiochirurgických metod, především možnosti operovat na otevřeném srdci za užití mimotělního oběhu, a zdokonalením zobrazovacích metod jako je ultrazvukové vyšetření (UZ), počítačová tomografie (CT) a magnetická resonance (MRI). V současné době je většina tumorózních lézí v srdci odhalena na základě neinvazivního zobrazovacího vyšetření, i když část stále zůstává náhodným nálezem při operaci srdce z jiného důvodu či při sekci.
V srdci se můžeme setkat s pravými nádory, benigními i maligními, i s řadou nenádorových tumorózních lézí (tromby, vegetacemi či kalcifikacemi), které mohou nádorová onemocnění imitovat (1,2). Hodnocení nádorů srdce vychází z poslední verze WHO klasifikace z roku 2015, v rámci které bylo oproti předchozím verzím provedeno několik změn. Ve shodě s obecným trendem hodnocení měkkotkáňových nádorů přestalo být užíváno označení maligní fibrózní histiocytom jako synonymum pro nediferencovaný pleomorfní sarkom; naproti tomu výhradně v rámci WHO klasifikace nádorů srdce přestal být epiteloidní hemangioendoteliom samostatnou jednotkou a je nově uváděn jako výrazně vzácnější nízce maligní varianta angiosarkomu; kromě toho začaly být znovu užívány pojmy osteosarkom a myxofibrosarkom jako samostatné podtypy srdečních sarkomů. Dále byly rozšířeny znalosti molekulárních charakteristik mnoha srdečních nádorů a rozvířila se diskuze ohledně existence primárních intimálních sarkomů srdce (1,2).
Primární nádorová onemocnění srdce se vyskytují s četností 0,001-0,3 %. Prevalence primárních nádorů je minimálně 100x nižší než výskyt sekundárních nádorů v této oblasti (3). Srdeční nádory mohou být odhaleny i náhodně při screeningovém UZ vyšetření již během fetálního života, a to s četností 0,14 % (4,5).
V České republice se incidence zhoubných nádorů srdce a mezihrudí dle údajů Ústavu zdravotnických informací a statistiky České republiky dlouhodobě pohybuje pod 1 případem na 100 tis. obyvatel. V roce 2016 bylo v celé republice zaznamenáno asi 80 případů.
Dle různých zdrojů jsou z primárních nádorů srdce více než tři čtvrtiny (70-90 %) benigních (1,6-8). U dětí i dospělých je prevalence srdečních nádorů srovnatelná, liší se však svým spektrem (4,5). Benigních lézí je v dětském věku téměř 90 %, přičemž nejčastěji zastoupenými tumory jsou rhabdomyom a fibrom, u plodů pak teratom (9). U dospělých se z benigních tumorů nejčastěji vyskytují myxomy, následované papilárními fibroelastomy, jejichž incidence v posledních letech relativně narostla (pravděpodobně se však jedná pouze o zdánlivý nárůst vycházející z přesnější a dostupnější diagnostiky). Někteří autoři dokonce uvažují, že by fibroelastomy mohly být nejpočetnějšími benigními tumory srdce. Vycházejí ze skutečnosti, že jsou obvykle asymptomatické, a tudíž unikají pozornosti (6,10).
Naprostou většinu primárních maligních nádorů srdce představují sarkomy. U dospělých jsou nejvíce zastoupeny nediferencované pleomorfní sarkomy a angiosarkomy. V posledních letech se také více hovoří o primárních intimálních (vřetenobuněčných) sarkomech srdce, které bývají řazeny do skupiny nediferencovaných sarkomů. V mladším dětském věku jsou nejčastějšími malignitami rhabdomyosarkomy a u adolescentů nezralé teratomy (2).
KLINICKÁ PREZENTACE A TERAPIE SRDEČNÍCH LÉZÍ
Klinické projevy srdečních lézí se odvíjejí od jejich velikosti, lokalizace, charakteru růstu a konsistence, se kterou souvisí i sklon k případné embolizaci. Nitrodutinově rostoucí afekce se mohou manifestovat obstrukcí, embolizací či systémovými příznaky. Dopady jsou dle lokalizace léze v oblasti velkého či malého oběhu. Nespecifické systémové příznaky bývají popisovány jak u osob s maligními lézemi, tak například u osob s myxomy. Zahrnují únavu, horečku, úbytek hmotnosti a bolesti kloubů. Často se současně vyskytuje anémie, zvýšené hladiny imunoglobulinů či Raynaudův fenomén (v souvislosti s uvolněním cytokinů). Intramurálně rostoucí tumory se mohou projevit převodními poruchami s možnými fatálními následky. Prezentovat se takto mohou i benigní léze, např. fibromy či cystický tumor AV uzlu (1).
Další poměrně častou klinickou manifestací srdečních nádorů je tvorba perikardiálního výpotku. Vyskytnout se může jak u benigní tak u maligní léze. Výpotek hemoragického charakteru svědčí spíše pro malignitu. Vzácně může být první manifestací nádorového postižení i srdeční tamponáda. U rozsáhle nekrotických nádorů byla popsána i ruptura srdeční stěny (1).
Léčba srdečních nádorů spočívá především v jejich resekci. Resekce se týká i většiny symptomatických benigních lézí. Výjimku představují rhabdomyomy, neboť ty mají tendenci ke spontánní regresi, intramurální angiomy, které mohou dobře zareagovat na léčbu kortikoidy, a některé fibromy, konkrétně takové, u kterých není možná bezpečná resekce, ale je možné antiarytmiky zajistit kontrolu arytmií. Ve vzácných případech je indikována transplantace srdce. V případě maligních lézí může být u pokročilých nálezů chirurgický zákrok kombinován s chemoterapií či radioterapií. Primární srdeční lymfomy se léčí systémově. U nádorů exprimujících MDM2 je možné podání inhibitorů tyrosin kinázy a nízkomolekulárních antagonistů MDM2 (1,11).
NENÁDOROVÉ INTRAKARDIÁLNÍ LÉZE
Nejčastější intrakardiálně se vyskytující masou jsou tromby. Ty mohou být lokalizovány v síních i komorách, mohou být variabilně velké, přisedlé či stopkaté.Obzvláště z klinického hlediska může být při využití běžných zobrazovacích metod někdy obtížné odlišit trombus od pravého nádoru.
Jako pravé nádory mohou imponovat také vegetace při infekční endokarditidě. Vegetace bývají obvykle mobilní, nepravidelné, nacházejí se nejčastěji na síňové části atrioventrikulárních chlopní a komorové ploše poloměsíčitých chlopní, vzácně na nástěnném endokardu. I jiné intrakardiálně se vyskytující zánětlivé infekční léze mohou imitovat nádorovou masu, jedná se především o mykotické afekce jako je aspergilom či postižení v rámci TBC v podobě intramyokardiálního či perikardiálního tuberkulomu. Setkáváme se s nimi velmi vzácně, obvykle u osob imunosuprimovaných (1).
Další skupinu afekcí představují kalcifikované léze. Kalcifikovaný amorfní tumor je nenádorovou srdeční masou, která může vyrůst z kteréhokoliv srdečního oddílu. Představuje nodulární kalcifikaci, která může vzniknout v rámci reakce na předchozí infekci nebo organizací trombu (1). Jedná se o velmi vzácnou lézi, které bylo popsáno několik desítek. Afekce může především makroskopicky a na zobrazovacích vyšetřeních imitovat nádorovou masu, a to jak z benigního spektra (např. výrazně regresivně změněný, kalcifikovaný a nekrotický myxom), tak i maligního původu (především osteosarkom). Z nenádorových lézí může obdobný obraz vyvolat masivní kalcifikace v oblasti anulu mitrální chlopně, se kterou se setkáváme především v jeho zadní části v rámci degenerativních změn chlopně provázených dystrofickou kalcifikací.
V širším slova smyslu je možné mezi kardiovaskulární pseudoneoplázie zahrnout také ektopickou štítnou žlázu, bronchogenní cysty, perikardiální cysty či MICE (mesothelial/monocytic incidental cardiac excrescences) – pravděpodobně reaktivní lézi vznikající v souvislosti s předchozí intervencí v perikardiálním vaku (1). Často jsou odhaleny náhodně při zobrazovacím vyšetření hrudníku z jiného důvodu. V případě jejich zastižení má význam především vyloučení mesenchymální maligní léze. Elegantním je kromě zhodnocení morfologie také využití imunohistochemického průkazu mezoteliálních markerů (WT1, vimentin, calretinin) a pro odlišení benigní mezoteliální proliferace pozitivita BAP1 (12).
SRDEČNÍ NÁDORY V PEDIATRII
Nádory srdce jsou v dětství velmi vzácné. Nezhoubné léze mívají často atypické klinické projevy a v případě jejich resekce hrozí riziko rekurence (nejčastěji u myxomů a teratomů). Primární zhoubné nádory bývají diagnostikovány až v pozdních stádiích, v době generalizace, a mají tudíž velmi nepříznivou prognózu (4). Necelá pětina nádorů je diagnostikována již prenatálně, klinicky se mohou manifestovat arytmiemi plodu, městnavým srdečním selháváním a/nebo hydropsem plodu. Čtvrtina pacientů je operovaných před prvním rokem života. Metastatické postižení srdce je u dětí významně méně časté než u dospělých, přesto je i u dětí sekundární nádorové postižení srdce výrazně častější než primární srdeční nádory, a to deseti až dvacetinásobně. Do srdce nejčastěji metastazují sarkomy, lymfomy, nádory varlat a Wilmsův tumor (9).
Pediatrické srdeční nádory jsou častěji asociované s genetickými abnormitami. Asi u desetiny pacientů byla diagnostikována tuberózní skleróza. U části postižených byly současně přítomny vrozené srdečné vady (nejčastěji defekt komorového septa, perzistující ductus arteriosus a defekt septa síní). Nejčastějšími příznaky bývají dyspnoe a cyanóza, u části postižených se onemocnění projevuje vznikem šelestů, arytmiemi, či srdečním selháváním. Komorová tachykardie je typicky popisována u osob s fibromy, které vzhledem k charakteru růstu mohou vést až ke vzniku náhlé srdeční smrti. Typickou lokalizací srdečních nádorů je pravá komora následovaná levou komorou a síní (1,4).
Ve skupině dětí jsou nejčastějšími benigními tumory rhabdomyom a fibrom. Myxomy jsou u dětí významně méně časté než u dospělých, přičemž se vyskytují spíše u dětí starších. Nejčastějšími primárními maligními nádory jsou sarkomy, především rabdomyosarkomy a vzácné varianty teratomů (1,4). Srdeční nádory mohou především na zobrazovacích vyšetřeních imitovat léze jako tromby, perikardiální cysty, vrozené srdeční aneurysmata či divertikly.
Rhabdomyomy (obr. 1) jsou nejčastějšími tumory dětského věku, představují téměř dvě třetiny všech dětských srdečních tumorů. Jsou považovány spíše za hamartomy než za pravé nádory. Léze jsou ve většině případů (86 %) asociovány s tuberózní sklerózou a u 60 % pacientů s tuberózní sklerózou jsou přítomny srdeční rhabdomyomy. Jedná se o benigní léze, které rostou typicky intramurálně, v naprosté většině případů (90 %) bývají mnohočetné, dobře ohraničené, neopouzdřené. Mají tendenci spontánně regredovat, obzvláště u mladších dětí, což je zohledňováno v terapeutickém přístupu, kdy by nemělo být u asymptomatických pacientů přistupováno k resekci (2,10). Histopatologicky se jedná o dobře ohraničené uzly tvořené velkými modifikovanými kardiomyocyty, které mají centrálně lokalizovaná jádra a bohatou vakuolizovanou cytoplazmu s objemnými deposity glykogenu utlačujícími sarkoplazmu, která zůstává patrná jen v podobě tenkých sept, což propůjčuje buňkám charakteristický pavoukovitý vzhled (2,6).
Obr. 1. Obr. 1. A: Rhabdomyom srdce s přítomností pavoukovitých buněk (hematoxylin & eosin, 200x). B: Cytoplazmatická pozitivita glykogenu v nádorových buňkách (PAS, 200x). 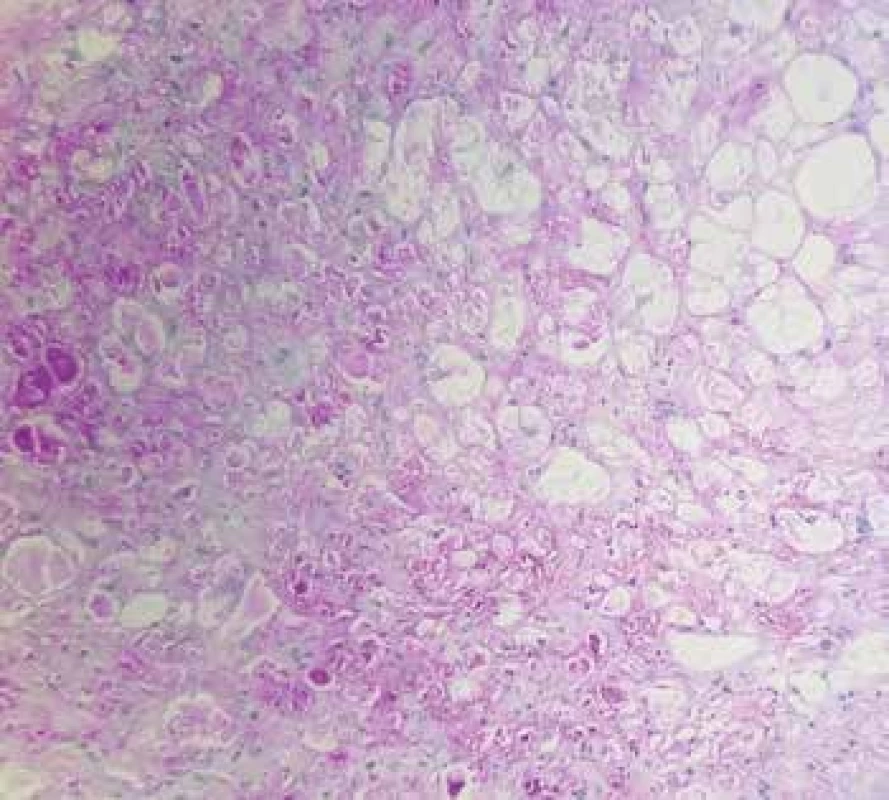
V rámci diferenciální diagnostiky rhabdomyomů by připadala v úvahu glykogenóza. Pro postižení srdce při glykogenóze je též charakteristická akumulace glykogenu v cytoplazmě kardiomyocytů, které jsou tak zvětšené, avšak ukládání glykogenu je více difuzní, buňky připomínají spíše rostlinná pletiva, nemají vzhled pro rhabdomyom typických pavoukovitých buněk. Navíc jde celkově o více difuzní proces, bez tvorby jasně ohraničených uzlů. Variabilně bývá přítomna intersticiální fibróza. Ve speciálním barvení PAS (Periodic Acid Schiff) v kombinaci s natrávení diastázou jsou abnormální glykogenová depozita, na rozdíl od glykogenu v rhabdomyomu, často diastáza resistentní. Dále bývají v diferenciální diagnostice zmiňovány fibromy, které bývají tužší, s kalcifikacemi a spíše solitární, bez pavoukovitých buněk; histiocytární kardiomyopatie, hamartom ze zralých kardiomyocytů či lokalizovaná nodulární hypertrofie srdce (2,13).
Druhými nejčastějšími nádory dětského věku jsou fibromy (obr. 2). Ty jsou typicky diagnostikovány v kojeneckém věku či prenatálně. Větší riziko výskytu srdečních fibromů je u pacientů s Gorlinovým syndromem. Bývají obvykle lokalizovány intramyokardiálně, častěji v levé komoře a na rozdíl od rhabdomyomů bývají solitární. Tvoří makroskopicky dobře ohraničené tuhé kulovité léze, avšak mikroskopicky bývají často hranice nádoru neostré a nezřídka se nádor infiltrativně šíří do okolního myokardu. Časté jsou pozitivní resekční okraje u resekátů. Mikroskopicky bývají srdeční fibromy fascikulárně stavěné, z vřetenitých buněk, fokálně mohou být přítomny myxoidní partie. Centrum tumoru bývá hyalinizované s kalcifikacemi. Diferenciální diagnostika zahrnuje rhabdomyom a myxom, vzhledem k možnému infiltrativnímu charakteru růstu také dobře diferencovaný fibrosarkom. Dále pak připadá v úvahu fibromatóza, u které by na rozdíl od fibromu byla patrná jaderná pozitivita beta-kateninu (14). Především klinicky mohou léze imitovat na zobrazovacích vyšetřeních hypertrofickou kardiomyopatii či septální komorovou hypertrofii. Vzhledem k velkému riziku vzniku fatálních arytmií a typicky solitárnímu výskytu je doporučována jejich resekce i u asymptomatických lézí (2,10).
Obr. 2. A, B: Srdeční fibrom tvořený fascikulárně rostoucími vřetenitými buňkami bez jaderných atypií a bez mitotické aktivity (hematoxylin & eosin, 100x, 200x). C: Okraj fibromu s patrným infiltrativním růstem do okolního myokardu (Massonův trichrom, 100x). 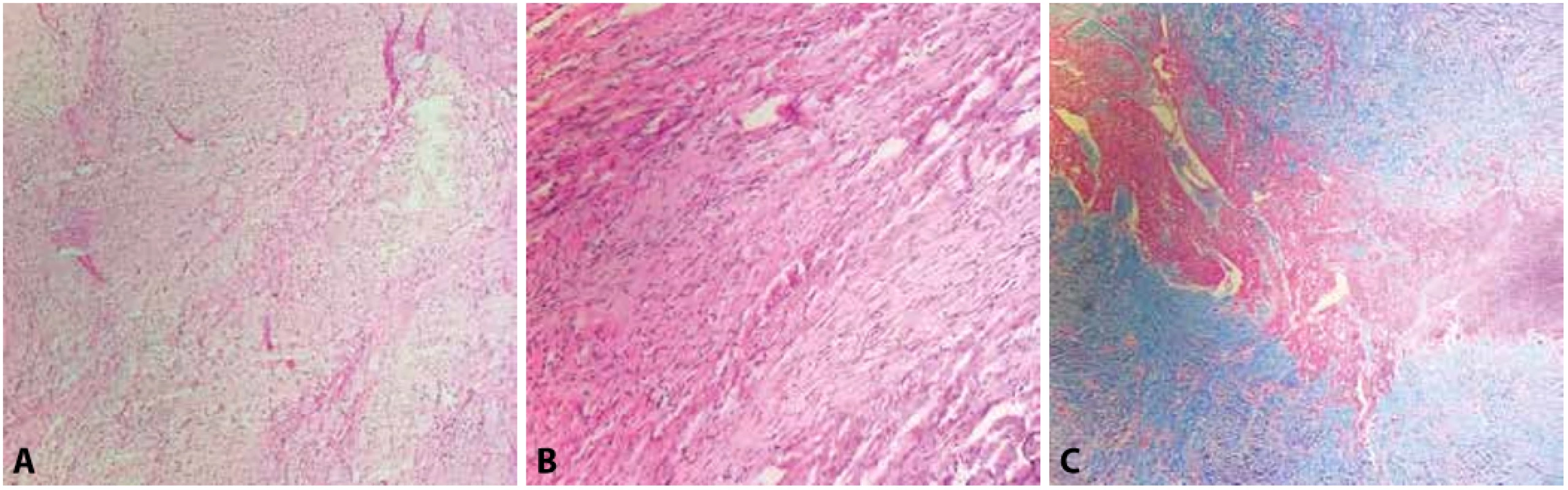
Tab. 1. Pomocné znaky pro rozlišení benigních a maligních primárních srdečních nádorů. 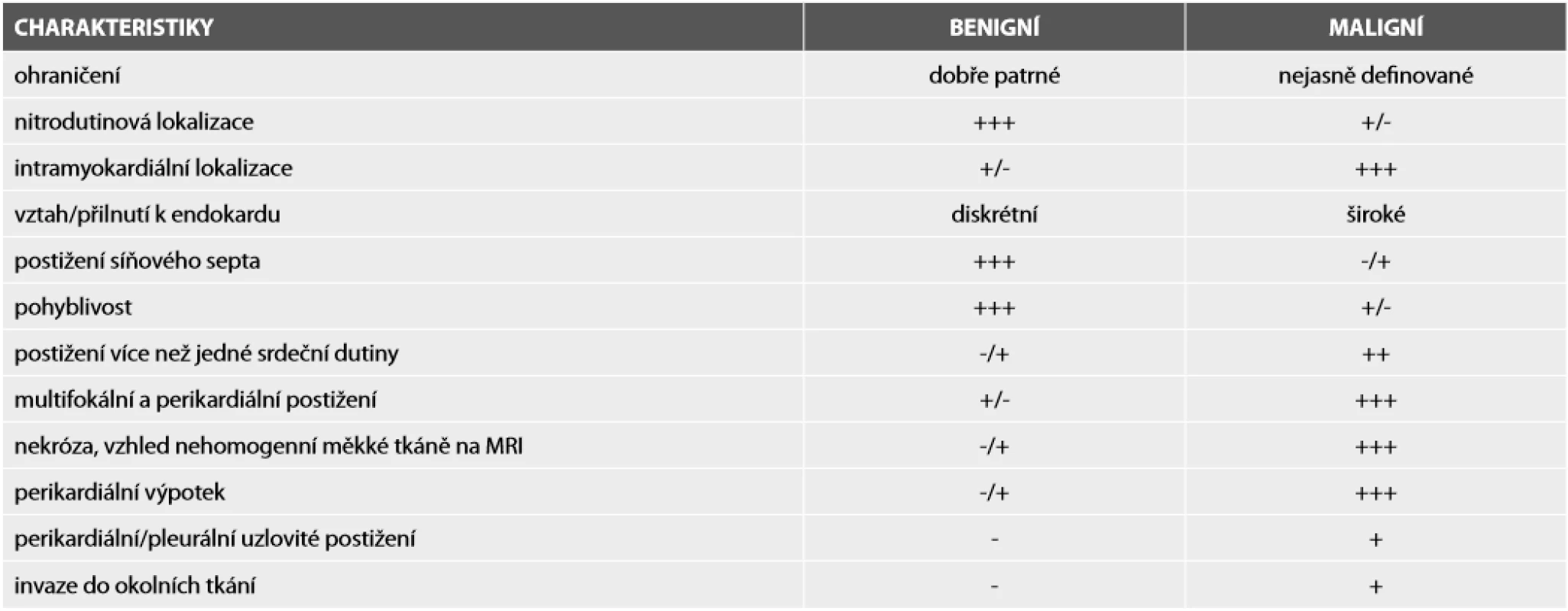
Spíše v dětství, byť byly jednotlivé případy zdokumentovány i u dospělých osob (8), se v srdci můžeme setkat také s inflamatorním myofibroblastickým tumorem (IMT), nádorem vyrůstajícím typicky v pravostranných srdečních oddílech z endokardiální oblasti, včetně cípů chlopní. IMT bývá lobulovaný, se širokou základnou, dobře vaskularizovaný, neopouzdřený, nepravidelně infiltrující okolní myokard. Představuje vzácný nádor mezenchymálního původu tvořený diferencovanými myofibroblasty a chronickým zánětlivým infiltrátem (makrofágy/histiocyty, plasmatické buňky a lymfocyty), ve kterém můžeme zastihnout i myxoidní partie. Bývá variabilně celulární s oblastmi tvořenými pruhy denzního kolagenního vaziva prostoupenými zánětlivou celulizací a hypercelulárními oblastmi s SMA a ALK1 pozitivními vřetenitými buňkami. Obvykle se tato léze vyskytuje v jiných lokalizacích, nejčastěji v plicích. Jedná se o afekce nejistého biologického potenciálu, většina se chová benigně, avšak byly popsány i případy lokální invaze a rekurence po resekci. (9).
Z primárních maligních nádorů se v dětském věku nejčastěji setkáváme se sarkomy, nejčastěji rhabdomyosarkomy, u starších dětí (typicky adolescentů) je nejčastější primární malignitou nezralý teratom. Primární lymfomy srdce jsou pro dětský věk raritní (9). O primárních maligních kardiálních lézích je pojednáno níže.
PRIMÁRNÍ SRDEČNÍ NÁDORY DOSPĚLÉHO VĚKU
Primární nádory srdce jsou vzácnou skupinou nádorových onemocnění. Naprostá většina primárních nádorů je benigních (70-90 %). V recentní studii Wanga a spol. tvořily benigní léze dokonce 94 % všech vyšetřených primárních nádorů (7).
Benigní primární srdeční nádory
Nejčastějšími benigními nádory dospělého věku jsou myxomy (obr. 3). Představují 40 % (8) až 90 % (7) všech benigních nádorů, tudíž jsou nejčastějšími primárními nádory srdce obecně. Vyskytují se nejčastěji v oblasti levé síně, v okolí fossa ovalis síňového septa. Maximum výskytu je ve 4. až 6. dekádě. Dvakrát častěji se vyskytují u žen než u mužů. Klinická prezentace myxomů může být velmi variabilní (viz klinická prezentace srdečních lézí), u větších lézí jsou běžné příznaky spojené s obstrukcí. U lézí vilózních a s bohatým myxoidním stromatem, které jsou křehčí, pak hrozí komplikace spojené s embolizací oddělených částí. Méně než 10 % srdečních myxomů je asociováno s Carneyovým komplexem. Podezření z Carneyova komplexu vyvstává především, jsou-li myxomy vícečetné a atypicky lokalizované a vyskytnou-li se u mladších osob. Obvykle se však jedná o solitární křehké polypovité tumory se širokou stopkou, vyklenující se do levé síně. Povrch bývá variabilně členitý, lobulovaný. Na řezu jsou typicky heterogenní, myxoidní až hlenovité, s tužšími okrsky, často ložiskově prokrvácené, vzácně se mohou vyskytnout i výraznější regresivní změny až charakteru nekróz, dystrofických kalcifikací či osifikací. Histopatologicky je nádor tvořený bohatým myxoidním stromatem s typickými diagnostickými hvězdicovitými buňkami, tzv. myxoma cells, ve skupinkách, pruzích či jednotlivě, které někdy tvořící prstenčité (vasoformativní) struktury okolo intratumorózních cév (2,7).
Obr. 3. A: Srdeční myxom s regresivními změnami (hemoragie, depozita hemosiderinu, fibrinoidní prosáknutí) a okrsky extramedulární hematopoézy (hematoxylin & eosin, 100x). B: Detail na hvězdicovité myxomové buňky (hematoxylin & eosin, 200x). 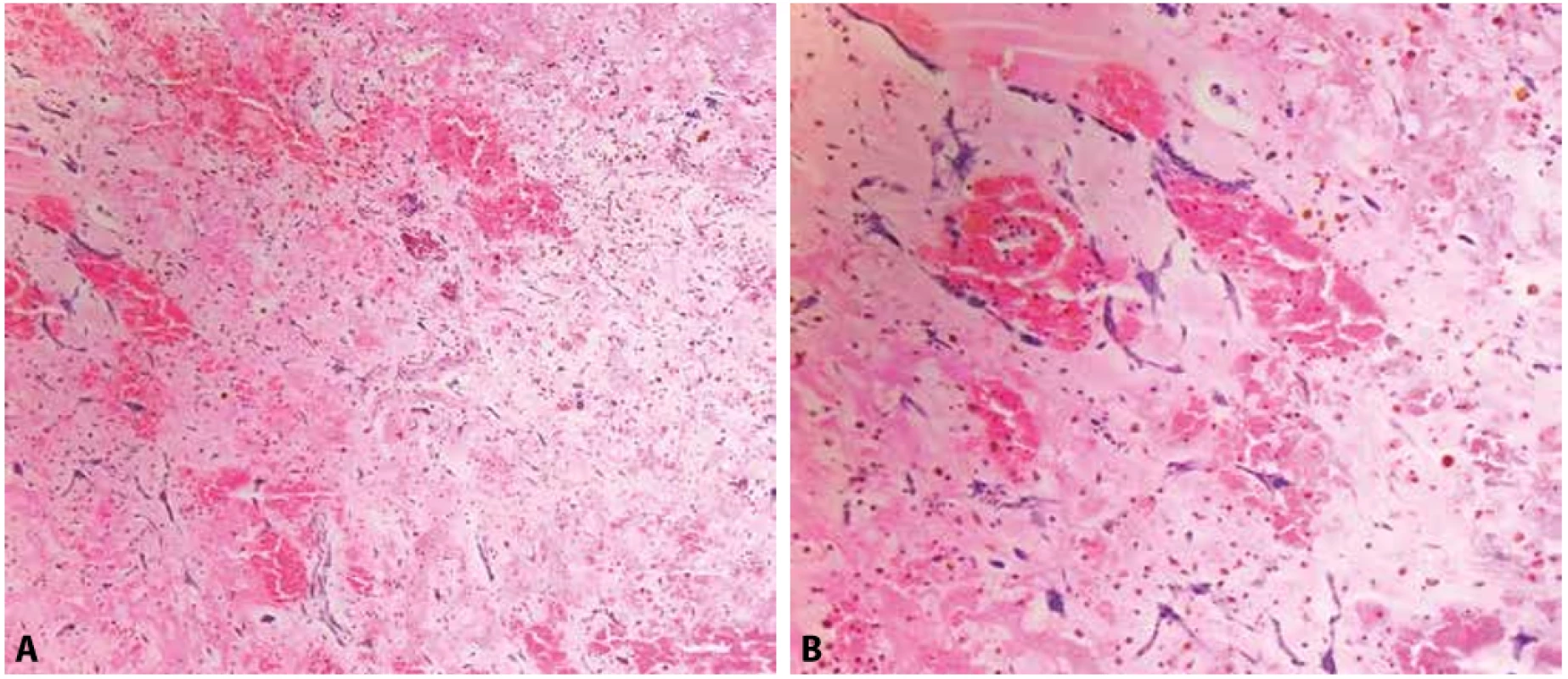
Makroskopicky i mikroskopicky mohou myxomy občas imitovat i jiné léze, a to jak benigní tak maligní (tabulka č. 2). Z benigních afekcí mohou například výrazně prokrvácené myxomy připomínat hemangiom, v kavernózním typu bývá často přítomno bohatší myxoidní stroma. Myxoidní partie se mohou nacházet i u inflamatorního myofibroblastického tumoru. Diagnostické rozpaky mohou vyvolat i obyčejné léze jako je trombóza, neboť těžce regresivně změněný, masivně prokrvácený myxom může být od trombu obtížně odlišitelný, i v něm ale nalezneme diagnostické myxoma cells. Ty jsou v naprosté většině případů pozitivní v imunohistochemickém průkazu kalretininu. Z maligních lézí je třeba diferenciálně diagnosticky odlišit především léze s myxoidními partiemi, jako jsou nediferencovaný pleomorfní sarkom, myxofibrosarkom, myxoidní liposarkom či chondrosarkom (2,6). V některých případech se můžeme v myxomu setkat i s prominujícími glandulárními strukturami, tyto léze tvoří méně než 3 % všech myxomů (15) a v takovém případě je vždy na místě zvážit a vyloučit možnost sekundární nádorové infiltrace adenokarcinomem (2,6). Předpokládá se, že žlázové struktury by mohly pocházet ze zavzatých reziduí předního střeva, anebo vznikat diferenciací totipotentních prekurzorů kardiomyocytů. Lokalizovány bývají při bazi nádoru, v blízkosti atriálního septa, avšak neměly by infiltrovat do myokardu a měly by být bez dysplastických změn (15).
Tab. 2. Diferenciální diagnostika myxomů (převzato z Fletcher: Diagnostic histopathology of tumors (16)). 
Dalším velmi častým primárním benigním srdeční tumorem a nejčastějším primárním tumorem srdečních chlopní je papilární fibroelastom (obr. 4). Vychází ze subendoteliální vrstvy endokardu, obvykle chlopenního (mitrální a aortální chlopeň). Jeho skutečná incidence je neznámá, neboť může být zcela asymptomatický, ne zřídka je odhalen náhodně na resekované chlopni při její náhradě. Je exofyticky rostoucí, velmi křehký, gelovitého, papilárního či filiformního vzhledu. Histopatologicky mají papily centrální avaskulární jádra bohatá na elastická vlákna, periferie papil je tvořená řidším až myxoidním pojivem, povrch je krytý endotelem, který může být S100 pozitivní (7). Fibroelastom by měl být odlišen od Lamblových výběžků na chlopni, ty bývají menší, široce přisedlé, bez zřetelně stopky, obvykle bez prominujících elastických vláken, lokalizované výhradně na aortální chlopni (6).
Obr. 4. Papilární fibroelastom filiformní úpravy s centrálním jádrem bohatým na elastiku a řidším pojivem na periferii (Weigertův resorcin-fuchsin, 100x). 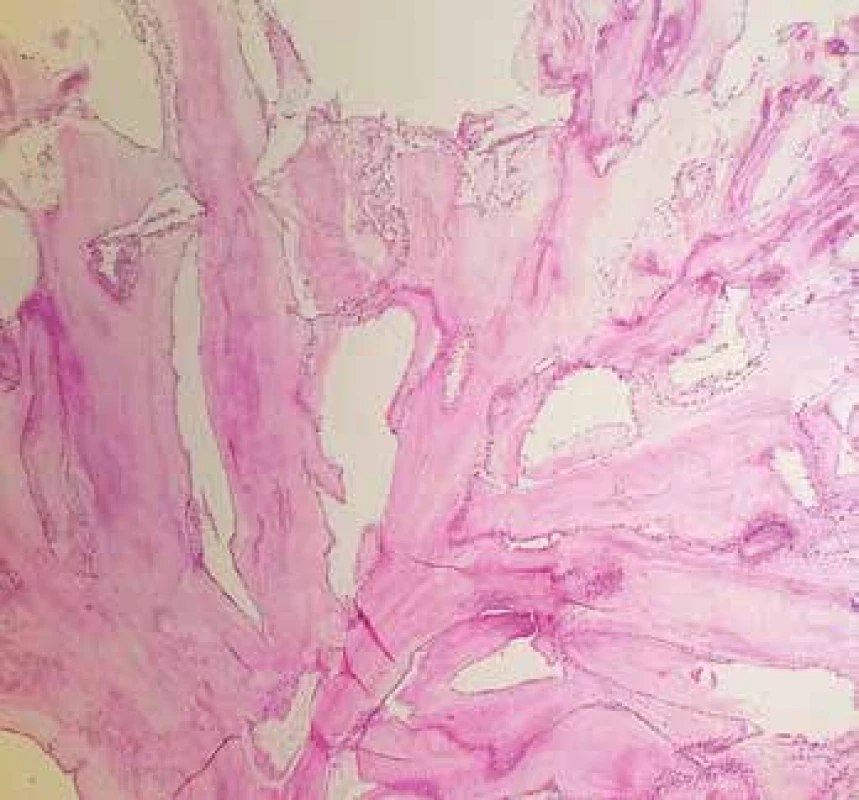
Hemangiomy představují obvykle houbovitou prokrvácenou tkáň. Mohou být lokalizovány intramurálně i subendokardiálně, kde v případě exofytického charakteru růstu mohou makroskopicky připomínat myxomy. Mikroskopicky mohou být tvořeny tenkostěnnými i silnostěnnými cévními strukturami, které mohou být promíseny se svalovinou a tukovou tkání. Pozitivní je imunohistochemický průkaz endoteliálních markerů (8).
Další skupinu tumorózních afekcí srdce představují lipomatózní léze. Ty zahrnují pravé nádorové afekce, vrozené i reaktivní léze. Diferenciálně diagnosticky připadají v úvahu lipomy, lipomatózní hypertrofie síňového septa, lipomatózní hamartom AV chlopní a lipomatózní atrofie myokardu. Množství tukové tkáně v srdci přibývá s věkem. Typicky dochází u starších osob k hromadění adipocytů v oblasti přední stěny pravé komory, tento vcelku běžný stav se nazývá lipomatózní atrofie. Lipomy představují velmi vzácné pravé neoplastické léze tvořené zralými adipocyty typicky lokalizované v subendokardiální či subepikardiální oblasti. Bývají solitární, avšak mohou být i součástí difuzní lipomatózy. Jedná se typicky o solidní dobře ohraničené opouzdřené tumory. I u nich se můžeme setkat s prostupováním adipocytů mezi kardiomyocty. Další lézí, tentokrát spíše difuzního charakteru, je lipomatózní hypertrofie síňového septa (8) (obr. 5), benigní nenádorové léze, která pravděpodobně vzniká během vývoje, kdy dojde k zadržení embryonálního tuku v oblasti septa během septace síní. Tukové buňky jsou v septu promíseny s kardiomyocyty, které mohou být regresivně změněné, s atypickými až bizarními jádry. I u této afekce se zastoupení tukových buněk zvětšuje s věkem a narůstající obezitou (6,10). Raritní lézí je lipomatózní hamartom atrioventrikulárních chlopní, který může vést k insuficienci chlopní a může se šířit až na papilární svaly (16).
Obr. 5. Lipomatózní hypertrofie septa síní s okrskem regresivně změněných kardiomyocytů, vykazujících jaderné atypie až pleomorfie degenerativního charakteru (hematoxylin & eosin, 200x). 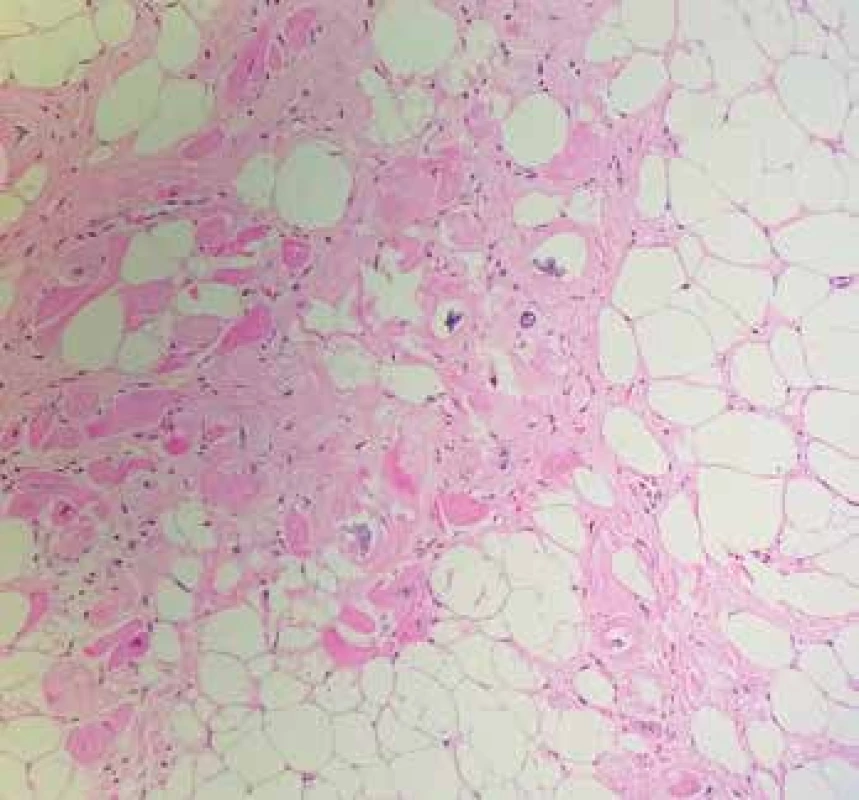
Pouze vzácně se u dospělých setkáme s teratomy, jedná se o primární srdeční nádory typické pro raný dětský věk a plody. Mikroskopický obraz je variabilní v závislosti na zastoupení jednotlivých tkání. Naprostá většina lézí představuje zralé teratomy. Z dalších raritně se vyskytujících lézí se u dospělých můžeme setkat s inflamatorním myofibroblastickým tumorem, který je spíše záležitostí dětského věku, stejně jako vrozený cystický tumor AV uzlu, který je obvykle multicystickou lézí, jejíž cysty jsou vyplněné hlenem a vystlané kubickým až naznačeně dlaždicově diferencovaným epitelem. Tumor může kompletně destruovat AV uzel a vést k poruše vedení srdečního vzruchu a může být podkladem náhlé srdeční smrti. Většina jich je diagnostikována až posmrtně (6).
Vzácnou tumorózní lézí je také adultní hamartom ze zralých kardiomyocytů. Obvykle se jedná o asymptomatickou, nepravidelně ohraničenou tuhou neproliferující lézi benigního charakteru nacházející se v komorovém myokardu, která je mikroskopicky tvořená zvětšenými vírovitě uspořádanými kardiomyocyty, které mohou mít až bizarní jádra (13). Mikroskopicky bývají prakticky neodlišitelné od hypertrofické kardiomyopatie, odlišení je možné pouze makroskopicky. Adultní hamartomy jsou lokalizovanými lézemi, nikoliv difuzním postižením.
Maligní primární srdeční nádory
Primární maligní nádory srdce jsou velmi vzácnou skupinou onemocnění. Naprostou většinu primárních maligních lézí, více než 90 % (6,10), tvoří SARKOMY. Ty představují po myxomech druhou nejpočetnější skupinu primárních srdečních nádorů. Nejčastěji jsou diagnostikovány mezi 3. a 5. dekádou života. Ačkoliv se mohou vyskytnout v kterékoliv části srdce, nacházíme je nejčastěji v levostranných srdečních oddílech, častěji v síni. Výjimku tvoří angiosarkomy, ty totiž většinou vyrůstají z pravé síně (10). Sarkomy mají velmi špatnou prognózu, medián přežití je bez chirurgické resekce pouze několik měsíců. Pokud možno kompletní resekce je nejúčinnější terapeutickou metodou, která může i více než trojnásobně prodloužit dobu přežití. K chemo a radioterapii bývají sarkomy obvykle resistentní (2,17).
Nejčastějšími typy sarkomů jsou angiosarkom a nediferencovaný pleomorfní sarkom. V posledních letech se do popředí zájmu dostaly intimální sarkomy, které by dle Neuvilla a spol. (18) mohly představovat dokonce nejvíce zastoupenou skupiny srdečních sarkomů. Ten v rámci své práce zabývající se stovkou srdečních sarkomů na základě FISH vyšetření MDM2 amplifikace překlasifikoval více než třetinu svého souboru na intimální sarkomy. Stanovení diagnózy intimálního sarkomu je založené na histopatologickém a molekulárně genetickém vyšetření. Byla v nich popsána amplifikace EGFR a/nebo PDGFR a především overexprese a amplifikace MDM2. Všechny jím popsané intimální sarkomy v imunohistochemickém vyšetření exprimovaly MDM2, stejně jako téměř polovina nediferencovaných sarkomů a pětina angiosarkomů. Molekulární analýza amplifikace MDM2 pomocí FISH ale prokázala pozitivitu pouze u intimálních sarkomů, ostatní sarkomy, byť s imunohistiochemicky prokázanou expresí MDM2, amplifikaci MDM2 nevykazovaly (18).
Intimální sarkomy jsou typicky maligní mezenchymální nádory velkých cév (plicní tepny, aorta, plicní žíly, duté žíly). Jejich výskyt v oblasti srdce byl považován za raritní. V recentní WHO klasifikaci srdečních nádorů je o intimálních sarkomech zmínka u nediferencovaných pleomorfních sarkomů (2,19). S levostrannými srdečními sarkomy (typická lokalizace nediferencovaných pleomorfních sarkomů) mají společný intrakavitární růst. Nediferencované sarkomy rostou typicky endokardiálně, intimální sarkomy v cévách intraluminálně. Intimální sarkomy jsou typicky vysoce agresivní, nízce diferencované sarkomy tvořené vřetenitými a/nebo pleomorfními buňkami, které mohou obsahovat objemné myxoidní stroma. Nádorové buňky mohou mít také epiteloidní vzhled, mohou připomínat leiomyosarkom, vzácně se můžeme setkat i s rhabdo, angio či osteosarkomatoidně diferencovanými partiemi (20,21).
Vzhledem k tomu, že se exprese a amplifikace MDM2 může vyskytovat i u jiných sarkomů – např. liposarkomů a jak se zdá také u značné části nediferencovaných pleomorfních sarkomů (18), tak je prosté překlasifikování sarkomů s MDM2 amplifikací do skupiny intimálních sarkomů poněkud kontroverzní. Malleszewski a spol. (22) se proti tomuto zjednodušení, a upozadění významu histologického typu sarkomů v jejich klasifikaci, striktně ohradil. Spíše než prostou reklasifikaci doporučuje zmínění MDM2 statusu v názvu nádoru – nediferencovaný pleomorfní sarkom s či bez MDM2 amplifikace (22). Přesto se jeví pravděpodobné, že prostřednictvím kombinace imunohistochemického a FISH průkazu MDM2 exprese a amplifikace by mělo být možné detekovat ve skupině nízce diferencovaných sarkomů sarkomy intimální. Význam detekce tohoto znaku je nezpochybnitelný, neboť může být využit v cílené terapii.
V tradičním pohledu jsou za nejčastější typy primárních srdečních sarkomů považovány angiosarkomy. Ty se dvakrát častěji vyskytují u mužů a na rozdíl od ostatních typů sarkomů predilekčně vyrůstají z pravé síně nebo z perikardu, často v podobě multicentrického postižení (10). Histopatologicky jsou tvořené obvykle směsí oblastí s anastomózujícími vaskulárními kanály vystlanými pleomorfními atypickými endoteliemi a hypercelulárními oblastmi s atypickými nízce diferencovanými epiteloidními a vřetenitými buňkami s Kaposhi-like uspořádáním. Častá je přítomnost rozsáhlých nekróz a hemoragií a vysoká mitotická aktivita (6,17).
Nediferencované sarkomy (obr. 6) představují nádory bez specifických ultrastrukturálních znaků nebo specifického imunoprofilu. Nediferencovaný pleomorfní sarkom, dříve označovaný jako pleomorfní maligní fibrózní histiocytom, se vyskytuje typicky u osob ve 4. dekádě, bez pohlavní predilekce. Makroskopicky tvoří lobulované přisedlé či stopkaté nádory prominující do lumen srdečních dutin, typicky levostranných. Histopatologicky je tvořený vřetenitými a pleomorfními buňkami, které jsou obvykle rohožovitě uspořádané. Přítomny mohou být i histiocytoidní nebo pěnité buňky a v různé míře smíšený zánětlivý infiltrát (6). Vzhledem k tomu, že mohou mít myxoidní stroma a navíc bývají typicky lokalizované v levé síni, i když mimo oblast mezisíňového septa, tak mohou být někdy zaměněny za srdeční myxom. Diferenciálně diagnosticky připadá v úvahu i low-grade myxofibrosarkom, ten se také obvykle vyskytuje v levostranných srdečních oddílech a roste endokardiálně. Mikroskopicky však nevykazuje výraznější pleomorfie a nebývají v něm přítomny nekrózy ani storiformní uspořádání, typicky převažuje myxoidní vzhled, hyperchromázie atypických jader a zvýšená proliferační aktivita. Ve srovnání s myxomem chybí v myxofibrosarkomu vazoformativní struktury, hemoragie a makrofágy a exprese calretininu, ten je naopak exprimován u většiny myxomů (2). Pravděpodobné souvislosti mezi intimálním sarkomem a nediferencovaným pleomorfním sarkomem jsme se věnovali výše.
Obr. 6. A, B: Primární sarkom srdeční síně. Nádor byl storiformně stavěný, hypercelulární, infiltrativně rostoucí, s úseky nekróz, tvořený vřetenitými buňkami s atypickými jádry a mitotickou aktivitou (hematoxylin & eosin, 100x, 400x). Nádor byl silně pozitivní v imunohistochemickém průkazu hladkosvalového aktinu a vimentinu, fokálně pozitivní v průkazu desminu (C, 200x), širokospektrého cytokeratinu, CD10 a S100. Negativní byl průkaz CD31, ERG, h-kaldesmonu, CD34, ALK, STAT6, SOX10 a EMA. Léze byla hodnocena jako nediferencovaný sarkom s fokální hladkosvalovou diferenciací. 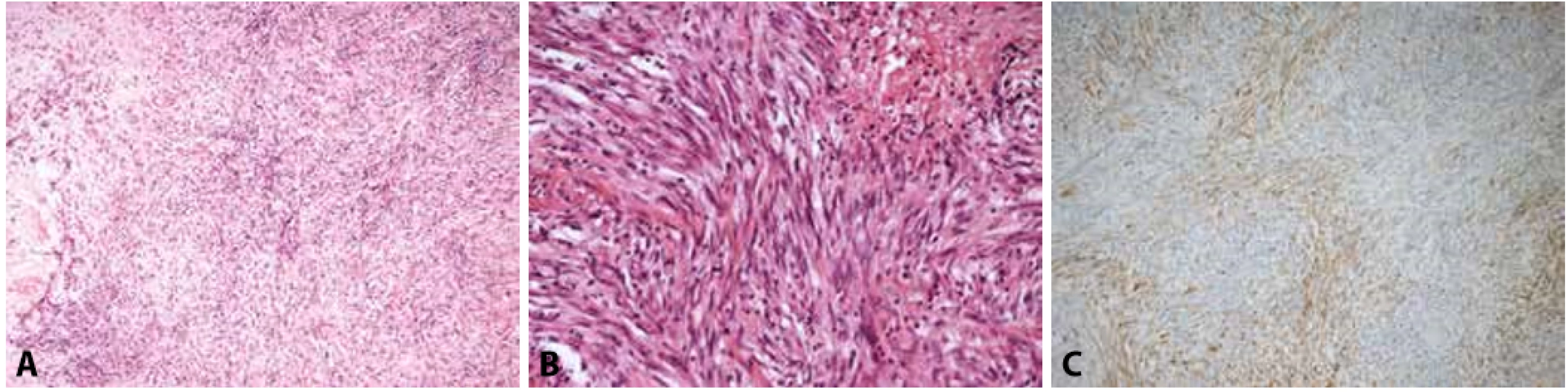
Z dalších typů sarkomů se častěji vyskytují osteosarkomy, zejména chondroblastický podtyp, který je v srdeční lokalizaci poměrně častý. Vyskytují se nejčastěji v srdečních síních, četněji v levé, mohou se šířit do plicních žil a na mitrální chlopeň (2,6).
Dále to jsou například vzácně leiomyosarkomy, a raritně rhabdomyosarkomy, které jsou typicky nádorem dětského věku, častěji bývají popisovány u chlapců, typicky v oblasti levé komory. Histopatologicky jsou obvykle tvořeny embryonálním typem buněk (2,6).
Výrazně méně početnou skupinu primárních maligních srdečních nádorů tvoří lymfomy. Obvykle se jedná o non-Hodgkinské lymfomy, nejčastěji vznikající z B lymfocytů, typicky difuzní velkobuněčný B lymfom (DLBCL). Primární srdeční lymfomy jsou raritními malignitami, vyskytující se typicky u imunokompromitovaných osob. Naproti tomu postižení srdce v rámci diseminovaných extrakardiálních lymfomů se vyskytuje až u čtvrtiny pacientů (11).
V rámci primárního lymfomu nalezneme často infiltraci ve více srdečních oddílech (typicky včetně pravé síně), invazi do perikardu a často masivní perikardiální výpotek. Prognóza je u lymfomů lepší než u sarkomů, významně se ale odvíjí od celkového stavu pacienta, extrakardiálního šíření a hlavně infiltrace levé komory srdeční. Pacienti s infiltrací v LK přežívají průměrně 1 měsíc, kdežto pacienti bez postižení LK mají medián přežití téměř 2 roky (11).
Sekundární maligní nádory srdce
Sekundární maligní nádory (obr. 7, 8) se do srdce mohou šířit buď klasicky zakládáním vzdálených metastáz lymfogenní a hematogenní cestou, dále kontinuálním šířením velkými cévami (dolní dutou žilou či plicními žilami) nebo přímým prorůstáním z okolních orgánů (plíce, jícen, mediastinum). Zakládání vzdálených metastáz, přímé šíření z okolí a četnost případů prorůstání cévami se vyskytuje přibližně srovnatelně často, s lehkou převahou vzdálených metastáz (35 %). Nejčastěji je postižený perikard (2/3 metastáz), následovaný epikardem (1/3) a myokardem (1/3). Metastázy infiltrující endokard bývají lokalizovány v pravostranných srdečních dutinách, jsou vzácné (5 %) a obvykle asociované s endovaskulárním šířením nádorů ledvin, jater či dělohy (23).
Obr. 7. Metastatický adenoidně-cystický karcinom v myokardu (hematoxylin & eosin, 200x). 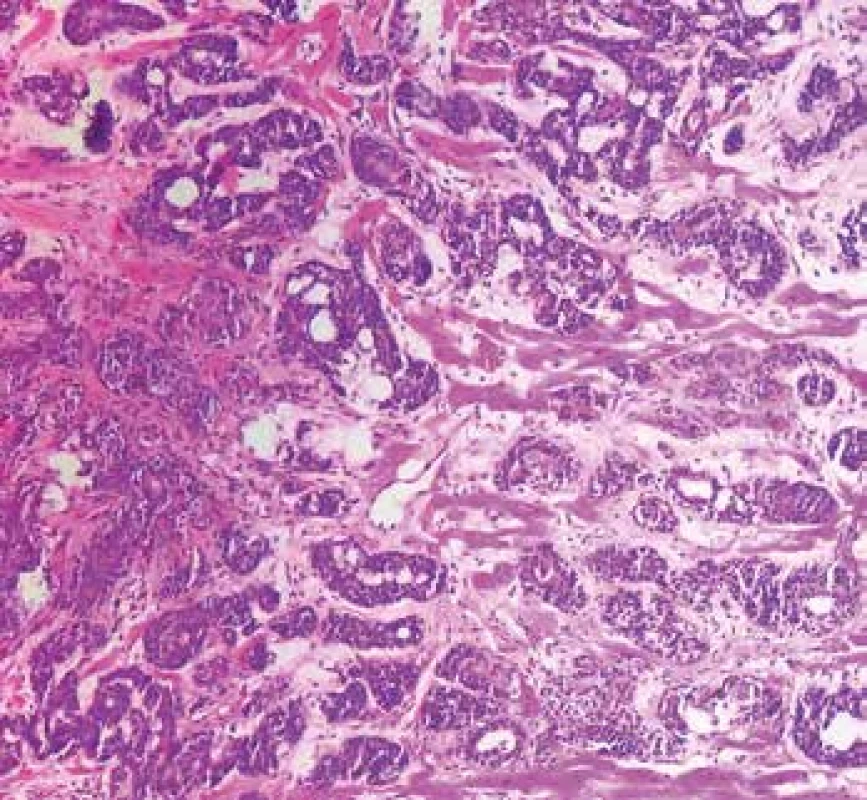
Obr. 8. A: Metastatický lobulární karcinom prsu v myokardu, klinicky a na zobrazovacích metodách mimikující myokarditidu (hematoxylin & eosin, 100x). B: Jaderná pozitivita nádorových buněk v imunohistochemickém průkazu antigenu GATA3 (100x). C: Jaderná pozitivita nádorových buněk v imunohistochemickém průkazu estrogenových receptorů (100x). 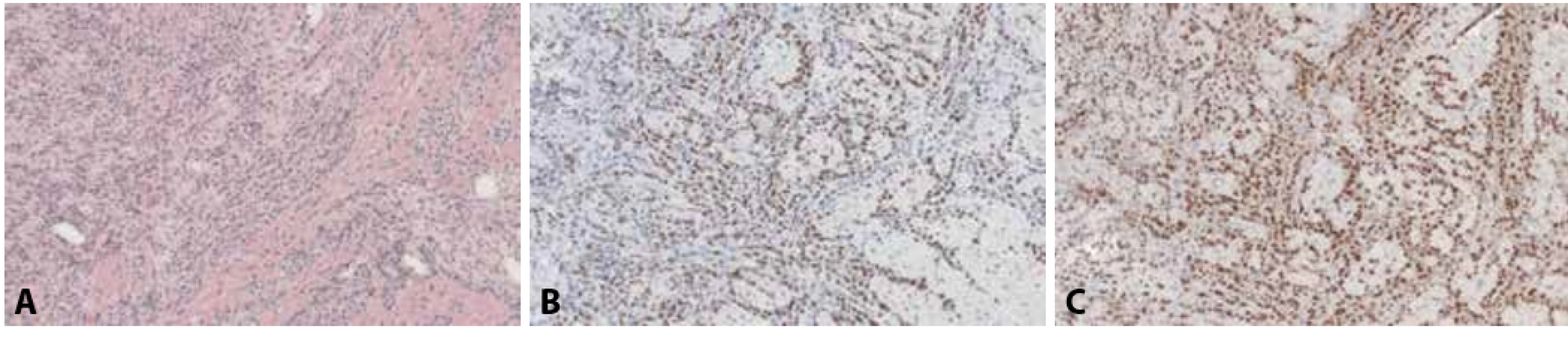
Údaje o výskytu sekundárních maligních nádorů srdce jsou historicky uváděny v různých souborech ve velkém rozpětí 0,7 – 3,5 % u sekčních případů, a až 14% u autopsií zemřelých s anamnézou malignity (3). V největším recentním souboru sekčních případů jich Bussani a spol. zaznamenali 9,1 % (23). Výskyt metastatických nádorů v srdci tedy není až takovou vzácností a je jednoznačně mnohonásobně vyšší než výskyt primárních srdečních malignit. V absolutních počtech do srdce nejčastěji metastazují karcinomy plic, následované karcinomy prsu, maligním melanomem a hematologickými malignitami (leukémie, lymfomy). Z pohledu jednotlivých nádorových onemocnění má největší tendenci zakládat metastázy v srdci maligní mezoteliom pleury, který je ovšem velmi vzácný, a melanom, následovaný nádory ze zárodečných buněk, karcinomy plic a hematologickými malignitami (3,23). Klinická manifestace metastatického postižení srdce je značně variabilní a záleží na rozsahu a místě nádorové infiltrace. Často jsou metastázy asymptomatické a jediným projevem postižení srdce je přítomnost perikardiálního výpotku.
ZÁVĚR
Srdeční nádory jsou velkou výzvou pro kardiology, kardiochirurgy, onkology i patology. Jsou velmi vzácné a stanovení správné diagnózy a posléze vhodného terapeutického přístupu vyžaduje úzkou spolupráci všech zúčastněných odborníků. Histopatologické vyšetření je nedílnou součástí a hlavním pilířem tohoto procesu. V dnešní době, kdy je často k dispozici i možnost endovaskulárního odběru tkáně nádoru či molekulárně genetické vyšetření nádorových buněk, může významně ovlivnit další osud pacienta.
PODĚKOVÁNÍ
Tato práce vznikla za podpory projektů BBMRI-CZ: Síť biobank – univerzální platforma k výzkumu etiopatogeneze chorob, reg. č.: EF16 013/0001674, BBMRI-CZ LM 20/8125 a programu Progres Q40/11.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Adéla Matějková, Ph.D.
Fingerlandův ústav patologie
Fakultní nemocnice
Sokolská 581, 50005 Hradec Králové
tel: 495 833 493
email: adela.matejkova@gmail.com
Zdroje
1. Basso C, Rizzo S, Valente M, Thiene G. Cardiac masses and tumours. Heart 2016; 102(15): 1230-1245.
2. Travis WD, Brambilla E, Burke AP, Marx A, Nicholson AG, eds. Tumours of the heart. In: WHO classification of tumours of the lung, pleura, thymus and heart.(4th edn). Lyon: IARC; 2015 : 299-348.
3. Amano J, Nakayama J, Yoshimura Y, Ikeda U. Clinical classification of cardiovascular tumors and tumor-like lesions, and its incidences. Gen Thorac Cardiovasc Surg 2013;61(8):435-447.
4. Tzani A, Doulamis IP, Mylonas KS, Avgerinos DV, Nasioudis D. Cardiac Tumors in Pediatric Patients: A Systematic Review. World J Pediatr Congenit Heart Surg 2017; 8(5): 624-632.
5. Günther T, Schreiber C, Noebauer C, Eicken A, Lange R. Treatment strategies for pediatric patients with primary cardiac and pericardial tumors: a 30-year review. Pediatr Cardiol 2008; 29(6): 1071-1076.
6. Butany J, Nair V, Naseemuddin A, Nair GM, Catton C, Yau T. Cardiac tumours: diagnosis and management. Lancet Oncol 2005; 6(4): 219-228.
7. Wang JG, Wang B, Hu Y, et al. Clinicopathologic features and outcomes of primary cardiac tumors: a 16-year-experience with 212 patients at a Chinese medical center. Cardiovasc Pathol 2018; 33 : 45-54.
8. Patel J, Sheppard MN. Pathological study of primary cardiac and pericardial tumours in a specialist UK Centre: surgical and autopsy series. Cardiovasc Pathol 2010; 19(6): 343-352.
9. Tao TY, Yahyavi-Firouz-Abadi N, Singh GK, Bhalla S. Pediatric cardiac tumors: clinical and imaging features. Radiographics 2014; 34(4): 1031-1046.
10. Bruce CJ. Cardiac tumours: diagnosis and management. Heart 2011; 97(2): 151-160.
11. Hudzik B, Miszalski-Jamka K, Glowacki J, et al. Malignant tumors of the heart. Cancer Epidemiol 2015; 39(5): 665-672.
12. Cigognetti M, Lonardi S, Fisogni S, et al. BAP1 (BRCA1-associated protein 1) is a highly specific marker for differentiating mesothelioma from reactive mesothelial proliferations. Mod Pathol 2015; 28(8): 1043-1057.
13. Miller DV, Revelo MP. Diagnostic pathology: Cardiovascular (2nd edn). Elsevier; 2018.
14. Bhattacharya B, Dilworth HP, Iacobuzio-Donahue C, et al. Nuclear beta-catenin expression distinguishes deep fibromatosis from other benign and malignant fibroblastic and myofibroblastic lesions. Am J Surg Pathol 2005; 29(5): 653-659.
15. Zhang M, Ding L, Liu Y, Xue L. Cardiac myxoma with glandular elements: a clinicopathological and immunohistochemical study of five new cases with an emphasis on differential diagnosis. Pathol Res Pract 2014; 210(1): 55-58.
16. Fletcher ChDM. Diagnostic histopathology of tumors. Vol 1. (4th edn.). Philadelphia: Elsevier Saunders; 2013 : 6-37.
17. Patel SD, Peterson A, Bartczak A, et al. Primary cardiac angiosarcoma - a review. Med Sci Monit 2014; 20 : 103-109.
18. Neuville A, Collin F, Bruneval P, et al. Intimal sarcoma is the most frequent primary cardiac sarcoma: clinicopathologic and molecular retrospective analysis of 100 primary cardiac sarcomas. Am J Surg Pathol 2014; 38(4): 461-469.
19. Mendes EM, Ferreira A, Felgueiras P, et al. Primary intimal sarcoma of the left atrium presenting with constitutional symptoms. Oxf Med Case Reports 2017; 7 : 109-112.
20. Ibrahim A, Luk A, Singhal P, et al. Primary intimal (spindle cell) sarcoma of the heart: a case report and review of the literature. Case Rep Med 2013; 2013 : 461815.
21. Valecha G, Pau D, Nalluri N, Liu Y, Mohammad F, Atallah JP. Primary Intimal Sarcoma of the Left Atrium: An Incidental Finding on Routine Echocardiography. Rare Tumors 2016; 8(4): 6389.
22. Maleszewski JJ, Tavora F, Burke AP. Do “intimal” sarcomas of the heart exist? Am J Surg Pathol 2014; 38(8): 1158-1159.
23. Bussani R, De-Giorgio F, Abbate A, Silvestri F. Cardiac metastases. J Clin Pathol 2007; 60(1): 27-34.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2020 Číslo 1-
Všechny články tohoto čísla
- Prof. MUDr. Zdeňka Vernerová, CSc.
- Novinky v klinické diagnostice ischemické choroby srdeční a aktuální doporučené terapeutické postupy
- Diferenciální diagnostika tumorózních lézí srdce
- Aktuální nomenklatura a histopatologická kritéria pro hodnocení nezánětlivých degenerativních onemocnění aorty
- Deset let redakční práce a změny do budoucna
- Echinococcus multilocularis: Diagnostický problém v punkční biopsii jater - kazuistika
- Vzácný podtyp papilárního renálního karcinomu (kazuistika)
- Úloha patologa v chirurgickém stagingu karcinomu děložního hrdla
- PŘEDSTAVUJEME NOVÉ EDITORY
- Rosai and Ackerman’s Surgical Pathology
- Prof. Dr. Leo Taussig - zapomenutý průkopník komplexní cytologie mozkomíšního moku
- Jessenius o srdci
- Spomienka na prof. MUDr. Štefana Kopeckého, PhD.
- Monitor aneb nemělo by Vám uniknout, že...
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika tumorózních lézí srdce
- PŘEDSTAVUJEME NOVÉ EDITORY
- Echinococcus multilocularis: Diagnostický problém v punkční biopsii jater - kazuistika
- Novinky v klinické diagnostice ischemické choroby srdeční a aktuální doporučené terapeutické postupy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




