-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Molekulárně genetické metody ve skríningu karcinomu děložního hrdla
Autoři: Kateřina Černá 1,2; Jana Němcová 1,2,3
Působiště autorů: Bioptická laboratoř s. r. o., Plzeň 1; Šiklův ústav patologie, Fakultní nemocnice, Plzeň 2; Biomedicínské centrum, Plzeň 3
Vyšlo v časopise: Čes.-slov. Patol., 63, 2018, No. 4, p. 169-174
Kategorie: Přehledový článek
Souhrn
Ve skríningu karcinomu děložního hrdla (KDH) se celosvětově uplatňují molekulárně genetické metody. Také v České republice už zaujaly své místo hlavně při stratifikaci pacientek s nejasným výsledkem gynekologické cytologie. Nejčastěji využívaným testem je skríningové vyšetření vysoce rizikových typů lidských papilomavirů (HPV). V článku jsou popsány jednotlivé skupiny HPV testů, které mohou být využity ve skríningu KDH, a diskutována kritéria, která musí tyto testy splňovat. V klinické praxi je již také využíváno testu metylačního umlčení tumorsupresorových genů, který dokáže na základě epigenetických charakteristik cervikálního stěru rozlišit pacientky s vysokým krátkodobým rizikem progrese cervikální léze do karcinomu. V článku jsou diskutovány i nové metody a přístupy, které v budoucnu mohou být u pacientek využity pro zpřesnění míry rizika vzniku karcinomu děložního hrdla. Sem patří například stanovení expresních profilů mikroRNA molekul, analýza genomu HPV pomocí sekvenování nové generace, která umožní zařazení virů do subtypů, variant a subvariant, testování integrace viru do genomu buňky nebo metylační analýza virových genů.
Klíčová slova:
děložní hrdlo – karcinom – skríning – HPV – molekulární metody – genotypizace – metylace – NGS
LIDSKÉ PAPILOMAVIRY
Lidské papilomaviry (HPV, z angl. human papillomavirus) představují velkou skupinu neobalených virů, jejichž dědičná informace je tvořena dvouvláknovou kruhovou DNA. HPV viry jsou etiologicky spojené s celou řadou benigních a maligních lézí vznikajících na kůži či sliznici. Taxonomická klasifikace papilomavirů, která vychází ze sekvenčních rozdílů v genu kódujícím L1 protein, rozlišuje více jak 200 typů HPV. Nejméně 12 HPV typů (HPV16, HPV18, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV56, HPV58 a HPV59) z rodu alfa má onkogenní potenciál a je kauzálně spojeno se vznikem karcinomu děložního hrdla (1). Tyto HPV typy se označují jako vysoce rizikové (HR HPV, z angl. high-risk HPV). Některé z HR HPV typů mohou indukovat vznik i dalších anogenitálních malignit a část karcinomů v oblasti hlavy a krku. V souvislosti s karcinomem děložního hrdla (KDH) se rozlišují také možné vysoce rizikové HPV typy (HPV26, HPV30, HPV34, HPV53, HPV66, HPV67, HPV69, HPV70, HPV73, HPV82, HPV85 a HPV97) a pravděpodobné vysoce rizikové HPV typy (HPV68), které mohou v raritních případech indukovat karcinogenezi na děložním hrdle, ale jejich prevalence u žen s normálním nálezem na děložním hrdle je tak vysoká, že většinou nejsou zahrnuty ve skríningových HPV testech (výjimkou jsou hraniční typy HPV66 a HPV68) (1).
Onkocytologický skríning KDH založený na mikroskopické identifikaci abnormálních buněk v PAP cervikálních nátěrech vedl k dramatickému poklesu incidence KDH a mortality s ním spojené. Až několik desetiletí po zavedení cytologického skríningu KDH byla objasněna příčina dysplastických buněčných změn a lidský papilomavirus určen jako etiologické agens tohoto onemocnění, jehož perzistentní přítomnost je nezbytnou podmínkou rozvoje karcinomu (2).
HPV infekce je velmi častá v obecné sexuálně aktivní populaci, ale většina z těchto infekcí spontánně vymizí do 1-2 let po nákaze. Pouze dlouhodobá perzistentní infekce jedním nebo více typy HR HPV, která se vyskytuje u několika procent žen, je asociována s progresí onemocnění. Zhruba u 30 % žen, které mají neléčenou lézi těžkého stupně HSIL, vznikne v průběhu let invazivní onemocnění (3).
Určení původce KDH umožnilo rozvoj dvou revolučních technik, které znamenají průlom v boji s tímto onemocněním. Profylaktické vakcíny cílící na nejvíce agresivní HR HPV typy jsou vysoce efektivním nástrojem primární prevence KDH, zejména pokud jsou podány před nástupem aktivního sexuálního života (4). HPV test, tedy molekulárně genetická detekce HR HPV ve stěru z děložního hrdla, zefektivnil zase úspěšnost sekundární prevence KDH v rámci skríningu, a to zejména zvýšením citlivosti záchytu těžkých lézí.
Obr. 1. Schéma změn, které probíhají při progresi HPV indukované léze do karcinomu (změny spojené s HPV – zelená barva, změny spojené s hostitelskými buňkami – červená barva, koncept HPV indukované karcinogeneze - modrá barva). Intenzita barvy odpovídá frekvenci detekce změny, přerušovanou čarou zvýrazněna nízká nebo neznámá četnost změny. V levém sloupci je naznačena využitelnost jednotlivých změn jako biomarkerů pro skríning karcinomu děložního hrdla. Upraveno dle Steenbergen et al. 2014 (30). 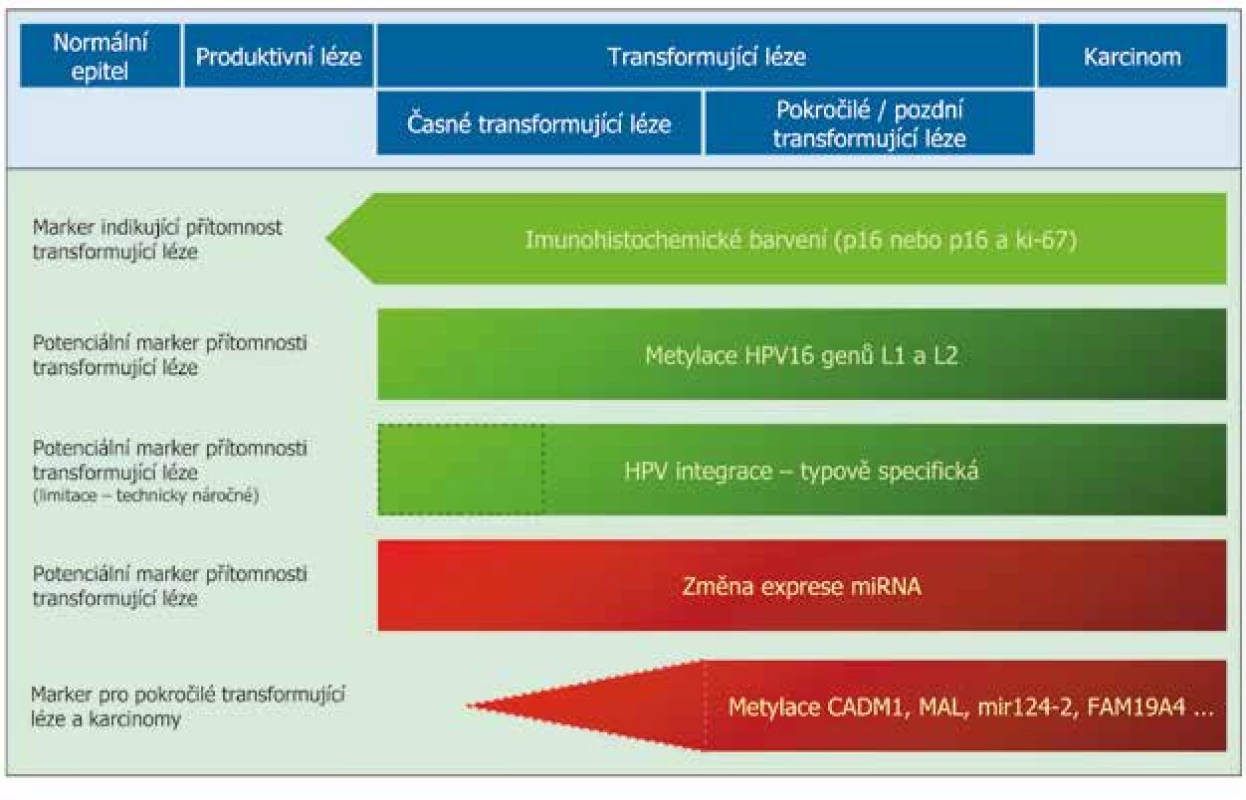
HPV TESTY VYUŽITELNÉ VE SKRÍNINGU KDH
HPV test byl doposud využíván ve skríningu KDH zejména jako reflexní test pro onkocytologický stěr při hraničním nebo nejednoznačném nálezu a jako velmi citlivá kontrola ablační léčby provedená s několikaměsíčním odstupem. Nověji se HPV testy díky své vysoké citlivosti detekce onemocnění začínají uplatňovat také jako primární testy skríningu karcinomu děložního hrdla, buďto samostatně, nebo v kombinaci s cytologií, tzv. kotest. Nižší specifita HPV testu pro detekci těžkých lézí je řešena několika rozličnými variantami reflexního testu pro stratifikaci rizika HPV pozitivních pacientek (5).
Skríningové HPV testy musí splňovat svými charakteristikami přesná kritéria, která vychází z optimální rovnováhy mezi klinickou senzitivitou testu a specifitou pro detekci těžké cervikální intraepiteliální neoplázie (HSIL). Testy zároveň nesmí nadměrně detekovat transientní HR HPV infekce, proto je jejich analytická citlivost omezená na určitý počet kopií viru (6,7). Pro účely skríningu KDH není účelné více zvyšovat citlivost HPV testů, protože i malé zvýšení senzitivity by znamenalo dramatický nárůst počtu klinicky falešně negativních pacientek (tj. HR HPV pozitivních bez těžké cervikální léze) (8).
Hybrid Capture 2 (hc2; Qiagen) a GP5 +/6+-PCR EIA jsou HPV testy, jejichž charakteristiky pro skríning KDH byly hodnoceny v dlouhodobých prospektivních kohortových studiích a randomizovaných klinických studiích, a proto jsou považovány za plně klinicky a epidemiologicky validované. Nové kandidátní skríningové HPV testy musí splňovat klinické charakteristiky, které odpovídají těmto standardním porovnávacím testům, a to zejména v kritériích senzitivity, specifity a reprodukovatelnosti. HPV vědecká komunita definuje podmínky tohoto testování ve dvou hlavních dokumentech - tzv. „Meijer´s a VALGENT guidelines“ (6,7).
Hc2 a GP5 +/6+-PCR EIA prokázaly citlivost pro detekci těžkých lézí 90–95 % (9), kandidátní skríningové testy musí tedy splňovat alespoň 90% relativní citlivost pro detekci těžkých lézí ve srovnání se standardními testy (6). Specifita standardních HPV testů pro ženy nad 30 let věku byla 91,3 – 94,1 % a kandidátní skríningové testy musí dosáhnout alespoň 98% relativní specifity ve srovnání se standardními testy (6).
V současné době lze ve skríningu KDH použít několik HPV testů, které spadají do tří kategorií (10):
- HR HPV DNA základní skríningové testy
- HR HPV DNA skríningové testy s částečnou genotypizací hlavních HR HPV typů
- HR HPV E6/E7 mRNA testy
Základní HR HPV skríningové testy zahrnují kvalitativní nebo semikvantitativní HPV detekční eseje, které používají různé molekulárně-genetické technologie k identifikaci přítomnosti nebo absence cílených HPV typů. Nejčastěji je detekčně cíleno 13-14 HPV typů: 12 HR HPV typů a možný HR HPV typ 66 a/nebo pravděpodobný HR HPV typ 68. Na trhu je nejméně 29 HR HPV komerčních skríningových testů, z nichž dostatečně klinicky ověřené pro primární HPV skríning jsou zhruba 4: Hybrid Capture 2 (hc2) HR HPV DNA Test (Qiagen), Cervista HPV HR Test(Hologic), EIA HPV GT HR (Diassay), HPV-Risk Assay (Self-Screen BV).
Druhá skupina testů, tedy HR HPV DNA skríningové testy s částečnou genotypizací, má přidanou hodnotu oproti základním testům v možnosti zlepšení přesnosti a účinnosti skríningu díky detekčnímu vyčlenění několika klinicky odlišných HPV typů ze spektra ostatních HR HPV typů. Poslední souhrnný článek z vědeckého kolektivu Poljak et al., který hodnotí komerční HPV testy, udává asi 24 testů v této skupině, z nichž mezi dobře klinicky ověřené testy patří Cobas 4800 HPV Test (Roche Molecular Systems Inc.), Cervista HPV 16/18 Test (Hologic), RealTime High Risk HPV Test (Abbott Molecular) a BD Onclarity HPV Assay (BD Diagnostics) (10).
Přestože naprostá většina skríningových HPV testů je založena detekci HPV DNA, rostoucí počet studií poukazuje na větší efektivitu testování HPV mRNA, a to díky vyšší specifitě těchto testů pro detekci těžkých cervikálních lézí (11,12). HR HPV E6/E7 mRNA skríningové testy lze tedy s výhodou použít místo DNA HPV skríningových testů jako reflexních testů při primárním onkocytologickém skríningu, a dokonce i jako samostatných primárních HPV skríningových testů, neboť nevedou k nižšímu záchytu HSIL lézí, pouze specifičtěji vyhledávají právě těžší léze KDH (13). Optimálně klinicky ověřený je zatím jeden test z této kategorie skríningových testů – Aptima HPV Assay (Hologic). Tento test je možné doplnit částečnou genotypizací testem Aptima 16 18/45 (Hologic).
Největší skupina komerčních HPV testů, které jsou dostupné na trhu, patří mezi plně genotypizační HPV testy. Tyto testy mají minimální využití ve skríningu KDH. Měly by být využívány pouze pro epidemiologické studie, monitorování vakcinačních programů a v případě testování vzorků s degradovanými nukleovými kyselinami, jako jsou např. formalínové bloky (14). Výjimku z tohoto pravidla tvoří vzácné těžké léze na děložním hrdle, které jsou způsobeny HPV typy nezastoupenými ve skríningových HPV testech (zejm. možnými a pravděpodobnými HR HPV typy). Zde není jiná možnost potvrzení HPV indukovaného karcinogenního procesu zjištěného např. pomocí onkocytologie než přesná genotypizace HPV. Navíc stále ještě probíhá diskuze ve vědeckých kruzích, zda kontrola ablační léčby těžké léze KDH s odstupem 6-12 měsíců by také neměla být provedena pomocí více citlivého genotypizačního DNA testu (15). Mezi dobře klinicky ověřené genotypizační testy patří např. Linear Array HPV Genotyping Test (Roche Molecular Systems Inc.), RHA Kit SPF10-LiPA 25 version1 (Labo Bio-medical Products), AnyplexTM II HPV HR Detection (Seegene) nebo PapilloCheck® High-risk Test (GreinerBio-One) (10).
DOPLŇKOVÉ MOLEKULÁRNÍ TESTY VE SKRÍNINGU KDH
Nezávisle na strategii skríningu karcinomu děložního hrdla (ať se jedná o primární cytologický skríning (PAP test), primární HPV test nebo kotest) je skríningem vyselektována skupina žen s pozitivním (nebo nejasným) výsledkem testu, u kterých je nutné následné vyšetření pro odhalení těch, jež je třeba neodkladně léčit. Díky použití genetických a epigenetických biomarkerů je možné snížit množství žen, u nichž je nutné provést invazivní bioptické vyšetření nebo expertní kolposkopii, neboť tyto biomarkery lze detekovat v primárním stěru cytologie z tekutého média (LBC) nebo odběru pro HPV vyšetření. Některé biomarkery jsou již běžně používány v klinické praxi, další jsou ve fázi validace a jiné ve fázi intenzivního výzkumu.
Částečná HPV genotypizace 16/18/45
Karcinogenní potenciál jednotlivých HPV typů se značně liší. HPV16 je typem, který je spojován s nejvyšším rizikem vzniku prekanceróz a KDH, dalším je HPV18 (16,17), přičemž tyto dva typy jsou zodpovědné za vznik 52-64 % HSIL lézí a přibližně 70 % karcinomů děložního hrdla. Ženy, které mají pozitivní HPV test na typ 16 nebo 18, mají 5x větší riziko vzniku HSIL léze v následujících 10 letech ve srovnání s ženami infikovanými jinými typy HPV (18,19). Navíc typy 16, 18, 45 jsou zodpovědné za více než 95 % adenolézí, které jsou často cytologií nezachyceny a mohou uniknout i kolposkopickému vyšetření, protože jsou zanořeny hlouběji v endocervixu (20). Z těchto skutečností vychází částečně genotypizační testy zařazené za pozitivní skríningové HPV testy, které detekují nejčastěji HPV16 a 18 (některé i HPV45), čímž je možno stratifikovat ženy ve zvýšeném riziku vzniku prekanceróz a karcinomu. Nicméně pozitivní prediktivní hodnota (PPV) tohoto testu při primárním HPV skríningu je 15,5-26,1 %, negativní prediktivní hodnota (NPV) je okolo 90,6-93,4 %, což nedovolí vyřadit negativní ženy z dalšího sledování (21). Pokud je ale genotypizační HPV test využit jako reflexní test v kombinaci s cytologií, je senzitivita vyšetření pro HSIL léze 78,2-96,6 % s NPV 97,1-98,8 % (21,22). V zemích, kde probíhá primární skríning založený na HPV testaci, je tedy kombinace genotypizačního HPV16/18/45 testu s PAP cytologií dobrou a bezpečnou strategií ke stratifikaci HR HPV pozitivních žen (23). V České republice, kde probíhá primární cytologický skríning, je HPV test s částečnou genotypizací 16/18/45 nejčastěji indikovaným následným vyšetřením u diagnóz ASC-US u žen nad 30 let věku. Přestože byl pro tyto diagnózy vyjmut zdravotními pojišťovnami z indukované péče a ekonomicky se jeví jako velmi výhodný (24), stále je poměrně málo využíván.
Metylace virové DNA
Metylace HPV DNA je jedním z protektivních mechanizmů, kterými lidská hostitelská buňka brání virové invazi. Tato metylace vede k umlčení virových genů. Pouze u HPV typů 16 a 18 ale vykazuje specifická kombinace metylace CpG ostrůvků v rámci L1a L2 genů konzistentní hypermetylační status, který stoupá se závažností léze, u ostatních HPV typů jsou zatím data nejasná (25). Jelikož je tato analýza limitována tím, že pro každý HPV typ existují jedinečné DNA sekvence, které je třeba sledovat, jeví se použití těchto metod v klinické praxi zatím jako nevhodné.
Metylace hostitelských buněk
Během procesu karcinogeneze jsou v buňkách epitelu děložního hrdla pozorovány změny metylace genomu (26). Ty souvisí s progresí infekce perzistujícím HPV virem, kdy původně produktivní infekce přechází v infekci transformující. Virovými onkoproteiny E6 a E7 modulovaná aktivace DNA-metyltransferázy a remodelace chromatinu vede k hypermetylaci CpG-ostrůvků v hostitelském genomu. Pokud dojde k hypermetylaci v oblasti genových promotorů, dochází ke snížení transkripce daných genů (27). Testy metylace promotorů tumorsupresorových genů jsou schopny určit pacientky s pokročilými transformujícími lézemi, které mají metylační profil podobný karcinomu a vysoké krátkodobé riziko progrese do karcinomu, a tedy potřebují neodkladnou léčbu (28-30).
V posledním desetiletí proběhlo mnoho studií, které se zaměřily na identifikaci kandidátních tumorsupresorových genů, jejichž metylační status stoupá se závažností cervikální léze. Mezi tyto geny patří například geny FAM19A4, cell adhesion molecule 1 (CADM1), myelin and lymphocyte (MAL), paired box 1 (PAX1), telomerase reverse transkriptase (TERT), PR domain containing 14 (PRDM14), EPB41L3, JAM3, GFRA1, CDH6, LHX8 a další (28,31-33). Stupeň metylace dvou buněčných genů, CADM1 a MAL, stoupá nejen se závažností léze, ale je spojen i s délkou trvání transformující léze (26,32). Několik studií také ukázalo, že změna exprese některých mikroRNA je jednou z prvních změn na počátku HPV-indukované karcinogeneze, přičemž snížení exprese může být výsledkem metylace CpG bohatých regulačních sekvencí (např. u mir124-1, mir124-2, mir124-3, mir149, mir203 a dalších) (34).
V současné době je k dispozici několik komerčně dostupných testů, které detekují metylační umlčení tumorsupresorových genů v různých kombinacích. Na českém trhu je to test QIAsure (Qiagen), který kombinuje metylační analýzu promotorů genů FAM19A4 a mir124-2. Je validován pro cytologické diagnózy NILM, ASC-US, AGC-NOS a LSIL, je tedy vhodným reflexním testem jak pro ženy HR HPV pozitivní, tak pro ženy s nejasnou cytologickou diagnózou.
MikroRNA a jejich exprese
MikroRNA (miRNA) jsou nekódující molekuly RNA dlouhé 18-25 nukleotidů, které se mohou vázat na 3´netranslatované konce mRNA, čímž buď inhibují translaci proteinů, nebo způsobují degradaci mRNA, případně obojí. To může ovlivnit expresi proteinů onkogenů i tumorsupresorových genů. Expresní profil miRNA, kterých je v současné době u člověka známo už přes 2500, je vysoce tkáňově specifický a liší se i v různě diferencovaných tkáních stejného původu, často je tedy pozměněný u rakovinných buněk (34,35). U KDH byl prozatím potvrzen relativně malý počet miRNA, které mají konstantně změněný expresní profil. Jedná se o snížení exprese miR-126, miR-143 a miR-145 a zvýšení exprese miR-15b, miR-16, miR-146a a mi-R155 (36). Je třeba ještě získat více dat týkajících se různých expresních profilů miRNA v těžkých lézích, nicméně už teď je pravděpodobné, že expresní analýza určité skupiny miRNA ve stěrech z děložního hrdla bude moci být v budoucnu použita jako biomarker detekující transformující léze.
Role sekvenování nové generace a genomiky viru
V současné době se díky dostupnosti sekvenování nové generace (next generation sequencing – NGS) objevily studie, které se pokouší rozkrýt do větších podrobností biologii HPV viru a mechanizmy jeho karcinogenity. Sekvenováním HPV16 bylo například zjištěno, že některé subvarianty tohoto viru mají specifický tropizmus (podle typu léze) a také představují různé riziko pro rozvoj onemocnění. Například subvarianty A4, D2 a D3 představují signifikantně vyšší riziko vzniku glandulárních lézí ve srovnání s běžnějšími subvariantami A1 a A2 (37-39), což může být využito pro zvýšení záchytu glandulárních lézí. NGS metody lze použít například i k průkazu toho, zda se u infekce určitým typem HPV viru jedná o perzistentní infekci, nebo o opakované nakažení jinou subvariantou stejného typu viru. V neposlední řadě bylo pomocí NGS zjištěno, že HPV16, který se vyskytuje v transformujích infekcích, má mnohem menší množství jednonukleotidových polymorfizmů (SNP) ve srovnání s HPV16 z infekcí tranzientních (38). Především HPV16 subvarianta s vysoce konzervovaným genem pro onkoprotein E7 je asociovaná se zvýšeným rizikem HPV indukované kancerogeneze (37).
V nedávné době se studie zaměřily na analýzu integrace HR HPV do genomu lidských buněk, často s využitím NGS. Integrace usnadňuje overexpresi virových onkogenů E6 a E7 a představuje zásadní krok v progresi HR HPV infekce, proto se jeví jako vhodný biomarker při stratifikaci pacientek. Mechanizmus integrace není ještě zcela rozluštěn, zdá se ale, že v něm mohou hrát roli procesy účastnící se oprav DNA (40). Virová integrace do hostitelských chromozomů může vyústit v epigenetické změny v genomu HPV (například metylaci L1 genu). Integrace je bohužel ale stejně jako metylace L1 virového genu typově specifická. HPV typy 31 a 33 se integrují s mnohem nižší frekvencí ve srovnání s typy 16, 18 a 45 (41). Zajímavá je i skutečnost, že podle nedávné studie se liší schopnost integrace i u jednotlivých variant HPV16 (42). Přibližně u 10-30 % těžkých lézí nebyla zatím integrace HPV do lidského genomu prokázána a předpokládá se jiný mechanizmus overexprese proteinů E6 a E7 (40,41). Všechna tato zmíněná fakta znamenají zatím značné překážky pro rutinní použití virové integrace jako biomarkeru ve skríningu KDH (43).
NGS a s ním spojené metody jsou zajímavou možností do budoucna využitelnou k stratifikaci žen ve zvýšeném riziku vzniku KDH, je ale třeba více studií, aby bylo tyto testy možné zařadit do algoritmu klinické praxe.
SHRNUTÍ
Molekulárně genetické testy nejen zvyšují úspěšnost skríningu KDH, ale umožnují snížit množství invazivních výkonů a nadbytečné léčby lézí bez akutního rizika progrese, což je důležité zejména u mladých žen s neukončenými reprodukčními plány.
Skríningové HPV testy zvyšují citlivost včasného záchytu těžkých lézí děložního hrdla. V zemích se zavedenou praxí cervikální cytologie je výhodné kombinovat v primárním skríningu KDH oba dva testy, neboť hodnocení cytologického stěru poskytuje mnoho dodatečných informací, a to nejen o HPV indukovaných lézích. Navíc nedávno publikovaná retrospektivní analýza laboratorních dat potvrdila, že samotné HPV testy v primárním skríningu KDH mohou minout malou podskupinu cervikálních karcinomů (44). Existuje několik teoretických možností, proč tomu tak je. Jednak ve vzácných případech mohou být karcinomy na děložním hrdle způsobeny jinými než HR HPV typy (př. HPV53 a 67). Druhou možností je biologická variabilita viru, a to zejména fakt, že v některých těžkých lézích DH se může během procesu integrace HPV do lidského genomu ztratit část genetické informace viru (zejm. geny E1, L1), proto HPV eseje detekčně cílící tyto geny mohou být falešně negativní (45). Dalším vysvětlením je skutečnost, že zřejmě existuje velmi vzácná varianta KDH, která není způsobena HPV viry. A v neposlední řadě nelze vyloučit možnost falešné negativity testu v důsledku velkého množství nekrotického materiálu, který může být přítomen ve velmi pokročilých stádiích KDH a inhibovat molekulárně genetickou esej (45). Tyto vzácné varianty selhání HPV testu ale nelze v populačním měřítku brát v úvahu zejména v případě méně rozvinutých zemí, kde zavedení logisticky a ekonomicky výhodnější varianty skríningu KDH pomocí primárního HPV testu může zachránit tisíce životů (46).
Další doplňkové molekulárně genetické testy zvyšují specifitu primárních testů, což dovolí stratifikaci rizika pacientek a sníží množství dalších ambulantních vyšetření a zbytečných invazivních zákroků. Sledováním genetických změn (jak v buňkách epitelu děložního hrdla, tak v genomu viru) pomocí metod molekulární biologie lze odlišit léze, ve kterých dochází k produktivní infekci virem HPV, od lézí, ve kterých dochází k transformaci genomu HPV virem. Transformující léze mohou být dále rozděleny na časné a pokročilé transformující léze na základě stanovení množství genetických a epigenetických změn (např. aberace počtu kopií DNA v buňce, metylace tumorsupresorových genů). Rozlišení časné a pokročilé transformující léze není vždy možné z histologického preparátu i při použití imunohistochemických markerů (30). Ženy s pokročilými transformujícími lézemi, které mají vysoké riziko rychlé progrese do karcinomu a potřebují neodkladnou léčbu, je možné odlišit právě použitím molekulárních metod. Tyto nové možnosti v algoritmu skríningu KDH představují hlavní přínos především pro mladší ženy v produktivním věku, u kterých by nadbytečná léčba mohla být spojena s komplikacemi v těhotenství a možným předčasným porodem (47,48). Metylační markery mohou být také využity k monitorováníHPV pozitivních žen po léčbě těžkých lézí, kde rozliší HPV infekci nově získanou po zákroku od původní infekce, jež zbyla v epitelu při nedostatečném odstranění tkáně.
Do budoucna je třeba vzít v úvahu fakt, že molekulární metody lze použít i pro materiál, který si žena odebere pomocí speciální odběrové soupravy sama (tzv. samoodběry). Metoda samoodběrů je obecně ve světě přijímána jako dobrý pomocník v oblastech bez dostupné lékařské péče nebo jako poslední možnost u žen, které se neúčastní skríningu karcinomu děložního hrdla. Ze samoodběru lze provést jak HPV testaci, případně genotypizaci, tak i některá další vyšetření, která už jsou pro samoodběry validována (např. test metylace tumorsupresorových genů QIAsure) (28). Provedení cytologického vyšetření z tohoto typu materiálu nemá velkou výpovědní hodnotu, neboť většinou obsahuje omezené množství cervikálních buněk, často špatně zachované morfologie, na pozadí velkého nadbytku buněk pochvy.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
RNDr. Kateřina Černá, Ph.D.
Bioptická laboratoř s.r.o.
Mikulášské náměstí 4, 326 00 Plzeň
tel. +420 737 512 841
email: cerna@biopticka.cz
Zdroje
1. Schiffman M, Clifford G, Buonaguro FM. Classification of weakly carcinogenic human papillomavirus types: addressing the limits of epidemiology at the borderline. Infect Agent Cancer 2009; 4: 8.
2. Schiffman M, Castle PE, Jeronimo J, Rodriguez AC, Wacholder S. Human papillomavirus and cervical cancer. Lancet 2007; 370: 890-907.
3. McCredie MR, Sharples KJ, Paul C, et al. Natural history of cervical neoplasia and risk of invasive cancer in women with cervical intraepithelial neoplasia 3: a retrospective cohort study. Lancet Oncol 2008; 9: 425-434.
4. Lowy DR, Schiller JT. Reducing HPV-associated cancer globally. Cancer Prev Res (Phila) 2012; 5: 18-23.
5. Schiffman M, Wentzensen N, Wacholder S, Kinney W, Gage JC, Castle PE. Human papillomavirus testing in the prevention of cervical cancer. J Natl Cancer Inst 2011; 103: 368-383.
6. Meijer CJ, Berkhof J, Castle PE, et al. Guidelines for human papillomavirus DNA test requirements for primary cervical cancer screening in women 30 years and older. Int J Cancer 2009; 124: 516-520.
7. Arbyn M, Depuydt C, Benoy I, et al. VALGENT: A protocol for clinical validation of human papillomavirus assays. J Clin Virol 2016; 76 Suppl 1: S14-s21.
8. Bulkmans NW, Berkhof J, Rozendaal L, et al. Human papillomavirus DNA testing for the detection of cervical intraepithelial neoplasia grade 3 and cancer: 5-year follow-up of a randomised controlled implementation trial. Lancet 2007; 370: 1764-1772.
9. Cuzick J, Clavel C, Petry KU, et al. Overview of the European and North American studies on HPV testing in primary cervical cancer screening. Int J Cancer 2006; 119: 1095-1101.
10. Poljak M, Kocjan BJ, Ostrbenk A, Seme K. Commercially available molecular tests for human papillomaviruses (HPV): 2015 update. J Clin Virol 2016; 76 Suppl 1: S3-s13.
11. Burger EA, Kornor H, Klemp M, Lauvrak V, Kristiansen IS. HPV mRNA tests for the detection of cervical intraepithelial neoplasia: a systematic review. Gynecol Oncol 2011; 120: 430-438.
12. Iftner T, Becker S, Neis KJ, et al. Head-to-Head Comparison of the RNA-Based Aptima Human Papillomavirus (HPV) Assay and the DNA-Based Hybrid Capture 2 HPV Test in a Routine Screening Population of Women Aged 30 to 60 Years in Germany. J Clin Microbiol 2015; 53: 2509-2516.
13. Cook DA, Smith LW, Law J, et al. Aptima HPV Assay versus Hybrid Capture((R)) 2 HPV test for primary cervical cancer screening in the HPV FOCAL trial. J Clin Virol 2017; 87: 23-29.
14. Cubie HA, Cuschieri K. Understanding HPV tests and their appropriate applications. Cytopathology 2013; 24: 289-308.
15. Cuschieri K, Bhatia R, Cruickshank M, Hillemanns P, Arbyn M. HPV testing in the context of post-treatment follow up (test of cure). J Clin Virol 2016; 76 Suppl 1: S56-s61.
16. Guan P, Howell-Jones R, Li N, et al. Human papillomavirus types in 115,789 HPV-positive women: a meta-analysis from cervical infection to cancer. Int J Cancer 2012; 131: 2349-2359.
17. de Sanjose S, Quint WG, Alemany L, et al. Human papillomavirus genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldwide study. Lancet Oncol 2010; 11: 1048-1056.
18. Khan MJ, Castle PE, Lorincz AT, et al. The elevated 10-year risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type-specific HPV testing in clinical practice.J Natl Cancer Inst 2005; 97: 1072-1079.
19. Kjaer SK, Frederiksen K, Munk C, Iftner T. Long-term absolute risk of cervical intraepithelial neoplasia grade 3 or worse following human papillomavirus infection: role of persistence. J Natl Cancer Inst 2010; 102: 1478-1488.
20. Pirog EC, Kleter B, Olgac S, et al. Prevalence of human papillomavirus DNA in different histological subtypes of cervical adenocarcinoma. Am J Pathol 2000; 157: 1055-1062.
21. Rijkaart DC, Berkhof J, van Kemenade FJ, et al. Evaluation of 14 triage strategies for HPV DNA-positive women in population-based cervical screening. Int J Cancer 2012; 130: 602-610.
22. Dijkstra MG, van Niekerk D, Rijkaart DC, et al. Primary hrHPV DNA testing in cervical cancer screening: how to manage screen-positive women? A POBASCAM trial substudy. Cancer Epidemiol Biomarkers Prev 2014; 23: 55-63.
23. Saslow D, Solomon D, Lawson HW, et al. American Cancer Society, American Society for Colposcopy and Cervical Pathology, and American Society for Clinical Pathology screening guidelines for the prevention and early detection of cervical cancer. CA Cancer J Clin 2012; 62: 147-172.
24. Schiffman M, Adrianza ME. ASCUS-LSIL Triage Study. Design, methods and characteristics of trial participants. Acta cytol 2000; 44: 726-742.
25. Clarke MA, Wentzensen N, Mirabello L, et al. Human papillomavirus DNA methylation as a potential biomarker for cervical cancer. Cancer Epidemiol Biomarkers Prev 2012; 21: 2125-2137.
26. Wentzensen N, Sherman ME, Schiffman M, Wang SS. Utility of methylation markers in cervical cancer early detection: appraisal of the state-of-the-science. Gynecol Oncol 2009; 112: 293-299.
27. Fournier A, Sasai N, Nakao M, Defossez PA. The role of methyl-binding proteins in chromatin organization and epigenome maintenance. Brief Funct Genomics 2012; 11: 251-264.
28. De Strooper LMA, Verhoef VMJ, Berkhof J, et al. Validation of the FAM19A4/mir124-2 DNA methylation test for both lavage - and brush-based self-samples to detect cervical (pre)cancer in HPV-positive women. Gynecol Oncol 2016; 141: 341-347.
29. Costello JF, Plass C. Methylation matters.J Med Genet 2001; 38: 285-303.
30. Steenbergen RD, Snijders PJ, Heideman DA, Meijer CJ. Clinical implications of (epi)genetic changes in HPV-induced cervical precancerous lesions. Nat Rev Cancer 2014; 14: 395-405.
31. Boers A, Wang R, van Leeuwen RW, et al. Discovery of new methylation markers to improve screening for cervical intraepithelial neoplasia grade 2/3. Clin Epigenetics 2016; 8: 29.
32. Bierkens M, Hesselink AT, Meijer CJ, et al. CADM1 and MAL promoter methylation levels in hrHPV-positive cervical scrapes increase proportional to degree and duration of underlying cervical disease. Int J Cancer 2013; 133: 1293-1299.
33. Steenbergen RD, Ongenaert M, Snellenberg S, et al. Methylation-specific digital karyotyping of HPV16E6E7-expressing human keratinocytes identifies novel methylation events in cervical carcinogenesis. J Pathol 2013; 231: 53-62.
34. Wilting SM, Verlaat W, Jaspers A, et al. Methylation-mediated transcriptional repression of microRNAs during cervical carcinogenesis. Epigenetics 2013; 8: 220-228.
35. Lopez-Serra P, Esteller M. DNA methylation-associated silencing of tumor-suppressor microRNAs in cancer. Oncogene 2012; 31: 1609-1622.
36. Kaczkowski B, Morevati M, Rossing M, Cilius F, Norrild B. A Decade of Global mRNA and miRNA Profiling of HPV-Positive Cell Lines and Clinical Specimens. Open Virol J 2012; 6: 216-231.
37. Mirabello L, Yeager M, Cullen M, et al. HPV16 Sublineage Associations With Histology-Specific Cancer Risk Using HPV Whole-Genome Sequences in 3200 Women. J Natl Cancer Inst 2016; 108: doi: 10.1093/jnci/djw100.
38. Cullen M, Boland JF, Schiffman M, et al. Deep sequencing of HPV16 genomes: A new high-throughput tool for exploring the carcinogenicity and natural history of HPV16 infection. Papillomavirus Res 2015; 1: 3-11.
39. Burk RD, Terai M, Gravitt PE, et al. Distribution of human papillomavirus types 16 and 18 variants in squamous cell carcinomas and adenocarcinomas of the cervix. Cancer Res 2003; 63: 7215-7220.
40. Bodelon C, Untereiner ME, Machiela MJ, Vinokurova S, Wentzensen N. Genomic characterization of viral integration sites in HPV-related cancers. Int J Cancer 2016; 139: 2001-2011.
41. Vinokurova S, Wentzensen N, Kraus I, et al. Type-dependent integration frequency of human papillomavirus genomes in cervical lesions. Cancer Res 2008; 68: 307-313.
42. Jackson R, Rosa BA, Lameiras S, et al. Functional variants of human papillomavirus type 16 demonstrate host genome integration and transcriptional alterations corresponding to their unique cancer epidemiology. BMC genomics 2016; 17: 851.
43. Torres-Rojas FI, Alarcon-Romero LDC, Leyva-Vazquez MA, et al. Methylation of the L1 gene and integration of human papillomavirus 16 and 18 in cervical carcinoma and premalignant lesions. Oncol Lett 2018; 15: 2278-2286.
44. Rossi PG, Ronco G, Dillner J, et al. Why follow-back studies should be interpreted cautiously: The case of an HPV-negative cervical lesion. Cancer Cytopathol 2016; 124: 66-67.
45. Wentzensen N, Arbyn M. HPV-based cervical cancer screening - facts, fiction, and misperceptions. Prev Med 2017; 98: 33-35.
46. Maza M, Gage JC. Considerations for HPV primary screening in lower-middle income countries. Prev Med 2017; 98: 39-41.
47. Bruinsma FJ, Quinn MA. The risk of preterm birth following treatment for precancerous changes in the cervix: a systematic review and meta-analysis. BJOG 2011; 118: 1031-1041.
48. Arbyn M, Kyrgiou M, Simoens C, et al. Perinatal mortality and other severe adverse pregnancy outcomes associated with treatment of cervical intraepithelial neoplasia: meta-analysis. BMJ 2008; 337: a1284.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2018 Číslo 4-
Všechny články tohoto čísla
-
Cytopathologist is the best…
… to do more with even less - Cytopatologie - ze škaredého kačátka se stává labuť
- Monitor aneb nemělo by vám uniknout, že...
- Moderní cytopatologie
- Negynekologická cytologie – návod na přežití
- Karcinom děložního hrdla v ČR a možnosti jeho prevence
- Molekulárně genetické metody ve skríningu karcinomu děložního hrdla
- MUDr. Jiří Kudrmann
- Cytologie výpotků v coelomových dutinách
- Hyalinizující trabekulární tumor štítné žlázy s transkapsulární invazí: kazuistika
- Jaká je vaše diagnóza?
- Intravaskulární fasciitida vedoucí k disekci aorty. Kazuistika
- Monitor aneb nemělo by vám uniknout, že...
- Setkání profesora Antonína Fingerlanda s budoucím nositelem Nobelovy ceny Dr. Danielem Carletonem Gajduskem v Antverpách v roce 1959
- Jaká je vaše diagnóza? Odpověď: Dysplastický cerebelární gangliocytom (onemocnění Lhermitte-Duclos)
- Monitor aneb nemělo by vám uniknout, že...
-
Cytopathologist is the best…
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Cytologie výpotků v coelomových dutinách
- Karcinom děložního hrdla v ČR a možnosti jeho prevence
- Hyalinizující trabekulární tumor štítné žlázy s transkapsulární invazí: kazuistika
- Molekulárně genetické metody ve skríningu karcinomu děložního hrdla
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



