-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Peroperačná diagnostika nádorov centrálneho nervového systému
Autoři: Marián Švajdler 1,2; Boris Rychlý 3; Josef Zámečník 4; Peter Švajdler 5
Působiště autorů: Šiklův ústav patologie, Univerzita Karlova v Praze, Lékařská fakulta v Plzni a Fakultní nemocnice Plzeň, Česká republika 1; Bioptická laboratoř, s. r. o., Plzeň, Česká republika 2; Cytopathos s. r. o., Bratislava, Slovenská republika 3; Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole, Praha, Česká republika 4; Oddelenie patológie, Univerzitná nemocnica Louisa Pasteura, Košice, Slovenská Republika 5
Vyšlo v časopise: Čes.-slov. Patol., 54, 2018, No. 3, p. 119-126
Kategorie: Přehledový článek
Souhrn
Nádory centrálneho nervového systému (CNS) sú relatívne vzácne a pre patológa, ktorý nie je špecialistom na neuropatológiu, môže byť peroperačné vyšetrovanie lézií CNS „nočnou morou”. Systematický prístup s využitím zobrazovacích metód, znalostí typickej klinickej prezentácie jednotlivých typov nádorov a kombinácia zmrazených rezov s náterovou cytológiou však umožňujú vo väčšine prípadov spoľahlivú diagnózu. V článku popisujeme indikácie, ciele, diagnostický algoritmus a potenciálne diagnostické pasce peroperačného vyšetrovania lézií CNS.
Kľúčové slová:
peroperačná biopsia – náterová cytológia – centrálny nervový systém
Nádory centrálneho nervového systému (CNS) sú relatívne vzácne a pre bežného patológa, ktorý nie je špecialistom na neuropatológiu, môže byť peroperačné vyšetrovanie lézií CNS „nočnou morou” (1). Často ide o vyšetrenie veľmi malej vzorky tkaniva, ktorá je niekedy získaná iba stereotaktickou alebo endoskopickou biopsiou. Mnoho nádorov CNS má prekrývajúce sa histologické a cytologické charakteristiky a presná klasifikácia a grading sú aj v definitívnej biopsii v súčasnosti možné až po imunohistochemickom alebo genetickom vyšetrení (2,3). Vo veľkej časti prípadov preto počas operácie úplne stačí informácia o reprezentatívnosti odobratého tkaniva (1).
V článku sa budeme venovať všeobecným aspektom peroperačného vyšetrovania lézií CNS a na konkrétnych prípadoch ukážeme, že systematický prístup s využitím klinických informácií, zobrazovacích metód, znalostí typickej lokalizácie určitých lézií v konkrétnej vekovej skupine a predovšetkým použitie peroperačnej cytológie umožňujú vo väčšine prípadov spoľahlivú diagnózu.
Indikácie, ciele a algoritmus peroperačnej diagnostiky lézií CNS
Aj v prípade peroperačného vyšetrenia lézií CNS platí základné pravidlo, že výsledok peroperačnej konzultácie by malovplyvniť ďalší postup operácie alebo bezprostrednú pooperačnú starostlivosť o pacienta. V opačnom prípade je lepšie ponechať tkanivo na definitívne vyšetrenie, a vzácnym materiálom zbytočne neplytvať. Peroperačné vyšetrenie môže mať niekoľko cieľov (1,4,5):
(i) Posúdenie reprezentatívnosti tkaniva. Absolútnou prioritou je odber diagnostickej vzorky počas prvej operácie. Opakovanie diagnostickej procedúry (otvorenej alebo stereotaktickej biopsie) je vždy asociované s rizikom komplikácií. Týka sa to najmä lézií vo funkčne kritických lokalitách (napr. mozgový kmeň), kde je často možný iba jeden pokus o biopsiu. Patológ by si mal byť prítomnosťou lézie istý. V opačnom prípade by mal vždy požiadať o ďalšie tkanivo.
(ii) Stanovenie či je lézia nádorová alebo nenádorová (napr. infarkt, demyelinizácia, infekcia). V prípade podozrenia na infekčné ochorenie musí operatér zabezpečiť odber materiálu na mikrobiologické vyšetrenie. V prípade demyelinizácie (radiologicky s obrazom tzv. tumefaktívnej demyelinizácie) je samozrejme operačný zákrok ukončený.
(iii) Stanovenie presného histologického typu nádorovej lézie. Vo všeobecnosti platí, že sa operatér snaží odstrániť nádor v čo najväčšom rozsahu, samozrejme s ohľadom na lokalizáciu lézie a možný následný neurodeficit. U niektorých lézií však totálna resekcia nádorového tkaniva nie je možná, alebo nemá väčší terapeutický význam. V prípade diagnózy lymfómu, pri nemožnosti resekcie (často ide o hlboko lokalizované lézie), postačí diagnostická biopsia a odber materiálu na špeciálne vyšetrenia. Výsledok flowcytometrického vyšetrenia s presnou diagnózou môže byť k dispozícii už za pár hodín. V prípade diagnózy difúzneho gliómu sa môže začať liečba už počas operácie, napr. ožiarením nádorového hypofýlôžka. V prípade ependymómov je najdôležiteším prognostickým faktorom kompletnosť chirurgickej resekcie („gross total resection“). Patológ by preto mal vedieť ependymóm rozpoznať, aj keď v mnohých prípadoch to nie je spoľahlivo možné. Podobne, správne rozpoznanie metastázy alebo low-grade primárneho tumoru môže znamenať, že namiesto probatórnej biopsie sa chirurg môže pokúsiť o kompletné odstránenie ložiska.
(iv) Grade nádorovej lézie. V prípade, že je predoperačne predpokladaná diagnóza high-grade gliómu (napr. pri vyšetrení magnetickou rezonanciou ide o kontrast vychytávajúcu prstencovitú léziu u staršieho pacienta s krátkou anamnézou), histologický nález iba mierne hypercelulárneho tkaniva s minimálnymi cytologickými atypiami, bez nekróz alebo mikrovaskulárnej proliferácie nekoreluje s klinickou prezentáciou - neurochirurg pravdepodobne zaslal tkanivo z periférnej „low-grade“ časti gliómu a pokiaľ to situácia dovoľuje mal by vykonať ďalší odber tkaniva z hlbších častí lézie.
Diagnostický algoritmus peroperačne vyšetreného tkaniva lézií CNS sa v podstate nelíši od diagnostiky z tkaniva spracovaného v parafíne a jeho najjednoduchšie zhrnutie je následovné (1,4,6,7):
- Je zachytené normálne tkanivo, alebo je prítomná patologická lézia?
- Je lézia nádorová, alebo by sa mohlo jednať o léziu nenádorovú, ktorá nádor iba napodobuje? Nemôže sa jednať iba o reaktívnu gliózu?
- Aký je histologický typ nádoru (metastáza, lymfóm, difúzny glióm, iný primárny tumor)?
- Aký je grade?
- Zodpovedá patologická diagnóza klinickej prezentácii a radiologickému nálezu?
Ako už bolo spomínané, odpoveď na všetky otázky nie je vždy možná a ani nutná. Niekedy stačí rámcová diagnóza (napr. „high - grade glióm, pravdepodobne glioblastóm“), alebo krátka diferenciálna diagnóza (napr. „malígna epiteloidná lézia, pravdepodobne metastáza karcinómu, nemožno vylúčiť epiteloidný glioblastóm“). Vzácne je nevyhnutné odložiť diagnózu na vyšetrenie definitívnej biopsie.
Technika peroperačného vyšetrenia Podobne ako pri vyšetrovaní iných orgánov, aj pri peroperačnom vyšetrení lézií CNS je základom kvalitný zmrazený rez ofarbený hematoxylínom-eozínom. Rezy dávajú patológovi prehľad o celularite, architektonike, prípadne aj mitotickej aktivite, horšie to však môže byť s cytologickými detailami. Zmrazenie tkaniva vedie k vzniku artefaktov, napr. arteficiálnemu zväčšeniu, angulácii a hyperchromázii jadier, čo môže viesť k neprávnej diagnóze gliómu aj pri zmrazení normálneho tkaniva alebo reaktívnej gliózy. Navyše, nedostatočne rýchlym zmrazením edematózneho nádorového tkaniva môžu vzniknúť ľadové kryštály, ktoré tkanivo potrhajú a znemožnia spoľahlivé hodnotenie biopsie (obr. 1A). Preto je pri vyšetrovaní lézií CNS vhodné doplniť vyšetrenie zmrazených rezov cytologickým vyšetrením (1,4,5,8). Cytológia poskytne patológovi dokonalé cytologické detaily ako aj informáciu o pozadí/stróme (napr. fibrilárne pozadie gliómov) (obr. 1B,C). V porovnaní so zmrazenými rezmi spotrebuje cytológia neporovnateľne menej tkaniva. V prípade, že je peroperačné vyšetrenie veľmi malej vzorky naozaj nutné, niektorí autori (vrátane autorov tohoto článku) preferujú iba samotné cytologické vyšetrenie a tkanivo v zmrazených rezoch nevyšetrujú (1).
Obr. 1. A) Biopsia tumoru frontálneho laloka u 31-ročného muža. Zmrazením tkaniva došlo k vzniku kryštálikov ľadu a potrhaniu tkaniva. Aj keď sú nepravidelné a hyperchromatické jadrá sugestívne pre diagnózu gliómu, architektoniku nemožno spoľahlivo hodnotiť. (B) Gliálne lézie sa v náterovej cytológii prezentejú skupinami buniek, ktoré sú vzájomne spojené eozinofilnými gliálnymi výbežkami. (C) Detailný pohľad na nádorové bunky potvrdil prítomnosť eozinofilnej cytoplazmy s gliálnymi výbežkami, jadrovú hyperchromáziu a pleomorfiu. Peroperačná diagnóza: low-grade primárny (astrocytárny) novotvar. Definitívna diagnóza: difúzny astrocytóm, grade II. (D) Pomocou náterovej cytológie je možné vyšetriť rôzne časti materiálu na jednom skle. (E) Náter zhotovený z dvoch rôznych častí materiálu (vložený obrázok) ukázal prítomnosť nádoru – oligodendrogliómu (horná časť obrázku) a normálneho tkaniva mozgu (dolná časť obrázku). Možnosť porovnania nenádorovej a nádorovej populácie výrazne uľahčuje diagnózu. (F) Cytolyticky zmenené bunky difúzneho veľkobunkového B-lymfómu. Reprezentatívnejšie (menej cytotolyzované) bunky boli prítomné v inej časti náteru. Na optimálne zachovanie cytologických detailov je nevyhnutná okamžitá fixácia. 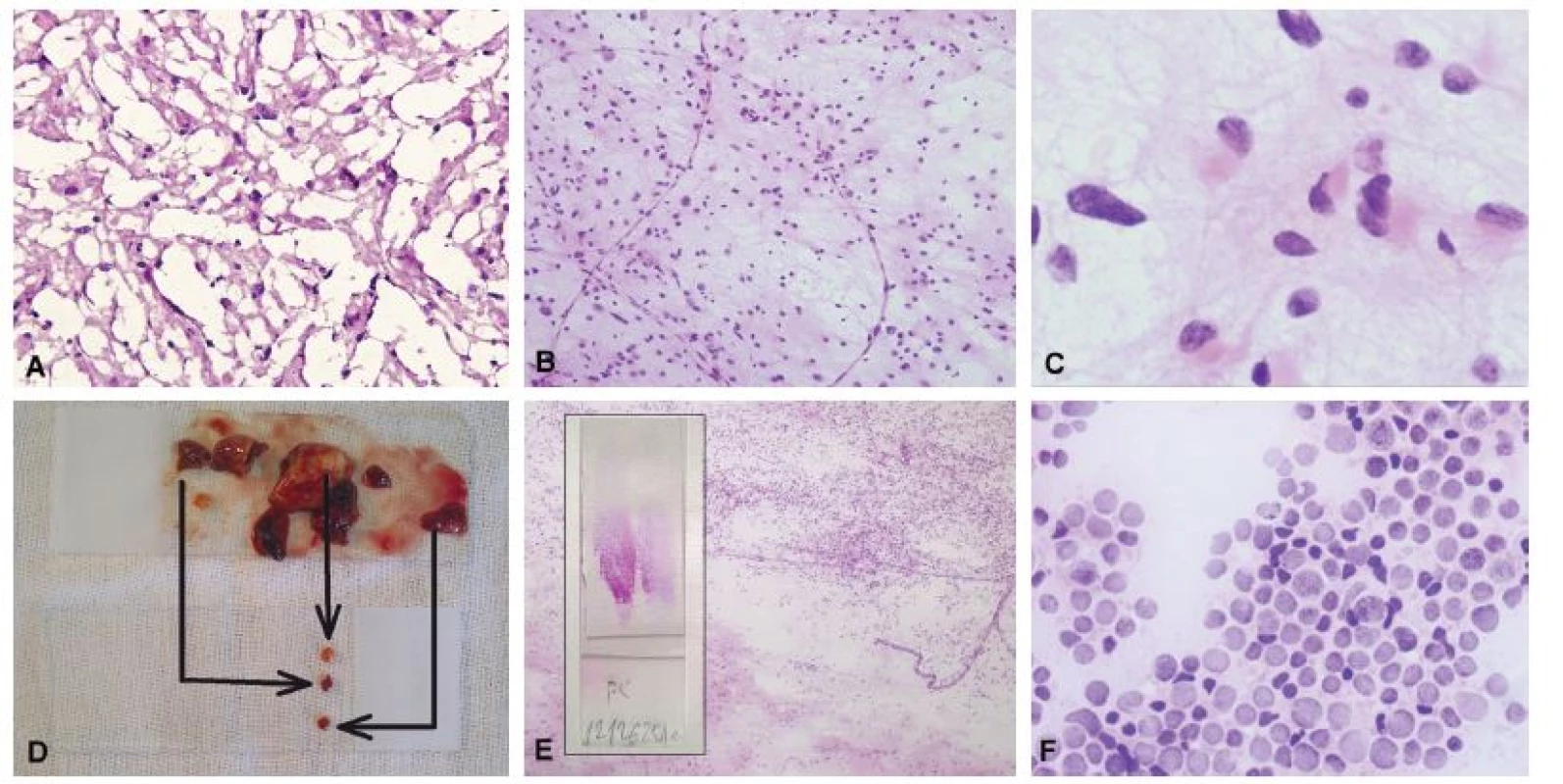
Existujú dva typy techník ako zhotoviť cytologický preparát. Dotykové metódy („touch“, „imprint“) sú vhodné predovšetkým pre lézie, ktoré ľahko uvoľňujú bunky, napr. adenómy hypofýalezy alebo lymfómy (1,9). Omnoho lepšie výsledky je však možné dosiahnuť technikou jemného roztlačenia vzorky medzi dvoma podložnými sklíčkami a následným rozotretím tkaniva („squash“, „crush“, alebo „smear“ cytológia) (1,8). Použitím tejto techniky sa často zachovajú aj niektoré histologické/architektonické detaily (napr. perivaskulárne usporiadanie buniek gliómu), takže predstavuje metodiku na pomedzí histológie a cytológie. V prípade, že je na peroperačné vyšetrenie zaslané väčšie množstvo tkaniva s heterogénnym makroskopickým vzhľadom, je pomocou náterovej cytológie možné vykonať „sampling“ lézie a vyšetriť rôzne časti materiálu na jednom skle (obr. 1D,E). Dôležita je rýchla – okamžitá – fixácia cytologického preparátu 95% alkoholom, buď ponorením skla do alkoholu v kyvete, alebo opatrným nastriekaním fixačného roztoku na sklo v horizontálnej polohe pomocou rozprašovača (podľa našich skúseností lepšia možnosť). K cytolýze a strate morfologických detailov dochádza už po niekoľkých sekundách od zhotovenia náteru (obr. 1F). Nevýhodou cytológie je, že nadhodnocuje celularitu lézie, hodnotenie architektoniky je menej spoľahlivé ako v zmrazených rezoch a je nešetrná k mitózam, ktoré sa veľmi ľahko „rozpadnú“ (8). Preto nález aj jednej-dvoch mitóz v náterovej cytológii väčšinou znamená, že nádor je mitoticky vysoko aktívny (8).
Zmrazené rezy a cytológia sa vzájomne dopĺňajú, preto ak má patológ dostatočné množstvo tkaniva, mal by použiť obe metodiky.
Detailný popis nálezov v náterovej cytológii rôznych lézií CNS je mimo rozsah tohto článku a pre podrobné štúdium odkazujeme predovšetkým na dve vynikajúce učebnice (1,8) a ďalšie referencie na konci článku. Väčšinu nálezov je možné rozdeliť do niekoľkých základných vzorov (8):
- A) Gliálne lézie (gliómy, reaktívna glióza) sa v náterovej cytológii prezentejú skupinami buniek, ktoré sú vzájomne (alebo s cievami) spojené eozinofilnými gliálnymi výbežkami (8). Diagnóza oligodendrogliómu však môže byť obtiažna, hlavnou diferenciálnou diagnózou je neurocytóm (10-12).
- B) Epitelové lézie (metastázy karcinómov, kraniofaryngeóm, nádory plexus choroideus, meningoteliálne meningiómy) sú charakterizované kohezívnymi bunkami s dobre definovanými bunkovými membránami, v plachtovitých, papilárnych alebo globoidných formáciách (13-19).
- C) Pre diskohezívne („tekuté“) lézie (napr. adenómy hypofýzy, lymfómy, niektoré nízko diferencované karcinómy, melanómy, zápalové lézie, medulloblastómy, atypický teratoidný/ rabdoidný tumor) je typické, že sa vďaka nízkemu podielu intercelulárnej matrix natierajú úplne ľahko, sú na skle natreté rovnomerne (podobne ako hematologické nátery), bez zhlukovania buniek, často vo forme „nahých jadier“ - cytoplazma buniek diskohezívnych lézií je často veľmi krehká a ľahko sa rozpadá (20-23).
- D) Kohezívne lézie (napr. schwannóm, hemangioblastóm, niektoré meningiómy, niektoré karcinómy, gliosarkómy) obsahujú veľa kolagénnej matrix, ktorá pevne viaže bunky a tie je možné natretím získať iba s ťažkosťami (24,25), prípadne sú natoľko poškodené použitou silu, že sú často nehodnotiteľné. Našťastie, pri týchto léziách je často možná kompletná resekcia a peroperačná diagnóza nemusí byť až taká dôležitá.
Peroperačná diagnostika najčastejších lézií CNS u dospelých a detí
Peroperačné vyšetrenie lézií centrálneho nervového systému vyžaduje koreláciu klinických a radiologických údajov s histologickým a/alebo cytologickým nálezom. Patológ musí dostatočne ovládať v akom veku a akej lokalite sa konkrétne lézie najčastejšie vyskytujú a ovládať aspoň základy zobrazovacích metód. Aj keď sa v podstate takmer všetky nádory dospelého veku môžu vyskytovať aj u detí a naopak, niektoré „detské“ nádory postihujú aj dospelých, mnohé lézie sú výrazne častejšie v jednej alebo druhej skupine (1,8,26,27). Iné lézie sa v danej vekovej skupine prakticky vôbec nevyskytujú, napríklad oligodendroglióm alebo meningeóm u detí, alebo karcinóm plexus choroideus u dospelých. Je vhodné, aby ešte pred samotným peroperačným vyšetrením bola sformulovaná diferenciálna diagnóza, ktorá vychádza z veku pacienta, lokalizácie tumoru, klinického priebehu a radiologického nálezu.
Napríklad, supratentoriálna prstencovitá kontrast-pozitívna lézia na magnetickej rezonancii u dospelého pacienta môže predstavovať glioblastóm (obr. 2), metastázu (obr. 3) alebo absces. Podobnú radiologickú prezentáciu však môže mať vzácne aj lymfóm (obr. 4A,B), alebo demyelinizačný pseudotumor (tzv. tumefaktívna demyelinizácia) (obr. 4C-F) (28-31). Solídna extraaxiálna lézia v oblasti ponto-cerebelárneho uhla bude s veľkou pravdepodobnosťou schwannóm (obr. 5A,B) alebo meningeóm (obr. 5C,D). Solídno-cystická lézia v oblasti mozočka môže predstavovať metastázu alebo hemangioblastóm (obr. 5E,F), vzácnejšie pilocytický astrocytóm (najmä u mladších dospelých).
Obr. 2. (A) Biopsia tumoru temporálne vpravo u 59-ročného muža. Radiologicky suspekný high-grade glióm. V zmrazených rezoch bol zachytený hypercelulárny tumor tvorený atypickými bunkami s objemnou cytoplazmou. (B) Mikrovaskulárna proliferácia. (C) Detail cytologických atypií v zmrazenom reze, prítomné boli početné mitózy. (D) V náterovej cytológii bolo možné pozorovať abnormálne cievy (mikrovaskulárna proliferácia), ku ktorým boli gliálnymi výbežkami pripojené nádorové bunky. (E) Detail mikrovaskulárnej proliferácie. (F) Atypické bunky s gemistocytickou morfológiou na fibrilárnom pozadí. Peroperačná diagnóza: high-grade glióm – glioblastóm. Definitívna diagnóza: Glioblastóm, Grade IV. 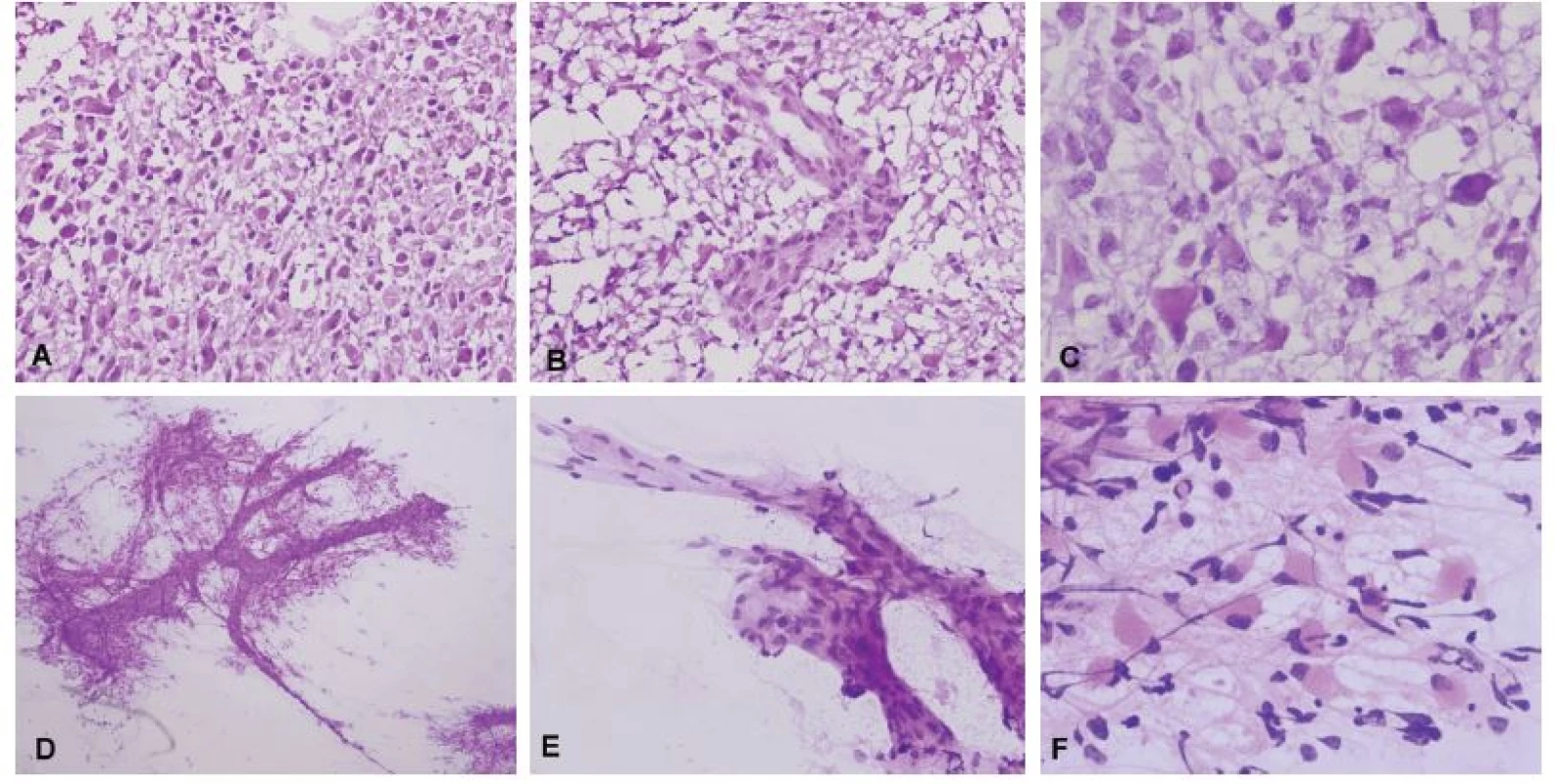
Obr. 3. (A, B) Biopsia supratentoriálneho ložiska u 35-ročnej ženy. V náterovej cytológii boli zachytené papilárne formácie kohezívnych epiteloidných buniek (A). V niektorých bunkách bola prítomná intracelulárna produkcia mucínu (B). Peroperačná diagnóza: metastáza adenokarcinómu. Definitívna diagnóza: metastáza papilárneho adenokarcinómu pľúc. (C, D) Biopsia solitárneho ložiska u 63-ročného muža. V cytológii zachytené kohezívne plachtovité formácie epiteloidních buniek. Ložiskovo naznačené glandulárne/acinárne štruktúry (C). Išlo o mierne atypické bunky s objemnou kolumnárnou cytoplazmou s početnými mitózami (D). Peroperačná diagnóza: metastáza karcinómu, skôr adenokarcinómu. Definitívna diagnóza: metastáza acinárneho karcinómu prostaty. (E, F) Biopsia supratentoriálneho ložiska u 19-ročného muža s anamnézou testikulárneho seminómu. V cytológii zachytené naznačene papilárne formácie epiteloidných buniek (E). Jednalo sa o výrazne atypické bunky s prominentními jadierkami a svetlo eozinofilnou cytoplazmou (F). Peroperačná diagnóza: metastáza epitelového nádoru, mohlo by sa jednať o germ-cell tumor. Definitívna diagnóza: metastáza embryonálneho karcinómu. 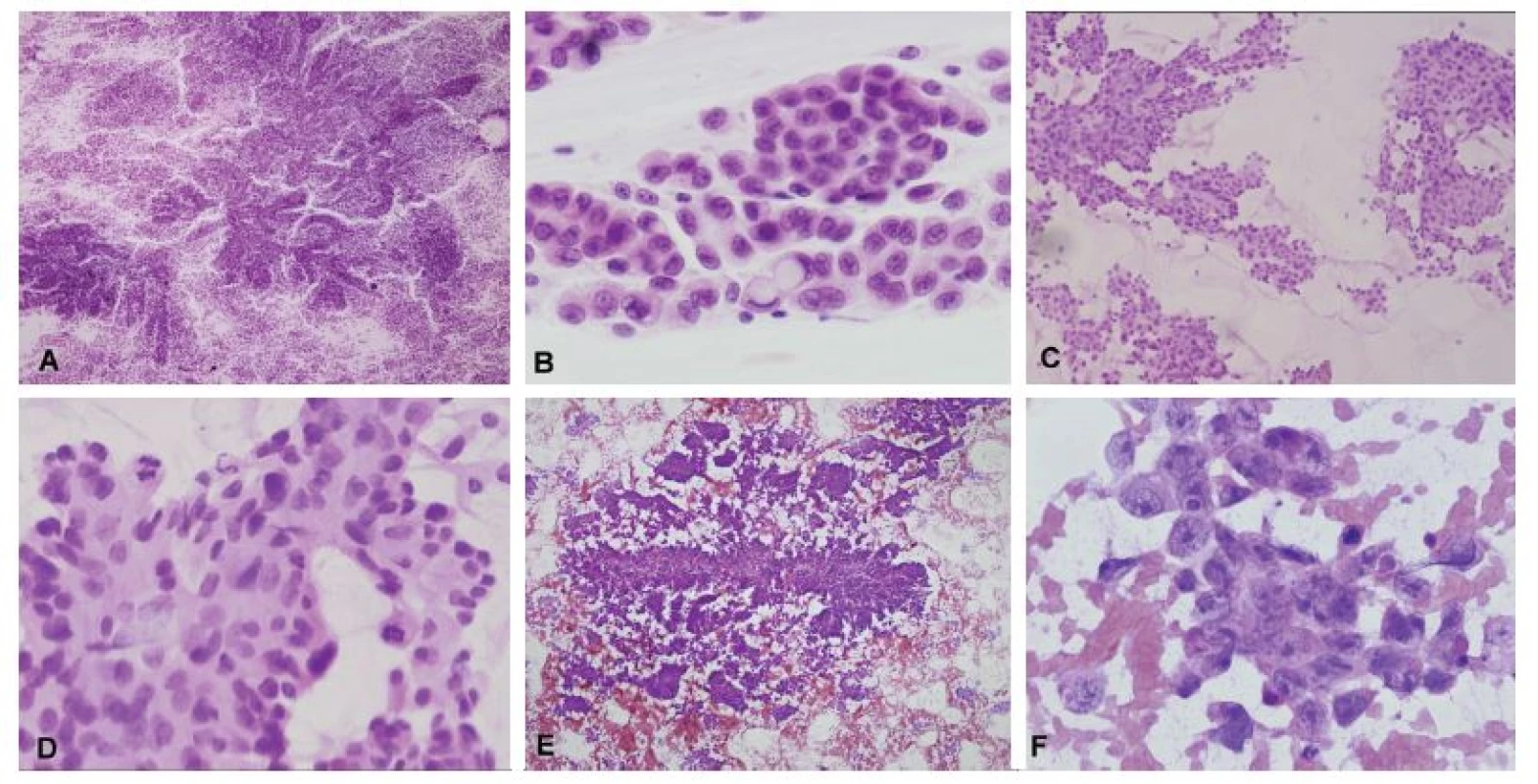
Obr. 4. (A, B) Periventrikulárny tumor u 75-ročnej ženy. V zmrazenom reze jasná nádorová infiltrácia, typ nádoru však nemožno spoľahlivo stanoviť (A). V náterovej cytológii bola zachytená diskohezívna lymfoidná populácia buniek, niektoré iba s nahými jadrami, iné s tenkým lemom cytoplazmy. Na pozadí početné tzv. lymfoglandulárne telieska - fragmenty cytoplazmy po rozpade buniek. Jadrá majú vzhľad prevažne centrocytrov (B). Peroperačná diagnóza: high-grade lymfóm. Definitívna diagnóza: difúzny veľkobunkový B-lymfóm (DLBCL). (C-F) Supratentoriálne ložisko u 21-ročnej ženy. Náter bol na prvý pohľad celulárny a pôsobil „nádorovo“ (C). Pri bližšom pohľade ale bolo jasné, že sa jedná o heterogénnu populáciu buniek, ktorá je tvorená reaktívnymi astrocytmi s jemnými pravidelnými dlhými výbežkami, malými lymfocytmi a makrofágmi s objemnou svetlou jemne granulárnou cytolplazmou (D, E). V ložiskách demyelinizácie (ale aj iných procesoch s reaktívnou astrocytózou) sa často vyskytujú neobvyklé astrocyty s fragmentovaným jadrom – tzv. Creutzfeldtove bunky (F). Peroperačná diagnóza: akútna zápalová demyelinizácia, jednoznačný nádor nie je prítomný. Definitívna diagnóza: ložisko aktívnej demyelinizácie sugestívne pre diagnózu sclerosis multiplex. 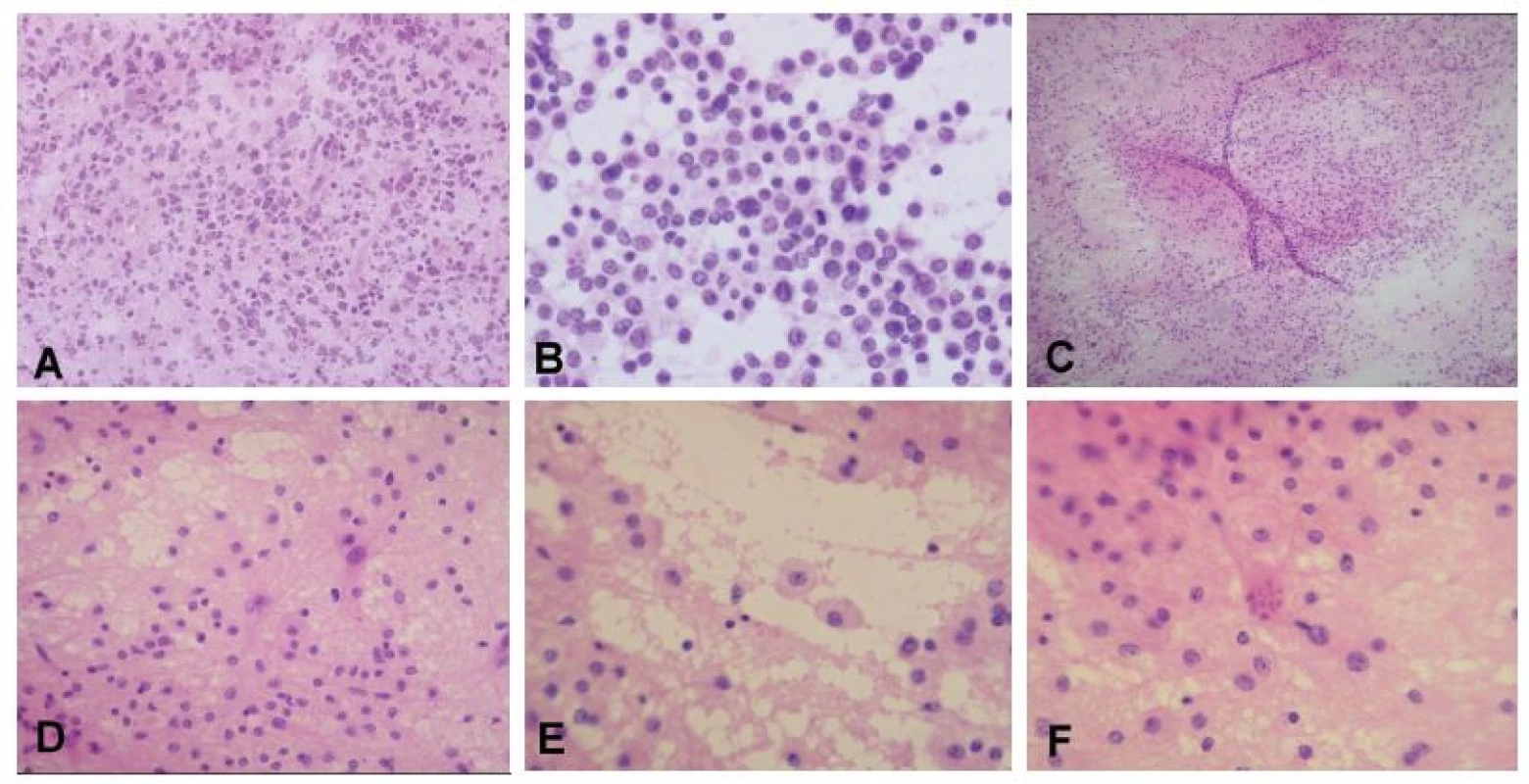
Obr. 5. (A, B) Tumor pontocerebelárneho uhla u 53-ročného muža. V zmrazenom reze bola zachytená lézia bohatá na kolagénnu matrix a vretenitými bunkymi s hyperchrómnymi pretiahnutými jadrami s naznačeným rytmickým/palisádujúcim usporiadaním (A). V náterovej cytológii prítomné iba zhluky tkaniva (žiadne izolované bunky) zloženého z vretenitých buniek s tmavými jadrami, palisádovanie však bolo ložiskovo ešte výraznejšie ako v zmrazenom reze (B). Peroperačná a definitívna diagnóza: schwannóm. (C, D) Tumor pontocerebelárneho uhla u 48-ročnej ženy. V zmrazenom reze je zachytená solídna proliferácia epiteloidných buniek, s naznačenými vírovitými formáciami (C). V náterovej cytológii monotónna blandná populácia epiteloidných kohezívnych buniek (spojené širokým pruhom cytoplazmy), ložiskovo s typickým vírovitým usporiadaním a jadrovými pseudoinklúziami (vložený obrázok) (D). Peroperačná diagnóza: meningióm. Definitívna diagnóza: meningoteliálny meningióm, grade I. (E, F) 62-ročná žena so solídno-cystickým tumorom hemisféry mozočka. V zmrazenom reze bola zachytená nádorová lézia tvorená bunkymi s vakuolizovanou cytoplazmou a atypickými hyperchrómnymi jadrami (E). V náterovej cytológii kohezívne fragmenty tvorené epiteloidnými bunkami s atypickými jadrami a jemne vakuolizovanou cytoplazmou (F). Peroperačná a definitívna diagnóza: hemagioblastóm. 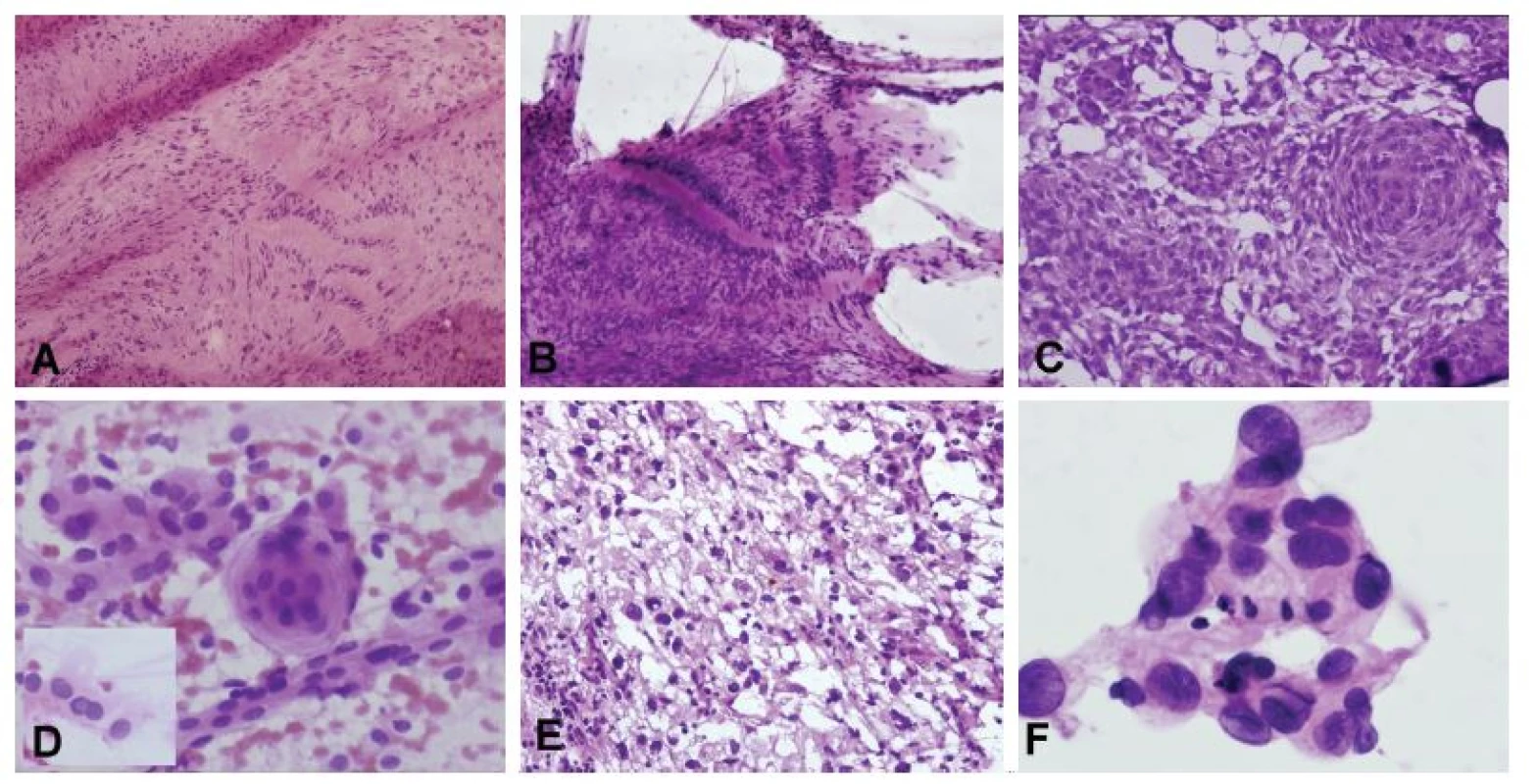
U pacienta v detskom veku v prípade solídno-cystického kontrast-pozitívneho tumoru v zadnej jame je nutné na prvom mieste uvažovať o pilocytickom astrocytóme (obr. 6A,B) (32) alebo medulloblastóme - tieto dve biologicky a prognosticky kompletne odlišné lézie môžu mať prakticky identický radiologický nález (obr. 6C,D)(21). Difúzne gliómy majú identický histologický a cytologický obraz ako u dospelých, ale napr. lokalizácia v mozgovom kmeni je typickejšia pre detský vek. Atypický teratoidný/ rabdoidný tumor (AT/RT) je vzácny tumor, ktorý ale tvorí až ~ 10% nádorov dojčeneckého veku (obr. 6E,F)(22,23).
Obr. 6. (A, B) Nádor mozočka u 6-ročného chlapca, s typickou radiologickou prezentáciou – cysta s kontrast-pozitívnym murálnym uzlíkom. V náterovej cytológii bolo zrejmé, že sa jedná gliový tumor s cytologicky blandnými bunkami usporiadanými okolo abnormálnej cievy (pripomína mikrovaskulárnu proliferáciu high-grade gliómov, ale stena je pravdepodobne hyalínne zmenená) (A). V detaile monotónna populácia s blandnými jadrami a dlhými piloidnými výbežkami. Užitočným pomocným znakom je prítomnosť Rosenthalovych vláken. Peroperačná a definitívna diagnóza: pilocytický astrocytóm. (C, D) Solídny, kontrast-pozitívny tumor mozočka u 5-ročného chlapca. Náter bol rovnomerný, išlo o léziu s nízkou kohezivitou nádorových buniek (C). Jednalo o malé bunky s minimom cytoplazmy, „salt and pepper“ chromatínom, bez nápadnejších jadierok a početnými mitózami a apoptózami (D). Peroperačná a definitívna diagnóza: medulloblastóm, klasický typ. U dospelého pacienta by pri podobnom náleze bola v diferenciálnej diagnóze na prvom mieste metastáza malobunkového karcinómu. (E, F) Tumor IV. komory u 2–ročného chlapca. V náterovej cytológii boli zachytené jednak kohezívnejšie pseudopapilárne usporiadanie, celkovo však bol náter diskohezívny (E). Vo veľkom zväčšení charakteristické rabdoidné bunky (F). Peroperačná a definitívna diagnóza: atypický teratoidný/rabdoidný tumor 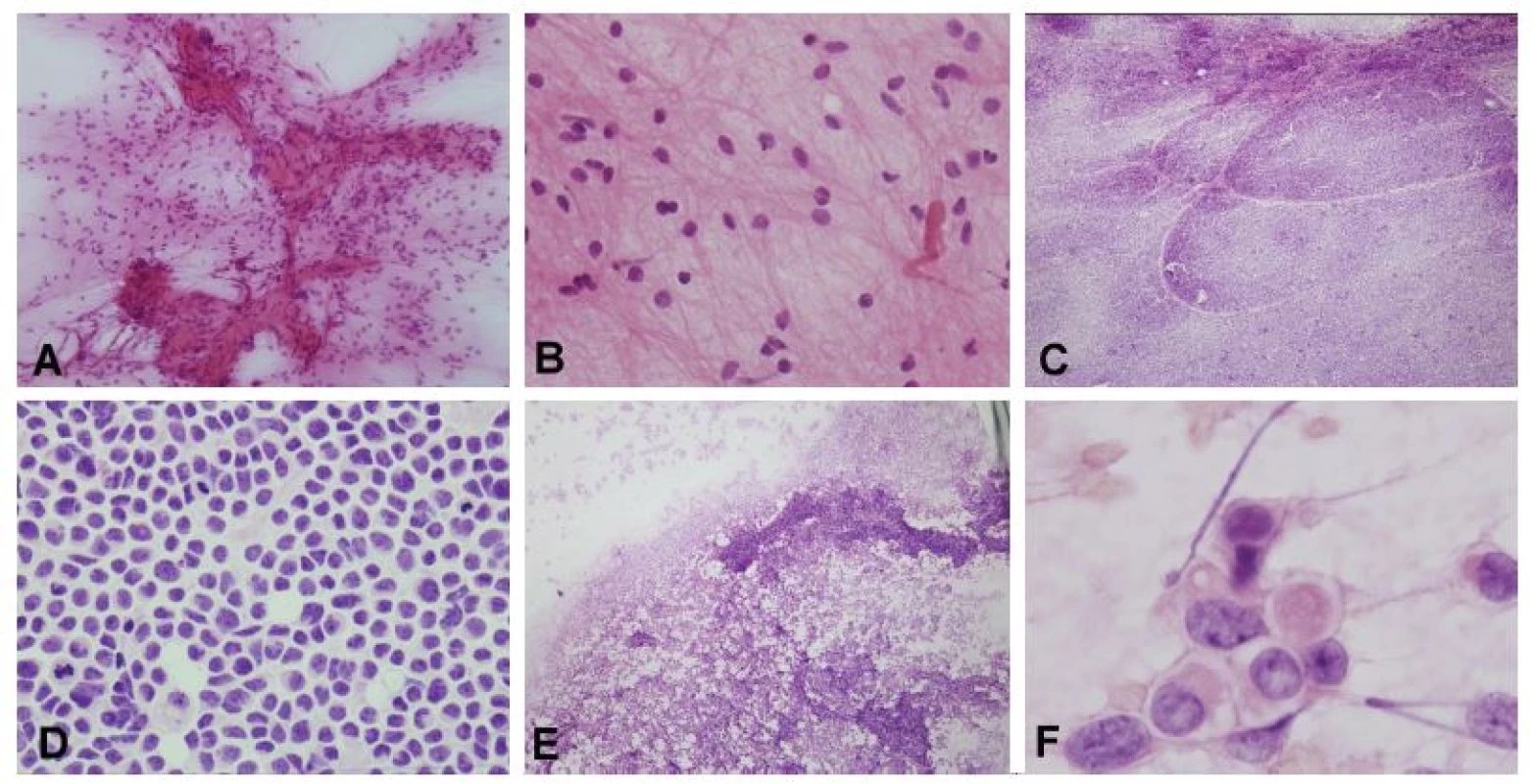
Ependymóm je najčastejším intramedulárnym tumorom u pacientov v dospelom veku, u detí je však typickejšia lokalizácia supratentoriálne alebo v zadnej jame. Peroperačná diagnóza ependymómu môže viesť k pokusu o kompletné odstánenie, preto by na tento tumor mal patológ vždy myslieť, najmä v prípade periventrikulárne alebo intraventrikulárne lokalizovaného tumoru (obr. 7)(33-35). Vzácne sa ale ependymómy vyskytujú aj v iných lokalizáciách.
Obr. 7. (A-D) Tumor IV. komory u 31-ročného muža. V zmrazenom reze bol zachytený výrazne celulárny tumor, ložiskovo s perivaskulárnymi pseudorozetami (A). V nátere sa nádorové bunky „držia“ okolo ciev (B). Perivaskulárne pseudorozety – nádorové bunky sú k cievam prichytené gliálnymi výbežkami, jadrá sú zoradené periférne (C, D). Pre vysokú celularitu a pomerne výrazné jadrové atypie bol nádor peroperačne nesprávne diagnostikovaný ako medulloblastóm. Definitívna diagnóza: anaplastický ependymóm, grade III. (E, F) V inom prípade prítomnosť typických buniek s okrúhlymi jadrami a „salt and pepper“ chromatínom umožnila správnu peroperačnú diagnózu ependymómu. 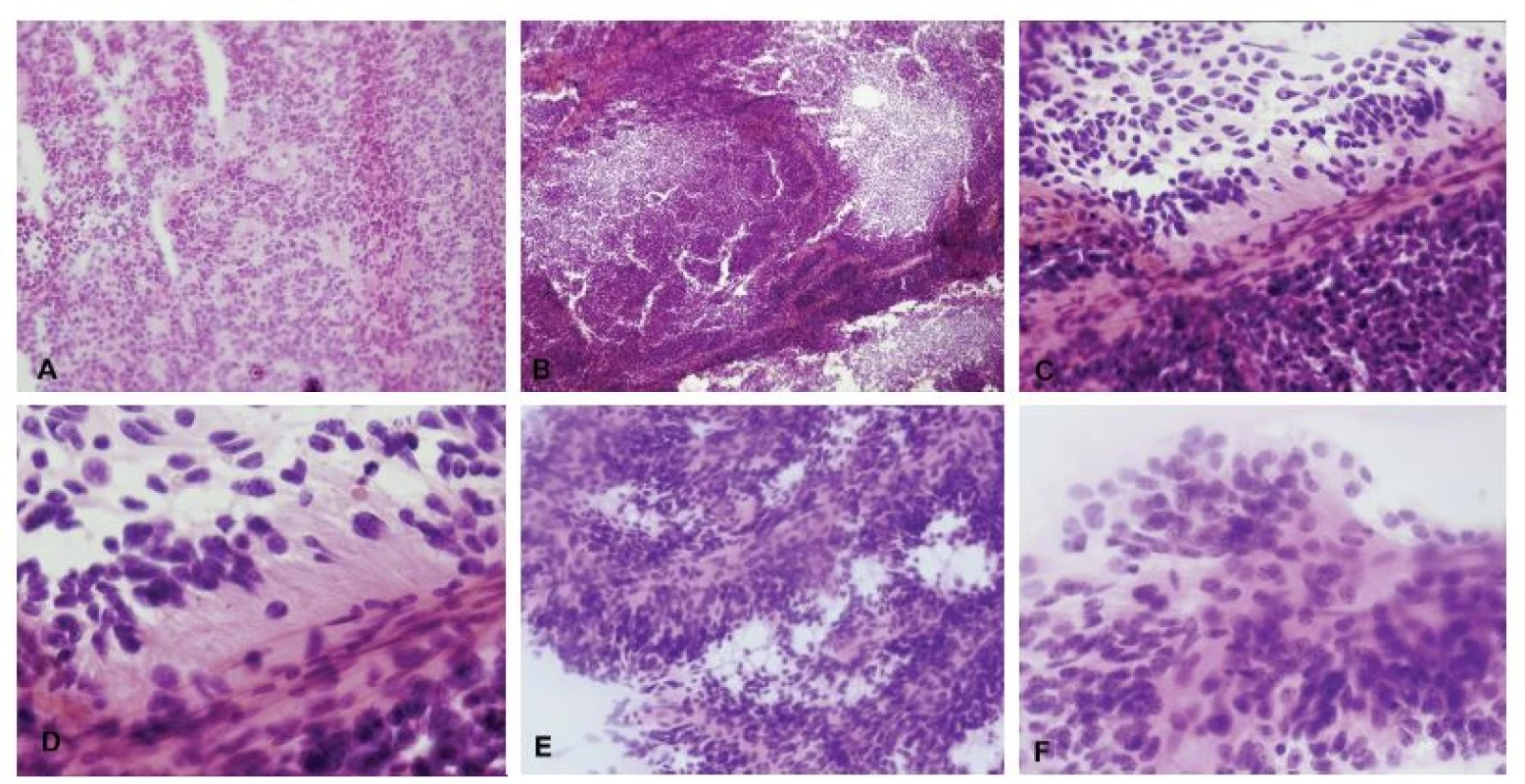
Diagnostické pasce („pifalls“) peroperačného vyšetrenia lézií CNS
Existuje množstvo sitácií, ktoré môžu viesť k nesprávnej peroperačnej diagnóze. Na prvom mieste, pomerne ľahko sa v zmrazených rezoch alebo peroperačnej cytológii dajú zameniť normálne štruktúty mozgu alebo reaktívna glióza za nádor. Normálny mozog sa zo všetkých tkanív natiera najľahšie (tkanivo gliómov je predsa len o niečo tuhšie), v hypocelulárnom nátere nepozorujeme zhlukovanie buniek ale iba tenké kapiláry a heterogénnu populáciu buniek: astro - a oligodendrogliu vo vzorke bielej hmoty, a vo vzorke z kôry aj gangliové bunky (obr. 8A). Výrazná reaktívna glióza sa typicky vyskytuje v okolí niektorých lézií (kraniofaryngeóm, ependymómy - najmä spinálne, metastázy…), preto v prípade nálezu „low-grade gliálnej lézie“ alebo obrazu ktorý pripomína pilocytický astrocytóm (tzv. piloidná glióza) je vždy nutné položiť si otázku, či je nález kompatibilný s klinikou a radiologickým nálezom. Podobne, je dôležité nezameniť štruktúry normálneho mozočka za medulloblastóm (obr. 8B). Dôležité je správne poznať normálnu pineálnu žľazu a nezameniť ju za nádor (36,37). Nádorové zmeny môžu imitovať aj zápalové lézie, napr. demyelinizácia (obr. 4C-F). Histologicky je hranica medzi normálnym mozgovým tkanivom a ložiskom demyelinizácie zvyčajne ostrá (na rozdiel od väčšiny difúznych gliómov). Dobrým vodítkom je aj prítomnosť prevažne perivaskulárne lokalizovaných lymfocytárnych infiltrátov (niekedy je však lymfocytov málo, prípadne úplne chýbajú). Naopak, lymfóm može byť zamenený za demyelinizáciu, najmä ak patológ peroperačne nepoužije cytologické vyšetrenie (31).
Obr. 8. (A) 65-ročný muž, tumor frontoparietálne. V cytológii zachytené tenké kapiláry a mix blandných buniek – astrocytov, oligodendrocytov, mikroglie a neurónov. Peroperačná a definitívna diagnóza: normálny kortex. V následnej stereotaktickej biopsii bol diagnostikovaný oligodendroglióm. (B) Normálny mozoček v náterovej cytológii – jadrá neurónov granulárnej vrsvy sú na rozdiel od meduloblastómu alebo lymfómu menšie, monotónne, pravidelné, bez mitóz alebo apoptóz (porovnaj s obr. 6D). Nález Purkyněho buniek podporuje „diagnózu“ normálneho mozočka. (C) V pilocytickom astrocytóme je bežná prítomnosť viacjadrových a pleomorfných „atypických“ buniek. Početné Rosenthalove vlákna sú ale typické pre low-grade tumory. (D) Oligodendrogliómy majú v náterovej cytológii takmer diskohezívny vzhľad, s početnými nahými jadrami, a aj keď je gliálnej matrix málo, gliálne výbežky je vo veľkom zväčšení možné nájsť takmer vo všetkých prípadoch. Bunky majú okrúhle jadrá, „salt and pepper“ chromatín, charakteristická je prítomnosť tzv. minigemistocytov (šípky), ktoré sa nevyskytujú v neurocytóme. Typické perinukleárne haló je fixačný artefakt, v cytológii neprítomný. (E) Biopsia tumoru v corpus callosum u 15-ročného chlapca. V náterovej cytológii boli zachytené dyskohezívne atypické bunky s okrúhlymi jadrami s výraznými jadierkami a tenkým lemom cytoplazmy. V kombinácii s epiteloidným granulómom (šípka) a lymfoidným pozadím je nález diagnostický pre seminóm (dysgerminóm). (F) Biopsia extraaxiálneho tumoru vo frontotemporálnej oblasti u 10-ročného divčaťa, ktorý infiltroval podkožné mäkké tkanivá, kalvu a duru. V diskohezívnom nátere boli prítomné epiteloidné bunky s výrazne poprehýbanými jadrami. Na pozadí početné neutrofily a eozinofily a ojedinelé mnohojadrové obrovské bunky (vložený obrázok). Peroperačná a definitívna biopsia: Langerhans cell histiocytóza. 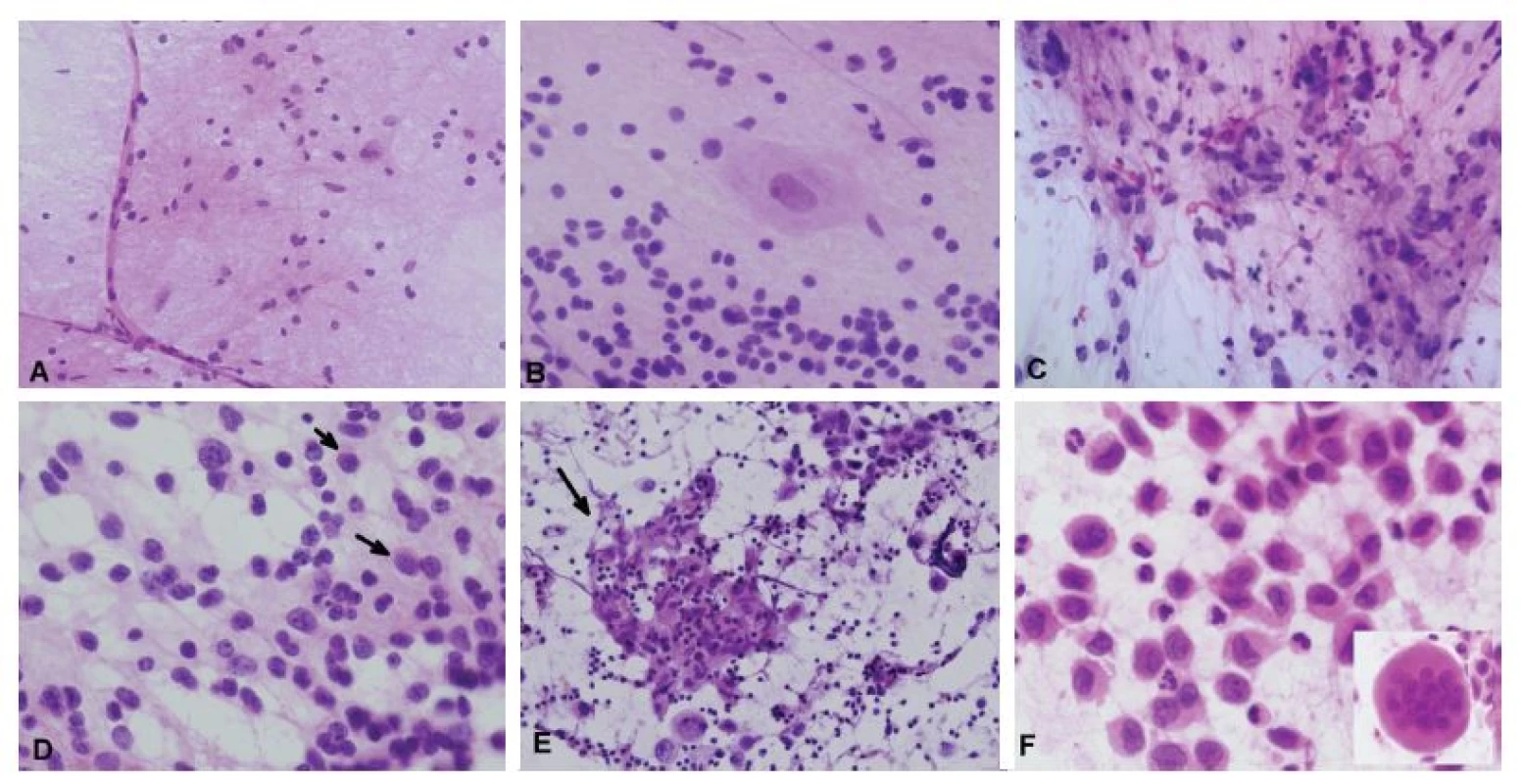
Niektoré low-grade nádorové lézie vykazujú cytologické atypie, ktoré môžu viesť k nesprávnej interpretácii ako high-grade lézia (a odradiť chirurga od pokusu o kompletnú resekciu). Typickým príkladom sú atypie v stromálnych bunkách hemangioblastómu (24) (obr. 5E a5F), atypické bunky pleomorfného xantoastrocytómu (38,39), schwannómu, alebo pilocytického astrocytómu (32)(obr. 8C).
Je dôležité nezameniť oligodendroglióm za lymfóm (obr. 8D). Epiteloidný alebo rabdoidný glioblastóm môže byť neodlíšiteľný od metastázy karcinómu alebo AT/RT (40) a naopak, vaskulárna proliferácia v metastázach môže imitovať glioblastóm (41).
A nakoniec, patológ by vždy mal počítať s výskytom lézií v netypických lokalizáciách (napr. orbitálny alebo intraventrikulárny meningióm) (42) alebo v neobvyklom veku. Mal by byť pripravený aj na vzácne a neobvyklé lézie, napr. primárny germ-cell tumor mozgu (43,44), s typickým výskytom v strednej čiare (obr. 8F), alebo lézie, ktoré môžu postihovať kosti lebky (obr. 8F) alebo skelet chrbtice (45,46).
ZÁVER
Konkordancia medzi peroperačnou diagnózou (histologickou, cytologickou, alebo pri použití oboch metód) a definitívnou biopsiou je v rôznych štúdiách udávaná v rozmedzí 83 - 97,5 % (47-52). Najväčšia diagnostická zhoda medzi bežnými nádormi CNS bola zaznamenaná pre schwannómy, adenómy hypofýzy, meningeómy, astrocytómy, metastatické karcinómy, chordómy a neurocytómy (50,53). Naopak, nižšia korelácia medzi peroperačnou a definitívnou diagnózou je popisovaná v prípade oligodendrogliómov, ependymómov, lymfómov a nediferencovaných malígnych nádorov (nediferencované metastatické karcinómy, „primitívne neuroektodermálne tumory“, sarkómy) (48,50,53).
Peroperačná diagnostika lézií CNS je však napriek určitým nepresnostiam relatívne spoľahlivé vyšetrenie, najmä pri použití náterovej cytológie. Na správnu diagnózu je nevyhnutná tesná spolupráca s rádiologom a neurochirurgom. Korelácia peroperačnej histológie a/alebo cytológie s klinickou a radiologickou prezentáciou umožňuje stanovenie správnej diagnózy vo väčšine prípadov.
PREHLÁSENIE
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikácií tohto článku nie v konflikte záujmov a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlasenie sa týka i všetkých spoluautorov.
Adresa pre korešpondenciu:
MUDr. Marián Švajdler, Ph.D.
Bioptická laboratoř, s.r.o.
Mikulášske nám. 4
326 00 Plzeň, Česká republika
tel.: +420 737220036
e-mail: svajdler@yahoo.com
Zdroje
-
Burger PC. Smears and frozen sections in sur - gical neuropathology. A manual. Baltimore, Maryland: PB Medical Publishing; 2009.
-
Švajdler M, Rychlý B, Zámečník J, Švajdler P. Novinky vo WHO klasifikácii nádorov centrálneho nervového systému 2016 – 1.časť: Difúzne infiltrujúce gliómy. Cesk Patol 2017; 53(1): 12-21.
-
Zámečník J, Rychlý B, Švajdler M. Novinky ve WHO klasifikaci nádorů centrálního nervového systému 2016 - 2. část: Embryonální nádory CNS a ostatní skupiny nádorů (kromě difúzních gliomů). Cesk Patol 2017; 53(1): 22-28.
-
Powell SZ. Intraoperative consultation, cytologic preparations, and frozen section in the central nervous system. Arch Pathol Lab Med 2005; 129(12): 1635-1652.
-
Sharma S, Deb P. Intraoperative neurocyto - logy of primary central nervous system neo - plasia: A simplified and practical diagnostic approach. J Cytol 2011; 28(4): 147-158.
-
Kleinschmidt-DeMasters BK, Prayson RA. An algorithmic approach to the brain biopsy - part I. Arch Pathol Lab Med 2006; 130(11): 1630 - 1638.
-
Prayson RA, Kleinschmidt-DeMasters BK. An algorithmic approach to the brain biopsy - part II. Arch Pathol Lab Med 2006; 130(11): 1639-1648.
-
Joseph JT. Diagnostic neuropathology smears (1st ed). Philadelphia, PA: Lippincott Williams & Wilkins; 2007.
-
Afroz N, Khan N, Hassan J, Huda MF. Role of imprint cytology in the intraoperative diagno - sis of pituitary adenomas. Diagn Cytopathol 2011; 39(2): 138-140.
-
Goh SG, Chuah KL. Role of intraoperative smear cytology in the diagnosis of anaplastic oligodendroglioma. A case report. Acta Cytol 2003; 47(2): 293-298.
-
Klysik M, Gavito J, Boman D, Miranda RN, Hanbali F, De Las Casas LE. Intraoperative imprint cytology of central neurocytoma: The great oligodendroglioma mimicker. Diagn Cy - topathol 2010; 38(3): 202-207.
-
Jaiswal S, Vij M, Jaiswal AK, Behari S. Squash cytomorphology of central neurocytoma: a study of five cases. Diagn Cytopathol 2012; 40(8): 678-683.
-
Kobayashi TK, Bamba M, Ueda M, et al. Cy - tologic diagnosis of brain metastasis from he - patocellular carcinoma by squash preparation. Diagn Cytopathol 2006; 34(3): 227-231.
-
Daneshbod Y, Monabati A, Kumar PV, Taghi - poor M, Bedayat GR. Intraoperative cytologic crush preparation findings in craniophary - ngioma: a study of 12 cases. Acta Cytol 2005; 49(1): 7-10.
-
Tena-Suck M, Salinas-Lara C, Vega-Orozco R, Rembao-Bojorquez D, Gelista N. Crush intraoperatory analysis in craniopharyngioma. Diagn Cytopathol 2012; 40(10): 865-870.
-
Pai RR, Kini H, Rao VS, Naik R. Choroid plexus papilloma diagnosed by crush cytology. Diagn Cytopathol 2001; 25(3): 165-167.
-
Savage NM, Crosby JH, Reid-Nicholson MD. The cytologic findings in choroid plexus car - cinoma: report of a case with differential dia - gnosis. Diagn Cytopathol 2012; 40(1): 1-6.
-
Siddiqui MT, Mahon BM, Cochran E, Gattuso P. Cytologic features of meningiomas on crush preparations: a review. Diagn Cytopathol 2008; 36(4): 202-206.
-
Fukuoka K, Hirokawa M, Kanahara T, Ishii N, Ishii R, Shirabe T. Cytology of microcystic meningioma in crush preparation. Diagn Cyto - pathol 2000; 23(4): 275-278.
-
Ng HK. Smears in the diagnosis of pituitary adenomas. Acta Cytol 1998; 42(3): 614-618.
-
Takei H, Dauser RC, Adesina AM. Cytomor - phologic characteristics, differential diagnosis and utility during intraoperative consultation for medulloblastoma. Acta Cytol 2007; 51(2): 183-1892.
-
Raisanen J, Hatanpaa KJ, Mickey BE, Whi - te CL 3rd. Atypical teratoid/rhabdoid tumor: cytology and differential diagnosis in adults. Diagn Cytopathol 2004; 31(1): 60-63.
-
Güner G, Önder S, Söylemezoğlu F. Cyto - morphological features of atypical teratoid/ rhabdoid tumor: an account of 12 years’ ex - perience. Diagn Cytopathol 2014; 42(10): 856 - 862.
-
Ortega L, Jiménez-Heffernan JA, Perna C. Squash cytology of cerebellar haemangiob - lastoma. Cytopathology 2002; 13(3): 184-185.
-
Parwani AV, Berman D, Burger PC, Ali SZ. Gliosarcoma: cytopathologic characteristics on fine-needle aspiration (FNA) and intraope - rative touch imprint. Diagn Cytopathol 2004; 30(2): 77-81.
-
Adesina AM. Intraoperative consultation in the diagnosis of pediatric brain tumors. Arch Pathol Lab Med 2005; 129(12): 1653-1660.
-
Lacruz CR, Catalina-Fernández I, Barda - les RH, Pimentel J, López-Presa D, Sáenz-Santamaría J. Intraoperative consultation on pediatric central nervous system tumors by squash cytology. Cancer Cytopathol 2015; 123(6): 331-346.
-
Erana-Rojas IE, Barboza-Quintana A, Ayala AG, Fuller GN. Demyelinating pseudotumor. Ann Diagn Pathol 2002; 6(5): 265-271.
-
Zámečník J, Mrázková L. Pseudotumory cen - trálního nervového systému. Cesk Patol 2012; 48(4): 184-189.
-
Welsh CT. Pseudoneoplasms in the nervous system. Semin Diagn Pathol 2016; 33(1): 13-23.
-
Sugita Y, Terasaki M, Nakashima S, Ohshima K, Morioka M, Abe H. Intraoperative rapid diagnosis of primary central nervous system lymphomas: advantages and pitfalls. Neuro - pathology 2014; 34(5): 438-345.
-
Teo JG, Ng HK. Cytodiagnosis of pilocytic as - trocytoma in smear preparations. Acta Cytol 1998; 42(3): 673-678.
-
Manasa PL, Uppin MS, Sundaram C. Analysis of squash smear cytology of ependymomas. Acta Cytol 2012; 56(2): 183-188.
-
Bradly DP, Reddy VB, Cochran E, Gattuso P. Comparison of cytological features of myxo - papillary ependymomas on crush preparati - ons. Diagn Cytopathol 2009; 37(8): 607-612.
-
Chaudhuri PM, Chaudhuri S, Chakrabarty D, et al. Squash cytology of tanycytic epen - dymoma: case report of two cases. Diagn Cy - topathol 2017; 45(3): 270-273.
-
Lee HY, Ng I, Lian DW, Yap WM, Chuah KL. Cytological features of the native pineal gland in intraoperative squash preparations. Diagn Cytopathol 2011; 39(3): 196-199.
-
Jiménez-Heffernan JA, Bárcena C, Agra C, Asunción A. Cytologic features of the normal pineal gland of adults. Diagn Cytopathol 2015; 43(8): 642-645.
-
Bleggi-Torres LF, Gasparetto EL, Faoro LN, et al. Pleomorphic xanthoastrocytoma: re - port of a case diagnosed by intraoperative cytopathological examination. Diagn Cytopathol 2001; 24(2): 120-122.
-
Jiménez-Heffernan JA, Freih Fraih A, Álvarez F, Bárcena C, Corbacho C. Cytologic features of pleomorphic xanthoastrocytoma, WHO gra - de II. A comparative study with glioblastoma. Diagn Cytopathol 2017; 45(4): 339-344.
-
Yamamoto Y, Yamazaki K, Yamada M, et al. Rhabdoid glioblastoma: touch imprint cytolo - gy clearly demonstrates globular cytoplasmic inclusions. Diagn Cytopathol 2016; 44(6): 556 - 558.
-
Gi T, Sato Y, Tokumitsu T, et al. Microvascular proliferation of brain metastases mimics gliob - lastomas in squash cytology. Cytopathology 2017; 28(3): 228-234.
-
Agrawal P, Dey P, Saikia UN, et al. Fine-need - le aspiration cytology of orbital meningiomas. Diagn Cytopathol 2012; 40(11): 967-969.
-
Ng HK. Cytologic diagnosis of intracranial ge - rminomas in smear preparations. Acta Cytol 1995; 39(4): 693-697.
-
Ates D, Kosemehmetoglu K, Onder S, Soy - lemezoglu F. Pseudopapillary pattern in intra-operative squash smear preparations of central nervous systém germinomas. Cytopathology 2014; 25(1): 45-50.
-
Kobayashi TK, Ueda M, Nishino T, et al. Lan - gerhans cell histiocytosis of the skull on cyto - logic squash preparations. Diagn Cytopathol 2007; 35(3): 154-157.
-
Nahm JH, Yoon G, Do SI, Kim HS. Squash smear cytology of Langerhans cell histiocyto - sis. Int J Clin Exp Pathol 2015; 8(7): 7998-8007.
-
Bleggi-Torres LF, de Noronha L, Schneider Gugelmin E, et al. Accuracy of the smear technique in the cytological diagnosis of 650 lesions of the central nervous system. Diagn Cytopathol 2001; 24(4): 293-295.
-
Roessler K, Dietrich W, Kitz K. High diagnos - tic accuracy of cytologic smears of central nervous system tumors. A 15-year experience based on 4172 patients. Acta Cytol 2002; 46(4): 667–674.
-
Iqbal M, Shah A, Wani MA, Kirmani A, Ram - zan A. Cytopathology of the central nervous system. Part I. Utility of crush smear cytology in intraoperative diagnosis of central nervous systém lesions. Acta Cytol 2006; 50(6) :608-616.
-
Goel D, Sundaram C, Paul TR, et al. Intraope - rative cytology (squash smear) in neurosurgi - cal practice – pitfalls in diagnosis experience based on 3057 samples from a single instituti - on. Cytopathology 2007; 18(5): 300-308.
-
Uematsu Y, Owai Y, Okita R, Tanaka Y, Itaku - ra T. The usefulness and problem of intraope - rative rapid diagnosis in surgical neuropatho - logy. Brain Tumor Pathol 2007; 24(2): 47-52.
-
Ghosal N, Hegde AS, Murthy G, Furtado SV. Smear preparation of intracranial lesions: a retrospective study of 306 cases. Diagn Cyto - pathol 2011; 39(8): 582-592.
-
Krishnani N, Kumari N, Behari S, Rana C, Gupta P. Intraoperative squash cytology: ac - curacy and impact on immediate surgical ma - nagement of central nervous systém tumours. Cytopathology 2012; 23(5): 308-314.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Peroperační biopsie (2. díl)
Článek vyšel v časopiseČesko-slovenská patologie

2018 Číslo 3-
Všechny články tohoto čísla
- Peroperační biopsie v gynekopatologii
- Monitor aneb nemělo by vám uniknout, že...
- Peroperačná diagnostika nádorov centrálneho nervového systému
- Peroperační biopsie plíce, pleury a mediastina: Retrospektivní analýza 5 let praktických zkušeností a přehled literatury
- Metody detekce molekulárních prognostických a prediktivních markerů v diagnostice adenoidně cystického karcinomu slinných žláz
- Klinicko-patologická analýza dôkazu ligandy proteínu 1 programovanej smrti v nádorových bunkách 325 pacientov s nemalobunkovým karcinómom pľúc: Prediktívny a potenciálny prognostický význam
- Aberantní axilární tkáň mléčné žlázy s pseudoangiomatózní stromální hyperplázií u muže
- JOSE VEROCAY - “Pražský patolog”.
- Peroperační biopsie (2. díl)
- Pathology will stay as a cornerstone of personalized medicine
- Monitor aneb nemělo by vám uniknout, že...
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Peroperačná diagnostika nádorov centrálneho nervového systému
- Peroperační biopsie v gynekopatologii
- Aberantní axilární tkáň mléčné žlázy s pseudoangiomatózní stromální hyperplázií u muže
- Klinicko-patologická analýza dôkazu ligandy proteínu 1 programovanej smrti v nádorových bunkách 325 pacientov s nemalobunkovým karcinómom pľúc: Prediktívny a potenciálny prognostický význam
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



