-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neuroendokrinní nádory trávicího ústrojí – historie a současnost
Neuroendocrine Tumours of the Alimentary Tract – History and at Present
Histological classification of the neuroendocrine tumours (”carcinoids“) of the alimentary tract, as well as the opinion on biological behaviour of these tumours, changed rapidly within the last decade. Advances in knowledge of cellular biology of the diffuse endocrine system and in clinical diagnostics and treatment of tumours lead to the creation of a new histological classification of neuroendocrine tumours. This classification, apart from essential histological picture and immunohistological characterisation of the markers of neuroendocrine differentiation, also includes definition of biological properties of tumours based on their site of origin, mitotic and proliferative activity of the tumour cells and clinicopathological correlation, including the size of the tumour and its progression. Exact classification of an individual tumour into a corresponding category is an essential condition to select adequate following diagnostic procedures and optimal therapeutic strategy.
Key words:
neuroendocrine tumours – alimentary tract – histological classification – imunohistological markers – biological behaviour
Autoři: V. Mandys
Působiště autorů: Ústav patologie 3. lékařské fakulty UK a FNKV, Praha
Vyšlo v časopise: Čes.-slov. Patol., 45, 2009, No. 3, p. 57-63
Kategorie: Přehledový článek
Souhrn
Histologická klasifikace neuroendokrinních nádorů („karcinoidů“) trávicího ústrojí a s ní související názory na biologické chování těchto nádorů prodělaly v uplynulých letech podstatné změny. Pokroky v poznání biologie buněk difúzního endokrinního systému a v klinické diagnostice a terapii nádorů k těmto buňkám histogeneticky blízkým vedly k vytvoření nové klasifikace založené na komplexním posouzení nádoru, zahrnujícím kromě základního mikroskopického obrazu, imunohistologické detekce znaků neuroendokrinní diferenciace i určení jeho biologických vlastností podle lokalizace nádoru, mitotické a proliferační aktivity nádorových buněk a klinicko-patologické korelace, vycházející z velikosti nádoru a rozsahu jeho růstu. Přesné zařazení nádoru do příslušné kategorie je nezbytnou podmínkou pro správnou volbu dalších diagnostických kroků a pro určení optimální terapeutické strategie.
Klíčová slova:
neuroendokrinní nádory – trávicí ústrojí – histologická klasifikace – imunohistologické znaky – biologické chováníEndokrinně aktivní nádory trávicího ústrojí (gastroenteropankreatické neuroendokrinní tumory GEP-NET) tvoří heterogenní skupinu poměrně vzácných nádorů, jejichž definujícím znakem je endokrinní diferenciace nádorových buněk spojená se schopností produkovat, hromadit a uvolňovat biologicky aktivní látky hormonální povahy. GEP-NET se morfologicky i biologickým chováním liší od běžných epitelových nádorů trávicího ústrojí. Histogeneticky mají úzký vztah k endokrinním buňkám gastrointestinálního traktu (GIT) a Langerhansových ostrůvků pankreatu, podle současných představ vycházejí z prekurzorů těchto buněk (10, 37).
První popisy méně obvyklých epitelových nádorů střeva makroskopicky, mikroskopickým obrazem a neagresivním chováním se lišících od běžných karcinomů GIT pocházejí z konce 19. století. První práce souborně popisující tyto neobvyklé střevní nádory byla publikována mnichovským patologem Siegfriedem Oberndorferem v roce 1907. V této práci se poprvé vyskytuje i označení nádorů jako „karzinoide“, tedy karcinomu podobné; označení „karcinoid“ se udrželo po dlouhá desetiletí a je s výhradami synonymicky pro NET používáno dodnes (34). V roce 1914 byly Gossetem a Massonem popsány argentafinní vlastnosti buněk karcinoidu a tím byl určen jeho vztah k enterochromafinním (Kultšitského) buňkám GIT (22). Významným bodem ve vývoji poznání endokrinních buněk GIT i karcinoidů bylo zjištění schopnosti dekarboxylovat 5-hydroxytryptofan na 5-hydroxytryptamin (serotonin) a z toho vyplývající označení APUD (amine precursor uptake and decarboxylation) buňky (38). Teorie APUD systému byla populární v druhé polovině minulého století, termín APUDom navržený pro označení endokrinně aktivních nádorů se však neujal a je dnes považován za obsoletní. V současné době je pro rozptýlené endokrinní buňky používán termín difúzní neuroendokrinní systém (DNES) (32).
Epidemiologie a genetika
Získávání přesnějších epidemiologických údajů o GEP-NET je i v současné době poměrně obtížné. To je dáno jednak tím, že se jedná o relativně vzácné nádory, jednak tím, že část NET nevyvolává díky často neagresivnímu biologickému chování klinické příznaky. Není vzácností, že NET nejsou během života pacientů vůbec diagnostikovány a objeví je až pitva. Informace o nádorech s nejistým biologickým chováním, zejména apendikálních, jsou značně neúplné. Tyto většinou bezpříznakové nádory bývají vedlejším nálezem u apendektomie provedené pro zánět. Navíc v řadě i evropských zemí není apendix, pokud nejeví významné makroskopické odchylky, po apendektomii rutinně biopticky vyšetřován. K problémům při získávání přesnějších epidemiologických dat přispívá i přetrvávající nejednotnost v histologické klasifikaci NET. Podle současných pramenů je incidence NET v gastrointestinálním traktu 2–3 na 100 000 s mírnou převahou u žen, přičemž jsou patrné poměrně významné regionální rozdíly (20). Incidence pankreatických NET je přibližně 1 na 1 000 000 (21). Rozdíly v epidemiologických datech mohou být v jednotlivých zemích ovlivněny i různou úrovní zdravotní péče a na ni navázanou činností oboru patologie, zahrnující zejména systém provádění pitev a bioptických vyšetření.
NET se převážně vyskytují jako sporadické nádory, u cca 20 % nemocných mohou být i vícečetné. Přibližně 5 % NET je vázáno na definované genetické syndromy, především syndrom mnohočetné endokrinní neoplazie - MEN. Přesná molekulární patogeneze NET nebyla dosud objasněna. U sporadických NET byly zjištěny alterace některých genů, které se mohou uplatňovat v nádorové transformaci, nicméně na rozdíl od jiných maligních nádorů GIT, jako jsou kolorektální karcinom nebo adenokarcinom pankreatu, nejsou u většiny NET alterovány ani běžné onkogeny, jako ras, myc nebo fos ani běžné tumor supresorové geny (P53, Rb). Ve vzniku a rozvoji sporadických NET by mohly hrát roli alterace jiných genů; jako kandidátní jsou uváděny zejména MEN1, p16MTS/1, DPC4/Smad 4 gen a HER-2/neu protoonkogen. Přesněji jsou genové alterace charakterizovány u NET, které představují součást geneticky podmíněných syndromů (4, 28).
Syndrom mnohočetné endokrinní neoplazie typu I (MEN I) je podmíněn mutacemi genu MEN1 lokalizovaného na chromozomu 11q13. Tento gen kóduje jaderný protein menin, jehož exprese je závislá na buněčném cyklu; menin je přenášen i do cytoplazmy, kde reaguje s řadou dalších regulačních proteinů. Spektrum působení meninu je zřejmě značně široké – podílí se na regulaci transkripce DNA, negativně reguluje geny, které podporují buněčný růst, snižuje aktivitu telomerázy a účastní se regulací buněčné diferenciace a apoptózy. Mutace genu MEN1 spojené s alteracemi meninu vedou ke komplexní poruše základních mechanismů regulací buněčné proliferace, diferenciace a apoptózy (21, 40). U syndromu mnohočetné endokrinní neoplazie typu II (MEN II) jsou v poslední době uváděny zejména alterace genu RET, lokalizovaného na chromozomu 10, v blízkosti centroméry. RET gen kóduje receptorovou tyrosin kinázu. Protein RET hraje významnou roli i v diferenciaci neuronů; je důležitý pro normální vývoj centrálního i periferního nervového systému a dále i ledvin a spermatogonií. Aktivující bodové mutace RET protoonkogenu se uplatňují ve vzniku MEN II (4).
Neuroendokrinní nádory se mohou vyskytnout i u některých dalších vzácných syndromů, jako jsou von Hippel-Lindau (VHL) a neurofibromatóza typu 1 (NF1). VHL syndrom je způsobený mutacemi genu VHL, lokalizovaného na chromozomu 3p25-26. Protein VHL ovlivňuje některé důležité procesy, jakými jsou kontrola buněčného cyklu, stabilita mRNA a hypoxií indukovatelná genová exprese. Ve vzniku NF1 (von Recklinghausenovy nemoci) se uplatňují mutace genu NF1, lokalizovaného na chromozomu 17q11.2, kódujícího protein neurofibromin, který se účastní přenosu buněčných signálů (36, 39).
Diferenciační znaky NET
Endokrinně aktivní buňky je možné ozřejmit pomocí speciálních histologických barvicích metod, především argentafinní a argyrofilní reakce. Argentafinní reakce (Bodianova metoda) je založená na schopnosti buněk redukovat amoniakální stříbro a je příznačná pro buňky produkující serotonin. Argyrofilní reakce (barvení podle Grimelia) znázorňuje sekreční granula v nádorových buňkách bez ohledu na jejich obsah.
Pro přesnější identifikaci endokrinně aktivních buněk jsou v současné době používány imunohistologické metody, které pomocí specifických protilátek umožňují detekci jednak antigenních struktur souvisejících s neuroendokrinní diferenciací buněk, jednak specifických hormonálních působků těmito buňkami produkovaných (8, 28).
Ke znakům bezprostředně souvisejícím s endokrinní aktivitou buněk patří chromograniny, rutinně je využívána především detekce chromograninu A. Chromograniny představují rodinu kyselých polypeptidů tvořících podstatnou část solubilních proteinů sekrečních granul endokrinních buněk. Všechny endokrinní buňky trávicího traktu i převážná většina NET vykazují pozitivní imunoreaktivitu chromograninu A (15, 17, 19). Pozitivita chromograninu je v buňkách příznačně granulární a v podstatě odpovídá Grimeliovu barvení; výsledky však nemusejí být vždy zcela identické. Navíc při použití jen jedné monoklonální protilátky se u NET můžeme setkat s falešně negativním nálezem (23).
Jiným antigenem, který je součástí neurosekrečních granul endokrinních buněk, je Leu-7 (CD57). Ve většině NET trávicího traktu je možné zjistit pozitivitu CD57, podobně jako chromograninu A. Distribuce pozitivit obou těchto znaků v nádorech se poněkud liší; to platí zejména u nádorů vyššího stupně malignity. Průkaz CD57 představuje alternativní možnost zjištění přítomnosti neurosekrečních granul v nádorech, které nevykazují imunohistologickou pozitivitu chromograninu A (15–17).
K dalším znakům, které souvisejí s neuroendokrinní diferenciací buněk, patří cytosolické molekuly – neuron specifická enoláza (NSE), neuronální cytoplazmatický proteinový genový produkt (PGP9.5) a protein mikrovesikul podobných synaptickým – synaptofyzin.
Neuron specifická enoláza (NSE) je enzym katalyzující přeměnu 2-fosfoglycerolu na fosfoenolpyruvát. Původní představa, že NSE se vyskytuje výhradně v centrálním nervovém systému, se nepotvrdila. Bylo prokázáno, že je přítomna i v buňkách jiných tkání, včetně buněk DNES a nádorů vycházejících z těchto buněk. I když pozitivita tohoto znaku není tak specifická, jak se původně předpokládalo, je imunohistologický průkaz NSE důležitou součástí mikroskopické diagnostiky NET. Pozitivita NSE v těchto nádorech nekoreluje s pozitivitou argentafinní nebo argyrofilní reakce, ani s přítomností znaků souvisejících s neurosekrečními granuly (chromogranin A, CD57). Průkaz NSE může tedy být významným příspěvkem k diagnóze NET v případech, kdy nádorové buňky obsahují jen malé množství neurosekrečních granul (8, 19).
Neuronální cytoplazmatický proteinový genový produkt (PGP9.5) je ubikvitinová hydroláza exprimovaná ve všech fázích neuronální diferenciace i v buňkách DNES. V posledních letech byl PGP9.5 zařazen do spektra diagnosticky používaných znaků NET (19).
Synaptofyzin je membránový glykoprotein presynaptických vesikul neuronů a mikrovesikul buněk DNES. V současnosti je uváděn jako jeden ze základních znaků neuroendokrinní diferenciace používaných v mikroskopické diagnostice NET. Pozitivita synaptofyzinu byla prokázána ve většině těchto nádorů; pozitivní detekce tohoto antigenu podporuje diagnózu NET zejména v případech, kdy průkaz ostatních znaků není jednoznačný.
Vzhledem k tomu, že NSE, PGP9.5 i synaptofyzin mohou být pozitivní i v nádorech, které nevykazují endokrinní diferenciaci a nejsou tedy NET, musejí být výsledky imunohistologického vyšetření těchto znaků vždy pečlivě zvažovány a korelovány s mikroskopickým obrazem nádoru a výsledky dalších imunohistologických vyšetření nebo jiných barvicích metod.
Před rutinním zavedením imunohistologických metod byla k detekci neurosekrečních granul v buňkách NET používána elektronová mikroskopie. Sekreční granula mají charakteristický vzhled, sestávají z denzního centra, obklopeného světlým halo, na periferii jsou ohraničena membránou. Bylo zjištěno, že velikost a tvar sekrečních granul jsou charakteristické pro určitý sekreční produkt, praktickému využití tohoto poznatku pro přesnější diagnostiku NET však brání okolnost, že v řadě nádorů jsou sekreční granula pleomorfní a jejich morfologie proto neumožňuje jednoznačnou identifikaci specifického sekrečního produktu. Elektronmikroskopický průkaz sekrečních granul v cytoplazmě nádorových buněk je pro diagnostiku NET v současné době používán jen výjimečně.
Lokalizační a funkční klasifikace NET
Neuroendokrinní nádory jsou v současné době klasifikovány podle několika různých kritérií. Z hlediska klinické symptomatologie mají důležité místo klasifikace lokalizační a klasifikace podle typu humorálního působku. Z onkologického hlediska, zejména s ohledem na průběh a prognózu onemocnění, má rozhodující význam klasifikace histologická, jejíž nedílnou součástí je kódování nádorů podle MKN-O.
Podle lokalizace vyplývající z embryonálních vztahů se NET dělí na nádory předního střeva (foregut), středního střeva (midgut) a zadního střeva (hindgut) (22).
K NET předního střeva se kromě nádorů lokalizovaných v žaludku, duodenu a pankreatu řadí i nádory plic a thymu. Jde o značně heterogenní skupinu nádorů; to se projevuje pestrou klinickou symptomatologií a značně variabilní produkcí humorálních působků. Mezi NET středního střeva patří nádory jejuna, ilea, apendixu a céka. Z největší části jde o nádory, které mají charakter „klasického“ karcinoidu, produkujícího serotonin. NET zadního střeva jsou lokalizovány v tračníku a v rektu, často jsou hormonálně neaktivní.
Podle typu humorálního produktu jsou klasifikovány především NET pankreatu, dříve v této lokalizaci označované jako nezidiomy.
Inzulinom (M-8151/1;M-8151/3)
Je nejčastějším nádorem Langerhansových ostrůvků (cca 60 % NET v této lokalizaci). V převážné většině (až 90 %) případů jde o nádor průměru menšího než 2 cm, 30 % inzulinomů má průměr menší než 1 cm. Obvykle jsou nádory solitární, dobře ohraničené. Většinou se vyskytují ve středním věku, mírně převažují u žen. U cca 10 % nemocných se vyskytují vícečetně. Maligní chování je vzácné, vyskytuje se u přibližně 10 % inzulinomů. Ve 4–7 % se inzulinomy vyskytují v rámci syndromu MEN1; v těchto případech jsou obvykle vícečetné, v 25 % maligní. NET produkující inzulin se vzácně mohou vyskytnout i v extrapankreatické lokalizaci, například v duodenu, ileu a v plíci (11, 13, 41).
Glukagonom (M-8152/1;M-8152/3)
Je vzácný, většinou sporadický, pomalu rostoucí nádor, vyskytující se nejčastěji u nemocných ve věku kolem padesáti let. Nádory dosahují větších rozměrů, ne vzácně až 6 cm. Glukagonomy jsou obvykle vysoce maligní, v 80 % případů jsou v době stanovení diagnózy přítomny metastázy, převážně jaterní. V menším počtu případů (5–17 %), obvykle u mladších nemocných průměrného věku kolem 33 let, je glukagonom součástí syndromu MEN1 (21, 25, 42).
Gastrinom (M-8153/1;M-8153/3)
Většina gastrinomů vzniká v tzv. gastrinomovém trojúhelníku, který je tvořen duodenem, hlavou pankreatu a hepatoduodenálním ligamentem. Nádory se vyskytují buď sporadicky ve středním věku, častěji u mužů, nebo (v cca 25 %) v rámci syndromu MEN1; v těchto případech jde obvykle o malé vícečetné nádory lokalizované v duodenu. Ve většině případů vykazují gastrinomy maligní chování, u 70–80 % nemocných jsou v době stanovení diagnózy již založeny metastázy v lymfatických uzlinách a v játrech (14, 21, 42).
VIPom (M-8155/1;M-8155/3)
Většina VIPomů se vyskytuje sporadicky, ve středním věku. V 70–80 % vznikají v pankreatu, především v oblasti kaudy. S tím souvisí okolnost, že v době diagnózy je jejich velikost obvykle větší než 2 cm. Vícečetné VIPomy jsou vzácné, pozorovány jsou jen v cca 4 % případů. U necelých 10 % nemocných jsou součástí syndromu MEN1. Více než polovina VIPomů vykazuje maligní chování s metastázami do lymfatických uzlin a do jater (9, 21).
Somatostatinom (M-8156/1;M-8156/3)
Je velmi vzácný nádor, který se na rozdíl od předchozích tumorů vyskytuje převážně v extrapankreatické lokalizaci, nejčastěji v duodenu, vzácněji v jejunu, tlustém střevě a rektu. Duodenální somatostatinomy dosahují obvykle menších rozměrů (do 2 cm), často jsou lokalizovány v blízkosti Vaterovy ampuly. Průměrná velikost většiny pankreatických somatostatinomů je větší, až kolem pěti cm. V rámci syndromu MEN1 se somatostatinom vyskytuje jen zcela výjimečně, poněkud častější je jeho výskyt u 1. typu neurofibromatózy a v kombinaci s feochromocytomem (21, 25).
Nádor produkující serotonin (M-8241/1;M-8241/3)
„Serotoninomy“ jsou nejčastějšími NET trávicího ústrojí, odpovídají argentafinnímu karcinoidu. Histogeneticky mají vztah k enterochromafinním (EC) buňkám střevní a žaludeční sliznice. Vyskytují se ve všech úsecích GIT, převážně v tenkém střevě a apendixu, tedy v úseku embryogeneticky odvozeném od středního střeva. Kromě serotoninu, který je jejich hlavním sekrečním produktem, syntetizují nádorové buňky i kallikrein a prostaglandiny (12). Klinické příznaky a biologické chování nádorů se liší v závislosti na lokalizaci v jednotlivých oddílech trávicího ústrojí. Nádory z EC buněk žaludku produkující serotonin jsou vzácné.Morfologicky, biologickým chováním a endokrinními projevy jsou identické se serotonin produkujícími NET ostatních oddílů GIT. Duodenální a pankreatické NET produkující serotoninjsou vzácné. Nádory v duodenu jsou obvykle menších rozměrů, bývají málo agresivní. Častěji se vyskytují u nemocných s neurofibromatózou a někdy i u MEN syndromu. Pankreatické nádory dosahují větších rozměrů, jejich chování je agresivnější, u více než 70 % nemocných jsou v době diagnózy založeny jaterní metastázy. Nádory z EC buněk tenkého střeva patří k nejčastějším NET (6). Většina je lokalizována v ileu, multicentrický výskyt není vzácností. Průměrný věk nemocných je mezi 60–65 lety. Biologické chování nádoru je do značné míry individuální, i některé nádory malých rozměrů (5 mm) mohou metastazovat. Přibližně ve třetině případů jsou v době diagnózy vytvořeny metastázy v lymfatických uzlinách, u další třetiny nemocných jsou metastázy hematogenní, zejména v játrech. Metastatické postižení jater je podmínkou pro rozvoj karcinoidového syndromu (syndromu hyperserotininismu), který se vyvine u cca 20 % nemocných. Nádory z EC buněk apendixu jsou nejčastějšími nádory v této lokalizaci a patří i k nejčastějším NET. Jde většinou o nádory asymptomatické, náhodně nalezené při apendektomii prováděné z jiných důvodů, nejčastěji zánětu. Průměrný věk nemocných v době diagnózy je 40–45 let. Biologické chování je v převážné většině případů příznivé, metastazování je spíše výjimečné (27). Nádory z EC buněk tlustého střeva jsou nejčastěji lokalizovány v céku a v ileocékalní oblasti. Většina nádorů dosahuje velikosti více než 2 cm, průměrný věk nemocných je kolem sedmdesáti let. U více než 60 % nemocných jsou v době diagnózy založeny uzlinové nebo jaterní metastázy (29). Nádory z EC buněk rekta se vyskytují nejčastěji u nemocných ve věku kolem šedesáti let. Biologické chování je relativně příznivé, nádory menší velikosti než 1 cm metastazují jen výjimečně (v méně než 5 % případů). U cca 10 % nemocných se vyskytují jiné synchronní nádory v tlustém střevě, především adenokarcinom (7, 12, 35).
Nádor produkující histamin (M-8242/1;M-8242/3)
V žaludku se častěji než nádory z EC buněk produkujících serotonin vyskytujínádory z buněk podobných enterochromafinním (ECL) produkující histamin,označované také jako karcinoidy z ECL buněk (26). Tyto nádory se dělí do tří skupin. První typ (A) představují nádory u nemocných vyššího věku s autoimunitní chronickou atrofickou gastritidou. U těchto nemocných dochází v důsledku hypochlorhydrie a hypergastrinémie k hyperplazii ECL buněk žaludeční sliznice, na jejímž podkladě vznikají nádory, obvykle vícečetné, několikamilimetrových rozměrů; tyto nádory jsou málo agresivní, metastazují vzácně. Nádory typu B se vyskytují téměř výhradně u nemocných se syndromem MEN1, u nichž se vyvíjí Zollinger - Ellisonův syndrom. I v těchto případech se nádor zřejmě vyvíjí na podkladě hyperplazie ECL buněk. Biologické chování je podobné jako u nádorů typu A. Sporadické nádory žaludku z ECL buněk představují typ C. Vznikají většinou v intaktní žaludeční sliznici, dosahují větších rozměrů a jejich chování je agresivnější, u cca 2/3 nemocných jsou v době diagnózy založeny jaterní metastázy. V malém procentu případů vede produkce histaminu k rozvoji atypického karcinoidového syndromu (12, 32, 35).
Histologická klasifikace
Významné rozšíření poznatků o buňkách DNES a nádorů, které mají histogenetický vztah k buňkám tohoto systému vyústil koncem minulého století ve snahy o přesnější histomorfologickou klasifikaci karcinoidních nádorů. Identifikace jednotlivých hormonálních působků produkovaných jak buňkami DNES, tak endokrinně aktivními nádory a možnost imunohistologické detekce těchto působků a dalších znaků neuroendokrinní diferenciace v nádorových buňkách znamenaly na jednu stranu přesnější histologickou diagnostiku nádorů, na druhou stranu vedly k vyčlenění specifických typů nádorů, jako jsou gastrinom, inzulinom, glukagonom a další. Již předtím bylo však evidentní, že „karcinoid“ není jeden typ nádoru, ale že zřejmě představuje více nádorových typů (34); to se například odrazilo v termínech argentafinní a non-argentafinní karcinoid. Klasifikace karcinoidů podle histologické stavby nádorů (7) nebyla všeobecně přijata a navíc se ukázalo, že histologická stavba sama o sobě nehraje významnější roli v biologickém chování nádoru. Výsledkem snah o odstranění uvedených nedostatků byla nová histologická klasifikace endokrinně aktivních nádorů vydaná WHO v roce 2000 a následně upřesněná v letech 2003–2006 (30, 32, 35). Nová klasifikace vychází ze skutečnosti, že nádory histogeneticky odvozené od endokrinních buněk jsou definovány nejen histomorfologickým obrazem, ale i pozitivitou znaků neuroendokrinní diferenciace, především chromograninů, synaptofyzinu, NSE a PGP9.5 (32). Klasifikace navíc přesněji definuje jednotlivé typy NET i hodnocení jejich biologického chování s tím, že kromě mikroskopického obrazu jsou pro zařazení nádoru do určitého typu rozhodující i jeho lokalizace, mitotická a proliferační aktivita nádorových buněk a tzv. klinicko-patologické korelace, zohledňující zejména velikost nádoru a rozsah jeho růstu (2). Pro všechny oblasti trávicího ústrojí jsou stanoveny 3 hlavní kategorie endokrinně aktivních nádorů:
- 1. Dobře diferencovaný neuroendokrinní tumor (karcinoid) M-8240/1
- 2. Dobře diferencovaný neuroendokrinní karcinom (maligní karcinoid) M-8240/3
- 3. Nízce (špatně) diferencovaný neuroendokrinní karcinom (malobuněčný karcinom) M-8041/3
Jako další kategorie je uváděn:
- 4. Smíšený exokrinní-endokrinní karcinom M-8244/3
Histologický obraz dobře diferencovaného neuroendokrinního tumoru a dobře diferencovaného neuroendokrinního karcinomu je prakticky identický. Nádory ve většině případů vykazují uspořádání do solidních hnízd, časté je i trabekulární (pentlicovité) uspořádání nádorových buněk, méně obvyklá je tvorba tubulárních struktur. V některých nádorech jsou výše uvedené struktury kombinované.
Zařazení nádoru do dané kategorie je založeno na tzv. klinicko-patologické korelaci, zahrnující velikost nádoru, rozsah jeho růstu, známky angioinvaze a hormonální produkci. Kritéria pro klasifikaci nádorů jsou v jednotlivých oddílech GIT a v pankreatu odlišná. V trávicí trubici je hlavním kritériem hloubka invaze.
Jako dobře diferencovaný neuroendokrinní tumor (obr. 1) je klasifikován nádor rostoucí pouze ve sliznici a/nebo submukóze; velikost nádoru určuje jeho maligní potenciál. Nádory „benigního chování“, přesněji řečeno velmi nízkého maligního potenciálu, jsou neangioinvazivní, velikosti menší než 1 cm (platí pro žaludek a tenké střevo) nebo menší než 2 cm (platí pro tlusté střevo a rektum). Výjimku tvoří nádory apendixu, kde do této kategorie spadají neangioinvazivní nádory, jejichž růst je omezen na stěnu apendixu. Nádory „nejistého biologického chování“ (nejistého maligního potenciálu) jsou větší než 1 cm (platí pro žaludek a tenké střevo) nebo větší než 2 cm (platí pro tlusté střevo a rektum), nebo vykazující angioinvazivitu. V apendixu jde o nádory větší než 2 cm, prorůstající celou stěnou až do oblasti subserózy, nebo nádory angioinvazivní. V pankreatu je jako dobře diferencovaný neuroendokrinní tumor „benigního chování“ klasifikován nádor omezený na pankreas, velikosti do 2 cm, jehož buňky vykazují nízkou mitotickou (≤ 2 mitózy/10 HPF) a proliferační (≤ 2% Ki-67 index) aktivitu. Jako nádor nejistého biologického chování je zařazen nádor velikosti větší než 2 cm, který vykazuje vyšší mitotickou (>2 mitózy/10 HPF) a proliferační (>2% Ki-67 index) aktivitu, nebo angioinvazivitu (33, 35). Dobře diferencovaný neuroendokrinní karcinom GIT (obr. 2.) je definován infiltrativním růstem do tunica muscularis, popřípadě infiltrací celé stěny a prorůstáním do okolí. V apendixu je takto klasifikován nádor infiltrující mesoapendix, nebo okolí apendixu. Pankreatické nádory spadající do této kategorie jsou obvykle větší než 3 cm, lokálně invazivní nebo prorůstající do okolí pankreatu (obr. 3.) (33, 35).
Obr. 1. Dobře diferencovaný neuroendokrinní tumor. Nádor rostoucí pouze ve sliznici a submukóze, velikost menší než 1 cm. H&E, 100krát (A), zcela ojedinělá jaderná pozitivita Ki-67. 200krát (B) 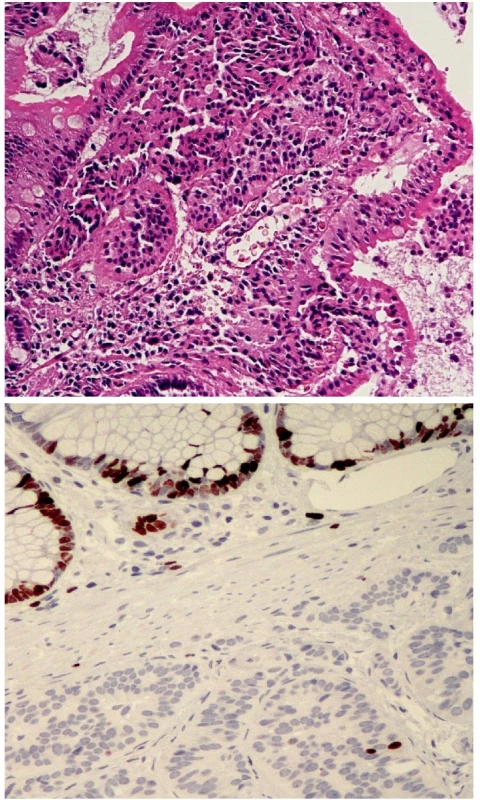
Obr. 2. Dobře diferencovaný neuroendokrinní karcinom. Solidní hnízda nádorových buněk a ojedinělé tubulární struktury. H&E, 40krát (A), cca 4% nádorových buněk vykazuje jadernou pozitivitu Ki-67, nález odpovídá G2. 200krát (B) 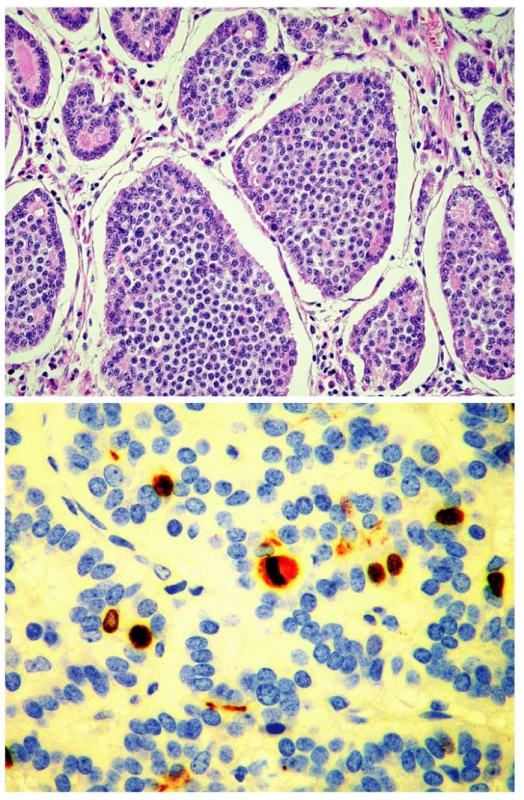
Obr. 3. Špatně diferencovaný neuroendokrinní karcinom. Solidně uspořádaný nádor vykazující vysokou mitotickou aktivitu. H&E, 400krát (A), převážná většina nádorových buněk vykazuje jadernou pozitivitu Ki-67, nález odpovídá G3. 100krát (B) 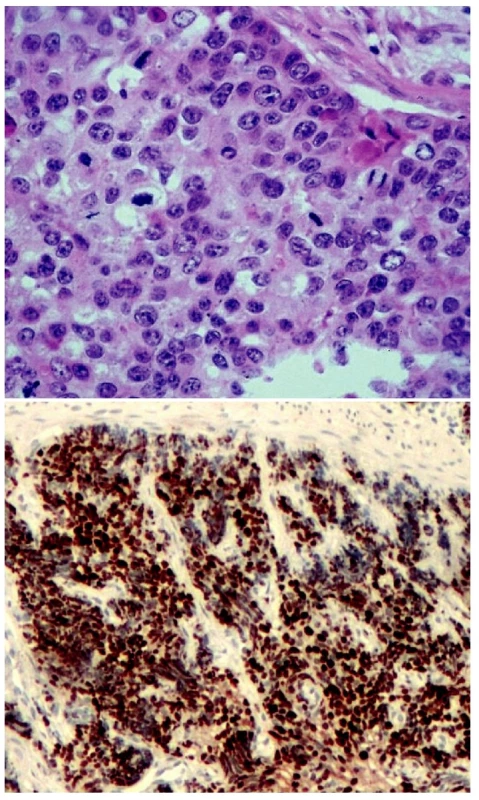
Metastazující nádory jakékoliv velikosti a rozsahu růstu jsou vždy klasifikovány jako dobře diferencovaný neuroendokrinní karcinom.
Nízce (špatně) diferencovaný neuroendokrinní karcinom (malobuněčný karcinom) je vysoce maligní nádor morfologicky odpovídající častějšímu malobuněčnému plicnímu karcinomu. Histologicky vykazuje nádor solidní uspořádání, často s ložisky nekróz. Nádorové buňky jsou menší velikosti, fenotypicky primitivní, cytologicky relativně uniformní, s chudou cytoplazmou, vykazují vysokou mitotickou a proliferační aktivitu. V případech, kdy mají nádorové buňky krátce vřetenitý tvar, odpovídá nádor tzv. „ovískovému“ karcinomu. Část nízce diferencovaných karcinomů je tvořena buňkami polygonálními; tyto nádory bývají označovány jako karcinomy z intermediárních buněk (1, 24).
Smíšený exokrinní-endokrinní karcinom je velmi vzácný kompozitní nádor sestávající ze struktur adenokarcinomu a neuroendokrinního karcinomu, jehož komponenta představuje více než 30% nádoru (12). Ojedinělá pozorování tohoto karcinomu byla popsána v žaludku a v apendixu, kde nesmí být zaměňován za poněkud častější karcinoid s pohárkovými buňkami (mukokarcinoid). Každá z obou komponent smíšeného exokrinního-endokrinního karcinomu vykazuje odpovídající imunohistologický profil, adenokarcinomová zejména karcinoembryonálního antigenu a neuroendokrinní chromograninu a synaptofyzinu. Biologické chování určuje adenokarcinomová komponenta, nádor je tedy agresivnější než dobře diferencovaný neuroendokrinní karcinom. Z diagnostického hlediska je důležité, že malá příměs disperzně rozptýlených endokrinních buněk je v adenokarcinomech GIT běžná; nález minoritně zastoupených endokrinních buněk neopravňuje k diagnóze smíšeného exokrinního-endokrinního karcinomu (5, 12).
V apendixu se vzácně vyskytuje zvláštní typ nádoru, vykazující známky neuroendokrinní diferenciace, označovaný jako karcinoid s pohárkovými buňkami nebo mukokarcinoid (M-8243/3). Jedná se o adenokarcinom nízkého stupně malignity, sestávající z drobných hnízd nádorových buněk s intracytoplazmatickou akumulací hlenu, připomínajících pohárkové buňky střevní sliznice. V hnízdech nádorových buněk bývají přimíšeny buňky vykazující znaky neuroendokrinní diferenciace (3, 18, 27).
Histologický grading
Již z prvních pozorování neuroendokrinních nádorů bylo zřejmé, že se jejich vlastnosti liší od běžných karcinomů. Kromě morfologických vlastností patří ke zvláštnostem NET zjištění, že maligní potenciál dobře diferencovaných nádorů nesouvisí bezprostředně ani s histologickou stavbou nádoru, ani s cytologickými vlastnostmi (atypiemi) nádorových buněk, ale že stupeň maligního chování („grade“) těchto nádorů závisí zejména na mitotické a proliferační aktivitě nádorových buněk (31, 32). I když se v jiných případech grading provádí jen u nádorů maligních, u NET má jeho hodnocení význam i ve skupině dobře diferencovaných tumorů. Kritéria pro hodnocení stupně maligního chování NET jsou uvedena v tabulce 1.
Tab. 1. Kritéria pro grading NET 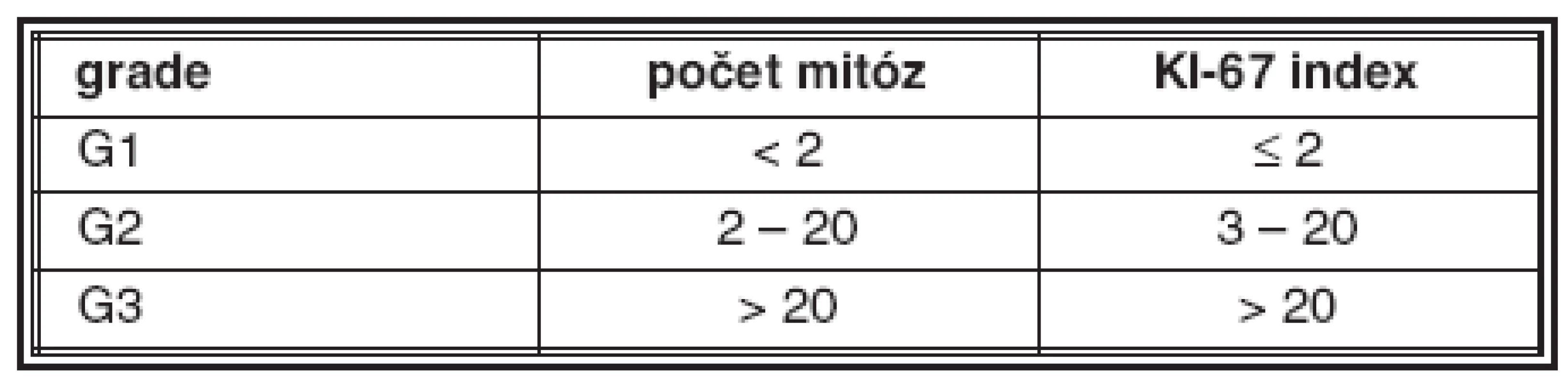
Dobře diferencované neuroendokrinní tumory jsou většinou G1; pokud splňují kritéria pro nádor G2, je u nich vyšší riziko maligního chování. Dobře diferencované neuroendokrinní karcinomy mohou být buď G1 nebo G2. Všechny nádory splňující kritéria G3 nádorů jsou hodnoceny jako vysoce maligní a odpovídají nízce (špatně) diferencovanému neuroendokrinnímu karcinomu, bez ohledu na jejich velikost a rozsah růstu (32).
TNM staging
Nutnost standardizace diagnostických a terapeutických postupů vedla v minulých letech k vytvoření návrhu pro TNM staging neuroendokrinních nádorů. V gastrointestinálním traktu jsou pravidla stagingu shodná jako u adenokarcinomu; vychází z hloubky invaze nádoru a jeho velikosti. U nádorů pankreatu vychází staging z velikosti nádoru a z rozsahu jeho růstu ve vztahu k pankreatické tkáni. Hodnocení uzlinových a vzdálených metastáz je obdobné jako u jiných karcinomů (31). Příklady návrhu stagingu jsou uvedeny v tabulce 2 a 3.
Tab. 2. Návrh TNM klasifikace NET žaludku 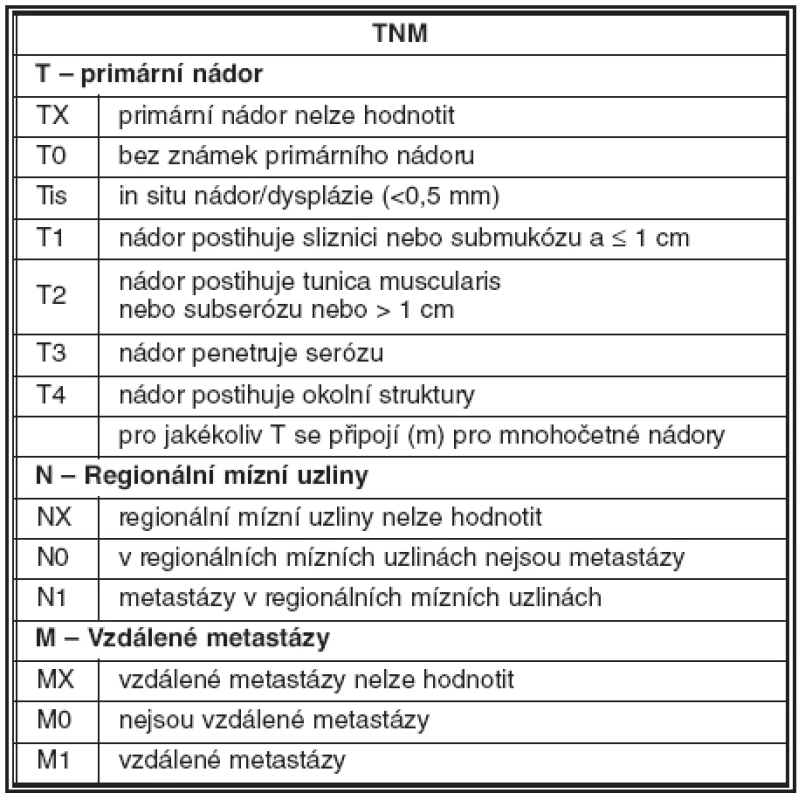
Tab. 3. Návrh TNM klasifikace NET pankreatu 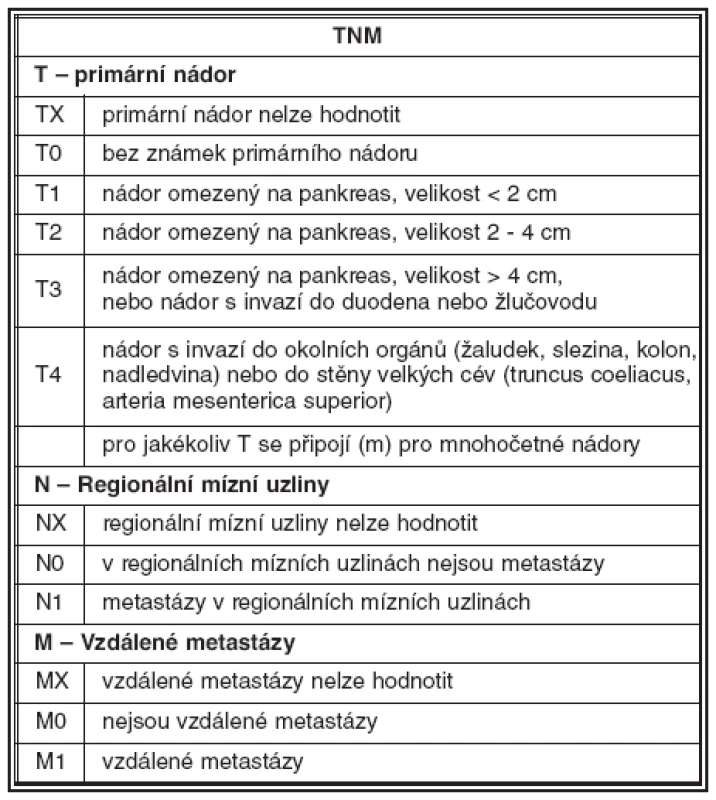
Závěr
Zvýšený zájem o neuroendokrinní nádory pozorovaný v uplynulých letech vyplývá zejména z nových možností klinické diagnostiky jak primárních nádorů, tak jejich metastatických ložisek a ze zavedení nových terapeutických přístupů. Poslední WHO histologická klasifikace a její následující upřesnění zdůrazňují, že kromě základního mikroskopického obrazu a imunohistologické detekce znaků neuroendokrinní diferenciace je pro přesné zařazení nádoru a určení jeho biologických vlastností rozhodující i jeho lokalizace, mitotická a proliferační aktivita nádorových buněk a tzv. klinicko-patologická korelace, vycházející z velikosti nádoru a rozsahu jeho růstu. Přesná klasifikace nádoru do příslušné kategorie má bezprostřední vliv na volbu dalšího diagnostického postupu a terapeutické strategie, která se u jednotlivých nádorových typů výrazně liší. Vzhledem k tomu je u neuroendokrinních nádorů doporučováno „druhé čtení“ bioptických vyšetření na specializovaném pracovišti.
Práce byla podpořena Výzkumným záměrem „Onkologie“, MSM 0021620808 Ministerstva školství, mládeže a tělovýchovy České republiky.
Prof. MUDr. Václav Mandys, CSc.
Ústav patologie 3. LF UK a FN KV
Šrobárova 50
100 34 Praha 10
tel.: 267162510
e-mail: mandys@fnkv.cz
Zdroje
1. Ahlman, H., Nilsson, O., McNicol, A.M. et al.: Poorly-differentiated endocrine carcinomas of midgut and hindgut origin. Neuroendocrinology, 2008, 87 : 40–6.
2. Bordi, C., DęAdda, T., Pizzi, S. et al.: The assessment of malignancy in endocrine tumours of the gastrointestinal tract. Current Diagnostic Pathology, 2002, 8 : 421–9.
3. Burke, A.P., Sobin, L.H., Federspiel, B.H., Shekitka, K.M., Helwig, E.B.: Goblet cell carcinoids and related tumors of the vermiform appendix. Am J Clin Pathol, 1990, 94/1 : 27–35.
4. Calender, A.: Genetics of neuroendocrine tumours. In: Handbook of Neuroendocrine tumours. Their current and future management. Caplin, M., Kvols, L. Eds., 2006, Bristol, BioStientifica.
5. Cooper, H.S.: Intestinal neoplasms. In: Diagnostic Surgical Pathology, volume 2, Third Edition, Sternberg, S.S., Antonioli, D.A., Carter, D., Mills, S.E., Oberman, H.A., Eds., 1999. Philadelphia, Baltimore, New York, Lippincott, Williams, Wilkins.
6. Eriksson, B., Klöppel, G., Krenning, E. et al. Consensus guidelines for the management of patients with digestive neuroendocrine tumors – well-differentiated jejunal-ileal tumor/carcinoma. Neuroendocrinology, 2008, 87 : 8–19.
7. Fenoglio-Preiser, C. et al. Neoplastic lesions of the small intestine. In.: Gastrointestinal Pathology - an Atlas and Text. Lippincot-Raven Publishers, Philadelphia, New York, 1999, s. 481–495.
8. Ferolla, P., Faggiano, A., Mansueto, G., et al.: The biological characterization of neuroendocrine tumors: The role of neuroendocrine markers. J Endocrinol Invest, 2008, 31 : 277–86.
9. Ghaferi, A.A., Chojnacki, K.A., Long, W.D. et al.: Pancreatic VIPomas: subject review and one institutional experience. J Gastrointest Surg, 2008, 12/2 : 382–93.
10. Goddard, M.J., Lonsdale, R.N.: The histogenesis of appendiceal carcinoid tumours. Histopathology, 1992, 20/4 : 345–9.
11. Grant, C.S.: Insulinoma. Best Pract Res Clin Gastroenterol. 2005, 19/5 : 783–98.
12. Hamilton, S.R., Aaltonen, L.A.: Pathology & Genetics Tumours of the Digestive System. World Health Organization Classification of Tumours. 2000. Lyon, IARC Press.
13. de Herder, W.W., Niederle, B., Scoazec, J-Y. et al.: Well-differentiated pancreatic tumor/carcinoma: Insulinoma. Neuroendocrinology, 2006, 84 : 183–8.
14. Jensen, R.T., Niederle, B., Mitry, E. et al.: Gastrinoma (duodenal and pancreatic). Neuroendocrinology, 2006, 84 : 173–82.
15. Jirásek, T., Hozák, P., Mandys, V.: Different patterns of chromogranin A and Leu-7 (CD57) expression in gastrointestinal carcinoids: immunohistochemical and confocal laser scanning microscopy study. Neoplasma, 2003, 50/1 : 1–7.
16. Jirásek, T., Mandys, V.: Karcinoidy gastrointestinálního traktu: význam hodnocení diferenciačních a proliferačních markerů. Čes-slov Patol, 2003, 39/2 : 47–53.
17. Jirásek, T., Mandys, V.: Immunohistochemical Expression of Chromogranin A and Leu-7 in Gastrointestinal Carcinoids. In: Imunohistochemistry and in situ Hybridization of Human Carcinomas. Molecular genetics, gastrointestinal carcinoma, and ovarian carcinoma. Vol. 4, II. Gastrointestinal Carcinoma, Hayat, M.A. Ed., 2006, Amsterdam, Boston, Heidelberg, Academic Press.
18. Kanthan, R., Saxena, A., Kanthan S.C.: Goblet cell carcinoids of the appendix: immunophenotype and ultrastructural study. Arch Pathol Lab Med, 2001, 125(3): 386–90.
19. Kasprzak, A., Zabel, M., Biczysko, W.: Selected markers (chromogranin A, neuron-specific enolase, synaptophysin, protein gene product 9.5) in diagnosis and prognosis of neuroendocrine pulmonary tumours. Pol J Pathol, 2007, 58(1): 23–33.
20. Maggard, M.A., O‘Connell, J.B., Ko, C.Y.: Updated population-based review of carcinoid tumors. Ann Surg. 2004, 240/1 : 117–22.
21. Mansour, J.C., Chen, H.: Pancreatic endocrine tumors. J Surg Res, 2004, 120/1 : 139–61.
22. Modlin, I.M., Zikusoka, M, Kidd, M. et al.: The history and epidemiology of neuroendocrine tumours. In: Handbook of neuroendocrine tumours. Their current and future management. Caplin, M., Kvols, L. Eds., 2006, Bristol, BioStientifica.
23. Nehar, D., Lombard-Bohas, C., Olivieri, S. et al.: Interest of chromogranin A for diagnosis and follow up of endocrine tumours. Clin Endocrinol, 2004, 60 : 644–52.
24. Nilsson, O., Van Cutsem, E., Delle Fave, G. et al.: Poorly differentiated carcinomas of the foregut (gastric, duodenal and pancreatic). Neuroendocrinology, 2006, 84 : 212–5.
25. O‘Grady, H.L., Conlon, K.C.: Pancreatic neuroendocrine tumours. Eur J Surg Oncol, 2008, 34/3 : 324–32.
26. Plöckinger, U., Rindi, G., Arnold, R. et al.: Guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. Neuroendocrinology, 2004, 80 : 394–424.
27. Plöckinger, U., Couvelard, A., Falconi, M. et al.: Consensus guidelines for the management of patients with digestive neuroendocrine tumours: well-differentiated tumour/carcinoma of the appendix and goblet cell carcinoma. Neuroendocrinology, 2008, 87 : 20–30.
28. Ramage, J.K., Davies, A.H., Ardill, J. et al.: Guidelines for the management of gastroenteropancreatic neuroendocrine (including carcinoid) tumours. Gut, 2005, 54 (Suppl IV): iv1–iv16.
29. Ramage, J.K., Goretzki, P.E., Manfredi, R. et al.: Consensus guidelines for the management of patients with digestive neuroendocrine tumours: well-differentiated colon and rectum tumour/carcinoma. Neuroendocrinology, 2008, 87 : 31–9.
30. Rindi, G., Klöppel, G.: Endocrine tumors of the gut and pancreas: tumor biology and classification. Neuroendocrinology, 2004, 80 (Suppl 1): 12–5.
31. Rindi, G., Klöppel, G., Alhman, H. et al.: TNM staging of foregut (neuro)endocrine tumors: a consensus proposal including a grading system. Virchows Arch, 2006, 449/4, 395–401.
32. Rindi, G., Bordi, C.: Classification of neuroendocrine tumours. In: Handbook of neuroendocrine tumours. Their current and future management. Caplin, M., Kvols, L. Eds., 2006, Bristol, BioStientifica.
33. Ruszniewski, P., Delle Fave, G., Cadiot, G. et al.: Well-differentiated gastric tumors/carcinomas. Neuroendocrinology, 2006, 84 : 158–64.
34. Soga, J.: The term „carcinoid“ is a misnomer: the evidence based on local invasion. J Exp Clin Cancer Res, 2009, 28/1 : 15.
35. Solcia, E., Klöppel, G., Sobin, L.H.: Histological typing of endocrine tumours, Second Edition, World Health Organization International Histological Classification of Tumours. 2000. Berlin, Heidelberg, New York, Springer.
36. Starker, L.F., Carling, T.: Molecular genetics of gastroenteropancreatic neuroendocrine tumors. Curr Opin Oncol, 2009, 21/1 : 29–33.
37. Takenaka, Y., Tsukamoto, T., Mizoshita, T. et al.: Gastric and intestinal phenotypic correlation between exocrine and endocrine components in human stomach tumors. Histol Histopathol, 2007, 22/3 : 273–84.
38. Temple, W.J., Sugarbaker, E.V., Ketcham, A.S.: The APUD system and its apudomas. Int Adv Surg Oncol, 1981, 4 : 255–76.
39. Toumpanakis, C.G., Caplin, M.E.: Molecular genetics of gastroenteropancreatic neuroendocrine tumors. Am J Gastroenterol, 2008, 103/3 : 729–32.
40. Tsukada, T., Nagamura, Y., Ohkura, N.: MEN1 gene and its mutations: basic and clinical implications. Cancer Sci, 2008, 100/2 : 209–15.
41. Tucker, O.N., Crotty, P.L., Conlon, K.C.: The management of insulinoma. Br J Surg, 2006, 93/3 : 264–75.
42. Warner, R.R: Enteroendocrine tumors other than carcinoid: a review of clinically significant advances. Gastroenterology, 2005, 128/6 : 1668–84.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Angiosarkom příušní žlázyČlánek JAKÁ JE VAŠE DIAGNÓZA?Článek Bednářova cenaČlánek Dopis redakciČlánek JAKÁ JE VAŠE DIAGNÓZA?Článek JAK SE VÁM LÍBÍ?
Článek vyšel v časopiseČesko-slovenská patologie

2009 Číslo 3-
Všechny články tohoto čísla
- Neuroendokrinní nádory trávicího ústrojí – historie a současnost
- Systémové amyloidózy v biopsiích ledvin
- Angiosarkom příušní žlázy
- Retiformný hemangioendotelióm u 8-ročného dievčaťa – kazuistika
- Folliculitis perforans Kazuistický prípad a diferenciálna diagnostika choroby
- Recidiva mucinózního karcinomu kůže napodobující primární mucinózní karcinom příušní slinné žlázy: popis diagnosticky obtížného případu
- JAKÁ JE VAŠE DIAGNÓZA?
- Bednářova cena
- Jak v praxi zlepšit diagnostiku systémových amyloidóz
- Dopis redakci
- Doc. MUDr. Viera Povýšilová, CSc. – ohlédnutí za životní dráhou
- JAKÁ JE VAŠE DIAGNÓZA?
- JAK SE VÁM LÍBÍ?
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Neuroendokrinní nádory trávicího ústrojí – historie a současnost
- Doc. MUDr. Viera Povýšilová, CSc. – ohlédnutí za životní dráhou
- Folliculitis perforans Kazuistický prípad a diferenciálna diagnostika choroby
- Systémové amyloidózy v biopsiích ledvin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



