-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
KARIOGENNÍ MIKROFLÓRA U DĚTÍ S KAZEM ČASNÉHO DĚTSTVÍ A U JEJICH MATEK
Původní práce – klinická studie
CARIOGENIC MICROFLORA IN CHILDREN WITH EARLY CHILDHOOD CARIES AND THEIR MOTHERS
Original article – clinical studyAim: Early childhood caries (ECC) is defined as the presence of one or more carious lesions (noncavitated or cavitated) or filled tooth surfaces in any primary tooth or missing teeth (due to caries) in children below six years of age. Cariogenic oral bacteria Streptococcus mutans, Lactobacillus spp. and Actinomyces spp. were found to be involved in the caries development. The early phase of the caries development is associated with the presence of visible plaque on the teeth surface and S. mutans occurrence in the oral cavity, with the most critical period for S. mutans colonization from 19–31 months of age. The aim of this study was to identify the cariogenic bacteria Streptococcus mutans, Lactobacillus spp., and Actinomyces spp. in children with early childhood caries and their mothers.
Methods: A total of 80 mother/child pairs (child mean age 3.8 years ± 1.14 SD) were included in the study. Children were orally examined in a dental chair using a probe, mirror and a good light source. In children, the dmft index was identified, in mothers, the age, the presence of plaque, the number of caries, fillings, extracted teeth, whether they visit their dentists regularly and whether they lick their children´s spoon or pacifier were determined. The dental plaque samples for the assessment of the presence of S. mutans, Lactobacillus spp. and Actinomyces spp. were taken from the surface of carious teeth in children and surface of all teeth in mothers, always using sterile cotton swabs. The presence of cariogenic bacteria was identified by the CarioGene® test (Protean s.r.o., Dobrá voda, Czech Republic) and the results were statistically evaluated.
Results: The presence of S. mutans was identified in 27 mother/child pairs, negative finding in both mother and child was found in 32 cases. The absence of Lactobacillus spp. in the children and their mothers was detected in 13 pairs, the positive finding in both in 46 cases. Actinomyces spp. was detected in both the child and mother in 67 cases. We demonstrated a significant relationship between the presence of S. mutans and Lactobacillus spp. in mothers and their children (p < 0.0001 and p < 0.00001). When mothers were split into the group who licked the spoon at feeding their and the group who did not, the results were significant only in mothers from the first group (p < 0.001). However, the results of Actinomyces spp. were not statistically significant (p > 0.05).
Conclusion: The results of the study demonstrated that the source of acquiring cariogenic bacteria in children suffering from ECC might be through mothers. The potential way of transmission may be licking the infant´s spoon.
Keywords:
ECC – Streptococcus mutans – Lactobacillus spp. – Actinomyces spp.
Autoři: M. Bartošová; M. Kukletová; L. Izakovičová Hollá
Působiště autorů: Stomatologická klinika, Lékařská fakulta Masarykovy univerzity, a Fakultní nemocnice u svaté Anny, Brno
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 121, 2021, 1, s. 19-27
Kategorie: Původní práce
Souhrn
Úvod a cíl práce: Zubní kaz v časném dětství (ECC) je definován jako přítomnost jedné nebo více kariézních lézí (nekavitovaných či kavitovaných) nebo výplně na kterémkoliv dočasném zubu nebo nepřítomnost zubu chybějícího pro kaz a jeho komplikace u dětí mladších než šest let. Na rozvoji ECC se podílejí kariogenní bakterie, mezi které řadíme Streptococcus mutans, Lactobacillus spp. a také druhy Actinomyces. Počáteční fáze vzniku zubního kazu je spojena s přítomností viditelného zubního plaku na povrchu zubu a S. mutans v dutině ústní, přičemž pro adhezi bakterie S. mutans je nejrizikovější období mezi 19. a 31. měsícem – první infekční okno. Cílem naší práce bylo identifikovat kariogenní bakterie Streptococcus mutans, Lactobacillus spp. a Actinomyces spp. u dětí postižených ECC a u jejich matek.
Metodika: Do studie bylo zahrnuto 80 párů matka/dítě (průměrný věk dítěte 3,8 let ± 1,14 SD). Děti byly vyšetřeny běžným způsobem na stomatologickém křesle za pomoci sondy, zrcátka a dobrého osvětlení. Stanovili jsme u nich kpe index zubů. U matek jsme zjišťovali věk, přítomnost povlaku, počet zubních kazů, výplní a extrahovaných zubů (má/nemá), preventivní prohlídky (chodí/nechodí) a to, zda u krmení olizuje dítěti lžičku nebo dudlík, který spadl na zem. Materiál pro vyšetření bakterií S. mutans, Lactobacillus spp. a Actinomyces spp. jsme získávali u dětí stěrem z povrchu kariézních zubů, u matek byl povlak stírán z povrchu všech zubů, vždy pomocí vatové sterilní štětičky. Odebrané vzorky byly vyhodnoceny pomocí testu CarioGene® (Protean s.r.o., Dobrá voda u Českých Budějovic, Česká republika) pro DNA diagnostiku kariogenních bakterií a byly statisticky zpracovány.
Výsledky: Přítomnost bakterie S. mutans byla zjištěna u 27 párů matka/dítě, negativní nález u obou byl prokázán ve 32 případech. Nepřítomnost Lactobacillus spp. u dítěte i u jeho matky byla zjištěna u 13 dvojic, pozitivní nález u obou byl ve 46 případech. Bakterie Actinomyces spp. byla detekována u matky i u jejího dítěte v 67 případech. Statisticky byla prokázána významná souvislost mezi přítomností bakterií S. mutans a Lactobacillus spp. u matky a jejího dítěte (p < 0,0001 a p < 0,00001). Po rozdělení na skupinu matek olizujících/ neolizujících lžičku při krmení byly výsledky signifikantní pouze u matek z první skupiny (p < 0,001). V případě bakterie Actinomyces spp. nebyly výsledky statisticky významné (p > 0,05).
Závěr: Výsledky práce nasvědčují tomu, že zdrojem kariogenní infekce u dítěte je jeho matka. Za potenciální cesty přenosu infekce je pokládáno hlavně olizování lžičky při krmení dítěte.
Klíčová slova:
ECC – Streptococcus mutans – Lactobacillus spp. – Actinomyces spp.
ÚVOD A CÍL PRÁCE
Zubní kaz v časném dětství (ECC) je definován jako přítomnost jedné nebo více kariézních lézí (nekavitovaných či kavitovaných) či výplně na kterémkoliv dočasném zubu nebo nepřítomnost zubu chybějícího pro kaz a jeho komplikace u dětí mladších než šest let [1]. Kaz časného dětství se vyskytuje v mnoha zemích světa s různou prevalencí [2, 3, 4]. I když je patrná klesající tendence výskytu ECC, česká studie provedená ve školním roce 2010/2011 demonstrovala pokles počtu dětí s intaktním chrupem, a to v kategorii pětiletých na 44,6 % a v kategorii šestiletých až na necelých 37 % [5]. Informace o prevalenci ECC se liší jak mezi jednotlivými zeměmi, tak i v rámci různých studií v České republice. Podle práce Handzela z roku 2008 trpí v České republice onemocněním ECC asi 20 % dětí, jiní autoři zmiňují u věkové kategorie pětiletých v roce 2009 prevalenci 57,4 % [6, 7].
Zubní kaz působí nejenom bolest v orofaciální oblasti, ale má vliv i na rozvoj vhodných návyků při žvýkání a fonaci a také na celkový zdravotní stav jedince. Destrukce dočasných zubů může vést k potížím s příjmem jídla a k bolesti při ukusování či rozmělňování potravy. Protože strava není dostatečně rozmělněna a obalena slinou, není ani patřičně natrávena amylázou. Dostavují se obtíže při polykání a trávení, které vedou až k neprospívání dítěte. Zanedbání péče o chrup v předškolním věku má za následek také poruchy výslovnosti. Mezera ve frontální oblasti chrupu může vést k vadnému vyslovování souhlásek „C“, „S“ a „Z“. Negativní roli hraje zubní kaz i v sociální sféře, kdy přítomnost kariézního chrupu, a to zejména ve frontální oblasti, zhoršuje estetiku a postižené dítě se tak může stát terčem posměchu. Předčasnou ztrátou dočasných zubů bez následné rekonstrukce chrupu snímacími či fixními mezerníky dochází k posunům a sklonům zubů a ke ztrátě místa pro stálé zuby; může vzniknout stěsnání a ve stálém chrupu je nutná ortodontická léčba. Nerekonstruovaná výška skusu může mít za následek poruchy vývoje čelistního kloubu [8].
Za základní teorii vzniku zubního kazu je považována modifikovaná Millerova chemicko - parazitární teorie, která je upřesněna aktuálními moderními poznatky [9]. Vysvětluje proces tvorby zubního kazu jako narušení rovnováhy mezi protektivními (ochranné a reparativní mechanismy organismu) a rizikovými faktory (zvýšená koncentrace kariogenních bakterií a častý příjem fermentovatelných cukrů). Na vzniku zubního kazu se podílejí především čtyři základní etiologické činitele – vnímavá sklovina, mikrobiální osídlení s tvorbou zubního plaku, dietní preference a čas. Lze je označit za základní rizikové faktory, které jsou modifikované řadou dalších vnějších a vnitřních vlivů [10].
ORÁLNÍ MIKROFLÓRA
Rozvoje zubního kazu se účastní kariogenní bakterie, mezi které řadíme Streptococcus mutans, Lactobacillus spp. a také druhy Actinomyces. S počáteční fází vzniku kazu koreluje přítomnost viditelného zubního plaku na povrchu zubu. Výzkumy potvrzují, že významným rizikovým faktorem je zejména množství streptokoků (S. mutans) ve slině [11, 12]. U kavitované léze je vysoká pravděpodobnost nálezu Lactobacillus spp. a celkově zvýšeného počtu mikroorganismů [11]. U dětí mladších než 30 měsíců byly se zubním kazem spojeny zejména rody Streptococcus a Veillonella, zatímco rody Leptotrichia, Selenomonas, Fusobacterium, Capnocytophaga a Porphyromonas byly častěji detekovány u dětí s intaktní dočasnou denticí [13]. Z kariézních lézí jsou typicky izolovány S. mutans a S. sobrinus [14], nejčastěji sérotyp c S. mutans, který tvoří 70 až 100 % izolovaných kmenů této skupiny [15, 16]. Streptokoky jsou schopny produkovat extracelulární i intracelulární polysacharidy fermentací sacharózy a vytvářet kyseliny (kyselina mléčná, máselná, propionová, mravenčí a octová), čímž snižují hodnoty zubního plaku pod 5,5 pH, a vytvářejí tak vhodné podmínky pro demineralizaci skloviny.
Ústní dutina novorozence je v době porodu většinou sterilní, ale krátce po něm ji začíná kolonizovat značné množství různých druhů mikroorganismů, které tvoří přirozenou mikroflóru ústní dutiny. Za primární zdroj těchto bakterií se pokládají porodní cesty [17]. Osidlování ústní dutiny bakteriemi může být ovlivněno způsobem porodu, byť v literatuře nacházíme protichůdné informace. Studie provedená na indické populaci nezaznamenala statisticky významné rozdíly v přítomnosti bakterie S. mutans mezi dětmi narozenými vaginálním porodem a císařským řezem, a to až do věku 12 měsíců [18]. Na druhé straně studie thajských autorů na větším vzorku populace dokládá, že děti narozené vaginální cestou mají ve věku tří let vyšší prevalenci zubního kazu a vyšší kolonizaci bakterií S. mutans než ty po abdominální operaci [19].
Obecně se předpokládá, že S. mutans kolonizuje dutinu ústní dítěte ve větší míře po prořezání prvních dočasných zubů. Kolonizaci ovlivňuje prenatálně i postnatálně řada faktorů, jakými jsou vysoké hladiny S. mutans u matky, nízká porodní hmotnost dítěte nebo socioekonomické faktory rodiny [17, 18, 19, 20, 21]. Důležitou roli v kolonizaci bakterií sehrává imunitní systém novorozence, především koncentrace sekrečního imunoglobulinu A (sIgA) ve slinách, který se zvyšuje s gestačním věkem plodu. U dětí s nízkou porodní hmotností a dětí předčasně narozených není imunitní systém dostatečně funkční, hladiny sIgA jsou nízké, a proto jsou tito jedinci vystaveni zvýšenému riziku vzniku infekce [22]. Navíc jsou dětem narozeným předčasně nebo s nízkou porodní hmotností častěji podávána antibiotika. Bakteriální kolonizaci může ovlivnit i délka poporodní hospitalizace na jednotkách intenzivní péče (s endotracheální intubací) a omezený kontakt s matkami. Ukazuje se, že faktorů, které ovlivňují vývoj orální mikroflóry dítěte, je celá řada, včetně mikrobiomu matky z vaginální oblasti, střeva, kůže, mateřského mléka a první potravy [23].
Jako indikátory socioekonomického statusu se používají údaje o příjmu rodiny, zaměstnání a vzdělání rodičů. Rodinné i kulturní zvyky a praktiky ovlivňují stav chrupu a ústní dutiny prostřednictvím stravovacích návyků, způsobem péče o dítě nebo léčbou různých onemocnění. Tyto faktory jsou úzce spojeny s demografickými charakteristikami, dostupností zubní péče a možnostmi pojištění. Vyšší příjem rodičů je většinou spojen s lepším hodnocením kvality života, včetně úrovně orálního zdraví.
V České republice byl nalezen vztah mezi stavem chrupu dítěte a dosaženým vzděláním matky [24]. Mezi další faktory, které se mohou podílet na stavu orálního zdraví, řadíme věk rodičů, rodinný stav, adopci, užívání drog a kouření rodičů [7]. Sociální faktory modulují přímo behaviorální složku prevence zubního kazu, a to orální hygienu, stravovací návyky a využívání odborné stomatologické péče.
Hlavní roli v osidlování ústní dutiny dítěte však sehrává vertikální přenos z matky na dítě, kde transportním médiem je slina [25]. Kmeny S. mutans izolované od matek a jejich dětí mají podobný fenotypový profil nebo chromozomální DNA vzorce, což svědčí o tom, že zdrojem S. mutans u dítěte je jeho matka, a to zejména pokud ona sama nedodržuje řádnou ústní hygienu, nemá ošetřený vlastní chrup ani parodont [26, 27]. Hlavními rizikovými faktory jsou olizování dudlíku, lžičky při krmení nebo líbání úst dítěte.
Ke kolonizaci povrchu zubu streptokoky dochází především v tzv. infekčních oknech. Streptokoky se v dutině ústní nacházejí již před prořezáním zubů, ale pro jejich uchycení na tkáních je důležitý nedeskvamující povrch, což právě sklovina poskytuje. Rizikovým obdobím se proto stává prořezávání zubů, které začíná už v šesti měsících. Pro adhezi bakterie S. mutans je ale nejrizikovější období mezi 19. a 31. měsícem – první infekční okno – a poté období šestého roku – druhé infekční okno, kdy se prořezávají moláry a zdrojem infekce může být i dočasný kariézní chrup [6]. Naproti tomu pro bakterii S. sanguis platí, že iniciální kolonizace je spojena s prořezáním prvního zubu a první infekční okno se otevírá v devátém měsíci [20]. V souvislosti s možným přenosem kariogenní infekce se uvádí též horizontální přenos, kdy v úvahu přicházejí otec dítěte nebo partner matky, prarodiče, sourozenci a spolužáci v předškolních zařízeních [28, 29]. Ve srovnání s významem matek jako primárního zdroje infekce však tyto další možnosti mají pro přenos mikrobů mnohem menší význam [30].
Cílem studie bylo analyzovat přítomnost kariogenních bakterií S. mutans, Actinomyces spp. a Lactobacillus spp. u malých dětí a jejich matek a zhodnotit, zda existuje statisticky významná souvislost mezi jejich výskytem u matky a jejího dítěte.
SOUBOR VYŠETŘENÝCH DVOJIC A METODIKA
V rámci studie bylo vyšetřeno 80 dvojic matka/dítě s diagnózou ECC (průměrný věk dítěte 3,8 let ± 1,14 SD). Děti byly odeslány k vyšetření svým registrujícím lékařem na dětské oddělení Stomatologické kliniky FN u sv. Anny a jejich matky souhlasily se zařazením do studie. Před samotným klinickým vyšetřením byla odebrána anamnéza dítěte zaměřená na celkový zdravotní stav, alergie a užívanou medikaci. Do studie byly zařazeny pouze děti celkově zdravé, které více než dva měsíce neužívaly antibiotika. Všechny matky uváděly, že svým dětem zuby čistí, ale ne všechny děti u čištění spolupracovaly. Z dalších výživových a hygienických návyků jsme zjišťovali složení podávaných nápojů, frekvenci svačin, olizování lžičky matkou u krmení dítěte nebo čištění dudlíku v ústech matky.
Děti byly vyšetřeny běžným způsobem na stomatologickém křesle za pomoci sondy, zrcátka a dobrého osvětlení jedním zubním lékařem, kalibraci jsme provedli před zahájením studie. Před vyšetřením byly zuby jemně osušeny vzduchovou pistolí, aby nebyl porušen zubní povlak. Vizuálně byla hodnocena přítomnost zubního povlaku (plak přítomen/ nepřítomen) a byl stanoven kpe index zubů. Při diagnostice zubního kazu bylo použito doporučení stanovené Světovou zdravotnickou organizací (WHO) z roku 1997 a do indexu kpe byly započítány pouze kavitované léze (D3–4). U matek se zjištoval věk, přítomnost povlaku byla hodnocena vizuálně: plak přítomen/ nepřítomen, dále byl zaznamenán počet zubních kazů, výplní a extrahovaných zubů (má/nemá), preventivní prohlídky (chodí/ nechodí) a to, zda u krmení olizuje dítěti lžičku nebo dudlík (příloha 1). Podepsaný informovaný souhlas matek byl schválen etickou komisí FNUSA, Brno (1G/2017).
Příloha 1 Dotazník
Additional file 1 Questionnaire
Materiál pro vyšetření bakterií S. mutans, Lactobacillus spp. a Actinomyces spp. byl u dětí získán stěrem z povrchu kariézních zubů, u matek byl povlak stírán z povrchu všech zubů, vždy pomocí vatové sterilní štětičky. Děti ani matky v předchozích dvou hodinách nic nejedly, nečistily si zuby, matky nekouřily a děti v předchozích dvou měsících neužívaly antiobiotika. U 80 dvojic byl proveden odběr na vyšetření přítomnosti kariogenní bakterie S. mutans, u kmenů Lactobacillus a Actinomyces bylo vyhodnoceno pouze 70 dvojic. Odebrané vzorky byly hodnoceny pomocí testu CarioGene® pro DNA diagnostiku kariogenních bakterií.
Test CarioGene®
Test CarioGene® (Protean, s.r.o., Dobrá voda u Č. Budějovic, Česká republika) umožňuje semikvantitativní průkaz bakterií Streptococcus mutans, Lactobacillus spp. a Actinomyces spp. s využitím metod molekulární biologie – technologie založené na PCR. Hodnocení (-) negativní odpovídá počtu bakterií < 103, (+) slabě pozitivní odpovídá počtu bakterií 103–104, (++) středně pozitivní odpovídá počtu bakterií 104–105, (+++) silně pozitivní odpovídá počtu bakterií >105.
Statistická analýza
Byla porovnána přítomnost kariogenních bakterií mezi matkou a jejím dítětem u bakterií Actinomyces spp. u 70 párů matka/dítě a u Lactobaccillus spp. a S. mutans u 80 párů matka/dítě. Výsledky byly hodnoceny jednostranným Fisherovým exaktním testem. Pro statistickou analýzu byl použit program SPSS (SPSS 20.0.1, IBM Corporation, 2011, Chicago, USA).
VÝSLEDKY
Průměrný věk matek ve skupině byl 32,4 let, (± 5,38 SD), průměrný věk jejich dětí byl 3,8 let (± 1,14 SD). Z celkového počtu 80 dětí bylo 42 (52,5 %) mužského a 38 (47,5 %) ženského pohlaví. Průměrné kpe zubů u dětí bylo 8,74 (± 3,77 SD). V době vyšetření mělo aktivní zubní kaz 37,5 % matek, u 98,6 % matek byl zubní kaz ošetřen výplní a 48,6 % matek již absolvovalo extrakci zubu pro kaz. O nízkém zájmu matek o péči o svůj chrup svědčí i to, že jen 77 % matek navštěvuje pravidelně svého zubního lékaře. Zuby zřetelně pokryté plakem jsme zaznamenali u 42,9 % matek (odpovídá stupni 2–3 na škále podle Loë a Silnesse 1963 [31]). Celkem 71,3 % matek udávalo, že olizovalo lžičku při ochutnávání stravy dítěte a následně dítě stejnou lžičkou krmilo, 40 % matek čistilo dudlík ve svých ústech. Pro úplnost je konstatováno, že 35 % matek dudlík v ústech nečistí a 12,5 % uvádělo, že dítě nikdy dudlík nemělo. Ačkoliv CarioGene® test umožňuje semikvantitativní analýzu, hodnocena byla pouze kvalitativně přítomnost/nepřítomnost bakterií ve stěru (za negativní výsledek stěru byla považována hodnota < 103 bakterií, vyšší množství bylo hodnoceno jako pozitivní nález).
Negativní nález S. mutans u dítěte i u jeho matky byl zjištěn u 32 dvojic (40 %), přítomnost u obou byla prokázána u 27 párů (33,75 %). U 12 matek (15 %) byl stěr na S. mutans negativní, zatímco jejich děti měly test na tuto bakterii pozitivní. V devíti případech (11,25 %) byl nález pozitivní jen u matky (tab. 1). Výsledky hodnocené jednostranným Fisherovým exaktním testem prokázaly významnou souvislost mezi přítomností bakterie S. mutans u matky a u jejího dítěte (p < 0,0001, OR = 8,00, 95% CI: 2,93–21,85).
Tab. 1. Detekce bakterie S. mutans
Tab. 1 Detection of cariogenic bacteria S. mutans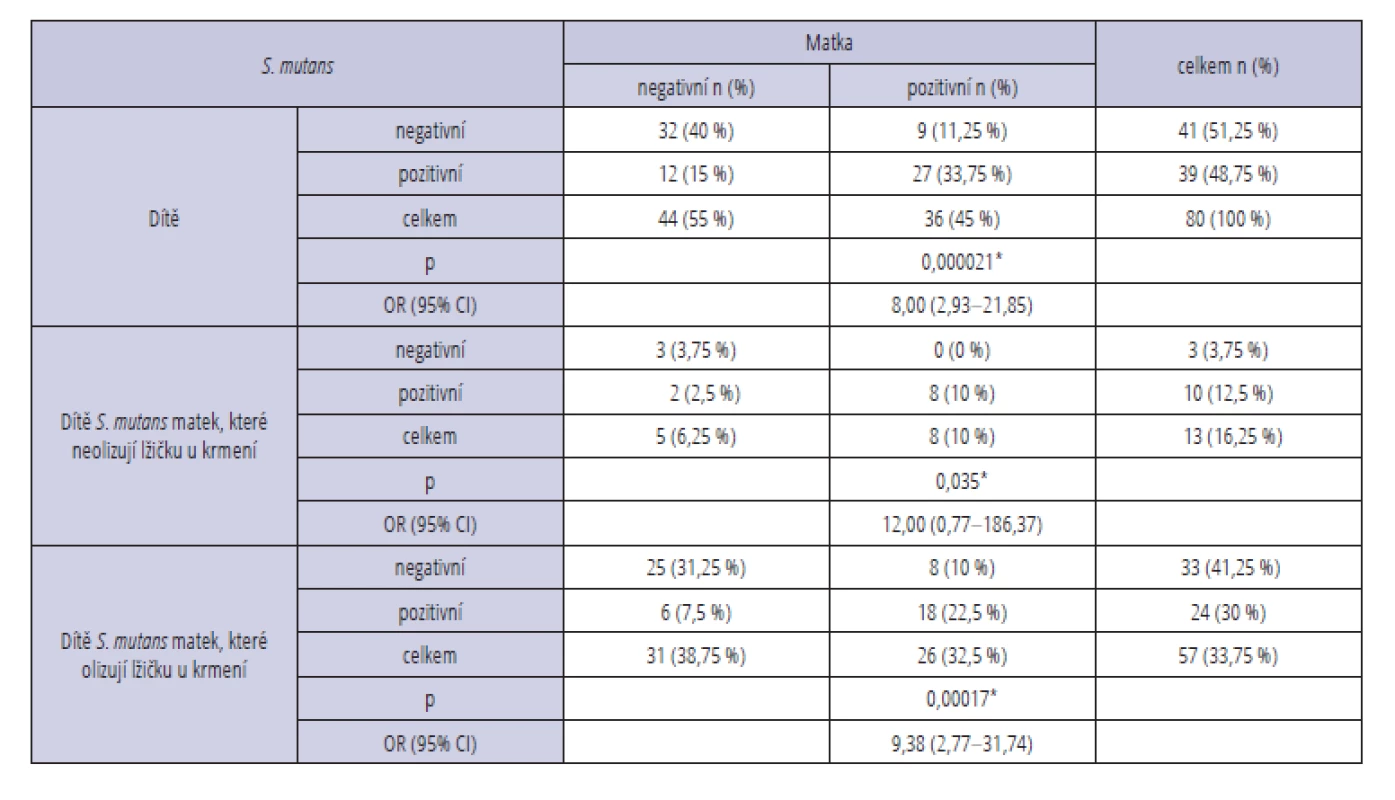
Dítě S. mutans
– stěr u dítěte k vyšetření bakterie S. mutans metodou Cario-Gene®
Matka S. mutans
– stěr u matky k vyšetření bakterie S. mutans metodou Cario-Gene®
Negativní
– S. mutans nedetekován, odpovídá počtu bakterií < 103 CFU
Pozitivní
– S. mutans odpovídá počtu bakterií ≥103 CFU
p – p-hodnota; *p < 0,05;
CI – interval spolehlivosti;
OR – poměr šancí
Child S. mutans
– smear in child to detection of bacteria S. mutans by method Cario-Gene®
Mother S. mutans
– smear in mother to detection of bacteria S. mutans by method Cario-Gene®
Negative
– S. mutans – no detection, level of bacteria is < 103 CFU
Positive
– S. mutans – low level, level of bacteria is ≥ 103 CFU
p – level of signifikance;
*p < 0.05; CI – confidence interval;
OR – odds ratioPro bakterie Lactobacillus spp. a Actinomyces spp. jsme použili stejné hodnocení jako v případě S. mutans. Zjišťovali jsme, zda bakterie jsou nebo nejsou ve stěru přítomné, přičemž množství bakterií menší než 103 bylo hodnoceno jako negativní výsledek.
Negativní nález Lactobacillus spp. u dítěte i u matky byl zjištěn u 13 dvojic (18,57 %), pozitivní u obou byl u 46 (65,71 %). Nález pozitivní pouze u matky, ale negativní u dítěte byl pozorován ve dvou případech (2,86 %), pozitivní pouze u dítěte a negativní u matky byl zjištěn v devíti případech (12,86 %) (tab. 2). Výsledky jsme opět hodnotili jednostranným Fisherovým exaktním testem. Zjištěný vztah mezi přítomností/nepřítomností Lactobacillus spp. u matky a u jejího dítěte byl statisticky významný (p < 0,00001, OR = 33,22, 95% CI: 6,37–173,21) stejně jako v případě S. mutans.
Tab. 2. Detekce bakterie Lactobacillus spp.
Tab. 2 Detection of cariogenic bacteria Lactobacillus spp.
Dítě Lactobacillus spp.
− stěr u dítěte k vyšetření bakterie Lactobacillus spp. metodou Cario-Gene®
Matka Lactobacillus spp. − stěr u matky k vyšetření bakterie Lactobacillus spp. metodou Cario-Gene®
Negativní
− Lactobacillus spp. nedetekován, odpovídá počtu bakterií < 103 CFU
Pozitivní
− Lactobacillus spp. odpovídá počtu bakterií ≥103 CFU
p – p-hodnota; *p < 0,05;
CI – interval spolehlivosti;
OR – poměr šancí
Child Lactobacillus spp.
– smear in child to detection of bacteria Lactobacillus spp. by method Cario-Gene®
Mother Lactobacillus spp.
– smear in mother to detection of bacteria Lactobacillus spp. by method Cario-Gene®
Negative
– Lactobacillus spp. – no detection, level of bacteria is < 103 CFU
Positive
– Lactobacillus spp. – low level, level of bacteria is ≥ 103 CFU
p – level of signifikance;
*p < 0,05; CI – confidence
interval; OR – odds ratioBakterii Actinomyces spp. jsme ve stěrech neprokázali pouze u jednoho dítěte (1,43 %) a dvou matek (2,86 %). U matky i u dítěte byla tato bakterie detekována v 67 případech (95,71 %) a pouze u dvou dvojic byl pozitivní stěr jen u dítěte, a ne u matky (2,86 %). Výsledky hodnocené Fisherovým exaktním testem však nebyly statisticky významné (p > 0,05) (tab. 3).
Tab. 3. Detekce bakterie Actinomyces spp. Tab. 3 Detection of cariogenic bacteria Actinomyces spp. 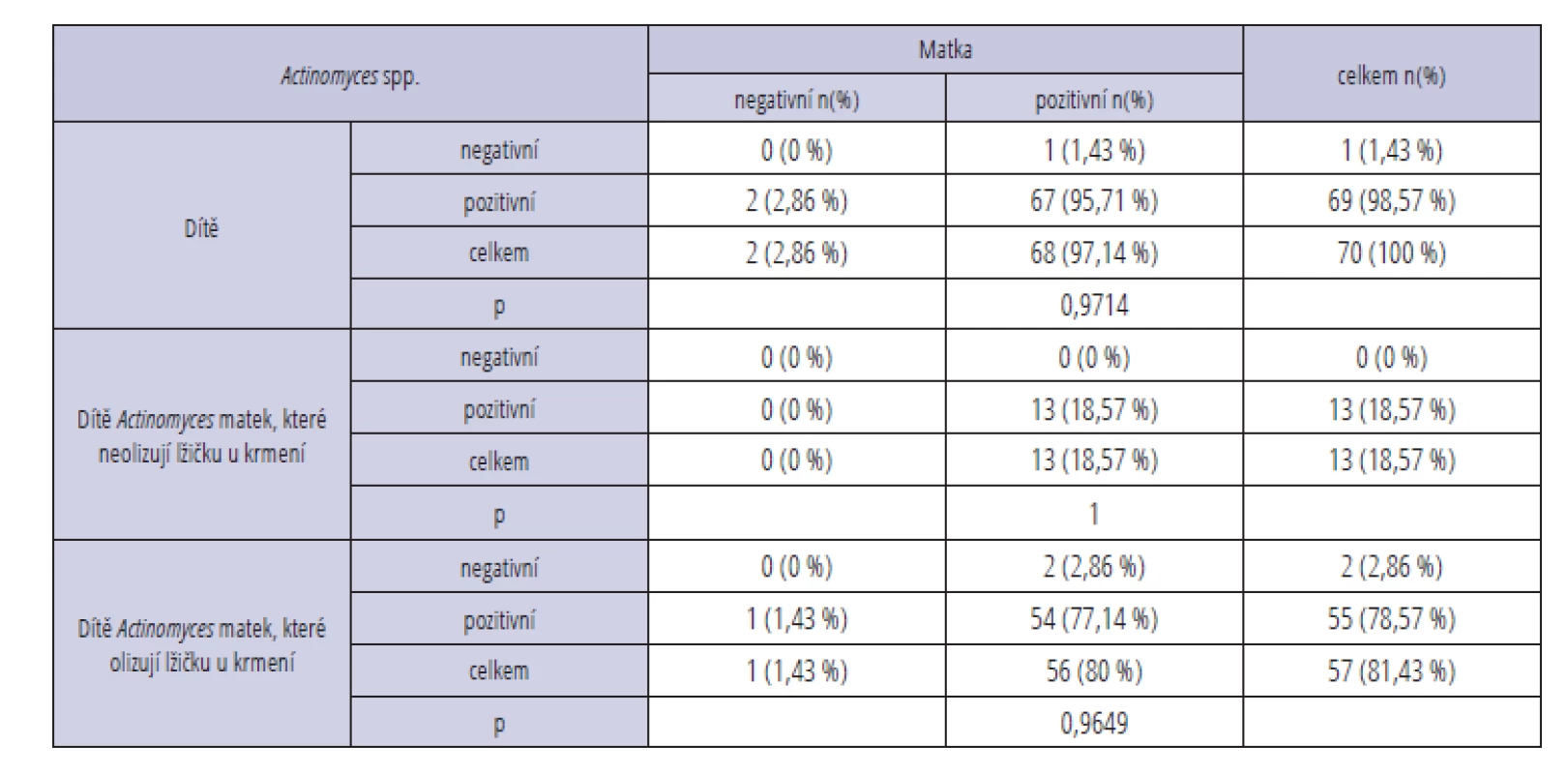
Dítě Actinomyces spp.
− stěr u dítěte k vyšetření bakterie Actinomyces spp. metodou Cario-Gene®
Matka Actinomyces spp. −
stěr u matky k vyšetření bakterie Actinomyces spp. metodou Cario-Gene®
Negativní
– Actinomyces nedetekován, odpovídá počtu bakterií < 103 CFU
Pozitivní
– Actinomyces slabě pozitivní, odpovídá počtu bakterií ≥103 CFU
p – p-hodnota
Child Actinomyces spp.
– smear in child to detection of bacteria Actinomyces spp. by method Cario-Gene®
Mother Actinomyces spp.
– smear in mother to detection of bacteria Actinomyces spp. by method Cario-Gene®
Negative
– Actinomyces spp. – no detection, level of bacteria is < 103 CFU
Positive
– Actinomyces spp. – low level, level of bacteria is ≥103 CFU
p – level of significancePři rozdělení souboru na matky olizující lžičku při krmení dítěte a ty, které to nedělaly, jsme prokázali významnou souvislost mezi přítomností bakterie S. mutans a Lactobacillus spp. u matky a u jejího dítěte pouze u první podskupiny (p < 0,001, OR = 9,38, 95% CI: 2,77–31,74 a p < 0,0001, OR = 26,00, 95% CI: 5,30–127,63) (tab. 1, 2). U matek, které neolizovaly lžičku, byl tento vztah nesignifikantní. U bakterie Actinomyces spp. nebyla prokázána statisticky významná souvislost mezi její přítomností u matky a dítěte ani v jedné z podskupin matek olizujících/neolizujících lžičku při krmení (p > 0,05) (tab. 3).
DISKUSE
S. mutans je důležitým faktorem v rozvoji kazivého procesu [11, 12]. Tato bakterie osidluje povrch zubů obtížněji, než je tomu u jiných mikroorganismů. Období kolonizace zubů je omezeno na určitý časový úsek, který nazýváme infekční okno. Pokud je však v ústní dutině vytvořen stabilní biofilm fyziologické mikroflóry, bakterie S. mutans jej kolonizuje mnohem obtížněji a infekční okno se uzavírá.
Naše výsledky jsou v souladu s teorií, která za hlavní patogeny v kariogenezi považuje bakterie S. mutans a Lactobacillus spp. přítomné v zubním plaku. Ve vyšetřené skupině dětí (3,8 let ± 1,14 let) postižených ECC se S. mutans vyskytoval ve velkém množství. Tato bakterie byla přítomna u přibližně 50 % dětí, Lactobacillus spp. byl detekován ještě častěji – v 70 % případů. Je pravděpodobné, že vyšší procento výskytu Lactobacillus spp., který je nalézán na spodinách kariézních lézí častěji než S. mutans, jenž je naopak spojován s iniciálními lézemi skloviny, odpovídá tomu, že 100 % dětí mělo v době vyšetření kavitovanou kariézní lézi neošetřenou výplní [32, 33].
Naše výsledky jsou v souladu se studiemi, které prokázaly výskyt S. mutans v plaku u 30–40 % a ve slině u 10 % dětí postižených ECC [4, 23, 34, 35, 36, 37]. Studie 520 thajských dětí zjistila, že jedinci s vyšším množstvím S. mutans mají i vyšší hodnotu indexu kpe zubů, a to již ve věku 19 měsíců, což je v souladu s našimi výsledky [12].
Ústní dutina novorozence je sterilní a hlavní roli v osidlování kariogenními mikroorganismy, které probíhá vertikálním přenosem z matky na dítě, hraje slina, jež je transportním médiem [4, 23, 37]. Naše výsledky podporují platnost této teorie [26]. Byl prokázán statisticky významný vztah mezi přítomností S. mutans a Lactobacillus spp. u matky a jejího dítěte, a to zejména ve skupině matek, které olizují lžičku, s níž krmí své dítě. Genetická příbuznost bakterií u sledovaných párů matka - dítě však nebyla analyzována. Pattanaporn a kol. ve své práci uvádějí, že vertikální přenos se podílí nejenom na transportu bakterií S. mutans, Lactobacillus a Actinomyces, ale i dalších, jako je Bifidobacterium spp. [19]. Mitchell a kol. naproti tomu u 74 % dětí postižených ECC neprokázali shodný genotyp bakterie S. mutans s matkou [27]. Je nutné podotknout, že přenos bakterií může probíhat od každé osoby, která dítě hlídá a nedodržuje základní hygienické návyky, jako je neolizování lžičky nebo dudlíku. Autoři výše uvedené studie se nezmiňují o těchto informacích, proto nemůžeme jejich soubor pacientů porovnat s naší skupinou, kde jsme zjistili, že téměř tři čtvrtiny matek olizovalo lžičku při ochutnávání stravy dítěte a následně stejnou lžičkou děti krmilo a 40 % matek čistilo dudlík ve svých ústech. Rozdíly mezi oběma studiemi mohou být dány i odlišným počtem vyšetřených párů; Mitchell a kol. sledovali celkem 27 párů dítě/matka, zatímco náš soubor tvořilo 80 dvojicí [27]. Studie, která se zabývala vlivem mikrobiomu matky na orální mikrobiom dítěte, byla provedena ve Spojených státech [37]. Autoři vyšetřili 33 párů matka/dítě a neodhalili žádné významné rozdíly v diverzitě mikrobiomu mezi matkami a dětmi. K podobným výsledkům dospěli také autoři Gomez a kol. [23].
V zahraniční literatuře lze najít i studie, které se zabývají horizontálním přenosem mezi sourozenci nebo dětmi v předškolních a školních zařízeních [38, 39]. Náš soubor pacientů byl tvořen dětmi, které nenavštěvovaly předškolní zařízení, zaměřili jsme se proto zejména na přenos z matky na dítě.
I když se v literatuře klade hlavní důraz na roli streptokoků (zejména již zmiňovaného S. mutans) v rozvoji zubního kazu, důležitou součástí orální mikroflóry jsou i aktinomycety. Ty využívají cukr obsažený ve stravě pro tvorbu intracelulárních polysacharidů, které následně metabolizují další mikroorganismy jako zdroj energie v době, kdy extracelulární sacharidy chybějí, a tím se podílejí na tvorbě kyselin i v průběhu noci [40, 41, 42]. Aktinomycety se účastní tvorby plaku již v jeho rané fázi jako součást iniciální flóry a vyskytují se především v oblastech mělkých jamek a fisur [43, 44]. Ve vztahu k zubnímu kazu je podstatné, jak vysoký je počet grampozitivních koků produkujících kyseliny, které pH plaku snižují (S. mutans), tak i grampozitivních tyček, jako jsou Actinomyces spp. a Lactobacillus spp.
Mnoho studií popisuje souvislost mezi vysokým počtem bakterie S. mutans a rychle se rozvíjejícím zubním kazem u dětí s vysokým příjmem sacharidů ve stravě a v nápojích. Některé další práce o kazu raného dětství prokázaly, že ECC je asociován spíše s rozmanitou mikroflórou [12, 34, 35, 36, 45]. Druhy, které jsou nejčastěji spojovány s těžkou formou ECC, jsou S. mutans, Scardovia wiggsiae, Veillonella parvula, Streptococcus cristatus, Actinomyces gerencseriae a Actinomyces naeslundii [46, 47]. Je nesporné, že bakterie rodu Actinomyces hrají nejenom důležitou roli při vzniku zubního kazu, ale spolu se S. mutans se podílejí i na jeho progresi [48]. To podporuje i naše zjištění, kdy ze 70 dětí postižených ECC mělo jen jedno dítě negativní stěr na Actinomyces. Tato studie byla limitována skutečností, že byl sledován výskyt kariogenní mikroflóry u dětí, které se dostavily na dětské oddělení STK FN u sv. Anny pro ošetření akutní situace a jejichž matky ve většině případů nejevily zájem o spolupráci. Bylo proto možné analyzovat jen některé proměnné, které mohou mít vliv na vznik ECC, a nebylo proto možné vyšetřit ani sourozence, ani otce či jinou osobu, která o dítě rovněž pečuje. Jistou limitaci studie představuje rovněž použití testu CarioGene®, který neumožňuje stanovit genetickou příbuznost mikrobiální flóry u dítěte a jeho matky a který byl vzhledem k nízkým počtům vyšetřených párů matka-dítě využit jen v rámci kvalitativního hodnocení.
Pro prevenci zubního kazu, tedy i ECC, je důležité, aby byly matky edukovány o rizikových faktorech tvorby kazu a možnostech jeho přenosu. Podle výsledků studie Lenčové si rodiče uvědomují svoji zodpovědnost za prevenci zubního kazu u svých dětí. Mají snahu pomáhat dětem s čištěním zubů a vědí i o riziku podávání slazených jídel a nápojů [49]. Za nejlepší způsob prevence však pokládají návštěvu zubního lékaře a podceňují závažnost ztráty dočasného chrupu. Jako jedna z vhodných možností prevence zubního kazu se jeví i využití metod behaviorální intervence se zobrazováním negativních dopadů zubního kazu na zdraví dítěte, a to umístěním vhodných obrázků v čekárnách pediatrů, zubních lékařů nebo na etiketách sladkostí a slazených nápojů [50].
ZÁVĚR
Výsledky naší práce nasvědčují tomu, že zdrojem kariogenních bakterií u dětí by mohly být jejich matky. Byla prokázána signifikantní souvislost mezi přítomností zkoumaných druhů u matky a jejího dítěte s ECC, a to u S. mutans a Lactobacillus spp. Předložená práce je tak v souladu se studiemi, které tento přenos potvrzují. Za potenciální cesty přenosu infekce u námi vyšetřených dětí se hlavně pokládá olizování lžičky při krmení dítěte nebo čištění dudlíku v ústech matky.
Tato studie byla podpořena grantem AZV NV17-30439A a MUNI/A/1428/2019 a z prostředků poskytnutých Lékařskou fakultou MU juniorskému výzkumníkovi Michaele Bartošové.
MDDr. Michaela Bartošová, Ph.D.
Stomatologická klinika Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice u svaté Anny Pekařská 53 656 91 Brno
e-mail: michaela.bartosova@fnusa.cz
Zdroje
1. American Academy of Pediatric Dentistry (AAPD). Definition of Early Childhood Caries (ECC). [cit. 15. 12. 2018]. Dostupné z: http://www.aapd.org/assets/1/7/d_ecc.pdf.
2. Naidu R, Nunn J, Donnelly-Swift E. Oral health-related quality of life and early childhood caries among preschool children in Trinidad. BMC Oral Health. 2016; 16(1): 128.
3. Filstrup L, Briskie D, da Fonseca M, Lawrence L, Wandera A, Inglehart M. Early childhood caries and quality of life: child and parent perspectives. Pediatr Dent. 2003; 25(5): 31–440.
4. Hajishengallis E, Parsaei Y, Klein MI, Koo H. Advances in the microbial etiology and pathogenesis of early childhood caries. Mol Oral Microbiol. 2017; 32(1): 24–34. doi: 10.1111/omi.12152.
5. Lenčová E, Broukal Z. Prevalence zubního kazu u českých předškolních dětí. Čes Stomatol. 2012; 112(6): 168–172.
6. Handzel J. Prevence časného zubního kazu dítěte. Pediatrie pro praxi. 2008; 9(1): 61–62.
7. Merglová V, Ivančaková R. Zubní kaz a jeho prevence v časném dětském věku. 1. vydání. Praha: Česká stomatologická komora; 2009.
8. LeResche L. Epidemiology of temporomandibular disorders: implications for the investigation of etiologic factors. Crit Rev Oral Biol Med. 1997; 8(3): 291–305. doi: 10.1177/10454411970080030401.
9. Featherstone J. Caries prevention and reversal based on the caries balance. Pediatr Dent. 2006; 28(2): 128–132.
10. Axelsson, P. Chapter 2, Chapter 3. In: Axelsson, P. Diagnosis and risk prediction of dental caries. 2. vydání. Berlin: Quintessence; 2000, 43–86, 91–146.
11. Parisotto T, Steiner-Oliveira C, Silva C, Rodrigues L, Nobre-dos-Santos M. Early childhood caries and mutans streptococci: a systematic review. Oral Health Prev Dent. 2010; 8(1): 59–70.
12. Vachirarojpisan T, Shinada K, Kawaguchi Y, Laungwechakan P, Somkote T, Detsomboonrat P. Early childhood caries in children aged 6–19 months. Community Dent Oral Epidemiol. 2004; 32 : 133–142.
13. Xu H, Hao W, Zhou Q, et al. Plaque bacterial microbiome diversity in children younger than 30 months with or without caries prior to eruption of second primary molars. PLoS ONE. 2014;9:(2). doi: 10.1371/journal.pone.0089269.
14. Mosci F, Perito S, Bassa S, Capuano A, Marconi P. The role of Streptococcus mutans in human caries. Minerva Stomatol. 1990; 39(5): 413–429.
15. Cvitkovitch D. Genetic competence and transformation in oral streptococci. Crit Rev Oral Biol Med. 2001; 12(3): 217–243.
16. Loesche W. Role of Streptococcus mutans in human dental decay. Microbiol Rev. 1986; 50(4): 353–380.
17. Torrey J, Reese K. Initial aerobic flora of newborn infants. Am J Dis Child. 1944; 67 : 89–99.
18. Thakur R, Singh M, Chaudhary S, Manuja N. Effect of mode of delivery and feeding practices on acquisition of oral Streptococcus mutans in infants. Int J Paediatr Dent. 2012; 22(3): 197–202.
19. Pattanaporn K, Saraithong P, Khongkhunthian S, et al. Mode of delivery, mutans streptococci colonization, and early childhood caries in three - to five-year-old Thai children. Community Dent Oral Epidemiol. 2013; 41(3): 212–223. doi: 10.1111/cdoe.12013.
20. Caufield P, Cutter G, Dasanayake A. Initial acquisition of mutans streptococci by infant: evidence for a window of infectivity. J Dent Res. 1993; 72 : 37–45.
21. Milgrom P, Riedy C, Weinstein P, Tanner A, Manibusan L, Bruss J. Dental caries and its relationship to bacterial infection, hypoplasia, diet and oral hygiene in 6 - to 36-month-old children. Community Dent Oral Epidemiol. 2000; 28 : 295–306.
22. Nogueira RD, Sesso ML, Borges MC, Mattos-Graner RO, Smith DJ, Ferriani VP. Salivary IgA antibody responses to Streptococcus mitis and Streptococcus mutans in preterm and fullterm newborn children. Arch Oral Biol. 2012; 57 : 647–653. doi: 10.1016/j.archoralbio.2011.11.011 PubMed: 22169809.
23. Gomez A, Nelson KE. The oral microbiome of children: Development, disease and implications beyond oral health. Microb Ecol. 2017; 73 : 492–503. doi:10.1007/s00248-16-0854-1.
24. Kukletová M, Izakovičová Hollá L, Broukal Z, Musilová K, Kukla L. Vztah mezi ukazateli orálního zdraví u 13–15letých dětí skupiny ELSPAC Brno a stupněm vzdělání jejich rodičů. Čes Stomatol. 2013; 113(1): 8–13.
25. Chaffee BW, Gansky SA, Weintraub JA, Featherstone JDB, Ramos-Gomez FJ. Maternal oral bacterial levels predict early childhood caries development. J Dent Res. 2014; 93(3): 238–244.
26. Vadiakas G. Case definition, aetiology and risk assessment of early childhood caries (ECC): A revisited review. Eur Arch Paediatr Dent. 2008; 9(3): 114–125.
27. Mitchell S, Ruby J, Moser S, Momeni S, Smith A, Osgood R, Litaker M, Childers N. Maternal transmission of mutans Streptococci in severe-early childhood caries. Pediatr Dent. 2009; 31(3): 193–201.
28. Mattos-Graner RQ, Li Y, Caufield PW, Duncan M, Smith DJ. Genotypic diversity of mutans streptococci in Brazilian nursery children suggests horizontal transmission. J Clin microbiol. 2001; 39 : 2313–2316.
29. Tedjosasongk U, Kozai K. Initial acquisition and transmission of mutans streptoccoci in children at day nursery. J Dent Child. 2002; 69 : 284–288, 234–235.
30. Douglass JM, Li Y, Tinaoff N. Association of mutans streptococci between caregivers and their children. Pediatr Dent. 2008; 30 : 375–387.
31. Loe H, Silness J. Periodontal disease in pregnancy. Prevalence and severity. Acta Odontol Scand. 1963; 21 : 533–551.
32. Milnes A, Bowden G. The microflora associated with developing lesions of nursing caries. Caries Res. 1985; 19(4): 289–297.
33. Macpherson L, MacFarlane T, Stephen K. An intra-oral appliance study of the plaque microflora associated with early enamel demineralization. J Dent Res. 1990; 69(11): 1712–1716.
34. van Houte J, Gibbs G, Butera C. Oral flora of children with "nursing bottle caries". J Dent Res. 1982; 61(2): 382–385.
35. Berkowitz R, Turner J, Hughes C. Microbial characteristics of the human dental caries associated with prolonged bottlefeeding. Arch Oral Biol. 1984; 29(11): 949–951.
36. Boue D, Armau E, Tiraby G. A bacteriological study of rampant caries in children. J Dent Res. 1987; 66(1): 23–28.
37. Xiao J, Grier A, Faustoferri RC, et al. Association between oral candida and bacteriome in children with severe ECC. J Dent Res. 2018; 97(13): 1468–1476. doi: 10.1177/0022034518790941.
38. Liu Y, Zou J, Shang R, Zhou XD. Genotypic diversity of Streptococcus mutans in 3 - to 4-year-old Chinese nursery children suggests horizontal transmission. Arch Oral Biol. 2007; 52(9): 876–881. doi: 10.1016/j. archoralbio.2007.03.004.
39. Lembo FL, Longo PL, Ota-Tsuzuki C, Rodrigues CR, Mayer MP. Genotypic and phenotypic analysis of Streptococcus mutans from different oral cavity sites of caries-free and caries-active children. Oral Microbiol Immunol. 2007; 22(5): 313–319. doi: 10.1111/j.1399-302X.2007.00361.x.
40. Nyvad B, Crielaard W, Mira A, Takahashi N, Beighton D. Dental caries from a molecular microbiological perspective. Caries Res. 2013; 47(2): 89–102. doi: 10.1159/000345367.
41. Takahashi N, Yamada T. Glucose and lactate metabolism by Actinomyces naeslundii. Crit Rev Oral Biol Med. 1999; 10(4): 487–503.
42. Takahashi N, Washio J, Mayanagi G. Metabolomic approach to oral biofilm characterization – A future direction of biofilm research. J Oral Biosci. 2012; 54 : 138–143.
43. Dige I, Raarup M, Nyengaard J, Kilian M, Nyvad B. Actinomyces naeslundii in initial dental biofilm formation. Microbiology. 2009; 155(7): 2116–2126. doi: 10.1099/mic.0.027706-0.
44. Dige I, Nilsson H, Kilian M, Nyvad B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur J Oral Sci. 2007; 115(6): 459–467.
45. Milén A, Tala H. Social inequity in oral health – a newly awakened problem. Proc Finn Dent Soc. 1986; 82(5–6): 260–266.
46. Tanner A, Mathney J, Kent R, et al. Cultivable anaerobic microbiota of severe early childhood caries. J Clin Microbiol. 2011; 49(4): 1464–1474. doi: 10.1128/JCM.02427–10.
47. Tang G, Yip H, Samaranayake L, Luo G, Lo E, Teo C. Actinomyces spp. in supragingival plaque of ethnic Chinese preschool children with and without active dental caries. Caries Res. 2003; 37(5): 381–390.
48. Aas J, Griffen A, Dardis S, Lee AM, Olsen I, Dewhirst FE, Leys EJ, Paster BJ. Bacteria of dental caries in primary and permanent teeth in children and young adults. J Clin Microbiol. 2008; 46(4): 1407 – 1417. doi: 10.1128/JCM.01410–07.
49. Lencová E, Pikhart H, Broukal Z, Tsakos G. Relationship between parental locus of control and caries experience in preschool children – cross-sectional survey. BMC Public Health. 2008; 8(1). doi: 10.1186/1471-2458 - 8-208.
50. Bartosova M, Svetlak M, Kukletova M, Borilova Linhartova P, Dusek L. Emotional stimuli candidates for behavioural intervention in the prevention of early childhood caries: a pilot study. BMC Oral Health. 2019; 19(1): 33. doi: 10.1186/s12903-019-0718-4.
Štítky
Chirurgie maxilofaciální Ortodoncie Stomatologie
Článek EDITORIAL
Článek vyšel v časopiseČeská stomatologie / Praktické zubní lékařství
Nejčtenější tento týden
2021 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Orální lichen planus v kostce: Jak v praxi na toto multifaktoriální onemocnění s různorodými symptomy?
- Význam ústní sprchy pro čištění mezizubních prostor
- MIH – komplexní problém s nutností komplexního přístupu
- Benzydamin v léčbě zánětů v dutině ústní
-
Všechny články tohoto čísla
- EDITORIAL
-
VÝSKYT NEDIAGNOSTIKOVANÝCH ORTODONTICKÝCH ANOMÁLIÍ NA ZÁKLADNÍCH ŠKOLÁCH OLOMOUCKÉHO KRAJE
Původní práce – epidemiologická studie -
KARIOGENNÍ MIKROFLÓRA U DĚTÍ S KAZEM ČASNÉHO DĚTSTVÍ A U JEJICH MATEK
Původní práce – klinická studie -
FRAKTURY MANDIBULY A JEJICH VZTAH K PORANĚNÍ SKELETU HLAVY A KRKU
Původní práce – retrospektivní studie - VYBRANÉ VLASTNOSTI SÚČASNÝCH ENDODONTICKÝCH SEALEROV: ČASŤ 2
- Česká stomatologie / Praktické zubní lékařství
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle-
FRAKTURY MANDIBULY A JEJICH VZTAH K PORANĚNÍ SKELETU HLAVY A KRKU
Původní práce – retrospektivní studie - VYBRANÉ VLASTNOSTI SÚČASNÝCH ENDODONTICKÝCH SEALEROV: ČASŤ 2
-
VÝSKYT NEDIAGNOSTIKOVANÝCH ORTODONTICKÝCH ANOMÁLIÍ NA ZÁKLADNÍCH ŠKOLÁCH OLOMOUCKÉHO KRAJE
Původní práce – epidemiologická studie -
KARIOGENNÍ MIKROFLÓRA U DĚTÍ S KAZEM ČASNÉHO DĚTSTVÍ A U JEJICH MATEK
Původní práce – klinická studie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



