-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Výzkum vstřebatelnosti kovových materiálů na biologických modelech
Biodegradability of Metal Alloys: in vivo Testing
Introduction and aim:
The standard material used for osteosynthesis of the facial skeleton is the titan and its compounds. One of the disadvantages of the conventional material is the need for its extraction in indicated cases. Degradable material offer a solution to the situation. In the past, materials based on polylactic or polyglycolic acid were used for these purposes. It clinically proved to be unsatisfactory. The modern solution is the use of biodegradable metal alloys. The authors present original research on the degradation of metal materials based on magnesium and zinc on the biomodels.Materials and methods:
A total of 12 animal models (rabbits) were used. Screws of 3 types of metals (Zn-2Mg and WE43 degradable alloys and the titanium as a standard material) were implanted in the rabbit’s tibias. The animals were euthanasied in 4-weeks intervals, samples of bone tissue with an implanted material have been scaned under mikrofocus CT and were histologically examined. The rate of degradation of the materials was examined.Results:
Time period of degradation of the material WE43 under physiological conditions has been shown to be too short to stabilize the fracture. Material of Zn-2 mg during the 16 weeks showed a minimum ability to degradation. Both materials have demonstrated reasonable biological properties.Conclusion:
Degradable materials based on magnesium and zinc are from the biological point of view matching materials. The results of this research indicates that the use of both types of alloys does not satisfy the materials requirments, i.e. retained strength for 12–24 weeks and degradation in reasonable time frame..Keywords:
biodegradable alloys – osteosynthesis – magnesium alloys
Autoři: J. Levorová 1; J. Dušková 2; M. Drahoš 1; R. Vrbová 3; J. Kubásek 4; D. Vojtěch 4; M. Bartoš 1; L. Dugová 1; D. Ulmann 1; R. Foltán 1
Působiště autorů: Stomatologická klinika, maxilofaciální chirurgie 1. LF UK a VFN, Praha 1; Patologický ústav 1. LF UK a VFN, Praha 2; Stomatologická klinika, Laboratoř pro výzkum vlastností materiálů 1. LF UK a VFN, Praha 3; Ústav kovových materiálů a korozního inženýrství, VŠCHT, Praha 4
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 117, 2017, 4, s. 79-84
Kategorie: Původní práce – experimentální studie
Souhrn
Úvod a cíl:
Standardním materiálem užívaným pro osteosyntézu obličejového skeletu je titan a jeho sloučeniny. Jednou z nevýhod konvenčního materiálu je nutnost jeho extrakce v indikovaných případech. Řešení situace nabízí degradovatelné materiály. V minulosti se pro tyto účely užívaly materiály na bázi polylaktidové nebo polyglykolidové kyseliny, které se klinicky prokázaly být nevyhovující. Moderním řešením je použití osteosyntetického materiálu z kovových degradovatelných slitin. Autoři prezentují původní práci – výzkum vstřebatelnosti kovových materiálů na bázi magnezia a zinku na biomodelech.Materiál a metodika:
K výzkumu bylo použito celkem 12 zvířecích biomodelů – králíků, kterým byly implantovány do tibií šrouby ze tří typů kovů (dvě vstřebatelné slitiny – Zn-2Mg a WE43 – a titan jako standardní materiál). Zvířata byla ve čtyřtýdenních intervalech eutanazována, vzorky kostní tkáně s implantovaným materiálem byly skenovány v mikrofokus-CT a histologicky vyšetřeny. Byla posouzena rychlost degradace materiálů.Výsledky:
Doba degradace materiálu je u WE43 za fyziologických podmínek krátká pro stabilizaci fraktury do doby její konsolidace. Materiál Zn-2Mg během 16 týdnů prokázal minimální schopnost degradace. Oba materiály prokázaly přiměřené biologické vlastnosti.Závěr:
Degradovatelné materiály na bázi magnezia a zinku jsou z biologického hlediska vyhovující materiály. Z výsledků výzkumu ale vyplývá, že použití obou typů slitin nevyhovuje požadavkům na materiál, tj. zachování pevnosti po dobu 12–24 týdnů a současně vstřebání v racionálním časovém rámci.Klíčová slova:
biodegradovatelné slitiny – osteosyntéza – magneziové slitinyÚVOD
Před více než 20 lety nahradil titan a jeho slitiny v osteosyntéze obličejového skeletu dříve používanou nerezovou ocel. Ve srovnání s nerezovou ocelí (nejčastěji používaný typ 316L ISO 5832-1) je titan a jeho slitiny více rezistentní vůči korozi, má nižší tvrdost a vyšší pevnost v tahu. Navíc díky nižší hustotě je pro výrobu osteosyntetické dlahy z titanu nebo jeho slitin potřeba asi o padesát procent méně materiálu, dlahy jsou lehčí. To přináší komfort pro pacienta a roste i snadnost manipulace s dlahou [13]. Současně používané materiály jsou dobře zobrazitelné na RTG a CT s únosnou tvorbou artefaktů v obrazu. Ať už hovoříme o čistém titanu pro komerční použití, nebo o jeho slitinách, jako např. Ti-6Al-7Nb, Ti-15Mo, fyzikální vlastnosti materiálu umožňují zhotovení tvarů klasických miniplatů a šroubů. Délka šroubů se pohybuje od dvou do 18 mm, vnější šířka závitu od jednoho do tří mm; tloušťka dlahy od jednoho do 2,8 mm, šířka od 4,8 do sedmi mm a délka může přesahovat i 200 mm [5].
V 90. letech minulého století proběhla éra použití vstřebatelných osteosyntetických materiálů na bázi polyglykolidové (PGA) nebo polylaktidové kyseliny (PLA). Cílem použití vstřebatelných materiálů bylo odstranit nutnost druhého operačního zákroku pro vyjmutí materiálu. Odstranění dlah je žádoucí například v případě rostoucího skeletu dětského pacienta (kovová dlaha brání růstu, způsobuje deformity skeletu), při potřebě zhotovení zobrazovacích metod v blízkosti materiálu, který by znehodnotil obraz; např. zhotovení MRI je absolutně kontraindikováno při prezenci feromagnetických materiálů. Nicméně od použití materiálů na bázi PLA/PGA se ustoupilo kvůli častému rozvoji zánětlivých projevů v místě implantátu; histologicky byla prokázána přítomnost granulomů z cizích těles ještě několik let po implantaci [1, 19].
Moderním trendem ve výzkumu v oblasti vstřebatelných osteosyntetických materiálů je inženýrství vstřebatelných slitin na bázi magnezia. Výzkumy byly a jsou prováděny i na jiných materiálech (s obsahem Zn, Fe, Al, kovů vzácných zemin v různém poměru). Předpokladem jsou dostatečné mechanické vlastnosti a biokompatibilita materiálu odpovídající úrovni stadardního materiálu – titanu v kombinaci s biodegradovatelností materiálu v přiměřeném čase [18]. Maximum výzkumu se stále soustřeďuje v preklinických studiích. Testy kompatibility těchto slitin na bázi magnezia vykazují poměrně dobré výsledky – tendence vzniku systémové zánětlivé odpovědi nebo hypersenzitivity nebyly zaznamenány. Jejich mechanické vlastnosti jsou velmi podobné vlastnostem kortikální kosti, takže i když nedosahují vlastností titanu, mají dobrý předpoklad pro použití pro fixaci obličejového skeletu [4, 9, 18].
MATERIÁL A METODY
Autoři použili na studii zvířecí modely (12 králíků, samci NZW od firmy Anlab, s. r. o., Česká republika). Studie na zvířecích biomodelech byla schálena Ministerstvem školství, mládeže a tělovýchovy ČR, rozhodnutí s č.j. 70030/2013-MZE-17210. Cílem studie bylo zjištění rychlosti vstřebatelnosti degradovatelné slitiny na bázi magnezia (WE43), porovnání s rychlostí vstřebatelnosti biodegradovatelných slitin na bázi zinku. Jako standardní srovnávací vzorek k porovnání průběhu hojení byl použit titan.
Zvířecí modely byly rozděleny náhodně do tří skupin (I–III) podle typu kovu, který jim byl aplikován.
- Skupina I obdržela implantáty z kovu Zn (Zn-2Mg).
- Skupina II obdržela implantáty z kovu WE43 (Mg-4Y-3RE).
- Skupina III obdržela implantáty z kovu Ti (čistý titan, standardní skupina).
Příprava kovových implantátů
Zn-2Mg slitiny byly připraveny roztavením čistých kovů v odporové peci v ochranné atmosféře argonu (čistota 99,9 %). Teplota taveniny byla udržována pod 500 °C, aby se zabránilo nadměrnému odpařování zinku a oxidaci magnezia. Po dostatečné homogenizaci byla tavenina slita do válcových forem (20 mm v průměru, 200 mm délka). Mg-4Y-3RE slitky o rozměrech 40 × 80 × 500 mm byly nakoupeny od průmyslového dodavatele, znovu rozpuštěny ve vakuové indukční peci a odlity do ingotů stejných rozměrů jako Zn-2Mg slitina. Následně byly kovy extrudovány za teploty 300 °C (Zn-2Mg) a 400 °C (Mg-4Y-RE), rychlost extruze 5 mm/min. Ze slitků byly vysoustruženy implantáty tvaru válcovitého vrutu, délky 3 mm, (šířka hlavy 3 mm, vnější šířka závitu 1,5 mm, šířka těla 1,1 mm). Sterilizace proběhla v 70% etanolu (dvě hodiny) a následnou expozicí UV záření (dvě hodiny).
Implantace
Zvířata, aklimatizovaná dva týdny před zahájením studie, byla umístěna do samostatných klecí, voda a potrava jim byly podávány ad libitum. Před zahájením vlastního výzkumu byla zvážena, podle tělesné hmotnosti byl veterinárním lékařem každému zvířeti i.m. aplikován Diazepam v dávce 0,5 mg/kg, Ketamin 5 mg/kg a infiltračně do místa operační rány 1 mm 2% Mesocainu. Byla podána antibiotická profylaxe Enrofloxacin 5 mg/kg (s.c.). Zvíře bylo uloženo do supinní polohy. Po běžné sterilní přípravě operačního pole jsme obnažili tibii z řezu na kůži pravé zadní končetiny anteromediálně v proximální třetině bérce. Do kosti byly konvenčním chirurgickým mikromotorem (NSK, Surgic XT, Německo) vyvrtány dva identické tunelové defekty o průměru 2 mm, hloubce 3 mm (vrták rovný, nerezavějící ocel; 800 otáček/min). Vzdálenost mezi defekty byla vždy 15–20 mm, velikost defektů byla volena s ohledem na rozměr kosti tak, aby bylo minimalizováno riziko fraktury. Během vrtání defektů byla kost konstantně chlazena fyziologickým roztokem. Do každého defektu v kosti jsme umístili kovový šroub s podložkou ze zkoumaného vstřebatelného kovového materiálu (tzn. do jednoho zvířete byly implantovány dva šrouby z identického kovu). Rány byly zašity po vrstvách monofilním materiálem. Zvířata byla ponechána samostatně v kleci, pooperačně byl apliko ván každému zvířeti s.c. Ketoprofen v dávce 2 mg/kg. Potrava a voda byly podávány po zotavení z anestezie i nadále ad libitum. Rány byly kontrolovány denně do plného zhojení kůže. Králíci byli eutanazováni ve čtyřtýdenních intervalech; z každé skupiny (I–III) bylo eutanazováno v daném termínu jedno zvíře, tj. jedno zvíře od jednoho kovu (provedl veterinární lékař aplikací Ketamin 35 mg/kg i.m., 2% Xylazin 5 mg/kg i.m., TG1 0,3 mg/kg i.c.).
Fixace a zpracování
Po eutanazii zvířat byly vyjmuty proximální části tibií s implantáty, ihned fixovány v roztoku 37% formaldehydu a 80% etanolu v poměru 1 : 2, s hodnotou pH 7,2, upravované přídavkem CaCO3 a 1M NaOH (každý vzorek v samostatné nádobě). Po dobu pěti dnů byl roztok denně měněn, nádoby se vzorky byly umístěny na vibračním stroji Rotamax 120 (Heidolph Instruments GmbH & Co, KG, Německo) při pokojové teplotě. Odvodnění kostí proběhlo v roztoku etanolu (během každých tří dnů vzrůstající koncentrace: 70% až 100%), následující 24 hodiny byly ponořeny do roztoku 100% etanolu a acetonu 1 : 1, ukončení odvodňovací fáze bylo provedeno ponořením vzorků do 100% etanolu. Následně byly vzorky zality do čistého metylmetakrylátu (MMA). Během 72 hodin byly ve dvanáctihodinovém režimu umístěny na vibračním přístroji při pokojové teplotě na rovné podložce při teplotě 4 °C. Infiltrace MMA byla opakována ve vakuu 800 mbar membránovou pumpou ILMVAC (ILMVAC GmbH, Německo). Po vyjmutí z MMA byly vzorky zality médiem vzniklým smícháním 100 g MMA, 12,5 ml dibutylftalátu, 1,8 g benzoylperoxidu, následnou homogenizací v magnetické míchačce Lavat MM-4 (Lavat, a.s., Česká republika) po dobu 90 minut. Vzorky zalité médiem byly uchovány po dobu 30 minut ve vakuu (při tlaku 800 mbar). Polymerizace probíhala ve vodní lázni při počáteční teplotě 26 °C s postupným zvyšováním ve 48 hodinových intervalech o 1 °C na konečných 36 °C.
MikrofocusCT
K vytvoření mikrotomografických skenů jednotlivých implantátů v kostní tkáni byl použit přístroj SkyScan 1272, (Bruker, s.r.o., ČR). Preparáty byly skenovány na vzduchu, s vertikální orientací dlouhé osy, parametry jednoho zobrazovacího pole: velikost 11 µm pixelů, zdroj napětí 100 kV, proud 100 µA, 0,11 mm měďný filtr, 360o rotace. Doba skenu byla průměrně 11 hodin pro jeden preparát. Implantáty byly skenovány po zalití MMA médiem. Obrazová dokumentace byla hodnocena v softwaru NRecon software (Bruker, s.r.o., ČR).
VÝSLEDKY
Pomocí µCT byl měřen povrch a objem implantátů v časových bodech 4, 8, 12 a 16 týdnů po implantaci. Statisticky významná změna objemu ve smyslu jeho poklesu byla zaznamenána pouze u implantátu WE43. Pokles objemu nastal až v časovém bodě 16 týdnů, resp. k poklesu muselo dojít v období mezi 12. a 16. týdnem. Z původních 9,22 mm3 se objem zmenšil na 5,07 mm3, tzn. na 55,1 % původní hodnoty (rozdíl je 4,14 mm3). U Zn-2Mg materiálu jsou změny objemu zanedbatelné (srovnání hodnot viz graf 1). V časových bodech 4., 8. a 12. týdne byly objemové změny zanedbatelné (u kontrolní skupiny Ti změny objemu v rozsahu 0,02–0,15 mm3 byly považovány za zanedbatelné). U vzorku WE43 od osmého týdne začínají implantáty ztrácet charakteristický tvar: dochází k zaoblení závitů, ztrátě jejich kontury. V šestnáctém týdnu došlo u obou šroubů z WE43 k fraktuře; jeden z implantátů byl kompletně fragmentován – původní tvar nebyl rozeznatelný. U Zn2-Mg podobné změny zaznamenány nebyly (obr. 1).
Graf 1. Postup geometrické korekce projekcí snímků 
Obr. 1. Microfocus CT, WE43 implantát v 16. týdnu; patrná je fraktura materiálu při jeho degradaci, ztráta původní kontury závitů 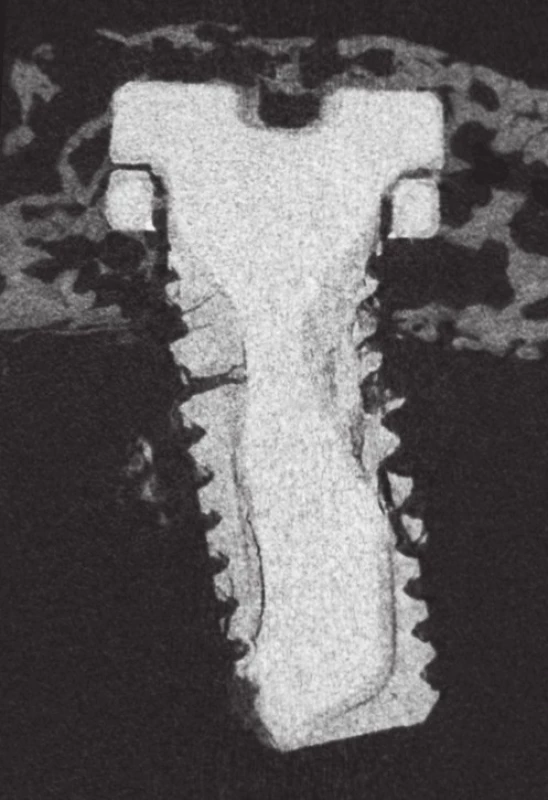
Změny povrchu implantátů v čase probíhaly analogicky; statisticky významného zvětšení povrchu bylo dosaženo u WE43 (zvětšení povrchu vzniká rozpadem materiálu). Při odběru ve 12. týdnu je povrch WE43 49,2 mm2, přírůstek povrchu je 88,4 mm2 do 16. týdne; původní hodnota 42,7 mm2; výsledná hodnota 137,6 mm2. Hodnoty povrchu všech materiálů jsou zaznamenány v tabulce 1. Pro statistickou analýzu výsledků byl použit Studentův t-test. Za statisticky signifikantní byl považován rozdíl hodnot p-value < 0,05.
Tab. 1. Závislost povrchu implantátů v závislosti na čase 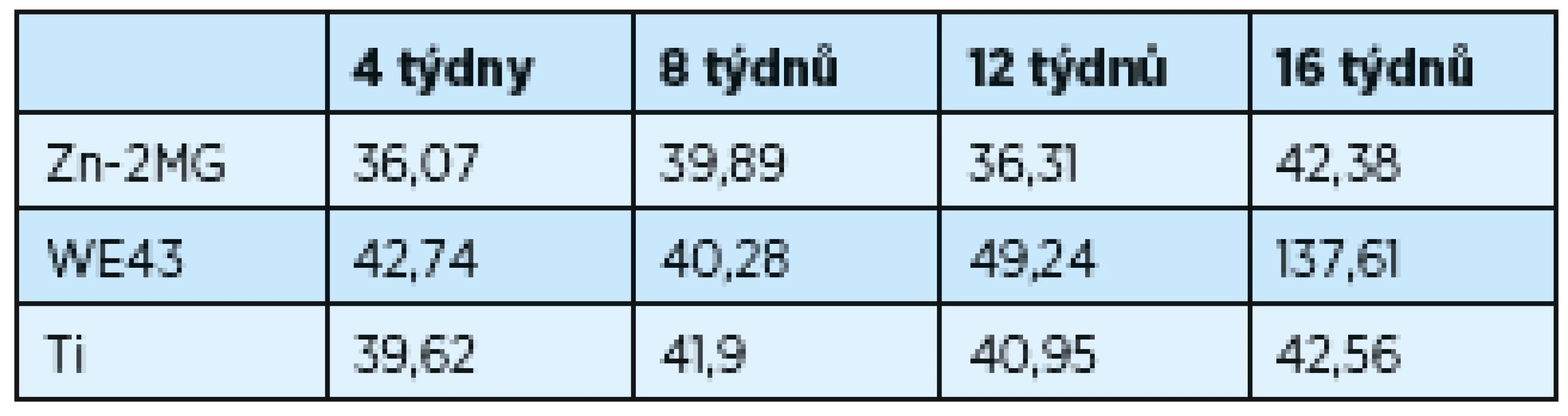
DISKUSE
V průběhu studie nebyly zaznamenány alergické reakce nebo systémové reakce zvířat. Hojení ran u všech zvířat proběhlo bez komplikací.
Degradace magnezia ve vodném prostředí za neutrálního pH lze popsat vztahem: Mg+ 2H2O→ Mg(OH)2 + H2 [8]. Kuhlmann [9] a kol. provedli studii na myších, kterým implantovali podkožně disky z rychle degradujících magneziových slitin. Sledování prokázalo uvolnění maximálního objemu vodíku v řádu několika hodin hned po implantaci, následně se rychlost degradace a tvorba vodíkových bublin snižuje [9]. Studie počítá s tím, že část objemu vodíku se rozpustí v krvi, menší část vodíku uniká přes kůži, případně se hromadí v podkoží, což se klinicky manifestuje vyklenutím a napnutím tkání s hmatnou bublinou plynu. V celém průběhu naší studie jsme nezaznamenali tvorbu bublin plynu. Kuhlmann předpokládá, že pokud je množství plynu tak velké, že nemůže z místa v okolí implantátu uniknout, vytváří v kostní tkáni kavity [9, 18]. Postupem času je vodík v kavitách nahrazován jinými plyny, jako je N2, O2, CO2. To podporuje nález Reifenrathové a kol. [12], kteří histologicky prokázali přítomnost bublin plynu ve všech vzorcích králičích tibií v okolí kovu WE43 i 6 a 12 měsíců po implantaci – přímo v kostní tkáni. Nález kostních kavit o velikosti jednoho osteonu byl v naší studii zaznamenán na histologických řezech. Maximum tvorby kavit v okolí WE43 proběhlo do osmého týdne, poté se jejich tvorba zastavuje, histologicky se znak kvantitativně objevuje statisticky méně často. To koreluje s nálezem Kuhlmanna: postupné zpomalování tvorby vodíku při pokročilé degradaci materiálu. Další in vivo pokusy popisují nález bublin plynu po implantaci degradovatelné slitiny na bázi MG-Y-Zn do peritoneální dutiny ještě 27 až 91 dní v okolních měkkých tkáních [4]. Windhagen a kol. ve studii o klinickém použití degradovatelné magneziové slitiny (MgYREZr) pro fixaci hallux valgus se o nálezu vodíkových bublin nezmiňují [15]. V jiných studiích nebyly bubliny plynu při degradaci magneziových slitin v kostní tkáni nalezeny vůbec [7, 10].
Tvorba kostních kavit u pomalu degradujících materiálů může být omezena nebo zcela nepřítomna. Rychlost degradace je při výrobním procesu záměrně ovlivněna přidáním kovů vzácných zemin [17]. WE43, který byl námi použit, je považován za pomalu korodující slitinu [2]. To, že histologicky kostní kavity prokázány byly, směřuje k předpokladu o urychlení degradace in vivo ve srovnání s pokusy in vitro. Literatura podobnou situaci nepopírá a existuje studie, která prokazuje rozdíly v rychlosti degradace materiálu in vivo versus in vitro [18]. Rychlost degradace WE43 in vitro dosahuje hodnot do 1 mm/rok, ve srovnání s jinými magneziovými slitinami (např. AJ62, AZ31) nebo čistým magneziem je jeho odolnost vůči korozi vysoká [14]. První výraznější změna objemu materiálu nastala mezi 12. a 16. týdnem. Pokud by degradace materiálu probíhala lineárně od 12. týdne, na neměřitelnou hodnotu objemu by se hypoteticky implantát dostal v bodě 18 týdnů + 4,5 dne (směrodatná odchylka 1,7). Doba konsolidace zlomeniny (celá šířka kosti, kosti obličejového skeletu) je přibližně šest až osm týdnů. Pro dostatečnou stabilizaci kosti by vysoká pevnost osteosyntetického materiálu měla trvat 12–24 týdnů. Pokud by se materiál rozpadal za méně než 19 týdnů, je degradace příliš rychlá [20].
Přesný mechanismus urychlení degradace in vivo není jasný. Jedním předpokladem urychlení degradace je vystavení materiálu koncentraci chloridových iontů od 30 mmol/l (fyziologická chlorémie králíka je v rozsahu 96–109 mmol/l [6]). Taková koncentrace způsobuje přeměnu produktu degradace – korozní bariéry Mg(OH)2 na MgCl2, tj. na vlastní degradovatelnou sloučeninu materiálu, která opět podléhá degradaci. Dochází tak k akceleraci degradace vlastním degradačním produktem [18]. Statisticky významný nárůst plochy povrchu implantátu WE43 jsme zaznamenali ve 12. týdnu po implantaci (plocha ve 12. týdnu odpovídá 115,2 % počáteční hodnoty). V 16. týdnu došlo k výraznému nárůstu plochy na 321,9 % původní hodnoty; oproti hodnotě ve 12. týdnu došlo k nárůstu plochy na 279,5 %. To by znamenalo, že v období od 12. týdne začalo docházet k většímu uvolňování degradačních produktů.
Dalším mechanismem urychlení degradace je adsorpce krevních bílkovin na podkladě Vromanova efektu na povrch implantátu (vazba bílkovin podle velikosti jejich molekul. Po postupném rozrušení vazeb probíhá vazba nových molekul v závislosti na afinitě k danému povrchu), které mohou působit jako korozní bariéra. Zrychlení rozpadu implantátu při fyziologických hodnotách pH je diskutabilní – při in vitro pokusech je snaha dosažení stejných hodnot pH [3, 18].
Rychlá degradace materiálu (doprovázená zvýšenou tvorbou vodíku a jeho tlakem na kost) může vést k zpomalení hojení rány [18]. Poměr důležitosti tohoto mechanismu a proti tomu probíhající indukce formace kosti uvolněnými magneziovými ionty je sporný [16].
MDDr. Jitka Levorová
Stomatologická klinika 1. LF UK a VFN
U Nemocnice 2
128 08 Praha 2
e-mail: jitka.levorova@gmail.com
Zdroje
1. Bergsma, J. E., de Bruijn, W. C., Rozema, F. R., Bos, R. R., Boering, G.: Late degradation tissue response to poly(L-lactide) bone plates and screws. Biomaterials, roč. 16, 1995, č. 1, s. 25–31.
2. Charyeva, O., Feyerabend, F., Willumeit, R., Zukowski, D., Gasqueres, C., Szakacs, G., Agha, N. A., Hort, N., Gensch, F., Cecchinato, F., Jimbo, R., Wennerberg, A., Lips, K. S.: In vitro resorption of magnesium materials and its effect on surface and surrounding environment. MOJ Toxicol., roč. 1, 2015, č. 1, s. 1–6.
3. Dee, K. C., Puleo, D. A., Bizios, R.: Protein-surface interactions. In Dee, K. C., a kol: An introduction to tissue-biomaterial interactions. New Jersey, Willey-Liss, Inc., 2002, s. 37–52.
4. Hänzi, A. C., Gerber, I., Schinhammer, M., Löffler, J. F., Uggowitzer, P. J.: On the in vitro and in vivo degradation performance and biological response of new biodegradable Mg-Y-Zn alloys. Acta Biomater., roč. 6, 2010, č. 5, s. 1824–1833.
5. Haug, R. H.: Design and function of implants. In Ehrenfeld, M., a kol: Principles of internal fixation of the craniomaxillofacial skeleton trauma and orthognatic surgery. New York, Thieme, 2012, s. 53–81.
6. Hewitt, C., Innes, D., Savory, J., Wills, M.: Normal biochemical and hematological values in New Zealand white rabbits. Clin. Chemistry, roč. 8, 1989, č. 35, s. 1777–1779.
7. Krause, A., Von der Hoh, N., Bormann, D., Krause, C., Bach, F. W., Windhagen, H., Meyer-Lindenberg, A.: Degradation behaviour and mechanical properties of magnesium implants in rabbit tibiae. J. Materials Science, roč. 45, 2010, č. 1, s. 624.
8, Kubásek, J., Vojtěch, D., Lipov, J., Ruml, T.: Structure, mechanical properties, corrosion behavior and cytotoxicity of biodegradable Mg–X (X=Sn, Ga, In) alloys. Materials Science and Engineering C, roč. 33, 2013, č. 4, s. 2421–2432.
9. Kuhlmann, J., Bartsch, I., Willbold, E., Schichardt, S., Holz, O., Hort, N., Höche, D., Heineman, W. R., Witte, F.: Fast escape of hydrogen from gas cavities around corroding magnesium implants. Acta Biomaterialia, roč. 9, 2013, č. 10, s. 8714–8721.
10. Marukawa, E., Tamai, M., Takahashi, Y., Hatakeyama, I., Sato, M., Higuchi, Y., Kakidachi, H., Taniguchi, H., Sakamoto, T., Honda, J., Omura, K., Harada, H.: Comparison of magnesium alloys and poly-l-lactide screws as degradable implants in a canine fracture model. J. Biomed. Mater. Res. B. Appl. Biomater., roč. 104, 2016, č. 7, s. 1282–1289.
11. Pichler, K., Kraus, T., Martinelli, E., Sadoghi, P., Musumeci, G., Uggowitzer, P. J., Weinberg, A. M.: Cellular reactions to biodegradable magnesium alloys on human growth plate chondrocytes and osteoblasts. Int. Orthop., roč. 38, 2014, č. 4, s. 881–889.
12. Reifenrath, J., Bormann, D., Meyer-Lindenberg, A. Magnesium alloys as promising degradable implant materials in orthopaedic research. In Czerwinski, F.: Magnesium alloys – corrosion and surface treatments. Berlin, InTech, 2011, s. 93–108.
13. Richards, R. G., Disegi, A. J.: Metals, surfaces, and tissue inter-actions. In Ehrenfeld M.: Principles of Internal Fixation of the Craniomaxillofacial Skeleton Trauma and Orthognatic Surgery. New York, Thieme, 2012, s 39–44.
14. Vojtěch, D., Kubásek, J.: Structure, mechanical and corrosion properties of magnesium alloys for medical application. Acta Metallurcica Slovaca, roč. 3, 2013, č. 1, s. 82–89.
15. Windhagen, H., Radtke, K., Weizbauer, A., Ediekmann, J., Noll, Y., Kreimeyer, U., Schavan, R., Stukenborg-Colsman, C., Waizy, H.: Biodegradable magnesium-based screw clinically equivalent to titanium screw in hallux valgus surgery: short term results of the first prospective, randomized, controlled clinical pilot study. BioMedical Engineering OnLine, roč. 12, 2013, č. 1, s. 62.
16. Witte, F., Haferkamp, H., Kaese, V., Windhagen, H.: In vivo corrosion of four magnesium alloys and the associated bone response. Biomaterials, roč. 17, 2005, č. 26, s. 3557–3563.
17. Witte, F., Ulrich, H., Rudert, M., Willbold, E.: Biodegradable magnesium scaffolds: Part I appropriate inflammatory response. J. Biomed. Mater. Res. A., roč. 81, 2007, č. 3, s. 748–756.
18. Witte, F., Hort, N., Vogt, C., Cohen, S., Kainer, K. U., Willumeit, R., Feyerabend, F.: Degradable biomaterials based on magnesium corrosion. Current Opinion in Solid State and Materials Science, roč. 12, 2008, č. 5, s. 63–72.
19. Xue, A., Koshy, J. C., Weathers, W. M., Wolfswinkel, E. M., Kaufman, Y., Sharabi, S. E., Brown, R. H., Hicks, M. J., Hollier, L. H.: Local foreign-body reaction to commercial biodegradable implants: an in vivo animal study. Craniomaxillofac Trauma Reconstr., roč. 7, 2014, č. 1,. s. 27–34.
20. Zheng, Y.: in vivo testing of biodegradable Mg alloy implants. In Zheng, Y.: Magnesium alloys as degradable biomaterials. Boca Raton, CRC Press, 2016, s. 421–456.
Štítky
Chirurgie maxilofaciální Ortodoncie Stomatologie
Článek DEN VÝZKUMNÝCH PRACÍ 2017Článek Seriál o EET
Článek vyšel v časopiseČeská stomatologie / Praktické zubní lékařství
Nejčtenější tento týden
2017 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Orální lichen planus v kostce: Jak v praxi na toto multifaktoriální onemocnění s různorodými symptomy?
- Význam ústní sprchy pro čištění mezizubních prostor
- Diagnostika alergie na bílkoviny kravského mléka − aktuální postupy a jejich vypovídací hodnota
- Benzydamin v léčbě zánětů v dutině ústní
-
Všechny články tohoto čísla
-
Časté paralelne sa vyskytujúce lézie na povrchu jazyka
(Prehľadový článok) - DEN VÝZKUMNÝCH PRACÍ 2017
- Seriál o EET
-
Zemřel doc. MUDr. Jiří Bittner, CSc.
(16. 4. 1930 – 16. 10. 2017) - Doc. MUDr. Otakar Krejsa, CSc., jubilující
- Výzkum vstřebatelnosti kovových materiálů na biologických modelech
-
Reziduální natální zub
(Kazuistika) -
Výsledky léčby parodontálních kostních chobotů kombinací kalcium sulfátu a beta trikalcium fosfátu
(Jednoletá retrospektivní studie)
-
Časté paralelne sa vyskytujúce lézie na povrchu jazyka
- Česká stomatologie / Praktické zubní lékařství
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle-
Časté paralelne sa vyskytujúce lézie na povrchu jazyka
(Prehľadový článok) -
Reziduální natální zub
(Kazuistika) -
Výsledky léčby parodontálních kostních chobotů kombinací kalcium sulfátu a beta trikalcium fosfátu
(Jednoletá retrospektivní studie) - Seriál o EET
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



