-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Oční jizevnatý pemfigoid – retrospektivní studie
Autoři: E. Szabó; M. Palos; P. Skalická
Působiště autorů: Oční klinika, 1. lékařská fakulta, Univerzita Karlova v Praze a Všeobecná fakultní nemocnice v Praze, přednostka doc. MUDr. Bohdana Kalvodová, CSc.
Vyšlo v časopise: Čes. a slov. Oftal., 72, 2016, No. 1, p. 283-292
Kategorie: Původní práce
Souhrn
Úvod:
Oční jizevnatý pemfigoid (OCP) je autoimunitní onemocnění spojivky, které je vzácné, závažné a zrak ohrožující. Postihuje pacienty staršího věku, častěji ženy.Cíl:
Zhodnocení úspěšnosti stabilizace očního nálezu u pacientů s OCP.Metodika:
Retrospektivní studie souboru pacientů z Centra pro onemocnění rohovky a spojivky Oční kliniky 1. LF UK a VFN v Praze v období 1992–2013. Byla sledována četnost klinických stadií OCP, centrální zraková ostrost (CZO), aktivita onemocnění a komplikace, se kterými pacienti přicházeli. Dále byl zaznamenán druh použité celkové imunosupresivní (IS) léčby, počet relapsů onemocnění a progrese stadia OCP. Zvláštní pozornost byla věnována efektu léčby a nežádoucím účinkům mykofenolát mofetilu (MM). Byly posuzovány typy operací, které pacienti před příchodem k nám podstoupili, a typy námi indikovaných operací. Vyhodnocena byla také výtěžnost diagnostických metod OCP a četnost záchytu celkového jizvícího onemocnění sliznic (MMP).Výsledky:
OCP byl během 21 let diagnostikován u 51 pacientů, 21 mužů a 30 žen. Průměrný věk při stanovení diagnózy byl 68,4 let, průměrná sledovací doba 57 měsíců. 55 % očí bylo odesláno v klinickém stadiu OCP 3, 27 % očí ve stadiu 4. Zachovat CZO se nám podařilo u 76 % očí, ke zlepšení došlo u 5 % očí, u 19 % očí jsme zaznamenali zhoršení. Aktivita onemocnění byla v době diagnózy přítomna u 96 % pacientů. Nejčastější komplikací při první návštěvě byl vřed či perforace rohovky. V kombinaci byly pacientům nejčastěji nasazeny kortikosteroidy u 47 pacientů, azathioprin u 28 pacientů, cyklofosfamid u 25 pacientů, MM u 16 pacientů, sulfasalazin u 5 pacientů a dapson též u 5 pacientů. Relaps onemocnění jsme zaznamenali u 40 % pacientů. U 7 očí (6,9 %) došlo k progresi do vyššího stadia onemocnění a 95 očí (93,1 %) zůstalo stabilních. Dlouhodobá stabilizace stavu byla dosažena při léčbě MM u 11 pacientů z 16 (69 %). U 5 pacientů nedošlo ke kontrole onemocnění a léčba proto byla změněna na jinou IS léčbu. Nežádoucí účinek MM (lymfopenie) byl přítomen u 1 pacienta. Mezi nejčastěji prodělané operace pacientů před příchodem na naší ambulanci patřila extrakce katarakty s implantací nitrooční čočky, kryoepilace řas či plastické operace víček hlavně entropia. U nás byla nejčastěji indikována transplantace amniové membrány do defektu a retropozice muskulokutánního listu. Pozitivní výsledek biopsie spojivky byl zjištěn u 48 % ze 42 odebraných vzorků a pozitivita anti-desmosomů u 22 % z 32 odběrů. U 31 % pacientů bylo OCP spojeno s jizevnatými procesy v těle.Závěr:
Diagnóza OCP je stanovena na základě anamnézy, klinického obrazu a podpořena pozitivním výsledkem biopsie spojivky a anti-desmosomů. Systémovou imunosupresivní terapií lze účinně tlumit aktivitu choroby a zabránit progresi onemocnění, nejlépe zahájenou v časných stadiích OCP.Klíčová slova:
oční jizevnatý pemfigoid, celková imunosupresivní léčba, přímá a nepřímá imunofluorescence, mykofenolát mofetilÚVOD
Oční jizevnatý pemfigoid (OCP) je vzácné jizevnaté onemocnění spojivky, které je pro svůj chronický a progresivní průběh zrak ohrožující (20). Je součástí heterogenní skupiny autoimunitních subepitelových puchýřnatých onemocnění (MMP) postihujících jakoukoliv sliznici včetně dutiny ústní, nosu, hrtanu, jícnu, průdušnice, rekta, penisu, dutiny poševní (21). V této skupině se vyskytuje OCP až v 75 %. Trpí-li pacienti pouze postižením kůže, je výskyt OCP nižší – 25 % (24). Na druhou stranu až 50 % pacientů s OCP má alespoň jedno mimooční postižení (36, 44). Pokud není zahájena léčba, může dojít až ke smrti pacienta (nejčastěji aspirace pro jícnové a tracheální striktury). Až 75 % pacientů je nutno léčit celkovou imunosupresivní (IS) léčbou (10).
Podle British Ophthalmological Surveillance Unit je incidence OCP 0,7 na 1 000 000 obyvatel s regionální variací 1,1 na 1 000 000 obyvatel v širším Londýně a 1,8 na 1 000 000 obyvatel ve West Midlands (6, 34). Incidence ve Francii a Německu byla zaznamenána 1,3 – 2,0 na 1 000 000 za rok (3, 4). Nebyla zaznamenána žádná rasová ani geografická predispozice (3, 42). Mortalita je uváděna 0,29 na 1 000 000 obyvatel dle studie provedené v USA v letech 1992–2002 (35).
Incidence je vyšší u žen než u mužů, a to v poměru 2–3 : 1 (14). Nejčastěji bývá OCP diagnostikováno po 70. roku života (24), podle Fostera je průměrný věk 65 let (14). Ve vzácných případech mohou být postiženy i děti (25).
Předpokládá se genetická predispozice v souvislosti s přítomností genu HLA – DQ7 (HLA-DQβ1*0301). Významně se uplatňují vnější vlivy (2).
Patofyziologie onemocnění není zcela jednoznačně objasněna. V literatuře se uvádí, že OCP je imunologická reakce (přecitlivělost) 2. typu charakterizovaná lineárními depozity imunoreaktantů (imunoglobulinů G, A, M a/nebo imonokomplementu C3) podél bazální membrány epitelu (43, 7). U některé podskupiny OCP může být detekována i autoprotilátka proti β4 integrinu (27).
Symptomy jsou nespecifické: dlouhodobě červené oko (oči), pálení, iritace, pocit cizího tělesa, slzení, světloplachost, suchost očí a zhoršení vízu (45). Potíže jsou vždy dlouhodobé, převážně oboustranné (s případnou asymetrií závažnosti), několik týdnů až let trvající a pomalu se zhoršující (29, 37). Výjimečně může být zpočátku OCP unilaterální, následně do 2 let dojde k postižení druhého oka (1).
OCP je klasifikováno dle Fostera do 4 stadií. První stadium je charakterizováno subepitelovou fibrózou a jizvením spojivky. Pátráme po ní na tarzální spojivce dolního a horního víčka (obr. 1). Ve druhém stadiu dochází ke změlčení fornixů (obr. 2). Ve třetím stadiu jsou přítomna symblefara (obr. 3, 4) a v posledním čtvrtém stadiu ankyloblefaron, dochází ke keratinizaci a vaskularizaci rohovky (obr. 5, 6). Starší klasifikace dle Mondiho hodnotí hloubku dolního fornixu, která se běžně pohybuje kolem 11 mm. Stadium I je změlčení fornixu o méně než 25 %, stadium II změlčení o 25–50 %, stadium III o 50–75 % a stadium IV o více než 75 % (30).
<b>Obr. 1-6</b> Stadia OCP (klasifikace dle Fostera) 
Diagnóza je stanovena na základě anamnézy a klinického obrazu, podpořena je pomocí přímé a nepřímé imunofluorescence. Při podezření na OCP by měla být provedena biopsie spojivky či bukální sliznice a odeslána na imunohistochemické vyšetření. Biopsii spojivky je nejlépe odebírat z temporálního horního kvadrantu bulbární spojivky, kde je nejmenší riziko jizvení a horní víčko urychlí hojení. Odebírá se vzorek 2–4 mm velký včetně bazální membrány (BM) spojivky. Naopak nikdy by neměla být biopsie prováděna z dolního fornixu pro nebezpečí urychlení jizvení spojivky (16). Grau doporučuje ve stejnou dobu odebrat i tkáň z bukální sliznice, a to ať už pacient má příznaky z jejího postižení či nikoliv. Pozitivní nález přímé imunofluorescence je zobrazen na obr. 7. Nepřímá imunofluorescence se provádí odběrem z periferní krve a sérum je vyšetřeno na cirkulující protilátky proti BM (anti-desmosomy) (37, 41).
Obr. 1. Přímá imunofluorescence 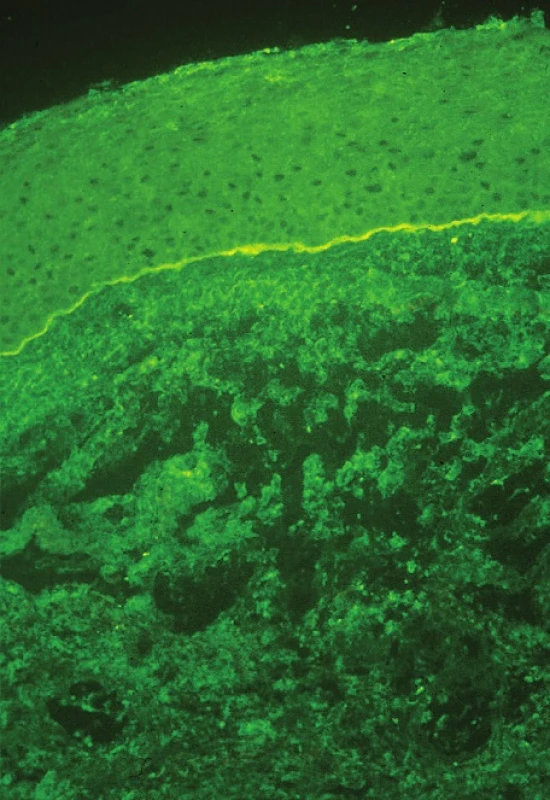
OCP léčíme IS léčbou (5, 14, 21, 22, 36, 38). Její výběr závisí na aktivitě a pokročilosti choroby, celkovém stavu pacienta, účinnosti dosavadní léčby a výskytu nežádoucích účinků léčby. Léčba je vedena přísně individuálně a je úspěšnější, je-li nasazena v časných stadiích onemocnění (39).
Komplikace OCP můžeme rozdělit na komplikace oční a komplikace celkové IS léčby. Mezi časté oční komplikace patří syndrom suchého oka, filamentózní keratitida, deficience limbálních buněk, nehojící se defekt epitelu rohovky, panus, buly na rohovce, vředy rohovky, lýza rohovky, perforace rohovky, keratinizace rohovky, endoftalmitida, trichiáza, entropium, lagoftalmus (37).
Mezi závažné komplikace celkové léčby řadíme leukopenii, lymfopenii, anémii, trombocytopenii, alopecii, hematurii, hepatotoxicitu, nefrotoxicitu, neuropatii, Cushingův syndrom, osteoporózu, průjem, oportunní infekci, smrt pacienta.
METODIKA
Retrospektivně jsme hodnotili pacienty z Centra pro onemocnění rohovky a spojivky Oční kliniky 1. LF UK a VFN v Praze.
Náš soubor tvořilo 51 pacientů, 21 mužů a 30 žen, u kterých byl diagnostikován OCP v období 1992–2013. Průměrná sledovací doba byla 57 měsíců (rozmezí 1–248 měsíců).
V souboru jsme hodnotili věk při stanovení diagnózy, počáteční centrální zrakovou ostrost (CZO) a konečnou CZO, pozitivitu přímé a nepřímé imunofluorescence, stadium OCP na začátku onemocnění a na konci sledování, aktivitu onemocnění při příchodu, aktivitu onemocnění a počet relapsů během léčby i po případném vysazení terapie.
Dále jsme se zaměřili na typ celkové IS léčby, kterou pacienti užívali, a její eventuální komplikace. Zvlášť jsme hodnotili účinnost a nežádoucí účinky (NÚ) terapie mykofenolát mofetilem (MM).
V souboru jsme současně sledovali oční komplikace, s jakými pacienti do naší ordinace přicházeli a které se vyskytly během sledovací doby. Zaznamenali jsme i operace, které pacienti před příchodem na kliniku podstoupili, a operace, které jsme jim indikovali my.
Zároveň jsme zjišťovali, zdali pacienti trpěli i systémovým bulózním onemocněním (MMP).
Diagnóza byla u pacientů stanovena na základě anamnézy a klinického vyšetření na štěrbinové lampě. Aktivitu onemocnění jsme hodnotili makroskopicky za denního světla ve všech kvadrantech spojivky. Pro potvrzení diagnózy byla u pacientů provedena biopsie spojivky k přímé imunofluorescenci a odběr krve odeslán na imunohistochemické vyšetření (anti-desmosomy, nepřímá imunofluorescence). CZO jsme vyšetřovali na Snellenových optotypech. Nitrooční tlak (NOT) jsme měřili aplanačně. Fotodokumentaci jsme prováděli na štěrbinové lampě.
VÝSLEDKY
V našem souboru 51 pacientů bylo celkem 21 mužů (41 %) a 30 žen (59 %). Věk pacientů v době stanovení diagnózy se pohyboval mezi 29–91 lety, průměrně 68,4 let, medián při stanovení diagnózy byl 71 let. Pacienty jsme rozdělili do 8 věkových skupin (graf 1).
Graf 1. Věk pacientů při stanovení diagnózy 
Z grafu je patrné, že nejvyšší incidence výskytu OCP byla ve věku 70–79 let, celkem 20 pacientů. Sedm pacientů (14 %) během sledování zemřelo.
Nejlepší CZO při prvním vyšetření byla 6/6 a nejhorší světlocit, nejistá světelná projekce. U našich pacientů jsme hodnotili stabilizaci CZO nebo její zlepšení či zhoršení (změna o 2 a více řádků na Snellenových optotypech). Každé oko jsme zaznamenali zvlášť. Zachovat CZO se podařilo u 76 % očí, ke zlepšení došlo u 5 % očí. U 19 % očí jsme zaznamenali zhoršení CZO (graf 2).
Graf 2. Změna CZO během sledování 
Z celkového počtu 51 pacientů byla biopsie spojivky provedena u 42, z toho jsme zaznamenali pozitivitu u 20 pacientů (48 %). Vyšetření na anti-desmosomy bylo provedeno celkem u 32 pacientů, z toho pozitivní výsledek byl u 7 z nich (22 %). Pozitivitu obou vyšetření jsme evidovali u 3 pacientů z 28 (11 %), alespoň jedno pozitivní vyšetření mělo 24 pacientů ze 46 (52 %). Naopak obě negativní vyšetření byla nalezena u 12 pacientů (43 %) z 28, u kterých byla provedena (tab. 1–3).
Tab. 1. -3 Výsledky diagnostických vyšetření 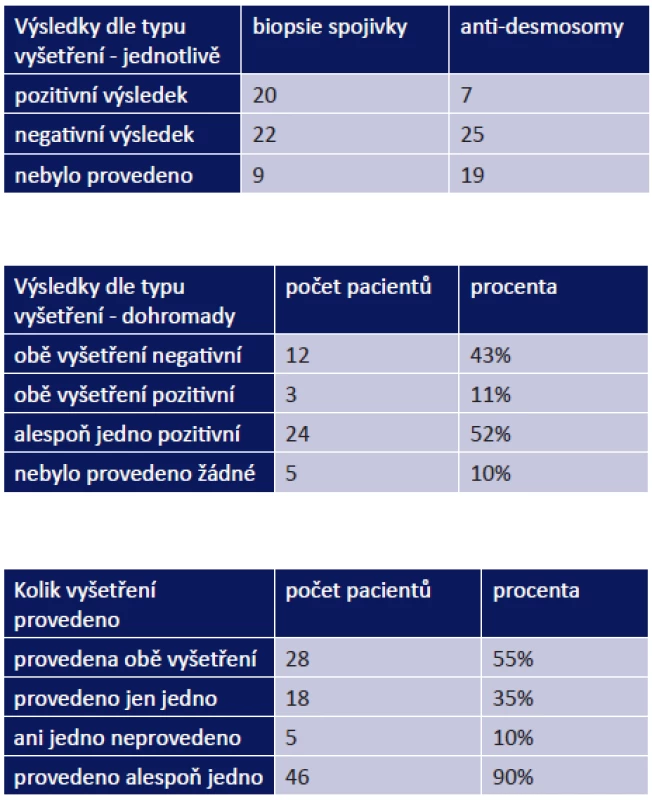
Ani jedno vyšetření nebylo provedeno u 5 pacientů (10 %). Důvodem byl již pokročilý nález onemocnění: 71letá pacientka přijata s komplikací OCP (vřed rohovky), stadium OCP IV na obou očích (OPL), 72letá pacientka s lýzou rohovky a celkovým MMP měla stadium IV na pravém oku (OP) a III na levém oku (OL) při prvním vyšetření, 74letá pacientka se stadiem IV na OP a III na OL, 75letá pacientka se stadiem III na OPL přijata s perforací rohovky, 75letý pacient se stadiem III na OPL bez komplikací sledovaný 131 měsíců.
Všichni pacienti v souboru měli oboustranné postižení. 56 očí (55 %) bylo na naší ambulanci odesláno ve stadiu OCP III, 28 očí (27 %) ve stadiu IV. Pouze 18 očí (18 %) bylo ve stadiu I či II (tab. 4).
Tab. 2. Stadia OCP na počátku a na konci sledování 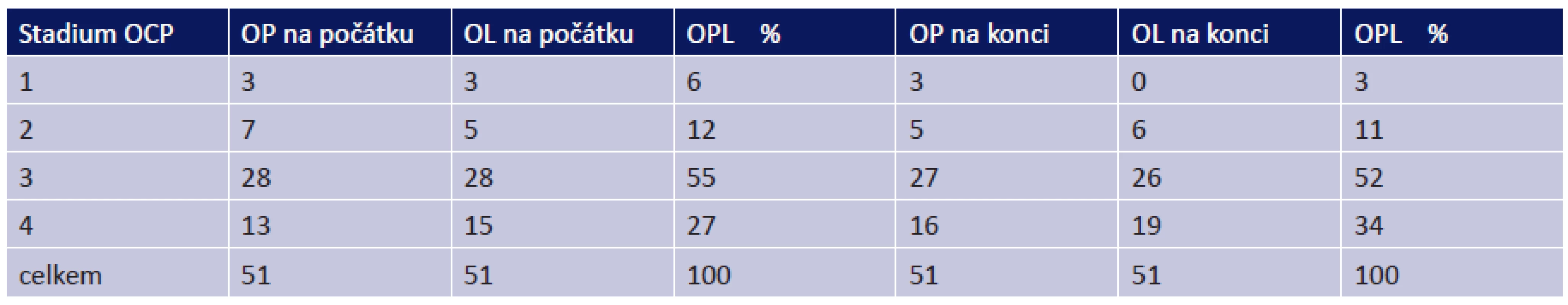
Během sledování došlo k progresi ze stadia I u 3 očí, ze stadia II u 1 oka a ze stadia III u 3 očí. Celkově tedy u 7 očí (6,9 %) došlo k progresi do vyššího stadia onemocnění a 95 očí (93,1 %) zůstalo stabilních.
Aktivita onemocnění na počátku sledování byla diagnostikována celkem u 49 z 51 pacientů (96 %) viz graf 3. Jednasedmdesátiletá pacientka byla v remisi, ale měla již pokročilé stadium OCP na OPL (stadium III), 81letý pacient měl v době příchodu na ambulanci aktivní ulcerace na epiglottis, stadium IV na OL, ale klidný nález na spojivkách.
Graf 3. Aktivita na počátku sledování 
Během sledování jsme zaznamenali relaps onemocnění (aktivitu) u 19 pacientů ze 48 (40 %) viz graf 4. Celkem tři pacientky jsme nehodnotili pro krátkou dobu sledování: 89letá pacientka přijata s lýzou rohovky a stadiem OCP IV na OPL a celkovým MMP sledována dva měsíce, poté zemřela, 86letá pacientka se stadiem III na OPL sledována zatím pouze dva měsíce, 72letá pacientka s celkovým MMP a stadiem OP IV a OL III sledována pouze měsíc.
Medián relapsu byl 2.
IS léčbu jsme vysadili u 16 pacientů, u 4 z nich (25 %) došlo po jejím vysazení k relapsu (graf 5).
Graf 5. Aktivita po vysazení IS 
IS léčba byla nasazena u 50 našich pacientů. Jeden pacient byl léčen pouze lokálně kortikosteroidními preparáty pro klidný nález bez progrese. V kombinaci byly nejčastěji nasazeny kortikosteroidy (KS) u 47 pacientů, azathioprin (AZA) u 28 pacientů, cyklofosfamid (CF) u 25 pacientů, MM u 16 pacientů, sulfasalazin u 5 pacientů a dapson též u 5 pacientů. Procentuální zastoupení jednotlivých IS léků je patrné z grafu 6. V průměru pacienti užívali či během léčby vystřídali 2,5 IS léku.
Graf 6. Rozložení pacientů dle imunosupresivní léčby 
Komplikace IS léčby jsme zaznamenali u 24 pacientů (48 %). Tři pacienti trpěli komplikacemi u více než jednoho IS preparátu.
Nejvíce nežádoucích účinků měli pacienti po nasazení CF. Vyskytly se celkem u 14 z 25 pacientů, kterým byl nasazen (56 %). Nejčastějším nežádoucím účinek byl útlum kostní dřeně – lymfopenie, leukopenie, trombocytopenie – tab. 5. Nejzávažnějším NÚ byla smrt 76letého pacienta ve stadiu OCP IV na oportunní infekci Pneumocystis carinii, pacient zároveň trpěl na jícnové spazmy a puchýře na hypofaryngu.
NÚ KS jsme zjistili u 5 z 50 pacientů (10 %). 1 pacient měl lymfopenii, 2 Cushingův syndrom, 1 osteoporózu a 1 oportunní infekci (tab. 6).
U pacientů užívajících AZA jsme zachytili u 2 pacientů lymfopenii, u 1 průjmy, u 1 elevaci jaterních testů a u 1 anémii. Čtyřiaosmdesátiletá pacientka s OCP stadium IV na OPL dva měsíce po nasazení AZA zemřela. Příčina úmrtí nebyla jednoznačně určena. Celkem byl AZA indikován u 28 pacientů a NÚ byly dokumentovány u 7 z nich (25 %), tab. 7.
NÚ MM byly pouze u 1 pacienta ze 16 (lymfopenie), tab. 8.
Tab. 3. –8 Nežádoucí účinky imunosupresivních léků 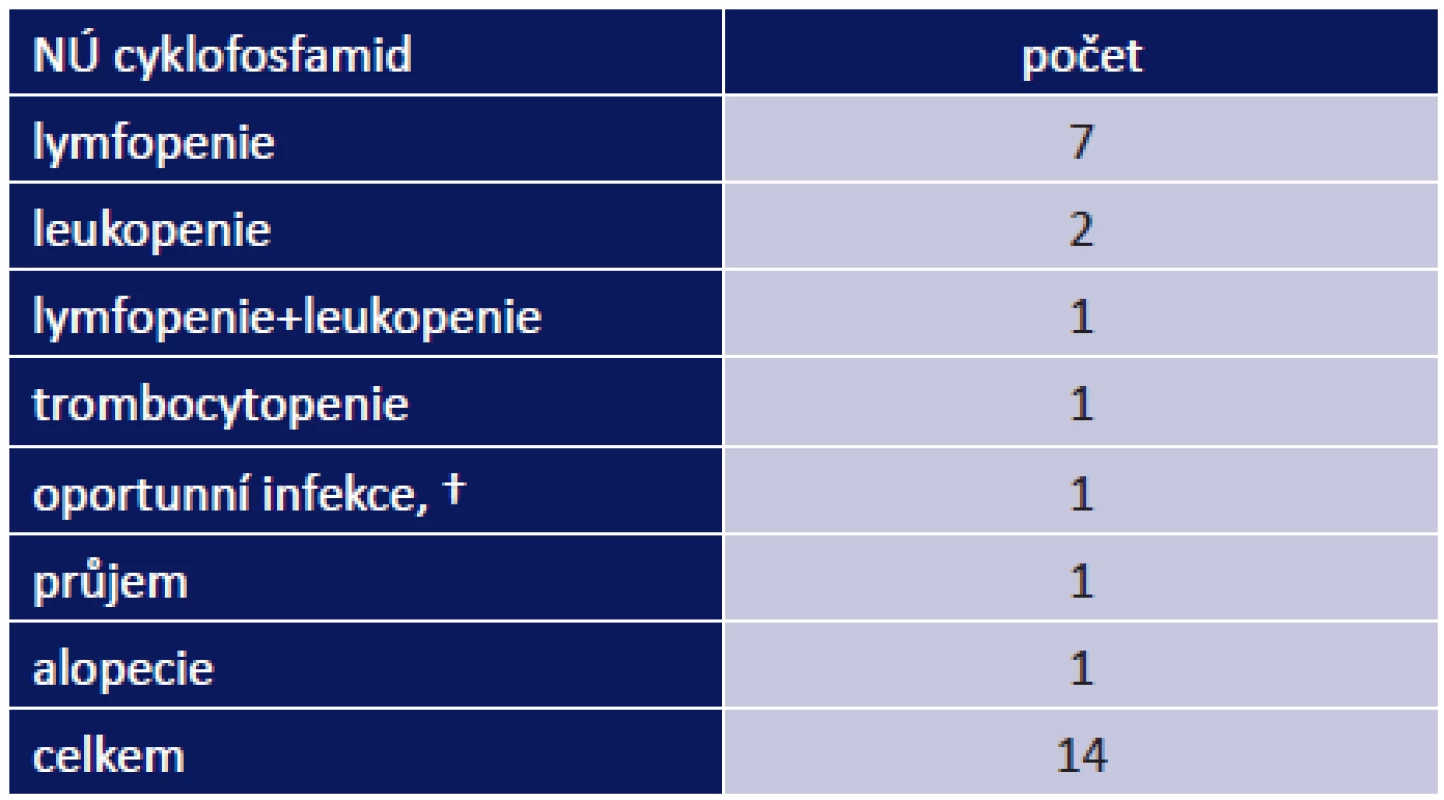
Léčba pomocí MM byla zahájena u 16 pacientů, poprvé v 5/2007, a to u 10 žen a 6 mužů. Průměrný věk těchto pacientů v době diagnózy byl 73,4 ± 12,2 let ve stadium OCP II-IV. 8 pacientů trpělo zároveň MMP – 2 pacienti měli postižení kůže, 2 sliznice úst, 1 epiglotis, 2 postižení hltanu a 1 vícečetné postižení sliznic. Průměrná doba sledování byla 64 měsíců, průměrné trvání terapie 25 měsíců. U 7 pacientů byla léčba MM lékem první volby, u 8 pacientů byla nasazena pro závažné NÚ dosavadní léčby a u 1 pacienta pro selhání účinnosti dosavadní léčby.
U 11 pacientů (69 %) byla zajištěna dlouhodobá stabilizace a kontrola aktivity onemocnění. Dva pacienti byli trvale v remisi a léčbu MM jsme vysadili po 8 a 15 měsících, 4 pacienti zůstali bez aktivity onemocnění, ale léčba MM pokračuje, 5 pacientů mělo epizody aktivity při snižování dávky. U 5 pacientů (31 %) nedošlo ke kontrole onemocnění a léčba proto byla změněna na CF nebo AZA.
Oční komplikace jsme rozdělili na komplikace při příchodu do naší ambulance a komplikace, které se vyskytly během léčby. Oční komplikace při prvním vyšetření byly přítomny u 24 pacientů (47 %). Zaznamenali jsme u nich celkem 34 očních komplikací. Mezi nejzávažnější patřil vřed rohovky/lýza celkem u 6 pacientů, perforace rohovky u 2 pacientů a endoftalmitida u 1 pacienta. Mezi méně závažné patřil panus u 2 pacientů a buly na rohovce u 1 pacienta (tab. 9). Nejčastěji se vyskytla trichiáza, a to u 14 pacientů (27 %).
Tab. 4. Oční komplikace při prvním vyšetření 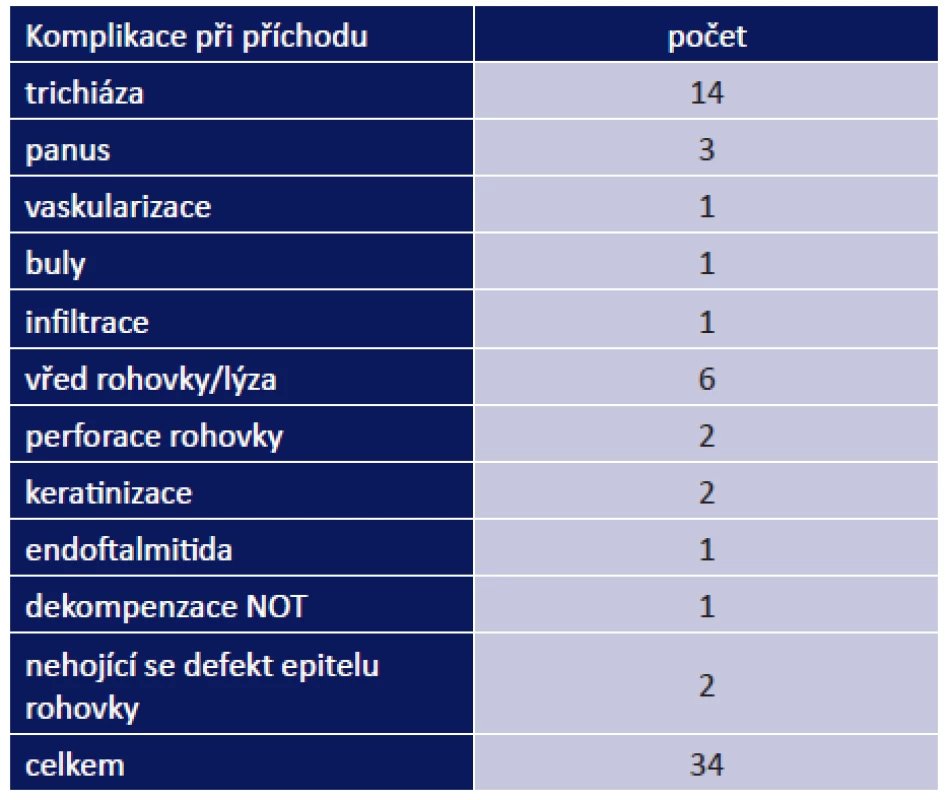
Během léčby jsme řešili 37 komplikací celkem u 27 pacientů (53 %): vřed na rohovce/lýza u 7 pacientů, perforace rohovky u 5 pacientů, nehojící se defekt rohovky u 2 pacientů. Do méně závažných komplikací jsme zařadili infiltrace na rohovce u 2 pacientů, dekompenzace NOT u 2 pacientů a keratinizace u 1 pacienta. Nejčastěji jsme řešili trichiázu, a to u 18 pacientů (tab. 10).
Tab. 5. Oční komplikace během léčby 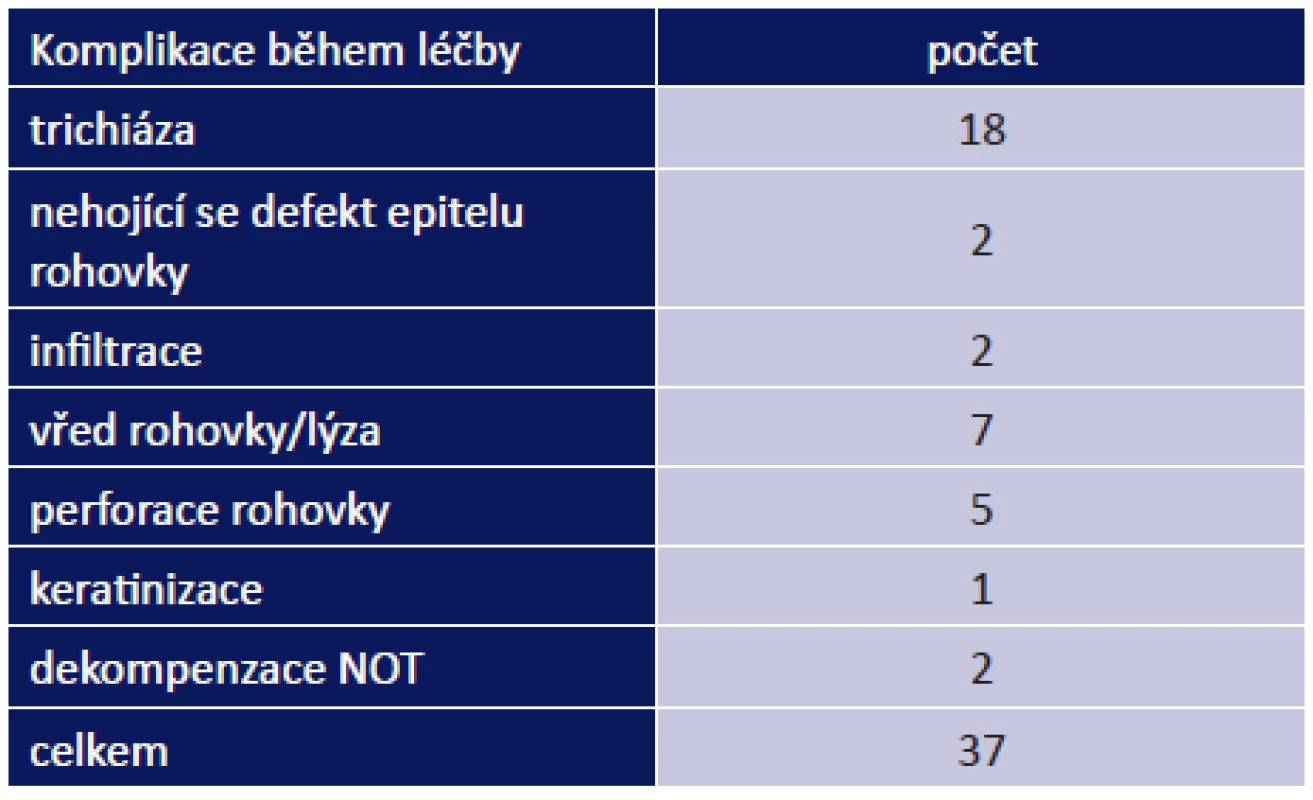
Dvacet šest pacientů (51 %) před příchodem na naší ambulanci podstoupilo celkem 48 očních operací: operace katarakty – 17x, kryoepilace či elektroepilace řas – 9x, operace spojivky – 4x, operace entropia či ektropia – 4x. Během našeho sledování jsme indikovali celkem 88 operací u 30 pacientů (59 %): transplantaci amniové membrány 17x, perforující keratoplastiku (PKP) 10x, retropozici muskulokutánního listu (MKL) 21x, kryoepilaci či elektroepilaci řas 14x, plastiku horních víček (HV) či tarzorafii 6x – viz graf 7.
Graf 7. Prodělané oční operace 
PPV (pars plana vitrektomie), HV (horní víčko), TE (trabekulektomie), SLT (selektivní laserová trabekuloplastika), CFK (cyklofotokoagulace), PKP (perforující keratoplastika), MLK (muskulokutánní list) Celkem 16 pacientů (31 %) trpělo i bulózním systémovým onemocněním. Pět pacientů mělo pouze kožní postižení do doby diagnózy OCP, 10 pacientů MMP (tedy i jiné postižení sliznic) a jedna pacientka paraneoplastický syndrom.
DISKUSE
OCP je oboustranné autoimunitní zrak ohrožující onemocnění charakterizované progresivním jizvením spojivky, spojené s mnoha očními komplikacemi. Neléčené může vést ke slepotě a někdy i smrti pacienta. Náš soubor tvoří 51 pacientů, u kterých jsme v letech 1992–2013 diagnostikovali OCP. Výsledky našeho sledování můžeme v některých parametrech porovnat se zahraničními studiemi.
Největší studie byla publikována Sawem a kol. (Moorfields Eye Hospital) v roce 2008 a čítá 115 pacientů za 11 let (36). Elder a kol. (Moorfields Eye Hospital, UK) publikovali v roce 1996 studii 66 pacientů za 3 roky sledování (10), Thorne a kol. (Wilmer Eye institute, USA) 94 pacientů za 22 let (40), Brunner a kol. (OMMA Eye Center, Švýcarsko) 18 pacientů za 17 let (5), Doycheva a kol. (University of Tuebingen, Německo) publikovali data 10 pacientů za 4 roky sledování (9), Nottage a kol. (Wills Eye Institute, USA) sledovali 23 pacientů za 6 let (31).
Průměrný věk pacientů v době diagnózy se pohybuje kolem 65 let – Saw 66,9 (36), Elder 67 let (10), Doycheva 70 let a medián 75 let (9), Brunner 64 let (5), Thorne 69 let (40). V našem souboru byl průměrný věk pacientů 68,4 let, medián 71 let, což se shoduje s ostatními publikacemi.
Poměr ženy:muži se v různých studiích liší pouze nepatrně. 1,25 : 1 (36, 5), 1 : 1 (9), 1,3 : 1 (10), 1,1 : 1 (40). V našem souboru byl poměr 1,4 : 1.
Hodnocení CZO probíhalo v různých studiích odlišně, Thorne a kol. uvádějí pouze průměrnou počáteční CZO u všech postižených očí (20/30) a prevalenci CZO horší než 20/200 u 16,6 % očí (40), Elder a kol. zaznamenali CZO pouze na počátku onemocnění (10), Brunner a kol. CZO neuvádějí (5). Saw a kol. rozdělili CZO do 4 kategorií. V kategorii CZO lepší než 6/18 bylo v době diagnózy 67 % očí, na konci sledování 48 % očí, v kategorii CZO horší než 3/60 bylo v počátku sledování 11 % očí a na konci sledování 26 % očí (36). Doycheva a kol. porovnali stejně jako naše studie změnu CZO, zlepšení vidění uvádějí u 11 % očí, stabilizace u 47 % očí a zhoršení u 42 % očí. Změnu hodnotili jako zlepšení či zhoršení o 3 a více řádků Snellenových optotypů. V našem souboru se nám podařilo dokonce zachovat CZO u 76 % očí, ke zlepšení došlo u 5 % očí a pouze u 19 % očí jsme zaznamenali zhoršení CZO (změna o 2 a více řádků na Snellenových optotypech). Při příchodu byla CZO 6/60 a horší u 30 % očí, na konci sledování u 38 % očí. Důvodem ke zhoršení CZO i přes IS léčbu je skutečnost, že je OCP diagnostikován až v pokročilých stadiích, u kterých jsou přítomny závažné oční komplikace. Nejčastější příčinou zhoršení vidění je vznik rohovkové vaskularizace, vředu rohovky/lýzy, perforace rohovky a keratinizace rohovky. Pro hodnocení účinnosti léčby ale není CZO směrodatná, významnější je remise očního nálezu a předcházení relapsům.
Téměř ve všech studiích se uvádí pozitivita přímé imunofluorescence (DIF). Saw a kol. uskutečnili biopsii u 62 ze 115 pacientů. Čtyřicet devět z nich podstoupilo biopsii spojivky (pozitivní u 61 %) a zbývajících 14 pacientů potom biopsii bukální sliznice (pozitivní u 78,6 %) (36). Thorne a kol. zařadili do své studie pouze pacienty, kteří měli pozitivní DIF (40). Ve studii Eldera a kol. (10) mělo provedeno biopsii spojivky 86 % pacientů, pozitivní nález byl u 54 % z nich. Brunner uvádí procento pozitivity biopsie spojivky ještě vyšší – 72,7 % a byla provedena u 61,1 % pacientů (5). Nottage a kol. naopak udávají procento nižší – 47,8 % (31), což se shoduje s našimi výsledky. My jsme zaznamenali pozitivitu u 20 pacientů (48 %) ze 46. U žádného z našich pacientů nebyla provedena biopsie bukální sliznice a ani jsme neprováděli opakované biopsie spojivky. Dle Grau a kol. (16) je důvodem pro nižší procento pozitivity DIF spojivky než bukální sliznice či jiné mukózní sliznice fakt, že je spojivka křehčí oproti jiným sliznicím. Doporučují proto vždy provádět odběr ze spojivky a zároveň bukální sliznice, a to i v případě, že ta není postižena.
Stadium onemocnění bylo hodnoceno v některých studiích dle Fostera, v jiných dle Mondino. Vzhledem k tomu, že jsme posuzovali stupeň postižení dle Fostera, uvádíme pouze studie, které použili stejné hodnocení. Ve studii Doycheva a kol. registrovali 63 % očí ve stadiu III, 11 % očí ve stadiu IV. Progresi jizvení popsali u 47 % očí, ale progrese do vyššího stadia OCP byla pouze u 11 % očí (9). Saw a kol. měli ve studii 81 % očí ve stadiu III, 2 % ve stadiu IV. Progrese do vyššího stadia proběhla u 8 % pacientů (36), progrese jizvení u 53 % pacientů. Thorne a kol. uvádějí, že 74,5 % očí bylo ve stadiu III (40). Elder a kol. (10) zaznamenali 61 % očí ve stadiu III a 14 % očí ve stadiu IV. K progresi jizvení došlo u 35 % očí, k progresi do vyššího stadia OCP u 4 % očí. Brunner a kol. (5) diagnostikovali stadium III u 58 % očí, stadium IV u 0 %. K progresi jizvení došlo u 33 % očí, neuvádějí progresi do vyššího stadia OCP. V našem souboru bylo 55 % očí odesláno ve stadiu III, 27 % ve stadiu IV, což je vyšší incidence stadia IV než ve srovnávaných studiích. Během sledování jsme evidovali progresi do vyššího stadia OCP celkem u 7 % očí, to lze vzhledem k ostatním studiím označit za uspokojivý výsledek. Progresi jizvení jsme nehodnotili.
Aktivitu onemocnění na počátku sledování hodnotili Thorne a kol. (40), a to na základě spojivkového nálezu (zarudnutí spojivky). Evidovali 66% pozitivitu. Relaps onemocnění během sledování byl u 8,5 % pacientů (8/96). V našem souboru byla aktivita hodnocena stejně a byla přítomna na počátku celkem u 96 % pacientů. Během sledování jsme zaznamenali relaps onemocnění (aktivitu) u 40 % pacientů (19/48). Saw a kol. (36) publikovali relaps u 20 % pacientů. Ostatní publikace hodnotili spíše počet měsíců do dosažení remise onemocnění. Medián relapsu byl 2. Průměrnou hodnotu jsme zde nehodnotili, neboť u jednoho pacienta došlo k 20 relapsům a výsledek by to zkreslovalo. Po vysazení celkové IS léčby u 16 pacientů jsme u 25 % (4 pacienti) z nich evidovali opět aktivitu onemocnění (relaps). Toto v ostatních studiích nebylo hodnoceno.
Základem léčby OCP je IS léčba. Ta byla nasazena u 74 % pacientů ve studii Eldera a kol. (10). Sulfapyridin užívalo 33 % pacientů, 30 % KS, 17 % CF, dapson 15 %, 12 % sulfamethoxypyridazin a 5 % AZA. Studie byla provedena v roce 1996, proto nezahrnovala žádného pacienta léčeného MM. V roce 2006 byla publikována studie Saw a kol. (36) ze stejného pracoviště a zde již léčili MM 12 % všech epizod, nejčastěji ale stále nasazovali dapson a to ve 30 %, AZA ve 21 %, CF u 19 % a sulfapyridin u 14 % epizod. Nejvíce účinný byl CF a MM, naopak nejméně AZA a sulfapyridin. IS léčba byla použita celkem u 75 % pacientů. Na naší klinice byla celková léčba nasazena u 98 % pacientů. Monoterapií bylo léčeno celkem 29 epizod. Většině pacientů byla během sledování nasazena kombinovaná IS léčba, jednak pro nedostatečnou účinnost monoterapie, relaps onemocnění nebo pro nežádoucí účinky léčby. KS užívalo 47 pacientů, více jak polovina AZA (28 pacientů) a CF (25 pacientů), MM užívalo 16 pacientů, sulfasalazin 5 pacientů a dapson též 5 pacientů. Na jednoho pacienta tedy připadá v průměru 2,5 IS léku.
Účinnost léčby byla hodnocena v našem souboru pacientů užívajících MM. Nejnovější studie dokazují, že je tato IS léčba velice účinná. Na rozdíl od CF vykazuje mnohem méně NÚ (36, 38, 9). MM bylo léčeno celkem 16 pacientů, 8 z nich trpělo zároveň MMP. Průměrná doba sledování byla 64 měsíců, trvání terapie 25 měsíců. U 7 pacientů byla léčba MM lékem první volby, u 8 pacientů byla nasazena pro závažné NÚ dosavadní léčby a u 1 pacienta nasazena pro selhání účinnosti dosavadní léčby. U 11 pacientů (69 %) se podařilo dlouhodobě kontrolovat aktivitu onemocnění. Dva pacienti (12,5 %) byli trvale v remisi a léčbu MM jsme vysadili, 4 pacienti (33 %) zůstali bez aktivity onemocnění, ale léčba MM pokračuje, 5 pacientů (31 %) mělo epizody aktivity při snižování dávky. Doycheva a kol. (9) dosáhli kompletní remisi u 58 % pacientů užívajících MM, Saw a kol. u 59 % (36) pacientů, Nottage u 82 % (31). Naše výsledky jsou v kontrole aktivity OCP velmi povzbudivé. U 5 pacientů užívajících MM (31 %) nedošlo ke kontrole onemocnění a léčba proto byla změněna na CF a AZA, což je v porovnání s výše uvedenými studiemi procento výrazně nižší.
Nežádoucí účinek léčby jsme zjistili pouze u 1 pacientky (6 %), a to lymfopenii. Obecně vykazuje MM velmi nízké riziko NÚ. Ve studii Saw a kol. uvedli 15 % (36), Nottage 21 % (31). Doycheva a kol. (9) zaznamenali NÚ u 7 z 10 pacientů, léčba MM ale byla přerušena pouze u 1 pacienta (10 %).
Komplikace celkové léčby CF hodnotili Saw a kol., zaregistrovali je až v 31 % (36). Nejobávanější NÚ CF (tumor močového měchýře) objevili Thorne a kol. (40) u 1 pacienta, u dalších 7 potom evidovali jiné malignity (bazocelulární karcinom, skvamózní karcinom, leukémie, tumor prsu). Léčili celkem 70 pacientů CF a setkali se i s infekcí Pneumocystis carinii. Ostatní studie NÚ nehodnotili. V našem souboru jsme řešili komplikace IS léčby u 24 pacientů z 50 (48 %). Tři pacienti trpěli NÚ u více než jednoho IS preparátu. I my jsme evidovali nejvíce NÚ u CF (14 z 25 pacientů – 56 %), nejčastěji útlum kostní dřeně, 1 pacient dokonce na oportunní infekci Pneumocystis carinii zemřel. NÚ KS se vyskytly u 10 % pacientů a o něco více u AZA 25 %. Naše závěry se tedy shodují se studiemi uvedenými výše, nejméně NÚ je při užívání MM, nejvíce pak u CF.
Nejvážnější oční komplikace byly uvedeny v obou studiích Eldera (12, 10), setkali se s 2 perforacemi rohovky z 10 pacientů, kteří nereagovali na předchozí IS léčbu a byli proto léčeni vysokými dávkami KS a CF. Ve druhé studii, do které byli zařazeni všichni pacienti, zaznamenali perforaci jen u jednoho z 66 (1,5 %). I my jsme se setkali s perforacemi rohovky (dohromady u 7 pacientů – 14 %), u 2 z nich na počátku sledování, u 5 během léčby. Rohovkové ulcerace evidovali Doycheva a kol. (9) u 20 % pacientů, v našem souboru u 12 %. Nehojící se defekt epitelu uvádí Elder a kol. (10) u 18 % pacientů během léčby, my jsme ho řešili u 4 % pacientů. Mezi méně závažné oční komplikace můžeme zařadit trichiázu. Thorne a kol. (40) ji zaznamenali při prvním vyšetření až u 38,5 % očí a jizvení rohovky u 13,4 %, což je srovnatelné s naším souborem, kde trichiázou při příchodu na kliniku trpělo 27 % pacientů. V další studii (9) byla dokonce trichiáza přítomna u 50 % pacientů.
V souboru Doycheva a kol. (9) uvedli, že celkem 53 % pacientů před příchodem na jejich kliniku prodělalo oční operaci, což se shoduje s našimi záznamy – 51 % pacientů. Během léčby poté indikovali operaci u 58 % pacientů, my téměř rovnocenně u 59 % pacientů. Naše výsledky se ale liší v druhu operací, které byly provedeny. Doycheva a kol. nejčastěji indikovali filtrující operaci pro dekompenzovaný glaukomu, rekonstrukce fornixu a víčkové operace. My jsme naopak indikovali transplantaci amniové membrány (17x) či PKP (10x), retropozici MKL (21x), kryoepilaci či elektroepilaci řas (14x) a plastiku HV či tarzorafii (6x). Dohromady tak našich 51 pacientů podstoupilo 88 výkonů.
Přítomnost MMP byla evidována v mnoha studiích a pohybuje se od 44,4 % (5), 50 % (10, 36), až k 70 % (12). U našeho souboru pacientů byl MMP diagnostikován pouze u 31 % pacientů: 62 % z nich mělo i jiné postižení sliznic, 31 % oční a kožní postižení a 6 % potom paraneoplastický syndrom.
ZÁVĚR
Oční jizevnatý pemfigoid je vzácné, chronické a závažné onemocnění, jehož diagnóza je stanovena na základě anamnézy, klinického obrazu a podpořena pozitivním výsledkem biopsie spojivky a/nebo anti-desmosomů. Systémovou imunosupresivní terapií lze účinně tlumit aktivitu choroby a zabránit progresi onemocnění, nejlépe zahájenou v časných stadiích OCP. Někdy ale i přes agresivní IS léčbu dochází k progresi jizvení a očním komplikacím, které mohou vést až ke slepotě pacienta.
Poděkování:
Za věcné připomínky a korekturu velice děkuji as. MUDr. Michaele Brichové, prim. MUDr. Pavlu Diblíkovi, MBA a doc. MUDr. Jarmile Heissigerové, Ph.D.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou.
MUDr. Eva Szabó
Oční klinika, 1. lékařská fakulta,
Univerzita Karlova v Praze a VFN
U Nemocnice 2
128 00 Praha 2
e-mail: Eva.Szabo@seznam.cz
Do redakce došlo dne 23. 12. 2015
Do tisku přijato dne 22. 1. 2016
Zdroje
1. Ahmee M, Zein G, Khawaja F. et al.: Ocular cicatricial pemphigoid: pathogenesis, diagnosis and treatment. Prog Retin Eye Res 2004; 23 : 579–92.
2. Ahmend AR, Foster SC, Zaltas MM.: Association of DQw7 (HLA-DQβ1*0301) with ocular cicatricial pemphigoid, Proc Natl Acad Sci U S A 1991; 88 : 11579–82.
3. Bernard P, Vaillant L, Labeille B, et al.: Incidence and distribution of subepidermal autoimmune bullous skin diseases in three French regions. Bullous Disease French Study group. Arch Dermatol 1995; 131; 48–52.
4. Bertram F, Brocker EB, Zillikens D, et al.: Prospective analysis of the incidence of autoimmune bullous disorders in Lower Franconia, Gemany. J Dtsch Dermatol Ges, 2009; 7 : 434–40.
5. Brunner M, Lacoste KJ, Bernauer W.: Control of ocular disease in mucous membrane pemphigoid. Klin Monbl Augenheilkd, 2014 Apr; 231(4): 331–4.
6. Canizares MJ, Smith DI, Conners MS at al.: Successful treatment of mucous membrane pemphigoid with etanercept in 3 patients. Arch Dermatol, 2006 Nov; 142(11): 1457–61.
7. DaCosta J.: Ocular cicatricial pemphigoid masquerading as chronic conjunctivitis: a case report. Clin Ophthalmol, 2012; 6 : 2093–5.
8. Daniel E, Thorne JE, Newcomb CW et al.: Mycophenolate mofetil for ocular inflammation. Am J Ophthalmol, 2010 Mar; 149(3): 423–32.e1–2.
9. Doycheva D, Deuter C, Blumenstock G, at al.: Long-term results of therapy with mycophenolate mofetil in ocular mucous membrane pemphigoid. Ocul Immunol Inflamm, 2011 Dec; 19(6): 431–8.
10. Elder MJ, Bernauer W, Leonard J, Dart JK.: Progression of disease in ocular pemphigoid. Br J Ophthalmol, 1996; 80 : 292–6.
11. Elder MJ, Dart JK, Collin R.: Inferior retractor plication surgery for lower lid entropion with trichiasis in ocular cicatricial pemphigoid. Br J Ophthalmol, 1995 Nov; 79(11): 1003–6.
12. Elder MJ, Lightman S, Dart JK., Role of cyclophosphamide and high dose steroid in ocular cicatricial pemphigoid. Br J Ophthalmol, 1995 Mar; 79(3): 264–6.
13. Foster CD.: Cicatricial pemphigoid. In: Cornea: Fundamentals, Diagnosis, and Management., ed 3 In“ Krachmer JH, Mannis MJ, Holland EJ, edsVol. 1. Philadelphia, Mosby Elsevier, 2011; p. 591–9.
14. Foster CS, Chang PY, Ahmed AR: Combination of rituximab and intravenous immunoglobulin for recalcitrant ocular cicatricial pemphigoid: a preliminary report. Ophthalmology, 2010 May; 117(5): 861–9.
15. Gangaputra S, Newcomb CW, Liesegang TL et al.: Methotrexate for ocular inflammatory diseases. Ophthalmology, 2009 Nov;116(11): 2188–98.e1.
16. Grau AE1, Setterfield J, Saw VP.: How to do conjunctival and buccal biopsies to investigate cicatrising conjunctivitis: improving the diagnosis of ocular mucous membrane pemphigoid. Br J Ophthalmol, 2013 Apr; 97(4): 530–1.
17. Heffernan MP, Bentley DD.: Successful treatment of mucous membrane pemphigoid with infliximab. Arch Dermatol, 2006 Oct; 142(10): 1268–70.
18. Hervás Ontiveros, Salom, España Gregori.: Methotrexate as a treatment in ocular cicatricial moderate pemphigoid. Arch Soc Esp Oftalmol, 2013 Dec 18. pii: S0365–6691(13): 00376–6.
19. Hollick EJ1, Watson SL, Dart JK et al.: Legeais BioKpro III keratoprosthesis implantation: long term results in seven patients. Br J Ophthalmol,2006 Sep; 90(9): 1146–51.
20. Chan LS, Ahmed AR, Anhalt GJ, et al.: The first international consensus on mucous membrane pemphigoid: definition, diagnostic criteria, pathogenic factors, medical treatment and prognostic indicators. Arch Dermatol, 2002; 138 : 370–9.
21. Chan LS.: Ocular and oral mucous membrane pemphigoid (cicatricial pemphigoid). Clin Dermatol, 2012 Jan-Feb; 30(1): 34–7.
22. Chang JH, McCluskey PJ.: Ocular cicatricial pemphigoid: manifestations and management. Curr Allergy Asthma Rep, 2005 Jul;5(4): 333–8.
23. Iakymenko S.: Forty-five years of keratoprosthesis study and application at the Filatov Institute: a retrospective analysis of 1 060 cases. Int J Ophthalmol, 2013 Jun 18;6(3): 375–80.
24. Kanski, J. J.: „Clinical Ophthalmology: A Systematic Approach“, Butteworth-Heinemann, 2007, s, 235-237, ISBN 9780702040931.
25. Kharfi M, Khaled A, Anane R, et al.: Early onset childhood cicatricial pemphigoid: case report and review of the literature. Paediatr Dermatol, 2010; 27 : 119–24.
26. Kirzhner M1, Jakobiec FA.: Ocular cicatricial pemphigoid: a review of clinical features, immunopathology, differential diagnosis, and current management.Semin Ophthalmol, 2011 Jul-Sep; 26(4–5): 270–7.
27. Letko E, Bhol K, Foster CS, Ahmed AR.: Influence of intravenous immunoglobulin therapy on serum levels of anti-β4 antibodies in ocular cicatricial pemphigoid. Curr Eye Res, 2000; 21 : 646–54.
28. Messmer EM1, Hintschich CR, Partscht K at al.: Ocular cicatricial pemphigoid. Retrospective analysis of risk factors and complications. Ophthalmologe, 2000 Feb; 97(2): 113–20.
29. Miserocchi E1, Baltatzis S, Roque MR.: The effect of treatment and its related side effects in patients with severe ocular cicatricial pemphigoid. Ophthalmology. 2002 Jan;109(1):111-8
30. Mondino BJ, Brown SI.: Ocular cicatricial pemphigoid. Ophthalmology, 1981 Feb; 88(2): 95–100.
31. Nottage JM1, Hammersmith KM, Murchison AP, et al.: Treatment of mucous membrane pemphigoid with mycophenolate mofetil. Cornea, 2013 Jun; 32(6): 810–5.
32. Pasadhika S, Kempen JH, Newcomb CW et al.: Azathioprine for ocular inflammatory diseases. Am J Ophthalmol, 2009 Oct; 148(4): 500–509.e2.
33. Pujari SS, Kempen JH, Newcomb CW et al.: Cyclophosphamide for ocular inflammatory diseases. Ophthalmology, 2010 Feb; 117(2): 356–65.
34. Radford CF1, Rauz S, Williams GP et al.: Incidence, presenting features, and diagnosis of cicatrising conjunctivitis in theUnited Kingdom. Eye (Lond), 2012 Sep; 26(9):1199–208.
35. Risser J1, Lewis K, Weinstock MA.: Mortality of bullous skin disorders from 1979 through 2002 in the United States. Arch Dermatol, 2009 Sep; 145(9): 1005–8.
36. Saw VP, Dart JK, Rauz S, et Wi al.: Immunosuppressive therapy for ocular mucous membrane pemphigoid strategies and outcomes. Ophthalmology, 2008; 115 : 253–261.
37. Saw VP, Dart JK.: Ocular mucous membrane pemphigoid: diagnosis and management strategies. Ocul Surf, 2008 Jul; 6(3): 128–42.
38. Sobolewska B, Deuter C, Zierhut M.: Current medical treatment of ocular mucous membrane pemphigoid. Ocul Surf, 2013 Oct; 11(4): 259–66.
39. Srikumaran D, Akpek EK.: Mucous membrane pemphigoid: recent advances. Curr Opin Ophthalmol, 2012 Nov; 23(6): 523–7.
40. Thorne JE, Woreta FA, Jabs DA et al.: Treatment of ocular mucous membrane pemphigoid with immunosuppressive drug therapy. Ophthalmology, 2008 Dec; 115(12): 2146–2152.
41. Thorne JE1, Anhalt GJ, Jabs DA.: Mucous membrane pemphigoid and pseudopemphigoid. Ophthalmology, 2004 Jan; 111(1): 45–52.
42. Trimarchi M1, Bellini C, Fabiano B, et al.: Multiple mucosal involvement in cicatricial pemphigoid. Acta Otorhinolaryngol Ital, 2009 Aug; 29(4): 222–5.
43. Tyagi S, Bhol K, Natarajan K at al.: Ocular cicatricial pemphigoid antigen: partial sequence and biochemical characterization. Proc Natl Acad Sci U S A,1996 Dec 10; 93(25): 14714–9.
44. Williams GP, Radford C, Nightingale P, et al.: Evaluation of early and late presentation of patients with ocular mucous membrane pemphigoid to two major tertiary referral hospitals in the United Kingdom. Eye, 2011; 25 : 1207–18.
45. Xu HH1, Werth VP, Parisi E, Sollecito TP.: Mucous membrane pemphigoid. Dent Clin North Am, 2013 Oct; 57(4): 611–30.
Štítky
Chirurgie maxilofaciální Oftalmologie
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2016 Číslo 1- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- První schválený léčivý přípravek pro terapii Leberovy hereditární optické neuropatie dostupný rovněž v ČR
- Selektivní laserová trabekuloplastika nesnižuje nitroční tlak více než argonová laserová trabekuloplastika
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
-
Všechny články tohoto čísla
- Oznámení
-
Perspektivy buněčné terapie v oftalmologii
1. Využití kmenových buněk v regeneraci poškozeného povrchu oka -
Perspektivy buněčné terapie v oftalmologii
2. Potenciál kmenových buněk pro léčbu onemocnění sítnice - Klinické projevy experimentální autoimunitní uveitidy
- Oční jizevnatý pemfigoid – retrospektivní studie
- Klinické zkoušky testující nové terapie pro Stargardtovu chorobu
- Drúzy papily zrakového nervu a jejich komplikace
- Bilaterální makulární edém na podkladě drúzových papil
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Drúzy papily zrakového nervu a jejich komplikace
- Klinické zkoušky testující nové terapie pro Stargardtovu chorobu
- Bilaterální makulární edém na podkladě drúzových papil
- Oční jizevnatý pemfigoid – retrospektivní studie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání








