Klinické projevy experimentální autoimunitní uveitidy
Autoři:
A. Klímová 1; P. Seidler Štangová 1; P. Svozílková 1; T. Kučera 2; prof. MUDr. Jarmila Heissigerová, Ph.D., MBA 1
Působiště autorů:
Oční klinika, 1. lékařská fakulta, Univerzita Karlova v Praze a Všeobecná fakultní nemocnice v Praze, přednosta doc. MUDr. Bohdana Kalvodová, CSc.
1; Ústav histologie a embryologie, 1. lékařská fakulta, Univerzita Karlova v Praze, přednosta doc. MUDr. Tomáš Kučera, Ph. D.
2
Vyšlo v časopise:
Čes. a slov. Oftal., 72, 2016, No. 1, p. 276-282
Kategorie:
Původní práce
Souhrn
Úvod:
Autoimunitní uveitida je závažné zrak ohrožující onemocnění, které u části pacientů zůstává rezistentní ke konvenční imunosupresivní anebo biologické léčbě. Výzkum z posledních let zlepšil terapeutické možnosti tohoto onemocnění a významný podíl na tomto vývoji má základní výzkum na experimentálních modelech. Cílem této práce je prezentovat klinické a histologické projevy zánětu na modelu experimentální autoimunitní uveitidy (EAU) u myši.
Metodika:
EAU byla indukována u myší kmene C57BL/6 subkutánní aplikací IRBP (interphotoreceptor retinoid binding protein) v kompletním Freundově adjuvans a pertusovým toxinem aplikovaným intraperitoneálně. Intenzita zánětu byla hodnocena in vivo pomocí speciálního zobrazovacího systému s využitím otoskopu. Bulby byly enukleovány post mortem 35. den po indukci EAU a intenzita zánětu hodnocena histologicky barvením kryořezů metodou hematoxylin-eozin.
Výsledky:
Fotodokumentace zobrazuje klinické projevy uveitidy in vivo i histologické známky zánětu získané post mortem.
Závěr:
Zavedení stabilního a reprodukovatelného modelu EAU umožňuje podrobně studovat imunopatogenetické mechanismy zánětu a jejich cílenou regulaci. Podobnost zánětlivých změn s nálezy pacientů se zadní uveitidou autoimunitní etiologie umožňuje výsledky výzkumu na tomto experimentálním modelu aplikovat v humánní medicíně.
Klíčová slova:
experimentální autoimunitní uveitida, autoimunita, myši
Úvod
Uveitida je spolu s diabetickou retinopatií hlavní příčinou slepoty v rozvinutých zemích u lidí v produktivním věku. Uveitida představuje desetiprocentní podíl na slepotě v těchto zemích (20, 9), a to i přes stále se rozšiřující terapeutické možnosti.
Etiologii autoimunitní uveitidy u člověka je velice obtížné zjistit. Přibližně u 25 % pacientů se autoimunitní uveitida pojí se systémovým onemocněním typu sarkoidózy, ankylózující spondylitidy, roztroušené sklerózy, systémového lupus erythematodes, Wegenerovy granulomatózy apod. Téměř u poloviny případů však etiologii nezjistíme.
Základní léčebnou modalitou autoimunitní uveitidy je imunosuprese. Výzkum v posledních letech významně zlepšil terapeutické možnosti a nemalý podíl na tomto vývoji má základní výzkum uveitid na experimentálních modelech.
První model uveitidy u potkanů (18) využíval aplikaci Freundova adjuvans obsahujícího mykobakteria a později i endotoxinu (10). Od té doby byl vyvinut model autoimunitní uveitidy u potkanů, u morčat, u koní a u primátů imunizací jedním ze sítnicových antigenů – arrestinem neboli S-antigenem v kompletním Freundově adjuvans (22, 12). Jeho aplikace experimentálnímu zvířeti vyvolala onemocnění s klinickým obrazem velmi podobným uveitidě u lidí. U běžně používaných kmenů myší však S-antigen zánětlivé oční onemocnění nevyvolává. Až po objevu intraretinálního vazebného peptidu (IRBP) byl vyvinut experimentální model autoimunitní uveitidy u myší (4). Od té doby vznikly četné varianty prvního základního myšího modelu, který spočívá v intraperitoneální či subkutánní aplikaci antigenu (IRBP).
V našich experimentech byla indukována EAU pomocí IRBP humánního původu. Protein IRBP se nachází v interfotoreceptorové matrix, která slouží k transportu derivátů vitaminu A mezi fotoreceptory a retinálním pigmentovým epitelem. Strukturu proteinu IRBP tvoří čtyři evolučně staré domény, o kterých se předpokládá, že vznikly genovou duplikací (1).
Další možností indukce EAU je adoptivní přenos T lymfocytů z imunizovaných donorů, dále „humanizovaná“ forma EAU u transgenních kmenů myší, EAU indukovaná injekcí dendritických buněk, které in vitro zrály v přítomnosti antigenu, a nakonec model spontánní uveitidy u myší, kterým chybí gen pro autoimmunitní regulátor (AIRE), a u athymických „nude“ myší s implantovaným krysím embryonálním thymem (6).
Námi používaný model experimentální uveitidy je velmi podobný obrazu zadní uveitidy či panuveitidy u lidí – s vitritidou, choroiditidou, retinitidou a vaskulitidou. Posouzení stupně uveitidy je založeno na hodnocení in vivo biomikroskopicky, tak post mortem histologicky (7).
Cílem této práce je prezentovat klinické a histologické projevy experimentální uveitidy u myši. Podle jejich stupně se provádí standardizované hodnocení intenzity zánětu, které slouží například k posouzení účinnosti nové léčby.
Metodika
Myši C57BL/6
Samice inbredního kmene myší C57BL/6 ve věku 5 až 8 týdnů byly dodány z Centra pro experimentální biomodely (1. lékařská fakulta, Univerzita Karlova, Praha). Použití laboratorních zvířat pro tento projekt bylo schváleno odbornou komisí pro práci s pokusnými zvířaty 1. lékařské fakulty Univerzity Karlovy v Praze a se zvířaty bylo nakládáno v souladu se zákonem č. 246/1992 Sb., na ochranu zvířat proti týrání, na základě osvědčení Ministerstva zemědělství.
Indukce EAU
Aplikace IRBP, který působí jako autoantigen, byla prováděna podle standardního protokolu (2, 3). Subkutánně se aplikuje 500 μg IRBP 1-20 (interphotoreceptor retinoid binding protein, New England Peptide, Gardner, USA). Pro rozpuštění peptidu byl použit DMSO (dimethyl sulfoxid) (Sigma Aldrich, St. Louis, USA). IRBP byl emulzifikován v poměru 1:1 s kompletním Freundovým adjuvans (Difco, USA) obsahujícím mykobakterie. Reaktivita imunitního systému byla podpořena intraperitoneální aplikací 1,2 μg pertusového toxinu (List Biologicals, Campbell, USA), rozpuštěného v PBS (phosphate buffered saline).
Klinické vyšetření uveitidy
Biomikroskopické vyšetření zvířat in vivo bylo prováděno pomocí otoskopu (obr. 1). Myši byly vyšetřovány v celkové intraperitoneální kombinované anestezii ketaminem 80 mg/kg (Narkamon 50 mg/ml, Bioveta, Slovensko) a xylazinem 5 mg/kg (Rometar 20 mg/ml, Bioveta, Slovensko). Pro dilataci zornice byl lokálně aplikován tropikamid (Unitropic 1% oph. gtt., Unimed Pharma, Slovensko) a phenylephrin (Neosynephrin-Pos 10 %, Ursapharm, Česká republika). Na rohovku pokrytou vrstvou viskomateriálu byl přikládán otoskop připojený k zevnímu zdroji světla a k fotoaparátu s předsazenou čočkou +4,0 dioptrie (19).

Histologické zpracování materiálu
Zvířata byla usmrcena podle etických pravidel daných zákonem České republiky cervikální dislokací. Oči byly enukleovány vystříháním ze spojivkového vaku bezprostředně post mortem 35. den po indukci EAU. Oči byly vloženy do gelového media (Tissue-Tek® O.C.T. CompoundTm, USA) a zamrazeny ve 2-methylbutanu (Sigma Aldrich, St. Louis, USA) v atmosféře tekutého dusíku. Vzorky zmražené na -70 ˚C byly krájeny na mikrotomu (Leica CM 1850) na 7 μm silné řezy. Řezy byly krájeny vždy z periferie a z oblasti optického nervu obou očí a barveny metodou hematoxylin-eozin podle standardního protokolu. Vzorky byly odebrány z obou očí, vzhledem k tomu, že zánět může být asymetrický.
Výsledky
Subkutánní aplikace IRBP v kompletním Freundově adjuvans potencovaná intraperitoneálním pertusovým toxinem vyvolala u citlivých myších kmenů projevy zadní uveitidy, mimořádně i panuveitidy.
Hodnocení intenzity zánětu bylo provedeno klinicky in vivo nebo histologicky post mortem.
Klinické projevy EAU
Klinické známky zadní uveitidy jsou zřetelné na fotografiích sítnice vytvořených pomocí zobrazovacího systému otoskopu. Známky zánětu na našich snímcích zachycují vaskulitidu, choroiditidu a edém optického nervu (obr. 2–12).
Klinický systém hodnocení intenzity uveitidy popisuje Xu et. al. (23). Hodnotí ve škále 1 (minimální zánět) až 4 (silný zánět) 4 parametry: velikost a tvar infiltrátů sítnice, zánětlivé změny zrakového nervu, stupeň opouzdření cév a strukturální změny sítnice (atrofie/jizvení).
Biomikroskopicky byla u našich myší nejvyšší intenzita uveitidy pozorována 25. až 28. den po indukci, a to průměrně stupeň 3. Na začátku pozorování (14. den) byl u některých očí ojediněle zachycen infiltrát nebo byl přítomný mírný edém terče, v celkovém hodnocení je klasifikován průměrně stupeň 0. V dalším vývoji 20. až 21. den je u některých očí patrný výrazný edém terče zrakového nervu, opouzdření cév a bělavé sítnicové lineární či granulární zánětlivé léze (obr. 4 a 5), většina očí zůstává bez zánětlivých změn, průměrně je stupeň zánětu 1. Na vrcholu zánětu 25. až 28. den jsou u většiny očí výrazné projevy zánětu (obr. 6, 7, 8). Od 35. dne jsou na sítnici přítomny atrofické změny (obr. 9 a 10), které se v čase stupňují (obr. 11 a 12).


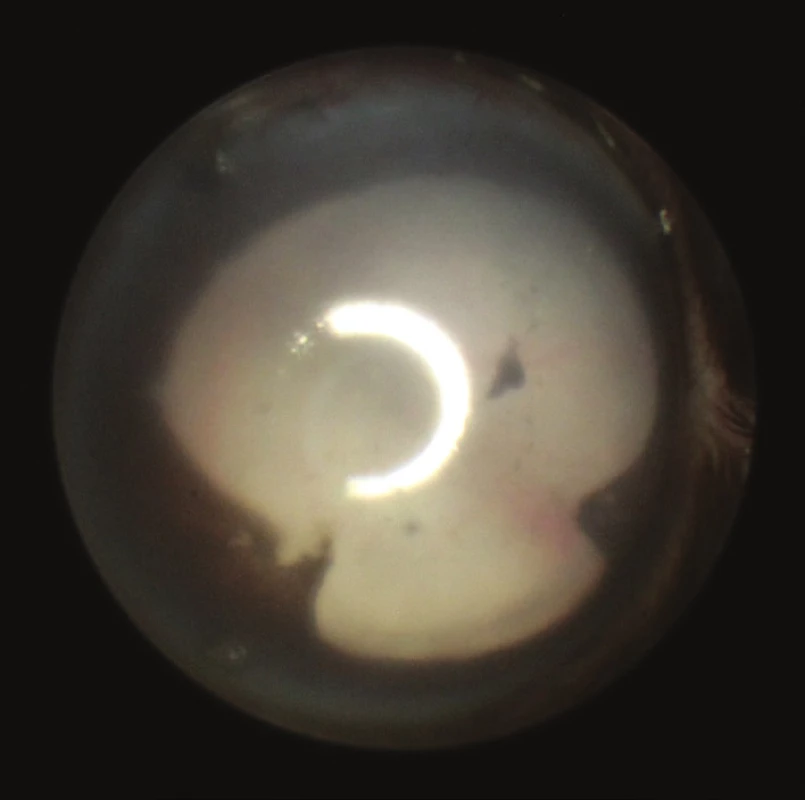
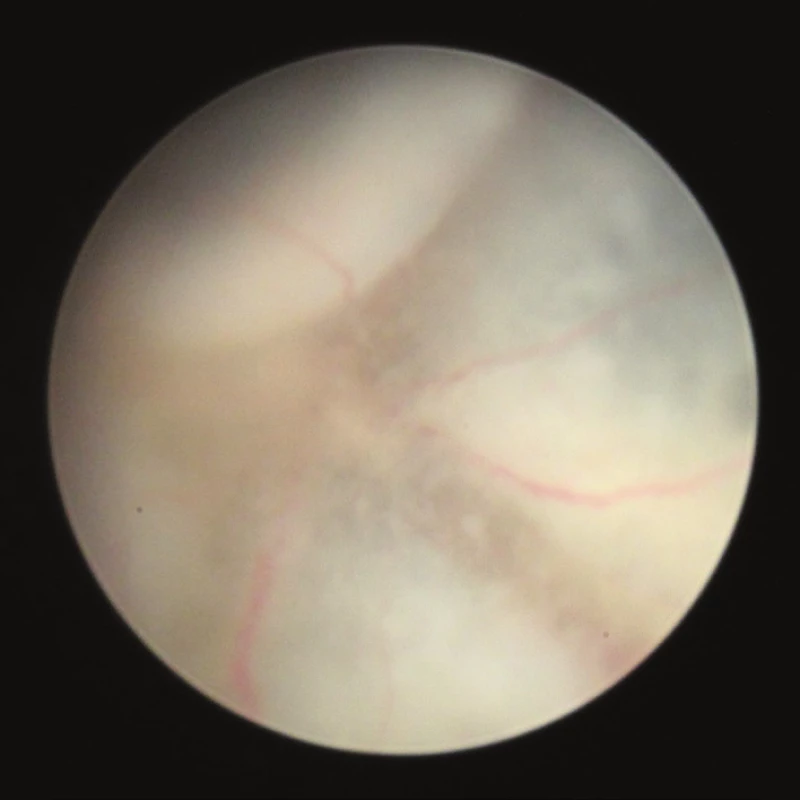
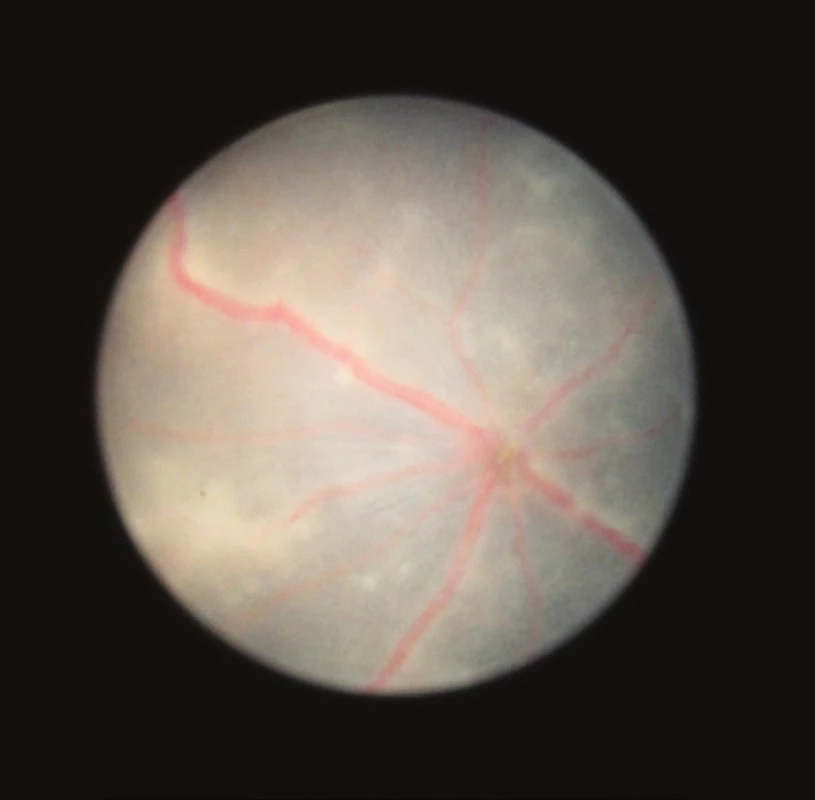


Obr. 2 – 12 Fotografie sítnice u zdravých myší a u myší v různých intervalech po indukci EAU zobrazují dynamiku zánětlivých projevů
Histologické projevy zánětu
Mezi histologické známky zadní uveitidy patří retinální záhyby, zánětlivá ložiska v sítnici, často lokalizovaná v blízkosti ciliárního tělíska, vaskulitida, vitritida, neovaskularizace sítnice či ztráta fotoreceptorů (obr. 15–18). Sítnice u zdravých myší má zřetelně oddělené vrstvy sítnice bez nepravidelností (obr. 13 a 14).
Mikroskopické hodnocení intenzity uveitidy na řezech barvených metodou hematoxylin-eozin se provádí podle zavedeného systému hodnocení od stupně 0 (žádný zánět) do stupně 4 (silný zánět) podle Caspi (4, 21, 8).
Histologicky jsou v našem pozorování maximální zánětlivé změny přítomny 35. den po indukci. Intenzita zánětu posuzovaná histologicky u našich myší je 1,0 až 2,0.

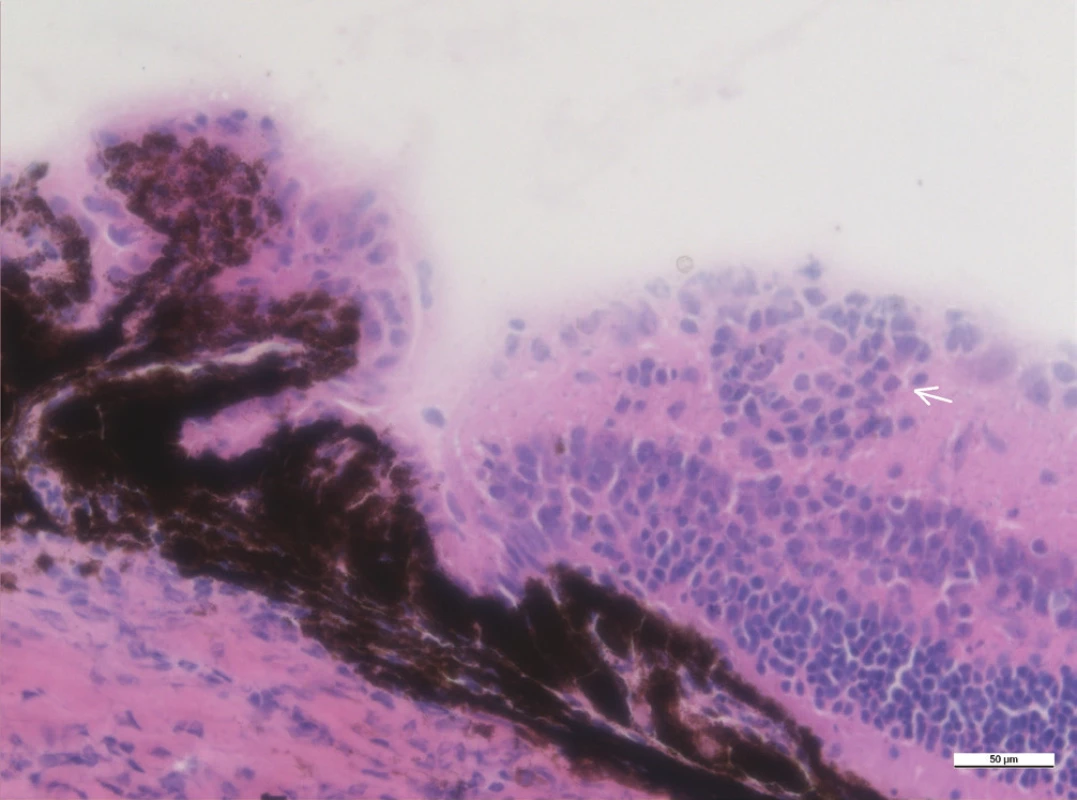
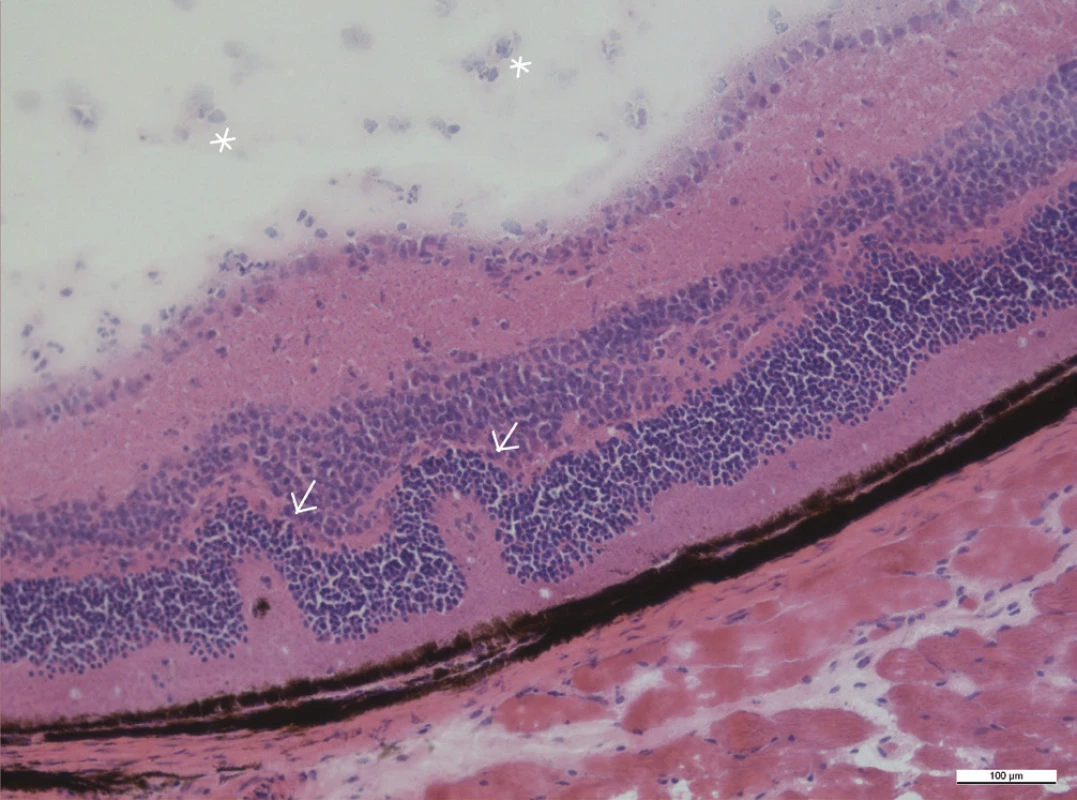
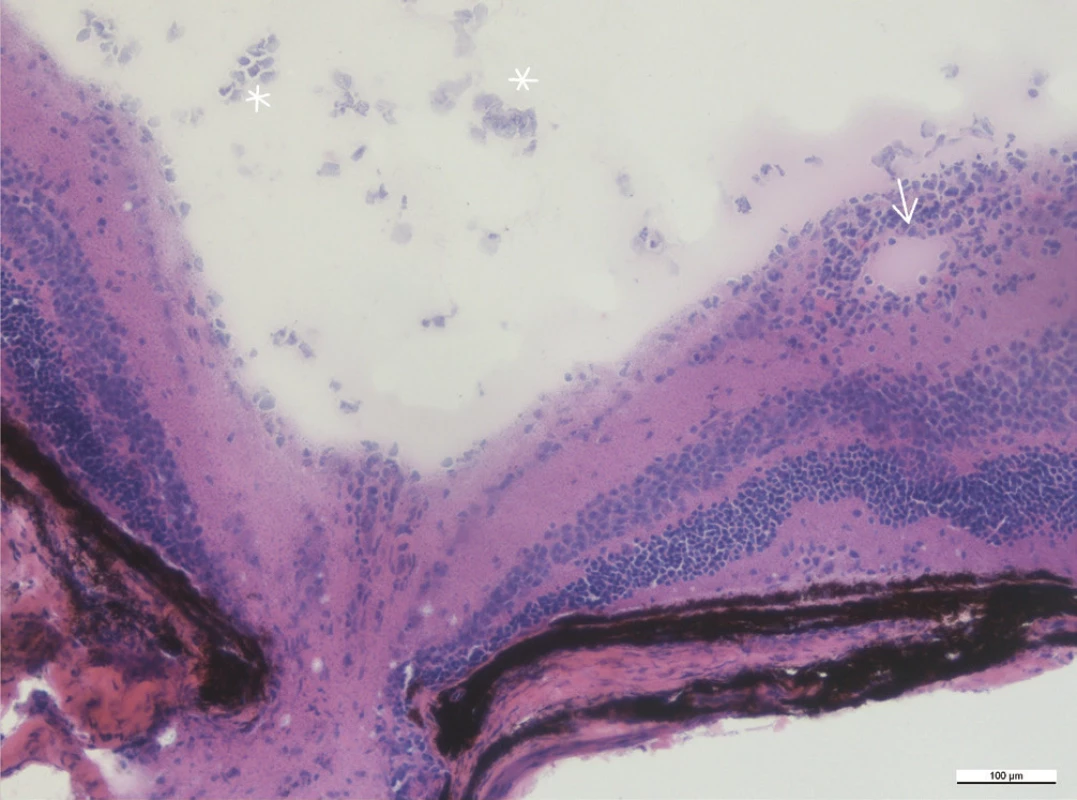
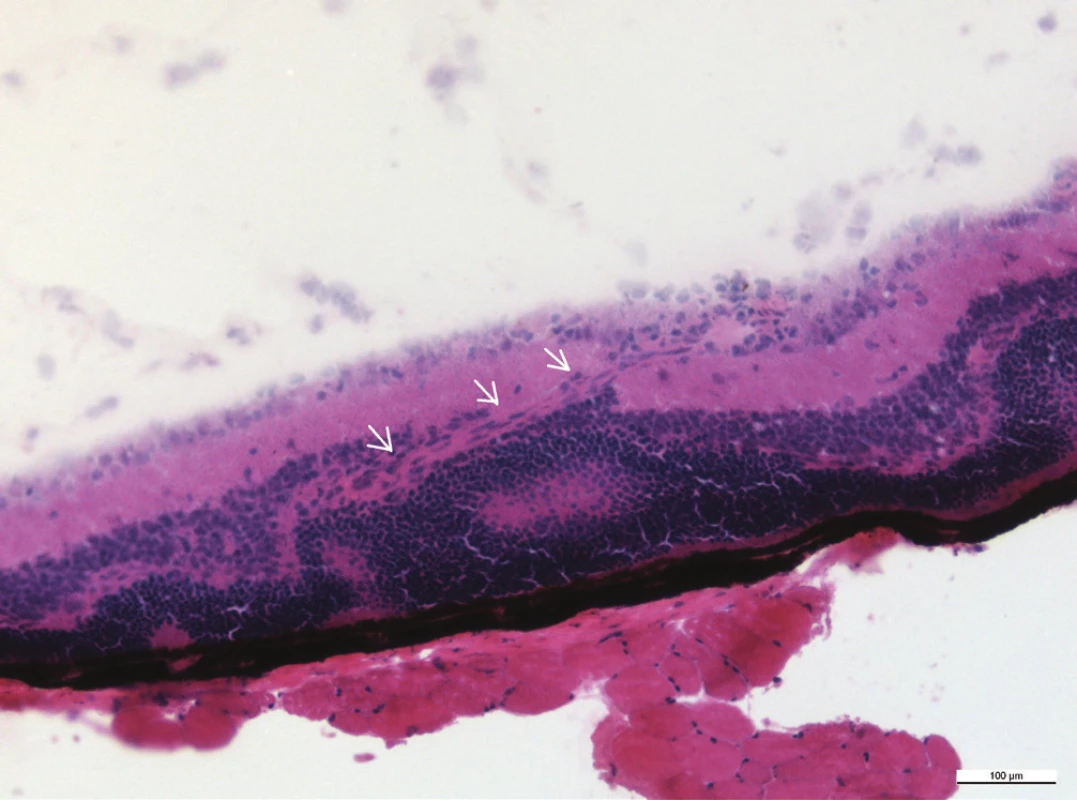
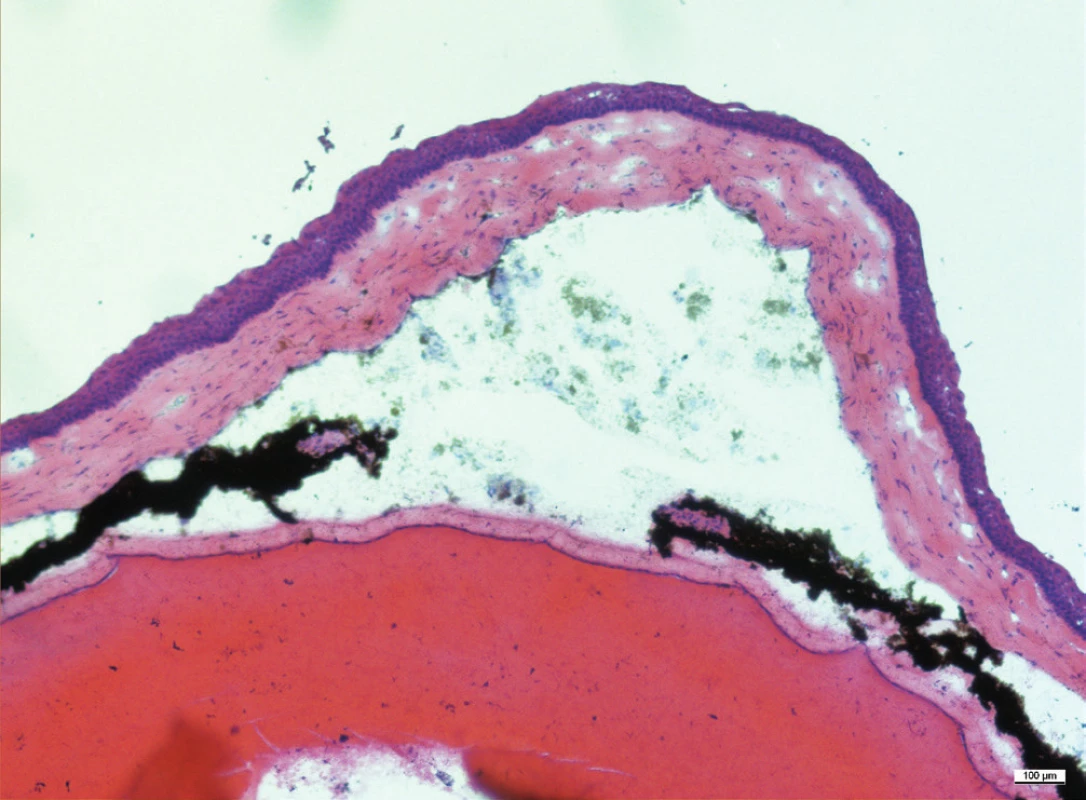
Obr. 13–19 Histologické řezy očí u zdravých myší a u myší 35. po indukci EAU barvené hematoxylinem a eozinem. Měřítko je uvedené na snímcích, linka odpovídá velikosti 100 μm.
Diskuse
Autoimunitní uveitida zahrnuje celou řadu jednotek, které se liší klinickým obrazem a průběhem onemocnění. Vzhledem k tomu, že se navíc jedná o vzácné onemocnění, je v humánní medicíně velice obtížné autoimunitní uveitidu studovat. Bylo vyvinuto několik experimentálních modelů, které umožňují detailnější studium uveitid (4, 23, 6). Tyto modely pomohly za posledních 40 let objasnit vliv genové výbavy na průběh nitroočního zánětu, zkoumat základní mechanismy patogeneze uveitid a vyzkoušet nové strategie imunologické léčby (11, 17).
Experimentální autoimunitní uveitida u myší představuje reprodukovatelný model, který otevírá další možnosti v oblasti výzkumu zadní uveitidy autoimunitní etiologie. Uveitida indukovaná u myší kmene C57BL/6 je mírná a chronická a blízce připomíná autoimunitní uveitidu u lidí (5). Tím se liší od staršího modelu akutní uveitidy u myší kmene B10.RIII, kde vzniká prudká krátkodobá panuveitida. Na tomto modelu je vrchol zánětu 12. až 15. den a není možné vyšetřit fundus biomikroskopicky pro zkalená optická média (13).
Citlivost běžně používaného kmene myší C57BL/6 k sítnicovému peptidu (IRBP) je poměrně variabilní. Úspěch indukce ovlivňuje více faktorů, například pohlaví a stáří myší nebo podmínky chovu. V našem souboru máme myši staré 5 až 8 týdnů, zatímco někteří autoři preferují myši ve stáří 8 až 12 týdnů (23). Obvykle se pracuje se samicemi, a to vzhledem k vyšší prevalenci autoimunitních onemocnění u žen. Dosud nebyla publikována práce srovnávající u myší intenzitu zánětu EAU mezi pohlavím. Neúspěšná indukce uveitidy může být důsledek chronického stresu (vyšší hladiny kortikosteroidů potlačují zánět) nebo akutního onemocnění (zvýšené cirkulující interferony) (1).
Intenzita vyvolaného zánětu hodnocená histologicky u kmene myší C57BL/6 kolísá mezi jednotlivými laboratořemi v závislosti na protokolu indukce uveitidy. Průměrně autoři uvádějí stupeň zánětu 1 až 2: Kim et al. (15) 2,13, Xu et al. (15) 1 až 2, Keino et al. (14) 1,2, Kitamei et al. (16) 1,63. V našich experimentech byl při histologickém hodnocení zaznamenán průměrný stupeň zánětu 1 až 2.
Pozoruhodné je, že intenzita zánětu ve škále 1 až 4 zjištěná při klinickém vyšetření otoskopem je vyšší než při hodnocení histologickém (23), což potvrzuje také naše sledování. Tato diskrepance může být vysvětlena například rozdílným rozsahem hodnocené sítnice. Při klinickém vyšetření je přehlédnuta celá sítnice. Při histologickém hodnocení je posuzováno 8 až 10 řezů sítnice jednoho oka silné 7 µm, nemusí být proto všechny léze zachyceny.
Výhodou modelu chronické EAU u myší C57BL/6 je relativně dlouhá doba aktivity zánětu trvající přibližně 3 až 4 týdny. Biomikroskopicky byla u našich myší nejvyšší intenzita zánětu 25. až 28. den po indukci. Histologicky byly prokázány maximální zánětlivé změny 35. den po indukci. Naše pozorování korelují s výsledky jiných autorů, Xe et al. (23) zaznamenává vrchol zánětu kolem 25. dne po indukci, Caspi (4) popisuje aktivní zánět od 3. do 7. týdne po indukci.
Postupný vývoj klinických a histologických projevů zánětu v našem pozorování odpovídá popisu v práci kolektivu autorů Xu et al. (23). V počátečních stadiích (14. den po indukci) je klinicky přítomný mírný edém terče zrakového nervu, na histologickém řezu je zrakový terč bez viditelných strukturních změn. Na vrcholu zánětu (25. den po indukci) je klinicky patrný výrazný edém terče zrakového nervu, opouzdření cév a bělavé sítnicové lineární léze. Na histologických řezech tyto změny odpovídají infiltraci zrakového nervu zánětlivými buňkami, vaskulitidě a retinálním záhybům. V pozdním stádiu (80. den po indukci) dominují v klinickém obraze sítnicové jizvy, histologicky byla prokázána glióza a ztráta zevních segmentů fotoreceptorů.
Minimální či žádné postižení předního segmentu u našeho modelu umožňuje lepší přehlednost a snadnější biomikroskopické vyšetření sítnice i při vysoké aktivitě zánětu.
Závěr
Klinické a histologické hodnocení intenzity zánětu na modelu EAU je zásadní pro využití tohoto modelu v základním výzkumu. Zavedení stabilního a reprodukovatelného modelu EAU umožňuje podrobně studovat imunopatogenetické mechanismy zánětu a jejich cílenou regulaci, což může přispět k efektivní léčbě nitroočních zánětů v humánní medicíně.
Tato práce vznikla z podpory grantu IGA MZ ČR NT/14017-3/2013, PRVOUK P25/LF1/2, SVV UK 254260023 a SVV UK 260148/2015.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou.
MUDr. Aneta Klímová
Oční klinika, 1. lékařská fakulta,
Univerzita Karlova v Praze a VFN
U Nemocnice 2
128 08 Praha 2
Telefon: 737 800 058
e-mail: aneta.klimova@volny.cz
Do redakce došlo dne 24. 3. 2015
Do tisku přijato dne 22. 1. 2016
Zdroje
1. Agarwal R.K., Silver P.B., Caspi R.R.: Rodent Models of Experimental Autoimmune Uveitis. Autoimmunity: Methods and Protocols, Methods in Molecular Biology, vol. 900, Springer Science+Business Media New York; 2012, Chapter 22, 443–469.
2. Avichezer D., Silver P. B., Chan C. C., Wiggert B. et al.: Identification of a new epitope of human IRBP that induces autoimmune uveroretinitis in mice of the H-2b haplotype. Invest Ophthalmol Vis Sci, 41; 2000: 127–131.
3. Broderick C., Hoek R. M., Forrester J. V. et al.: Constitutive retinal CD200 expression regulates resident microglia and activation state of inflammatory cells during experimental autoimmune uveoretinitis. Am J Pathol, 161(5); 2002: 1669–77.
4. Caspi R. R., Roberge F. G., Chan C. C.: A new model of autoimmune disease. Experimental autoimmune uveoretinitis induced in mice with two different retinal antigens. J Immunol, 140(5); 1988: 1490–1495.
5. Caspi R. R.: Animal models of autoimmune and immune-mediated uveitis. Drug Discovery Today: Disease Models, Volume 3, Issue 1, 2006, 3–9.
6. Caspi R. R., Silver P. B., Luger D. et al.: Mouse models of experimental autoimmune uveitis. Ophthalmic Res, 40; 2008: 169–74.
7. Chan C. C., Caspi R. R., Ni M. et al.: Pathology of experimental autoimmune uveoretinitis in mice. J Autoimmun, 3; 1990: 247–55.
8. Dick A. D., Cheng Y. F., Liversidge J. et al.: Immunomodulation of experimental autoimmune uveoretinitis: a model of tolerance induction with retinal antigens. Eye (Lond), 8 (Pt 1), 1994: 52–59.
9. Durrani O. M., Meads C. A., Murray P. I.: Uveitis: a potencially blinding disease. Ophthalmologica, 218; 2004: 223–36.
10. Forrester J. V., Worgul B. V., Merriam G. R., Jr.: Endotoxin-induced uveitis in the rat. Albrecht Von Graefes Arch Klin Exp Ophthalmol, 213; 1980: 221–33.
11. Forrester J. V., Liversidge J., Dua H. S. et al. (1992): Experimental autoimmune uveoretinitis: a model system for immunointervention: a review. Curr Eye Res, 11 (Suppl.): 33–40.
12. Hirose S., Singh V. K., Donoso L. A. et al.: An 18-mer peptide derived from the retinal S antigen induces uveitis and pinealitis in primates. Clin Exp Immunol, 77; 1989: 106–11.
13. Jiang H.R., Lumsden L., Forrester J.V.: Macrophages and dendritic cells in IRBP-induced experimental autoimmune uveoretinitis in B10RIII mice. Invest Ophthalmol Vis Sci, 40 (13); 1999: 3177–85.
14. Keino H., Kezuka T., Takeuchi M., et al.: Prevention of experimental autoimmune uveoretinitis by vasoactive intestinal peptide. Arch Ophthalmol. Aug, 2004; 122(8): 1179–84.
15. Kim T.W., Jeong H.J., Lee H.J. et al.: Intraperitoneal Infusion of Mesenchymal Stem/Stromal Cells Prevents Experimental Autoimmune Uveitis in Mice. Mediators Inflamm, 2014: 624-640.
16. Kitamei H., Kitaichi N., Yoshida K. et al.: Association of heat shock protein 70 induction and the amelioration of experimental autoimmune uveoretinitis in mice. Immunobiology, 2006; 212(1):11–8.
17. Klímová A., Seidler Štangová, J. Heissigerová et al.: Mycophenolate Mofetil and Cyclophosphamide Treatments Suppress Inflammation Intensity in an Experimental Model of Autoimmune Uveitis. Folia Biologica (Praha), 2014; 60: 228–234.
18. Lalive dE-Z.: Experimental uveitis in the rat after subcutaneous injection of Freund‘s adjuvant. Histological changes in the uvea. Ophthalmologica, 155; 1968: 271–89.
19. Paques M., Guyomard J. L., Simonutti M. et al.: Panretinal, High Resolution Color Photography of the Mouse Fundus. Invest. Ophthalmol Vis Sci, 48; 2007: 2769–2774.
20. Suttorp-Schulten M. S., Rothova A.: The possible impact of uveitis in blindness: a literature survey. Br J Ophthalmol, 80; 1996: 844–848.
21. Thurau S. R., Chan C. C., Nussenblatt R. B. et al.: Oral tolerance in a murine model of relapsing experimental autoimmune uveoretinitis (EAU): induction of protective tolerance in primed animals. Clin Exp Immunol, 109; 1997: 370–376.
22. Wacker W. B., Kalsow C. M.: Autoimmune uveo-retinitis in the rat sensitized with retina photoreceptor cell antigen. Int Arch Allergy Appl Immunol, 45; 1973: 582–92.
23. Xu H., Koch P., Chen M. et al.: A clinical grading system for retinal inflammation in the chronic model of experimental autoimmune uveoretinitis using digital fundus images. Exp Eye Res, 87; 2008: 319–326.
Štítky
Chirurgie maxilofaciální OftalmologieČlánek vyšel v časopise
Česká a slovenská oftalmologie

2016 Číslo 1
- Diagnostický algoritmus při podezření na syndrom periodické horečky
- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- Oční vyšetření a možnosti léčby v ordinaci praktického lékaře
- Léčba zánětů spojivek a mazových žlázek víčka v primární péči
Nejčtenější v tomto čísle
- Drúzy papily zrakového nervu a jejich komplikace
- Klinické zkoušky testující nové terapie pro Stargardtovu chorobu
- Bilaterální makulární edém na podkladě drúzových papil
- Oční jizevnatý pemfigoid – retrospektivní studie

