-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Gyrus dentatus – anatomie, cévní zásobení, funkce a neuropatologie
The dentate gyrus – anatomy, vascular supply, function and neuropathology
In short communication, we describe the anatomy of the dentate gyrus including its vascular supply. The dentate gyrus is a small gyrus of the human brain, hidden to the observer (anatomist, neurosurgeon) in the depth of the hippocampal complex. It is ejected to the ambient cistern only by its delicate teethed part. The dentate gyrus is important due to its involvement in the Andersen circuit during the creation and consolidation of the memory track. The anatomical dissection helps us to understand its position to the hippocampus proprius, what clarifies their functional connection (perforant path). This dissection is also important for the neurosurgeon, who performs amygdalohippocampectomy or resection of the mediotemporal glioma. We also deal with nosologic entities united to this complex and striking anatomical area.
Keywords:
memory – Dentate gyrus – Limbic system – neurodegenerative disease – hippocampal formation
Autoři: D. Ospalík 1; R. Bartoš 2,3; H. Zítek 2; M. Sameš 2; V. Němcová 3
Působiště autorů: Neurologické oddělení, Masarykova, nemocnice, KZ a. s., Ústí nad Labem 1; Neurochirurgická klinika Univerzity, J. E. Purkyně, Masarykova nemocnice, KZ a. s., Ústí nad Labem 2; Anatomický ústav 1. LF UK, Praha 3
Vyšlo v časopise: Cesk Slov Neurol N 2022; 85(5): 405-409
Kategorie: Krátké sdělení
doi: https://doi.org/10.48095/cccsnn2022405Souhrn
V krátkém sdělení popisujeme anatomii gyrus dentatus vč. jeho cévního zásobení. Jedná se o drobný gyrus lidského mozku, který je navíc pozorovateli (anatomovi, neurochirurgovi) skryt v hloubi hipokampálního komplexu. Do ambientní cisterny je z něj vysunuta pouze nepatrná zoubkovaná část. Gyrus dentatus je důležitý svým zapojením v Andersenově okruhu při tvorbě a konsolidaci paměťové stopy. Anatomická disekce nám napomůže pochopit jeho polohu vzhledem k vlastnímu hipokampu, což nám ozřejmí jejich společné funkční spojení (perforující dráha). Tato disekce je důležitá i pro neurochirurga, který provádí amygdalohipokampektomii nebo resekci mediotemporálního gliomu. Dále pojednáváme o nozologických jednotkách spojených s touto komplexní a krásnou anatomickou oblastí.
Klíčová slova:
paměť – neurodegenerativní onemocnění – gyrus dentatus – hipokampální formace – limbický systém
Úvod
Gyrus dentatus (GD) je strukturou mozku uloženou v hloubce mediotemporální oblasti, a tedy strukturou obtížně přístupnou anatomické disekci. Centrem našeho zájmu se stal díky svému bohatému funkčnímu zapojení, ale zaujal nás i z praktických důvodů – svým významem pro pochopení techniky operací v oblasti hipokampálního komplexu i svou provázaností s onemocněními, jako jsou epilepsie, deprese, schizofrenie a neurodegenerativní onemocnění. V GD také až do dospělosti dochází k postnatální neurogenezi [1].
Anatomie
Gyrus dentatus tvoří společně se subiculem – tvořícím horní plochu gyrus parahippocampalis a cornu ammonis – ležícím hlavně uvnitř temporálního rohu postranní komory hipokampální formaci (třívrstevný archicortex). GD leží mezi fimbria fornicis a subiculem, jak nám ukazuje histologický řez hipokampální formací (obr. 1). Nad ním se nachází fimbria fornicis, pod ním subiculum a gyrus parahippocampalis a superolaterálně je vlastní hipokampus – hippocampus proprius neboli cornu ammonis (CA: CA1–3). Sulcus fimbriodentatus ho odděluje od fimbria fornicis a sulcus hippocampalis od subicula. Na fimbrii se upíná tela choroida temporálního rohu postranní komory. Mediálně sousedí se strukturami ambientní cisterny a naproti je crus cerebri a tegmentum mesencephali. Na povrch hemisféry vyčnívá jen malá část GD oddělená pomocí sulcus hippocampalis superficialis (vepředu tenia Giacomini, uprostřed margo denticulatus a vzadu fasciola cinerea) a jeho převážná část je vnořena do hloubky a překryta cornu ammonis (viz histologický řez).
Obr. 1. Frontální řez zadní částí hippokampální formace vpravo; Nisslovo barvení kresylvioletí.
Fig. 1 Frontal section of the posterior part of the hippocampal complex on the right side; Nissl staining by cresyl violet.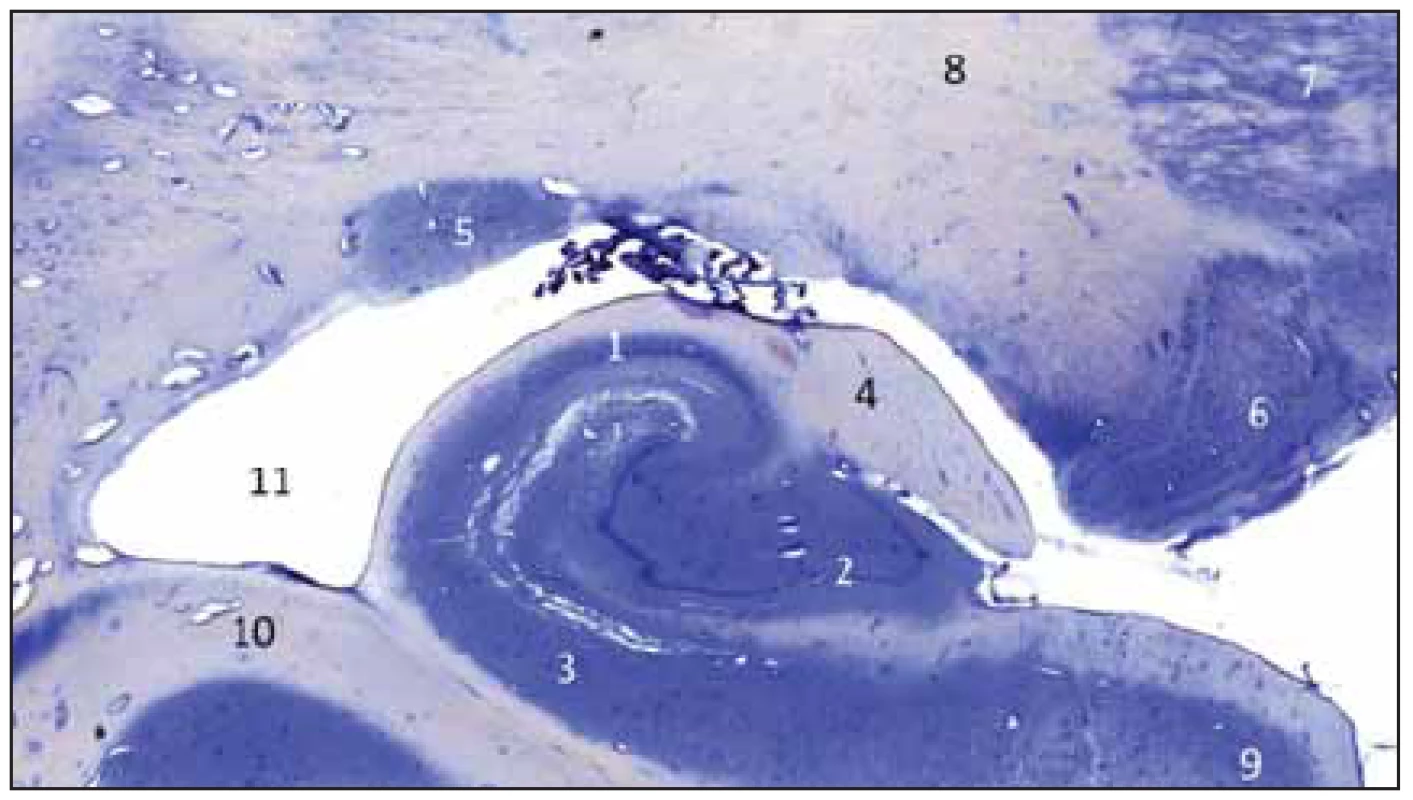
1 – cornu ammonis; 2 – gyrus dentatus; 3 – subiculum; 4 – fimbria fornicis; 5 – cauda nuclei caudati; 6 – corpus geniculatum laterale; 7 – talamus; 8 – capsula interna; 9 – gyrus parahippocampalis; 10 – eminentia collateralis; 11 – cornu inferius ventriculi lateralis 1 – cornu ammonis; 2 – gyrus dentatus; 3 – subiculum; 4 – fi mbria fornicis; 5 – cauda nuclei caudati; 6 – corpus geniculatum laterale; 7 – thalamus; 8 – capsula interna; 9 – gyrus parahippocampalis; 10 – eminentia collateralis; 11 – cornu inferius ventriculi lateralis Provedli jsme preparaci GD na kadaverozním preparátu fixovaném formolem (obr. 2A, B) a dále preparaci cévního zásobení pravostranného hipokampálního komplexu na preparátu s nástřikem cév barevným silikonem a následnou fixací (obr. 3). Anteriorně GD začíná na mediální ploše uncu jako tenia Giacomini, která se stáčí mírně dopředu a běží dolů směrem k sulcus uncinatus, v něm se ztrácí a pak již ostře zahýbá dozadu jako vlastní GD. Tenia Giacomini je vepředu oddělena pomocí sulcus hippocampalis superficialis od gyrus uncinatus a za ní je apex uncis. GD je charakteristický svým zoubkovaným povrchem, přičemž na našem preparátu jsme napočítali 20 zoubků, a dále dozadu pokračuje spolu s dalšími součástmi hipokampální formace jako fasciola cinerea směřující společně s gyrus fasciolaris (extraventrikulární část CA3) superomediálně nad splenium corporis callosi a dále jako indusium grisseum a proužky vláken striae longitudinales mediales et laterales (suprakomisurální hipokampus).
Obr. 2. (A) Gyrus dentatus (detail). (B) Širší zapojení GD v Papezově okruhu.
Fig. 2 (A) Right gyrus dentatus (detail). (B) Wider involvement of the right GD in the Papez circuit.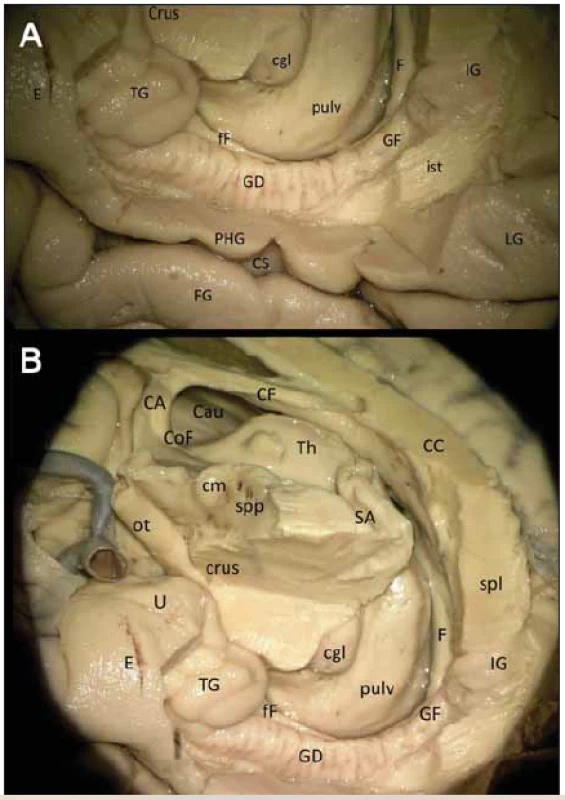
CA – commissura anterior; CC – corpus callosum; CF – corpus fornicis; Cgl – corpus geniculatum laterale; Cm – corpus mammilare; CoF – columna fornicis; Crus – crus mesencephali; CS – sulcus collateralis; E – cortex entorhinalis; F – fornix; fF – fi mbria fornicis; FG – gyrus fusiformis; GD – gyrus dentatus; GF – gyrus fasciolaris; IG – indusium grisseum; ist – istmus cinguli; LG – gyrus lingualis; ot – tractus opticus; PHG – gyrus parahippocampalis; Pulv – pulvinar thalami; Sa – aquaeductus mesencephali; Spl – splenium corporis callosi; Spp – substantia perforata posterior; TG – tenia giacomini; U – uncus CA – commissura anterior; CC – corpus callosum; CF – corpus fornicis; Cgl – corpus geniculatum laterale; Cm – corpus mammilare; CoF – columna fornicis; Crus – crus mesencephali; CS – sulcus collateralis; E – cortex entorhinalis; F – fornix; fF – fi mbria fornicis; FG – gyrus fusiformis; GD – gyrus dentatus; GF – gyrus fasciolaris; IG – indusium grisseum; ist – istmus cinguli; LG – gyrus lingualis; ot – tractus opticus; PHG – gyrus parahippocampalis; Pulv – pulvinar thalami; Sa – aquaeductus mesencephali; Spl – splenium corporis callosi; Spp – substantia perforata posterior; TG – tenia giacomini; U – uncus Obr. 3. Cévní zásobení hipokampálního komplexu vpravo (preparát s cévami barvenými silikonem).
Fig. 3 Vascular supply of the hippocampal complex (dyed silicon perfusion) on the right side.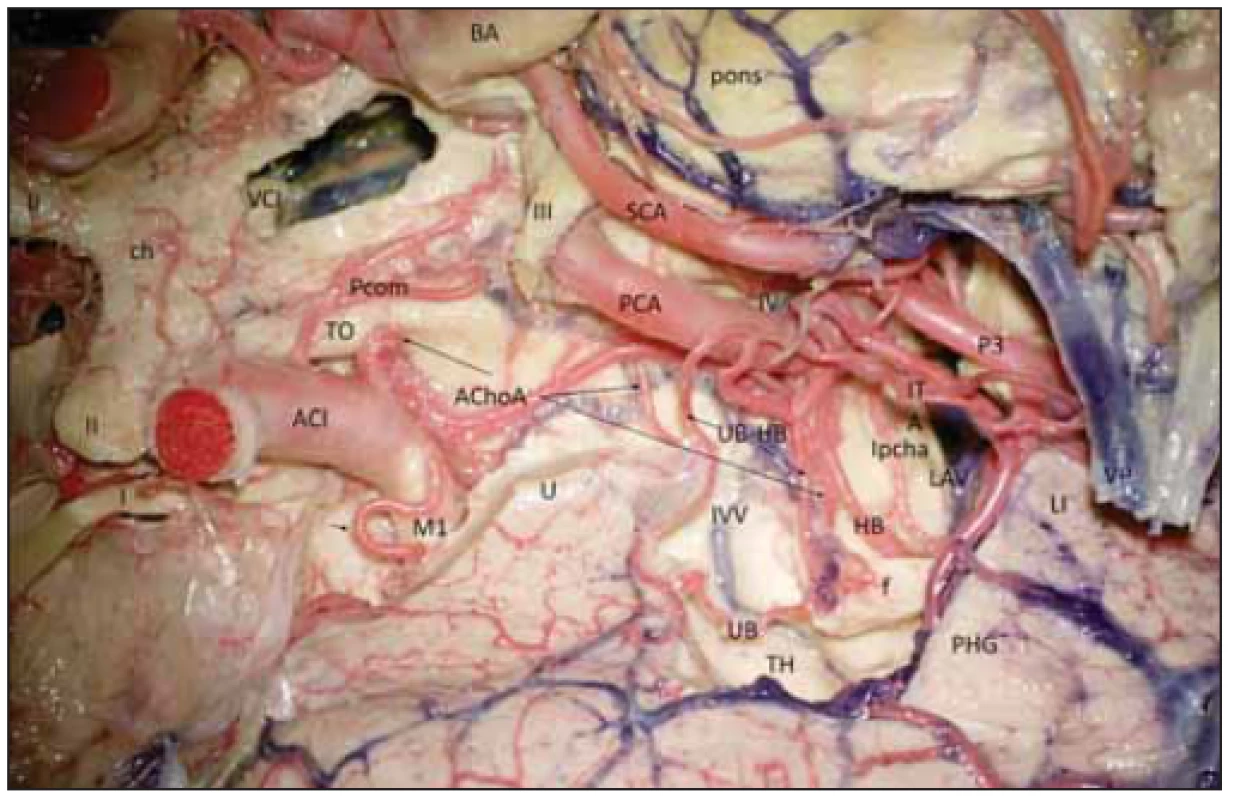
I – tractus olfactorius; II – nervus opticus; III – nervus oculomotorius; IV – nervus trochlearis; ACI – arteria carotis interna; AChoA – arteria choroidea anterior (ramus perforans; uncalis; plexi choroidei); BA – arteria basilaris; f – fornix; HB – arteria hippocampalis media; ch – chiasma; ITA – arteria temporalis inferior; IVV – vena ventriculi interna; LAV – vena atrii lateralis; LI – gyrus lingualis; lpcha – arteria choroidea posterolateralis; M1 – arteria cerebri media – M1 segment; P3 – arteria cerebri posterior – P3 segment; PCA – arteria cerebri posterior; PCom – arteria communicans posterior; PHG – gyrus parahippocampalis; pons – pons; SCA – arteria cerebelli superior; TH – pars temporalis ventriculi lateralis; TO – tractus opticus; U – uncus; UB – ramus arteriosus unci; UB-HB – arteria uncohippocampalis (arteria hippocampalis anterior); VCI – vena cerebri interna; VP – vena petrosa I – tractus olfactorius; II – nervus opticus; III – nervus oculomotorius; IV – nervus trochlearis; ACI – arteria carotis interna; AChoA – arteria choroidea anterior (ramus perforans; uncalis; plexi choroidei); BA – arteria basilaris; f – fornix; HB – arteria hippocampalis media; ch – chiasma; ITA – arteria temporalis inferior; IVV – vena ventriculi interna; LAV – vena atrii lateralis; LI – gyrus lingualis; lpcha – arteria choroidea posterolateralis; M1 – arteria cerebri media – M1 segment; P3 – arteria cerebri posterior – P3 segment; PCA – arteria cerebri posterior; PCom – arteria communicans posterior; PHG – gyrus parahippocampalis; pons – pons; SCA – arteria cerebelli superior; TH – pars temporalis ventriculi lateralis; TO – tractus opticus; U – uncus; UB – ramus arteriosus unci; UB-HB – arteria uncohippocampalis (arteria hippocampalis anterior); VCI – vena cerebri interna; VP – vena petrosa Gyrus dentatus je zapojen v Papezově limbickém okruhu (obr. 2B), jehož součástí je podkorový eferent hipokampální formace – fimbria fornicis a dále vlastní fornix, mířící do corpus mammilare. Během disekce jsme zaznamenali commissuru fornicis (lyra Davidis) pod rozhraním spodní plochy splenia a corporis callosi.
Histologie a funkční zapojení
Gyrus dentatus je třívrstevným archikortexem, na povrchu je stratum moleculare s řídce rozprostřenými interneurony, prostřední stratum granulare obsahuje projekční, hustě uspořádané granulární neurony, jejichž nemyelinizovaná mechová vlákna směřují do CA3, a v hloubce je stratum polymorfum s interneurony. GD je zapojen v Andersonově vnitřním hipokampálním okruhu (entorhinální kůra – GD – cornu ammonis – subiculum – entorhinální kůra), který zpracovává signály z entorhinální kůry a využívá je k paměťovým funkcím a prostorové paměti [2]. Granulární buňky mají nízkou a nepravidelnou spontánní aktivitu a představují filtr pro přenos signálů z entorhinální kůry do vlastního hipokampu. Signály procházejí přes GD pouze jednosměrně, není z něj zpětná projekce do entorhinální kůry. Z poměrně malé entorhinální kůry jdou signály perforující drahou do poměrně velkého GD, což zvyšuje rozdíly mezi podobnými signály a snižuje možnost překrývání signálů v GD. Granulární buňky nejsou na rozdíl od pyramidových buněk cornu ammonis vzájemně propojeny a vysílají objemná mechová vlákna k dendritům pyramidových buněk CA3. Zde dochází k formování a ukládání epizodické paměti. Pyramidové buňky CA3 jsou vzájemně propojeny kolaterálami (autoasociační síť) a končí u nich i asociační a komisurální vlákna. Proto lze v CA3 oblasti vybavit paměťový záznam i z jeho pouhého fragmentu. CA3 oblast pomocí Schafferových kolaterál projikuje do CA1 oblasti obsahující dvojnásobek neuronů než CA1, což zamezí ztrátě informace a omezí informační šum. Z CA1 oblasti pokračuje informace do subicula, z něj zpět do entorhinální kůry, odkud putuje do asociačních oblastí neokortexu. Projekce ze subicula a cornu ammonis slouží k ukládání vzpomínek do dlouhodobé paměti a k jejich vybavování. Subiculum je hlavním eferentem hipokampální formace, projikuje jednak do kůry (entorhinální, prefrontální, perirhinální, retrospleniální a parahipokampální), ale také fornixem do podkorových struktur (Papezův okruh). Subiculum zesiluje signály přicházející z CA1 a dostává i signály z povrchových vrstev entorhinální kůry a z perirhinální kůry [3]. Hipokampální formace i jádra amygdaly jsou vzájemně propojeny a mají reciproční spoje s kůrou (hipokampus hlavně s temporální, amygdala s prefrontální), integrují široké vstupy z kůry do svých okruhů [4]. Amygdala detekuje emočně významné podněty, zpracovává je a automaticky spouští odpovědi na ně (ventrální systém zpracování emocí). Přes spoje do entorhinální kůry a gyrus parahippocampalis ovlivňuje hipokampální formaci, která je spolu s gyrus cinguli a prefrontální kůrou součástí dorsálního systému regulujícího emoční odpovědi. [5]. Čichové podněty přicházející z perirhinální kůry ovlivňují přímo kortikální jádro amygdaly a s přepojením v entorhinální kůře i hipokampální formaci. Početné spoje z hipokampální formace do amygdaly způsobují emoční změny při vzpomínání na emočně vypjaté okamžiky.
Pohled neurochirurga
Pro neurochirurga je důležité pochopit, že při hipokampektomii odpojuje fimbrii fornicis, GD, cornu ammonis a gyrus parahippocampalis. Musí se vypořádat i s cévním zásobením celého komplexu. To je realizováno jednak unkální arterií vbíhající do unkálního sulku, kde se nachází i tenia Giacomini. Unkální arterie může odstupovat z M1 segmentu arteria cerebri media a nesmí zde být zaměněna s laterálním lentikulostriatálním perforátorem, dále pravidelně odstupuje z arteria choroidea anterior, ze které časně odstupuje jednak rostrální větev, ta zásobuje rostrální část uncu, a dále distálněji (někdy relativně silná) kaudální unkální větev vstupující do přední části unkálního sulku, ta zásobuje část amygdaly, a zejména přední část hipokampálního komplexu, proto se nazývá unko-hipokampální arterií. Unkální arterie může také někdy odstupovat z přední hipokampální arterie. Hipokampální arterie jsou tři, odstupují z kmene P2 nebo temporálních arterií. Přední hipokampální arterie směřuje z druhé strany k unkální arterii v posteriorní části unkálního sulku, další její větvičky směřují i posteriorně do fimbriodentátního sulku. Střední hipokampální arterie může odstupovat společně s přední a směřuje ke GD, přičemž silnější vstupuje nad subiculem do hipokampálního sulku, který je zde již hlavním vstupem cévní arteriální sítě. Zadní hipokampální arterie je přítomna prakticky vždy, odstupuje z kmene P2, ale ve 35,3 % může odstupovat i ze spleniální arterie, zásobuje zadní část gyrus parahippocampalis, caudu hippocampi a posteriorní část GD. Dalšími větvemi zásobujícími hipokampální komplex jsou parahipokampální arterie směřující do collaterálního sulku, ty odstupují buď z kmene P2 (41,1 %), nebo z jeho větví: z přední, střední a nejméně často ze zadní temporální arterie (11,8 %). Varietou je společná temporální arterie a pak mohou odstupovat z ní. Parahipokampální arterie ale mohou odstupovat i z hipokampálních arterií, pak se nazývají hipokampo-parahipokampálními arteriemi. Toto uspořádání je nejméně časté v oblasti zadní hipokampální arterie, zde obě větévky častěji odstupují každá zvlášť [6]. Arterie hipokampálního komplexu spolu však bohatě anastomozují (obr. 3), neurony CA1 jsou totiž velice citlivé k hypoxii.
Pohled neurologa
Z funkčního hlediska se hipokampus podílí na vyšších mozkových funkcích, jako jsou učení, paměť a prostorová orientace. GD funguje jako vstupní oblast hipokampu, můžeme ho chápat jako preprocesor přicházející informace. Animální studie odhalily mnohé senzorické vstupy do GD vč. vestibulárních, čichových, zrakových, sluchových, somatosenzorických a dalších [7].
Klinický pohled nám může pomoci dotvořit si představu o funkci GD, jenž je předmětem zájmu mnoha odvětví neurologie a psychiatrie. Je známo, že u Alzheimerovy choroby dochází k atrofii hipokampu [8]. Zaměřením se i na jednotlivé podoblasti hipokampu lze zjistit signifikantní zmenšení objemu GD u Alzheimerovy choroby oproti zdravým kontrolám. Histologicky jsou v této oblasti depozita tau proteinu nejen v neuronech, ale i extraneuronálně v hilárních astrocytech [9]. Nedávno bylo nově popsáno neurodegenerativní onemocnění klinicky připomínající Alzheimerovu chorobu – LATE (limbic-predominant age-related TDP-43 encephalopathy), u něhož dochází k depozitům TDP-43 proteinu dominantně v limbické oblasti, amygdale, entorhinálním kortexu a v hipokampu (GD) [10]. Velká pozornost je věnována dalšímu neurodegenerativnímu onemocnění – primární progresivní afázii a jejím variantám: nonfluentní/agramatické, sémantické, logopenické a primární progresivní apraxii řeči. Mezi těmito je v popředí našeho zájmu sémantická varianta, neboť na MR je nápadná asymetrická temporální atrofie, u které lze i v brzkých stadiích onemocnění rozeznat atrofii oblastí hipokampu vč. GD [11]. Histologicky lze u tohoto onemocnění v GD prokázat depozita proteinu TDP-43 [12].
V epileptologii je GD předmětem zájmu u temporální epilepsie a meziotemporální sklerózy, a to zejména selektivní vulnerabilita neuronů v této oblasti. Je usuzováno, že granulární buňky GD mohou fungovat jako jakýsi „detonátor“ a svou mohutnou excitací CA3 generovat záchvaty [13].
V psychiatrii je GD studován v souvislosti s depresemi, zajímavostí je zvětšení objemu GD po elektrokonvulzivní terapii. Větší objem gyru dle studie uvedené v časopise Nature navíc souvisí s poklesem skóre ve škálách deprese [14]. Volumetrické změny GD a cornu ammonis byly pozorovány i u schizofrenie [15].
Závěr
Gyrus dentatus je nesporně zajímavou anatomickou strukturou mediotemporální oblasti mozku s četnými funkčními zapojeními a velkým klinickým významem, jež je stále předmětem vědeckého bádání mnoha oblastí neurověd.
Grantová podpora
Tato práce byla částečně podpořena vnitřním granty KZ. a. s. IGA-KZ-2020-1-20 a IG8 – 217112009.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Robert Bartoš, Ph.D.
Neurochirurgická klinika
Univerzity J. E. Purkyně
Masarykova nemocnice, KZ a.s.
Sociální péče 3316/12A
400 11 Ústí nad Labeme-mail: robert.bartos@kzcr.eu
Přijato k recenzi: 9. 5. 2022
Přijato do tisku: 15. 9. 2022
Zdroje
1. Eriksson P, Perfilieva E, Björk-Eriksson T et al. Neurogenesis in the adult human hippocampus. Nat Med 1998; 4 (11): 1313–1317. doi: 10.1038/3305.
2. Grim M, Druga R. Základy anatomie 4a. Centrální nervový systém. Praha: Galén 2020.
3. Amaral DG, Scharfman HE, Lavenex P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Prog Brain Res 2007; 163 : 3–22. doi: 10.1016/S0079-6123 (07) 63001-5.
4. Mégevand P, Groppe DM, Bickel S et al. The hippocampus and amygdala are integrators of neocortical influence: a corticocortical evoked potential study. Brain Connect 2017; 7 (10): 648–660. doi: 10.1089/brain. 2017.0527.
5. Phillips ML, Drevets WC, Rauch SL et al. Neurobiology of emotion perception I: the neural basis of normal emotion perception. Biol Psychiatry 2003; 54 (5): 504–514. doi: 10.1016/s0006-3223 (03) 00168-9.
6. Marinković S, De Divitiis O, Nikodijević I. Arteries of the brain and spinal cord: anatomic features and clinical significance. Avellino: De Angelis 1997.
7. Peter J, Lisman J. Structure, function, and plasticity of hippocampal dentate gyrus microcircuits. Front Neural Circuits 2014; 8 : 107. doi: 10.3389/fncir.2014.00107.
8. Rusina R, Matěj R. Neurodegenerativní onemocnění. Praha: Mladá fronta 2019 : 136–137.
9. Kevin R, Steullet P, Pachoud M et al. Tau accumulation in astrocytes of the dentate gyrus induces neuronal dysfunction and memory deficits in Alzheimer’s disease. Nat Neurosci 2020; 23 (12): 1567–1579. doi: 10.1038/s41593-020-00728-x.
10. Nelson PT, Dickson DW, Trojanowski JQ et al. Limbic-predominant age-related TDP-43 encephalopathy (LATE): consensus working group report. Brain 2019; 142 (6): 1503–1527. doi: 10.1093/brain/awz099.
11. Bocchetta M, Iglesias JE, Russell LL et al. Segmentation of medial temporal subregions reveals early right-sided involvement in semantic variant PPA. Alzheimers Res Ther 2019; 11 (1): 41. doi: 10.1186/s13195-019-0489-9.
12. Hodges JR, Mitchell J, Dawson K et al. Semantic dementia: demography, familial factors and survival in a consecutive series of 100 cases. Brain 2010; 133 (1): 300–306. doi: 10.1093/brain/awp248.
13. Scharfman HE. The dentate gyrus and temporal lobe epilepsy: an „exciting“ era. Epilepsy Curr 2019; 19 (4): 249–255. doi: 10.1177/1535759719855952.
14. Nuninga JO, Mandl RCW, Boks MP et al. Volume increase in the dentate gyrus after electroconvulsive therapy in depressed patients as measured with 7T. Mol Psychiatry 2020; 25 (7): 1559–1568. doi: 10.1038/s41380-019-03 92-6.
15. Soichiro N, Turner JA, Calhoun VD et al. Dentate gyrus volume deficit in schizophrenia. Psychol Med 2020; 50 (8): 1267–1277. doi: 10.1017/S0033291719001144.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2022 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Onemocnění bederní páteře – nová neurologická nemoc z povolání
- Karotický web
- Vývoj elektronického testu paměti pro starší osoby (ALBAV)
- Vlastnosti mikroflóry a rizikové faktory infekcí dolních cest dýchacích u pacientů se závažným kraniocerebrálním poraněním na jednotce intenzivní péče
- Výsledky rekonstrukčních operací lícního nervu
- Účinek sumatriptanu po simulovaném traumatickém poranění mozku u potkanů
- Supracerebellární transtentoriální přístup
- Gyrus dentatus – anatomie, cévní zásobení, funkce a neuropatologie
- Počítačově modelovaná kranioplastika z porózního polyethylenu v rizikovém terénu
- Kombinace Bickerstaffovy kmenové encefalitis se syndromem Guillain-Barrého
- Cenobamát
- Zemřel MUDr. Jan Pařízek
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Onemocnění bederní páteře – nová neurologická nemoc z povolání
- Cenobamát
- Výsledky rekonstrukčních operací lícního nervu
- Karotický web
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



