-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Frontotemporální demence
Frontotemporal dementia
This minimonography presents a comprehensive view of frontotemporal dementia. The behavioral variant of frontotemporal dementia (bvFTD) is a clinical syndrome within the spectrum of frontotemporal lobar degenerations. Typical manifestations of bvFTD include early behavioral disturbance, personality changes, cognitive deficits with a dominant impairment of executive functions, and language impairment. MRI typically shows asymmetric atrophy with frontal lobe predominance. The underlying neuropathology is in up to one half of the cases of a tauopathy, while the most frequent tau negative inclusions are TDP-43 protein deposits. Many patients with amyotrophic lateral sclerosis may develop cognitive and behavioral manifestation similar to bvFTD; these disorders have recently been called amyotrophic lateral sclerosis – frontotemporal spectrum disorder. In conclusion, the most important differential diagnose are discussed: frontal variant of Alzheimer’s disease and psychiatric disorders mimicking bvFTD.
Keywords:
Frontotemporal dementia – frontotemporal lobar degeneration – Alzheimer’s disease – behavioral variant of frontotemporal dementia – Pick’s disease – tauopathy – TDP-43 proteinopathy
Autoři: R. Rusina 1; R. Matěj 2; Z. Cséfalvay 3; J. Keller 4; V. Franková 5; M. Vyhnálek 6,7
Působiště autorů: Neurologická klinika 3. LF UK a Fakultní Thomayerova nemocnice, Praha 1; Ústav patologie a molekulární medicíny, 3. LF UK a Fakultní Thomayerova nemocnice, Praha 2; Katedra logopedie, Komenského Univerzita, Bratislava, Slovensko 3; Neurologická klinika, 3. LF UK a FN Královské Vinohrady, Praha 4; Psychiatrická nemocnice v Dobřanech 5; Neurologická klinika 2. LF UK a FN Motol, Praha 6; Mezinárodní centrum klinického výzkumu, FN u sv. Anny, Brno 7
Vyšlo v časopise: Cesk Slov Neurol N 2021; 84/117(1): 9-29
Kategorie: Minimonografie
doi: https://doi.org/10.48095/cccsnn20219Souhrn
Minimonografie se zabývá komplexním pohledem na frontotemporální demenci. Behaviorální varianta frontotemporální demence (bvFTD) je klinickým syndromem, který patří do skupiny frontotemporálních lobárních degenerací. Typická manifestace bvFTD zahrnuje časné poruchy chování, osobnostní změny, kognitivní deficit s dominantním postižením exekutivních funkcí i řečové postižení. Na MR je typicky asymetrická atrofie s frontální převahou. Základní neuropatologie je až v polovině případů tauopatie, nejčastější tau negativní inkluze jsou depozita proteinu TDP-43. Řada pacientů s amyotrofickou laterální sklerózou má kognitivní a behaviorální postižení nápadně připomínající bvFTD; tyto stavy se nově označují jako frontotemporální spektrum postižení u amyotrofické laterální sklerózy. Závěrem jsou diskutovány i nejvýznamnější diferenciální diagnózy: frontální varianta Alzheimerovy nemoci a některá psychiatrická onemocnění připomínající bvFTD.
Klíčová slova:
frontotemporální demence – frontotemporální lobární degenerace – Alzheimerova nemoc – behaviorální varianta frontotemporální demence – Pickova nemoc – tauopatie – proteinopatie TDP-43
Úvod
Problematika frontotemporální demence (FTD) je poměrně komplikovaná a klinický i neuropatologický pohled se v průběhu posledních desítek let opakovaně výrazně proměnil. Tento přehledový článek se zabývá komplexním pohledem na behaviorální variantu frontotemporální demence (bvFTD) a demenci při onemocnění motorického neuronu. Netradičně, ale z našeho pohledu klinicky relevantně, jsou diskutovány i nejvýznamnější diferenciální diagnózy: frontální varianta Alzheimerovy nemoci (AN) a některá psychiatrická onemocnění připomínající frontální typ demence.
V 90. letech 20. století se mezi FTD řadily i primární progresivní afázie (PPA), v současné době se tato heterogenní skupina neurodegenerací považuje za samostatnou kategorii a v tomto článku nebude detailně diskutována – odkazujeme na recentní minimonografii publikovanou v tomto časopise [1].
Definice a vymezení pojmu: FTD nebo FTLD?
V povědomí odborné veřejnosti mnohdy splývají termíny Pickova nemoc, frontotemporální lobární degenerace (FTLD) a FTD – v poslední době se vžilo přesnější označení behaviorální varianta FTD (bvFTD) – a jejich používání promiscue může komplikovat komunikaci mezi lékaři, kteří nejsou specialisty na kognitivní neurologii nebo neurodegenerativní onemocnění.
Frontotemporální lobární degenerace je klinicky i neuropatologicky heterogenní skupina neurodegenerativních onemocnění definovaných svým neuropatologickým podkladem, s dominujícím postižením frontálního laloku a frontotemporálního pomezí (často ale bývají postiženy i parietální kůra a bazální ganglia). Neuropatologickým podkladem jsou intraneuronální depozita tau proteinu (tauopatie) nebo jiných peptidů (non-tau FTLD), z nichž nejčastěji jde o protein TDP-43 (TAR DNA-binding protein 43; TDP-43 proteinopatie), ubikvitinu, proteinu FUS a dalších. Následně dochází k zániku postižených neuronů a sekundární astroglióze [2–5]. FTLD se klinicky projevují ve třech možných kategoriích:
a) bvFTD – dominuje změna osobnosti a chování, většinou provázená dysexekutivním syndromem (tab. 1) [6];
b) PPA – nově vzniklá a zpočátku izolovaná alterace řeči, která postupně progreduje do obrazu demence – viz recentní minimonografii [1];
c) kombinace demence a poruch hybnosti – extrapyramidové projevy u tauopatií – kortikobazální degenerace (corticobasal degeneration; CBD) a progresivní supranukleární obrna (PSP); nebo onemocnění motorického neuronu u TDP-43 proteinopatií (viz dále) (obr. 1) [7].
Tab. 1. Diagnostická kritéria bvFTD (adaptováno z [6]). ![Diagnostická kritéria bvFTD (adaptováno z [6]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/1986e67efa1b8104dee52eebf524fcf5.png)
1„časný“ znamená přítomnost příznaku v průběhu prvních 3 let onemocnění bvFTD – behaviorální varianta frontotemporální demence Obr. 1. Současná klasifi kace FTLD (vlevo tauopatie, vpravo tau negativní formy; klinické formy jsou horizontálně seskupeny) upraveno dle [7].
Fig. 1. Current classifi cation of FTLD (tauopathies left, tau negative forms right; clinical forms are grouped horizontally (modifi ed from [7]).![Současná klasifi kace FTLD (vlevo tauopatie, vpravo tau negativní formy; klinické
formy jsou horizontálně seskupeny) upraveno dle [7].<br>
Fig. 1. Current classifi cation of FTLD (tauopathies left, tau negative forms right; clinical
forms are grouped horizontally (modifi ed from [7]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b30dbd705ceebd4ef54b85cad42049df.png)
„demence +“ označuje kombinaci demence a poruch hybnosti (především parkinsonismus a/nebo onemocnění motorického neuronu). AGD – demence s argyrofi lními zrny; ALS – amyotrofi cká laterální skleróza; ALS-FTDS – frontotemporální spektrum postižení u ALS; ARTAG – věkově vázaná astrogliální tauopatie; bvFTD – behaviorální varianta frontotemporální demence; CBD – kortikobazální degenerace; CTE – chronická traumatická encefalopatie; FTLD – frontotemporální lobární degenerace; GGT – globulární gliální tauopatie; LATE – onemocnění s depozity TDP-43 v hipokampální a přední temporální krajině; nfvPPA – nonfl uentní/agramatická varianta primární progresivní afázie; PART – primární věkově vázaná tauopatie; PSP – progresivní supranukleární obrna; svPPA – sémantická varianta primární progresivní afázie
“demence +” indicates combined dementia and movement disorder (primarily parkinsonism and/or motor neuron disease). AGD – argyrophilic grain disease; ALS – amyotrophic lateral sclerosis; ALS-FTSD – amyotrophic lateral sclerosis – frontotemporal spectrum disorder; ARTAG – aging-related tau astrogliopathy; bvFTD – behavioral variant of frontotemporal dementia; CBD – corticobasal degeneration; CTE – chronic traumatic encephalopathy; FTLD – frontotemporal lobar degeneration; GGT – globular glial tauopathies with mainly oligodendroglial and astrocytic inclusions; LATE – limbic-predominant age-related TDP-43 encephalopathy; nfvPPA – primary progressive aphasia, non-fl uent/agrammatic variant; PART – primary age-related tauopathy; PSP – progressive supranuclear palsy; svPPA – primary progressive aphasia, semantic variantBehaviorální varianta FTD je klinickým syndromem, nikoli onemocněním, a jedná se de facto o „podmnožinu FTLD“. Typická manifestace bvFTD zahrnuje časné poruchy chování, osobnostní změny a řečové postižení; může být přidružen i parkinsonizmus. Asi polovina případů bvFTD jsou tauopatie, které jsou způsobeny ukládáním hyperfosforylovaného tau proteinu (vč. Pickových tělísek). U druhé poloviny případů bvFTD jsou prokazatelná tau negativní depozita (ubikvitinu, a/nebo TDP-43 proteinu, vzácněji FUS); tato onemocnění mohou být provázena onemocněním motorického neuronu [8].
Amyotrofická laterální skleróza byla dlouho považována za onemocnění výlučně motorického systému. V současné době je už zjevné, že mnoho pacientů s ALS má kognitivní a behaviorální postižení nápadně připomínající bvFTD – tyto stavy se nově označují jako frontotemporální spektrum postižení u ALS (amyotrophic lateral sclerosis – frontotemporal spectrum disorder; ALS-FTSD).
Diferenciálně diagnosticky je od bvFTD nutno odlišit kromě psychiatrických onemocnění i frontální variantu AN, která je lépe terapeuticky ovlivnitelná. U bvFTD byl prokázán nikoli deficit cholinergní (jako u AN), ale zejména úbytek serotoninu s významně sníženou hustotou serotoninových receptorů ve frontální kůře [9].
Mezi jednotlivými formami FTLD existují četné klinické překryvy a přechodné formy. Není výjimkou, že onemocnění pacienta začne pod klinickým obrazem bvFTD a později se přidá kortikobazální syndrom či porucha expresivní složky řeči nebo naopak (ke klinickým obrazům PPA či CBD se přidávají behaviorální příznaky) [10]. Tuto zdánlivě nelogickou heterogenitu pomůže pochopit lokalizační pohled („podle toho, která část mozku je nejvíce postižena numerickou atrofií, se bude odvíjet klinický obraz“).
Historický přehled
Během téměř celého 20. století bylo pro frontální typ neurodegenerativní demence s časnými poruchami chování a řeči běžně používáno označení Pickova nemoc (zvolené podle význačného pražského psychiatra Arnolda Picka).
Pick popsal pacienty s frontálním typem demence a postižením řeči, což je klinicky velmi odlišný obraz od AN. Ve své první kazuistice z roku 1892 popisuje pacienta s progresivní afázií bez přesvědčivých známek demence [11, anglický překlad 12], ale ve své další publikaci již uvádí jasné příklady pacientů s behaviorálními projevy, časnými změnami osobnosti, nápadnými stereotypiemi, desinhibicí, apatií a sníženou slovní produkcí (verbální fluencí), při relativně zachované paměti [13, anglický překlad 14].
Po Arnoldu Pickovi jsou pojmenované zduřelé balonovité neurony s oxyfilním plazmatem, vyplněné kulovitými inkluzemi: Pickovými tělísky (argyrofilní intraneuronální inkluze lokalizované nejčastěji ve fascia dentata a pyramidových neuronech hipokampu). Nicméně jen část pacientů s frontální demencí má v mozku prokazatelné inkluze typu Pickových tělísek, proto je dnes Pickova nemoc diagnózou čistě neuropatologickou.
V 90. letech 20.století bylo jednoznačně prokázáno, že Pickova tělíska jsou podskupinou depozit tau proteinu, která jsou typická třemi opakováními vazebného místa pro mikrotubuly (DR typ 3) [15,16].
Postupně se zjistilo, že depozita tau proteinu mohou vedle obrazu bvFTD vyvolávat i zcela odlišné klinické syndromy (obr. 1), od nonfluentní-agramatické varianty PPA přes CBD, PSP a vzácné jednotky typu demence s argyrofilními zrny až po „nové tauopatie“ (věkově vázaná astrogliální tauopatie, primární věkově vázaná tauopatie, globulární gliální tauopatie), jejichž klinický korelát se teprve hledá [17].
Naopak koncem 90. let 20. století byla u tau negativních bvFTD prokázána pozitivita reakce s protilátkou proti ubikvitinu a bylo zavedeno označení „ubikvitinopatie“ (FTLD-U). Významný byl objev role proteinu TDP-43 v roce 2006, který se ukázal být zásadním u tau negativních bvFTD [18,19].
Klinické manifestace TDP-43 proteinopatií zahrnují vedle bvFTD a ALS-FTSD i jeden ze syndromů PPA (sémantickou variantu) [20]. Nově popsané onemocnění s TDP-43 inkluzemi v temporálním kortexu a hipokampech (limbic-predominant age-related TDP-43 encephalopathy; LATE) se svým klinickým obrazem velmi blíží AN [21].
Behaviorální varianta frontotemporální demence (aneb „Pickova nemoc sensu lato“)
Prevalence bvFTD
Behaviorální varianta FTD zahrnuje asi polovinu případů FTLD [22]. Jedná se o častou příčinu demence ve středním věku a ve věkové skupině 45–65 let je její incidence téměř stejná jako u AN (3,5 případu na 100 000 obyvatel/rok) [23]. Prevalenční studie uvádějí často výrazně vyšší čísla [24]. Medián začátku onemocnění je 58 let [25]; s věkem absolutní incidence stoupá, po 70. roce věku pak opět klesá. Průměrný věk přežití u bvFTD je asi 6 let, což je výrazně více než u ALS-FTSD, ale naopak méně než u PPA [26].
Klinická manifestace bvFTD
Podobně jako u dalších neurodegenerativních onemocnění je pro bvFTD typický nenápadný začátek s postupnou progresí obtíží.
Již v časném stadiu onemocnění je pro bvFTD typická kombinace dvou hlavních okruhů příznaků:
- narušení přiměřeného sociálního chování a emocí (známky desinhibice, ztráta sebekontroly a empatie, nepřítomnost emoční vřelosti a sociálního taktu);
- ztráta motivace rozvíjet dříve běžné činnosti a zájmy (tedy projevy apatie, abulie – ztráty vůle a iniciativy).
Z těchto důvodů je velmi příhodné označení „behaviorální demence“. Tyto příznaky doprovází většinou kognitivní porucha s dominujícím dysexekutivním syndromem (poruchy iniciace, úsudku, schopností abstrakce, plánování a řešení komplexních činností).
Exekutivní funkce úzce anatomicky i funkčně souvisejí zejména s pozorností, která bývá často k exekutivním funkcím přiřazována. Obě funkce bývají mnohdy postiženy společně [27].
Změny osobnosti, poruchy chování a sociální kognice mohou předcházet rozvoji klasického dysexekutivního syndromu a až u poloviny pacientů bývají zpočátku zaměňovány za projevy čistě psychiatrického onemocnění [28,29]. Navíc přítomnost dysexekutivního syndromu není zcela specifická a obdobný kognitivní profil může být i u frontální varianty AN [30].
Častým projevem bvFTD je i postižení řeči, kterého si u svého pacienta povšiml už Pick v roce 1904 [13].
V diagnostických kritériích se zdůrazňuje termín „časný rozvoj příznaků“, který je definován dobou posledních 3 let, a umožňuje tak odlišit počínající bvFTD od již dříve přítomných psychiatrických onemocnění (např. dlouholeté obsedantně-kompulzivní obtíže) nebo celoživotních poruch osobnosti (např. hraniční nebo disociální osobnost) [6]. Praktický klinický přístup nabízí tab. 2.
Tab. 2. Cílené otázky týkající se nově vzniklých obtíží. 
Změny osobnosti a poruchy chování u bvFTD
Změny osobnosti a chování jsou hlavními klinickými příznaky bvFTD, jsou přítomné již v nejčasnějším klinickém stadiu onemocnění. Poruchy chování u bvFTD mohou být heterogenní v závislosti na tom, jaká část frontálního laloku a která hemisféra jsou zasaženy nejvíce.
Desinhibice
Hlavní a pro bvFTD charakteristickou poruchou chování je desinhibice. Projevuje se jako impulzivní či společensky nepřijatelné chování (nerespektování společenských konvencí). Pacienti se nedokáží zorientovat v běžných společenských situacích a adekvátně se zapojit do konverzace. Časté jsou netaktní poznámky, mnohdy se sexuálním podtextem, a dále i nevhodné žertování či smích s přílišnou familiaritou. Důsledkem pak bývá narušení mezilidských vztahů.
V pozdějších stadiích se objevují koprolálie, fyzická agresivita, sexuálně odbržděné chování vůči cizím lidem, bezohlednost při řízení motorových vozidel i v jiných životních situacích. Porucha chování může vyústit až v kriminální činy [31,32]. Na rozdíl od pacientů s poruchou osobnosti ale nemá chování u pacientů s bvFTD za cíl někomu uškodit a je důsledkem nepochopení sociálních norem.
Korelátem desinhibice na morfologických a funkčních zobrazovacích metodách je patologie orbitofrontální a ventromediální kůry a přední části temporálního laloku, zejména vpravo [33–36].
Apatie
Další častou poruchou chování je apatie projevující se pasivitou a ztrátou zájmu. Pacienti s bvFTD mnohdy nejsou schopni začít nějakou činnost a výrazně redukují své aktivity – tráví celé dny doma a ztrácejí zájem o své záliby, koníčky i sociální kontakty.
Na rozdíl od deprese není apatie u bvFTD doprovázena poruchami nálady – „pacienti jsou ve svém nicnedělání spokojeni“. Apatie je častá i u dalších demencí (zejména u demence vaskulární); u bvFTD má však v průměru větší intenzitu [37–39]. Míra apatie koreluje zejména s atrofií a hypofunkcí mediální části frontálního laloku a předního cingula, dále pak i s atrofií dorzolaterální a orbitofrontální kůry [33,35,40].
Ztráta empatie a sociálních vztahů
Jedním z prvních, navíc pro bvFTD velmi specifickým projevem, bývá ztráta empatie – neschopnost vcítit se do druhých lidí a porozumět jejich pocitům [41,42]. Projevuje se jako sebestřednost (egocentrizmus), emoční chlad a nepochopení jednání druhých osob, což vede k časnému zhoršení mezilidských vztahů.
Ztráta empatie bývá dávána do souvislosti zejména s narušením frontotemporálního pomezí vpravo [41,42].
Perseverativní a kompulzivní chování
Perseverace, stereotypní a kompulzivní chování je další z častých rysů bvFTD. Patří sem opakování jednoduchých úkonů či gest, jako např. soustavné poklepávání prsty, mlaskání či jiné pohyby rtů a jednoduché vokalizace. Může jít i o komplexní činnosti, které mají až podobu rituálů vázaných často na hygienu, kontrolu a přepočítávání věcí. Jindy vidíme extrémní lpění na určité (někdy i bizarní) rutině, např. chůze po zcela shodných trasách ve stejnou dobu.
Typickým projevem bvFTD je i tzv. sběratelství, kompulzivní hromadění často bezcenných předmětů (rozbité staré hodinky, barevné kuličky, kelímky od jogurtů apod.).
Perseverace jsou často patrné i v běžné konverzaci, kdy pacienti mají tendenci opakovat jednotlivá slova, věty či myšlenky [43–45].
Strukturální korelát této poruchy zatím není spolehlivě znám.
Hyperoralita
Součástí diagnostických kritérií a důležitou klinickou známkou bvFTD je hyperoralita (abnormní tendence prozkoumávat předměty vkládáním do úst) a změna v jídelních zvyklostech.
Časté jsou zvýšený příjem sladkých potravin, nekontrolované přejídání, stereotypní chování při výběru jídel či při vlastní konzumaci; objevit se může i konzumace nejedlých předmětů (časté zejména u sémantické varianty PPA).
Hyperoralita je asociována zejména s atrofií orbitofrontálního kortexu; na poruchách příjmu potravy se však podílí i temporální kortex a změny bývají prokazovány i v hypotalamu [46–48].
Kognitivní poruchy u bvFTD
Zatímco se časná diagnostika bvFTD opírá zejména o přítomnost typických poruch chování, v pokročilejším stadiu je již vždy detekovatelná kognitivní porucha, která se výrazným způsobem podílí na poruše soběstačnosti.
V kognitivním profilu pacientů s bvFTD dominuje dysexekutivní syndrom, naopak paměť a zrakově-konstruktivní funkce bývají často relativně ušetřeny [49,50].
Typický pacient v časné fázi demence při bvFTD je dobře orientován v čase i v prostoru a dobře si pamatuje recentní události, což kontrastuje s poruchou rozhodování, logického myšlení a společenského chování.
Celkově je však skupina pacientů s bvFTD z hlediska neuropsychologického profilu poměrně heterogenní a vyšetření klasickou neuropsychologickou baterií nemusí odlišit bvFTD od AN ani od postižení psychiatrického [51,52]. Důvody těchto překryvů jsou heterogenita stran topiky postižení u pacientů s bvFTD, vliv exekutivní dysfunkce na špatný výkon v testech zaměřených i na jiné domény a častá koexistence bvFTD patologie s patologií alzheimerovskou. Proto doporučujeme výsledky neuropsychologického vyšetření vždy interpretovat v kontextu všech dalších výsledků a klinických příznaků pacienta. Interpretaci neuropsychologického vyšetření dále pomůže, jestliže si při testování všímáme kvalitativních známek frontálního postižení (stereotypie, utilizační chování, perseverace) [52].
Dysexekutivní syndrom
Termín „exekutivní funkce“ označuje komplexní mozkové procesy umožňující provádění smysluplné činnosti za účelem dosažení cíle: naplánovat a začít konkrétní smysluplnou činnost (iniciace), v činnosti vytrvat (inhibice nedůležitých podnětů), v průběhu činnosti reagovat na změnu podmínek (supervize, seberegulace), činnost včas ukončit (rozhodování) či přerušit a přepnout na nový program (flexibilita).
Součástí exekutivních funkcí je schopnost správného posouzení sociálních situací, logického myšlení (úsudek) a schopnost abstrakce, plánování a řešení problémů (logicky analyzovat komplexní situace). Mezi exekutivní funkce patří i tzv. set shifting – schopnost přepínání mezi několika činnostmi.
Pacienti s bvFTD jsou mentálně rigidní, málo motivovaní, lehce se rozptýlí okolními nevýznamnými podněty a perseverují – nedokáží se odpoutat od jednoho podnětu. Mají tak často výrazné problémy v běžném životě, přestože schopnost orientace v čase i v prostoru bývá zachovaná a epizodická paměť relativně málo postižená.
Klasické neuropsychologické testy exekutivních funkcí testují zejména dorzolaterální prefrontální kortex a jsou málo citlivé k postižení orbitofrontálního kortexu, který je u pacientů s bvFTD často postižen nejdříve a jehož narušení se projevuje zejména poruchami chování [53].
V některých studiích nebyl nápadnější rozdíl v míře exekutivního postižení mezi pacienty s bvFTD a AN, nebo mezi pacienty s bvFTD a pacienty s psychiatrickými onemocněními. Za relativně nejvíce senzitivní a specifické testy frontální dysfunkce u bvFTD jsou považovány testy fonemické slovní produkce (verbální fluence) (tj. schopnost uvést co nejvíce slov začínajících na určité písmeno – např. FAS test) a testy inhibice (např. Stroopův test) [52].
Porucha paměti
U bvFTD dominuje porucha frontálních laloků a jejich okruhů a konvexity temporálního laloku. Poruchy paměti jsou většinou v pozadí a nepřítomnost výrazné amnézie je dokonce obsažena v dřívějších i současných klinických diagnostických kritériích [6,54,55]. Poruchy anterográdní paměti jsou u bvFTD přítomny, avšak většinou jsou překryty výrazným dysexekutivním syndromem a poruchami chování, které dominují klinickému obrazu.
Zajímavé a poměrně charakteristické pro pacienty s bvFTD jsou relativní ušetření rekognice a porucha paměti zdrojové (paměť pro okolnosti a dobu, ze které vzpomínka pochází – porucha tohoto typu paměti má u pacientů s bvFTD za následek četné perseverace – udávání položek z předchozích testů) [55,56].
V poslední době se ukazuje, že většina pacientů s bvFTD má horší výsledky i v testech epizodické paměti, i když jejich výkony většinou bývají lepší než u pacientů s AN. Patologická skóre bývají vysvětlována postižením hipokampu neuropatologickým procesem, kombinací s alzheimerovskou patologií i vlivem pozornosti a strategie na výkon v paměťových testech [52,57–59]. Ke snížení vlivu frontálního laloku na výkon v testech paměti se doporučuje v diferenciální diagnostice AN a bvFTD používat testy s procedurou kontrolovaného ukládání a vybavení s vodítky, kdy pacienti s bvFTD mají často obdobně nízký výkon při volném vybavení, ale na rozdíl od pacientů s AN mají výrazně vyšší účinnost nápovědy [56,60].
Kromě paměti epizodické bývá u bvFTD prokazováno i narušení paměti sémantické, které je jinak nejvýraznější u sémantické varianty PPA. Toto narušení je nejspíše příčinou nízkých skóre v testech pojmenování [51,52].
Narušení zrakově-prostorových funkcí
Zrakově-prostorové funkce jsou relativně ušetřeny, přesto ale pacienti s bvFTD často selhávají v komplexních konstrukčních úkolech, jako je obkreslování složitých figur, a to z důvodu poruchy pozornosti a strategie, které jsou závislé na frontálních lalocích.
Narušení sociálních a emočních vazeb
U velké části bvFTD nelze poruchu fungování v běžném životě vysvětlit postižením klasicky vyšetřovaných kognitivních funkcí ani poruchami chování. Pacienti s bvFTD často dělají špatná rozhodnutí a v běžném životě fungují daleko hůře, než by odpovídalo jejich kognitivnímu postižení. Neorientují se v řadě situací a jednají „asociálně“. Zhoršení vztahů často předchází objektivně detekovatelnému kognitivnímu deficitu.
Tyto obtíže bývají z velké části přisuzovány získanému deficitu v „teorii mysli“, což je schopnost vcítit se do pocitů druhých lidí, porozumět jejich emocím, myšlenkám a přáním [61].
Všechny tyto schopnosti jsou u pacientů s bvFTD postiženy již časně a bývají dávány do souvislosti zejména s postižením pravého předního temporálního laloku a frontální části inzuly [62]. Současně je prokázán i deficit v rozeznávání emocí z tváře, ale i např. z hlasu [63,64]. Kromě problémů s interpretací myšlenek a emocí ostatních je porucha jednání a rozhodování ovlivněna i změněnou citlivostí k odměně [65,66]. Tyto komplexní funkce nejsou v naprosté většině případů zachyceny standardní neuropsychologickou baterií, i když často představují pro okolí větší zátěž než klasická porucha logického uvažování či paměti [67].
Porucha řeči
Poruchy řeči jsou u pacientů s bvFTD velmi časté. Jejich manifestace v klinickém obraze se může lišit kvalitativně (zasaženy jsou různé modality jazyka v expresivní a/nebo impresivní složce, v mluvené i psané formě) nebo kvantitativně (různá míra jazykových deficitů v daném stadiu onemocnění).
Afázie může mít různou tíži a podobu, časté jsou perseverace (opakování slov nebo větných celků a ulpívání na nich), parafázie (deformace slov různého stupně a typu) a poruchy porozumění složitějším větám a souvislostem.
Typický řečový deficit u bvFTD někteří autoři označují spíše jako „změny v řeči“ a zdůrazňují sníženou produkci spontánní řeči, častější stereotypie v odpovědích nebo tendenci opakovat slyšená slova a věty (echolalie) [68]. Způsob komunikace se v průběhu onemocnění mění nejprve ve smyslu „obsahu“ mluveného, což souvisí s behaviorálními změnami (např. nepřiměřené až vulgární vtipkování). Stejně tak reakce na slyšené informace mohou v rámci sociální kognice vyznívat necitlivě nebo nepřiměřeně [69].
Kromě typického narušení jazykových procesů ve smyslu afázie se u některých pacientů s bvFTD vyskytují tzv. motorické poruchy řeči (motor speech disorders), ve smyslu dysartrie nebo apraxie řeči. Tyto poruchy se téměř výhradně vyskytují u pacientů s neuropatologickými změnami v zadní oblasti frontální kůry, inzuly a bazálních ganglií [70].
Pozitivní příznaky u bvFTD
Je prokázáno, že neurodegenerace spojená s bvFTD nemusí vést pouze k funkčnímu zhoršení, ale také k manifestaci nových schopností. Změněná funkce mozku může usnadnit uměleckou tvořivost (mluví se o tzv. paradoxní funkční facilitaci). Je popsáno mnoho kazuistik pacientů s bvFTD, u nichž byla především časná stadia neurodegenerace spojena s výraznou zejména výtvarnou kreativitou, vysvětlovanou kombinací desinhibice a ušetření zrakově-konstruktivních funkcí [71].
Motorické příznaky u bvFTD
Klasický neurologický klinický pohled na poruchy hybnosti a demence vychází ze zhodnocení postižení motorického systému (přítomnost extrapyramidového syndromu nebo příznaky horního či dolního motorického neuronu), skríningového vyšetření kognice a následně z posouzení vzájemného vztahu těchto nálezů. Typické klinické závěry pak jsou např. Parkinsonova nemoc s demencí, syndromy „parkinson plus“ nebo ALS s demencí.
U bvFTD je kombinace s motorickým postižením poměrně častá [72]. Vzhledem k tomu, že asi 50 % případů bvFTD je způsobeno tauopatií (s afinitou k bazálním gangliím) a 50 % případů depozity TDP-43 (s afinitou k pyramidovým buňkám motorické kůry), je nutné po zhodnocení kognitivního a behaviorálního profilu cíleně pátrat po (mnohdy jen diskrétně přítomných) motorických příznacích.
Pacienti s bvFTD na podkladě tauopatie mají často parkinsonské projevy (akineze může převládat nad rigiditou, ale klidový tremor většinou chybí; mohou se objevit i poruchy okulomotoriky). Pacienti s bvFTD na podkladě TDP-43 proteinopatie mohou mít naopak diskrétní projevy onemocnění motorického neuronu (typicky hyperreflexie a ojedinělé fascikulace v proximálních svalech horních končetin nebo ve stehenních svalech, ale svalová síla bývá zachována a EMG nemusí ukázat přesvědčivý nález) [73,74].
Sfinkterové obtíže
Součástí klinického obrazu bvFTD jsou i sfinkterové obtíže. Relativně častá je zejména močová inkontinence, jejíž přítomnost byla dokonce doporučována jako podpůrné diagnostické kritérium FTD [54]. Pilotní studie dávají inkontinenci moči do souvislosti přímo s postižením mikčního centra ve frontálním laloku [75]. Pro bvFTD jsou navíc typické poruchy chování vázané na vyměšování – močení na nevhodných místech nebo lhostejnost k existující poruše vyměšování [54].
Vyšetření kognitivních funkcí u pacientů s bvFTD
Skríning
Tradičně užívaný test Mini-Mental State Examination (MMSE) je velmi málo citlivý k frontální dysfunkci, a proto pacienti v časných stadiích bvFTD v tomto testu mnohdy skórují normálně [22]. Z dalších tradičních kognitivních skríningových testů frontální dysfunkci a bvFTD lépe zachytí test MoCA (Montrealský kognitivní test) nebo ACE-R (Addenbrookský kognitivní test) [76].
K rychlému skríningu postižení frontálních funkcí je někdy doporučován test FAB (Frontal Assessment Battery) dostupný na [77] [78,79]. Celkové skóre v tomto testu však neodliší pacienty s bvFTD od AN a není ověřena senzitivita testu v časných stadiích bvFTD ani v diferenciální diagnostice bvFTD a psychiatrických onemocnění. Při interpretaci výsledků je vhodné test hodnotit kvalitativně, na bvFTD by mohla poukazovat zejména porucha inhibice (go-no-go subtest) a výrazné snížení fonemické slovní produkce [80,81].
Praktický návod ke skríningu u lůžka pacienta shrnuje tab. 3.
Tab. 3. Skríningové vyšetření frontálních funkcí u lůžka. 
Neuropsychologické testy
U bvFTD je v popředí porucha exekutivních funkcí a pozornosti, narušeny jsou strategie i logické myšlení, což ovlivňuje výkon i v testech zaměřených na jiné domény (typicky může ovlivnit výkon při kopii složitějších obrazců, např. Rey-Osterriethovy komplexní figury, což je důsledek poruchy ukládání a vybavování z paměti).
Klasický profil s dominující exekutivní dysfunkcí a relativním ušetřením paměti a zrakově-prostorových funkcí odliší bvFTD od ostatních demencí s více než 90% senzitivitou a 80% specificitou [82].
Nejčastějším testem na hodnocení exekutivních funkcí a řeči zároveň je test slovní produkce [83]. Pacient má za úkol vyjmenovat za minutu co nejvíce prvků dané kategorie (např. zvířata) (sémantická slovní produkce); dále vyjmenovat slova, která začínají na danou hlásku (např. písmeno „n“) (fonemická slovní produkce). Laisney et al zjistili, že pacienti s bvFTD měli lepší výkon v sémantické slovní produkci než pacienti se sémantickou variantou PPA, při fonemickém úkolu se výkonnost obou skupin nelišila [84]. Důvodem je to, že řečový výkon u bvFTD závisí na míře postižení exekutivních funkcí, zatímco u sémantické varianty PPA je výkon limitován narušenou sémantickou pamětí.
Emoční a sociální kognice se v klinické praxi testují zřídka. K vyšetření rozeznávání emocí lze použít test rozeznávání tváří dle Ekmana a Friesena, kde je alterace patrná již v časných stadiích bvFTD [85].
K posouzení sociální kognice byla vyvinuta komplexní baterie sociálních funkcí. Obsahuje např. test vnímání sociálních situací – Faux pas test, kde pacient usuzuje, zda se osoba na obrázku dopustila sociálního faux pas, či test k posouzení komplexního finančního rozhodování – Iowa Gambling Task [86].
Morfologické a funkční zobrazení u bvFTD
Pro bvFTD je charakteristickým nálezem frontotemporální atrofie s předozadním gradientem (tedy relativně menší atrofické změny parietookcipitálně). Tato atrofie je často asymetrická a pro její hodnocení lze využít koronární T2 vážené obrazy či rekonstrukci z 3D T1 vážených dat (obr. 2).
Obr. 2. MR a neuropatologie u behaviorální varianty frontotemporální demence.
Fig. 2. MRi and neuropathology in the behavioral variant of frontotemporal dementia.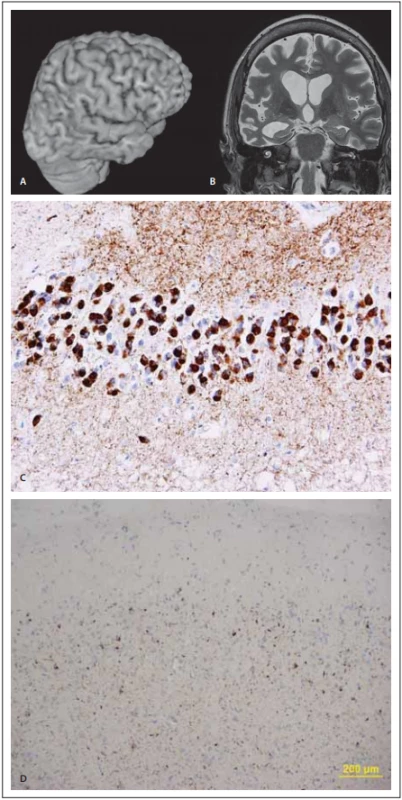
(A) Pohled na pravou hemisféru pomocí 3D rekonstrukce z T1 váženého 3D obrazu o izotropním rozlišení 0,7 mm (Siemens Skyra 3T, Erlangen, Německo). (B) Koronární řez skloněný podle dlouhé osy hipokampů; na obou obrazech je patrná nápadná asymetrická atrofie frontálně, na 3D rekonstrukci navíc temporopolárně, na koronárním řezu dále i atrofie pravého hipokampu a přilehlé části temporálního laloku. (C) Pickovy inkluze v hipokampální formaci v imunohistochemické reakci s monoklonální protilátkou proti hyperfosforylované formě tau proteinu u Pickovy nemoci. Originální zvětšení 400×. (D) Tenké a dlouhé neurity spolu s globulárními inkluzemi v cytoplasmě neuronů frontální kůry s predominantním postižením 2. a 3. vrstvy u behaviorální varianty frontotemporální demence v imunohistochemické reakci s monoklonální protilátkou proti hyperfosforylované formě proteinu TDP-43. Originální zvětšení 100×.
(A) View of the right hemisphere using 3D reconstruction from T1-weighted 3D images with isotropic discrimination 0.7 mm (Siemens Skyra 3T, Erlangen, Germany). (B) Coronal slice based on the following long axis of the hippocampi; on both images, marked asymmetry in frontal atrophy is evident, and on 3D reconstructions, there is also atrophy of the right hippocampus in the temporopolar regions on coronal slices and adjacent parts of the temporal lobe. (C) Pick’s inclusions in the hippocampal area in the immunohistochemical reaction with monoclonal antibodies against the hyperphosphorylated form of tau protein in Pick’s disease. Original magnifi cation 400×. (D) Long and thin neurites and globular inclusions in the cytoplasm of frontal cortex neurons with predominant involvement of the 2nd and the 3rd layer in the behavioral variant of frontotemporal dementia in the immunohistochemical reaction with monoclonal antibodies against the hyperphosphorylated form of TDP-43 protein. Original magnifi cation 100×.T2 vážené obrazy spolu s obrazy FLAIR (fluid attenuated inversion recovery) slouží nejen ke zhodnocení rozsahu případné vaskulární komorbidity, ale mohou odhalit i okrsky subkortikálních změn, které byly popsány u patologicky potvrzených pacientů s bvFTD. Jako časná známka této choroby se popisuje atrofie orbitofrontálního kortexu, kterou následuje atrofie interhemisferálního kortexu meziofrontálního a ještě později dorzolaterální prefontální kůry.
Do obrazu patří i atrofie amygdaly a hipokampu, které též sledují předozadní gradient. Amygdala tedy bývá více postižená než hipokampus, jehož zadní část nemusí atrofii vykazovat vůbec [87].
Obraz asymetrické atrofie mívá převahu vpravo (obr. 2), čímž se liší od klasické sémantické varianty PPA, svPPA (ta ovšem existuje i v pravostranné formě, což znemožňuje rozlišení čistě na základě grafického nálezu). Je popisována hypoperfuze frontálně a temporálně, což lze prokázat pomocí PET ev. perfuzního zobrazení MR. Hypoperfundovaná oblast je součástí salientní sítě, jejíž sníženou aktivaci může ukázat klidová funkční MR (která však v současné době nepatří mezi rutinní, ale pouze experimentální metody).
Genetika bvFTD
Dědičné formy FTLD vč. bvFTD jsou relativně časté (až 30–50 % má známou rodinnou predispozici s postižením některého z příbuzných, mnohdy prvního stupně příbuzenství), s převážně autozomálně-dominantním typem dědičnosti a různým – většinou neznámým – stupněm penetrance [88,89].
V případě tauopatií byly nalezeny kauzální mutace v genu pro tau protein (gen MAPT), který se nalézá na dlouhém raménku chromozomu 17 (familiární tauopatie, demence frontálního typu s parkinsonizmem s mutací v genu MAPT), či genu pro preseniliny, které jsou zodpovědné za autozomálně dominantní formy AN, ale mohou způsobovat i bvFTD (geny PSEN1 a PSEN2). Tyto případy jsou spojeny s histopatologickým nálezem tau-pozitivních intraneuronálních inkluzí (často charakteru Pickových tělísek a jim podobných struktur) a klinicky s behaviorálními poruchami, extrapyramidovým postižením a častými psychotickými příznaky.
V rámci non-tau FTLD byly popsány mutace v genu pro protein TDP-43 (TARDBP), v genu pro progranulin (GRN), vzácněji i v genech pro valosin obsahující peptid (VCP), chromatin modifikující protein 2B (CHMP2B), FUS protein (fused in sarcoma) (FUS), izoformu 5A těžkého řetězce kinesinu (KIF5A), sekvestozom 1 (SQSTM1), TANK vážící kinázu 1 (TBK1), ubikvilin 2 (UBQLN2) a další, vyskytující se vzácně. Recentně objevená mutace v otevřeném čtecím rámci číslo 72 na 9. chromozomu (c9orf72) je také poměrně častá u familiárních forem bvFTD (11,7 %), především ale představuje velmi častou kauzální mutaci dědičných i sporadických forem ALS, to zejména u případů asociovaných s demencí frontotemporálního typu (FTLD-MND) [90]
Zajímavé je, že stejná mutace se v rámci postižené rodiny může projevovat různými, často zcela odlišnými klinickými symptomy (např. část rodiny trpí především onemocněním ze skupiny MND a druhá část je postižena dominantně bvFTD), což zřejmě souvisí s přítomností dalších modifikujících polymorfizmů v jiných genech [91].
Indikace molekulárně-genetického vyšetření je úzce spojena s podrobným klinicko-genetickým vyšetřením a odběr podrobné rodinné anamnézy je velmi důležitý. Rutinní stanovování genetických změn není v současné době přínosné, je však velmi důležité v případech prokázané genetické rodinné zátěže, atypického klinického průběhu a symptomatologie či atypických nálezů při neuropatologickém vyšetření mozkové tkáně [92].
Neuropatologické nálezy u bvFTD
Neuropatologický nález je charakterizován histomorfologickými změnami, které jsou nejvíce vyjádřeny v kůře konvexity frontálního laloku, někdy nejnápadněji v orbitofrontální kůře, v přední třetině temporálního laloku a v rostrální části gyrus cinguli. Je však možné pozorovat i atrofii parietální kůry.
U některých nemocných, zvláště s nápadnými stereotypiemi chování, se najde nepříliš významné postižení neokortexu; atrofie je výrazná ve striatu, amygdale a hipokampu.
Z novějších studií je patrné, že FTLD jsou multisystémovým postižením a lokální distribuce neuropatologických změn může výrazně kolísat.
Apatie a abulie jsou spojeny s postižením mediálních frontálních oblastí a předního cingula; desinhibice s atrofií orbitofrontální kůry a dysexekutivní syndrom s akcentací změn v dorzolaterálním frontálním závitu. Hyperoralita vzniká nejspíše na podkladě lézí inzuly a hypotalamu, u kompulzivity jsou změny ventrálního striata a palida, u ztráty empatie patologie předního temporálního laloku a inzuly. Sémantická porucha řeči souvisí se změnami temporálního pólu dominantní hemisféry, porucha paměti s lézí hipokampů a entorhinální kůry. V některých případech mohou být rovněž narušeny extrapyramidový systém (substantia nigra, striatum) a motorická kůra, což se projeví parkinsonizmem, resp. pyramidovými projevy.
Mikroskopicky je dominující změnou úbytek počtu neuronů (numerická atrofie) se sekundární (reaktivní) astrogliózou. U pokročilých forem je patrná charakteristická vakuolizace ve II. a III. vrstvě kortexu, která může imponovat jako spongiformní dystrofie u prionových onemocnění, s níž ale nesmí být zaměněna.
Diagnostická je přítomnost specifických inkluzí různých typů jak v neuronálních elementech (v perikariu i ve výběžcích), tak i v gliích, které jsou pozitivní na imunohistochemicky prokazatelné hyperfosforylované formy tau proteinu u tauopatií. V jiných případech můžeme zastihnout imunohistochemickou pozitivitu v reakci s protilátkou proti proteinu TDP-43 u TDP-43 proteinopatií (FTLD-TDP), proti depozitům ubikvitinu (ubikvitinopatie – FTLD-U) nebo proti dalším méně častým proteinům (např. FTLD-FUS).
Do objevu specifických proteinových molekul a možnosti jejich detekce byly případy bez nálezu specifických patognomonických inkluzí nazývány demencí bez histologického podkladu (dementia lacking distinct histology; DLDH). Diagnóza DLDH stále ještě existuje, je však rezervována pro zcela ojedinělé případy, kdy na objev patogenního peptidu v inkluzích stále ještě čekáme [3,19,93].
Terapie
Farmakoterapie bvFTD je symptomatická, cílená především na behaviorální příznaky a vychází z výsledků menších randomizovaných studií a klinických zkušeností. U bvFTD byl prokázán úbytek především serotonergních, méně pak i noradrenergních a dopaminergních neuronů.
Inhibitory acetylcholinesterázy nejsou u bvFTD účinné a mohou dokonce zhoršovat některé symptomy (zejména neklid a agitovanost) [94]. Teoretický předpoklad pro použití má memantin, ale ani zde nejsou výsledky studií jednoznačné [7,95]. V případě diferenciálně-diagnostických rozpaků mezi bvFTD a AN je nicméně vhodné nasazení inhibitorů acetylcholinesterázy při sledování efektu a případných nežádoucích účinků.
Menší randomizovaná studie prokázala účinnost trazodonu (300 mg/den) na různé behaviorální projevy bvFTD [96]. Efekt mohou mít i antidepresiva ze skupiny SSRI (selektivní inhibitory zpětného vychytávání serotoninu). S ohledem na minimální riziko lékových interakcí a dobrou toleranci se nejčastěji používají sertralin, citalopram nebo escitalopram (především na hyperoralitu a kompulzivní projevy).
Pokud v klinickém nálezu převažuje apatie a abulie, lze zkusit ovlivnit i noradrenergní systém (např. venlafaxin v dávkách 150 mg denně a vyšších může mít stimulující účinek). Apatii by mohlo zlepšit podávání metylfenidátu – diskutovaný mechanizmus účinku je podpora účinku noradrenalinu a dopaminu ve fronto-striatálních a talamických okruzích, viz recentní studii u pacientů s AN [97].
V případě neklidu, agitovanosti nebo agresivity nasazujeme tiaprid, ev. jiná antipsychotika 2. generace (risperidon, olanzapin, kvetiapin). Dlouhodobé podávání antipsychotik pečlivě zvažujeme z důvodu pravděpodobně zvýšeného rizika kardio - a cerebrovaskulárních onemocnění. Při intoleranci antipsychotik nebo přetrvání závažných poruch chování volíme antiepileptika (většinou valproát) nebo benzodiazepin (např. klonazepam), které ale mohou zhoršovat kognitivní funkce a vést ke zmatenostem, arteriální hypotenzi a poruchám chůze.
Velkým problémem v péči o pacienty s bvFTD je riziko náhlých emočních „bouří“ a obtížně zvladatelných atak kompulzivity s agitovaností a desinhibicí. Pečovatele je v tomto směru nutné edukovat a pro podobné případy mít k dispozici sedativní lék s rychlým nástupem účinku (tiaprid, benzodiazepin).
Důležitou součástí je nefarmakologická intervence, která spočívá ve vhodném přístupu k nemocnému (zjednodušení sociálních interakcí, vyhýbání se komplikovaným denním aktivitám aj.), aktivačních technikách pro maximální uchování stávajících schopností (oblíbené hry, koníčky) a některých behaviorálních technikách k úpravě chování nemocného (hledání a odstraňování příčin chování).
Nutná je i spolupráce s pečujícími rodinnými příslušníky, kterým by měla být poskytnuta dlouhodobá emoční podpora, vč. možností krizové intervence v případě potřeby.
Zásadní pro prevenci syndromu vyhoření (toto riziko je u pečovatelů o pacienty s bvFTD mnohem vyšší než u jiných neurodegenerativních onemocnění) je poskytnout pečujícím komplexní, ale srozumitelné informace o onemocnění, jeho projevech, možnostech léčby a předpokládaném průběhu. Dalším krokem je naučit je základním technikám komunikace s pacientem i zvládání některých behaviorálních manifestací, popř. se pokusit ovlivnit některé psychické problémy pomocí výše uvedené medikace. Citlivá bývá sociálně-právní problematika (řešení držení řidičského průkazu, omezení svéprávnosti aj.).
Rodina by neměla s pacientem zůstávat v izolaci, velmi přínosné jsou v tomto směru různé podpůrné skupiny, pacientská sdružení, asistenční služby, dobrovolníci, aj. Pečujícím by měl zůstat i čas pro sebe (aktivní odpočinek, koníčky, zájmy), důležité je zachování denního rytmu, prevence poruch spánku, udržení sociálních kontaktů s přáteli a známými.
Pokud se nedaří behaviorální projevy zvládat v domácím prostředí, je indikovaná hospitalizace na psychiatrii.
Frontotemporální demence u onemocnění motorického neuronu (aneb ALS a demence)
Motorické projevy jsou u onemocnění motorického neuronu konstantně doprovázeny poruchami kognice a chování různé intenzity. V nových diagnostických kritériích se tyto projevy dělí do čtyř kategorií na základě postižení konkrétní kognitivní oblasti: sociální kognice, řeči, paměti a chování [98]. Tyto projevy jsou důsledkem frontotemporální dysfunkce asociované s ALS a souhrnně se označují jako frontotemporální spektrum postižení u ALS (amyotrophic lateral sclerosis – frontotemporal spectrum disorder; ALS-FTSD) (tab. 4).
Tab. 4. ALS-FTSD kritéria pro diagnózu kognitivních a behaviorálních syndromů přidružených k ALS (upraveno a zjednodušeno dle [98]). ![ALS-FTSD kritéria pro diagnózu kognitivních a behaviorálních syndromů přidružených k ALS (upraveno a zjednodušeno
dle [98]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/9bfc8a65f235a6763e8ae8855a510ffe.png)
* behaviorální/kognitivní projevy bvFTD:
1. Časná behaviorální desinhibice
2. Časná apatie
3. Časná ztráta empatie nebo vřelosti v mezilidských vztazích
4. Časné perseverativní, stereotypní nebo kompulzivně/rituální chování, „sběratelství“
5. Hyperoralita a změny v příjmu potravy
6. Dysexekutivní neuropsychologický profi l
ALS-FTSD – frontotemporální spektrum postižení u amyotrofi cké laterální sklerózy; FTLD-MND – frontotemporální demence s onemocněním motorického neuronuU pacientů s ALS a demencí pravidelně nacházíme pozitivní inkluze TDP-43, proto se v literatuře používalo klinické i neuropatologické označení FTLD-MND-TDP (frontotemporal lobar degeneration with motor neuron disease and TDP-43 positive inclusions). Syndrom demence je obvykle definován jako stav, kdy je závažně narušena kognice a zároveň soběstačnost. V tomto směru se vedly terminologické debaty u ALS s demencí, poněvadž behaviorální forma (ALSbi, viz dále) nemusí v řadě případů splňovat kritéria demence ve smyslu omezení soběstačnosti. Recentně tak byla změněna terminologie z dřívějšího „FTLD-MND“ na novější ALS-FTSD (s důrazem na „spektrum“).
V současné době se tedy termín FTLD-MND-TDP stává označením neuropatologickým, zatímco v klinické praxi se používají jednotlivé subtypy ALS-FTSD (viz dále).
Prevalence ALS-FTSD
Prevalence ALS je 4–8 případů na 100 000 obyvatel, kognitivní deficit postihuje až 50 % nemocných. Míra kognitivního deficitu u ALS je značně heterogenní, zjevnou demenci má asi 15 % ALS pacientů [99].
Klinická manifestace ALS-FTSD
Míra postižení kognice a behaviorálních projevů u ALS je různá, od mírných kognitivních příznaků na hranici normy až po výrazné změny osobnosti a chování v rámci těžkého frontálního syndromu. Kognitivní postižení je častější u bulbární formy ALS.
Demence může předcházet nebo následovat příznaky postižení motorického systému. Pacienti s ALS mohou v průběhu nemoci rozvinout více nebo méně typický obraz bvFTD – a naopak u některých pacientů s bvFTD se časem mohou objevit příznaky onemocnění motorického neuronu (od klinicky nevýznamných fascikulací s hyperreflexií až po obraz zjevné ALS vč. typických EMG projevů). Rozvinutí klinického obrazu ALS a bvFTD současně v jedné době je však velmi neobvyklé [100].
Pacienti s ALS-FTSD mají výrazně horší prognózu a kratší dobu přežití než pacienti s izolovanou ALS nebo bvFTD. Významným nepříznivým prognostickým faktorem jsou poruchy chování a změny osobnosti [98].
Exekutivní funkce a sociální kognice
Jedny z prvních známek počínající deteriorace u ALS-FTSD jsou pokles slovní produkce a zhoršení pozornosti a pracovní paměti (vč. soustředění a psychomotorického tempa). S další progresí nemoci se rozvíjí oslabení plánování, úsudku a set shiftingu a vyskytují se perseverace. Tyto projevy korelují s postižením dorzolaterálního frontálního kortexu a gyrus frontalis inferior [101].
Osobnostní změny a postižení sociální kognice se manifestují narušením kontroly a vnímání emocí (např. ztráta schopnosti detekovat negativní emoce na obrázcích lidských tváří); ztrácí se schopnost empatie a orientace v komplexních sociálních situacích (např. neschopnost detekovat faux pas). Tyto projevy odpovídají predilekčnímu postižení orbitofrontálního a mediálního frontálního kortexu.
Poruchy řeči
Mezi specifické jazykové deficity pacientů s ALS-FTSD se na základě nejnovějších výzkumů uvádějí zejména poruchy v oblasti sémantiky a syntaxe. Narušená sémantika se v řeči projevuje jako anomie (porucha pojmenování) nebo jako porucha porozumění významu slov. Narušené syntaktické procesy se manifestují jako poruchy porozumění řeči na úrovni vět nebo textu. U pacientů s ALS-FTSD je přítomna zejména porucha dekódování syntaktických struktur, tedy porozumění gramaticky složitějším větám [102,103].
Ačkoli se tyto jazykové problémy vyskytují i u pacientů s ALS, jejich stupeň je u pacientů s ALS-FTSD výraznější a častější (např. deficit při porozumění syntaktického dekódování byl detekován u 25 % pacientů s ALS vs. 92,9 % pacientů s ALS-FTSD). Stupeň atrofie v oblasti předního temporálního laloku významně koreluje se sémantickými deficity, zatímco atrofie levé periinzulární oblasti s deficitem syntaktického porozumění. Komunikaci pacientů s ALS-FTSD může kromě uvedených jazykových deficitů samozřejmě výrazně ztěžovat i motorická porucha řeči (dysartrie).
Na pozadí obtíží v produkci řeči jsou tedy kombinace poruch, např. redukované tempo řeči vzniká v důsledku dysartrie, ale i jako důsledek potíží při vyhledávání slov v mentálním lexikonu.
Paměť
Mnestické funkce jsou relativně zachovány, i když výkon může být narušen kvůli deficitu pozornosti. Případné oslabení paměti se týká více výbavnosti než ukládání nových paměťových stop.
Tento profil ale neplatí v případě komorbidity ALS a AN, kde naopak narušení epizodické paměti bývá časným příznakem a lze prokázat hipokampální profil s narušením vštípivosti i výbavnosti, zhoršenou schopnost učení a přítomnost četných intruzí.
Poruchy chování u ALS-FTSD
Nejčastějším behaviorálním projevem ALS-FTSD je apatie postihující až 70 % pacientů. Mezi další příznaky patří desinhibice, egocentrizmus, mentální rigidita, impulzivita, snížení sociální adaptace, ztráta empatie a anosognózie, ztráta náhledu [98].
Subtypy ALS-FTSD
Z klinického pohledu lze rozlišit pět hlavních možných manifestací ALS-FTSD:
- forma s kognitivním postižením (cognitive impairment; ALSci);
- behaviorální forma (behavioral impairment; ALSbi);
- kombinovaná forma s kognitivním a behaviorálním postižením (cognitive and behavioral impairment; ALS-cbi);
- plně rozvinutý obraz bvFTD v kombinaci s ALS (frontotemporal dementia ALS-FTD);
- kombinace ALS a AN.
Celkem snadno lze diagnostikovat ALSci, která se projevuje nápadným dysexekutivním syndromem s výraznou apatií, perseveracemi, postižením úsudku a náhledu a někdy i známkami mírné desinhibice. Neuropsychologické vyšetření prokáže zjevnou kognitivní deterioraci převážně frontálního typu [98].
V klinické praxi bývá naopak velmi obtížné rozpoznat ALSbi. V popředí jsou výrazné poruchy chování a změny osobnosti v souvislosti s narušením sociální kognice. Pacienti se stávají vznětlivými, jsou negativističtí, silně egocentričtí a mění se jejich emoční vnímání i chování s dramatickým zhoršením jejich sociálních a komunikačních dovedností (často potvrzené rodinnými příslušníky až při cíleném dotazování). Přitom tyto projevy typicky kontrastují s jen mírným kognitivním deficitem při standardním neuropsychologickém vyšetření klasických kognitivních domén.
U ALS-FTD převažuje apatie s těžkou anosognózií a poruchami chování – tito pacienti mají projevy identické s plně rozvinutou bvFTD.
Pacienti s komorbidní ALS a AN mají klinický průběh progresivní amnestické demence typické pro AN s časným a výrazným narušením epizodické paměti se zjevnou hipokampální atrofií na MR.
Vyšetření kognitivních funkcí u pacientů s podezřením na ALS-FTSD
Kognitivní vyšetření pacientů s ALS je mnohdy komplikované na provedení a interpretaci z důvodu dysartrie a motorického deficitu. Tomu jsou přizpůsobeny i doporučené baterie. Skríningové vyšetření by mělo zahrnovat zkoušku slovní produkce (verbální fluence). Pro komplexnější skríningové posouzení kognice je v ČR k dispozici validizovaná verze Edinburské kognitivně-behaviorální zkoušky pro amyotrofickou laterální sklerózu (Edinburgh Cognitive and Behavioural ALS Screen; ECAS) [104]. Důležitou součástí vyšetření je rozhovor s pečovatelem zaměřený na změny kognice a chování.
Morfologické a funkční zobrazení u ALS-FTSD
Zatímco u bvFTD bývá obvykle patrná asymetrická zřetelná atrofie, MR obraz u ALS-FTSD může dlouho zůstávat normální. Atrofie, nejlépe patrná v koronární rovině, má své maximum frontálně, s možným přesahem do temporálních laloků [105] (obr. 3).
Obr. 3. MR a neuropatologie u frontotemporální demence s amyotrofi ckou laterální sklerózou.
Fig. 3. MRI and neuropathology in frontotemporal dementia and a myotrophic lateral sclerosis.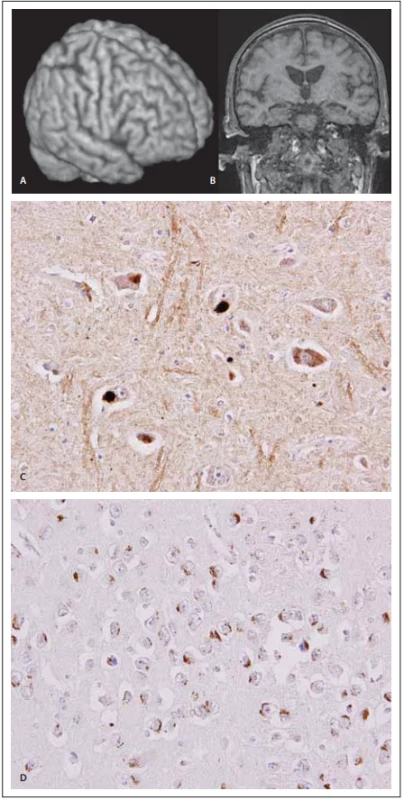
(A) Pohled na pravou hemisféru pomocí 3D rekonstrukce z T1-váženého 3D obrazu o izotropním rozlišení 1 mm (Siemens Avanto 1,5T, Erlangen, Německo) (B) Koronární řez zrekonstruovaný z téhož objemu: mírná frontální atrofie včetně precentrálního gyru (lépe zřetelná na 3D rekonstrukci) je doprovázena jen nevelkou atrofií temporální i v oblasti obou hipokampů. (C) “Lewy-like” a granulární cytoplazmatické inkluze v jádře nervus vagus u onemocnění motorického neuronu v imunohistochemické reakci s monoklonální protilátkou proti hyperfosforylované formě proteinu TDP-43. Originální zvětšení 400×. (D) Různé typy inkluzí v cytoplazmě neuronů hipokampální formace u frontotemporální lobární degenerace s poruchou motorického neuronu v imunohistochemické reakci s monoklonální protilátkou proti hyperfosforylované formě proteinu TDP-43. Originální zvětšení 400×.
(A) View of the right hemisphere using 3D reconstruction from T1-weighted 3D images with isotropic discrimination of 1 mm (Siemens Avanto 1.5T, Erlangen, Germany). (B) Coronal slice reconstructed from the same volume: mild frontal atrophy including the precentral gyrus (more evident in 3D reconstruction) is associated with only mild temporal atrophy in both hippocampal areas. (C) “Lewy-like” and granular cytoplasmic inclusions in nucleus of the vagus nerve in motor neuron disease in the immunohistochemical reaction with monoclonal antibodies against the hyperphosphorylated form of TDP-43 protein. Original magnifi cation 400×. (D) Diff erent types of cytoplasmic inclusions in neurons from the hippocampal formation in frontotemporal lobar degeneration with clinical features of motor neuron disease in the immunohistochemical reaction with monoclonal antibodies against the hyperphosphorylated form of TDP-43 protein. Original magnifi cation 400×.Genetika ALS-FTSD
Nejčastější kauzální mutací dědičných forem ALS (60–70 %) a častou mutací u dědičných forem bvFTD (18 %) je expanze hexarepeatů (GGGGCC) v genu C9orf72. U nositelů mutací C9orf72 existuje mnohem vyšší riziko výskytu kognitivního postižení (40–50 %) než u pacientů bez této mutace (8–9 %). Typickou klinickou manifestací, při níž je vhodné na tuto mutaci pomýšlet, představují pacienti s ALS s psychózou a úplnou absencí náhledu.
V současné době existuje již více než 20 dalších různých genetických změn asociovaných s ALS-FTSD, které se vyskytují u cca 2–6 % postižených. Patogenní mutace byly popsány v genech pro protein TDP-43 (TARDBP), progranulin (PGRN), superoxid dismutázu 1 (SOD1), FUS protein (FUS), izoformu 5A těžkého řetězce kinesinu (KIF5A), dynaktin 1 (DCNT1), matrin 3 (MTR3), optineurin (OPTN), sekvestozom 1 (SQSTM1), TANK vážící kinázu 1 (TBK1), tubulin alfa 4A (TUBA4A), ubikvilin 2 (UBQLN2) a valosin obsahující peptid (VCP) [106,107].
V současné době probíhá v oblasti molekulární neuropatologie dynamický vývoj, který akceptuje teorii, že neurodegenerativní onemocnění podmíněná patologií proteinu TDP-43 jsou obdobnými systémovými onemocněními, jakými jsou synukleinopatie a tauopatie.
Indikace molekulárně-genetického vyšetření předmětných genů je zvažována po podrobném klinicko-genetickém vyšetření s pečlivým odběrem podrobné rodinné anamnézy. Zatím není rutinní testování genetických změn přínosné, je však velmi důležité v případech prokázané genetické rodinné zátěže, atypického klinického průběhu a symptomatologie či atypických nálezů při neuropatologickém vyšetření mozkové tkáně [93].
Neuropatologické nálezy u ALS-FTSD
V regresivně změněných motorických neuronech předních rohů míšních, primární motorické mozkové kůry a v neuronálních strukturách frontálního a temporálního kortexu bývají často přítomné různé typy diagnostických inkluzí, které jsou pozitivní v imunohistochemické reakci s protilátkami proti ubikvitinu a proteinu p62. Většina neuronálních struktur má v cytoplazmě inkluze pozitivní v imunohistochemické reakci s protilátkou proti TDP-43 a zejména s jeho hyperfosforylovanou formou (identické jako se prokazují u ALS bez postižení kognice). Vzácně se u genetických forem nacházejí i inkluze jiných abnormálně změněných proteinů, nejčastěji SOD1 a FUS.
U FTLD-TDP-MND jsou inkluze zastoupeny nejvíce ve frontální a temporální kůře. U ALS se zachovanou kognicí jsou depozita převážně v cytoplazmě motorických neuronů bez postižení kortikálních struktur [108].
Terapie
Farmakoterapie ALS-FTSD je založena na kombinaci léčby onemocnění motorického neuronu (riluzol, podpůrná terapie, rehabilitace, logopedie, zavedení perkutánní endoskopické gastrostomie v indikovaných případech) a terapie bvFTD (serotoninergní medikace, antipsychotika, memantin), v případě komorbidity s AN lze podávat inhibitory acetylcholinesterázy.
Podobně jako u bvFTD na jedné straně a u ALS na straně druhé je důležitou součástí péče i podpora rodiny. Zásadní je včasná diskuze prognostických aspektů, anticipace predikovatelného horšení v čase a hledání takového léčebného postupu, který odpovídá hodnotám a preferencím pacienta a jeho rodiny [109]. Výsledné rozhodnutí pacienta pak může být formulováno v podobě dříve vysloveného přání, které je sepsáno v době, kdy demence již byla diagnostikována, ale míra postižení kognitivních funkcí ještě umožňuje kompetentní rozhodování (pacient se tak vyjadřuje k poskytování zdravotních služeb v budoucnu v době, kdy je k tomu ještě plně způsobilý) [110].
Frontální varianta Alzheimerovy nemoci (aneb „FTD-like demence“)
Do předkládané minimonografie věnované FTD demenci jsme se rozhodli poněkud netradičně začlenit i kapitolu o frontální variantě AN (fvAN), a to ze dvou důvodů:
- fvAN je pravděpodobně výrazně poddiagnostikována, v běžné klinické praxi se na ni mnohdy nemyslí a může být snadno zaměněna za bvFTD;
- správné klinické rozlišení mezi fvAN a bvFTD má přímé dopady na pacienta a jeho rodinu, ať už se jedná o prognostické aspekty, terapeutické přístupy, progresi nemoci v čase, nebo o otázku zátěže pečovatelů a podpory rodiny [111–113].
Typický obraz AN zahrnuje časné a významné postižení epizodické paměti s postupnou alterací dalších kognitivních domén („progresivní amnestická demence“). Vedle této nejčastější formy se vyskytují i formy atypické, a to „vizuální varianta“ (zadní korová atrofie; posterior cortical atrophy), „řečová varianta“ (logopenická varianta PPA) a frontální varianta AN (fvAN) [114]. Neuropatologický rozdíl mezi typickou (amnestickou) formou AN a atypickými variantami spočívá především v odlišné topografii neuronálních depozit tau proteinu a numerické atrofie neuronů (entorhinální a hipokampální distribuce vs. parietookcipitální, perisylviánská, respektive frontální distribuce).
Poprvé popsali fvAN v roce 1999 Johnson et al, kteří ve skupině 63 neuropatologicky potvrzených případů AN nalezli u 19 případů pokročilou neurofibrilární patologii ve frontálním laloku (ve srovnání s obvyklou převahou entorhinálního postižení) [115].
Pacienti s fvAN proto mají řadu behaviorálních projevů (emoční oploštění, narušení sociálních dovedností, desinhibice, stereotypní a perseverativní myšlení), které mohou připomínat klinický obraz bvFTD [116]. Neuropsychiatrické projevy u AN mohou být rozpoznány ještě před rozvojem demence [117].
S určitým zjednodušením lze uvést, že v klinické praxi může být obtížnější rozpoznat fvAN (na kterou se často nemyslí) než bvFTD (která se nabízí jako první u pacientů s frontálním typem demence v nepřítomnosti strukturálních lézí čelního laloku nebo rozsáhlých vaskulárních lézí v bílé hmotě hemisfér). V dalším textu se budeme věnovat srovnání těchto dvou nemocí (souhrnně tab. 5) [118].
Tab. 5. Srovnání fvAN a bvFTD (upraveno a zjednodušeno dle [118]). ![Srovnání fvAN a bvFTD (upraveno a zjednodušeno dle [118]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/d44058415e15d5d26b269196666b882d.png)
bvFTD – behaviorální varianta frontotemporální demence; fvAN – frontální varianta Alzheimerovy nemoci Prevalence fvAN
O prevalenci fvAN nejsou k dispozici přesná data. Některé studie odhadují její četnost na 2–3 % všech případů AN [119]. Ve skutečnosti bude její výskyt jistě mnohem větší, protože alzheimerovská patologie byla zjištěna až u 25 % (sic!) post-mortem vyšetřovaných mozků pacientů s klinickou diagnózou bvFTD [10].
Klinická manifestace fvAN
Klinická diagnóza bvFTD vychází z přítomnosti behaviorálních změn, které předcházejí rozvoji kognitivního deficitu [6]. První manifestace zpravidla zahrnují osobnostní změny a poruchy chování, od apatie přes desinhibici až po ztrátu emoční kontroly, sociální kognice a empatie. Typický dysexekutivní syndrom se rozvíjí až později, s další progresí onemocnění.
Klinický obraz fvAN se zdá být značně heterogenní, nicméně mnohdy lze zachytit časné amnestické období, které předchází rozvoji často výrazného a rychle progredujícího behaviorálního postižení připomínajícího bvFTD. Oproti bvFTD ale u fvAN můžeme zachytit nápadné deficity epizodické paměti a zrakově-prostorových funkcí i v časné fázi onemocnění [116].
Změny osobnosti a poruchy chování
U fvAN jsou osobnostní změny vyjádřeny méně než u bvFTD, sociální interakce jsou přijatelnější a desinhibice bývá mírnější. Důležitým diferenciálně diagnostickým aspektem je absence kompulzivně-perseverativních projevů u fvAN, které jsou pro bvFTD naopak typické („sběratelství“, hyperoralita, hyperfagie, rituální chování) [120].
I u behaviorálních projevů lze nalézt rozdíly mezi oběma nemocemi. Zatímco fvAN je častěji provázena iritabilitou, depresí a emoční labilitou, u bvFTD se typicky setkáváme s emočním útlumem a apatií.
Diferenciálně diagnosticky je užitečné zaměřit se na poruchy příjmu potravy a jídelní zvyklosti. Hyperoralita a hyperfagie s kompulzivními automatizmy a atypické kombinace jídla u bvFTD spolu s nadměrnou preferencí sladkého často vedou k nápadnému přibírání na váze. To kontrastuje s častým hubnutím a anorexií u fvAN. Na rozdíl od fvAN bývá u bvFTD rovněž nápadná ztráta společenských konvencí při stolování (jedení rukama místo příboru, přidávání si na vlastní talíř z talíře spolustolovníka, častá sebestřednost a nejapné vtipkování u stolu apod.).
Exekutivní funkce
Přítomnost nápadných perseverací může bvFTD od fvAN odlišit [25,44,121–123]. Při odlišení obou poruch může pomoci test slovní produkce. Zatímco u fvAN je obvykle více narušena sémantická slovní produkce, u bvFTD je více alterována slovní produkce fonemická [6,49,124,125]. Naopak výkony pacientů s bvFTD jsou sice v některých dalších testech exekutivních funkcí (např. Stroopův test nebo Wisconsinský test třídění karet) patologické, ale neliší se od výkonů pacientů s AN [126].
Poruchy paměti a zrakově-prostorových funkcí
Dobrým diferenciálně diagnostickým vodítkem je nápadnější postižení paměti (zejména epizodické) u fvAN. Pacienti s bvFTD sice zaostávají v paměťových testech ve srovnání se zdravými kontrolami, ale skórují lépe než pacienti s AN [127–129].
Podobný obraz ukazuje i vyšetření zrakově-prostorových funkcí: na rozdíl od fvAN si většina pacientů s bvFTD dlouho zachovává schopnost kopírovat jednoduché kresby a posuzovat prostorové vztahy. To koreluje i s relativně zachovanou schopností navigace v prostoru u bvFTD [130,131].
Poruchy řeči
U pacientů s bvFTD mohou být narušeny „sociálně emocionální“ aspekty řeči spíše než samotný jazyk, a to např. neschopností porozumět souvislostem rozhovorů a emočnímu kontextu. Postupná degradace jazykových funkcí se objevuje až v rozvinuté fázi bvFTD. Naopak u pacientů s fvAN se již v raném stadiu vyskytují obtíže při hledání slov, anomie a sémantické parafázie [131].
Model srovnání fvAN a bvFTD („Hastroš a Plechový drvoštěp“)
Ve své recentní publikaci Sawyer et al nabízejí velmi jednoduché, elegantní a instruktivní srovnání těchto dvou onemocnění na příkladu dvou postav ze slavného románu L. Franka Bauma „Čaroděj ze země Oz“: Hastroš (který je vycpaný slámou a nesmírně si přeje získat rozum) je prototypem fvAN, zatímco Plechový drvoštěp (který je celý z kovu a tolik touží mít srdce) ztělesňuje bvFTD [118,132].
Hastroš nemá rozum; bez mozku má špatné učení i paměť (opakovaně se ptá, jestli to dělá dobře); má depresivní sklony s anorexií (vůbec nepotřebuje jíst) a nízkou váhu; je iritabilní, někdy netrpělivý, má paranoidní percepce (pronásledují ho okřídlené opice); celkově je úzkostný a nejistý, někdy má i přeludy a výbuchy hněvu.
Plechový drvoštěp nemá srdce; chybí mu empatie; má hyperfagii (má mnohem vyšší hmotnost než hastroš); má perseverativní a rituální chování (urputně doplňuje zásoby); projevuje známky kompulzivity; navíc je zarezlý a nepohyblivý (viz parkinsonizmus, který doprovází tauopatie).
Morfologické a funkční zobrazení u bvFTD
Rozeznat obraz fvAN od bvFTD může být obtížné nejen klinicky, ale i radiologicky. Klíčovým vodítkem je distribuce atrofických změn, které v případě fvAN (na rozdíl od bvFTD) vycházejí z perisylvijské oblasti temporálního laloku, což bylo potvrzeno i kvantitativními morfometrickými studiemi [117]. Součástí obrazu fvAN je i vcelku symetrická atrofie hipokampů (obr. 4).
Obr. 4. MR a neuropatologie u frontální varianty Alzheimerovy nemoci.
Fig. 4. MRI and neuropathology in the frontal variant of Alzheimer‘s disease.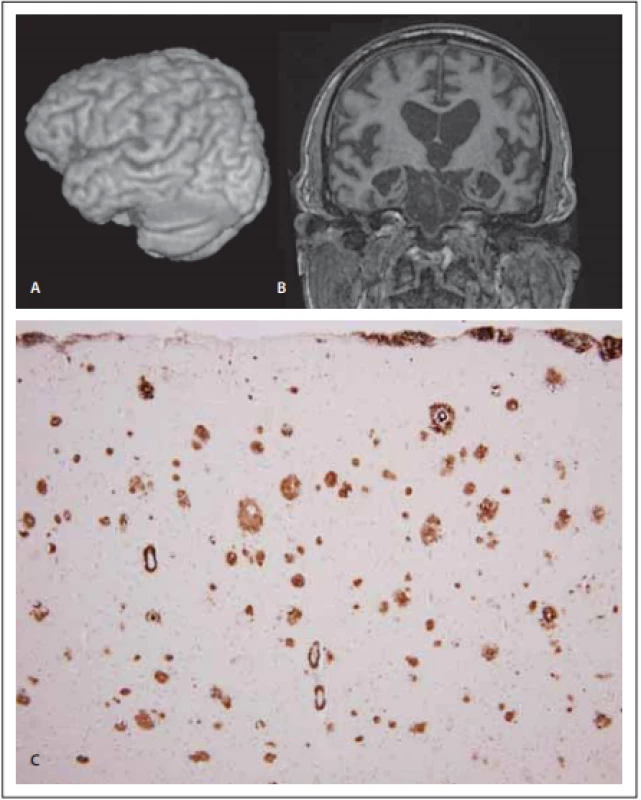
(A) Pohled na levou hemisféru pomocí 3D rekonstrukce z T1-váženého 3D obrazu o izotropním rozlišení 1 mm (Siemens Avanto 1,5T, Erlangen, Německo). (B) Koronární řez zrekonstruovaný z téhož objemu. Atrofi cké změny s maximem v oblasti Sylviovy rýhy postihují především temporální lalok, dále pak zasahují i frontálně a nápadná je i oboustranná atrofi e hipokampů. (C) Senilní amyloidové plaky různých typů v temporální kůře pozitivní v imunohistochemické reakci s protilátkou proti beta-amyloidu. Pozitivita je zřejmá i ve stěnách cév ve formě cerebrální amyloidové angiopatie. Originální zvětšení 100×.
(A) View of the right hemisphere using 3D reconstruction from T1-weighted 3D images with isotropic discrimination of 1 mm (Siemens Avanto 1.5T, Erlangen, Germany). (B) Coronal slice reconstructed from the same volume: Maximal atrophy in the Sylvian fi ssure predominates in the temporal lobe, continues towards frontal regions and bilateral hippocampal atrophy is also noticeable. (C) Senile amyloid plaques with diff erent forms in the temporal cortex that were positive in the immunohistochemical reaction with antibodies against amyloid beta. Positive eff ects are also evident within the vascular wall in the form of cerebral amyloid angiopathy. Original magnifi cation 100×.Na rozdíl od bvFTD nacházíme u fvAN pozitivitu některých biomarkerů (pokles hladiny beta-amyloidu a nárůst hladiny tau proteinu v mozkomíšním moku nebo pozitivitu amyloidového PETu). Hlavním rozdílem na SPECT (PET) jsou chybějící perfuzní (metabolické) změny v parietálním laloku u bvFTD.
Genetika fvAN
Genetika fvAN je obdobná jako u ostatních forem AN, většina případů je sporadická, podmíněna multifaktoriálně. Pouze asi 1 % má autozomálně dominantní dědičnost (např. mutace presenilinu 1 na chromozomu 14, presenilinu 2 na chromozomu 1 a amyloidového prekurzorového proteinu na chromosomu 21) – jde zejména o časné formy AN (nástup příznaků před 65. rokem věku). Avšak i u klasické sporadické formy dosahuje dědičnost téměř 60 %, což je vysvětlováno aditivním efektem řady genetických polymorfizmů a epigenetických faktorů. Z těchto genů má významný vliv gen pro apolipoprotein E, který je umístěn na chromozomu 19. Přítomnost alely E4 významně zvyšuje riziko AN [133].
Poznatků o genech, genových a chromozomálních lokusech asociovaných s AN neustále přibývá. V současnosti již existuje systém řazení AN podle asociace s genetickou poruchou do skupin AN1–AN18. Přehled všech genetických aberací souvisejících s AN je vysoce nad rámec tohoto textu a lze jej dohledat ve volně přístupných databázích (např. Alzforum, Molgen, NCBI).
Neuropatologické nálezy u fvAN
Definitivní diagnóza fvAN je identická jako u běžné AN s tím rozdílem, že některé oblasti mozku jsou postižené depozity patologicky změněných proteinů významněji [134]. V současnosti se vychází ze semikvantitativniho hodnocení přítomnosti neuropatologickych markerů, tedy depozit beta-amyloidu ve formě plak a agregátů hyperfosforylované formy tau proteinu v neurofibrilárních klubkách (tangles) v různých oblastech mozku. Konsenzuální ABC kritéria dle NIA (National Institute of Aging) skórují nálož amyloidu, distribuci depozit tau proteinu podle Braakových a semikvantitativní distribuci neuritických plak dle CERAD (Consortium to Establish a Registry for Alzheimer’s disease) ve stupních 0–3. Výsledkem hodnocení je stupeň pravděpodobnosti (žádná, nízká, střední či vysoká), že klinicky popsaný stav kognitivního deficitu je asociován s AN. Získáme alfanumerické skóre od A0B0C0, kdy nejsou patrné neuropatologické známky alzheimerovských změn, až po nejvyšší A3B3C3, kde jsou neuropatologické změny specifické pro AN vyjádřeny v maximálním rozsahu [134,135].
Samostatnému hodnocení pak ještě podléhají depozita beta-amyloidu v cévních stěnách charakteru cerebrální amyloidové angiopatie, která, je-li pokročile vyvinuta, může významně ovlivňovat klinický obraz kognitivní alterace [136].
Terapie fvAN
Ačkoli u pacientů s fvAN nebyly provedeny randomizované klinické studie s kognitivy, lze předpokládat jejich přínos podobně jako u klasické (amnestické) formy AN.
U bvFTD se terapeutické přístupy liší (viz příslušnou kapitolu).
Ukazuje se tedy, že rozlišování mezi fvAN a bvFTD má v klinické praxi i významný terapeutický dopad – pokud jsou přítomny mnestické obtíže, je podávání kognitiv u fvAN zcela na místě.
Duševní poruchy napodobující frontotemporální demenci (aneb poruchy chování a emocí bez demence)
Symptomy bvFTD jsou podobné symptomům některých duševních poruch a diferenciální diagnostika je často oběma směry obtížná.
Chybou je zejména nerozpoznání duševní poruchy, která může být při vhodné terapii plně nebo částečně reverzibilní; naopak nesprávně diagnostikovaná duševní porucha dává pacientovi s bvFTD i jeho blízkým falešnou naději na příznivou prognózu. Až 50 % pacientů s bvFTD dostane nejprve čistě psychiatrickou diagnózu a trvá průměrně 5–6 let, než se určí organická etiologie potíží [52].
Klíčová je anamnéza poruchy – její začátek, rychlost nástupu příznaků a vývoj. „Velké“ duševní poruchy (schizofrenie, depresivní a bipolární porucha) zpravidla začínají už ve 2.–4. deceniu (výjimkou je unipolární deprese, která může přijít v kterémkoli věku, a pozdní schizofrenie, kde ale převažují bludy a halucinace s menším narušením osobnosti), příznaky se rozvíjejí poměrně rychle, mívají fluktuující průběh a zlepšují se léčbou.
Zobrazovací vyšetření mozku (MR, PET) mohou u schizofrenie i afektivní poruchy vykazovat patologii v předních oblastech mozku, byť v menší míře než u rozvinuté bvFTD [137]. Jednoznačné rozlišení často nepřináší ani podrobné neuropsychologické vyšetření [52] a správnou diagnózu naznačí až dlouhodobější vývoj příznaků.
Někteří autoři navrhují označení „syndrom fenokopie bvFTD“ pro pacienty (častěji muže) s neuropsychiatrickými projevy připomínajícími bvFTD, kteří ale nemají frontotemporální atrofii na MR a/nebo hypometabolizmus na PET a v čase neprogredují do demence [138,139].
Klinické projevy duševních poruch, které napodobují bvFTD
Schizofrenie
Po odeznění akutní fáze schizofrenie, kde převažují pozitivní příznaky (halucinace, bludy), vystupují do popředí příznaky negativní (snížená a otupělá afektivita, pasivita, nedostatek iniciativy, chudá řeč i nonverbální komunikace, zanedbávání zevnějšku a chudé sociální vztahy). Schizofrenii provází i kognitivní deficit (porucha pozornosti, pracovní paměti, exekutivních funkcí), deficit sociální kognice a chybění vhledu. Příznaky připomínají apatické projevy bvFTD.
Zásadní je anamnéza minimálně jedné psychotické epizody (nemusí být ale jednoznačná – nevyhledal psychiatra, nebyla nutná hospitalizace, tzv. „tichý blázen“, „podivín“ apod.; u vzácné simplexní schizofrenie fáze pozitivních příznaků chybí). Důležitý je i údaj o pozitivní rodinné anamnéze schizofrenie.
Bipolární afektivní porucha
V manické epizodě bývají zvýšená sociabilita, elace nálady, desinhibice, zvýšená energie a aktivita, snížená potřeba spánku, přílišná důvěrnost, navazování pochybných kontaktů, žoviálnost, nevhodné vyjadřování velikášských myšlenek, bezstarostné utrácení peněz, neomalené vtipkování a nadměrná konzumace alkoholu, jídla, cigaret aj.
Zvýšená aktivita mívá zpravidla nějaký smysl i emoční prožitek (nadměrné nakupování, účast na akcích bez zohlednění potenciálních rizik aj.), na rozdíl od chování při bvFTD (např. rozebírání funkčních předmětů). Anamnesticky zjišťujeme již dříve proběhlou depresivní nebo manickou epizodu (po 50. roce života vidíme první manickou epizodu vzácně).
Depresivní porucha
U depresivní poruchy mohou být v popředí apatie (neprožívání radosti, emoční plochost, chybění motivace a iniciace smysluplné činnosti, netečnost), ztráta zájmu, obraz depresivní pseudodemence, dysexekutivní syndrom a lhostejnost k péči o sebe – tedy obdobné symptomy jako u bvFTD. Typické jsou prožitek smutné nálady (u deprese se začátkem ve vyšším věku ale může chybět!), pocity viny a bezcennosti, sebevražedné myšlenky. Tím se liší od symptomů bvFTD, kde na cílený dotaz i apatický pacient reaguje, že je šťastný, ev. vyjadřuje lhostejnost či neurčitost.
V anamnéze (osobní i rodinné) častěji nacházíme výskyt afektivní poruchy či sebevražedného jednání.
Nadužívání psychoaktivních látek
Důsledkem nadužívání alkoholu (i jiných psychoaktivních látek) může být reziduální stav charakterizovaný přetrvávajícími změnami kognitivních funkcí (dysexekutivní syndrom, konfabulace), emotivity (lhostejnost k pocitům druhých i okolním událostem), osobnosti (zanedbávání péče o sebe) nebo chování (neomalené vtipkování, vulgarity, zanedbávání povinností aj.). Chybí vhled poruchy, kritičnost, může se objevit paranoidita až bludy [140]. Pro diagnózu je zásadní anamnéza dlouhodobého nadužívání psychoaktivních látek.
Nadužívání alkoholu nebo léků (až stereotypní), které se objeví bez příčiny u pacienta středního a vyššího věku, který dosud podobné sklony neměl, může být prvním příznakem bvFTD!
Poruchy osobnosti
Typické příznaky disociální poruchy osobnosti jsou: nezájem o city druhých, trvalý postoj nezodpovědnosti a bezohlednosti vůči společenským normám, pravidlům a závazkům (např. krádeže, lhaní), neschopnost udržet trvalé vztahy při schopnosti vztahy vytvářet, nízký práh pro uvolnění agrese aj. [140]. Podobnost s příznaky bvFTD je zjevná [6]. U poruchy osobnosti má ale chování většinou nějaký (byť často krátkodobý) účel, např. osobní prospěch či svedení viny na druhé. Přestupky, narušené vztahy a další výše uvedené příznaky se objevují již od školního věku.
U bvFTD jde o změnu osobnosti a chování při předchozím běžném fungování. Patologické chování zde bývá neúčelné, nemocný se nesnaží zakrýt svoji vinu a přijímá ji lhostejně, někdy dokonce se smíchem.
Obsedantně-kompulzivní porucha
Přítomny bývají stereotypní úkony, nutkavé akty nebo rituály spojené s nutkavými (obsedantními) myšlenkami, nepříjemnými pocity, úzkostí a snahou jim odolat. Jejich provedení vede k uvolnění tenze a úzkosti, popř. jde o domnělou prevenci nepříjemných událostí. Pacienti si plně uvědomují nepřiměřenost svého chování [140].
Tímto se liší od podobného chování u bvFTD, kde nemocný přijímá úkony lhostejně (stereotypní tleskání, tření dlaní, opakování vět, umývání apod.) nebo se zájmem a potěšením (hromadění obalů, potravin, odpadků či jiných neúčelných předmětů), nemá snahu jim odolávat a nepovažuje je za problém; souvisí s poruchou rozhodování.
Jiné stavy, které mohou napodobovat bvFTD
Nejen duševní poruchy, ale i chování, které může být vyhrocením tzv. krize středního věku, může při povrchním hodnocení připomínat iniciální příznaky bvFTD.
Chování se může změnit v nezodpovědné a lehkovážné (navazování nepatřičných známostí, věnování se rizikovým aktivitám atd.), dochází k ochladnutí ve vztahu k partnerovi. Typické jsou sebestřednost, upřednostňování vlastních zájmů a potěšení na úkor blízkých osob. Na rozdíl od bvFTD je nadměrná pozornost věnovaná sobě samému, vzhledu a kondici. Jindy může člověk „dohánět, co nestačil“, začít nadměrně cestovat, najít si nové koníčky apod. (toulání, sběratelství a fascinace něčím mohou být první příznaky bvFTD!). Stav bývá přechodný, byť mnohdy s trvalými následky ve vztazích.
Terapeutické aspekty
Při nejistotě zahajujeme razantní symptomatickou psychiatrickou léčbu s monitorováním efektu a nežádoucích reakcí (u neurodegenerativních onemocnění je větší riziko nežádoucích účinků!).
Psychofarmakoterapie bvFTD je v některých aspektech podobná, některé léky indikované u duševních poruch a poruch chování (antidepresiva, antipsychotika, valproát) jsou doporučované i k symptomatické terapii behaviorálních projevů FTD.
Závěr
Diagnostika FTD je založena na zhodnocení anamnézy, klinického a neuropsychologického vyšetření, nutné je kvalitní morfologické, popř. i funkční zobrazovací vyšetření mozku. Výhodou je spolupráce neurologa a psychiatra. Zásadní je diferenciálně diagnostické odlišení stavů, které vyžadují specifickou léčbu (AN, duševní poruchy). Velmi důležitým zjištěním poslední doby je dříve podceňované, a přitom tak časté behaviorální a kognitivní postižení u pacientů s onemocněním motorického neuronu.
Péče o pacienty a jejich rodinné příslušníky je náročná, vyžaduje velkou míru zkušenosti, empatie a trpělivosti lékaře i motivaci celé rodiny. Výsledkem může být prodloužení období přiměřené soběstačnosti pacienta, jeho setrvání v důvěrně známém prostředí a oddálení institucionalizace.
Probíhající výzkum jistě v příštích letech povede k lepšímu pochopení patofyziologických mechanizmů i možnosti cílenější a individualizované léčby zaměřené na ovlivnění specifického neurodegenerativního procesu u bvFTD.
Grantová podpora
Podpořeno granty NV18-04-00346 a NV19-04-00090 MZ ČR a projektem Thomayerovy nemocnice TN 006419, projektem č. LQ1605 z Národního programu udržitelnosti II (MŠMT), MZ ČR – RVO, FN v Motole 00064203 a programem IPE 2. LF UK 699012.
Poděkování
Autoři děkují MUDr. Haně Kolářové, Ph.D. za cenné kritické připomínky k rukopisu.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů.
doc. MUDr. Robert Rusina, Ph.D.
Neurologická klinika 3. LF UK
Fakultní Thomayerova nemocnice
Vídeňská 800
140 59 Praha
e-mail: robert.rusina@lf3.cuni.cz
Přijato k recenzi: 22. 6. 2020
Přijato do tisku: 14. 1. 2021
Zdroje
1. Cséfalvay Z, Bajtošová R, Keller J. Primární progresivní afázie. Cesk Slov Neurol N 2020; 83/116 (3): 226–239. doi: 10.14735/amcsnn2020226.
2. Cairns NJ, Bigio EH, Mackenzie IR et al. Neuropathologic diagnostic and nosologic criteria for frontotemporal lobar degeneration: consensus of the Consortium for Frontotemporal Lobar Degeneration. Acta Neuropathol 2007; 114 (1): 5–22. doi: 10.1007/s00401-007 - 0237-2.
3. Rohan Z, Matej R. Current concepts in the classification and diagnosis of frontotemporal lobar degenerations: a practical approach. Arch Pathol Lab Med 2014; 138 (1): 132–138. doi: 10.5858/arpa.2012-0510-RS.
4. Mann DMA, Snowden JS. Frontotemporal lobar degeneration: Pathogenesis, pathology and pathways to phenotype. Brain Pathol 2017; 27 (6): 723–736. doi: 10.1111/bpa.12486.
5. Ferrari R, Manzoni C, Hardy J. Genetics and molecular mechanisms of frontotemporal lobar degeneration: an update and future avenues. Neurobiol Aging 2019; 78 : 98–110. doi: 10.1016/j.neurobiolaging.2019.02. 006.
6. Rascovsky K, Hodges JR, Knopman D et al. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain 2011; 134 (Pt 9): 2456–2477. doi: 10.1093/brain/awr179.
7. Vercelletto M, Boutoleau-Bretonnière C, Volteau C et al. Memantine in behavioral variant frontotemporal dementia: negative results. J Alzheimers Dis 2011; 23 (4): 749–759. doi: 10.3233/JAD-2010-101632.
8. Perry DC, Brown JA, Possin KL et al. Clinicopathological correlations in behavioural variant frontotemporal dementia. Brain 2017; 140 (12): 3329–3345. doi: 10.1093/brain/awx254.
9. Herrmann N, Black SE, Chow T et al. Serotonergic function and treatment of behavioral and psychological symptoms of frontotemporal dementia. Am J Geriatr Psychiatry 2012; 20 (9): 789–797. doi: 10.1097/JGP.0b013e31823033f3.
10. Kertesz A, McMonagle P, Blair M et al. The evolution and pathology of frontotemporal dementia. Brain 2005; 128 (Pt 9): 1996–2005. doi: 10.1093/brain/awh598.
11. Pick A. Über die Beziehungen der senilen Hirnatrophie zur Aphasie. Prager Med Wochenschr 1892; 17 : 165–167.
12. Pick A, Berrios GE, Girling DM. On the relationship between senile cerebral atrophy and aphasia. Hist Psychiatry 1994; 5 (20): 542–547.
13. Pick A. Zur Symptomatologie der linksseitigen Schläfenlappenatrophie. Monatsschr Psychiatr Neurol 1904; 16 : 378–388.
14. Pick A, Girling DM, Berrios GE. On the symptomatology of left - sided temporal lobe atrophy. Hist Psychiatry 1997; 8 (29): 149–59. doi: 10.1177/0957154X9700802910.
15. Ghetti B, Oblak AL, Boeve BF et al. Invited review: frontotemporal dementia caused by microtubule-associated protein tau gene (MAPT) mutations: a chameleon for neuropathology and neuroimaging. Neuropathol Appl Neurobiol 2015; 41 (1): 24–46. doi: 10.1111/nan.12213.
16. Rusina R, Matěj R, Růžička E et al. Diferenciální diag-nostika tauopatií – klinický pohled. Cesk Slov Neurol N 2015; 78/111 (5): 526–534. doi: 10.14735/amcsnn2015526.
17. Kovacs GG. Astroglia and tau: new perspectives. Front Aging Neurosci 2020; 12 : 96. doi: 10.3389/fnagi. 2020.00096.
18. Neumann M, Sampathu DM, Kwong LK et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science 2006; 314 (5796): 130–133. doi: 10.1126/science.1134108.
19. Neumann M, Mackenzie IR. Review: neuropathology of non-tau frontotemporal lobar degeneration. Neuropathol Appl Neurobiol 2019; 45 (1): 19–40. doi: 10.1111/nan.12526.
20. Kim G, Bolbolan K, Shahidehpour R et al. Morphology and distribution of TDP-43 pre-inclusions in primary progressive aphasia. J Neuropathol Exp Neurol 2019; 78 (3): 229–237. doi: 10.1093/jnen/nlz005.
21. Nelson PT, Dickson DW, Trojanowski JQ et al. Limbic-predominant age-related TDP-43 encephalopathy (LATE): consensus working group report. Brain 2019; 142 (6): 1503–1527. doi: 10.1093/brain/awz099.
22. Forman MS, Farmer J, Johnson JK et al. Frontotemporal dementia: clinicopathological correlations. Ann Neurol 2006; 59 (6): 952–962. doi: 10.1002/ana.20873.
23. Mercy L, Hodges JR, Dawson K et al. Incidence of early-onset dementias in Cambridgeshire, United Kingdom. Neurology 2008; 71 (19): 1496–1499. doi: 10.1212/01.wnl.0000334277.16896.fa.
24. Ratnavalli E, Brayne C, Dawson K et al. The prevalence of frontotemporal dementia. Neurology 2002; 58 (11): 1615–1621. doi: 10.1212/wnl.58.11.1615.
25. Rosso SM, Donker Kaat L, Baks T et al. Frontotemporal dementia in the Netherlands: patient characteristics and prevalence estimates from a population-based study. Brain 2003; 126 (Pt 9): 2016–2022. doi: 10.1093/brain/awg204.
26. Hodges JR, Davies R, Xuereb J et al. Survival in frontotemporal dementia. Neurology 2003; 61 (3): 349–354. doi: 10.1212/01.wnl.0000078928.20107.52.
27. Vyhnalek M, Laczo J, Nikolai T et al. Neuropsychiatrie. In: Uhrova T, Roth J (eds). Neuropsychiatrie. Praha: Maxdorf 2020 : 38–62.
28. Woolley JD, Khan BK, Murthy NK et al. The diagnostic challenge of psychiatric symptoms in neurodegenerative disease: rates of and risk factors for prior psychiatric diagnosis in patients with early neurodegenerative disease. J Clin Psychiatry 2011; 72 (2): 126–133. doi: 10.4088/JCP.10m06382oli.
29. Sommerlad A, Lee J, Warren J et al. Neurodegenerative disorder masquerading as psychosis in a forensic psychiatry setting. BMJ Case Rep 2014; bcr2013203458.doi: 10.1136/bcr-2013-203458.
30. Giovagnoli AR, Erbetta A, Reati F et al. Differential neuropsychological patterns of frontal variant frontotemporal dementia and Alzheimer‘s disease in a study of diagnostic concordance. Neuropsychologia 2008; 46 (5): 1495–1504. doi: 10.1016/j.neuropsychologia.2007.12. 023.
31. Mendez MF, Chen AK, Shapira JS et al. Acquired sociopathy and frontotemporal dementia. Dement Geriatr Cogn Disord 2005; 20 (2–3): 99–104. doi: 10.1159/000 086474.
32. Diehl-Schmid J, Perneczky R, Koch J et al. Guilty by suspicion? Criminal behavior in frontotemporal lobar degeneration. Cogn Behav Neurol 2013; 26 (2): 73–77. doi: 10.1097/WNN.0b013e31829cff11.
33. Le Ber I, Guedj E, Gabelle A et al. Demographic, neurological and behavioural characteristics and brain perfusion SPECT in frontal variant of frontotemporal dementia. Brain 2006; 129 (Pt 11): 3051–3065. doi: 10.1093/brain/awl288.
34. Zamboni G, Huey ED, Krueger F et al. Apathy and disinhibition in frontotemporal dementia: insights into their neural correlates. Neurology 2008; 71 (10): 736–742. doi: 10.1212/01.wnl.0000324920.96835.95.
35. Massimo L, Powers C, Moore P et al. Neuroanatomy of apathy and disinhibition in frontotemporal lobar degeneration. Dement Geriatr Cogn Disord 2009; 27 (1): 96–104. doi: 10.1159/000194658.
36. Hornberger M, Geng J, Hodges JR. Convergent grey and white matter evidence of orbitofrontal cortex changes related to disinhibition in behavioural variant frontotemporal dementia. Brain 2011; 134 (Pt 9): 2502–2512. doi: 10.1093/brain/awr173.
37. Kertesz A, Nadkarni N, Davidson W et al. The Frontal Behavioral Inventory in the differential diagnosis of frontotemporal dementia. J Int Neuropsychol Soc 2000; 6 (4): 460–468. doi: 10.1017/s1355617700644041.
38. de Vugt ME, Riedijk SR, Aalten P et al. Impact of behavioural problems on spousal caregivers: a comparison between Alzheimer’s disease and frontotemporal dementia. Dement Geriatr Cogn Disord 2006; 22 (1): 35–41. doi: 10.1159/000093102.
39. Merrilees J, Dowling GA, Hubbard E et al. Characterization of apathy in persons with frontotemporal dementia and the impact on family caregivers. Alzheimer Dis Assoc Disord 2013; 27 (1): 62–67. doi: 10.1097/WAD. 0b013e3182471c54.
40. McMurtray AM, Chen AK, Shapira JS et al. Variations in regional SPECT hypoperfusion and clinical features in frontotemporal dementia. Neurology 2006; 66 (4): 517–522. doi: 10.1212/01.wnl.0000197983.39436.e7.
41. Rankin KP, Gorno-Tempini ML, Allison SC et al. Structural anatomy of empathy in neurodegenerative disease. Brain 2006; 129 (Pt 11): 2945–2956. doi: 10.1093/brain/ awl254.
42. Eslinger PJ, Moore P, Anderson C et al. Social cognition, executive functioning, and neuroimaging correlates of empathic deficits in frontotemporal dementia. J Neuropsychiatry Clin Neurosci 2011; 23 (1): 74–82. doi: 10.1176/jnp.23.1.jnp74.
43. Mendez MF, Lauterbach EC, Sampson SM. An evidence-based review of the psychopathology of frontotemporal dementia: a report of the ANPA Committee on Research. J Neuropsychiatry Clin Neurosci 2008; 20 (2): 130–149. doi: 10.1176/jnp.2008.20.2.130.
44. Nyatsanza S, Shetty T, Gregory C et al. A study of stereotypic behaviours in Alzheimer’s disease and frontal and temporal variant frontotemporal dementia. J Neurol Neurosurg Psychiatry 2003; 74 (10): 1398–1402. doi: 10.1136/jnnp.74.10.1398.
45. Rosso SM, Roks G, Stevens M et al. Complex compulsive behaviour in the temporal variant of frontotemporal dementia. J Neurol 2001; 248 (11): 965–970. doi: 10.1007/s004150170049.
46. Woolley JD, Gorno-Tempini ML, Seeley WW et al. Binge eating is associated with right orbitofrontal-insular-striatal atrophy in frontotemporal dementia. Neurology 2007; 69 (14): 1424–1433. doi: 10.1212/01.wnl.0000277461.06713.23.
47. Whitwell JL, Sampson EL, Loy CT et al. VBM signatures of abnormal eating behaviours in frontotemporal lobar degeneration. Neuroimage 2007; 35 (1): 207–213. doi: 10.1016/j.neuroimage.2006.12.006.
48. Piguet O, Petersen A, Yin Ka Lam B et al. Eating and hypothalamus changes in behavioral-variant frontotemporal dementia. Ann Neurol 2011; 69 (2): 312–319. doi: 10.1002/ana.22244.
49. Wittenberg D, Possin KL, Rascovsky K et al. The early neuropsychological and behavioral characteristics of frontotemporal dementia. Neuropsychol Rev 2008; 8 (1): 91–102. doi: 10.1007/s11065-008-9056-z.
50. Rascovsky K, Salmon DP, Hansen LA et al. Disparate letter and semantic category fluency deficits in autopsy-confirmed frontotemporal dementia and Alzheimer’s disease. Neuropsychology 2007; 21 (1): 20–30. doi: 10.1037/0894-4105.21.1.20.
51. Liscic RM, Storandt M, Cairns NJ et al. Clinical and psychometric distinction of frontotemporal and Alzheimer dementias. Arch Neurol 2007; 64 (4): 535–540. doi: 10.1001/archneur.64.4.535.
52. Ducharme S, Dols A, Laforce R et al. Recommendations to distinguish behavioural variant frontotemporal dementia from psychiatric disorders. Brain 2020; 143 (6): 1632–1650. doi: 10.1093/brain/awaa018.
53. Seeley WW, Crawford R, Rascovsky K et al. Frontal paralimbic network atrophy in very mild behavioral variant frontotemporal dementia. Arch Neurol 2008; 65 (2): 249–255. doi: 10.1001/archneurol.2007.38.
54. Neary D, Snowden JS, Gustafson L et al. Frontotemporal lobar degeneration: a consensus on clinical diagnostic criteria. Neurology 1998; 51 (6): 1546–1554. doi: 10.1212/wnl.51.6.1546.
55. Lemos R, Duro D, Simões MR et al. The free and cued selective reminding test distinguishes frontotemporal dementia from Alzheimer‘s disease. Arch Clin Neuropsychol 2014; 29 (7): 670–679. doi: 10.1093/arclin/acu031.
56. Urbanová M, Vyhnálek M, Nikolai T et al. Validita testu Enhanced cued recall pro diferenciální diagnostiku demence Alzheimerova typu a behaviorální formy frontotemporální demence. Cesk Slov Neurol N 2014; 77/110 (5): 576–581.
57. Poos JM, Jiskoot LC, Papma JM et al. Meta-analytic review of memory impairment in behavioral variant frontotemporal dementia. J Int Neuropsychol Soc 2018; 24 (6): 593–605. doi: 10.1017/S1355617718000115.
58. Hornberger M, Piguet O. Episodic memory in frontotemporal dementia: a critical review. Brain 2012; 135 (Pt 3): 678–692. doi: 10.1093/brain/aws011.
59. Pennington C, Hodges JR, Hornberger M. Neural correlates of episodic memory in behavioral variant frontotemporal dementia. J Alzheimers Dis 2011; 24 (2): 261–268. doi: 10.3233/JAD-2011-101668.
60. Carlesimo GA, Perri R, Caltagirone C. Category cued recall following controlled encoding as a neuropsychological tool in the diagnosis of alzheimer’s disease: a review of the evidence. Neuropsychol Rev 2001; 21 : 54–65. doi: 10.1007/s11065-010-9153-7.
61. Gregory C, Lough S, Stone V et al. Theory of mind in patients with frontal variant frontotemporal dementia and Alzheimer‘s disease: theoretical and practical implications. Brain 2002; 125 (Pt 4): 752–764. doi: 10.1093/brain/awf079.
62. Irish M, Hodges JR, Piguet O. Right anterior temporal lobe dysfunction underlies theory of mind impairments in semantic dementia. Brain 2014; 137 (Pt 4): 1241–1253. doi: 10.1093/brain/awu003.
63. Keane J, Calder AJ, Hodges JR et al. Face and emotion processing in frontal variant frontotemporal dementia. Neuropsychologia 2002; 40 (6): 655–665. doi: 10.1016/s0028-3932 (01) 00156-7.
64. Rosen HJ, Pace-Savitsky K, Perry RJ et al. Recognition of emotion in the frontal and temporal variants of frontotemporal dementia. Dement Geriatr Cogn Disord 2004; 17 (4): 277–281. doi: 10.1159/000077154.
65. O’Callaghan C, Bertoux M, Irish M et al. Fair play: social norm compliance failures in behavioural variant frontotemporal dementia. Brain 2016; 139 (Pt 1): 204–216. doi: 10.1093/brain/awv315.
66. Wong S, Irish M, O’Callaghan C et al. Should I trust you? Learning and memory of social interactions in dementia. Neuropsychologia 2017; 104 : 157–167. doi: 10.1016/j.neuropsychologia.2017.08.016.
67. Ascher EA, Sturm VE, Seider BH et al. Relationship satisfaction and emotional language in frontotemporal dementia and Alzheimer disease patients and spousal caregivers. Alzheimer Dis Assoc Disord 2010; 24 (1): 49–55. doi: 10.1097/WAD.0b013e3181bd66a3.
68. Snowden J, Neary D, Mann D. Frontotemporal lobar degeneration: clinical and pathological relationships. Acta Neuropathol 2007; 114 (1): 31–38. doi: 10.1007/s00401-007-0236-3.
69. Kirschner HS. Frontotemporal dementia and primary progressive aphasia, a review. Neuropsychiatr Dis Treat 2014; 10 : 1045–1055. doi: 10.2147/NDT.S38821.
70. Ogar JM, Dronkers NF, Brambati SM et al. Progressive nonfluent aphasia and its characteristic motor speech deficits. Alzheimer Dis Assoc Disord 2007; 21 (4): S23–S30. doi: 10.1097/WAD.0b013e31815d19fe.
71. Erkkinen MG, Zúñiga RG, Pardo CC et al. Artistic renaissance in frontotemporal dementia. JAMA 2018; 319 (13): 1304–1306. doi: 10.1001/jama.2017.19501.
72. Menšíková K, Tučková L, Kaňovský P. Atypický parkinsonizmus a frontotemporální demence – klinické, patologické a genetické aspekty. Cesk Slov Neurol N 2016; 79/112 (3): 275–286. doi: 10.14735/amcsnn2016275.
73. Burrell JR, Kiernan MC, Vucic S et al. Motor neuron dysfunction in frontotemporal dementia. Brain 2011; 134 (Pt 9): 2582–2594. doi: 10.1093/brain/awr195.
74. Tremolizzo L, Susani E, Aliprandi A et al. Muscle ultrasonography for detecting fasciculations in frontotemporal dementia. Amyotroph Lateral Scler Frontotemporal Degener 2014; 15 (7–8): 546–550. doi: 10.3109/ 21678421.2014.913636.
75. Perneczky R, Diehl-Schmid J, Förstl H et al. Urinary incontinence and its functional anatomy in frontotemporal lobar degenerations. Eur J Nucl Med Mol Imaging 2008; 35 (3): 605–610. doi: 10.1007/s00259-007-0626-8.
76. Kopecek M, Stepankova H, Lukavsky J et al. Montreal cognitive assessment (MoCA): Normative data for old and very old Czech adults. Appl Neuropsychol Adult 2017; 24 (1): 23–29. doi: 10.1080/23279095.2015.1065261.
77. Frontal Assessment Battery – Baterie frontálních funkcí. [online]. Dostupné z URL: https: //www.lf2.cuni.cz/files/page/files/2016/fab.doc.
78. Slachevsky A, Villalpando JM, Sarazin M et al. Frontal assessment battery and differential diagnosis of frontotemporal dementia and Alzheimer disease. Arch Neurol 2004; 61 (7): 1104–1107. doi: 10.1001/archneur.61.7.1104.
79. Dubois B, Slachevsky A, Litvan I et al. The FAB: a frontal assessment battery at bedside. Neurology 2000; 55 (11): 1621–2626. doi: 10.1212/wnl.55.11.1621.
80. Castiglioni S, Pelati O, Zuffi M et al. The frontal assessment battery does not differentiate frontotemporal dementia from Alzheimer‘s disease. Dement Geriatr Cogn Disord 2006; 22 (2): 125–131. doi: 10.1159/000093665.
81. Boban M, Malojcić B, Mimica N et al. The frontal assessment battery in the differential diagnosis of dementia. J Geriatr Psychiatry Neurol 2012; 25 (4): 201–207. doi: 10.1177/0891988712464821.
82. Harris JM, Gall C, Thompson JC et al. Sensitivity and specificity of FTDC criteria for behavioral variant frontotemporal dementia. Neurology 2013; 80 (20): 1881–1887. doi: 10.1212/WNL.0b013e318292a342.
83. Nikolai T, Štěpánková H, Michalec J et al. Testy verbální fluence, česká normativní studie pro osoby vyššího věku. Cesk Slov Neurol N 2015; 78/111 (3): 292–299. doi: 10.14735/amcsnn2015292.
84. Laisney M, Matuszewski V, Mézenge F et al. The underlying mechanisms of verbal fluency deficit in frontotemporal dementia and semantic dementia. J Neurol 2009; 256 (7): 1083–1094. doi: 10.1007/s00415-009 - 5073-y.
85. Diehl-Schmid J, Pohl C, Ruprecht C et al. The Ekman 60 Faces Test as a diagnostic instrument in frontotemporal dementia. Arch Clin Neuropsychol 2007; 22 (4): 459–464. doi: 10.1016/j.acn.2007.01.024.
86. Torralva T, Roca M, Gleichgerrcht E et al. A neuropsychological battery to detect specific executive and social cognitive impairments in early frontotemporal dementia. Brain 2009; 132 (Pt 5): 1299–1309. doi: 10.1093/brain/awp041.
87. Barkhof F, Fox NC, Bastos-Leite AJ et al. Neuroimaging in dementia. Berlin: Springer Science & Business Media 2011.
88. Greaves CV, Rohrer JD. An update on genetic frontotemporal dementia. J Neurol 2019; 266 (8): 2075–2086. doi: 10.1007/s00415-019-09363-4.
89. Sellami L, Saracino D, Le Ber I. Genetic forms of frontotemporal lobar degeneration: current diagnostic approach and new directions in therapeutic strategies. Rev Neurol (Paris) 2020; 176 (7–8): 571–581. doi: 10.1016/j.neurol.2020.02.008.
90. Frontotemporal dementia. [online]. Available from URL: https: //omim.org/entry/600274?search=FTLD&highlight=ftld.
91. Van Mossevelde S, Engelborghs S, van der Zee J et aj. Genotype-phenotype links in frontotemporal lobar degeneration. Nat Rev Neurol 2018; 14 (6): 363–378. doi: 10.1038/s41582-018-0009-8.
92. Parobková E, Rusina R, Matějčková M et al. Genetika neurodegenerativních demencí v deseti bodech – co může neurolog očekávat od molekulárního genetika? Cesk Slov Neurol N 2019; 82 (1): 100–105 doi: 10.14735/amcsnn2019100.
93. Rohan Z, Rusina R, Matěj Z. Neuropatologické post mortem vyšetření mozku a míchy v deseti bodech – co může neurolog od neuropatologa očekávat při verifikaci klinické diagnózy neurodegenerativního onemocnění? Cesk Slov Neurol N 2018; 81 (1): 109–114. doi: 10.14735/amcsnn2018109.
94. Mendez MF, Shapira JS, McMurtray A et al. Preliminary findings: behavioral worsening on donepezil in patients with frontotemporal dementia. Am J Geriatr Psychiatry 2007; 5 (1): 84–87. doi: 10.1097/01.JGP.0000231744.69631. 33.
95. Boxer AL, Knopman DS, Kaufer DI et al. Memantine in patients with frontotemporal lobar degeneration: a multicentre, randomised, doubleblind, placebo-controlled trial. Lancet Neurol 2013; 12 (2): 149–156. doi: 10.1016/S1474-4422 (12) 70320-4.
96. Lebert F, Stekke W, Hasenbroekx C et al. Frontotemporal dementia: a randomised, controlled trial with trazodone. Dement Geriatr Cogn Disord 2004; 17 (4): 355–359. doi: 10.1159/000077171.
97. van Dyck CH, Arnsten AFT, Padala PR et al. Neurobiologic rationale for treatment of apathy in Alzheimer‘s disease with methylphenidate. Am J Geriatr Psychiatry 2020; 29 (1): 51–62. doi: 10.1016/j.jagp.2020.04.026.
98. Strong MJ, Abrahams S, Goldstein LH et al. Amyotrophic lateral sclerosis – frontotemporal spectrum disorder (ALS-FTSD): revised diagnostic criteria. Amyotroph Lateral Scler Frontotempral Degener 2017; 18 (3–4): 153–174. doi: 10.1080/21678421.2016.1267768.
99. Goldstein LH, Abrahams S. Changes in cognition and behaviour in amyotrophic lateral sclerosis: nature of impairment and implications for assessment. Lancet Neurol 2013; 12 (4): 368–380. doi: 10.1016/S1474-4422 (13) 70 026-7.
100. Beeldman E, Raaphorst J, Klein Twenaar M et al. The cognitive profile of behavioural variant FTD and its similarities with ALS: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry 2018; 89 (9): 995–1002. doi: 10.1136/jnnp-2017-317459.
101. Yunusova Y, Ansari J, Ramirez J et al. Frontal anatomical correlates of cognitive and speech motor deficits in amyotrophic lateral sclerosis. Behav Neurol 2019; 2019 : 9518309. doi: 10.1155/2019/9518309.
102. Leslie FV, Hsieh S, Caga J et al. Semantic deficits in amyotrophic lateral sclerosis. Amyotroph Lateral Scler Frontotemporal Degener 2015; 16 (1–2): 46–53. doi: 10.3109/21678421.2014.987301.
103. Kamminga J, Leslie FV, Hsieh S et al. Syntactic comprehension deficits across the FTD-ALS continuum. Neurobiol Aging 2016; 41 : 11–18. doi: 10.1016/j.neurobiolaging.2016.02.002.
104. Bezdíček O, Marková L, Soósová N et al. Pilotní studie Edinburské kognitivně-behaviorální zkoušky pro amyotrofickou laterální sklerózu na české populaci. Cesk Slov Neurol N 2018; 81 (2): 208–212. doi: 10.14735/amcsnn2018208.
105. Rusina R., Matěj R. Frontotemporální lobární degenerace. In: Rusina R, Matěj R, Bartoš A et al. Neurodegenerativní onemocnění. 2. vyd. Praha: Mladá fronta 2019 : 177–191.
106. Forsberg K, Graffmo K, Pakkenberg B et al. Misfolded SOD1 inclusions in patients with mutations in C9orf72 and other ALS/FTD-associated genes. J Neurol Neurosurg Psychiatry 2019; 90 (8): 861–869. doi: 10.1136/jnnp-2018-319386.
107. Siddique N, Siddique T. Amyotrophic lateral sclerosis overview. [online]. Available from: https: //www.ncbi.nlm.nih.gov/books/NBK1450/.
108. Geser F, Lee VM, Trojanowski JQ. Amyotrophic lateral sclerosis and frontotemporal lobar degeneration: a spectrum of TDP-43 proteinopathies. Neuropathology 2010; 30 (2): 103–112. doi: 10.1111/j.1440-1789.2009.01091.x
109. Harrison KL, Hunt LJ, Ritchie CS et al. Dying with dementia: Underrecognized and stigmatized. J Am Geriatr Soc 2019; 67 (8): 1548–1551. doi: 10.1111/jgs.15895.
110. Rusina R, Špeciánová Š. Paliativní aspekty u pokročilé demence. Neurol praxi 2020; 21 (2): 100–102. doi: 10.36290/neu.2020.056.
111. Musa G, Slachevsky A, Muñoz-Neira C et al. Alzheimer‘s disease or behavioral variant frontotemporal dementia? Review of key points toward an accurate clinical and neuropsychological diagnosis. J Alzheimers Dis 2020; 73 (3): 833–848. doi: 10.3233/JAD-190924.
112. Li Y, Hai S, Zhou Y et al. Cholinesterase inhibitors for rarer dementias associated with neurological conditions. Cochrane Database Syst Rev 2015; (3): CD009444. doi: 10.1002/14651858.CD009444.pub3.
113. Peters ME, Schwartz S, Han D et al. Neuropsychiatric symptoms as predictors of progression to severe Alzheimer’s dementia and death: the Cache County Dementia Progression Study. Am J Psychiatry 2015; 172 (5): 460–465. doi: 10.1176/appi.ajp.2014.14040480.
114. Dubois B, Feldman H, Jacova C et al. Advancing research diagnostic criteria for Alzheimer’s disease: the IWG-2 criteria. Lancet Neurol 2014; 13 (6): 614–629. doi: 10.1016/S1474-4422 (14) 70090-0.
115. Johnson JK, Head E, Kim R et al. Clinical and pathological evidence for a frontal variant of Alzheimer disease. Arch Neurol 1999; 56 (10): 1233–1239. doi: 10.1001/archneur.56.10.1233.
116. Ossenkoppele R, Pijnenburg YA, Perry DC et al. The behavioural/dysexecutive variant of Alzheimer’s disease: clinical, neuroimaging and pathological features. Brain 2015; 138 (Pt 9): 2732–2749. doi: 10.1093/brain/ awv191.
117. Matušková V, Nikolai T; Marková H et al. Neuropsychiatrické symptomy jako časná manifestace Alzheimerovy nemoci. Cesk Slov Neurol N 2020; 83 (1): 64–72. doi: 10.14735/amcsnn202064.
118. Sawyer RP, Rodriguez-Porcel F, Hagen M et al. Diagnosing the frontal variant of Alzheimer‘s disease: a clinician‘s yellow brick road. J Clin Mov Disord 2017; 4 : 2. doi: 10.1186/s40734-017-0052-4.
119. Alladi S, Xuereb J, Bak T et al. Focal cortical presentations of Alzheimer’s disease. Brain 2007; 130 (Pt 10): 2636–2645. doi: 10.1093/brain/awm213.
120. Leger GC, Banks SJ. Neuropsychiatric symptom profile differs based on pathology in patients with clinically diagnosed behavioral variant frontotemporal dementia. Dement Geriatr Cogn Disord 2014; 37 (1–2): 104–112. doi: 10.1159/000354368.
121. Bathgate D, Snowden JS, Varma A et al. Behaviour in frontotemporal dementia, Alzheimer’s disease and vascular dementia. Acta Neurol Scand 2001; 103 (6): 367–378. doi: 10.1034/j.1600-0404.2001.2000236.x
122. Bozeat S, Gregory CA, Ralph MA et al. Which neuropsychiatric and behavioural features distinguish frontal and temporal variants of frontotemporal dementia from Alzheimer’s disease? J Neurol Neurosurg Psychiatry 2000; 69 (2): 178–186. doi: 10.1136/jnnp.69.2.178.
123. Mendez MF, Shapira JS, Miller BL. Stereotypical movements and frontotemporal dementia. Mov Disord 2005; 20 (6): 742–745. doi: 10.1002/mds.20465.
124. Rascovsky K, Salmon DP, Ho GJ et al. Cognitive profiles differ in autopsy-confirmed frontotemporal dementia and AD. Neurology 2002; 58 (12): 1801–1808. doi: 10.1212/wnl.58.12.1801.
125. Libon DJ, McMillan C, Gunawardena D et al. Neurocognitive contributions to verbal fluency deficits in frontotemporal lobar degeneration. Neurology 2009; 73 (7): 535–542. doi: 10.1212/WNL.0b013e3181b2a4f5.
126. Hutchinson AD, Mathias JL. Neuropsychological deficits in frontotemporal dementia and Alzheimer’s disease: a meta-analytic review. J Neurol Neurosurg Psychiatry 2007; 8 (9): 917–928. doi: 10.1136/jnnp.2006.100669.
127. Elfgren C, Brun A, Gustafson L et al. Neuropsychological tests as discriminators between dementia of Alzheimer type and frontotemporal dementia. Int J Geriatric Psychiatry 1994; 9 (8): 635–642.
128. Lindau M, Almkvist O, Johansson SE et al. Cognitive and behavioral differentiation of frontal lobe degeneration of the non-Alzheimer type and Alzheimer‘s disease. Dement Geriatr Cogn Disord 1998; 9 (4): 205–213. doi: 10.1159/000017048.
129. Giovagnoli AR, Erbetta A, Reati F et al. Differential neuropsychological patterns of frontal variant frontotemporal dementia and Alzheimer‘s disease in a study of diagnostic concordance. Neuropsychologia 2008; 46 (5): 1495–1504. doi: 10.1016/j.neuropsychologia.2007.12.023.
130. Barber R, Snowden JS, Craufurd D. Frontotemporal dementia and Alzheimer’s disease: retrospective differentiation using information from informants. J Neurol Neurosurg Psychiatry 1995; 59 (1): 61–70. doi: 10.1136/jnnp.59.1.61.
131. Mendez MF, McMurtray AM, Licht EA et al. Frontal-executive versus posterior-perceptual mental status deficits in early-onset dementias. Am J Alzheimers Dis Other Demen 2009; 24 (3): 220–227. doi: 10.1177/1533317509332626.
132. Baum, LF. Čaroděj ze země Oz / The Wonderful Wizard of Oz. Praha: Garamond 2018 : 308.
133. Andrews SJ, McFall GP, Booth A et al. Association of Alzheimer‘s disease genetic risk loci with cognitive performance and decline: a systematic review. J Alzheimers Dis 2019; 69 (4): 1109–1136. doi: 10.3233/JAD-190342.
134. DeTure MA, Dickson DW. The neuropathological diagnosis of Alzheimer‘s disease. Mol Neurodegener 2019; 14 (1): 32. doi: 10.1186/s13024-019-0333-5.
135. Montine TJ, Phelps CH, Beach TG et al. National Institute on Aging-Alzheimer‘s Association guidelines for the neuropathologic assessment of Alzheimer‘s disease: a practical approach. Acta Neuropathol 2012; 123 (1): 1–11. doi: 10.1007/s00401-011-0910-3.
136. Greenberg SM, Bacskai BJ, Hernandez-Guillamon M et al. Cerebral amyloid angiopathy and Alzheimer disease – one peptide, two pathways. Nat Rev Neurol 2020; 16 (1): 30–42. doi: 10.1038/s41582-019-0281-2.
137. Miller BL. Frontotemporal dementia. Oxford: Oxford University Press 2013 : 32–35.
138. Devenney E, Swinn T, Mioshi E et al. The behavioural variant frontotemporal dementia phenocopy syndrome is a distinct entity – evidence from a longitudinal study. BMC Neurol 2018; 18 (1): 56. doi: 10.1186/s12883-018-1060-1.
139. Valente ES, Caramelli P, Gambogi LB et al. Phenocopy syndrome of behavioral variant frontotemporal dementia: a systematic review. Alzheimers Res Ther 2019; 11 (1): 30. doi: 10.1186/s13195-019-0483-2.
140. Mezinárodní klasifikace nemocí. 10. revize. Duševní poruchy a poruchy chování. Popisy klinických příznaků a diagnostická vodítka. Praha: Psychiatrické centrum 1992.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2021 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Prof. MUDr. Vladimír Beneš, DrSc. – 100 let
- Editorial
- COVID-19 a iktus
- Vizuální hodnocení a digitální analýza ultrazvukového obrazu u stabilního a progredujícího aterosklerotického plátu v karotické tepně
- Karotická endarterektómia po intranevóznej trombolýze a mechanickej trombektómii
- Prognostická úloha poměru neutrofilů k lymfocytům u dětského typu cystického adamantinomatózního kraniofaringeomu
- Validace české verze škály NPCS pro hodnocení potřeb pacientů s progresivním neurologickým onemocněním
- Encefalokéla v České republice – incidence, prenatální diagnostika a mezinárodní srovnání
- Komplexní léčba difuzních nízkostupňových gliomů – technika operování a onkologická léčba rezidua
- Komentář k článku autorů Bartoš et al Komplexní léčba difuzních nízkostupňových gliomů – technika operování a onkologická léčba rezidua
- Poděkování recenzentům
- Bowing třetí komory jako radiologický ukazatel obstrukčního hydrocefalu a úspěšnosti endoskopické ventrikulocisternostomie
- „Nový normál“ pro adjuvantní léčbu glioblastomu v podmínkách pandemie COVID-19
- Vliv první vlny pandemie COVID-19 na počty hospitalizovaných pacientů s ischemickou cévní mozkovou příhodou, na jejich diagnostiku a terapii
- Frontotemporální demence
- Kazuistika relabující infekce COVID-19 u pacientky s roztroušenou sklerózou léčenou ocrelizumabem
- Epiglotopexe v léčbě obstrukční spánkové apnoe
- Komentář k článku autorů Sejkorová et al Hemodynamic changes in four aneurysms leading to their rupture at follow-up periods
- Informace vedoucího redaktora
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Frontotemporální demence
- Encefalokéla v České republice – incidence, prenatální diagnostika a mezinárodní srovnání
- COVID-19 a iktus
- Karotická endarterektómia po intranevóznej trombolýze a mechanickej trombektómii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



