-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Liečba ťažkej spasticity intratekálnym podávaním baklofénu – 15-ročné skúsenosti
Intrathecal baclofen pump for the treatment of severe spasticity – 15 years of experience
Aim: Severe spasticity as a result of the affected CNS is difficult to be influenced by standard therapies in a number of cases. In recent years, continuous administration of baclofen in the intrathecal space using a pump system has proven to be effective. In this paper, we evaluate our experience with baclofen pump implantation from the aspect of this method’s safety and efficacy.
Patients and methods: 24 patients, median age 36 (30 -51) years, with a history of severe, intractable spasticity due to spinal cord injury (13 cases), multiple sclerosis (7 cases) and other cerebrospinal aetiology (4 cases), who underwent baclofen pump implantation. Spasticity was assessed using clinical scales (Ashworth Scale, Spasm Frequency Scale, Adductor Tone Rating) before and after titrating the effective dose of baclofen after pump implantation. Functional benefits were evaluated with Barthel Index before, 1 year, 5 and 10 years after implantation of the baclofen pump.
Results: During a follow up period with a median of 92 (41 -136) months, no death was noted. Nobody suffered from any new neurological impairment as a result of baclofen pump implantation. All patients presented with statistically significant improvement of spasticity and reduction of spasm frequency. We documented statistically significant improvement in functional status according to the Barthel Index 1, 5 and 10 years after pump implantation.
Conclusion: Intrathecal baclofen pump infusion is a safe and very effective method of treatment for intractable spasticity, which leads to functional improvement by increasing independence in daily living activities.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
鞘内注射巴氯芬泵治疗严重痉挛 – 15年的经验
目的:在许多病例中,受影响的中枢神经系统的严重痉挛很难受到标准疗法的影响。近年来,使用泵系统在鞘内持续给药巴氯芬被证明是有效的。本文就巴氯芬泵植入术的安全性和有效性进行评价。
患者和方法:24例患者,中位年龄36(30 -51)岁,有脊髓损伤引起的严重、顽固性痉挛(13例)、多发性硬化(7例)等脑脊液病因学(4例)病史,行巴氯芬泵植入式手术。采用临床量表(Ashworth量表、痉挛频率量表、内收肌张力分级)对泵植入式巴氯芬有效剂量滴定前后的痉挛状态进行评估。使用Barthel指数评估巴氯芬泵植入前、植入后1年、植入后5年和植入后10年的功能疗效。
结果:在平均92个月(41 -136个月)的随访期间,未发现死亡病例。没有人因为巴氯芬泵的植入而出现任何新的神经损伤。所有患者均有统计学意义的痉挛改善和痉挛频率降低。我们根据植入泵后1年、5年和10年的Barthel指数记录了功能状态的显著改善。结论:鞘内注射巴氯芬泵是治疗顽固性痉挛的一种安全有效的方法,可通过增加日常生活活动的独立性来改善功能。
关键词:痉挛–脊髓损伤–多发性硬化–鞘内巴氯芬–巴氯芬泵
Keywords:
spasticity – spinal cord injury – Multiple sclerosis – intrathecal baclofen – baclofen pump
Autoři: S. Vaneková 1; S. Tóth 1; M. Melišek 2; J. Vanko 2; P. Harangozó 2; B. Rudinský 2
Působiště autorů: Klinika fyziatrie, balneológie a liečebnej rehabilitácie FN s poliklinikou Nové Zámky, Slovensko 1; Neurochirurgická klinika FN s poliklinikou Nové Zámky, Slovensko 2
Vyšlo v časopise: Cesk Slov Neurol N 2019; 82(4): 430-436
Kategorie: Původní práce
doi: https://doi.org/10.14735/amcsnn2019430Souhrn
Cieľ: Ťažká spasticita, ktorá je dôsledkom postihnutia CNS, je veľakrát neľahko ovplyvniteľná bežnými spôsobmi liečby. V posledných rokoch sa osvedčilo kontinuálne podávanie baklofénu do intratekálneho priestoru implantovateľným systémom. V práci vyhodnocujeme naše skúsenosti s implantáciou baklofénovej pumpy z hľadiska bezpečnosti a efektivity metódy.
Súbor a metódy: 24 pacientov, s mediánom veku 36 (30–51) rokov, s ťažkou refraktérnou spasticitou v dôsledku poranenia miechy (13×), roztrúsenej sklerózy (7×) a inej cerebrospinálnej etiológie (4×), ktorí podstúpili implantáciu baklofénovej pumpy. Spasticita bola zhodnotená pomocou klinických škál (Ashworthova škála, Škála frekvencie spazmov, Škála tonusu adduktorov) pred implantáciou a ďalej po titrácii účinnej dávky po implantácii pumpy. Na zhodnotenie schopnosti vykonávať bežné denné činnosti sme použili Barthelovej test pred implantáciou pumpy a ďalej rok, 5 a 10 rokov po nej.
Výsledky: V priebehu sledovania (medián doby sledovania 92 [41–136] mesiacov) ani jeden pacient nezomrel. Nikto neutrpel nový neurologický deficit ako následok implantácie baklofénovej pumpy. U všetkých pacientov došlo k štatisticky signifikantnému poklesu spasticity a frekvencie spazmov. Zaznamenali sme štatisticky signifikantný nárast skóre v Barthelovej teste rok, 5 a 10 rokov po implantácii pumpy.
Záver: Liečba ťažkej spasticity intratekálnym podávaním baklofénu je bezpečná a veľmi efektívna metóda a vedie k zlepšeniu sebestačnosti pacientov pri vykonávaní bežných denných činností.
Klíčová slova:
spasticita – poranenia miechy – roztrúsená skleróza – intratekálny baklofén – baklofénová pumpa
Úvod
Spasticita patrí medzi závažné klinické prejavy poruchy centrálneho motoneurónu.
Je charakterizovaná abnormálnym zvýšením svalového tonusu pri rýchlom pasívnom natiahnutí tohoto svalu [1]. Patofyziologickým korelátom spasticity je hyperexcitabilita periférneho alfa-motoneurónu ako následok straty inhibičného vplyvu kortexu na tento motoneurón pri prerušení descendentných inhibičných dráh. To, do akej miery sa u pacienta rozvinie spastický syndróm, záleží od lokalizácie, veľkosti a rýchlosti vzniku lézie CNS. Vyššia prevalencia problematickej spasticity sa vyskytuje u pacientov s traumatickým postihnutím miechy (40–78 %) [2–3], s roztrúsenou sklerózou (až 84 %) [4], s perinatálnou encefalopatiou (až 93 %) [5]. U pacientov po CMP sa prevalencia spasticity pohybuje medzi 17–38 % [6–9]. Na objektivizáciu spasticity používame presne definované hodnotiace škály: Ashworthova škála a jej modifikácia, Tardieuova škála, Škála tonusu adduktorov, Škála frekvencie spazmov; a neurofyziologické metódy: H-reflex, T-vlna, ktoré určujú excitabilitu alfa-motoneurónu na presynaptickej či postsynaptickej úrovni. V súčasnosti najčastejší a najjednoduchší spôsob liečby spasticity je farmakologická liečba [10]. Liekom prvej voľby je baklofén (GABA agonista), účinný myorelaxačný preparát. Limitom perorálneho podania baklofénu je výskyt vedľajších nežiadúcich účinkov pri vysokých dávkach, kedže obtiažne preniká hematoencefalickou bariérou. Objavujú sa hlavne ospalosť, arteriálna hypotenzia, bradykardia, vracanie, hnačky, vzácne i depresia dychových funkcií. Farmakoterapiu preto používame najmä na liečbu spasticity ľahkého stupňa. U fokálnej spasticity postihujúcej malú svalovú skupinu, ktorá vedie k rozvoju spastickej dystónie, t.j. abnormálneho postavenia končatiny, je treba uvažovať o lokálnej intramuskulárnej aplikácii botulotoxínu A, ktorého efektivita a bezpečnosť bola preukázaná vo viacerých multicentrických štúdiách [11–13]. Nenahraditeľnou súčasťou každej formy terapie spasticity je rehabilitácia [14]. Generalizované formy spasticity sú zvyčajne refraktérne k štandardným spôsobom liečby. V týchto prípadoch sa osvedčilo intratekálne podávanie baklofénu pumpovým systémom, ktoré ako prví úspešne použili Penn a Kroin [15]. Perorálnej dávke 60 mg/ 24 h odpovedá 120 μg/ 24 h podaných intratekálne, pričom celková toxicita lieku je pri intratekálnom podaní veľmi nízka. Implantácia baklofénovej pumpy je indikovaná u pacientov s ťažkou spasticitou (najmä na dolných končatinách), po vyčerpaní všetkých možností konzervatívnej liečby, resp. ak sú prítomné neakceptovateľné nežiadúce účinky farmakoterapie. Nutným predpokladom implantácie baklofénovej pumpy je pozitívna odpoveď na jednorázové intratekálne podanie baklofénu, tzv. klinický baklofénový test (testovanie). Jedná sa o veľmi efektívnu metódu v zmysle redukcie spasticity, najmä u pacientov s traumatickým poranením miechy, mozgu, u pacientov s roztrúsenou sklerózou, s detskou mozgovou obrnou (DMO) a taktiež u istého percenta pacientov po CMP. Okrem redukcie svalového hypertonu dochádza k zmierneniu bolestivých spazmov a tým k zlepšeniu kvality života. Tento efekt bol následne preukázaný vo viacerých štúdiách [16–18]. Taktiež sa jedná o metódu bezpečnú, hoci zaťaženú komplikáciami, ktoré sú však väčšinou nezávažné. Týkajú sa hlavne poruchy katétra a vieme ich úspešne riešiť [19]. I napriek tomu je baklofén k intratekálnemu podávaniu registrovaný len v USA a v niektorých krajinách západnej Európy pod názvom Lioresal intrathecal (Novartis, Basilej, Švýcarsko). Na Slovensku nie je doposiaľ baklofén k inratekálnemu podávaniu registrovaný, na jeho dovoz musí byť udelená výnimka Ministerstva zdravotníctva, o ktorú je treba pravidelne žiadať. Programovateľná implantabilná baklofénová pumpa bola v ČR prvý krát zavedená v roku 1994 v Olomouci profesorom Houdekom, na Slovensku o 10 rokov neskôr v Nových Zámkoch. V práci vyhodnocujeme naše 15-ročné skúsenosti s liečbou spasticity intratekálnym podávaním baklofénu z hľadiska bezpečnosti a efektivity tejto metódy.
Súbor a metodika
V období od 9/ 2004 do 2/ 2019 sme na Neurochirurgickej klinike implantovali baklofénovú pumpu – Synchromed II (Medtronic, Dublin, Írsko) v liečbe ťažkej refraktérnej spasticity 24 pacientom. Súbor tvorilo 8 žien, 16 mužov, s mediánom veku 36 (30–51) rokov, najmladší pacient bol 16 ročný, najstarší 65 ročný. Celkom 13 pacientov utrpelo úraz miechy (od C3 po Th9), 7 pacientov má roztrúsenú sklerózu v chronicko-progredujúcom štádiu, s mediánom anamnézy ochorenia 12 (9–19) rokov pred implantáciou baklofénovej pumpy. Ďalší 4 pacienti trpia spasticitou inej cerebrospinálnej etiológie: 1× DMO, 1× neurogénna dystónia, 1× bazilárna meninigitída v detstve, 1× hereditárna spastická paraparéza. Pacienti trpeli ťažkou, prevažne spinálnou spasticitou. Boli vyčerpané možnosti farmakoterapie, tzn. ďalšie zvyšovanie dávky neviedlo k zníženiu svalového hypertonusu či k zmierneniu bolestivých spazmov. V troch prípadoch bol limitom farmakoterapie výskyt nežiadúcich účinkov zo strany gastrointestinálneho traktu (GIT) pri navyšovaní dávky. Pacienti boli väčšinou imobilní, používali invalidný vozík, len traja pacienti boli schopní chôdze pomocou chodítka, event. pomocou francúzskych barlí. Vačšina pacientov trpela početnými bolestivými kŕčmi, ktoré nielenže znemožňovali rehabilitáciu a komplikovali ošetrovateľskú starostlivosť, ale samotnými pacientmi boli hodnotené ako veľmi limitujúce z hľadiska sebestačnosti a kvality života. Všetci pacienti mali pozitívny test na jednorázové podanie baklofénu (obr. 1), tzn. že s odstupom 2–4 h po podaní 100 μg baklofénu lumbálnou punkciou prišlo k zníženiu svalového hypertonu su aspoň o dva stupne Ashworthovej škály. Implantáciu pumpového systému vykonával neurochirurg, pacienti boli v celkovej anestézii v polohe na pravom boku. Najprv sa v oblasti L2–5 paraspinálne pomocou Tuohy ihly zaviedol katéter intratekálne (obr. 2) tak, aby sa koniec katétra nachádzal zhruba vo výške Th10–Th12 (aspoň 20 cm katétra intratekálne). Správna poloha katétra bola potvrdená vizuálne – kvapka likvoru na konci katétra, event. fluoroskopicky. Súčasne bola vytvorená podkožná kapsa v oblasti ľavého hypochondria pre samotnú pumpu, ktorej rezervoár bol po odsatí pôvodnej náplne (sterilný fyziologický roztok) naplnený cez antibakteriálny filter baklofénom, obvykle 20 ml (event. 40 ml) v koncentrácii Lioresal Intrathecal 2 mg/ ml. Následne bol katéter tunelizovaný k pumpe, na ktorú bol napojený (obr. 3). Telemetricky bol nastavený program pumpy, ktorý bol spustený ešte na operačnej sále v režime ,,simple continuous“. Začínali sme počiatočnou dávkou 100 μg baklofénu za 24 h. Pacienti boli po implantácii preložení na jednotku intenzívnej starostlivosti (JIS) Neurochirurgickej kliniky, kde boli monitorovaní (krvný tlak, pulz, oxygenácia, EKG). Dávku baklofénu sme navyšovali postupne, aby sme sa vyhli nežiadúcim účinkom z predávkovania. Za účinnú hladinu sme považovali dávku, pri ktorej došlo k znížení spasticity o 1–2 stupne podľa Ashworthovej škály a kedy boli pacienti sami spokojní s dosiahnutým stavom. Dopĺňanie rezervoáru pumpy baklofénom prebiehalo v 3–6 mesačných intervaloch v závislosti na veľkosti dávky a množstve lieku v rezervoáre pumpy. Spasticita bola zhodnotená pomocou klinických škál: Ashworthova škála, Škála frekvencie spazmov, Škála tonusu adduktorov (tab. 1–3) pred implantáciou a ďalej po titrácii účinnej dávky po implantácii baklofénovej pumpy. Na zhodnotenie schopnosti vykonávať bežné denné činnosti sme použili Barthelovej test (tab. 4) pred implantáciou baklofénovej pumpy a rok, 5 a 10 rokov po nej.
Obr. 1. Baklofénový test – jednorazové intratekálne podanie baklofénu lumbálnou punkciou.
Fig. 1. Intrathecal baclofen screening test – injection of a test dose of baclofen into the intrathecal space.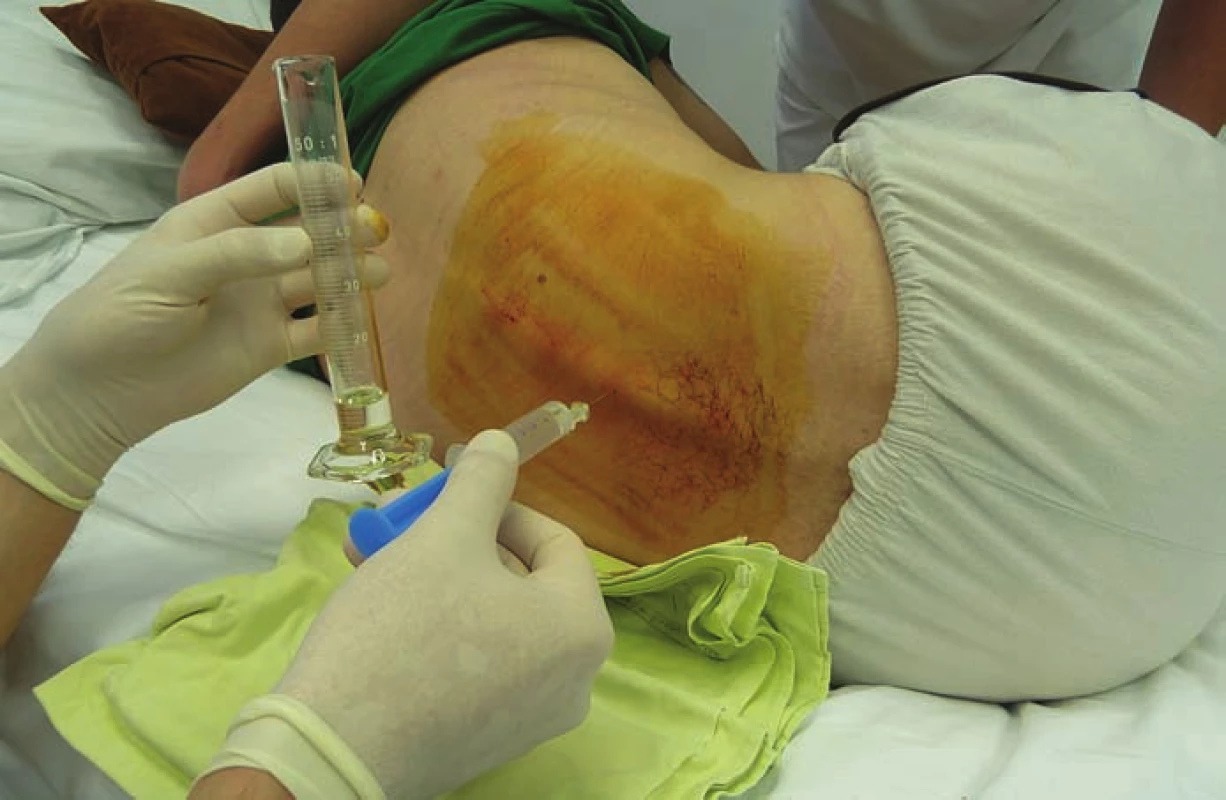
Obr. 2. Implantácia baklofénovej pumpy – zavádzanie katétra do intratekálneho priestoru.
Fig. 2. Baclofen pump implantation – catheter is inserted into the intrathecal space.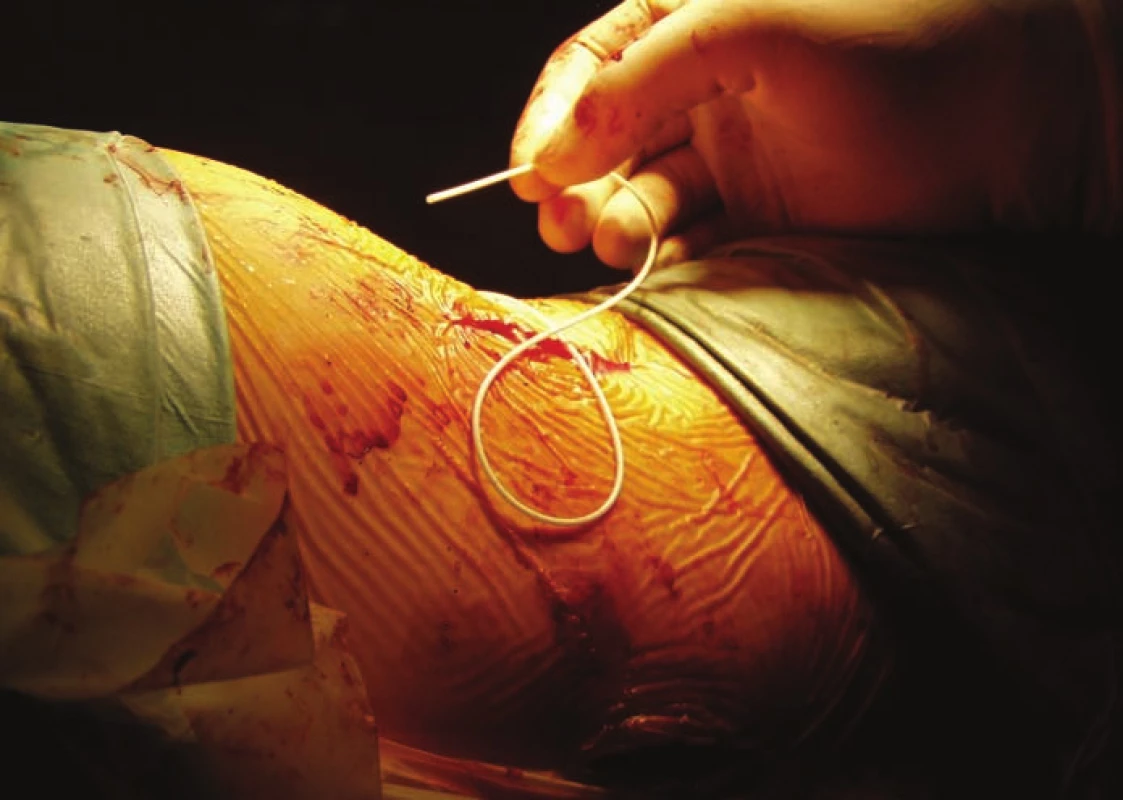
Obr. 3. Implantácia baklofénovej pumpy – napojenie tunelizovaného katétra na pumpu, ktorá je následne vložená do podkožia.
Fig. 3. Baclofen pump implantation – catheter is tunneled and connected to the pump, which is placed into the sack under the skin of the abdomen.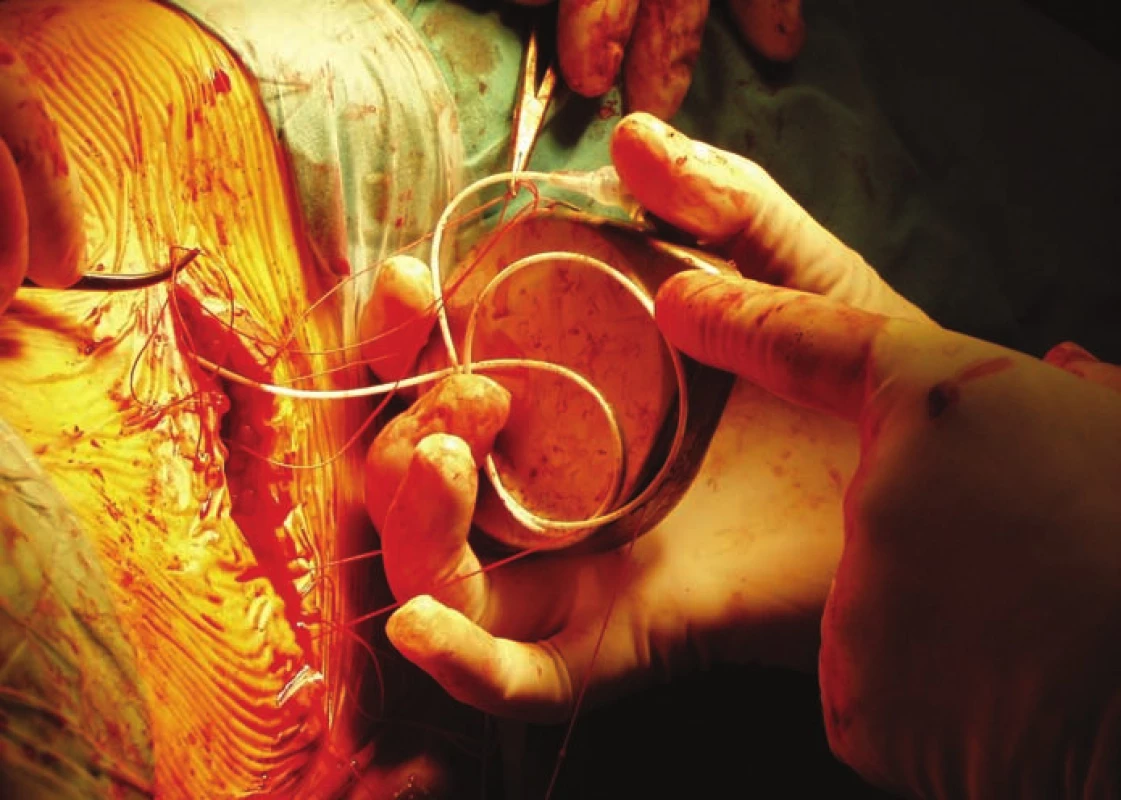
Tab. 1. Ashworthova škála – hodnotenie svalového hypertonusu. 
Tab. 2. Škála frekvencie spazmov – počet spazmov za 24 h. 
Tab. 3. Hodnotenie tonusu adduktorov. 
Štatistická analýza: všetky hodnoty boli vyjadrené ako medián a medzikvartilové rozpätie ako miera variability. Bol použitý Wilcoxonov test, kde p < 0,01 sme považovali za štatisticky významné, p < 0,001 za signifikantne významné.
Výsledky
Medián doby sledovania pacientov bol 92 (41–136) mesiacov. Najkratšia doba sledovania bola 12, najdlhšia 173 mesiacov. V priebehu sledovania ani jeden pacient nezomrel, ani jeden pacient neutrpel nový permanentný neurologický deficit ako dôsledok operácie či chronického intratekálneho podávania baklofénu. Pacienti v našom súbore mali po titrácii účinnej hladiny dennú dávku intratekálneho baklofénu v rozpätí 200–450 μg s mediánom 330 μg/ deň. U všetkých 24 pacientov s programovateľnou implantabilnou pumpou sme po titrácii účinnej dávky baklofénu zaznamenali štatisticky signifikantný pokles spasticity podľa Ashworthovej škály (medián pred implantáciou 4 [3–4], medián po implantácii 1 [1–1], p < 0,000012), štatisticky signifikantný pokles frekvencie spazmov (medián pred implantáciou 4 [4–4], medián po implantácii 1 [0–1], p < 0,000015), štatisticky signifikantný pokles spasticity podľa tonusu adduktorov (medián pred implantáciou 4 [3–4], medián po implantácii 1 [0–1], p < 0,000011) (tab. 5). U pacientov s dobou sledovania 12 a viac mesiacov (24 pacientov) sme rok po implantácii baklofénovej pumpy zaznamenali štatisticky signifikantný nárast skóre v Barthelovej teste (medián pred implantáciou 30 [10–49], medián rok po implantácii 45 [25–70], p = 0,000018). Rok po implantácii baklofénovej pumpy stúpla sebaobslužnosť a samostatnosť pacientov v Barthelovej teste z kategórie „vysoká závislosť” na kategóriu „závislosť stredného stupňa” (tab. 4). U pacientov s dobou sledovania 60 a viac mesiacov (17 pacientov) sme zopakovali Barthelovej test po 5 rokoch od implantácie pumpy. Opäť sme zaznamenali štatisticky signifikantný nárast skóre v Barthelovej teste (medián pred implantáciou 25 [10–35], medián 5 rokov po implantácii 40 [25–58], p = 0,000276). U pacientov s dobou sledovania 120 a viac mesiacov (10 pacientov), sme zopakovali Barthelovej test po 10 rokoch od implantácie prvej baklofénovej pumpy. Aj v tomto prípade sme zaznamenali štatisticky významný nárast skóre v Barthelovej teste (medián pred implantáciou 22,5 [10–35], medián 10 rokov po implantácii 40 [21–60], p = 0,00854) (tab. 6). Tento nárast však nestačil na zmenu kategórie a pacienti sú po 5 a taktiež i po 10 rokoch od implantácie baklofénovej pumpy v kategórii „vysoká závislosť” podľa Barthelovej (tab. 4). Mierny pokles skóre v Barthelovej teste po 5 rokoch v porovnaní so skóre 1 rok od implantácie baklofénovej pumpy je spôsobený tým, že u štyroch pacientov toto skóre po prechodnom náraste po 1 roku, po 5 rokoch mierne pokleslo. Vo všetkých štyroch prípadoch to boli pacienti s diagnózou roztrúsenej sklerózy s progresiou základného ochorenia.
Tab. 4. Barthelovej test základných denných aktivít 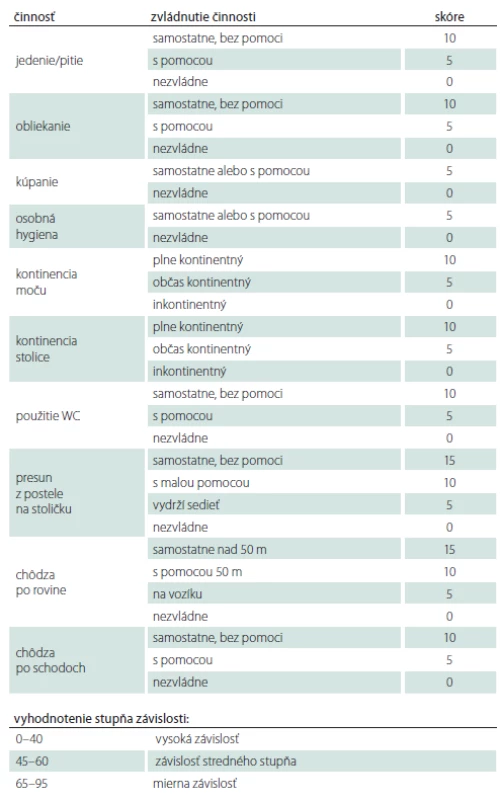
Tab. 5. Klinické škály spasticity, medián (medzikvartilové rozpätie), pred a po implantácii baklofenovej pumpy, štatistická významnosť. 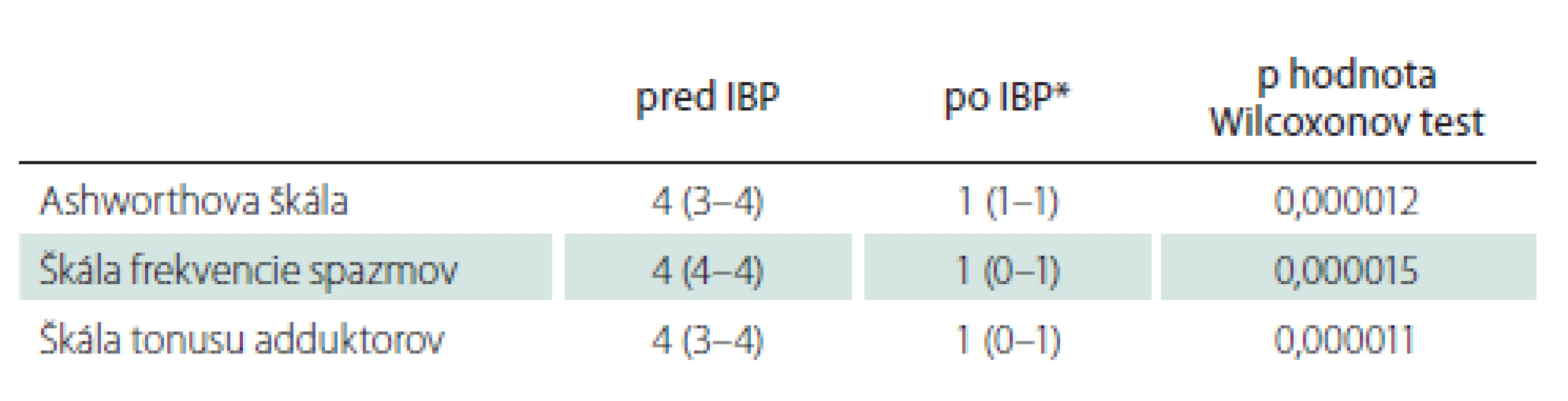
* po titrácii účinnej dávky; p < 0,001 – štatisticky signifi kantne významné IBP – implantácia baklofénovej pumpy Tab. 6. Barthelovej test, medián (medzikvartilové rozpätie), pred, 1 rok, 5 a 10 rokov po implantácii baklofenovej pumpy, štatistická významnosť. 
p < 0,01 štatisticky významné; p < 0,001 štatisticky signifikantne významné IBP – implantácia baklofénovej pumpy Po implantácii baklofénovej pumpy sme zaznamenali absolútnu redukciu perorálnej liečby. Ani jeden pacient neužíva baklofén v tabletkovej forme, traja pacienti stále užívajú perorálne tizanidin na ovplyvnenie spasticity na horných končatinách. U troch pacientov sme zaznamenali príznaky z predávkovania baklofénom: v dvoch prípadoch to bola svalová hypotónia doprevádzaná inkontinenciou moču a stolice s úpravou stavu po znížení dávky; v jednom prípade bol svalový hypotonus doprevádzaný arteriálnou hypotenziou s cefaleou a nauzeou, čo si vyžiadalo dočasné pozastavenie baklofénovej pumpy a uloženie pacienta na monitorované lôžko do odoznenia týchto príznakov. V štyroch prípadoch sme zaznamenali afunkciu katétra: 3× z dôvodu dislokácie preukázateľnej na röntgenovej snímke; 1× sme v rámci diagnostiky použili aplikáciu kontrastnej látky bočným portom pumpy za súčastnej skiaskopie a následnej perimyelografie s CT myelografiou, no jasnú príčinu sme nenašli. Vo všetkých prípadoch došlo k úprave funkcie systému po výmene katétra. U dvoch pacientov sa vyskytla infekcia operačnej rany v oblasti podkožnej kapsy, čo sme riešili operačnou revíziou a antibiotickým preliečením. U jedného pacienta sme z dôvodu dekubitu v oblasti pôvodnej podkožnej kapsy umiestnili pumpu do podkožia na inom mieste. 13 pacientov podstúpilo výmenu baklofénovej pumpy z dôvodu skončenia životnosti, z toho jeden pacient podstúpil túto výmenu už dvakrát. K výmene baklofénovej pumpy pre skončenie životnosti sa pristúpilo po 7 rokoch, v troch prípadoch po 6 rokoch od implantácie prvej pumpy.
Diskusia
Svalový hypertonus a bolestivé spazmy výrazne zhoršujú kvalitu života pacientov s léziou centrálneho motoneurónu, znižujú ich pohyblivosť, sebestačnosť a obmedzujú bežné denné aktivity. Spasticita je väčšinou celoživotný problém. V terapii je dôležité stanovenie si hoci malých, ale reálnych cieľov, ktoré vieme s pacientom postupne dosiahnuť. Vyžaduje si multidisciplinárny prístup (neurológ, rehabilitačný lekár, neurochirurg, fyzioterapeut, ergoterapeut) vrátane vhodnej kombinácie farmakoterapie s fyzioterapiou „ušitých na mieru“ konkrétneho pacienta [20]. Princípy chirurgickej liečby spasticity (selektívna periférna neurotómia, longitudinálna myelotómia, rizotómia atď.) sú založené na deštruktívnych metódach, neriešia vlastný zdroj spasticity a sú to de facto paliatívne výkony. Implantácia programovateľnej infúznej pumpy je však kreatívnym postupom, ktorý prináša novú fyziologickú funkciu so zachovaním pôvodnej funkcie [21]. Zavedenie tejto metódy do klinickej praxe možno považovať za významný prelom nielen v liečbe ťažkej spasticity, ale i v liečbe refraktérnej bolesti (intratekálne aplikovaný morfín) u onkologických pacientov [22].
Náš súbor tvoria prevažne pacienti s traumatickým postihnutím miechy a pacienti s roztrúsenou sklerózou, čo je v zhode s prevalenciou ťažkej spasticity [2–4]. Ťažká spasticita je častou komplikáciou i pacientov s DMO [5]. Intratekálny baklofén je v liečbe pacientov s touto diagnózou veľmi efektívny a implantácia je v dikcii detského neurochirurga. V našom súbore máme jedného dospelého pacienta s DMO. Problematická spasticita však postihuje i isté percento pacientov po CMP [6–9]. Výsledky multicentrických, randomizovaných štúdií doporučujú intratekálnu aplikáciu baklofénu i v liečbe ťažkej refraktérnej spasticity u pacientov po CMP [23]. Tento typ pacientov však v našom súbore nemá zastúpenie. Naproti tomu v súbore máme pacienta s hereditárnou spastickou paraparézou (HSP), čo je vzácna diagnóza, ktorá sa vyznačuje progredujúcou spastickou paraparézou. V terapii spasticity sa používa hlavne baklofén v tabletkovej forme. Doporučuje sa i intratekálne podávanie baklofénu pumpovým systémom. Túto formu aplikácie je však treba dôkladne zvážiť, pretože môže indukovať výraznú slabosť dolných končatín, ktorá znemožní chôdzu. Dôležité je preto správne posúdenie pohybových funkcií pri testovaní baklofénu. Pacient z nášho súboru netoleroval baklofén v perorálnej forme (nežiadúce účinky zo strany GIT – hnačky), preto implantácia baklofénovej pumpy sa javila ako potenciálne riešenie. Vykonali sme baklofénový test (podľa protokolu nášho pracoviska), ktorý bol pozitívny, súčasne neprišlo k výraznej hypotónii a pacient bol spokojný s efektom. Aktuálne, 3 roky po implantácii, pacient nemá spastické kŕče a je schopný chôdze pomocou dvoch francúzskych barlí. Pre komplexnosť uvádzame i menej časté diagnózy, kde na ovplyvnenie ťažkej refraktérnej spasticity prichádza do úvahy liečba intratekálnym baklofénom: stiff-person syndrome [24], amyotrofická laterálna skleróza [25], resp. primárna laterálna skleróza.
Ako u spondylochirurgického centra v našom súbore dominujú imobilní pacienti s ťažkou refraktérnou spasticitou ako následok úrazu miechy. Z toho vyplýva i stratégia testovania našeho pracoviska, ktorá je založená na zodpovedaní otázky, či je baklofén podaný intratekálne u daného pacienta účinný alebo neúčinný. Preto podávame jednorázovo 100 μg baklofénu lumbálnou punkciou. Konkrétna dávka sa vždy dá vytitrovať nastavením pumpy. V priebehu testovania pacienta monitorujeme na JIS. Taktiež kontrolujeme nežiadúce účinky baklofénu (zníženie tlaku krvi, cefalea, nadmerný hypotonus, zvracanie). Tie sa naštastie vyskytujú len u malého množstva testovaných osôb, spontánne odoznievajú a po implantácii pumpy sa väčšinou nevyskytujú. V našej praxi sme zaznamenali jeden prípad (pacientka s roztrúsenou sklerózou), kedy pri testovaní prišlo k nadmernému zníženiu svalového tonusu a k implantácii pumpy sme nepristúpili. Táto stratégia testovania intratekálneho baklofénu je medzinárodne akceptovaná, no v súčastnosti sa odbornou spoločnosťou doporučuje v priebehu testovania baklofénu začať dávkou 50 μg a postupne navyšovať o 25 μg za deň do maximálnej dávky 100 μg (3-dňový protokol). Schéma je navrhnutá tak, aby sa predišlo nežiadúcim účinkom z predávkovania. Jednotlivú dávku je možné podať jednorázovo lumbálnou punkciou alebo kontinuálne dočasne zavedeným intratekálnym katétrom. Za pozitívny účinok sa považuje zníženie svalového hypertonusu o 1–2 body podľa Ashworthovej škály, zníženie frekvencie spazmov o 1–2 stupne [26]. Testovanie kontinuálnym podávaním je obzvlášť vhodné u pacientov s cerebrálnym typom spasticity, kedy sa hodnotí efekt pozvolne, kontinuálne navyšovanej dávky baklofénu pri rôznych funkčných testoch v kontexte optimalizácie funkcie.
Výhodou plne programovateľných pumpových systémov je variabilita programov, ktoré umožňujú flexibilné podávanie v rôznych režimoch, napr. kontinuálne (simple-continuous) alebo bolusovo (flex-mode), s vyššou dávkou v noci alebo v priebehu dňa, s pacientským ovládaním pomocou vonkajšieho ovládača, ktorý má pacient doma. Flexibilita v programovaní režimov a dávkovania je výhodná hlavne u progredujúcich ochoreniach alebo u ochoreniach s kolísavým priebehom (roztrúsená skleróza, HSP). V našom súbore majú všetci pacienti režim simple-continuous.
I napriek relatívnej bezpečnosti tejto metódy sa môžu vyskytnúť komplikácie, ktoré, ak sa včas nerozpoznajú a adekvátne neriešia, môžu vyústiť v život ohrozujúcu situáciu. Preto je nevyhnutné, aby odborný personál, ktorý pracuje s touto liečebnou modalitou, poznal nežiadúce účinky intratekálne podávaného baklofénu, obzvášť prejavy akútneho predávkovania a náhleho odňatia baklofénu. Akútne predávkovanie vznikne väčšinou v rámci ľudského omylu, ako napr. neadekvátne vysoká prvá dávka. Prejavuje sa zvýšenou svalovou slabosťou, únavou, arteriálnou hypotenziou, znížením dychových funkcií, epileptickými záchvatmi, v krajnom prípade až somnolenciou, bezvedomím. Je nutné umiestniť pacienta na JIS. Okamžitou liečbou je zastavenie funkcie pumpy a odsatie baklofénu z pumpy a mozgovomiešneho moku. Selektívne antidotum baklofénu neexistuje. Používa sa taktiež fyzostigmín na úpravu dýchania a somnolencie. Naproti tomu chronické predávkovanie sa vyvíja postupne, prejavuje sa ako nadmerná svalová hypotónia, často doprevádzaná inkontinenciou. Po znížení dávky baklofénu sa svalový tonus a sfinkterové funkcie normalizujú. Názory na možnosť vzniku tolerancie na baklofén sú kontroverzné. Pripúšťa sa, že vzniká asi u 8–10 % pacientov. Doporučenou liečbou sú tzv. liekové prázdniny, pozvolné vysadzovanie až dočasné vysadenie baklofénu. Inou možnosťou ovplyvnenia tolerancie je zmena režimu podávania intratekálneho baklofénu, prechod z kontinuálneho na bolusové podávanie [27]. Ďalším závažným problémom je náhle prerušenie dodávky baklofénu do intratekálneho priestoru. Príčinou môže byť chybná činnosť pumpy alebo porucha katétra. Rozvíja sa abstinenčný syndróm. Medzi klinické príznaky patrí nárast spasticity, motorický i psychický nekľud, pruritus bez vyrážky, arteriálna hypotenzia, horúčka, rabdomyolýza a následné renálne a multiorgánové zlyhanie. Vždy je nutná hospitalizácia na JIS a čo najrýchlejšie obnovenie dodávky baklofénu do intratekálneho priestoru. Taktiež sa doporučuje intravenózna aplikácia benzodiazepínu v malej dávke spoločne s perorálnym baklofénom v závislosti od závažnosti klinického stavu. Abstinenčné príznaky potom v priebehu niekoľkých dní ustupujú. Najčastejšie sa jedná o komplikácie spojené s katétrom, udáva sa výskyt až 66 %. Môže ísť o dislokáciu, zalomenie, pretrhnutie, upchatie, rozpojenie a atď. Úspešné riešenie si často vyžaduje až chirurgickú intervenciu a výmenu katétra. Naproti tomu komplikácie vlastného pumpového systému ako preplnenie, pretočenie pumpy, event. poškodenie a vybitie batérie sú veľmi vzácne, zhruba okolo 3–5 % [28]. Pri podozrení na malfunkciu pumpy spojenú so zvýšenou spasticitou je dôležité čo najrýchlejšie zistiť príčinu komplikácie. V úvode je vhodné podať jednorazový bolus baklofénu programom pumpy a čakať na klinickú odozvu. Na overenie polohy pumpy, katétra a jeho hrotu používame röntgenovú snímku event. CT. Správnu funkciu overíme podaním špeciálnej kontrastnej látky do bočného portu pumpy (predtým je nutné odsať obsah katétra) za súčasnej skiaskopie, event. následnej CT myelografie. Pri podozrení na nedostatočnú funkciu pumpy je možné urobiť röntgenovú snímku pred plnením pumpy a po ňom k dôkazu otočenia rotoru pumpy – tzv. rotorový test [29]. Ako dôkaz prítomnosti baklofénu v intratekálnom priestore môžeme použiť H-reflex, ten je v tomto prípade nevýbavný. V prípade, že nenájdeme príčinu zvýšenej spasticity, vždy revidujeme katéter.
Efektivita liečby intratekálne aplikovaným baklofénom v zmysle redukcie spasticity bola demonštrovaná vo viacerých štúdiách [30–31]. V literatúre je menej štúdií, ktoré hodnotia vplyv tejto liečebnej modality na aktivity bežného života. Obzvlášť cenné sú štúdie s dlhodobým sledovaním pacientov. Prednosťou našej práce je práve dĺžka doby sledovania s mediánom 92 (41–136) mesiacov.
Záver
Výsledky nášho súboru potvrdili, že kontinuálne intratekálne podávanie baklofénu je veľmi účinná metóda v liečbe ťažkej refraktérnej spasticity. Po titrácii účinnej hladiny baklofénu sme u pacientov zaznamenali signifikantný pokles svalového hypertonusu a frekvencie bolestivých spazmov, čo viedlo k zlepšeniu sebestačnosti pacientov pri vykonávaní bežných denných činností. Taktiež sme potvrdili, že sa jedná o bezpečnú metódu. Komplikácie, ak sa vyskytnú, nebývajú závažné a vieme ich úspešne riešiť. Prekážkou častejšieho využitia tejto metódy je stále vysoká cena pumpového systému a administratívna náročnosť spojená s opakovaným žiadaním Ministerstva zdravotníctva na udelenie výnimky na dovoz lieku. Dostupnosť tejto metódy je jedným z indikátorov vypovedajúcim nielen o stave zdravotníctva, ale i o sociálno-kultúrnej úrovni spoločnosti.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Soňa Vaneková
Klinika fyziatrie, balneológie
a liečebnej rehabilitácie
FN s poliklinikou Nové Zámky
Slovenská 5587/11A
940 02 Nové Zámky
Slovensko
e-mail: svanekova@gmail.com
Přijato k recenzi: 2. 4. 2019
Přijato do tisku: 11. 6. 2019
Zdroje
1. Lance JW. Symposium synopsis. In: Feldman RG, Young RR, Koella WP (eds.). Spasticity: disordered motor control. Chicago: Yearbook Medical 1980 : 485–494.
2. Maynard FM, Karunas RS, Waring WP 3rd. Epidemiology of spasticity following traumatic spinal cord injury. Arch Phys Med Rehabil 1990; 71(8): 566–569.
3. Noreau L, Proulx P et al. Secondary impairments after spinal cord injury: a population-based study. Am J Phys Med Rehabil 2000; 79(6): 526–535.
4. Rizzo MA, Hadjimichael OC, Preiningerova J et al. Prevalence and treatment of spasticity reported by multiple sclerosis patients. Mult Scler 2004; 10(5): 589–595. doi: 10.1191/ 1352458504ms1085oa.
5. Wichers MJ, Odding E, Stam HJ et al. Clinical presentation, associated disorders and aetiological moments in Cerebral Palsy: a Dutch population-based study. Disabil Rehabil 2005; 27(10): 583–589. doi: 10.1080/ 09638280400018445.
6. Watkins CL, Leathley MJ, Gregson JM et al. Prevalence of spasticity post stroke. Clin Rehabil 2002; 16(5): 515–522. doi: 10.1191/ 0269215502cr512oa.
7. Lundstrom E, Terent A, Borg J. Prevalence of disabling spasticity 1 year after first-ever stroke. Eur J Neurol 2008; 15(6): 533–539. doi: 10.1111/ j.1468-1331.2008.02114.x.
8. Opheim A, Danielsson A, Alt Murphy M et al. Upper-limb spasticity during the first year after stroke: stroke arm longitudinal study at the university of gothenburg. Am J Phys Med Rehabil 2014; 93(10): 884–896. doi: 10.1097/ PHM.0000000000000157.
9. Jech R, Klinické aspekty spasticity. Neurol praxi 2015; 16(1): 14–19.
10. Lapeyre E, Kuks JB, Meijler WJ. Spasticity: revisiting the role and the individual value of several pharmacological treatments. NeuroRehabilitation 2010; 27(2): 193–200. doi: 10.3233/ NRE-2010-0596.
11. Snow BJ, Tsuji JK, Bhart MH et al. Treatment of spasticity with botulinum toxin: a double-blind study. Ann Neurol 1990; 28(4): 512–515. doi: 10.1002/ ana.410280407.
12. Olvey EL, Armstrong EP, Grizzle AJ. Contemporary pharmacologic treatments for spasticity of the upper limb after stroke: a systematic review. Clin Ther 2010; 32(14): 2282–2303. doi: 10.1016/ j.clinthera.2011.01.005.
13. Rosales RL, Chua-Yap AS. Evidence-based systematic review on the effi cacy and safety of botulinum toxin-A therapy in post-stroke spasticity. J Neural Transm (Vienna) 2008; 115(4): 617–623. doi: 10.1007/ s00702-007-0869-3.
14. Simon O, Yelnik AP. Managine spasticity with drugs. Eur J Phys Rehabil Med 2010; 46(3): 401–410.
15. Penn RD, Kroin JS. Intrathecal baclofen alleviates spinal cord spasticity. Lancet 1984; 1(8385): 1078. doi: 10.1016/ s0140-6736(84)91487-9.
16. Boviatis EJ, Kouyialis AT, Korfias S et al. Functional outcome of intrathecal baclofen administration for severe spasticity. Clin Neurol Neurosurg 2005; 107(4): 289–295. doi: 10.1016/ j.clineuro.2004.09.007.
17. Dario A, Scamoni C, Bono G et al. Functional improvement in patients with severe spinal spasticity treated with chronic intrathecal baclofen infusion. Funct Neurol 2001; 16(4): 311–315.
18. Zahavi A, Geertzen JH, Staal M et al. Long term effect (more that five years) of Intrathecal baclofen on impaitrment, disability and quality of life in patients with severe spasticity of spinal origin. J Neurol Neurosurg Psychiatry 2004; 75(11): 1553–1557. doi: 10.1136/ jnnp.2003.014282.
19. Stetkarova I, Yablon SA, Kofl er M et al. Procedure and device-related complications of intrathecal baclofen administration for management of adult muscle hypertonia: a review. Neurorehabil Neural Repair 2010; 24(7): 609–619. doi: 10.1177/ 1545968310363585.
20. Štetkářová I. Léčba spasticity u dospelých. Med praxi 2012; 9(3): 124–126.
21. Houdek M, Kala M, Pavlíček V. Míšní spasticita – nové léčebné možnosti. Praktický lékař 1996; 76 : 3110–3112.
22. Gregorová J, Holečková P. Intratekální podání léčiv u onkologického pacienta s refraktérní bolestí. Klin Farmakol Farm 2017; 31(3): 23–27.
23. Creamer M, Cloud G, Kossmehl P et al. Intrathecal baclofen therapy versus conventional medical management for severe poststroke spasticity: result from a multicentre, randomised, controlled, open/ label trial (SISTERS). J Neurol Neurosurg Psychiatry 2018; 89(6): 642–650. doi: 10.1136/ jnnp-2017-317021.
24. Stayer C, Tronnier V, Dressnandt J et al. Intrathecal baclofen therapy for stiff-person syndrome and progressive encephalomyelopathy with rigidity and myoclonus. Neurology 1997; 49(6): 1591–1597. doi: 10.1212/ wnl.49.6.1591.
25. Marquardt G, Lorenz R. Intrathecal baclofen for intractable spasticity in amyotrophic lateral sclerosis. J Neurol 1999; 246(7): 619–620.
26. Štětkářová I, Ehler E, Jech R. Spasticita a její léčba. Praha: Maxdorf 2012 : 117–128.
27. Heetla HW, Staal MJ, Kliphuis C et al. The incidence and management of tolerance in inrathecal baclofen therapy. Spinal Cord 2009; 47(10): 751–756. doi: 10.1038/ sc.2009.34.
28. Štětkářová I, Yablon SA, Kofler M et al. Procedure - and device - related complications of intrathecal baclofen administration for management of adult muscle hypertonia: a review. Neurorehabil Neural Repair 2010; 24(7): 609–619. doi: 10.1177/ 1545968310363585.
29. Avellino AM, Loeser JD. Intrathecal baclofen for the treatment of intractable spasticity of spine and brain etiology. Neuromodulation 2000; 3(2): 75–81. doi: 10.1046/ j.1525-1403.2000.00075.x.
30. Coffey JR, Cahill D, Steers W et al. Intrathecal baclofen for intractable spasticity of spinal origin: results of a long-term multicenter study. J Neurosurg 1993; 78(2): 226–232. doi: 10.3171/ jns.1993.78.2.0226.
31. Penn RD, Savoy SM, Corcos D et al. Intrathecal baklofen for severe spinal spasticity. New Engl J Med 1989; 320(23): 1517–1521. doi: 10.1056/ NEJM198906083202303.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2019 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Editorial
- Intrakraniálna stenóza – najlepšiu konzervatívnu liečbu je vhodné kombinovať so stentom - ÁNO
- Intrakraniální stenóza – nejlepší konzervativní léčbu je vhodné kombinovat se stentem - NE
- Intrakraniálna stenóza – najlepšiu konzervatívnu liečbu je vhodné kombinovať so stentom
- Multisystémová atrofie
- Spektrum MR nálezů progresivní multifokální leukoencefalopatie u kohorty pacientů s roztroušenou sklerózou v ČR
- Stanovení míry shody mezi záchranáři a neurology při identifi kaci těžké hemiparézy u pacientů s akutní cévní mozkovou příhodou
- Vyšetření čichu před operací nosní polypózy a po ní
- Retrospektivní autoevaluace výsledků operací intrinsických mozkových nádorů – konsekutivní kohorta 270 operací v rámci jednoho neurochirurgického centra NOS ČOS (Neuroonkologické sekce České onkologické společnosti) z let 2015–2017
- Spina bifida v České republice – incidence a prenatální diagnostika
- Čichová dysfunkce u české skupiny pacientů s idiopatickou poruchou chování v REM spánku
- Dvě původní české zkoušky k vyšetření paměti za tři minuty – Amnesia Light and Brief Assessment (ALBA)
- Liečba ťažkej spasticity intratekálnym podávaním baklofénu – 15-ročné skúsenosti
- Profil behaviorálních projevů u idiopatické poruchy chování v REM spánku
- Vliv subkutánně podávaného interferonu β-1a na aktivitu onemocnění u pacientů s klinicky izolovaným syndromem – observační studie ATRACT
- Je nutné při operační léčbě chronického subdurálního hematomu trepanací a drenáží provádět i výplach hematomu?
- Hypersomnia pri akútnej bitalamickej ischémii
- Postižení sluchu po spinální anestezii
- Objemná pneumokéla frontálního sinu s rozsáhlým intrakraniálním šířením imitujícím dysfunkci lumboperitoneální drenáže u predisponovaného pacienta s Marfanovým syndromem
- Dehiscence horního polokruhovitého kanálku
- Analýza dat v neurologii LXXVI. Korelační analýza vícerozměrných souborů kvantitativních a kvalitativních dat – představení vybraných ukazatelů
- Komentář k článku autorů Zítek et al Anterior choroidal artery aneurysm Cesk Slov Neurol N 2019; 82/ 115(3): 350–351
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Multisystémová atrofie
- Dehiscence horního polokruhovitého kanálku
- Spina bifida v České republice – incidence a prenatální diagnostika
- Postižení sluchu po spinální anestezii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



