-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zmeny v aktivite syntázy oxidu dusnatého v mieche po ligácii koreňov cauda equina v experimente
Changes in the Nitric Oxide Synthase Activity in the Spinal Cord after Multiple Cauda Equina Constrictions in the Experiment
Nitric oxide (NO) is known as a signalling molecule playing an important role in the pathophysiology of many neurodegenerative disorders. However, little is known about the role of NO in the pathogenesis of cauda equina syndrome. In the present study we investigated calcium-dependent nitric oxide synthase (NOS) activity in the Th1–Th12, L1–L3 and L4–L7 spinal cord segments divided into dorsal, medial and ventral parts and, neuronal NOS immunoreactivity (nNOS-IR) in L4–L7 segments after surgically-induced multiple cauda equina constrictions (MCEC) in the dog and after survival of experimental animals for 2 and 5 days. A significant increase of calcium-dependent NOS activity was noted in the dorsal part of thoracic and upper lumbar segments 2 days after MCEC. However, at 5th day the enzyme activity in the dorsal part of both above mentioned spinal cord segments was significantly decreased. No significant changes were noted in the dorsal part of L4–L6 segments. In the medial part of L4–L7 segments taken 2 days after MCEC, calcium-dependent NOS activity was only transiently enhanced; the value returned nearly to control level within 5 postconstriction days. MCEC, lasting for 2 days did not caused changes in enzyme activity in medial part of thoracic and upper lumbar segments. Significant differences were noted only 5 days after MCEC. The effect of MCEC on calcium-dependent NOS activity in the ventral part of thoracic, upper and lower lumbar segments was similar, showing a significant increase of enzyme activity in all segments studied, except for its decrease in the upper lumbar segments 5 days after postconstriction. The increase of calcium-dependent NOS activity in the lower lumbar segments correlates with increased number of NOS-IR neurons located in laminae VIII and IX and enhanced expression of NOS-IR axons in the ventrolateral column.
Key words:
cauda equina syndrome – nitric oxide synthase – spinal cord – dog
Autoři: J. Kafka 1; N. Lukáčová 2; D. Čížková 2; J. Maršala 2
Působiště autorů: Neurochirurgická klinika FNLP, Rastislavova 43, Košice 1; Neurobiologický ústav SAV, Šoltésovej 4, Košice 2
Vyšlo v časopise: Cesk Slov Neurol N 2007; 70/103(5): 505-511
Kategorie: Původní práce
Podporené VEGA grantom 2/3217/23, 2/5134/25 a APVV grantom 51-01-3002.
Souhrn
Oxid dusnatý (NO) je známy ako signálna molekula, ktorá hrá dôležitú úlohu v patofyziológii mnohých neurodegeneratívnych ochorení. Málo sa však vie o úlohe NO v patogenéze cauda equina syndrómu. V práci sme sledovali aktivitu kalciovo-závislej syntázy oxidu dusnatého (NOS) v Th1–Th12, L1–L3 a L4–L7 segmentoch miechy, rozdelenej na dorzálnu, mediálnu a prednú časť a neurónovú NOS imunoreaktivitu (nNOS-IR) v L4–L7 segmentoch po chirurgicky navodenej mnohonásobnej konstrikcii cauda equina (MCEC) u psa a po prežívaní experimentálnych zvierat po dobu 2 a 5 dní. Signifikantné zvýšenie kalciovo-závislej NOS aktivity bolo zaznamenané v zadnej časti torakálnych a horných lumbálnych segmentov 2 dni po MCEC, kým na piaty deň enzýmová aktivita v zadnej časti vyššie uvedených miechových segmentov sa signifikantne znížila. Nevýrazné rozdiely sa zaznamenali v zadnej časti L4–L6 segmentov. V mediálnej časti L4–L7 segmentov odobranej 2 dni po MCEC, bola kalciovo-závislá NOS aktivita zvýšená len prechodne; hodnota sa vrátila takmer na úroveň kontroly piaty deň po konstrikcii. 2 dni trvajúca MCEC nespôsobila zmeny v enzýmovej aktivite v mediálnej časti torakálnych a horných lumbálnych segmentov. Signifikantné rozdiely sa zaznamenali len 5 dní po MCEC. Vplyv MCEC na kalciovo-závislú NOS aktivitu vo ventrálnej časti torakálnych, horných a dolných lumbálnych segmentov bol podobný, pričom sa zistilo signifikantné zvýšenie enzýmovej aktivity v sledovaných segmentoch avšak s výnimkou jej zníženia v horných lumbálnych segmentoch 5 dní po konstrikcii. Zvýšenie kalciovo-závislej NOS aktivity v dolných lumbálnych segmentoch korelovalo so zvýšeným počtom NOS-IR neurónov lokalizovaných v laminae VIII a IX a so zvýšenou expresiou NOS-IR axónov vo ventrolaterálnom povrazci.
Klíčová slova:
syndróm caudae equinae – syntáza oxidu dusnatého – miecha – pesÚvod
Cauda equina označuje zväzok intradurálnych nervových koreňov začínajúcich na konci miechy v lumbálnej časti spinálneho kanála; tieto nervové korene (lumbálne a sakrálne) zabezpečujú senzitívnu a motorickú inerváciu dolných končatín a orgánov umiestnených v pelvickej oblasti [1]. Pri ich poškodení z rôznych príčin, najčastejšie v dôsledku kompresie (vysunutá medzistavcová platnička, stenóza spinálneho kanála, nádor alebo úlomky zlomenín) dochádza k rozvoju syndrómu cauda equina (CES), ktorý sa klinicky prejavuje v závislosti od miesta, množstva postihnutých koreňov, resp. stupňa ich poškodenia bolesťami lumbosakrálnej chrbtice, jednostrannými, častejšie však obojstrannými radikulárnymi bolesťami dolných končatín, perianálnymi a perigenitálnymi poruchami citlivosti vnútornej plochy oboch stehien, t.j. typu jazdeckých nohavíc, vymiznutím reflexov (análneho, RŠA, RMpL), motorickým oslabením dolných končatín, prípadne paraplégiou a poruchami sfinkterov a sexuálnych funkcií. Strata vôľového ovládania funkcie sfinkterov neprináša len zdravotné riziká, ale výrazne obmedzuje aj pracovné a spoločenské uplatnenie. Keďže reverzibilita tohto nepriaznivého stavu závisí od včasného uvoľnenia mechanického tlaku, je CES indikáciou k urgentnej neurochirurgickej operácii. Experimentálne práce ukázali, že kritický čas pre trvalé ischemické poškodenie periférnych nervov je kratší ako 6 hodín [2]. Pri pokusoch s CES na opiciach sa dosiahlo výrazné zlepšenie len v prípade, ak bola dekompresia uskutočnená do 4 hodín [3]; takýto čas je v klinickej praxi prakticky nedosiahnuteľný. Urgentná operácia, uskutočnená u pacientov s inkompletným CES ihneď po ich transporte na špecializované pracovisko výrazne zlepšuje prognózu ochorenia [4,5] a bráni rozvoju kompletného CES, kým u pacientov s kompletným CES nebol zaznamenaný rozdiel vo výsledkoch medzi urgentnou a odloženou operáciou.
V posledných rokoch sa veľká pozornosť venuje skúmaniu úlohy NO pri rozvoji niektorých neurologických poškodení a symptómov, súvisiacich s intenzifikovaním reflexnej aktivity, ktorá sa zaznamenáva pri rozvoji spasticity a hyperreflexie [1,6-8]. Účasť tejto jednoduchej, ale biologicky veľmi aktívnej molekuly sa dokázala aj na prenose somatosenzitívnych a viscerálnych (pravdepodobne bolestivých) signálov, a tiež v autonómnych spinálnych dráhach regulujúcich viscerálnu motilitu [9]. Pretože ide o molekulu s krátkym polčasom života, jej prítomnosť v nervovom tkanive sa dokazuje nepriamo, t.j. histochemickým dôkazom nikotínamiddinukleotidfosfát diaforázovej (NADPHd) pozitivity a imunohistochemickou vizualizáciu NOS imunoreaktívnych neurónových profilov. Hlavnou úlohou NO je aktivácia rozpustnej guanylátcyklázy (sGC), produkcia cyklického guanozín monofosfátu (cGMP) a následná aktivácia cGMP závislých procesov. Za patologických stavov, napríklad pri stimulácii nociceptívných impulzov, prípadne počas ischémie kedy sa zvyšuje uvoľňovanie glutamátu a iných neuroaktívnych substancií, dochádza k aktivácii (N-metyl-D-aspartátových) NMDA receptorov, k influxu intracelulárneho vápnika, aktivácii NOS a následne k zvýšenej syntéze NO. Aktivácia spinálnych NMDA receptorov, napríklad prostredníctvom tvorby NO môže indukovať zvýšenú citlivosť na bolestivé podnety [10,11]. V mieche sú zmeny v aktivite NOS opísané prevažne po experimentálne navodených léziach, ako je ligatúra, axotómia a elektrická stimulácia periférnych nervov [12-14]. Zistilo sa, že axotómia ischiadického nervu spôsobuje zmeny v odpovedi NOS pozitívnych neurónov na úrovni L4-L6 segmentov [15,16], v axónoch v rozsahu L3, Th10 a C3 segmentov a v neuropile nucleus gracilis [17] čo dokazuje, že NOS je po periférnom poškodení syntetizovaná de novo v bunkách príslušných spinálnych ganglií [15,18,19] a axónami dráhy zadných miechových povrazcov sa transportuje až do terminálneho jadra v predĺženej mieche [17]. Tieto zistenia naznačujú, že NO predstavuje neuromodulátor, ktorý výrazne odpovedá nielen na akútne a chronicky vyvolané bolestivé podnety [10,11], ale zároveň sa podieľa aj na prenose signálov v niektorých dlhých vodivých systémoch [20-23].
Za účelom sledovania zmien vznikajúcich po poškodení koreňov CE bolo vytvorených viacero experimentálnych modelov, predovšetkým u psov, ošípaných a potkanov. Analýzy, ktoré boli uskutočnené na ich základe ukázali, že mechanická stimulácia koreňov spôsobila anatomické a funkčné zmeny postihnutých koreňov, ale zároveň navodila anterográdne i retrográdne zmeny v mieche [24-27]. Za účelom sledovania ich rozsahu a intenzity po akútnej a chronickej kompresii koreňov CE bol v predchádzajúcich experimentoch použitý model viacnásobnej, chirurgicky navodenej konstrikcie koreňov CE u psa [25]. Podráždenie koreňov caudae equinae v dôsledku ich ligácie na úrovni L7-Co5 segmentov po dobu 2 dní navodilo včasné zmeny v NOS aktivite v bielej hmote segmentov miechy, ktorých korene priamo podliehali ligácii alebo boli lokalizované v tesnej blízkosti poškodenia. Piaty deň po navodení chirurgického zásahu bola aktivita NOS ovplyvnená výraznejšie. Zmeny sa zaznamenali v sivej hmote sakrálnych segmentov, ale aj v segmentoch vzdialených od epicentra poškodenia [1,28-30]. Cieľom našej práce bolo zistiť vplyv konstrikcie CE na zmeny v NOS aktivite a nNOS imunoreaktivite v dorzálnej, mediálnej a ventrálnej časti torakálnej a lumbálnej miechy a tým prispieť k prehĺbeniu poznatkov o patogenéze CES.
Materiál a metódy
Experimentálny protokol
V experimente sme použili 18 dospelých psov oboch pohlaví o hmotnosti 5-8 kg. Experiment bol schválený Etickou komisiou pri Neurobiologickom ústave SAV v Košiciach na základe protokolov, vypracovaných v súlade so Zákonom na ochranu zvierat SR č. 15/1995 Z.z. Zvieratá boli uvedené do celkovej anestézy ketamínom a xylazínom podaným intramuskulárne (100mg/kg a 15mg/kg hmotnosti zvieraťa), intubované endotracheálnymi kanylami, uložené do polohy na brucho a napojené na anesteziologický aparát (Anemat N8, Chirana, ČR), ktorým sa zabezpečila mechanická ventilácia. Anestéza bola počas operácie udržiavaná zmesou kyslíka s prímesou 1-2 % Narcotanu. Vychádzajúc z poznatkov anatómie psa, laminektómiu sme uskutočnili na úrovni 6 a 7 lumbálneho stavca a po odstránení žltého väzu sme obnažili durálny vak s koreňmi CE. Konstrikciu koreňov CE sme navodili naložením štyroch silonových ligatúr okolo durálneho vaku bez jeho otvorenia, a to približne vo vzdialenosti 2mm od seba na úrovni siedmeho driekového stavca (obr. 1). MCEC zahŕňala v sebe protrahovanú konstrikciu výbežkov buniek dorzálnych spinálnych ganglií L7, S1-S3 a Co1-Co5 spoločne s ventrálnymi koreňmi rovnakých segmentov. Po operačnom zákroku zvieratá prežívali 2 alebo 5 dní. Kontrolné zvieratá (n=6) a zvieratá prežívajúce 2 dni (n=6) a 5 dní (n=6) po navodení konstrikcie CE boli rozdelené do dvoch podskupín, t.j. na imunohistochemickú detekciu NOS a pre stavovenie katalytickej NOS aktivity. Neurologické poškodenie experimentálnych zvierat sme sledovali denne po chirurgicky navodenej MCEC.
Obr. 1. Schematický náčrt modelu MCEC u psa (pozn.: pes má 7 lumbálnych stavcov). 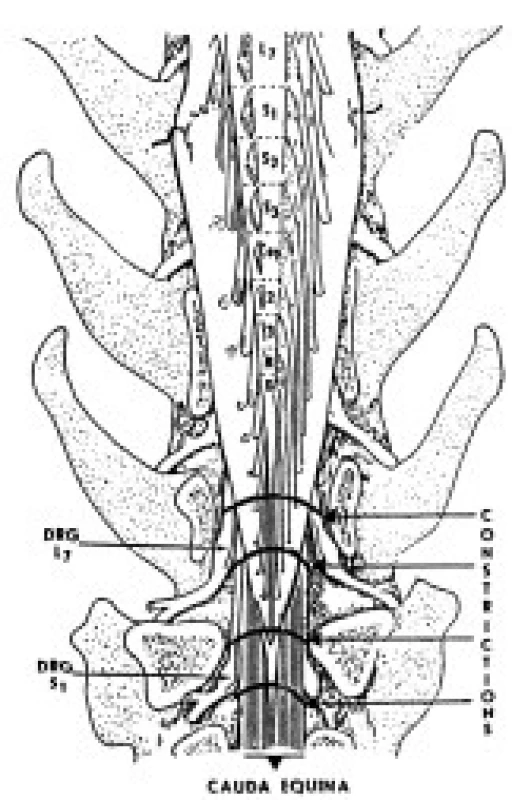
Stanovenie aktivity Ca2+-závislej syntázy oxidu dusnatého
Pre rádiometrické stanovenie aktivity Ca2+-závislej syntázy oxidu dusnatého bola miecha psa zmrazená v tekutom dusíku. Torakálne a lumbálne segmenty boli nakrájané na 600 μm rezy a rozdelené na ventrálnu, mediálnu a dorzálnu časť (obr. 2). Aktivita sledovaného enzýmu bola stanovená konverziou [3H]-arginínu na [3H]-citrulín, t.j. v reakcii, ktorá katalyzuje tvorbu oxidu dusnatého [31]. Vzorky z jednotlivých častí miechy boli homogenizované v 10mM Tris-HCl pufri, pH=7,4 a ich homogenáty (200 μg/ml) boli inkubované v reakčnej zmesi (10 mM [3H]-L-arginín (1μ Ci), 1 mM NADPH, 1 mM kalmodulín v 50 mM HEPES pufri, pH=7,4, ktorý obsahoval 1m M ditiotreitol, 1 mM EDTA, 2 mM CaCl2 a 15 mM tetrahydrobiopterín) pri teplote 37° C po dobu 45 min. Reakcia bola zastavená 100 mM HEPES, pH=5,5, ktorý obsahoval 10 mM EDTA. Vzorky boli delené afinitnou chromatografiou na Na+-výmennej kolóne (Dowex AG, 50W-X8), centrifugované a merané na spektrofotometri (Beckman LS-3801). Výsledky sú vyjadrené v mol/min/mg bielkovín.
Obr. 2. Schematický náčrt dolnej lumbálnej miechy (L5), ktorý zobrazuje delenie miechy na dorzálnu, mediálnu a ventrálnu časť. 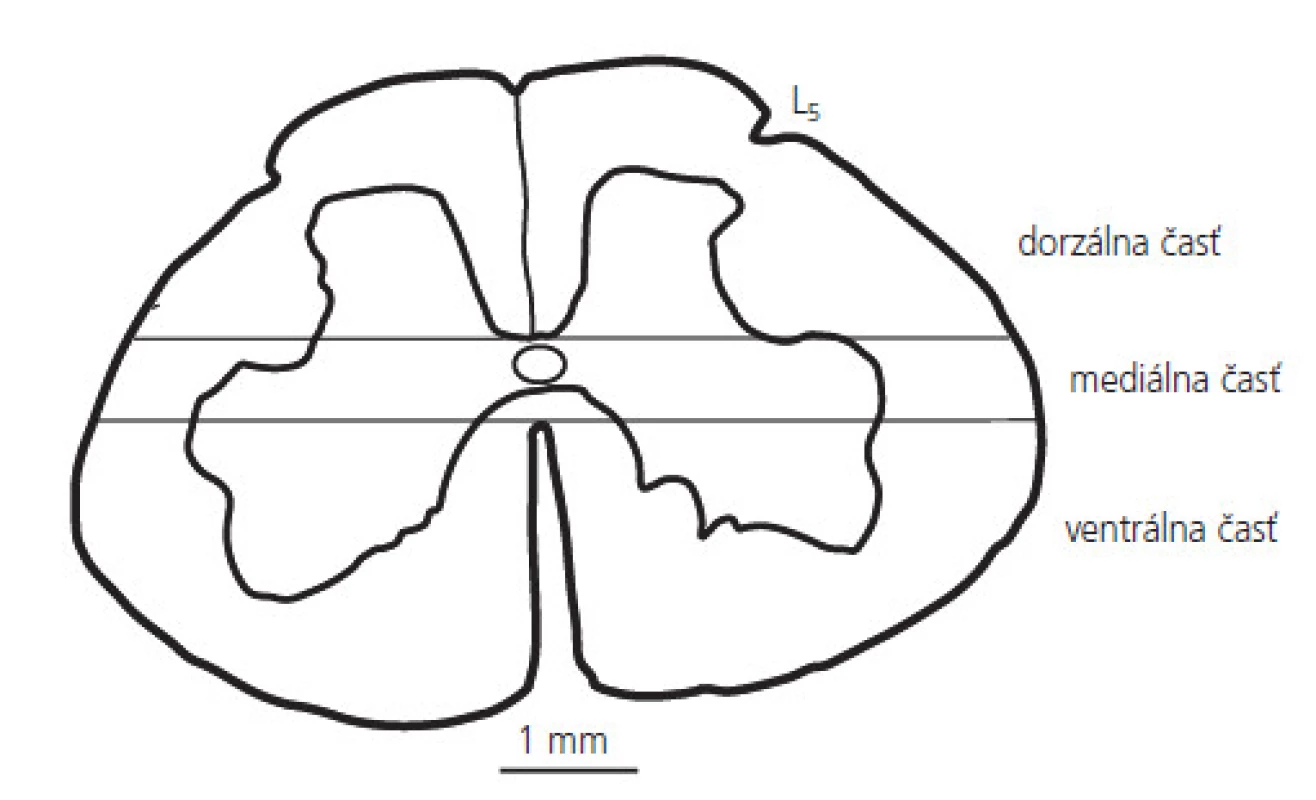
Imunohistochemické zobrazenie syntázy oxidu dusnatého
Kontrolné zvieratá a zvieratá, ktorým bola navodená konstrikcia CE na dobu 5 dní (n=3) boli anestetizované (pentobarbital, 50mg/kg, i.p.) a transkardiálne prepláchnuté 4% paraformaldehydom. Odobratá lumbálna miecha bola rozdelená na L4, L5 a L6 segmenty, ktoré boli ponorené vo fixatíve na 4 hodiny a uskladnené cez noc pri 4°C v 20% roztoku sacharózy. Nasledujúci deň bolo tkanivo zmrazené v petroléteri na -50°C a nakrájané na zmrazovacom mikrotóme na 30 μm rezy. Rezy boli umiestnené v komôrkach a inkubované pri izbovej teplote (3h) v 0,1M fosfátovom pufri (PBS), pH=7,4, ktorý obsahoval 5% králičie sérum, 0,2 % Triton X100 a 0,2% hovädzí sérum albumín. Následne boli rezy inkubované s primárnou protilátkou (polyclonal sheep anti-nNOS antibody) riedenou s 0,1M PBS v pomere 1 : 1500 cez noc pri 4°C. Primárna protilátka bola získaná ako dar od Dr. Emsona [32]. Po premytí v PBS boli rezy inkubované s biotinylizovanou sekundárnou protilátkou (anti-sheep; Vector Laboratories, Burlingame, CA), riedenou v pomere 1 : 200 po dobu 2 h a s avidín-biotín peroxidázovým roztokom (Vectastain Elite ABC peroxidázový kit; Vector Laboratories, USA, PK-6102) po dobu 1 h. Neurónová NOS bola vizualizovaná pomocou 0,05 DAB v 0,058 M Tris pufri, ktorý obsahoval 0.001 % H2O2. Rezy boli dôkladne premyté v Tris-fosfátovom pufri a natiahnuté na sklíčka s navrstvenou želatinou. Sklíčka boli vysušené, dehydratované vzostupnou alkoholovou radou (50,70,90,100%), prejasnené v xyléne a následne zamontované v Depexe [33].
Použité štatistické metódy
Pre štatistické spracovanie získaných experimentálnych údajov bol použitý ANOVA test a Tukey-Kramerov test. Výsledky predstavujú aritmetický priemer + SEM.
Výsledky
Štvornásobná ligácia centrálnych výbežkov buniek spinálnych ganglií a predných koreňov na úrovni L7-Co5 segmentov navodila regionálne a časovo-závislé zmeny v aktivite syntázy oxidu dusnatého. V dorzálnej časti torakálnych a horných lumbálnych segmentov miechy sa dva dni po ligácii CE zaznamenalo signifikantné zvýšenie katalytickej NOS aktivity. Aktivita sledovaného enzýmu bola výrazne znížená piaty deň po navodení chirurgického zásahu, avšak pokles pod bazálne hodnoty sa zaznamenal iba v L1-L3 segmentoch. Nevýrazné zmeny v aktivite NOS boli pozorované v dorzálnej časti L4-L7 segmentov, a to v obidvoch postkonstrikčných časoch (obr. 3A).
Obr. 3. Aktivita kalciovo-závislej syntázy oxidu dusnatého, zaznamenaná v dorzálnej (A), mediálnej (B) a ventrálnej (C) časti torakálnych (Th1–Th13), horných lumbálnych (L1–L3) a dolných lumbálnych (L4–L7) segmentov miechy u kontroly a 2 a 5 dni po navodení 4-násobnej konstrikcie cauda equina. Výsledky sú vyjadrené v mol/min/mg bielkovín, predstavujú aritmetický priemer (n = 3) ± SEM; *p < 0.05 v porovnaní s kontrolou. 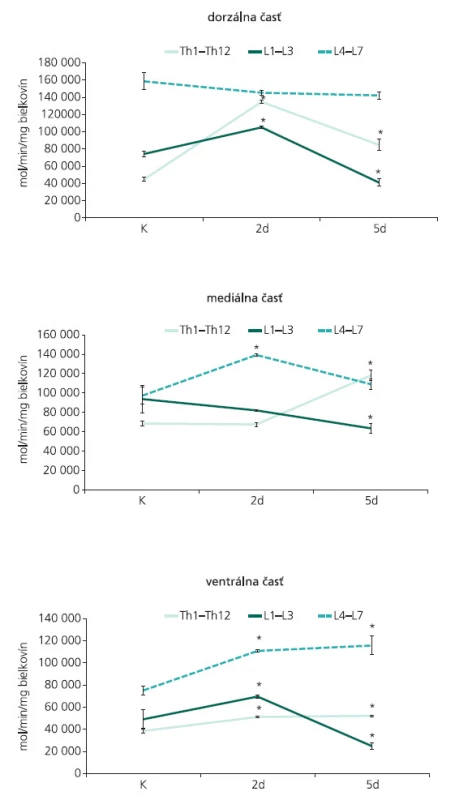
Menej výrazná odpoveď v NOS aktivite bola zaznamenaná 2 dni po ligácii CE v mediálnej časti miechy, kde enzýmová aktivita výrazne vzrástla iba v dolných lumbálnych segmentoch. Ligácia CE navodená experimentálnym zvieratám po dobu 5 dní spôsobila extrémny nárast NOS aktivity v Th1-Th12 segmentoch a naopak, navodila signifikantné zníženie aktivity sledovaného enzýmu v L1-L3 a L4-L7 segmentoch (obr. 3B).
Rovnaký priebeh zmien v aktivite NOS bol pozorovaný vo ventrálnej časti sledovaných segmentov miechy dva dni po ligácii CE. Ukázalo sa, že dráždenie koreňov CE po dobu 2 dní spôsobuje v torakálnych, horných a dolných lumbálnych segmentoch signifikantné zvýšenie NOS aktivity, a toto zvýšenie v Th1-Th12 a L4-L7 segmentoch výrazne vzrastá aj piaty deň po ligácii (obr. 3C). V L1-L3 segmentoch miechy sa zaznamenal signifikantný nárast v aktivite NOS iba v štádiu krátkodobého prežívania. Dráždenie CE u experimentálnych zvierat po dobu 5 dní navodilo v L1-L3 segmentoch signifikantný pokles enzýmovej aktivity (obr. 3C). Zvýšenie NOS aktivity v L4-L7 segmentoch koreluje s výraznými zmenami zaznamenanými v imunohistochemickej reakci NOS. Kým nNOS-IR neuróny lokalizované vo ventrálnom rohu vykazovali u kontrolných zvierat iba slabú imunohistochemickú reakciu, 5 dní po navodení konstrikcie CE, bola nNOS-IR zvýšená v populácii neurónov, ktoré lemujú dorzomediálny okraj ventrálneho povrazca (obr. 4). Mnohé nNOS-IR neuróny lokalizované v laminae VIII a IX v segmentoch dolnej lumbálnej miechy vykazovali intenzívnu dendritickú nNOS imunopozitivitu. Tieto zmeny boli doprevádzané výraznou expresiou nNOS-IR v axónoch, ktoré sa rozprestierajú pozdĺž ventrálneho povrazca (obr. 4).
Obr. 4. Obrázok, znázorňujúci nNOS-imunoreaktivitu vo ventrálnej časti dolnej lumbálnej miechy u kontroly (A,B) a 5 dní po navodení 4-násobnej konstrikcie cauda equina (C,D). 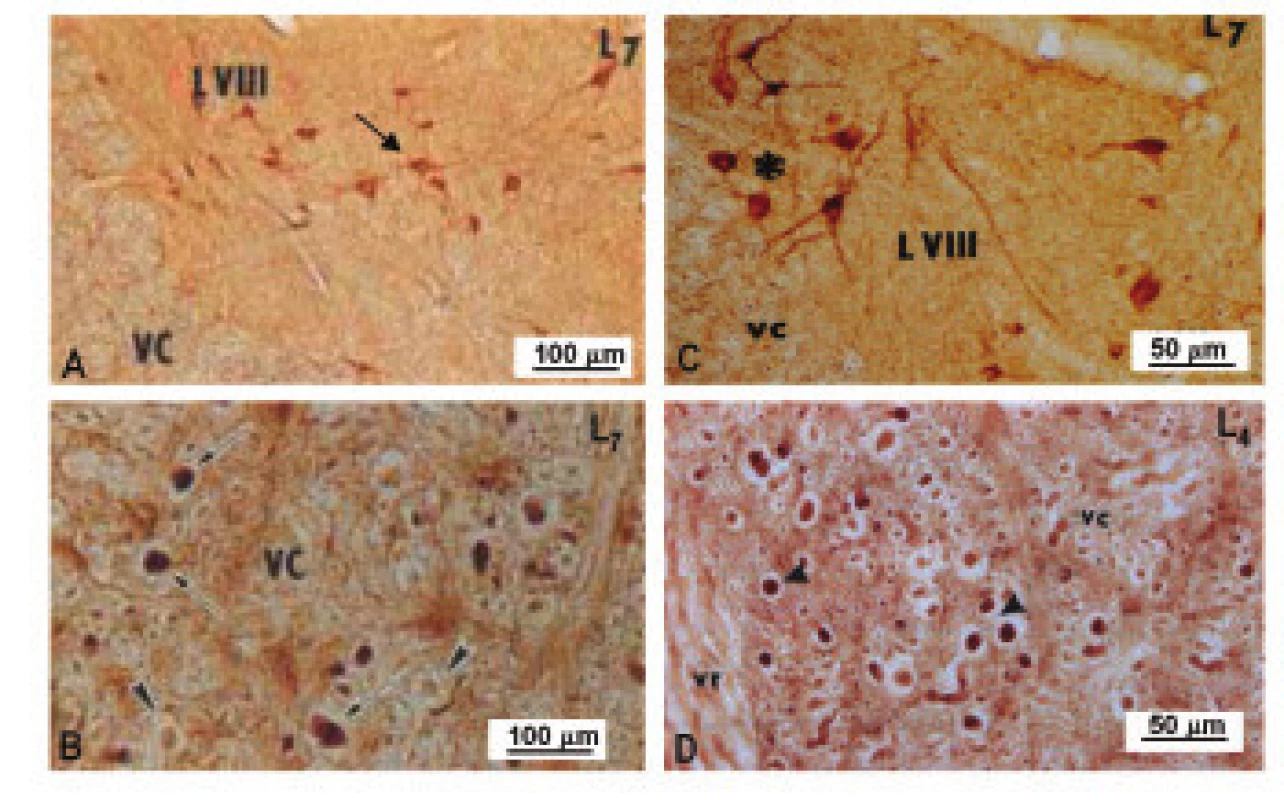
A – dorzomediálna časť ventrálneho rohu a dorzálna časť ventrálneho povrazca v segmente L7, ktorá znázorňuje nNOS-IR v telách neurónov (hviezdička), lokalizovaných v lamina VIII, vc – ventrálny povrazec. B – hrubé nNOS-IR axóny (šipka) a nNOS-IR axóny (hroty) vo ventrálnom povrazci v tesnej blízkosti ventrálneho rohu, vc – ventrálny povrazec. C – výrazná nNOS imunopozitivita v neurónoch (hviezdička) umiestnených v dorzomediálnej časti ventrálneho rohu v segmente L7, vc – ventrálny povrazec. D – hrubé nNOS-IR axóny (hroty) vo ventrálnom povrazci v L4 segmente, vc – ventrálny povrazec, vr – ventrálny koreň. V obidvoch experimentálnych skupinách (konstrikcia navodená po dobu 2 a 5 dní) bola zaznamenaná náhla motorická a senzitívna dysfunkcia, kombinovaná s akútnou urinálnou dysfunkciou. Konstrikcia caudae equinae navodená po dobu 2 dní spôsobila čiastočné neurologické poškodenie charakterizované paraparézou dolných končatín. Plne vyvinutá paraplégia a strata citlivosti sa zaznamenali u experimentálnych zvierat piaty deň po konstrikcii caudae equinae.
Diskusia
Hoci neuropatogenéza polyradikulárnej symptomatológie CES bola v priebehu dvoch desaťročí študovaná veľmi intenzívne [34,35], doterajšie analýzy, získané po mechanickej stimulácii caudae equinae u rôznych experimentálnych modelov, poskytli prevažne funkčné a neuropatologické zmeny postihnutých koreňov [1]. Nami použitý model konstrikcie CE [22], ktorý vyvoláva príznaky porovnateľné s rozvojom syndrómu CE u ľudí, sme použili na monitorovanie zmien v aktivite a expresii NOS v dorzálnej, mediálnej a ventrálnej časti miechy 2 a 5 dní po navodení 4-násobnej ligácie lumbosakrálnych koreňov (L7-Co5) u psa. Z analýzy katalytickej aktivity NOS vyplýva, že 4-násobná ligácia CE spôsobuje signifikantné zvýšenie NOS aktivity v zadnej časti horných lumbálnych a torakálnych segmentov už 2 dni po konstrikcii, zatiaľ čo v zadnej časti dolných lumbálnych segmentov sa signifikantné zmeny nezaznamenali ani v štádiu dlhodobého prežívania. Mechanizmus, akým ligácia koreňov CE ovplyvňuje enzýmovú aktivitu v zadných povrazcoch bielej hmoty, ktoré tvoria súčasť nami analyzovanej zadnej časti, nie je doposiaľ objasnený. Predpokladáme, že kontinuálne dráždenie senzitívnych koreňov caudae equinae stimuluje glutamátom determinovanú aktiváciu NMDA receptorov v malých a stredných bunkách spinálnych ganglií lumbosakrálnych segmentov a podobne ako po ligácii a axotómii periférnych nervov, podmieňuje v nich zvýšenú tvorbu NOS, ktorá sa transportuje centrálnymi výbežkami buniek spinálnych ganglií až do zadného rohu miechy [36]. Časť nNOS-IR axónov sa po vstupe do miechy vertikalizuje a v zostave vláken fasciculus gracilis lokalizovaných v zadnom povrazci prechádza do nucleus gracilis v predĺženej mieche [17 Na modeli axotómie ischiadického nervu u králika sa kombináciou biochemických a imunohistochemických prístupov zaznamenalo, že nNOS je transportovaná centripetálne a rozhodujúcou mierou ovplyvňuje NADPHd pozitivitu v neuropile zadného rohu a v axónoch, lokalizovaných v mediálnej časti zadného povrazca [17]. Štvornásobná ligácia centrálnych výbežkov buniek spinálnych ganglií na úrovni L7-Co5 segmentov, navodená po dobu 5 dní spôsobila výrazné zníženie NOS aktivity v zadnej časti horných lumbálnych a torakálnych segmentov. Rozdiely zaznamenané v NOS aktivite po dlhšie trvajúcej ligácii CE môžu odrážať rozdielnu odpoveď nNOS-IR neurónov lokalizovaných v povrchových a hlbokých vrstvách zadného rohu postihnutých segmentov miechy a v segmentoch, ktoré sú umiestnené rostrálne od miesta poškodenia, ako aj rôznu intenzitu imunohistochemického zobrazenia nNOS v neuropile. Naše výsledky ukazujú, že zmeny v NOS aktivite prebiehajú v senzitívnej oblasti miechy po ligácii CE mimoriadne intenzívne a pokrývajú pomerne rozsiahlu časť miechy, a to nielen jej lumbálne segmenty.
K zmene, ktorá sa zaznamenala v aktivite NOS po ligácii CE vo ventrálnej a mediálnej časti dolných lumbálnych segmentov môže dochádzať v dôsledku zvýšenia nNOS-IR v neurónoch predných rohov (lamina VIII) a pericentrálnej oblasti (lamina X). Axóny týchto buniek sa vyskytujú vo veľkom počte v prednom povrazci v okolí sivej hmoty a pravdepodobne tvoria propriospinálnu dráhu, ktorá je lokalizovaná v mediálnej časti predného rohu, a ktorá za použitia NO ako neuromodulátora zabezpečuje intersegmentové prepojenia [20,28]. V mediálnej časti bočného povrazca dolných lumbálnych segmentov je zaznamenaná výrazná nNOS imunoreaktivita axónov, ktoré spájajú lumbálnu intumescenciu s neurónmi ventrálneho motorického jadra v C7-Th1 segmentoch [21,37], to je jadra, ktoré je charakterizované v našej experimentálnej práci [21]. Tieto zistenia naznačujú účasť NOS na patogenéze rozvoja syndrómu caudae equinae a poukazujú na skutočnosť, že nNOS-IR senzitívne hotovosti v zadnom rohu a motorické hotovosti v dorzo-mediálnej časti predného rohu odpovedajú na konstrikciu CE veľmi výrazne. Použitie modelu klinicky manifestného syndrómu cauda equina u psa poskytuje informácie o zmenách v NOS aktivite a nNOS-IR v senzitívnej a motorickej oblasti miechy počas akútnej fázy jeho rozvoja a poukazuje na to, že doba počas ktorej sú korene CE komprimované, výrazne ovplyvňuje neurologické poškodenie.
Terapeutické prístupy, aplikované za účelom zlepšenia prognózy tohto mimoriadne závažného ochorenia v čase od konstrikcie až po chirurgicky navodenú dekompresiu, spočívajú v stimulácii obranných alebo blokácii deštrukčných mechanizmov, teda v reparácii poškodeného nervového tkaniva alebo v minimalizovaní následkov už jestvujúceho poškodenia. Poškodené nervové tkanivo neregeneruje; výskum v oblasti kmeňových buniek síce naznačil sľubnú perspektívu, tá je však iba v začiatkoch. V počiatočnom štádiu je aj objasňovanie patogenézy CES vo vzťahu k NOS a k poškodeniu senzitívnych a motorických dráh v mieche. Naše predchádzajúce experimentálne práce dokázali anterográdnu axonálnu degeneráciu všetkých sakrálnych a L7 dorzálnych nervových koreňov, retrográdnu degeneráciu motoneurónov v postihnutej oblasti a degeneráciu vláken fasciculus gracilis vo všetkých torakálnych a cervikálnych segmentoch miechy po konstrikcii MCEC u psa. Mechanická stimulácia takto postihnutých lumbosakrálnych koreňov zapríčinila anatomické a funkčné zmeny nielen v komprimovaných koreňoch, ale spôsobila výrazné zmeny aj v bielej a sivej hmote miechy [1,28-30]. Hľadanie príčin rozsiahlych zmien v NOS aktivite a nNOS-IR po experimentálne navodenej ligácii MCEC v mieche nás viedlo k záverom, že ventrálna časť miechy reaguje na zmeny v NOS aktivite a nNOS-IR po konstrikcii koreňov kaudy výraznejšie ako jej dorzálna a mediálna časť.
Přijato k recenzi: 24. 1. 2007
Přijato do tisku: 6. 3. 2007
MUDr. Jozef Kafka
Neurochirurgická klinika FNLP
Rastislavova 43
041 90 Košice
E-mail: jozef. kafka@fnlp.sk
Zdroje
. Orendáčová J, Čížková D, Kafka J, Lukáčová N, Maršala M, Šulla I, Maršala J, Katsube N. Cauda equina syndrome. Prog Neurobiol 2001; 64 : 613-637.
2. Dyck POJ, Thomas PK, Lambert EH, Bunge R. Peripheral neuropathy. 2nd ed. Philadelphia: WB Saunders 1984.
3. Stephenson GC, Gibson RM, Sonntag VKH. Who is to blame for the morbidity of acute cauda equina compression? J Neurol Neurosurg Psychiatry 1994; 57 : 388.
4. Gleave JR, Macfarlane R. Cauda equina syndrome: what is the relationship between timing of surgery and outcome ? Br J Neurosurg 2002; 16 : 325-328.
5. Hussain SA, Gullan RW, Chitnavis BP. Cauda equina syndrome: outcome and implications for managament. Br J Neurosurg 2003; 17 : 164-167.
6. Smyth MD, Peacock WJ. The surgical treatment of spasticity. Muscle Nerve 2000; 23 : 153-163.
7. Sheean G. The pathophysiology of spasticity. Eur J Neurol 9Suppl 2002; 1 : 3-9.
8. Lazorthes Y, Sol JC, Sallerin B, Verdie JC. The surgical management of spasticity.
Eur J Neurol 2002; 9(Suppl 11): 35-41.
9. Vizzard MA, Erickson K, de Groat WC. Localization of NADPH diaphorase in the thoracolumbar and sacrococcygeal spinal cord of the dog. J Auton Nerv Syst 1997; 64 : 128-142.
10. Meller ST, Cummings CP, Traub RJ, Gebhart GF. The role of nitric oxide in the development and maintenance of the hyperalgesia produced by intraplantar injection of carrageenan in the rat. Neuroscience 1994; 60 : 367-374.
11. Wiertelak EP, Furness LE, Watkins LR Maier SF. Illness-induced hyperalgesia is mediated by a spinal NMDA-nitric oxide cascade. Brain Res 1994; 664 : 9-16.
12. Hökfelt T, Zhang X., Wiesenfeld-Hallin Z. Messenger plasticity in primary sensory neurons following axotomy and its functional implications. Trends Neurosci 1994; 17 : 22-30.
13. Salter M, Strijbos PLJM, Neale S, Duffy C, Follenfant RL, Garthwaites J. The nitric-oxide-cyclic GMP pathway is required for nociceptive signalling at specific loci wthin the somatosensory pathway. Neuroscience 1996; 73 : 649-655.
14. Kaske A, Reinert A, Hoheisel U, Mense S. Nitric oxide synthase in rat dorsal horn neurones responds differentially to electrical stimulation of various afferent fibre populations. Soc Neurosci 1997; 23 : 441.
15. Verge VM, Xu Z, Xu XJ, Wiesenfeld-Hallin Z, Hökfelt T. Marked increase in nitric oxide synthase mRNA in rat dorsal root ganglia after peripheral axotomy: in situ hybridization and functional studies. Proc Natl Acad Sci USA 1992; 89 : 11617-1121.
16. Zhang X, Verge V, Wiesenfeld-Hallin Z, Ju G, Bredt D, Synder SH, Hokfelt T. Nitric oxide synthase-like immunoreactivity in lumbar dorsal root ganglia and spinal cord of rat and monkey and effect of peripheral axotomy. J Comp Neurol 1993; 335 : 563-575.
17. Lukáčová N, Čížková D, Križanová O, Pavel J, Maršala M, Maršala J. Peripheral axotomy affects nicotinamide adenine dinucleotide phosphate diaphorase and nitric oxide synthases in the spinal cord of the rabbit. J Neurosci Res 2003; 71 : 300-313.
18. Steel JH, Terenghi G, Chung JM, Na HS, Carlton SM, Polak JM. Increased nitric oxide synthase immunoreactivity in rat dorsal root ganglia in a neuropathic pain model. Neurosci Lett 1994; 169 : 81-84.
19. Choi Y, Raja SN, Moore LC, Tobin JR. Neuropathic pain in rats is associated with altered nitric oxide synthase activity in neural tissue. J Neurol Sci 1996; 138 : 14-20.
20. Maršala J, Lukáčová N, Čížková D, Kafka J, Katsube N, Kuchárová K, Maršala M. The case for the bulbospinal respiratory nitric oxide synthase-immunoreactive pathway in the dog. Exp Neurol 2002; 177 : 115-132.
21. Maršala J, Lukáčová N, Čížková D, Lukáč I, Kuchárová K, Maršala M. Premotor nitric oxide synthase immunoreactive pathway connecting lumbar segments with the ventral motor nucleus of the cervical enlargement in the dog. J Chem Neuroanat 2004; 27 : 43-54.
22. Maršala J, Lukáčová N, Šulla I, Wohlfahrt P, Maršala M. The evidence for nitric oxide synthase immunopositivity in the monosynaptic Ia-motoneuron pathway of the dog. Exp Neurol 2005; 195 : 161-178.
23. Maršala J, Lukáčová N, Kolesár D, Kuchárová K, Maršala M. Nitrergic proprioceptive afferents originating from quadriceps femoris muscle are related to monosynaptic Ia-motoneuron stretch reflex circuit in the dog. Cell Mol Neurobiol 2006; 26 : 1385-1410.
24. Olmarker K, Takahashi K, Rydevik B. Anatomy and compression-pathophysiology of the nerve roots of the lumbar spine. In: Anderson GBJ, MacNeill T, editors. Spinal Stenosis. St. Louis: Mosby Year Book 1992 : 77-90.
25. Maršala J, Šulla I, Jalč P, Orendáčová J. Multiple protracted cauda equina constrictions cause deep derangement in the lumbosacral spinal cord circuitry in the dog. Neurosci Lett 1995; 193 : 97-100.
26. Cornefjord M, Olmarker K, Rydevik B, Nordborg C. Mechanical and biochemical injury of spinal nerve roots: a morphological and neurophysiological study. Eur Spine J 1996; 5 : 187-192.
27. Yamaguchi K, Murakami M, Takahashi K, Moriya H, Tatsuoka H, Chiba T. Behavioral and morphologic studies of the chronically compressed cauda equina. Experimental model of lumbar spinal stenosis in the rat. Spine 1999; 24 : 845-851.
28. Maršala J, Kafka J, Lukáčová N, Čížková D, Maršala M, Katsube N. Cauda equina syndrome and nitric oxide synthase immunoreactivity in the spinal cord of the dog. Physiol Res 2003; 52 : 481-496.
29. Orendáčová J, Maršala M, Šulla I, Kafka J, Jalč P, Čížková D, Taira Y, Maršala J. Incipient cauda equina syndrome as a model of somatovisceral pain in dogs: spinal cord structures involved as revealed by the expression of c-fos and NADPH diaphorase activity. Neuroscience 2000; 95 : 543-557.
30. Lukáčová N, Kafka J, Čížková D, Maršala M, Maršala J. The effect of cauda equina constriction on nitric oxide synthase activity. Neurochem Res 2004; 29 : 429-439.
31. Bredt DS, Snyder SH. Isolation of nitric oxide synthetase, a calmodulin-requiring enzyme. Proc Natl Acad Sci USA 1990; 87 : 682-685.
32. Herbison AE, Simonian SX, Norris PJ, Emson PC. Relationship of neuronal nitric oxide immunoreactivity to GnRH neurons in the ovariectomized and intact female rat. J Neuroendocrinol 1996; 8 : 73-82.
33. Bredt DS, Hwang PM, Snyder SH. Localization of nitric oxide synthase indicating a neural role for nitric oxide. Nature 1990; 347 : 768-770.
34. Iwamoto H, Kuwahara H, Matsuda H, Noriage A, Yamano Y. Production of chronic compression of the cauda equina in rats for use in studies of lumbar spinal canal stenosis. Spine 1995; 20 : 2750-2757.
35. Sayegh FE, Kapetanos GA, Symeonides PP, Anogiannakis G, Madentzidis M. Functional outcome after experimental cauda equina compression. J Bone Joint Surg 1997; 79 : 670-674.
36. Fiallos-Estrada CE, Kummer W, Mayer B, Bravo R, Zimmermann M, Herdegen T. Long-lasting increase of nitric oxide synthase immunoreactivity, NADPH-diaphorase reaction and c-JUN co-expression in rat dorsal root ganglion neurons following sciatic nerve transection. Neurosci Lett 1993; 150 : 169-173.
37. Lukáčová N, Kolesárová M, Kuchárová K, Pavel J, Kolesár D, Radoňak J, Maršala M, Chalimoniuk M, Langfort J, Maršala J. The effect of a spinal cord hemisection on changes in nitric oxide synthase pools in the site of injury and in regions located far away from the injured site. Cell Mol Neurobiol 2006; 26 : 1365-1383.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2007 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Léčba epileptických syndromů u dětí
- Vliv antiepileptik na homeostázu hormonů štítné žlázy
- Léčebný potenciál lamotriginu v terapii epilepsie v dětství a adolescenci
- Zmeny v aktivite syntázy oxidu dusnatého v mieche po ligácii koreňov cauda equina v experimente
- Komentář ke článkům Vajtr D, Průša R, Kukačka J, Houšťava L, Šámal F, Pachl J, Pažout J. Dynamika vývoje GCS, hladiny NSE a S100b v séru a morfologie expanzní kontuze u pacientů s poraněním hlavy a Lavička P, Pikner R, Kormunda S, Topolčan O , Bosman R, Chytra I, Holubec L, Choc M. Význam stanovení S100B proteinu u pacientů s izolovaným poraněním hlavy.
- Dynamika vývoje GCS, hladiny NSE a S100B v séru a morfologie expanzní kontuze u pacientů s poraněním hlavy
- Význam stanovení S100B proteinu u pacientů s izolovaným poraněním hlavy
- Sledovanie objemových zmien nastávajúcich po stereotaktickej rádiochirurgickej liečbe v nide intrakraniálnych arteriovenóznych malformácií pomocou 3D volumetrickej štúdie na podklade MR-angiografie
- Pulzní radiofrekvenční terapie radikulární bolesti
- Hemimegalencefalie: přehled literatury a zkušenosti s chirurgickou léčbou 5 nemocných dětí
- Diagnostikujeme správně infekci virem West Nile?
- Hodnocení edému terče zrakového nervu
- Transforaminální lumbo-sakrální mezitělová fúze (TLIF) s instrumentací: prospektivní studie s minimálně 20měsíčním sledováním
- Měření tkáňového kyslíku v mozku jako součást multimodálního monitorování: kazuistiky
- „Inverzní“ syndrom Fostera-Kennedyho u nitrolebního meningeomu: kazuistika
- Jsou některé kontraindikace lumbální punkce dnes již obsoletní? Kazuistika
- Neobvyklá oboustranná atrofie endotelu rohovky a zrakového nervu po pravděpodobné intoxikaci insekticidem lambda-cyhalotrinem (Karate 5 CS) u 58letého vinaře: kazuistika
- Kombinovaná mikrochirurgická a endovaskulární terapie intramedulárního hemangioblastomu: kazuistika
- Epidurální hematom a impresivní fraktura lebky v důsledku bodového uchycení hlavy: zpráva o neobvyklé komplikaci: kazuistika
- Doporučené postupy pro léčbu Alzheimerovy nemoci a dalších onemocnění spojených s demencí
- Černý R, Machala L. Neurologické komplikace HIV/AIDS. Praha: Karolinum 2007. 303 stran. ISBN 978-80-246-1222-5.
- Webové okénko
- DOPORUČENÍ ČESKÉ MYELOMOVÉ SKUPINY (CZECH MYELOM GROUP - CMG) PRO ZAJIŠTĚNÍ ČASNÉ DIAGNOSTIKY MNOHOČETNÉHO MYELOMU V PODMÍNKÁCH AMBULANTNÍ KLINICKÉ PRAXE
-
Analýza dat v neurologii.
V. Přínos a důsledky transformace dat
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba epileptických syndromů u dětí
- Hodnocení edému terče zrakového nervu
- Jsou některé kontraindikace lumbální punkce dnes již obsoletní? Kazuistika
- Transforaminální lumbo-sakrální mezitělová fúze (TLIF) s instrumentací: prospektivní studie s minimálně 20měsíčním sledováním
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



