-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dynamika vývoje GCS, hladiny NSE a S100B v séru a morfologie expanzní kontuze u pacientů s poraněním hlavy
Dynamics of the GCS, NSE and S100B Serum Levels and the Morphology of the Expansive Contussion in Head Injury Patients
Introduction.
Laboratory diagnose of brain contussions is based on monitoring of proteins released to circulation (such as neuron specific enolasis (NSE) and S100B protein) from affected tissues. Morphological investigation of biopsy speciments proved focal changes of brain.Methods.
The group (n = 20) of patients with focal traumatic brain injury was investigated. In 9 patients was found improvement of Glasgow coma score (GCS) up to 13-15 points during 10 days after admission (group I) and 11 patients had value of GCS less than 13 (group II).Results.
We found the decrease of value of NSE and S100 b protein in group of all patients with focal brain injury during 10 days of hospitalisation. In 5 patients who died we observed the increase of NSE and S100B protein values on the. 2.-3. day. Patients with improvement of clinical status and GCS up to 15 points during 10 days of hospitalisation (group I) had lower value of NSE (33.53 vs 61.76 μg/l, p < 0.05) and S100B protein (0.61 vs 4.45 μg/l, p 0.05) 1-3 days after admission compared to values of group II. A morphological investigation demonstrated no damage of nucleolus of glial and ganglial cells, and pericytes digested the foregin proteins. Immuno-histochemical investigation proved diffuse positivity of anti-NSE, and CD68 antibody reacted around vessels microenvironment.Conclusion.
Monitoring of serum levels of NSE and S100B is convenient and complementary investigation for monitoring of patients with TBI.Key words:
contusion – Glasgow Coma Score (GCS) - neuron specific enolasis – S100B protein – electron microscopy – immunohistochemistry
Autoři: D. Vajtr 1,3; R. Průša 1; J. Kukačka 1; L. Houšťava 2; F. Šámal 2; J. Pachl 4; J. Pažout 4
Působiště autorů: Ústav klinické biochemie a patobiochemie 2. LF UK a FN Motol, Praha 1; Neurochirurgická klinika 3. LF UK a FNKV, Praha 2; Ústav soudního lékařství a toxikologie 1. LF UK a VFN, Praha 3; Klinika anesteziologie a resuscitace 3. LF UK a FNKV, Praha 4
Vyšlo v časopise: Cesk Slov Neurol N 2007; 70/103(5): 515-520
Kategorie: Původní práce
Práce je podporována grantem IGA MZ, reg.č. NR/8793-3/2006.
Souhrn
Úvod:
Laboratorní diagnostika kontuzí mozku je založena na měření specifických proteinů, které se uvolňují do cirkulace (neuron specifická enoláza - NSE a protein S100B). Doplňující histologické vyšetření resekované kontuze mozku prokazuje ložiskové změny mozkové tkáně.Metodika:
Byl vyšetřen soubor (n = 20) pacientů s ložiskovým poraněním hlavy. U 9 pacientů došlo během 10 dnů od přijetí ke zlepšení GCS na hodnoty 13-15 (skupina I) a u 11 byly hodnoty GCS nižží než 13 (skupina II).Výsledky:
V souboru pacientů s poraněním hlavy jsme zjistili pokles hodnot NSE a proteinu S100B od přijetí do 10 dne hospitalizace. U 5 pacientů, kteří zemřeli, byl pozorován vzestup hodnot NSE a S100B 2.-3.den. Pacienti s klinickým zlepšením a úpravou hodnot GCS během 10 dnů od přijetí (skupina I) na hodnotu 15 bodů měli nižší hodnoty NSE (33,53 vs 61,76 μg/l, p< 0,05) a proteinu S100B (0,61 vs 4,45 μg/l, p< 0,05) 1.-3. den po přijetí ve srovnání se skupinou II. Morfologické vyšetření kontuze prokázalo nepoškozená jadérka gliových a gangliových buněk, pericyty rozkládaly cizorodé proteiny. Imunohistochemické vyšetření prokázalo v okolí cév pozitivitu protilátky proti CD 68.Závěr:
Sledování sérových koncentrací NSE a S100B je vhodným nenáročným doplňkovým vyšetřením pro monitorování pacientů s kraniocerebrálním poraněním.Klíčová slova:
kontuze - Glasgow Coma Score (GCS) - neuron specifická enoláza – protein S100B – elektronová mikroskopie - imunohistochemie.Úvod
Primární poranění mozku vzniká jako výsledek působení mechanických sil vedoucích k deformaci mozkové tkáně v okamžiku úrazu [1]. Ložiskové poranění hlavy je prokazatelné nejen klinickými a zobrazovacími metodami, ale i morfologickými změnami v histologickém vyšetření resekované kontuze mozku [2,3]. Z poraněné tkáně se uvolňují některé specifické proteiny do cirkulace (např. neuron specifická enoláza – NSE, a protein S100B), které jsou rovněž používány ke sledování klinického stavu těchto pacientů [4]. Monitorování poškozených gliových a gangliových buněk při primárním poranění mozku je možné stanovením sérových hladin NSE a proteinu S100B [5,6,7,8]. NSE je glykolytický enzym (2-fosfo-D-glycerid hydroláza, molekulová hmotnost 80 kDa, referenční rozmezí fyziologických hodnot v séru do 15,2 μg/l). Je popsáno 5 izoenzymů NSE. Izoenzym s podjednotkami γγ je lokalizovaný primárně v cytoplazmě neuronů, izoenzym αγ je obsažen v erytrocytech a může interferovat s hodnotami izoenzymu γγ při hemolýze odebraného krevního vzorku [9]. Protein S100B je vápník vázající protein (molekulová hmotnost 21 kDa, referenční rozmezí fyziologických hodnot v séru do 0,105 μg/l) lokalizovaný v astroglii. NSE je senzitivní marker pro odhad prognózy pacientů s poraněním hlavy. U pacientů, kteří zemřeli následkem poranění hlavy, byly publikovány hladiny NSE vyšší než u pacientů přežívajících [5,10]. Nižší hodnoty NSE byly zjištěny u pacientů s dobrým klinickým průběhem po mozkového poranění [6]. Při experimentálním poranění mozku byl sledován vývoj hladin NSE v séru v závislosti na čase. Nejvyšší hladiny NSE byly 6 hodin po úraze [7]. U pacientů s těžkým a středně těžkým poraněním (GCS méně než 12) byly koncentrace NSE a proteinu S100B vyšší než u pacientů s lehčím traumatem (GCS méně než 12) [11,12]. Pokud byl sledován časový vývoj hodnot NSE a proteinu S100B po dobu více hodin až dní, bylo zjištěno, že po 24-72 hodinách klesají hodnoty obou ukazatelů až k hodnotám v rozmezí referenčního intervalu [13].
Metodika
Soubor pacientů
Soubor (n = 20) pacientů s poraněním hlavy. Ze souboru jsme vyloučili pacienty s difuzním axonálním poraněním (DAI), které bylo diagnostikováno po více týdnech na MRI. U všech pacientú bylo diagnostikováno fokální poranění mozku, u 2 pacientů byla prokázaná kontuze mozkového kmene. Během léčby jsme hodnotili klinický stav pacientů pomocí GCS, které patří mezi nejčastěji používanou stupnici hodnocení stavu vědomí [15]. U 9 pacientů (skupina I) došlo během 10 dnů od přijetí ke klinickému zlepšení GCS na hodnotu 13-15 bodů, vstupní hodnoty GCS byly v průměru 8,9 bodů. U 11 pacientů (skupina II) bylo GCS menší než 13 bodům po 10 dnech hospitalizace. Vstupní hodnoty GCS byly průměrně 4,8 bodů. Ve skupině I byli operováni 3 pacienti, ve skupině II celkem 4 pacienti pro expanzní chování kontuzního ložiska (ICP větší než 20 torrů, přetlak středočarových struktur o 5 mm a více, rozvoj mydriázy). Pacienti byli sledováni po celou dobu hospitalizace, po dobu 10 dnů byl prováděn odběr krve na biochemická vyšetření. Studie a informovaný souhlas pacienta byly schváleny etickou komisí.
Biochemické vyšetření
Vzorky krve byly schromážděny od pacientů v průběhu 10 denní hospitalizace na Anesteziologicko-resuscitačním oddělení, po centrifugaci bylo sérum zamraženo při -70 °C pro další analýzu, v případě hemolýzy krve nebylo měření ze séra provedeno. Sérové koncentrace NSE (izoenzym γγ), proteinu S100B byly měřeny metodou ECLIA diagnostickými soupravami Roche na přístroji Elecsys 2010. Horní hranice referenčního rozmezí pro NSE je 15,2 μg/l a pro S100B protein 0,105 μg/l.
Elektronová mikroskopie a imunohistochemie
U operovaných pacientů (n = 7) byla tkáň odebraného kontuzního ložiska fixovaná glutaraldehydem (k pozdějšímu zpracování pro elektronovou mikroskopii) a formaldehydem. Histologické bločky byly zalité do parafinu k imunohistochemickému vyšetření s protilátkou proti CD-68.
Statistické zpracování dat
U všech pacientů jsme sledovali vývoj hladin NSE a S100B. Data (získané hodnoty sérových hladin NSE a proteinu S100B) u obou souborů byla rozdělena do skupin: 1.-3. den, 4.-6. den a 7.-10. den hospitalizace. Koncentrace jednotlivých markerů byly vyjádřeny jako aritmetický průměr, rozdíly mezi jednotlivými skupinami byly porovnány metodou ANOVA v programu StatView. Hodnoty p < 0,05 byly považovány za statisticky významné.
Výsledky
Biochemické nálezy
U všech pacientů s poraněním hlavy (n = 20) byl zjištěn pokles hodnot NSE a proteinu S100B v průběhu prvních 10 dnů hospitalizace. U skupiny I s klinickým zlepšením a úpravou hodnot GCS během 10 dnů od přijetí na hodnoty 13-15 byly hodnoty NSE (33,53 vs 61,76 μg/l, p < 0,05) a proteinu S100B (0,61 vs 4,45 μg/l, p < 0,05) nižší během 1.-3. dne po přijetí ve srovnání s hodnotami u skupiny II (graf 1). Od 4. do 10. dne nebyly mezi oběma soubory statistické rozdíly. Ve skupině II zemřelo celkem 5 osob (45 %), jejichž průměrné hodnoty NSE a S100B se od 1.dne zvýšily 2.-3.den z 32,72 μg/l na 86,95 μg/l u NSE a u proteinu S100B z 3,419 μg/l na 5,804 μg/l. U dvou pacientů bylo na CT zjištěno pohmoždění mozkového kmene (skupina II).
Graf 1. Hodnoty proteinu S100B v průběhu prvních 3 dnů hospitalizace. Horní mez referenčního intervalu pro protein S100B je 0,105 μg/l. Skupina I – pacienti se zlepšením GCS v průběhu 10 dnů hospitalizace na hodnoty 13 až 15 bodů. Skupina II – pacienti bez zlepšení GCS 
Kazuistiky u expanzních kontuzí a morfologické nálezy u skupiny I
Kazuistika č.1 (skupina I)
28letý pacient po kraniocerebrálním poranění při pádu ze schodů v ebrietě. Na vstupním CT kontuze frontálně vpravo s plášťovým akutním subdurálním hematomem fronto-temporálně vpravo s přetlakem středočarových struktur 5 mm. Na kontrolním CT s odstupem 6 hodin progrese přetlaku. Indikováno zavedení čidla ICP, které ukazuje hodnoty kolem 30 torrů. Pacient somnolentní, zornice izokorické, GCS 8. Nemocný byl urgentně operován. Provedena evakuace akutního subdurálního hematomu a resekce kontuze s plastikou tvrdé pleny. Hodnoty NSE po operaci přechodně stoupají na 33,63 μg/l. Hladiny proteinu S100B klesají z hodnot 0,344 μg/l až k referenčním hodnotám během 3 dnů. Po odtlumení pacienta 6. den postupně zlepšování klinického stavu až do plného vědomí s GCS 15.
Kazuistika č.2 (skupina I)
32letý pacient s kraniocerebrálním poraněním při autonehodě. Na vstupním CT nález akutního subdurálního hematomu s kontuzí mozku pod impresivní zlomeninou parietálně vpravo. Při klinickém vyšetření nemocný s flekční reakcí na algický podnět bilaterálně, izokorické zornice, GCS 6, otevřená impresivní zlomenina parietálně vpravo s výtokem likvoru, v ráně patrná mozková tkáň. Nemocný urgentně operován. Provedena evakuace hematomu z dekompresivní kraniektomie a resekce části kontuzních hmot mozku s plastikou tvrdé pleny. Hodnoty markerů kontinuálně klesají během 4 dnů k referenčnímu rozmezí ze vstupních hodnot NSE (49,27 μg/l) a S100B (1,88 μg/l). 8. den po odtlumení pacienta postupně zlepšování klinického stavu až do plného kontaktu (GCS 15). Po 3 měsících pacient plně soběstačný, bez ložiskového neurologického nálezu na hlavových nervech a končetinách. Provedena replantace kostní ploténky.
Morfologické vyšetření okrajové zóny kontuze prokázalo u pacientů skupiny I perivaskulární krvácení a únik krevních bílkovin do perivaskulárního kompartmentu. V pericytech nacházíme telolyzozomy (obr. 1), které odpovídají immunohistochemické pozitivitě s protilátkou proti receptoru CD68 (obr. 2). V astrogliálních výběžcích se vyskytovaly proteiny, v cytoplasmě byly známky edému, jádra a jadérka byla dobře barvitelné.
Obr. 1. Imunohistochemická reakce s protilátkou proti antigenu CD 68 (◄ ) zbarvení značí pozitivní reakci navázané protilátky s DAB (diaminobenzidinem), zvětšení 400×. 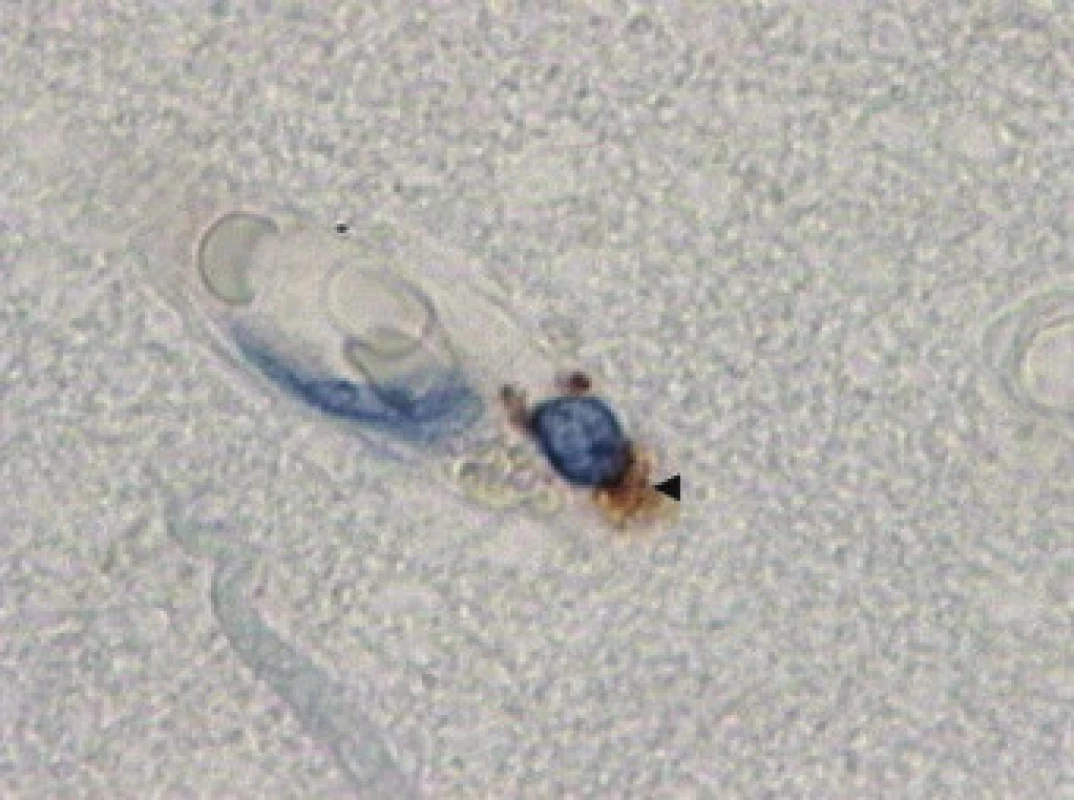
Obr. 2. Elektronová mikroskopie kontuzního ložiska u pacienta (soubor I), zobrazení lumen kapiláry s erytrocytem (Ery). Na řezu zachycena endotelie (En) a pericyt (PC) s telolyzozomem (*). 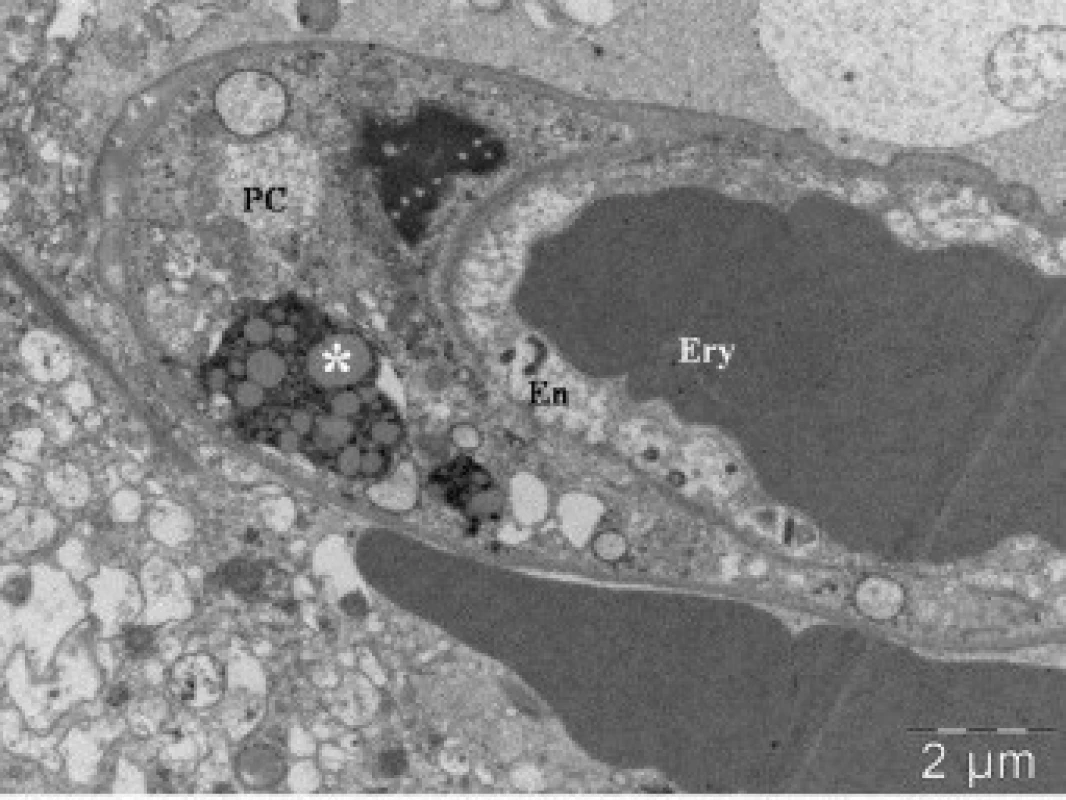
Kazuistiky u expanzních kontuzí a morfologické nálezy u skupiny II
Kazuistika č.3 (skupina II)
42letý pacient po kraniocerebrálním poranění při pádu ze schodů v ebrietě. Na vstupním CT nacházíme kontuze frontálně oboustranně s plášťovým akutním subdurálním hematomem parietálně vpravo. Plánovaný operační výkon, provedena evakuace akutního subdurálního hematomu a resekce kontuze s plastikou tvrdé pleny. Na kontrolním CT s nepříznivým pooperačním nálezem, dobarvení kontuzních ložisek frontálně vpravo (obr. 3) a temporálně vlevo. Rozvoj bilaterální mydriázy, vyhasnutí kmenových reflexů, 2. pooperační den známky smrti mozku při maligním posttraumatickém edému. Biochemické monitorování prokázalo vzestupnou tendenci hladin proteinu S100B 1. den (1,40 μg/l), 2. den (4,15 μg/l) a 3. den (10,7 μg/l).
Obr. 3. CT v mozkovém okně, dobarvení kontuze frontálně vpravo a temporálně vlevo, otok a hematom měkkých pokrývek lebních. Přetlak středočarových struktur o 10,3 mm. 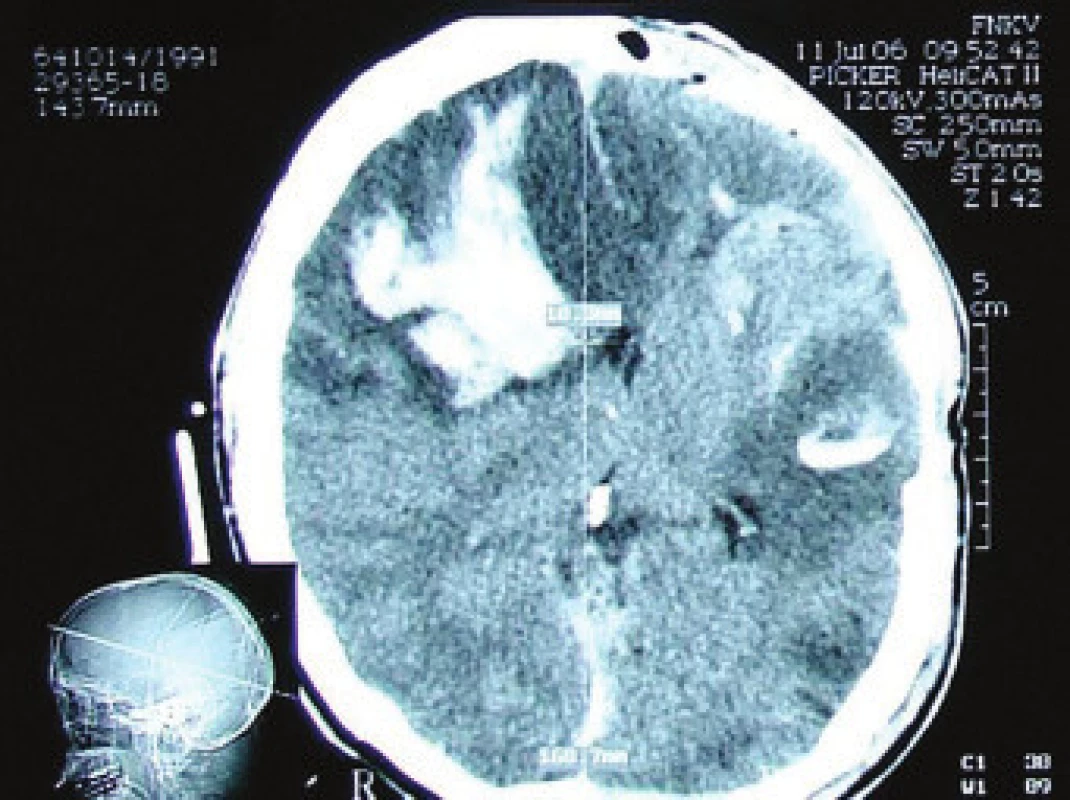
Kazuistika č.4 (skupina II)
50letý pacient, casus socialis, nalezen v hlubokém bezvědomí. Na vstupním CT nález akutního subdurálního hematomu fronto-temporálně vpravo, přetlak středočarových struktur doleva o 24 mm, kontuze temporo-parietálně vpravo. Nemocný urgentně operován. Provedena evakuace hematomu z dekompresivní kraniektomie a resekce části kontuzních hmot mozku. Na kontrolním CT přetrvávající edém, přetlak středočarových struktur o 20 mm. Biochemické monitorování prokázalo vzestupnou tendenci hladin proteinu S100B 1. den (1,38 μg/l), 2. den (1,44 μg/l) a 3. den (4,80 μg/l); 6. den exitus lethalis.Morfologický obraz okrajové zóny kontuze u skupiny II s horší prognózou prokazuje vystupňované ultrastrukturální změny. Nacházeli jsme poškození kapilár (obr. 4), aktivaci povrchu endotelií s tvorbou výběžků, vystupňovanou pinocytotickou aktivitu (obr. 5) a formování multivezikálních tělísek v endoteliích. V buňkách byly vystupňované známky cytotoxického edému, prakticky vymizení proteinů v astrogliálních výběžcích, deformace mitochondrií a dystrofie organel. Leukocytární adhezi a vycestování leukocytů do tkáně jsme zjistili u obou skupin.
Obr. 4. Elektronová mikroskopie kontuzního ložiska u pacienta (soubor II), zobrazení lumen kapiláry s leukocytem (Leu). Na řezu zachycen cytotoxický edém endotelie (En), pericytu (PC) a astrogli (AG); formování telolyzozomů (*). 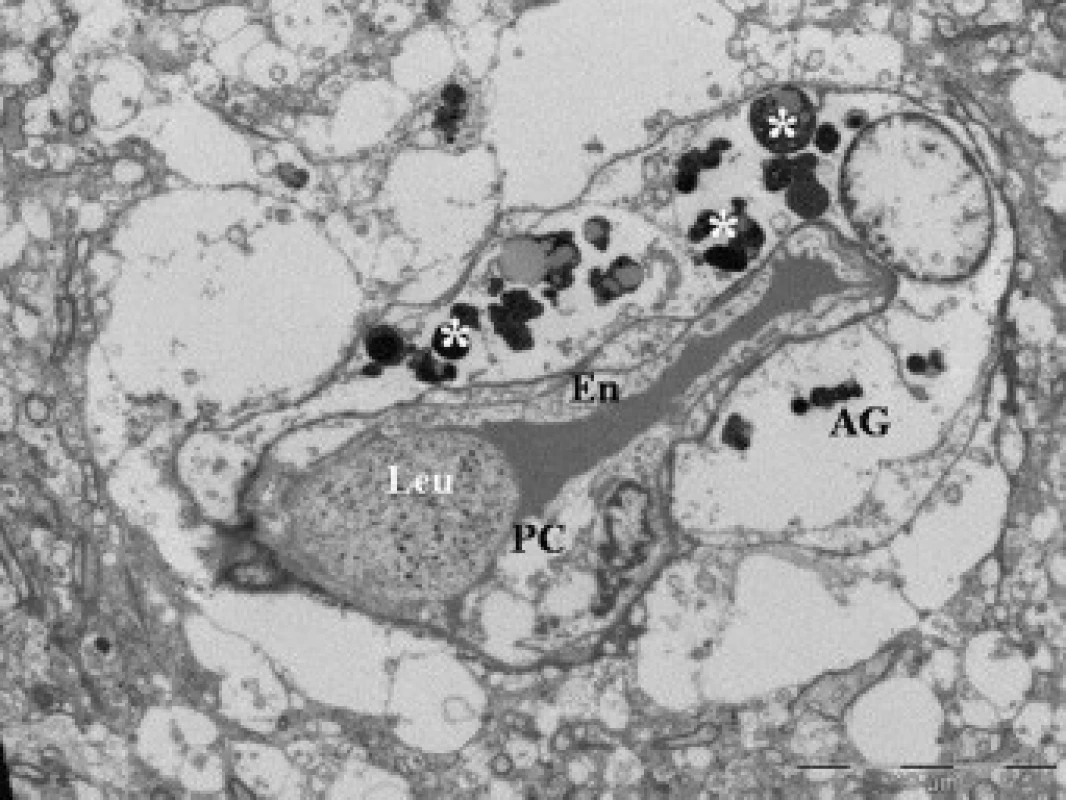
Obr. 5. Elektronová mikroskopie kontuzního ložiska u pacienta (soubor II), zobrazení lumen kapiláry (C). Na řezu zachycena endotelie (En) s pinocytotickými vakuolami (◄ ); výběžky astroglie (*). 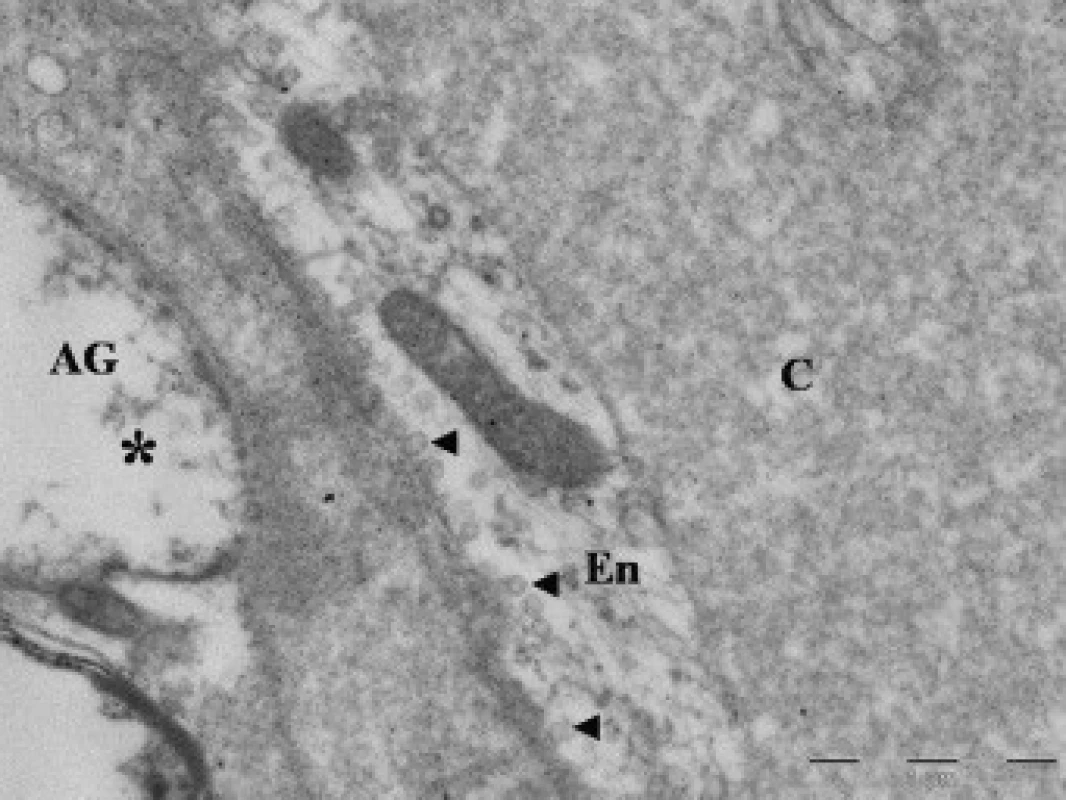
Diskuse
Hladiny NSE i proteinu S100B klesají po 24, 48 a 72 hodinách po přijetí na klinické pracoviště, tak jako to popisují někteří autoři [13]. Při sledování vývoje průměrných hodnot NSE a proteinu S100B během 10denní hospitalizace jsme zjistili, že hladiny klesají od 1. dne po úraze až k horní hranici referenčního intervalu, a to obou sledovaných ukazatelů. Při sledování rychlosti poklesu NSE a S100B během prvních dnů po přijetí lze rozlišit pacienty, u kterých ukazatelé 1.-3. den klesají z vysokých hodnot k referenčnímu rozmezí hodnot. U dalších pacientů jsou patrné hladiny markerů zvýšené nad referenční hodnoty i po dobu několika dnů. U 5 pacientů ze skupiny II, kteří zemřeli, byl dokumentován vzestup hodnot NSE a S100B 2.-3.den. Podobné výsledky byly publikovány u souboru pacientů s těžkým a středně těžkým poraněním (GCS méně než 12), u nichž přetrvávaly vyšší hodnoty NSE a proteinu S100B v porovnání s pacienty s lehčím traumatem [12]. Sérové hladiny S100B a NSE jsou v souladu se skórem závažnosti poranění a CT-nálezy [8]. Vstupní hodnoty mají význam k odhadu dlouhodobého výsledku léčby (outcome) podle řady autorů [5,6,8,13]. V našem souboru byli vyloučeni pacienti s DAI, kteří mají odlišnou kinetiku hodnot NSE a S100B [12] a patří do souboru pacientů s dlouhodobě nízkými hodnotami GCS [21]. Tyto hladiny jsou zároveň rozdílné u pacientů s kontuzí mozku a pacientů s DAI [12].
Při morfologickém vyšetření bioptického materiálu u našich pacientů jsme nalezli zduřelé denzní i světlé mitochondrie v kontuzním ložisku a u pacientů s horší prognózou byly mitochondrie v některých buňkách deformované. Mitochondrie mohou být významným iniciátorem procesů apoptózy v mozku. Ultrastrukturální studie poškození mitochondrií po ischemii a anoxii ukázaly, že mitochondrie podléhají postupné změně struktury a funkcí a přispívají k buněčné smrti [14]. Vznik apoptozómu uvolněním faktorů (Apaf-1) z mitochondrií, který aktivuje kaspázy v procesu apoptózy je v současnosti intenzivně studován [15].
V okolí cév jsme nalezli perivaskulární krvácení a průnik proteinů do Virchowova-Robinova prostoru. Huang prokázal, že infuze erytrocytů do mozku způsobuje akutní mozkové poškození [16]. Intracerebrální krvácení může vést k oxidativnímu poškození mozkové tkáně a uvolněné železo z erytrocytů může přispět k utváření volných kyslíkových radikálů [17], které mohou poškozovat membrány buněk při nedostatku antioxidantů např. metallothioneinu [21].
Z našich analýz dále vyplývá, že funkce pericytů byla zachována spolu s přítomností telolyzozomů a pozitivitou proti membránovému receptoru CD68 a schopností fagocytózy v perivaskulárním kompartmentu. Při imunohistochemické detekci se protilátka proti CD68 váže na epitop PG M1 lokalizovaný na membránách makrofágů, v mozkové tkání na mikroglii [18].
V astrogliálních výběžcích byla u našich pacientů zjištěna přítomnost proteinů. Jádra a jadérka gliových elementů nevykazovaly patologické znaky. Zahraničními autory je reakce astrocytů na trauma dobře dokumentována v bioptickém materiálu [2,3,14,19].
V endoteliích byla v našem souboru nalezena jádra a invaginace membrány. Také jsme prokázali přichycení neutrofilních leukocytů na endotelie a jejich vycestování do tkáně. Při ultrastrukturálním vyšetření endotelií pacientů s traumatickou kontuzí zahraniční autoři prokázali známky intracelulárního edému, těsná spojení byla nepoškozená. Pinocytická aktivita endotelií byla zvýšená a astrocytární výběžky byly zduřené, v makrofázích byly pozorovány objemné lyzozomy [20]. V našem souboru byla prokázána přítomnost vakuol v endoteliích. Pozorovali jsme, že u skupiny II s horší prognozou byly vystupňované ultrastrukturální změny. Nacházeli jsme poškození mitochondrií [22], poškození kapilár a formování multivesikálních tělísek v endoteliích. Gliové elementy vykazovaly vystupňovaný cytotoxický edém, který společně s poškozením mitochondrií a změnami endotelií může být projevem vyšší mortality pacientů skupiny II.
Závěr
V souboru pacientů s poraněním hlavy jsme zjistili pokles hodnot NSE a proteinu S100B od přijetí do 10 dnů hospitalizace. Pacienti s klinickým zlepšením a úpravou hodnot GCS během 10 dnů od přijetí na hodnotu 15 bodů měli nižší hodnoty NSE a proteinu S100B 1.-3. den po přijetí. U pacientů kteří zemřeli byl zjištěn nárůst hodnot NSE a S100B 2.-3. den. Morfologické vyšetření resekovaného kontuzního ložiska prokázalo, že funkce pericytů byla zachována spolu s přítomností telolyzozomů a pozitivitou proti membránovému receptoru CD68 a schopností fagocytózy v perivaskulárním kompartmentu. Vystupňovaný cytotoxický edém, poškození mitochondrií a změny endotelií může být projevem vyšší mortality pacientů skupiny II, která koreluje s vyššími hodnotami NSE a proteinu S100B v séru.
Přijato k recenzi: 10.8.2006
Přijato do tisku: 5.6.2007
MUDr. David Vajtr
Ústav klinické biochemie a patobiochemie 2. LF UK a FN Motol
V Úvalu 84
Praha 5 - Motol, 150 06
Zdroje
1. Gennarelli TA. Mechanisms of brain injury. J Emerg Med 1993; 11(Suppl 1): 5-11.
2. Castejon OJ, Acurero G. Traumatic axolemmal and cytoskeletal derangement in myelinated axons of human oedematous cerebral cortex and loss of consciousness. An electron microscopic study using cortical biopsies. J Submicrosc Cytol Pathol 2004; 36 : 285-293.
3. Castejon OJ. Astrocyte subtypes in the gray matter of injured human cerebral cortex: a transmission electron microscope study. Brain Inj 1999; 13 : 291-304.
4. Vajtr D, Průša R, Houšťava L, Šámal F, Kukačka J, Pachl J. Biochemical and immunohistochemical markers of brain injury. Soud Lek 2006; 51 : 36-41.
5. Pleines UE, Morganti-Kossmann MC, Rancan M, Joller H, Trentz O, Kossmann T. S-100 beta reflects the extent of injury and outcome, whereas neuronal specific enolase is a better indicator of neuroinflammation in patients with severe traumatic brain injury. J Neurotrauma 2001; 18 : 491-498.
6. Woertgen C, Rothoerl RD, Holzschuh M, Metz C, Brawanski A. Comparison of serial S-100 and NSE serum measurements after severe head injury. Acta Neurochir (Wien) 1997; 139 : 1161-1164.
7. Woertgen C, Rothoerl RD, Brawanski A. Time profile of neuron specific enolase serum levels after experimental brain injury in rat. Acta Neurochir Suppl 2000; 76 : 371-373.
8. Vos PE, Lamers KJ, Hendriks JC, van Haaren M, Beems T, Zimmerman C et al. Glial and neuronal proteins in serum predict outcome after severe traumatic brain injury. Neurology 2004; 62 : 1303-1310.
9. Royd JA, Davies-Jones GAB, Lewtas NA. Enolase isoenzymes in the cerebrospinal fluid of patients with diseases of the nervous systém. J Neurol Neurosurg Psychiatry 1983, 46 : 1031-1036.
10. Yamazaki Y, Yada K, Morii S, Kitahara T, Ohwada T. Diagnostic significance of serum neuron-specific enolase and myelin basic protein assay in patients with acute head injury. Surg Neurol 1995; 43 : 267-270.
11. Unden J, Bellner J, Reinstrup P, Romner B. Serial S100B levels before, during and after cerebral herniation. Br J Neurosurg 2004; 18 : 277-280.
12. Herrmann M, Jost S, Kutz S, Ebert AD, Kratz T, Wunderlich MT et al. Temporal profile of release of neurobiochemical markers of brain damage after traumatic brain injury is associated with intracranial pathology as demonstrated in cranial computerized tomography. J Neurotrauma 2000; 17 : 113-122.
13. Herrmann M, N Curio, S Jost. Release of biochemical markers of damage to neuronal and glial brain tissue is associated with short and long term neuropsychological outcome after tramatic brain injury. J Neurol Neurosurg Psychiatry 2001, 70 : 95-100.
14. Castejon OJ, de Castejon HV. Structural patterns of injured mitochondria in human oedematous cerebral cortex. Brain Inj 2004; 18 : 1107-1126.
15. Green DR, Reed JC. Mitochondria and apoptosis. Science 1998; 281 : 1309.
16. Huang FP, Xi G, Keep RF., Hua Y, Nemoianu A, Hoff JT. Brain edema after experimental intracerebral hemorrhage: role of hemoglobin degradation products. J Neurosurg 2002; 96 : 287–293.
17. Siesjo BK, Agardh CD, Bengstsson F. Free radicals and brain damage. Cerebrovasc Brain Metab Rev 1989; 1 : 165–211.
18. Oehmichen M. Is traumatic axonal injury (AI) associated with an early microglial activation? Application of a double-labeling technique for simultaneous detection of microglia and AI. Acta Neuropathol 1999; 97 : 491-494.
19. Castejon OJ, Arismendi GJ. Nerve cell nuclear and nucleolar abnormalities in the human oedematous cerebral cortex. An electron microscopic study using cortical biopsies. J Submicrosc Cytol Pathol 2004; 36 : 273-283.
20. Vaz R, Sarmento A, Borges N, Cruz C, Azevedo I. Ultrastructural study of brain microvessels in patients with traumatic cerebral contusions. Acta Neurochir (Wien) 1997; 139 : 215-220.
21. Kukacka J,Vajtr D, Huska D, Prusa R, Houstava L, Samal F et al. Blood metallothionein, neuron specific enolase, and protein S100B in patients with traumatic brain injury. Neuro Endocrinol Lett 2006; 27(Suppl 2): 116-120.Prusa R, Vajtr D, Kukacka J, Houstava L, Samal F, Kracmarova A et al. Gene Expression Profile and Serum Levels of NSE and S100b Protein in Patients with Traumatic Brain Injury during 10 Days of Hospitalization. Mol Biol Cell 2006; 17(Suppl): abstract 1340/B634 (CD-ROM).
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2007 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Léčba epileptických syndromů u dětí
- Vliv antiepileptik na homeostázu hormonů štítné žlázy
- Léčebný potenciál lamotriginu v terapii epilepsie v dětství a adolescenci
- Zmeny v aktivite syntázy oxidu dusnatého v mieche po ligácii koreňov cauda equina v experimente
- Komentář ke článkům Vajtr D, Průša R, Kukačka J, Houšťava L, Šámal F, Pachl J, Pažout J. Dynamika vývoje GCS, hladiny NSE a S100b v séru a morfologie expanzní kontuze u pacientů s poraněním hlavy a Lavička P, Pikner R, Kormunda S, Topolčan O , Bosman R, Chytra I, Holubec L, Choc M. Význam stanovení S100B proteinu u pacientů s izolovaným poraněním hlavy.
- Dynamika vývoje GCS, hladiny NSE a S100B v séru a morfologie expanzní kontuze u pacientů s poraněním hlavy
- Význam stanovení S100B proteinu u pacientů s izolovaným poraněním hlavy
- Sledovanie objemových zmien nastávajúcich po stereotaktickej rádiochirurgickej liečbe v nide intrakraniálnych arteriovenóznych malformácií pomocou 3D volumetrickej štúdie na podklade MR-angiografie
- Pulzní radiofrekvenční terapie radikulární bolesti
- Hemimegalencefalie: přehled literatury a zkušenosti s chirurgickou léčbou 5 nemocných dětí
- Diagnostikujeme správně infekci virem West Nile?
- Hodnocení edému terče zrakového nervu
- Transforaminální lumbo-sakrální mezitělová fúze (TLIF) s instrumentací: prospektivní studie s minimálně 20měsíčním sledováním
- Měření tkáňového kyslíku v mozku jako součást multimodálního monitorování: kazuistiky
- „Inverzní“ syndrom Fostera-Kennedyho u nitrolebního meningeomu: kazuistika
- Jsou některé kontraindikace lumbální punkce dnes již obsoletní? Kazuistika
- Neobvyklá oboustranná atrofie endotelu rohovky a zrakového nervu po pravděpodobné intoxikaci insekticidem lambda-cyhalotrinem (Karate 5 CS) u 58letého vinaře: kazuistika
- Kombinovaná mikrochirurgická a endovaskulární terapie intramedulárního hemangioblastomu: kazuistika
- Epidurální hematom a impresivní fraktura lebky v důsledku bodového uchycení hlavy: zpráva o neobvyklé komplikaci: kazuistika
- Doporučené postupy pro léčbu Alzheimerovy nemoci a dalších onemocnění spojených s demencí
- Černý R, Machala L. Neurologické komplikace HIV/AIDS. Praha: Karolinum 2007. 303 stran. ISBN 978-80-246-1222-5.
- Webové okénko
- DOPORUČENÍ ČESKÉ MYELOMOVÉ SKUPINY (CZECH MYELOM GROUP - CMG) PRO ZAJIŠTĚNÍ ČASNÉ DIAGNOSTIKY MNOHOČETNÉHO MYELOMU V PODMÍNKÁCH AMBULANTNÍ KLINICKÉ PRAXE
-
Analýza dat v neurologii.
V. Přínos a důsledky transformace dat
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba epileptických syndromů u dětí
- Hodnocení edému terče zrakového nervu
- Jsou některé kontraindikace lumbální punkce dnes již obsoletní? Kazuistika
- Transforaminální lumbo-sakrální mezitělová fúze (TLIF) s instrumentací: prospektivní studie s minimálně 20měsíčním sledováním
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



