-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sledovanie objemových zmien nastávajúcich po stereotaktickej rádiochirurgickej liečbe v nide intrakraniálnych arteriovenóznych malformácií pomocou 3D volumetrickej štúdie na podklade MR-angiografie
Monitoring volume changes following stereotactic radiosurgical treatment in the nidus of an intracranial arteriovenous malformation with the use of MR angiography based 3D volumetric study
Intracranial arteriovenous malformation (AVM) is a vascular anomaly jeopardising the affected person due to the risk of intracranial haemorrhage. Stereotactic radiosurgery is a mini-invasive method of treatment of AVM with the possibility of unlimited access to all the locations in the brain. The effect of treatment can be expected after 1 to 3 years.
Objective:
Define the volumetric change of an irradiated AVM nidus in the period of one year post-surgery using the method of 3D volumetric study based on magnetic resonance angiography (MRA). Observe the method of volumetric change monitoring with traditional angiography (DSA) on the basis of available literary data. Determine adequate percentage of volumetric change of AVM nidus and find out whether the speed of obliteration depends on the initial size of the nidus and on the therapeutic dose of irradiation.Set and methods:
Irradiation dose of 12 to 20 Gy (17.52 Gy on an average) was applied to a set of 31 patients aged 35 years, in the volume of 0.3–21.3 cm3 (6.21 cm3 on an average). 3D volumetric MRA based study was used for the calculation of volumetric changes. The non-parametric correlation method was used for testing the defined parameters.Outcome:
Using the 3D volumetric study, we discovered an average 64 % reduction of AVM nidus volume as early as one year after radiosurgery. The percentage of reduction depends on the therapeutic dose of irradiation (p = 0.031).Conclusion:
MRA based 3D volumetric study allows for a very precise assessment of the dynamism of even the smallest volumetric changes following radiosurgical irradiation. The 3D volumetric study appears as a suitable method for the follow up of effects of radiosurgical therapy of AVM. MRA is a non-invasive method allowing for detailed imaging of arteries in a 3D image with high spatial resolution. The information obtained is significant from the prognosis point of view, and for further management of the patients.Key words:
arteriovenous malformation – 3D volumetric study – MR angiography – stereotactic radiosurgery
Autoři: I. Vachaľová 1; A. Ďurkovský 2; M. Šramka 3; P. Traubner 1
Působiště autorů: 1. neurologická klinika LF UK a FNsPB, Bratislava 1; Klinika stereotaktickej rádiochirurgie OÚSA, Bratislava 2; Klinika rádiodiagnostiky TU a OÚSA, Bratislava 3
Vyšlo v časopise: Cesk Slov Neurol N 2007; 70/103(5): 527-532
Kategorie: Původní práce
Poďakovanie: Naša úprimná vďaka patrí kolektívu neurochirurgov, rádioterapeutov, rádioonkológov, radiačných fyzikov a rádiodiagnostikov Onkologického Ústavu svätej Alžbety v Bratislave, ktorí sa svojou dennou obetavou prácou zaslúžili o dosiahnuté výsledky rádiochirugickej liečby pacientov s intrakraniálnymi arteriovenóznymi malformáciami.
Za finančnú podporu vďačíme grantu poskytnutému firmou Wyeth a Grantu Univerzity Komenského.
Všetky MR vyšetrenia sa uskutočnili na 1T supravodivom systéme Harmony firmy Siemens.Souhrn
Intrakraniálna arteriovenózna malformácia (AVM) je vaskulárna anomália ohrozujúca svojho nositeľa možnosťou vzniku intrakraniálnej hemorágie. Stereotaktická rádiochirurgia je miniinvazívna metóda liečby AVM s možnosťou neobmedzeného prístupu do všetkých lokalizácií mozgu. Efekt liečby možno očakávať s časovým odstupom 1 až 3 roky.
Ciele práce:
Definovať objemovú zmenu ožiareného nidu AVM v časovom intervale jedného roka po zákroku metódou trojdimenzionálnej (3D) volumetrickej štúdie na podklade magneticko-rezonančnej angiografie (MRA). Porovnať túto metódu sledovania objemových zmien s klasickou angiografiou (DSA) na základe dostupných literárnych údajov. Stanoviť priemerné percento objemovej zmeny nidu AVM a zistiť, či na rýchlosť obliterácie má vplyv iniciálna veľkosť nidu, terapeutická dávka žiarenia.Súbor a metódy:
V súbore 31 pacientov s priemerným vekom 35 rokov bola aplikovaná dávka žiarenia 12 až 20 Gy ( priemerne 17,52 Gy) do objemu 0,3–21,3 cm3 (priemerne 6,21 cm3). Na výpočet objemových zmien sme použili 3D volumetrickú štúdiu na podklade MRA. Na testovanie zadaných parametrov bola použitá metóda neparametrickej korelácie.Výsledky:
Pomocou 3D volumetrickej štúdie sme odhalili priemerne 64% zmenšenie objemu nidu AVM už 1 rok po rádiochirurgickom zákroku. Percento dosiahnutého zmenšenia závisí od použitej terapeutickej dávky žiarenia (p = 0,031).Záver:
3D volumetrická štúdia na podklade digitálnej informácie z MRA umožňuje veľmi presne posudzovať dynamiku aj najjemnejších objemových zmien nastávajúcich po rádiochirurgickom ožiarení. 3D volumetrická štúdia sa javí ako vhodná metóda na sledovanie účinkov rádiochirurgickej (SRCH) liečby AVM. MRA je neinvazívna metóda dovoľujúca detailne zobraziť cievy v 3D obraze s vysokým priestorovým rozlíšením. Získané informácie majú význam z hľadiska prognózy a pre ďalší manažment pacientov.Klíčová slova:
arteriovenózna malformácia – 3D volumetrická štúdia – MR angiografia – stereotaktická rádiochirurgiaÚvod
Intrakraniálna arteriovenózna malformácia (AVM) je štrukturálna abnormalita cievnej vaskulatúry mozgu, ktorá je tvorená prívodnými artériami, vlastným nidom zloženým z klbka malformovaných ciev a odvodnými, drénujúcimi žilami [1]. Jej incidencia je približne 1/100 000 obyvateľov za rok. V spojení tepenného prívodu a drénujúcej žily vzniká arteriovenózny skrat. Nidus je vlastné aktívne centrum AVM, vytvorené z klbka ciev rôzneho kalibru. AVM ohrozuje svojho nositeľa najvýznamnejšie možnosťou vzniku intrakraniálnej hemorágie. AVM sú zodpovedné za cca 1 % všetkých náhlych cievnych mozgových príhod (CMP), za 3 % náhlych CMP u dospelých a približne za 9 % subarachnoidálnych hemorágií [2]. Všeobecné riziko iniciálnej hemorágie je približne 2-3 % ročne. Mortalita prvej hemoragickej príhody je približne 10-30 %, 10-20 % prežívajúcich má pomerne ťažký stupeň dlhodobého funkčného postihnutia [3-9]. AVM sa môže prejaviť aj menej závažnou formou, a to epileptickými záchvatmi, fokálnym neurologickým deficitom, alebo bolesťou hlavy, väčšinou migrenózneho charakteru.
Prezentujeme vlastné skúsenosti s liečbou intrakraniálnych AVM pomocou lineárneho urýchľovača (LINAC). Základom stereotaktickej rádiochirurgie pomocou LINACu je jednorazová aplikácia vysokej dávky radiačného žiarenia do cieľového objemu definovaného 3D stereotaktickým priestorom. Ožiarenie malformovaných ciev vedie k stimulácii proliferácie endotelu, k degenerácii buniek médie s produkciou hyalínu, čo vedie k alterácii hemodynamických pomerov s následnou obliteráciou nidu AVM [10]. Vo všeobecnosti sú k liečbe LINACom indikované malé lézie (najväčší rozmer <3cm, objem <10cm³), lokalizované v elokventnej oblasti – mozgový kmeň, senzomotorická oblasť, cerebelárne jadrá. Výhodou LINAC - stereotaktickej rádiochirurgie (SRCH) je miniinvazivita, vyžaduje len krátku hospitalizáciu a prístup je možný do všetkých anatomických oblastí mozgu. Nevýhodou však je, že efekt, teda obliterácia AVM, sa dostavuje s časovým odstupom 1-3 rokov. Počas tejto doby pretrváva riziko vzniku hemorágie. Zároveň je možné radiačné poškodenie zdravého mozgového tkaniva.
Cieľom práce bolo definovať objemovú zmenu ožiareného nidu AVM v časovom intervale jedného roka po zákroku metódou 3D volumetrickej štúdie na podklade MRA; porovnať túto metódu sledovania objemových zmien s klasickou angiografiou na základe dostupných literárnych údajov. Na základe údajov získaných 3D volumetrickou štúdiou stanoviť priemerné percento objemovej zmeny nidu AVM a zistiť, či na rýchlosť obliterácie má vplyv iniciálna veľkosť nidu, terapeutická dávka žiarenia.
Súbor a metodika
Ide o retrospektívnu štúdiu. Do súboru sme zaradili 31 pacientov (21 mužov a 10 žien) liečených na Klinike stereotaktickej rádiochirurgie od januára 2002 do decembra 2004. Vek pacientov sa pohyboval v rozmedzí 15 až 71 rokov, priemerne 35 rokov. 7 pacientov podstúpilo pred ožiarením endovaskulárnu embolizáciu, čím sa dosiahla okamžitá parciálna redukcia objemu AVM, ktorý bolo nutné ožiariť. Lokalizácia AVM bola u 27 pacientov supratentoriálne, u zvyšných 4 infratentoriálne. Počiatočný objem nidu AVM sa pohyboval medzi 0,3–21,3 cm³, s priemerom 6,21 cm³. Terapeutická dávka žiarenia bola daná rozhodnutím radiačného onkológa so zvážením elokvencie zóny, kde bol nidus lokalizovaný, cieľového objemu ako aj vzdialenosti od okolitých štruktúr. Rozptyl terapeutickej dávky žiarenia v našom súbore bol 12-20 Gy, s priemernou hodnotou 17,52 Gy (obr. 1). Predpísaná dávka bola aplikovaná do miesta 80% izodózy, ktorá sa podľa ožarovacieho plánu kryla s obalom nidu AVM. Maximálna dávka žiarenia dosahovala 13 až 34,87 Gy, priemerne 26,45 Gy. Podľa zložitosti tvaru lézie bol použitý ľubovoľný počet izocentier tak, aby sme dosiahli ožiarenie celej lézie potrebnou terapeutickou dávkou žiarenia. (S rozptylom lúča žiarenia v tkanive dochádza k jeho absorbcii, a tým k exponenciálne klesajúcej intenzite. Línie, spájajúce všetky body, kde dopadá žiarenie rovnakej intenzity, sa označujú „izodózy“. V priestore majú charakter obálky obklopujúcej ožarovaný objem.) Priemerný počet izocentier v našom súbore bol 3, s rozptylom 1 až 10. Všetky MR vyšetrenia sa uskutočnili na 1T supravodivom systéme Harmony firmy Siemens.
Obr. 1. Distribúcia použitej terapeutickej dávky žiarenia v súbore pacientov podľa objemu AVM. 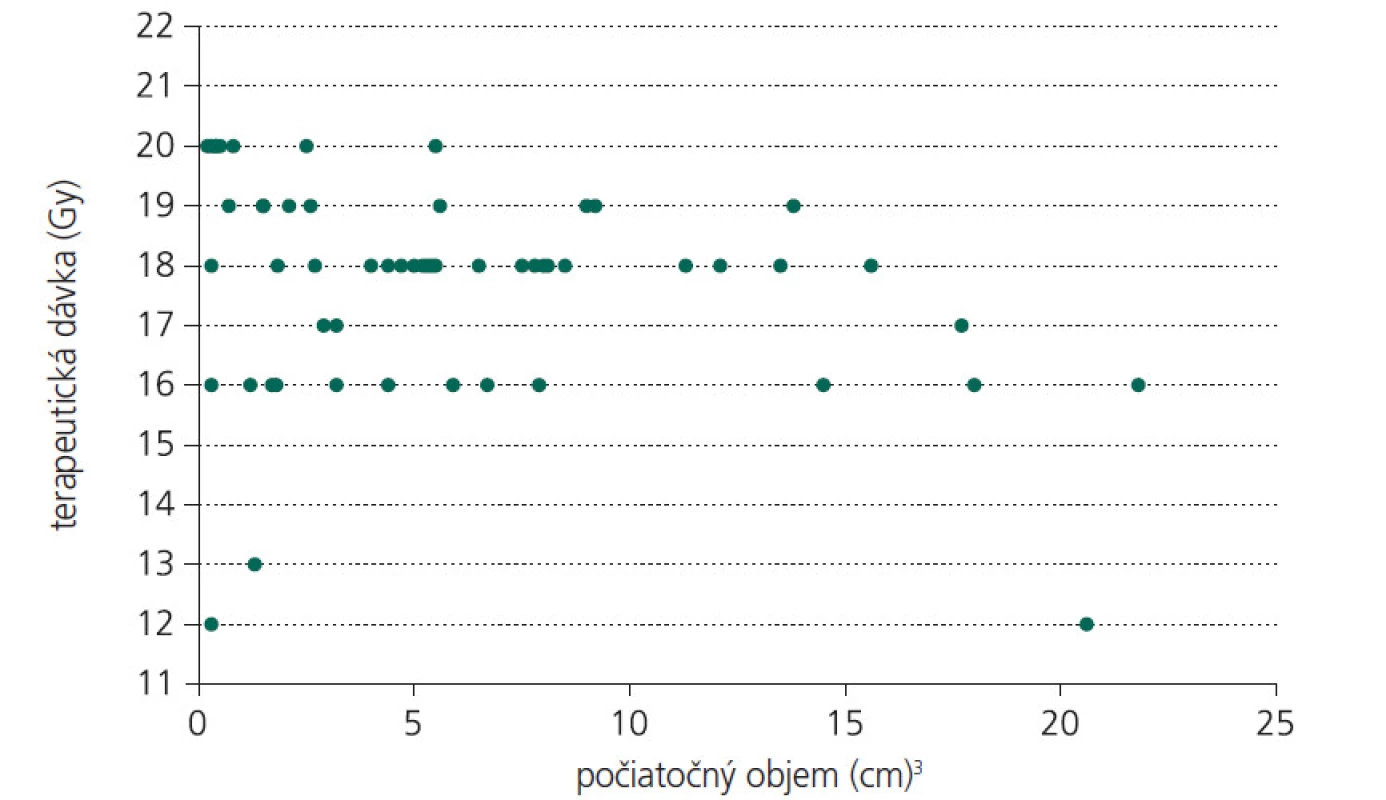
Do protokolu vyšetrenia sme zaradili 3D „time of flight“ (TOF) sekvenciu s 1-1,2 mm axiálnymi rezmi. Údaje boli nahrávané v digitálnom formáte DICOM, vyhodnocovanie sme vykonali v softvéri Tomocon Viewer©. Počas plánovania rádiochirurgického zákroku sme zakreslili obrysy nidu AVM na axiálnych rezoch. Cieľový objem sme vypočítali volumetricky metódou voxelov. Pri kontrolnej magneticko-rezonančnej angiografii (MRA) s odstupom 1 roku po zákroku sme urobili analogický výpočet objemu AVM a jej 3D rekonštrukciu. Výsledky sme navzájom porovnali.
Na základe literárnych údajov sme porovnali technické aspekty získavania informácií z MRA so „zlatým štandardom“ digitálnou subtrakčnou angiografiou (DSA).
Na testovanie zadaných parametrov sme použili štatistickú metódu neparametrickej korelácie.
Výsledky
Kontrolné vyšetrenie MRA u pacientov po roku odhalilo zmenšenie nidu AVM v priemere o 64,37 %. Na obr. 2 a 3 uvádzame názorné ukážky pozorovaných objemových zmien v nide AVM 1 rok po ožiarení. Potvrdili sme štatisticky významnú závislosť percenta obliterácie od použitej terapeutickej dávky žiarenia (p=0,031). Takúto štatisticky významnú závislosť percenta obliterácie sme nepotvrdili v súvislosti s iniciálnou veľkosťou nidu.
Obr. 2. Porovnanie objemových zmien nidu AVM s ročným časovým odstupom po ožiarení u vybraného pacienta. Október 2004 (obrázky vľavo), 3D TOF, objem 3,2 cm<sup>3</sup>; október 2005 (obrázky vpravo), 3D TOF, objem 1,6 cm<sup>3</sup>. 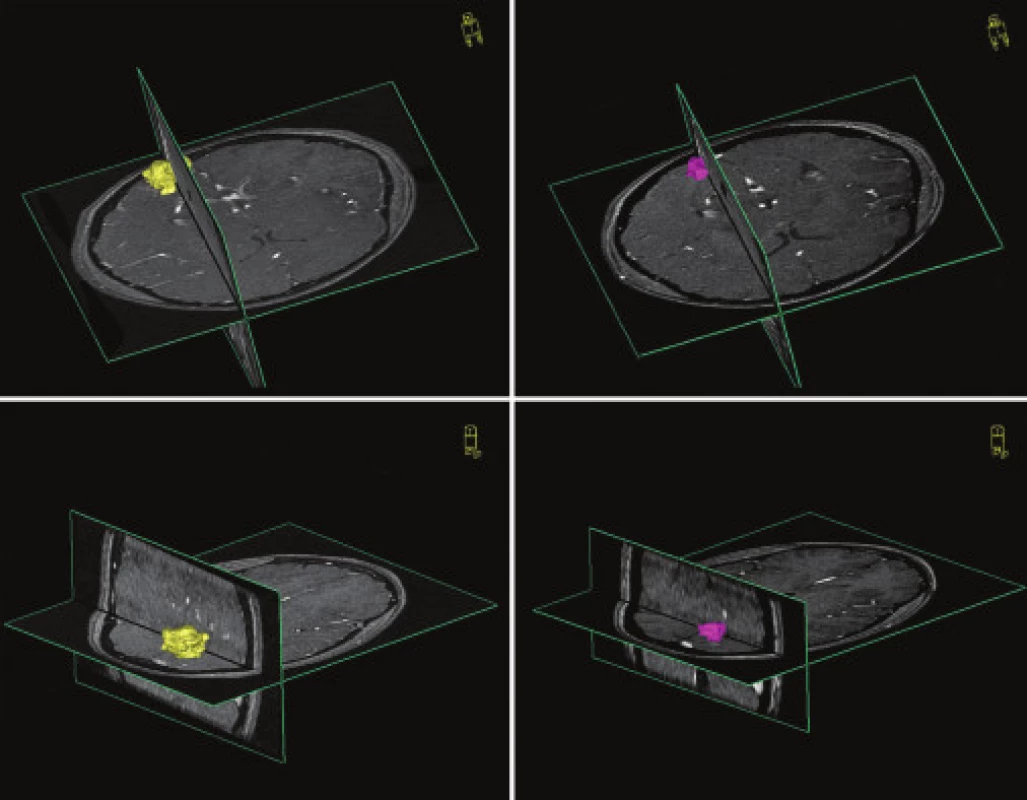
Obr. 3. Grafické znázornenie objemových zmien v súbore sledovaných pacientov. 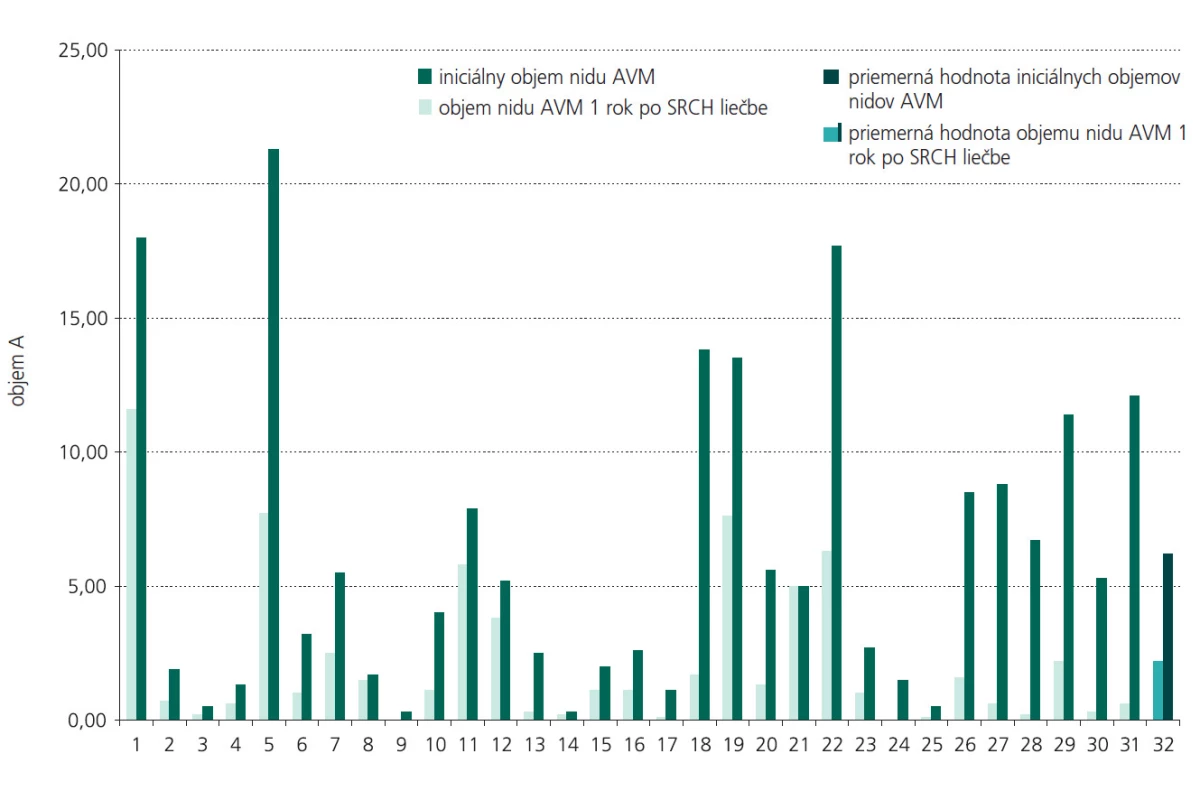
Záver
3D volumetrická štúdia na podklade digitálnej informácie z MRA umožňuje veľmi presne posudzovať dynamiku aj najjemnejších objemových zmien nastávajúcich po rádiochirurgickom ožiarení. 3D volumetrická štúdia sa javí ako vhodná metóda na sledovanie účinkov SRCH liečby AVM. MRA je neinvazívna metóda dovoľujúca detailne zobraziť cievy v 3D obraze s vysokým priestorovým rozlíšením, ktorá nezaťažuje pacienta a nebýva sprevádzaná možnými komplikáciami. Pomocou 3D volumetrickej štúdie sme odhalili priemerne 64% obliteráciu nidu AVM už 1 rok po rádiochirurgickom zákroku. Percento obliterácie závisí od použitej terapeutickej dávky žiarenia. Získané informácie majú význam z hľadiska prognózy a pre ďalší manažment pacientov.
Diskusia
DSA disponuje významnou priestorovou ako aj časovou rezolúciou. Je to však metóda invazívna, pri ktorej je nutné pacientovi podať jódovú kontrastnú látku a navyše aplikovať isté množstvo radiačnej záťaže. Približne v 0,1–1 % je sprevádzaná závažnými komplikáciami. Osobitná katetrizácia každej prívodnej cievy vyžaduje predĺženie času expozície radiácii. Pri klasickom angiografickom zobrazovaní ide o priemet priestorovej štruktúry do roviny fotografickej platne. Pri odhade veľkosti a objemu cieľovej lézie môže dôjsť k niektorým chybám. Podhodnotenie objemu nidu nastane, ak dlhá os nidu nie je paralelná k anteroposteriórnej alebo laterolaterálnej rovine zobrazenia. Keďže každá projekcia je stlačením priestoru do roviny, zaznamená sa najväčší obrys v danom priemete. Takto môže dôjsť k nadhodnoteniu objemu nidu. K chybe môže dôjsť aj v identifikácii vlastného nidu, pretože priemetom do roviny dochádza k superpozícii vaskulárnych komponentov, ktoré nepatria do nidu [11].
Podľa našich skúseností je nespornou výhodou MRA jej neinvazivita a relatívne vysoká presnosť, ak vezmeme do úvahy fakt, že priestorové rozlíšenie je u AVM väčších ako 3cm zhodné s DSA [12]. Ide o 3D zobrazenie, preto odpadajú problémy výpočtu objemu, aké sa vyskytujú pri klasickej angiografii. Navyše MRA pacienta radiačne nezaťažuje. Nevýhodou však stále zostáva nižšie, alebo nulové časové rozlíšenie.
Podľa platných odporúčaní z roku 2003 (International Radiosurgery Association Practice Guidline Initiative) je vhodné pacientov po SRCH výkone sledovať každých 6 mesiacov v prvom roku a potom každých 12 mesiacov do doby 3 rokov po zákroku pomocou MRA. Ak sa zaznamená kompletná obliterácia nidu, odporúča sa realizovať DSA na jej potvrdenie. V prípade, že pretrváva priechodnosť nidu, je potrebné prehodnotiť indikáciu opakovanej rádiochirurgickej event. mikrochirurgickej liečby. Napriek tomu, že bolo publikovaných niekoľko referencií o výrazne oneskorenom účinku rádiochirurgickej liečby aj s odstupom 65 mesiacov, väčšina prác potvrdzuje, že už zmeny na „skorom“ angiograme, (tj. urobenom 6-18 mesiacov po ožiarení) sú v pomerne tesnej korelácii s očakávateľnou úspešnosťou liečby [13].
V súčasnosti ide predovšetkým o snahu nájsť neinvazívnu a pritom rovnako výťažnú metódu sledovania, a tým uchrániť pacienta od nepríjemných procedúr spojených s realizáciou DSA, ktorá sa ale naďalej považuje za referenčnú metódu. Gauvrit referuje o 3D dynamickej MRA, u ktorej uvádza 81% senzitivitu a 100% špecificitu pre detekciu reziduálnej AVM po SRCH výkone. Konštatuje, že je to užitočná technika v asociácii so štandardným MR zobrazením a má byť opakovaná dovtedy, kým pretrváva opacifikácia nidu alebo perzistencia venóznej drenáže [14]. Ďurkovský vo svojej práci uvádza, že konvenčná DSA môže byť nahraditeľná kontrastnou FLASH 3D MRA a 3D TOF MRA aj v plánovaní cieľového objemu pre SRCH liečbu a tiež pre kontrolné vyšetrenia po výkone. Výsledky porovnania angiografických techník priniesli poznatok, že detaily nidu sa javili byť zhodné na DSA angiogramoch a obrazoch z nekontrastnej 3D TOF MRA na matici 512 x 512. Navyše MR vyšetrenie poskytuje aj informáciu o okolitom mozgovom tkanive. Pri použití vyššieho uhla v TOF sekvenciách – okolo 36 st. - ktorý má znázorniť čo najjemnejšie cievy s pomalým prietokom, býva signál z okolitého mozgu rušivý a imituje hematóm. Kontrastná FLASH 3D angiografia sa ukázala byť zbavená tohto nedostatku a určenie objemu nidu podľa tejto metódy sa zhodovalo s objemom z TOF sekvencií. Obe MRA dobre znázorňujú cievnu architektoniku pri stredných a väčších malformáciách. Pri malých pod 3 cm bol problém odlíšiť prívodné tepnové vetvy od patologických ciev tvoriacich nidus. Nedarilo sa určiť ani začiatok venóznej drenáže, ani intranidálne a-v shunty, ktoré boli prekryté ostatnými cievami. Je to spôsobené slabou rozlíšiteľnosťou v čase pri dobrej priestorovej rezolúcii. DSA na rozdiel od MRA techník poskytuje dobrú kvalitu v oboch rozlíšeniach. Stereotaktická MRA je schopná rozlíšiť plniace sa artérie od drénujúcich vén a extranidálnych ciev, ktoré konvenčná DSA zvyčajne zahrnie do nidu. Naďalej má klasická angiografia nezastúpiteľné miesto pre vizualizáciu malých a difúznych AVM, ako aj pre primárnu diagnostiku AVM a pre dôkaz podrobnej angioarchitektoniky a hemodynamických aspektov [12]. V literatúre nachádzame rôzne údaje o dosiahnutom percente obliterácie nidu po SRCH liečbe. V prvom roku sa pohybujú približne od 38 % [15] do 76 % [16], v 2. roku 66 % [17] až 90 % [16]. Mohli by sme teda v súlade s literárnymi údajmi uviesť, že približne 80 % AVM kompletne obliteruje v priebehu 2-3 rokov po rádiochirurgickej liečbe [18,19]. Percento obliterácie AVM po SRCH liečbe LINACom štatisticky významne závisí od aplikovanej terapeutickej dávky žiarenia (signifikantne stúpa pri použití dávky vyššej ako 18 Gy), iniciálnej veľkosti nidu (do 3cm, resp. ako zlomový bod bol určený objem 10 ml) [20] a stupňa Spetzler-Martin grade (I/II versus III-V) [21-23]. Pollock potvrdzuje úlohu štyroch faktorov, ktoré priaznivo ovplyvňujú výsledok SRCH liečby: malý objem nidu, nižší počet drénujúcich vén, nízky vek pacienta, hemisferálna lokalizácia nidu [24]. Difúzna štruktúra nidu ako aj asociovaná neovaskularita sú asociované s nižším percentom úspešnosti SRCH liečby [25]. Pri použití teoretického biomatematického modelu [26], ktorý simuloval arteriovenóznu malformáciu, na skúmanie potenciálnej úlohy intranidálneho hemodynamického urýchlenia toku pri vzniku ruptúry po ožiarení sa zistilo, že incidencia ruptúry je pomerne nízka a je tým menej pravdepodobná, čím viac je vyjadrená radiačne indukovaná fibróza v nide. Ak už ruptúra nastane, možno ju pripísať na účet oklúzie intranidálnych fistúl a plexiformných ciev väčšieho kalibru. To podporuje predpoklad, že sama rádiochirurgická liečba nezvyšuje riziko následnej hemorágie, iba v prípade subtotálneho ožiarenia nidu AVM, resp. ožiarenia nedostatočnými dávkami.
Napriek tomu sa rádiochirurgická liečba ukazuje ako úspešná metóda nielen preto, že smeruje k odstráneniu substrátu možného intrakraniálneho krvácania, ale popisuje sa jej vplyv na odstránenie symptómov, ktorými sa AVM prezentuje. Vykazuje signifikantné zlepšenie klinických prejavov aj predtým, než sa konštatuje samotná obliterácia nidu. V Steinerovej štúdii s 247 pacientmi liečenými pre AVM rádiochirurgicky odoznela bolesť hlavy u 75,5 % pacientov, u 18,6 % sa nevyskytli epileptické záchvaty aj bez pomocnej liečby, 50,8 % pacientov pri liečbe antiepileptikami nemali žiadne záchvaty. Preexistujúci neurologický deficit sa zlepšil alebo úplne upravil u 56,7 % pacientov. Pritom riziko krvácania po ožiarení pretrvávalo až do obliterácie rovnaké, ako je prirodzené ročné riziko neliečenej AVM [27]. Naopak, zvýšené riziko krvácania v prvých 2 rokoch po ožiarení na 4-8 % uvádza vo svojej štúdii Brada [28]. My sme retrospektívne hodnotili u 52 pacientov efekt SRCH na výskyt klinických symptómov 1 rok po liečbe (prezentovaná štúdia je výberom z týchto pacientov). U žiadneho z nich nedošlo ku vzniku intrakraniálnej hemorágie. Epileptické paroxyzmy (parciálne záchvaty so sekundárnou generalizáciou) 1 rok po zákroku vymizli úplne u 49 %, u 11 % nastala ich redukcia.
2 pacienti udávali zhoršenie bolestí hlavy bez korelátu v kontrolnom MR obraze. 5 pacientov malo drobné postradiačné zmeny v zmysle rádionekrózy alebo perifokálneho edému bez klinickej odozvy. 2 pacienti v korelácii so zmenami v MR obraze mali symptomatické prejavy postradiačného poškodenia - vznik ložiskového neurologického deficitu a zvýšenie počtu epileptických záchvatov.
Zoznam použitých skratiek
AVM - arteriovenózna malformácia
CMP - cievna mozgová príhoda
DSA - digitálna subtrakčná angiografia
event. - eventuálne
FLASH - fast low-angle shot
LINAC - lineárny urýchľovač
MR - magnetická rezonancia
MRA - magneticko-rezonančná angiografia
SRCH - stereotaktická rádiochirurgia
resp. - respektíve
TOF - time of flight
3D - trojdimenzionálna
Přijato k recenzi: 6. 12. 2006
Přijato do tisku: 1. 3. 2007
MUDr. Ivana Vachaľová
1. neurologická klinika LF UK a FNsPB
Mickiewiczova 13
Bratislava
e-mail: vachalova@gmail.com
Zdroje
Doppman JL. The nidus concept of spinal cord arteriovenous malformations. A surgical recommendations based upon angiographic observations. Br J Radiol 1971; 44 : 758-763.
2. Kloster R. Subarachnoid hemorrhage in Vestfold country. Occurence and prognosis. Tidsskr Nor Laegeforen 1997; 117 : 1879-1882.
3. Brown RD, Wiebers DO, Forbes G, O´Fallon WM, Piepgras DG, Marsh WR et al. The natural history of unruptured intracranial arteriovenous malformations. J Neurosurg 1988; 68 : 352-357.
4. Wilkins RH. Natural history of intracranial vascular malfomations: a review. Neurosurgery 1985; 16(3): 421-430.
5. Graf CJ, Perret GE, Torner JC. Bleeding from cerebral arteriovenous malformations as part of their natural history. J Neurosurg 1983; 58 : 331-337.
6. Fults D, Kelly DL. Natural history of arteriovenous malformations of the brain: a clinical study. Neurosurgery 1984; 15 : 658-662.
7. Forster DM, Steiner L, Hakanson S. Arteriovenous malformations of the brain: a long term clinical study. J Neurosurg 1972; 37 : 562-570.
8. Crawford PM, West CR, Chadwick DW, Shaw MD. Arteriovenous malformations of the brain: the natural history in unoperated patients. J Neurol Neurosurg Psychiatry 1986; 49 : 1-10.
9. Ondra SL, Troupp H, George ED, Schwab K. The natural history of symptomatic arteriovenous malformations of the brain: a 24 year follow up assessment. J Neurosurg 1990; 73 : 387-391.
10. Schneider BF, Eberhard DA, Steiner LE. Histopathology of arteriovenous malformations after gamma knife radiosurgery. J Neurosurg 1997; 187 : 352-357.
11. Spiegelmann R, Friedman WA, Bova FJ. Limitations of angiografic target localization in planning radiosurgical treatment. Neurosurgery 1992; 30 : 619-624.
12. Ďurkovský A. MR angiografia pri stereotaktickej rádiochirurgii AV malformácií mozgu a pre kontrolu jej liečebných účinkov (Dizertačná práca). Bratislava: Trnavská univerzita 2005.
13. Oppenheim C, Meder JF, Trystram D, Nataf F, Godn-Hardy S, Blustajn J et al. Radiosurgery of cerebral arteriovenous malformations: Is an early angiogram needed? American Journal of Neuroradiology 1999; 20 : 475-481.
14. Gauvrit JY, Oppenheim C, Nataf F, Naggara O, Trystram D, Munier T et al. Three-dimensional dynamic magnetic resonance angiography for the evaluation of radiosurgically treated cerebral arteriovenous malformations. Eur Radiol 2005a; 10 : 1007 - 1011.
15. Souhami L, Olivier A, Podgorsak EB, Pla M, Pike GB. Radiosurgery of cerebral arteriovenous malformations with the dynamic stereotactic irradiation. Int J Radiat Oncol Biol Phys 1990; 19 : 775-782.
16. Colombo F, Benedetti A, Pozza F, Marchetti Ch, Chierego G. Linear Accelerator Radiosurgery of Cerebral Arteriovenous Malformations. Neurosurgery 1989; 24 : 833-840.
17. Betti OO, Munari C, Rosler R. Stereotactic radiosurgery with the linear accelerator: treatment of arteriovenous malformations. Neurosurgery 1989; 24 : 311-321.
18. Pica A, Ayzac L, Sentenac I, Rocher FP, Pelissou-Guyotat I, Emery JC et al. Stereotactic radiosurgery for arteriovenous malformations of the brain using a standard linear accelerator: the Lyon experience. Radiotherapy and Oncology 1996; 40 : 51-54.
19. Friedman WA, Bova FJ. Linear accelerator radiosurgery for arteriovenous malformations. J Neurosurg 1992; 77 : 832-841.
20. Friedman WA, Bova FJ, Mendenhall WM. Linear accelerator radiosurgery for arteriovenous malformations: the relationship of size to outcome. J Neurosurg 1995; 82 : 180-189.
21. Zabel A, Milker-Zabel S, Huber P, Schiltz-Ertner D, Schlegel W, Debus J. Treatment outcome after linac-based radiosurgery in cerebral arteriovenous malformations: Retrospective analysis of factors affecting obliteration. Radiotherapy and Oncology 2005; 77(1): 105-10.
22. Sirin S, Kondziolka D, Niranjan A, Flickinger JC, Maitz AH, Lundsford LD. Prospective staged volume radiosurgery for large arteriovenous malformations: indications and outcomes in otherwise untreatable patients. Neurosurgery 2006; 58(1): 17-27.
23. Ellis TL, Friedman WA, Bova FJ, Kubilis PS, Buatti JM. Analysis of treatment failure after radiosurgery for arteriovenous malformations. J Neurosurgery 1998; 89 : 104-110.
24. Pollock BE, Flickinger JC, Lundsford LD, Maitz A, Kondziolka D. Factors associated with successful arteriovenous malformation radiosurgery. Neurosurgery 1998; 42(6): 1239-1244.
25. Zipfel GJ, Bradshaw P, Bova FJ, Friedman WA. Do the morfological characteristics of arteriovenous malformations affect the results of radiosurgery? J Neurosurgery 2004; 101(3): 393-401.
26. Massoud TF, Hademenos GJ, De Salles AF, Solberg TD. Experimental Radiosurgery Simulations Using a Theoretical Model of Cerebral Arteriovenous Malformations. Stroke 2000; 31(10): 2466.
27. Steiner L, Lindquist Ch, Adler JR, Torner JC, Alves W, Steiner M. Clinical outcome of radiosurgery for cerebral arteriovenous malformations. J Neurosurg 1992; 77 : 1-8.
28. Brada M, Kitchen N. How effective is radiosurgery for arteriovenous malformations? J Neurol Neurosurg Psychiatry 2000; 68 : 548-549.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2007 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Léčba epileptických syndromů u dětí
- Vliv antiepileptik na homeostázu hormonů štítné žlázy
- Léčebný potenciál lamotriginu v terapii epilepsie v dětství a adolescenci
- Zmeny v aktivite syntázy oxidu dusnatého v mieche po ligácii koreňov cauda equina v experimente
- Komentář ke článkům Vajtr D, Průša R, Kukačka J, Houšťava L, Šámal F, Pachl J, Pažout J. Dynamika vývoje GCS, hladiny NSE a S100b v séru a morfologie expanzní kontuze u pacientů s poraněním hlavy a Lavička P, Pikner R, Kormunda S, Topolčan O , Bosman R, Chytra I, Holubec L, Choc M. Význam stanovení S100B proteinu u pacientů s izolovaným poraněním hlavy.
- Dynamika vývoje GCS, hladiny NSE a S100B v séru a morfologie expanzní kontuze u pacientů s poraněním hlavy
- Význam stanovení S100B proteinu u pacientů s izolovaným poraněním hlavy
- Sledovanie objemových zmien nastávajúcich po stereotaktickej rádiochirurgickej liečbe v nide intrakraniálnych arteriovenóznych malformácií pomocou 3D volumetrickej štúdie na podklade MR-angiografie
- Pulzní radiofrekvenční terapie radikulární bolesti
- Hemimegalencefalie: přehled literatury a zkušenosti s chirurgickou léčbou 5 nemocných dětí
- Diagnostikujeme správně infekci virem West Nile?
- Hodnocení edému terče zrakového nervu
- Transforaminální lumbo-sakrální mezitělová fúze (TLIF) s instrumentací: prospektivní studie s minimálně 20měsíčním sledováním
- Měření tkáňového kyslíku v mozku jako součást multimodálního monitorování: kazuistiky
- „Inverzní“ syndrom Fostera-Kennedyho u nitrolebního meningeomu: kazuistika
- Jsou některé kontraindikace lumbální punkce dnes již obsoletní? Kazuistika
- Neobvyklá oboustranná atrofie endotelu rohovky a zrakového nervu po pravděpodobné intoxikaci insekticidem lambda-cyhalotrinem (Karate 5 CS) u 58letého vinaře: kazuistika
- Kombinovaná mikrochirurgická a endovaskulární terapie intramedulárního hemangioblastomu: kazuistika
- Epidurální hematom a impresivní fraktura lebky v důsledku bodového uchycení hlavy: zpráva o neobvyklé komplikaci: kazuistika
- Doporučené postupy pro léčbu Alzheimerovy nemoci a dalších onemocnění spojených s demencí
- Černý R, Machala L. Neurologické komplikace HIV/AIDS. Praha: Karolinum 2007. 303 stran. ISBN 978-80-246-1222-5.
- Webové okénko
- DOPORUČENÍ ČESKÉ MYELOMOVÉ SKUPINY (CZECH MYELOM GROUP - CMG) PRO ZAJIŠTĚNÍ ČASNÉ DIAGNOSTIKY MNOHOČETNÉHO MYELOMU V PODMÍNKÁCH AMBULANTNÍ KLINICKÉ PRAXE
-
Analýza dat v neurologii.
V. Přínos a důsledky transformace dat
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba epileptických syndromů u dětí
- Hodnocení edému terče zrakového nervu
- Jsou některé kontraindikace lumbální punkce dnes již obsoletní? Kazuistika
- Transforaminální lumbo-sakrální mezitělová fúze (TLIF) s instrumentací: prospektivní studie s minimálně 20měsíčním sledováním
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



