-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Azathioprin v terapii idiopatických střevních zánětů u dětí – díl I: indikace, dávkování a nežádoucí účinky léčby thiopuriny
Azathioprine in the therapy of paediatric inflammatory bowel disease – part I: treatment indications, dosing and thiopurine-related adverse events
Background: Thiopurines (in Europe mainly azathioprine) are widely used in the treatment of inflammatory bowel diseases in children. Due to a prolonged time until the onset of therapeutic effect, those drugs are aimed to be used in the maintenance phase of the therapy rather than for induction of remission. Thiopurines are sometimes used in combination therapy (with aminosalicylates or biological treatment agents). The adverse events of these drugs occur as often as in 15–40% cases and may lead to treatment cessation in a significant number of patients. Aims: To overview available information on (mainly) children suffering from inflammatory bowel disease. Conclusion: Genetic examination accompanied with laboratory monitoring of blood count parameters (specifically at the beginning of therapy) and biochemistry can help prevent some of the severe adverse events.
Keywords:
paediatrics – Ulcerative colitis – Crohn’s disease – mercaptopurine – thiopurines
Autoři: Pospíšilová K.; Bronský J.
Působiště autorů: Oddělení dětské gastroenterologie, Pediatrická klinika 2. LF UK v Praze a FN v Motole, Praha
Vyšlo v časopise: Gastroent Hepatol 2021; 75(6): 500-507
Kategorie: Dětská gastroenterologie a hepatologie: přehledová práce
doi: https://doi.org/10.48095/ccgh2021500Souhrn
Východiska: Thiopuriny (v Evropě pak především azathioprin) patří mezi nejčastěji užívaná léčiva v terapii idiopatických střevních zánětů u dětí. Vzhledem k relativně dlouhotrvajícímu nástupu účinku jsou tyto léky nevhodné pro indukci remise, ale užívají se spíše v udržovací fázi terapie. V některých případech jsou pak thiopurinová léčiva užívána v kombinaci s jinou terapií (s aminosalicyláty či přípravky biologické léčby). Nežádoucí účinky thiopurinů se mohou vyskytovat u 15–40 % pacientů a v nezanedbatelném procentu případů pak vedou k nutnosti léčbu přerušit. Cíle: Zpřehlednit dostupné informace o terapii a možnosti její optimalizace u (především) dětských pacientů s idiopatickými střevními záněty. Závěr: Genetické vyšetření a pečlivá pravidelná monitorace krevního obrazu a biochemických parametrů (především v počátku terapie) mohou pomoci části z vážnějších nežádoucích účinků předcházet.
Klíčová slova:
pediatrie – ulcerózní kolitida – Crohnova choroba – merkaptopurin – thiopuriny
Thiopuriny v terapii idiopatických střevních zánětů
Azathioprin (AZA) a jeho metabolit 6-merkaptopurin (6-MP) patří mezi nejčastěji užívaná imunosupresiva pro „udržení“ remise – tzv. udržovací léčbu – idiopatických střevních zánětů (IBD), tedy Crohnovy choroby (CD) i ulcerózní kolitidy (UC).
Thiopuriny v terapii CD u dospělých pacientů
Dle metaanalýzy randomizovaných placebem kontrolovaných studií z roku 2009 zabývajících se efektem azathioprinu (AZA) a 6-merkaptopurinu (6-MP) v léčbě Crohnovy choroby (CD) vykazují v případě udržení remise CD u dospělých pacientů oba thiopuriny pozitivního efektu (nižší procento relapsů ve srovnání s placebem). Pokud byl AZA podáván ve vyšších dávkách kolem 2,5 mg/kg/den, byla léčba účinnější než u dávek nižších (1,0 a 2,0 mg/kg/den) [1]. Navíc bylo vypozorováno, že léčba thiopuriny snižuje riziko chirurgického zásahu [2–4]. Časná terapie (zahájení léčby thiopuriny do 1–3 let od diagnózy, ještě lépe do 6 měsíců) vykazuje dle některých studií v tomto směru lepší účinek. Jiné však podobný efekt neprokázaly [5–7]. Dlouhodobě AZA snižuje potřebu systémových kortikosteroidů [8].
Thiopuriny v terapii CD u dětí
Pozitivní efekt 6-MP na udržení remise byl prokázán i v randomizované studii, která se zaměřila na dětské pacienty s CD [9]. Další studie zaměřené na účinnost thiopurinů u dětí (observační, retrospektivní) tento efekt podporují, jejich výsledky však nejsou tak optimistické. Kromě prodloužení remise byla popsána nižší potřeba kortikoterapie (tj. systémové kortikosteroidy podávané kratší dobu, v nižších dávkách, event. vůbec) a méně hospitalizací u pacientů léčených AZA [10–12].
Thiopuriny v terapii UC u dospělých pacientů
Podobně i v případě UC v udržení remise prokázala metaanalýza lepší efekt AZA v prevenci relapsu UC ve srovnání s placebem [13]. I v tomto případě snižují thiopuriny nutnost hospitalizace (dny hospitalizace přepočteny na pacienta a rok) či podávání systémových kortikosteroidů [14].
Thiopuriny v terapii UC u dětí
Účinek terapie v udržení remise choroby i snížení spotřeby kortikosteroidů podporují i studie zaměřené na pediatrickou populaci [10,15–17]. Dle prospektivní multicentrické kohortové studie z roku 2011 zůstane v remisi onemocnění 1 rok od nasazení terapie thiopuriny bez nutnosti konkomitantní kortikosteroidní terapie přibližně 50 % dětských pacientů s UC. Tento efekt byl pozorován nezávisle na tom, zda terapie thiopuriny byla zahájena do 3 měsíců od diagnózy [17].
Dle evropských i českých doporučení je možno AZA nebo 6-MP zvolit jako udržovací léčbu CD i UC. Efekt thiopurinů v indukci remise IBD je neprůkazný [18], proto není monoterapie AZA/6-MP ve snaze o indukci remise (na rozdíl od udržovací fáze) doporučována [19–23].
Indikace terapie
Thiopurinové preparáty jsou všeobecně doporučovány jako jedna z možností udržovací terapie u dětí trpících IBD. Efekt terapie nenastoupí ihned, účinnost léku je možné posuzovat až po několika týdnech podávání [19–23]. AZA a 6-MP jsou brány jako rovnocenné a prvotní volba závisí především na ošetřujícím lékaři, přesto však existují geografické rozdíly v preferenci jednoho nebo druhého. V Evropě je v terapii IBD preferován spíše AZA, zatímco v USA dávají lékaři přednost 6-MP [24].
Crohnova choroba
U všech pacientů, u nichž byla diagnostikována středně těžká až těžká forma CD ve věku < 17 let, by měla být zahájena terapie thiopuriny. Totéž platí pro pacienty, u nichž bylo remise onemocnění dosaženo systémovými kortikosteroidy nebo choroba alespoň jednou relabovala. Vzhledem k tomu, že lze efekt terapie očekávat až s odstupem několika týdnů, je ve většině případů léčba AZA/6-MP zahajována již v době stanovení diagnózy, a podávána tak v kombinaci s indukční terapií (výlučná enterální výživa, systémově podávané kortikosteroidy, event. biologická terapie) [19,20].
Ulcerózní kolitida
Primárním udržovacím lékem u mírnějších forem UC je 5-aminosalicylová kyselina (5-ASA). V případě na kortikosteroidech dependentní formy onemocnění (relaps při snižování dávky kortikosteroidů nebo do 3 měsíců od jejich vysazení) nebo pokud tito pacienti často relabují (alespoň 2–3 relapsy ve 12 měsících) i přes plně dávkované aminosalicyláty, je vhodné přidat do terapie imunosupresivum – obvykle thiopurinový preparát. Imunosupresivní terapie by měla být zahájena také u pacientů s extraintestinálními projevy choroby. Často je terapie dlouhodobě kombinována s 5-ASA, v některých případech i s biologickou léčbou [20,22,25].
Optimalizace dávkování a role TPMT
Vzhledem k tomu, že je AZA přeměněn na 6-MP pouze z 88 % a molekulární hmotnost 6-MP odpovídá pouze 55 % molekulární hmotnosti AZA, liší se dávkování 6-MP a AZA [26]. Doporučené standardní dávkování AZA je 2,0–2,5 mg/kg/den, většinou podáváno v jedné denní dávce, v případě 6-MP pak 1,0–1,5 mg/kg/den, taktéž jednou denně [19–22,25]. Zdá se však, že u dětí mladších 6 let jsou jako terapeutické nutné dávky vyšší (v některých případech i ekvivalent > 3 mg/kg AZA), než jaké jsou doporučovány v případě dětí starších [28,29]. Oproti tomu byl u dospělých pacientů popsán v případě udržení remise UC dostatečný terapeutický efekt dávek < 1,5 mg/kg/den AZA [30].
Důležitou roli v metabolizmu thiopurinů hraje thiopurinmetyltransferáza (TPMT), při jejíž snížené aktivitě dochází ke snížené přeměně AZA na vedlejší produkty (a tedy ke zvýšené produkci aktivních metabolitů) a ke zdánlivému předávkování léčivem (včetně zvýšeného výskytu na dávce závislých nežádoucích účinků). Aktivitu TPMT lze v podmínkách České republiky predikovat cíleným genetickým vyšetřením zaměřeným na detekci nejčastějších mutací v genu kódujícím tento enzym. Dané vyšetření je plně indikováno u všech pacientů před zahájením terapie AZA [19,20,25]. Přestože existuje úzká korelace mezi fenotypem a genotypem [27,31], nemusí genotypizace odhalit všechny rizikové pacienty ze skupiny intermediárních metabolizátorů, zčásti proto, že rutinní vyšetření neodhalí nové a méně časté mutace, zčásti z dosud neobjasněných důvodů. Přesto si však genetické vyšetření (obzvlášť jsou-li vyšetřeny všechny dosud známé mutace) zachovává velmi vysokou senzitivitu (90 %) a ještě vyšší specificitu (až 99 %) [32]. Stanovení fenotypu enzymu (stanovení aktivity biochemickými metodami) by mělo být, pokud je dostupné, nadřazeno genotypizaci [19,33]. Až 3 měsíce před tímto vyšetřením však nesmí být pacientovi podána transfuze erytrocytů [19]. Rutinní fenotypizace není na rozdíl od genetického vyšetření v naší zemi dostupná.
Dominantní homozygoté v genu pro TPMT jsou považováni za „normometylátory“, někdy též nepřesně nazývanými „rychlí“ metabolizátoři, dávkování AZA u nich odpovídá obecným doporučením. Heterozygoté („hypometylátoři“) mají pouze jednu aktivní alelu kódující daný enzym, mohou užívat AZA v redukované dávce, která odpovídá 30–50 % doporučené. Recesivním homozygotům (pomalým metabolizátorům), kteří tvoří pouze 0,3 % populace, AZA zpravidla nepodáváme (výjimečně lze léčivo podat ve výrazně redukované dávce – 10 % doporučené) [20,22,25]. Blíže se problematice polymorfizmu v genu pro TPMT budeme věnovat v druhé části tohoto článku.
V praxi by dle doporučení pro pediatrickou populaci měl být AZA nasazen zpočátku (v případě neznalosti aktivity TPMT) pouze v poloviční dávce (tj. přibližně 1 mg/kg/den). Vzhledem k riziku výskytu nežádoucích účinků v začátcích je důrazně doporučováno pravidelně monitorovat krevní obraz, jaterní testy (ALT, AST) a pankreatické enzymy (alespoň sérovou amylázu). V prvním měsíci je vhodná častější kontrola – v intervalu à 14 dní, poté à 1 měsíc do třetího měsíce od nasazení a dále trvale alespoň jednou za 3 měsíce [19–21,25]. Po obdržení výsledků genetického vyšetření, pokud nebyla prokázána mutace TPMT, může být denní dávka léku plně navýšena [20,21]. Jako další možnost se jeví zahájení terapie až po obdržení výsledků vyšetření TPMT.
Efekt léčby AZA/6-MP lze očekávat nejdříve za 2–3 měsíce [23], proto pokud není po 6–9 měsících dosaženo očekávaného efektu, není vhodné v monoterapii pokračovat. V případě dobrého efektu pokračujeme v podávání AZA dlouhodobě [20,22] a rozhodnutí o ukončení léčby lze v pediatrii stále považovat za kontroverzní [25].
Kombinovaná terapie s anti-TNF
Konkomitantní podávání AZA při léčbě infliximabem (IFX) vede k nižší tvorbě protilátek proti infliximabu (anti-IFX), a tím i k výskytu méně infuzních reakcí [34–36]. Přidaná hodnota AZA při léčbě IFX hraje roli především v prvních 6 měsících kombinované léčby [35,37]. Polská studie 99 dětí s CD randomizovala pacienty též po 6 měsících konkomitantní terapie na skupinu pokračují v konkomitantní léčbě a skupinu, u níž byl AZA vysazen. Po půl roce sledování bylo procento relapsů srovnatelné [38]. Ve srovnání s evropskou praxí jsou thiopuriny v kombinaci s IFX v terapii pediatrických pacientů s IBD v USA výrazněji méně rozšířeny [39]. Nejen z těchto důvodů pak i některá evropská doporučení považují zvážení vysazení AZA po 6 měsících konkomitantní terapie u pacientů v remisi CD (především u adolescentních chlapců vzhledem k riziku vzniku hepatosplenického T-buněčného lymfomu) za opodstatněné [19,25,35,40]. Pokud došlo ke ztrátě odpovědi na léčbu IFX (v monoterapii) z důvodu vytvoření anti-IFX, bylo popsáno několik případů, u nichž opětovné nasazení imunosupresiva (např. AZA) vedlo k obnovení odpovědi na léčbu doprovázené poklesem vytvořených protilátek [41].
Podobně jako v případě IFX může přidání imunosupresiva do terapie vést k reverzní sérokonverzi – tedy eliminaci protilátek proti ADA (anti-ADA) – až v téměř 50 % případů (retrospektivní studie na 23 dospělých pacientech) [42]. Retrospektivní studie 207 dospělých pacientů s CD však neprokázala rozdíl v dosažení remise mezi pacienty léčenými adalimumabem (ADA) v monoterapii a v kombinaci s AZA (82 vs. 85 %) [43]. Ani prospektivní randomizovaná studie z roku 2016 zabývající se CD u dospělých pacientů (n = 176) neprokázala přidanou hodnotu konkomitantní terapie v prvním půl roce léčby (78,1 vs. 68,1 % pacientů v remisi) [44].
Přídavný efekt imunosupresiva (včetně thiopurinových léčiv) nebyl prokázán ani při terapii (v pediatrii zatím omezeně dostupným) vedolizumabem – kombinace vs. monoterapie [45–47].
Nežádoucí účinky
Jedním z omezení léčby AZA/6-MP jsou její nežádoucí účinky (NÚ), které se u dospělých pacientů s IBD vyskytují v 15–40 %. V 5–28 % všech léčených pacientů vedou NÚ ke snížení dávky podávaného léčiva a v 11–31 % je nutné léčbu úplně přerušit [1,5,27,48–53]. U pediatrické populace se NÚ thiopurinů obecně vyskytují s nižší četností, než je tomu u dospělých pacientů (přibližně v 15 %), studií zabývajících se problematikou u dětí je však nepoměrně méně [27,54]. NÚ thiopurinových léčiv lze rozdělit na závislé na dávce (myelotoxicita, hepatotoxicita) a idiosynkratické – nezávislé na dávce (alergické kožní reakce, nauzea, únavnost, nechutenství, pankreatitida). Zatímco idiosynkratické NÚ se většinou objeví v prvních týdnech od zahájení terapie, a pokud je lék dobře tolerován po 3 týdnech léčby, obvykle se předpokládá jeho dlouhodobá tolerance, NÚ závislé na dávce se mohou objevit i po měsících až letech užívání léku [19–21,55].
Posoudit výskyt závažné leukopenie (myelotoxicity) na léčbě thiopuriny je obtížné, neboť rozdílné studie užívají rozdílných cut-off hodnot a i délka sledování pacientů se liší [52], většinou je však udávána četnost kolem 3–15 % [5,19,20,48,49,53,55]; výskytu u dětí pak odpovídá spíše dolní hranice daného rozmezí (tj. okolo 3 %) [54]. Lymfopenii a potažmo též mírnější leukopenii lze do určité míry považovat za chtěný účinek léčby. Oproti tomu neutropenii lze za NÚ na dávce závislý považovat. Neutropenie postihne přibližně 2–3 % pacientů [48,51,56], dostupná data však nelze považovat za dostačující, protože studie většinou posuzují neutropenii a leukopenii společně. Trombocytopenie se objeví u 2–3 % pacientů [48,52,53]. Výsledný krevní obraz ovlivňuje kromě léčby také aktivita onemocnění a další faktory – především konkomitantní virové infekce [57]. Ve většině případů se počet bílých krvinek, neutrofilů, trombocytů i lymfocytů upraví spontánně bez nutnosti zásahu, po snížení dávky či úplném vyřazení léku [51]. Byl však popsán i případ, kdy trombocytopenie přetrvávala po dobu 2 let i přes ukončení terapie AZA [53]. Přibližně v 1/4 případů je pak leukopenie asociována se sníženou aktivitou enzymu podílejícím se na thiopurinovém metabolizmu – TPMT [55,58]. Těžkou myelosupresí jsou nejvíce ohroženi recesivní homozygoté, u nichž je možné, v případě jejich včasné identifikace, ohrožující AZA indukované cytopenii předcházet [59,60]. U heterozygotů se případná cytopenie rozvine v průměru dříve (v prvním trimestru od zahájení terapie) než u dominantních homozygotů (měsíce až roky) [61]. V případě dostatečné aktivity TPMT je vhodné zvážit probíhající infekci jako možnou příčinu (tranzientní) leukopenie. Leukopenie je pouze přibližně v 1/4 případů asociována se sníženou funkcí TPMT [62], čehož lze využít v identifikaci velmi rizikových pacientů. Vzhledem ke zbývajícím 3/4 se v predikci výskytu leukopenie však nelze spoléhat pouze na vyšetření aktivity TPMT (ať už genotypu, nebo fenotypu) a je potřeba pacienty pečlivě monitorovat (pravidelné vyšetření krevního obrazu). V případě výrazného poklesu počtu leukocytů (a/nebo trombocytů) je pak dle doporučení vhodné dávku léčiva snížit a/nebo lék úplně vysadit (tab. 1). V první linii, pokud není pokles příliš výrazný, může být tato změna pouze přechodná a po úpravě parametrů krevního obrazu se lze pokusit o opětovné navrácení léku do terapie v plné dávce, samozřejmě za pečlivé kontroly pacienta [22,25].
Tab. 1. Doporučená úprava terapie AZA při cytopenii.
Tab. 1. Recommended AZA dose in case of cytopenia.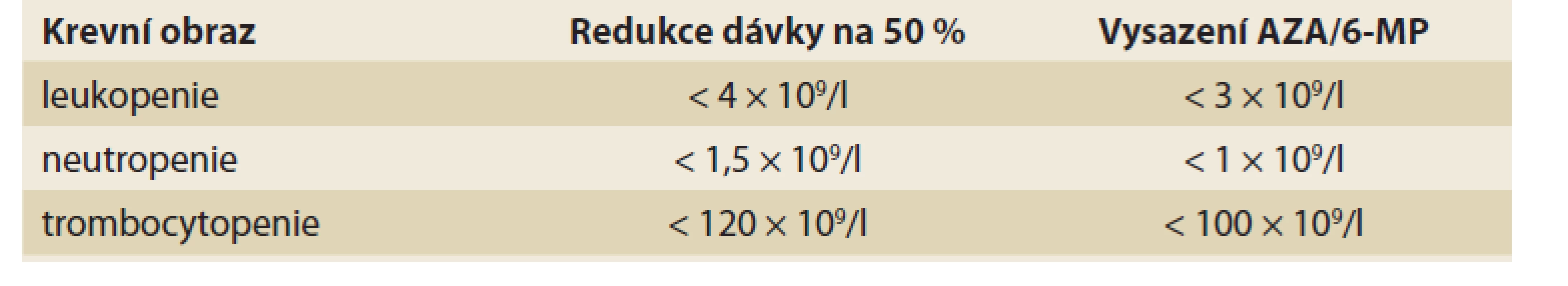
Zvýšené hodnoty transamináz pozorované u 2–17 % dospělých pacientů léčených thiopuriny vždy neznačí těžké jaterní poškození [5,48,49,51,53]. Výsledná četnost tohoto NÚ opět závisí na cut-off hodnotách užitých v jednotlivých studiích i délce sledování pacienta. V naprosté většině případů se v horizontu nanejvýš několika týdnů vrátí hodnoty transamináz do normálních rozmezí spontánně, bez nutnosti změny terapie, po snížení dávky nebo přerušení/ukončení léčby thiopuriny [48,50,61]. V případě zaznamenání laboratorní elevace transamináz je možné (pokud se nejedná o příliš výrazný vzestup) se pokusit nějakou dobu vyčkat na stávající dávce či snížit dávku léčiva o 25–50 %, podmínkou je pravidelná laboratorní monitorace pacienta à 1 týden do normalizace hodnot [48,50]. Případně je možné se pokusit o změnu thiopurinového preparátu – dle studie z roku 2013 až 80 % pacientů s projevy hepatotoxicity při léčbě AZA dobře toleruje 6-MP [63]. Pokud však laboratorní nález přetrvává či jsou jaterní funkce výrazněji alterovány, je vhodné pátrat po jiné příčině. V této souvislosti je vhodné pomýšlet i na nodulární regenerativní hyperplazii (NRH). Přestože se zvýšené riziko vzniku NRH pojí především s léčbou 6-thioguaninem (6-TG) – dalším z thiopurinů, který je z tohoto důvodu v terapii IBD spíše opomíjen – bylo u dospělých pacientů popsáno několik případů NRH asociovaných s AZA [64,65].
Akutní pankreatitidu řadíme mezi NÚ na dávce nezávislé a považujeme ji za reakci hypersenzitivity [19]. V dospělé populaci i u dětí se vyskytuje přibližně u 2–7 % pacientů [48,49,53,54,57,66] ve většině případů v 1. měsíci léčby [27,67] a je častější u kuřáků [52]. Pouhá elevace pankreatických enzymů bez diagnózy pankreatitidy (nesplňující diagnostická kritéria) se vyskytuje mnohem častěji – u dospělých až v 16 % [49,53]. Mezi Asiaty je zánět slinivky břišní jako NÚ terapie thiopuriny spíše vzácný [68]. Akutní pankreatitida se u pacientů s CD vyskytuje častěji než u pacientů léčených thiopuriny z jiné indikace [67], velmi pravděpodobně za určitou část onemocnění slinivky břišní je u těchto pacientů zodpovědná CD sama o sobě (duodenální postižení nebo extraintestinální manifestace), případně konkomitantní terapie (např. aminosalyciláty nebo výlučná enterální výživa) [19,69]. Jako rizikové pro vznik AZA indukované pankreatitidy byly recentně popsány genotypy HLA-DQA1*02 : 01-HLA-DRB1*07 : 01 v heterozygotní A/C a homozygotní C/C formě [70]. Akutní zánět slinivky indukovaný thiopuriny je ve většině případů pouze mírný a rychle ustoupí po vysazení terapie [69]. Pokud se u pacienta vyskytne AZA indukovaná pankreatitida, je tedy vhodné tento lék okamžitě vysadit, v tomto případě však není po ústupu symp - tomů většinou doporučováno pokoušet se o opětovné navrácení thiopurinů do terapie, tedy ani 6-MP [19,22,25,71]. Bylo však publikováno několik případů, kdy taková změna terapie byla úspěšná, zánět slinivky se u pacientů po zahájení léčby 6-MP znovu neobjevil a pacienti dále lék dobře tolerovali [72,73]
Gastrointestinální intolerance (prů - jem, zvracení, bolesti břicha) se projeví u 4–10 % léčených dospělých [5,48,49, 56,57]. Vzhledem k tomu, že pacienti s těmito projevy na terapii AZA ve vysokém procentu dobře tolerují 6-MP, se někteří autoři domnívají, že za část této intolerance i dalších časných idiosynkratických NÚ je zodpovědné imidazolové jádro odštěpené z AZA při přeměně na 6-MP [74]. Takzvané chřipkové příznaky („flu-like“ syndrom – myalgie, artralgie, horečka, nevolnost, bolesti hlavy) se objevují především ve 2.–3. týdnu léčby [20,21] a zakusí je kolem 8–13 % dospělých pacientů, u dětí se objevují přibližně v 7 %. Kterýkoli z těchto symptomů se může projevit osamoceně nebo společně s jiným NÚ [19,22,49,53]. Mezi další možné na dávce nezávislé NÚ patří kožní reakce v podobě rashe, alopecie a alergické reakce [1,51,75].
Gastrointestinální obtíže vymizí rychle po vysazení terapie stejně jako většina ostatních NÚ. V případě idiosynkratických NÚ vzniklých na terapii AZA je možno se pokusit o změnu terapie na 6-MP, která je úspěšná přibližně v 50 %, ačkoli dostupná data se různí. Nejlepších výsledků dosahuje tato změna u myalgií a artralgií, ale i u gastrointestinálních příznaků či „chřipkových“ symptomů může být relativně často úspěšná (kolem 20–30 %). V případech, kdy se změna terapie nezdaří a u pacienta se opět objeví vedlejší účinky, jedná se v 60 % o stejný NÚ, pro který byl AZA vysazen [19,22,27,74,63,71,76]. Dle studie z roku 2004 lze za část NÚ (především flu-like syndromu, pankreatitidy, rashe) podezřívat polymorfizmus v genu kódujícím inosintrifosfatázu, konkrétně 94C>A, a bylo navrženo, aby byl takovým pacientům v případě intolerance AZA/6-MP podáván 6-thioguanin (6-TG) [77]. V jiné studii ale asociace nebyla pozorována [78].
Pacienti léčení thiopuriny mohou být náchylnější k infekcím – častěji virovým, ale objevit se mohou i infekce bakteriální či mykotické. Riziko roste s množstvím podávaných imunosupresivních léků a je vyšší ve skupině starších pacientů [48,79–81]. Infekce bývají většinou pouze mírné – např. u pacientů léčených AZA byl popsán častější výsev herpes simplex (HSV) labialis/genitalis a virových bradavic než u pacientů AZA naivních [82]. Data z registrů shromažďujících informace o dětské (DEVELOP) i dospělé (TREAT) populaci pacientů s CD zvýšené riziko závažných infekčních komplikací u pacientů léčených thiopuriny neprokázala – na rozdíl od skupiny na biologické terapii anti-TNF preparáty nebo jedinců léčených systémovými kortikosteroidy [83,84].
Prevence infekcí je u jedinců užívajících imunosupresivní terapii vhodná [85]. Před zahájením terapie thiopuriny je vhodné zkontrolovat a eventuálně doplnit povinná očkování, pokud to klinický stav při základním onemocnění dovolí. Očkování živou vakcínou (především očkovací látky proti spalničkám, zarděnkám, příušnicím, planým neštovicím, případně tuberkulóze – BCG) je možné s odstupem 6 týdnů před zahájením imunosupresivní léčby nebo alespoň 3 měsíce po jejím ukončení. Na druhou stranu odklad léčby, která je nezbytně nutná pro kontrolu onemocnění, z důvodů doplnění vakcinace není považován za vhodný. Aktivní imunizace neživými vakcínami (včetně očkování proti lidskému papilomaviru – HPV) není kontraindikována, naopak se spíše doporučuje, přestože její účinnost může být snížena [20–22,80,86].
U varicella zoster virus (VZV) naivních, neimunizovaných, imunosupresivy léčených pacientů je v případě kontaktu s varicellou k dispozici pasivní imunizace, v případě propuknutí planých neštovic je indikována časná antivirová terapie. V případě opakovaných lokálních výsevů herpes simplex virus (HSV) labialis/genitalis je vhodné zvážit perorální antivirotickou terapii v době aktivního výsevu. V případě těžkého onemocnění je vhodné okamžitě zahájit antivirotickou terapii a imunosupresiva dočasně vysadit – podobně je tomu také v případě těžší formy infekční mononukleózy. Je vhodné zvážit očkování proti pneumokokovým onemocněním a chřipce [21,22,80].
Thiopurinová terapie zvyšuje riziko rozvoje lymfomu u pacientů s IBD přibližně 4–5krát. Ohrožena je především starší populace, v mladším věku je riziko lymfomu nižší – v dětské populaci přibližně 4,5 případů/10 tisíc paciento-roků léčby. Riziko narůstá s délkou léčby a klesá po jejím ukončení [87–92]. Vzácnou formu neléčitelného lymfomu představuje u pacientů s IBD léčených imunosupresivy hepatosplenický T-buněčný lymfom (HSTCL). V naprosté většině případů byl HSTCL popsán u mužů mladších 35 let, v 50 % dokonce 20 let (byl tedy popsán výskyt i v pediatrické populaci). V polovině případů je jeho výskyt asociován s kombinovanou terapií biologické léčby a thiopurinu, v druhé (téměř) polovině pak s AZA/6-MP v monoterapii. Pouze ojediněle je pak HSCTL asociován pouze s preparáty z řad biologické léčby [92–94]. Do skupiny lymfomů vzniklých na thiopurinové léčbě patří i vzácně se vyskytující s virem Ebsteina a Barrové (EBV) asociovaný lymfom, jehož riziko výskytu thiopuriny mírně zvyšují [95]. Mezi mladšími jedinci (včetně pediatrické populace) převyšuje pozitivní vliv terapie na udržení remise i na celkovou kvalitu života pacienta zvýšené riziko rozvoje lymfomu [88,89,96]. Nadto thiopuriny působí protektivně proti rozvoji kolorektálního karcinomu u pacientů s CD i UC – snižují riziko výskytu, které je u pacientů s IBD zvýšené [97].
Ve skupině pacientů, kteří jsou nebo v minulosti byli léčeni thiopurinovými preparáty, stoupá riziko výskytu nádorových onemocnění kůže nemelanomového typu – karcinomů (bazaliomu a dlaždicobuněčného karcinomu). Riziko je zvýšené i mezi jedinci mladšími 50 let [3,98,99]. Všichni pacienti, kteří byli někdy léčeni thiopuriny, by měli být celoživotně sledováni dermatologem a svou kůži dostatečně chránit proti UV záření [3,19,25].
Závěr
Azathioprin (AZA) stále zastává v udržovací terapii dětských pacientů s IBD své pevné místo. Stanovením aktivity TPMT před zahájením léčby a pečlivou pravidelnou monitorací pacientů lze předcházet mnohým z jeho nežádoucích účinků. V případě na dávce nezávislých nežádoucích účinků pak má význam pokusit se o změnu léčiva i v rámci skupiny (z AZA na 6-MP).
Doplnění terapie o AZA vede při léčbě anti-TNF k nižší tvorbě protilátek proti biologiku. Současný trend se v případě IFX kloní ke konkomitantnímu podávání AZA v prvních měsících terapie, při léčbě ADA se dle dostupných dat jeví současná terapie thiopuriny jako opodstatněná především v případě vytvoření protilátek proti ADA.
ORCID autorů
K. Pospíšilová ORCID 0000-0002-6850-5588,
J. Bronský ORCID 0000-0002-2641-7280.
Doručeno/Submitted: 2. 8. 2021
Přijato/Accepted: 29. 11. 2021
MUDr. Kristýna Pospíšilová
Oddělení dětské gastroenterologie
Pediatrická klinika
2. LF UK v Praze a FN v Motole
V Úvalu 84/1
150 06 Praha 5
Zdroje
1. Prefontaine E, Sutherland LR, MacDonald JK et al. Azathioprine or 6-mercaptopurine for maintenance of remission in Crohn‘s disease. Cochrane Database Syst Rev 2010; 1: CD000067. doi: 10.1002/14651858.CD000067.pub3.
2. Ramadas AV, Gunesh S, Thomas GA et al. Natural history of Crohn‘s disease in a population-based cohort from Cardiff (1986–2003): a study of changes in medical treatement and surgical resection rates. Gut 2010; 59 (9): 1200–1206. doi: 10.1136/gut.2009.202101.
3. Peyrin-Biroulet L, Oussalah A, Williet N et al. Impact of azathioprine and tumour necrosis factor antagonists on the need for surgery in newly diagnosed Crohn‘s disease. Gut 2011; 60 (7): 930–936. doi: 10.1136/gut.2010.227884.
4. Cleynen I, Ganzales JR, Figueroa C et al. Genetic factors conferring an increased susceptibility to develop Crohn‘s disease also influence disease phenotype: results from IBSchip European project. Gut 2013; 62 (11): 1556–1565. doi: 10.1136/gutjnl-2011-300777.
5. Fraser AG, Orchard TR, Jewell DP. The efficacy of azathioprine for the treatement of inflammatory bowel disease: a 30 year review. Gut 2002; 50 (4): 485–489. doi: 10.1136/gut.50.4.485.
6. Cosnes J, Bourier A, Laharie D et al. Early administration of azathioprine vs conventional management of Crohn‘s disease: a randomized controlled trial. Gastroenterol 2013; 145 (4): 758–765. doi: 10.1053/j.gastro.2013.04.048.
7. Panés J, López-Sanromán A, Bermejo A et al. Early azathioprine therapy is no more effective than placebo for newly diagnosed Crohn‘s disease. Gastroenterol 2013; 145 (4): 766–774. doi: 10.1053/j.gastro.2013.06.009.
8. Pearson DC, May GR, Fick GH et al. Azathioprine and 6-mercaptopurine in Crohn disease. Ann Intern Med 1995; 123 (2): 132–142. doi: 10.7326/0003-4819-123-2-199507150-00009.
9. Markowitz J, Grancher K, Kohn N et al. A multicenter trial of 6-mercaptopurine and prednisone in children with newly diagnosed Crohn‘s disease. Gastroenterol 2000; 119 (4): 895–902. doi: 10.1053/gast.2000.18144.
10. Barabino A, Torrente F, Ventura A et al. Azathioprine in paediatric inflammatory bowel disease: an Italian multicentre survey. Aliment Pharmacol Ther 2002; 16 (6): 1125–1130. doi: 10.1046/j.1365-2036.2002.01269.x.
11. Punati J, Markowitz J, Lerer T et al. Effect of early immunomodulator use in moderate to severe pediatric Crohn disease. Inflamm Bowel Dis 2008; 14 (7): 949–954. doi: 10.1002/ibd.20412.
12. Riello L, Talbotec C, Garnier-Lengliné H et al. Tolerance and efficacy of azathioprine in pediatric Crohn‘s disease. Inflamm Bowel Dis 2011; 17 (10): 2138–2143. doi: 10.1002/ibd.21612.
13. Timmer A, Patton PH, Chande N et al. Azathioprine and 6-mercaptopurine for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2016; 2016 (5): CD000478. doi: 10.1002/14651858.CD000478.pub4.
14. Gisbert JP, Nino P, Cara C et al. Comparative effectivenes of azathioprine in Crohn‘s disease and ulcerative colitis: prospective, long-term, follow-up study of 394 patients. Aliment Pharmacol Ther 2008; 28 (2): 228–238. doi: 10.1111/j.1365-2036.2008.03732.x.
15. Verhave M, Winter HS, Grand RJ. Azathioprinein the treatement of children with inflammatory bowel disease. J Pediatr 1990; 117 (5): 809–814. doi: 10.1016/s0022-3476 (05) 83349-9.
16. Kader HA, Mascarenhas MR, Piccoli DA et al. Experiences with 6-mercaptopurine and azathioprine therapy in pediatric patients with severe ulcerative colitis. Gastroenterol Nutr 1999; 28 (1): 54–58. doi: 10.1097/00005176-19 9901000-00013.
17. Hyams JS, Lerer T, Mack D et al. Outcome following thiopurine use in children with ulcerative colitis: a prospective multicenter registry study. Am J Gastroenterol 2011; 106 (5): 981–987. doi: 10.1038/ajg.2010.493.
18. Khan N, Dubinsky MC, Ford AC et al. Efficacy of immunosuppresive therapy for inflammatory bowel disease: a systematic review and meta-analysis. Am J Gastroenterol 2011; 106 (4): 630–642. doi: 10.1038/ajg.2011.64.
19. Ruemmelle FM, Veres G, Kolho KL et al. Consensus guidelines of ECCO/ESPHGAN on the medical management of pediatric Crohn‘s disease. J Crohns Colitis 2014; 8 (10): 1179–1207. doi: 10.1016/j.crohns.2014.04.005.
20. Adamcová M, Bajer M, Bajerová K et al. Doporučení Pracovní skupiny dětské gastroenterologie a výživy ČPS pro diagnostiku a léčbu nespecifických střevních zánětů u dětí. Čes-slov Pediat 2012; 67 (Suppl 2): S5–S47.
21. Bronský J, Beránková K, Černá Z et al. Doporučení Pracovní skupiny dětské gastroenterologie a výživy ČPS pro diagnostiku a léčbu nespecifických střevních zánětů u dětí – doplněk k 1. vydání. Gastroent Hepatol 2017; 71 (1): 11–18. doi: 10.14735/amgh201711.
22. Turner D, Levine A, Escher JC et al. Management of pediatric ulcerative colitis: joint ECCO and ESPHGAN evedence-based consensus guidelines. J Pediatr Gastroenterol Nutr 2012; 55 (3): 340–361. doi: 10.1097/MPG.0b013e3182662233.
23. Pozler O, Chládek J, Malý J et al. Steady-state of azathioprine during initiation treatement of pediatric inflammatory bowel disease. J Crohns Colitis 2010; 4 (6): 623–628. doi: 10.1016/j.crohns.2010.06.005.
24. Louis E, Belaiche J. Optimizing treatement with thioguanine derivates in inflammatory bowel disease. Best Pract Res Clin Gastroenterol 2003; 17 (1): 37–46. doi: 10.1053/bega.2002.0346.
25. Turner D, Ruemmele FM, Orlanski-Meyer E et al. Management of paediatric ulcerative colitis, part 1: ambulatory care - an evidence-based guideline from ECCO and ESPGHAN. J Pediatr Gastroenterol Nutr 2018; 67 (2): 257–291. doi: 10.1097/MPG.0000000000002035.
26. Van Os EC, J A McKinney JA, Zins BJ et al. Simultaneous determination of azathioprine and 6-mercaptopurine by high-performance liquid chromatography. J Chromatogr B Biomed Appl 1996; 679 (1–2): 147–154. doi: 10.1016/0378-4347 (96) 00007-2.
27. Hindorf U, Lindqvist M, Hildebrand H et al. Adverse events leading to modification of therapy in a large cohort of patients with inflammatory bowel disease. Aliment Pharmacol Ther 2006; 24 (2): 331–342. doi: 10.1111/j.1365-2036.2006.02977.x.
28. Stocco G, Martelossi S, Arrigo S et al. Multicentric case-control study on azathioprine dose and pharmacokinetics in early-onset pediatric inflammatory bowel disease. Inflamm Bowel Dis 2017; 23 (4): 628–634. doi: 10.1097/MIB.0000000000001051.
29. Grossman AB, Noble AJ, Mamula P et al. Increased dosing requirements for 6-mercaptopurine and azathioprine in inflammatory bowel disease patients six years and younger. Inflamm Bowel Dis 2008; 14 (6): 750–755. doi: 10.1002/ibd.20387.
30. Luan ZJ, Li Y, Zhao XY et al. Treatment efficacy and safety of low-dose azathioprine in chronic active ulcerative colitis patients: a meta-analysis and systemic review. J Dig Dis 2016; 17 (10): 652–659. doi: 10.1111/1751-2980.12386.
31. Ansari A, Hassan C, Duley J et al. Thiopurine methyltransferase activity and the use of azathioprine in inflammatory bowel disease. Aliment Pharmacol Ther 2002; 16 (10): 1743–1750. doi: 10.1046/j.1365-2036.2002.01353.x.
32. Schaeffeler E, Fisher C, Dierk B et al. Comprehensive analysis of thiopurine S-methyltransferase phenotype-genotype correlation in a large population of German-Caucasians and identification of novel TPMT variants. Pharmacogenetics 2004; 14 (7): 407–417. doi: 10.1097/01.fpc.0000114745.08559.db.
33. Winter JW, Gaffney D, Shapiro D et al. Assesment of thiopurine methyltransferase nezyme activity is superior to genotpye in predicting myelosuppresion following azathioprine therapy in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2007; 25 (9): 1069–1077. doi: 10.1111/j.1365-2036.2007.03301.x.
34. Jones J, Kaplan GG, Peyrin-Biroulet L et al. Effects of concomitant immunomodulator therapy on efficacy and safety of anti-tumor necrosis factor therapy for Crohn‘s disease: a meta-analysis of placebo-controlled trials. Clin Gastroenterol Hepatol 2015; 13 (13): 2233–2240. doi: 10.1016/j.cgh.2015.06.034.
35. Colombel JF, Sandborn WJ, Reinisch W et al. Infliximab, azathioprine, or combination therapy for Crohn‘s disease. N Engl J Med 2010; 362 (15): 1383–1395. doi: 10.1056/NEJMoa0904492.
36. Panaccione R, Ghosh S, Middleton S et al. Infliximab, azathioprine or infliximab + azathioprine for treatment of moderate to severe ulcerative colitis. The UC SUCCESS trial. Gastroenterology 2011; 5 (1): S8.
37. Van Assche G, Magdelaine-Beuzelin C, D‘Haens G et al. Withdrawal of immunosuppression in Crohn‘s disease treated with scheduled infliximab maintenance: a randomized trial. Gastroenterology 2008; 134 (7): 1861–1868. doi: 10.1053/j.gastro.2008.03.004.
38. Kierkus J, Iwanczyk B, Wegner A et al. Efficacy infliximab with immunomodulator and infliximab alone of maintenance therapy in children with Crohn‘s disease – multicenter randomized study. J Crohns Colitis 2013; 7 : 220–221.
39. Church PC, Hyams J, Ruemmele F et al. The continental divide anti-TNF use in pediatric IBD is different in North America compared to other parts of the world. Can J Gastroenterol Hepatol 2018; 2018 : 3190548. doi: 10.1155/2018/3190548.
40. Pariente B, Laharie E. Review article: why, when and how to de-escalate therapy in inflammatory bowel diseases. Aliment Pharmacol Ther 2014; 40 (4): 338–353. doi: 10.1111/apt.12838.
41. Ben-Horin S, Waterman M, Kopylov U et al. Addition of an immunomodulator to infliximab therapy eliminates antidrug antibodies in serum and restores clinical response of patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2013; 11 (4): 444–447. doi: 10.1016/j.cgh.2012.10.020.
42. Ungar B, Kopylov U, Engel T et al. Addition of an immunomodulator can reverse antibody formation and loss of response in patients treated with adalimumab. Aliment Pharmacol Ther 2017; 45 (2): 276–282. doi: 10.1111/apt.13862.
43. Reenaers C, Louis E, Belaiche J et al. Does co-treatment with immunosuppressors improve outcome in patients with Crohn‘s disease treated with adalimumab? Aliment Pharmacol Ther 2012; 36 (11–12): 1040–1048. doiI: 10.1111/apt.12076.
44. Matsumoto T, Motoya S, Watanabe K et al. Adalimumab monotherapy and a combination with azathioprine for Crohn’s disease: a prospective randomized trial. J Crohns Colitis 2016; 10 (11): 1259–1266. doi: 10.1093/ecco-jcc/jjw152.
45. Dulai PS, Singh S, Jiang X et al. The real-world effectiveness and safety of vedolizumab for moderate-severe Crohn‘s disease: results from the US VICTORY consortium. Am J Gastroenterol 2016; 111 (8): 1147–1155. doi: 10.1038/ajg.2016.236.
46. Shelton E, Allegretti JR, Stevens B et al. Efficacy of vedolizumab as induction therapy in refractory IBD patients: a multicenter cohort. Inflamm Bowel Dis 2015; 21 (12): 2879–2885. doi: 10.1097/MIB.0000000000000561.
47. Ledder O, Assa A, Levine A et al. Vedolizumab in paediatric inflammatory bowel disease: a retrospective multi-centre experience from the paediatric IBD Porto group of ESPGHAN. J Crohn Colitis 2017; 11 (10): 1230–1237. doi: 10.1093/ecco-jcc/jjx082.
48. Kirschner BS. Safety of azathioprine and 6-mercaptopurine in pediatric patients with inflammatory bowel disease. Gastroenterol 1998; 115 (4): 813–821. doi: 10.1159/000140974.
49. Costantino G, Furfaro F, Belvedere A et al. Thiopurine treatement in inflammatory bowel disease: response predictors, safety, and witchdrawal in follow-up. J Crohns Colitis 2012; 6 (5): 588–596. doi: 10.1016/j.crohns.2011.11.007.
50. Gearry RB, Barclay ML, Burt MJ et al. Thiopurine drug adverse effects in a population of New Zealand patients with inflammatory bowel disease. Pharmacoepidemiol Drug Saf 2004; 13 (8): 563–567. doi: 10.1002/pds.926.
51. Qiu Y, Mao R, Zhang S et al. Safety profile of thiopurines in Crohn disease: analysis of 893 patient-years follow-up in a Southern China cohort. Medicine 2015; 94 (41): e1513. doi: 10.1097/MD.0000000000001513.
52. Lopéz-Martín C, Chaparro M, Espinosa L et al. Adverse events of thiopurine immunomodulators in patients with inflammatory bowel disease. Gastroenterol Hepatol 2011; 34 (6): 385–392. doi: 10.1016/j.gastrohep.2011.03.023.
53. Goldberg R, Irving PM. Toxicity and response to thiopurines in patients with inflammatory bowel disease. Exp Rev Gastroenterol Hepatol 2015; 9 (7): 891–900. doi: 10.1586/17474124.2015.1039987.
54. De Ridder L, Van Dieren JM, Van Deverten HJH et al. Pharmacogenetics of thiopurine therapy in paediatric IBD patients. Aliment Pharmacol Ther 2006; 23 (8): 1137–1141. doi: 10.1111/j.1365-2036.2006.02853.x.
55. Bär F, Sina C, Fellermann K. Thiopurines in inflammatory bowel disease revisited. World J Gastroenterol 2013; 19 (11): 1699–1706. doi: 10.3748/wjg.v19.i11.1699.
56. Kim MJ, Lee SY, Choe YH. Monitoring thiopurine metabolites in korean pediatric patients with inflammatory bowel disease. Yonsei Med J 2014; 55 (5): 1289–1296. doi: 10.3349/ymj.2014.55.5.1289.
57. Schwab M, Schäffeler E, Marx C et al. Azathioprine therapy and adverse drug reactions in patients with inflammatory bowel disease: impact of thiopurine S-methyltransferase polymorphism. Pharmacogenetics 2002; 12 (6): 429–436. doi: 10.1097/00008571-200208000-00003.
58. Colombel JF, Ferrari N, Debuysere H et al. Genotypic analysis of thiopurine S-methyltransferase in patients with Crohn‘s disease and severe myelosuppresion during azathioprine therapy. Gastroenterology 2000; 118 (6): 1025–1030. doi: 10.1016/s0016-5085 (00) 70354-4.
59. Lennard L. TPMT in the treatement of Crohn‘s disease with azathioprine. Gut 2002; 51 (2): 143–146. doi: 10.1136/gut.51.2.143.
60. Leipold G, Schütz E, Haas JP et al. Azathioprine-induced severe pancytopenia due to homozygous two-point mutation of the thiopurine methyltransferase gene in patient with juvenile HLA-B27_asociated spondylarthritis. Artritis Rheum 1997; 40 (10): 1896–1898. doi: 10.1002/art.1780401026.
61. Dubinsky MC, Lamothe S, Ying Yang G et al. Pharmacogenomics and metabolite measurement for 6-mercaptopurine therapy in inflammatory bowel disease. Gastroenterol 2000; 118 (4): 705–713. doi: 10.1016/s0016-5085 (00) 70140-5.
62. Dubinsky CM. Azathioprine, 6-mercaptopurine in inflammatory bowel disease: pharmacology, efficacy, and safety. Clin Gastroenterol Hepatol 2004; 2 (9): 731–743. doi: 10.1016/s1542-3565 (04) 00344-1.
63. Kenedy NA, Ratigan E, Arnott IDR et al. A trial of mercaptopurine is a safe strategy in patients with inflammatory bowel disease intolerant to azathioprine: an observational study, systematic review and meta-analysis. Aliment Pharmacol Ther 2013; 38 (10): 1255–1266. doi: 10.1111/apt.12511.
64. Vernier-Massouille G, Cosnes J, Lemann M et al. Nodular regenerative hyperplasia in patients with inflammatory bowel disease treted with azathioprine. Gut 2007; 56 (10): 1404–1409. doi: 10.1136/gut.2006.114363.
65. Seiderer J, Zech CJ, Diebold J et al. Nodular regenerative hyperplasia: a reversible entity associated with azathioprine therapy. Eur J Gastroenterol Hepatol 2006; 18 (5): 553–555. doi: 10.1097/00042737-200605000-00018.
66. Meyer L, Simian D, Lubascher J et al. Eventos adversos en la terapia farmacológica de la enfermedad inflamatoria intestinal. Rev Med Chile 2015; 143 (1): 7–13. doi: 10.4067/S0034-98872015000100001.
67. Weersma RK, Peters FTM, Oostenburg LE et al. Increased incidence of azathioprine-induced pancreatitis in Crohn‘s disease compared with other diseases. Aliment Pharmacol Ther 2004; 20 (8): 843–850. doi: 10.1111/j.1365-2036. 2004.02197.x.
68. Fanbing Z, Xiang G, Liang D et al. Prospective evaluation of pharmacogenomics and metabolite measurements upon azathioprine therapy in inflammatory bowel disease. Medicine 2016; 95 (15): e3326. doi: 10.1097/MD. 0000000000003326.
69. Bermejo F, Lopez-Sanroman A, Taxonera C et al. Acute pancreatitis in inflammatory bowel disease, with special reference to azathioprine-induced pancreatitis. Aliment Pharmacol Ther 2008; 28 (5): 623–628. doi: 10.1111/j.1365-2036.2008.03746.x.
70. Wilson A, Jansen LE, Rose RV et al. HLA-DQA1-HLA-DRB1 polymorfism is a major predictor of azathioprine-induced pancreatitis with inflammatory bowel disease. Aliment Pharmacol Ther 2017; 47 (5): 615–620. doi: 10.1111/apt.14483.
71. Hindorf U, Johansson M, Eriksson A et al. Mercaptopurine treatement should be considered in azathioprine intolerant patients with inflammatory bowel disease. Aliment Pharmacol Ther 2009; 29 (6): 654–661. doi: 10.1111/j.1365-2036.2008.03925.x
72. Gallego-Gutiérrez S, Navas-Lopéz VM, Kolorz M et al. Successful mercaptopurine usage despite azathioprine-induced pancreatitis in paediatric Crohn‘s disease. J Crohns Colitis 2015; 9 (8): 676–679. doi: 10.1093/ecco-jcc/jjv086.
73. Ledder OD, Lemberg DA, Ooi CY et al. Are thiopurines always contraindicated after thiopurine-induced pancreatitis in inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2013; 57 (5): 583–586. doi: 10.1097/MPG.0b013e31829f16fc.
74. Lees CW, Maan AK, Hansoti B et al. Tolerability and safety of mercaptopurine in azathioprine-intolerant patients with inflammatory bowel disease. Aliment Pharmacol Ther 2008; 27 (3): 220–227. doi: 10.1111/j.1365-2036.2007.03570.x.
75. Schwab M, Klotz U. Pharmacokinetic considerations in the treatement of inflammatory bowel disease. Clin Pharmacokinet 2001; 40 (10): 723 – –751. doi: 10.2165/00003088-200140100-00003.
76. Doménech E, Nos P, Papo M et al. 6-mercaptopurine in patients with inflammatory bowel disease and previous digestive intolerance of azathioprine. Scand J Gastroenterol 2005; 40 (1): 50–52. doi: 10.1080/00365520410009492.
77. Marinaki AM, Ansari A, Duley JA et al. Adverse drug reactions to azathioprine therapy are associated with polymorphism in the gene encoding inosine triphosphate pyrophosphatase (ITPase). Pharmacogen 2004; 14 (3): 181–187. doi: 10.1097/00008571-200403000-00006.
78. Gearry RB, Roberts RL, Barclay ML et al. Lack of association between the ITP 94C>A polymorphism and adverse effects from azathioprine. Pharmacogenetics 2004; 14 (11): 779–781. doi: 10.1097/00008571-200411000-00010.
79. Toruner M, Loftus EV, Harmsen WS et al. Risk factors for opportunistic infections in patietnts with inflammatory bowel disease. Gastroenterol 2008; 134 (4): 929–936. doi: 10.1053/j.gastro.2008.01.012.
80. Rahier JF, Ben-Horin S, Chowers Y et al. European evidence-based Consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohns Colitis 2009; 3 (2): 47–91. doi: 10.1016/j.crohns.2009.02.010.
81. Kirchgesner J, Lemaitre M, Carrat F et al. Risk of serious and opportunistic infections associated with treatment of inflammatory bowel disease. Gastroenterology 2018; 155 (2): 337–346. doi: 10.1053/j.gastro.2018.04.012.
82. Seksik P, Cosnes J, Sokol H et al. Incidence of benign upper respiratory tract infections, HSV and HPV cutaneous infections in inflamatory bowel disease patients treated with azathioprine. Aliment Pharmacol Ther 2009; 29 (10): 1106–1113. doi: 10.1053/j.gastro.2018.04.012.
83. Lichtenstein GR, Feagan BG, Cohen RD et al. Serious infection and mortality in patients with Crohn‘s disease: more than 5 years of follow-up in the TREAT registry. Am J Gastroenterol 2012; 107 (9): 1409–1422. doi: 10.1038/ajg.2012.218.
84. Baldassano R, Colletti RB, Cucchiara S et al. Serious infections and associated risk factors in patients receiving infliximab and immunotherapies for children with inflammatory bowel disease: develop registry data. Gastroenterology 2013; 144 (5): S-11. doi: 10.1016/S1 873-9946 (13) 60016-1.
85. Veereman-Wauters G, de Ridder L, Veres G et al. Risk of infection and preventio in pediatric patients with IBD: ESPHGAN IBD Porto Group commentary. J Pediatr Gastroenterol Nutr 2012; 54 (6): 830–837. doi: 10.1097/MPG.0b013e31824d1438.
86. Magro F, Abreu C. Immunisations in Crohn‘s disease: who? why? what? when? Best Pract Res Clin Gastroenterol 2014; 28 (3): 485–496. doi: 10.1016/j.bpg.2014.04.007.
87. Khan N, Abbas AM, Lichtenstein GR et al. Risk of lymphoma in patients withulcerative colitis treated with thiopurines: a nationwide retrospective cohort study. Gastroenterology 2013; 145 (5): 1007–1015. doi: 10.1053/j.gastro.2013. 07.035.
88. Lewis JD, Schwartz JS, Lichtenstein GR. Azathioprine for maintenance of remission in Crohn‘s disease: benefits outweigh the risk of lymhoma. Gastroenterology 2000; 118 (6): 1018––1024. doi: 10.1016/s0016-5085 (00) 70353-2.
89. Beaugerie L, Brousse N, Bouvier AM et al. Lymphoproliferative disorders in patients receiving thiopurines for inflammatory bowel disease: a propective observational cohort study. Lancet 2009; 374 (9701): 1617–1625. doi: 10.1016/S0140-6736 (09) 61302-7.
90. Kandiel A, Fraser AG, Korelitz BI et al. Increased risk of lymphoma among inflammatory bowel disease patients treated with azathioprine and 6-mercaptopurine. Gut 2005; 54 (8): 1121–1125. doi: 10.1136/gut.2004.049460.
91. Ashworth LA, Billet A, Mitchell P et al. Lymphoma risk in children and young adults with inflammatory bowel disease: analysis of a large single-center cohort. Inflamm Bowel Dis 2012; 18 (5): 838–843. doi: 10.1002/ibd.21844.
92. Joose ME, Aardoom MA, Kemos P et al. Malignancy and mortality in paediatric-onset inflammatory bowel disease: a 3-year propsective, multinational study from the paediatric IBD Porto group of ESPHGAN. Aliment Pharmacol Ther 2018; 48 (5): 523–537. doi: 10.1111/apt.14893.
93. Kotlyar DS, Osterman MT, Diamond RH et al. A systemic review of factors that contribute to hepatosplenic T-cell lymphoma in patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2011; 9 (11): 36–41. doi: 10.1016/j.cgh.2010.09.016.
94. Chew C. FDA Drug Safety Communication: UPDATE on tumor necrosis factor (TNF) blockers and risk for pediatric malignancy. [online]. Dostupné z URL: https: //www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-update-tumor-necrosis-factor-tnf-blockers-and-risk-pediatric.
95. Dayhash GA, Loftus EV, Sandborn WJ et al. Ebstein-Barr virus-positive lymphoma in patients with inflammatory bowel disease treated with azathioprine or 6-mercaptopurine. Gastroenterology 2002; 122 (1): 72–77. doi: 10.1053/gast.2002.30328.
96. Thai A, Prindiville T. Hepatosplenic T-cell lymphoma and inflammatory bowel disease. J Crohns Colitis 2010; 4 (5): 511–522. doi: 10.1016/j.crohns.2010.05.006.
97. van Schaik FDM, van Oijen MGH, Smeets HM et al. Thiopurines prevent advanced colorectal neoplasia in patients with inflammatory bowel disease. Gut 2012; 61 (2): 235–240. doi: 10.1136/gut.2011.237412.
98. Singh H, Nuget Z, Demers AA et al. Increased risk of nonmelanoma skin cancers among individuals with inflammatory bowel disease. Gastroenterology 2011; 141 (5): 1612–1620. doi: 10.1053/j.gastro.2011.07.039.
99. O‘Donovan P, Perrett CM, Zhang X et al. Azathioprine and UVA light generate mutagenic oxidative DNA damage. Science 2005; 309 (5743): 1871–1874. doi: 10.1126/science.1114233.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2021 Číslo 6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Dětská gastroenterologie a hepatologie
- Léčba obezity – aby se bariatricko-metabolická chirurgie nestala obětí vlastního úspěchu
- Azathioprin v terapii idiopatických střevních zánětů u dětí – díl I: indikace, dávkování a nežádoucí účinky léčby thiopuriny
- Azathioprin v terapii idiopatických střevních zánětů u dětí – díl II: farmakodynamika, farmakokinetika a možnosti klinického využití stanovení metabolitů thiopurinů
- Indikace pro provádění koloskopie u íránských dětí – průřezová studie
- Stanovení lepku ve stolici jako metoda k ověření compliance s bezlepkovou dietou u dětí s nově diagnostikovanou celiakií
- Role bariatrické chirurgie u pacientů s diabetes mellitus 1. typu
- Jídelníček po bariatrickém zákroku v praxi
- Spontánny intramurálny hematóm duodena u mladej ženy
- Asistenční systém pro detekci polypů v reálném čase na bázi konvoluční neuronové sítě
- Účinok ursodeoxycholovej kyseliny pri postcholecystektomickej cholestatickej hepatopatii verifikovanej ultrasonograficky
- Biosimilární monoklonální protilátky v terapii idiopatických střevních zánětů Důležitý milník ve vývoji terapie Crohnovy nemoci a ulcerózní kolitidy, nebo jen sofistikovaná generika?
- Výběr z mezinárodních časopisů
- Idiopatické střevní záněty. Nové trendy a mezioborové souvislosti
- Idiopatické střevní záněty II. Nové trendy a mezioborové souvislosti
- Gastroenterologie a hepatologie v algoritmech
- Prof. MUDr. Petr Dítě, DrSc., slaví 80 let
- Správná odpověď na předchozí kvíz Gastrointestinální stromální tumor
- Kreditovaný autodidaktický test: dětská gastroenterologie a hepatologie / bariatrie a obezitologie
- Inhibitor Janusovy kinázy v moderní léčbě ulcerózní kolitidy
- Kouření a onkologie – nabídnout kuřákům vědecky podloženou méně škodlivou alternativu je etické
- Ružinovský gastroenterologický deň 2021 5. november 2021
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Azathioprin v terapii idiopatických střevních zánětů u dětí – díl I: indikace, dávkování a nežádoucí účinky léčby thiopuriny
- Jídelníček po bariatrickém zákroku v praxi
- Stanovení lepku ve stolici jako metoda k ověření compliance s bezlepkovou dietou u dětí s nově diagnostikovanou celiakií
- Prof. MUDr. Petr Dítě, DrSc., slaví 80 let
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



