-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Cytomegalovirová enteritida jako neobvyklý zdroj krvácení do gastrointestinálního traktu
CMV enteritis as unusual source of bleeding to GIT
Introduction: Cytomegalovirus disease affecting the gastrointestinal tract is a rare but severe disease presenting particularly in people under immunosuppression, solid organ transplant recipients and AIDS patients with CD4 count under 100/mm3. When colon or small intestine are affected, the disease may be complicated by severe bleeding. CMV therapy includes antivirals and, in case of bleeding, methods of therapeutic endoscopy or interventional radiology. Case description: We present a case of a 74-year-old woman 3 years after kidney transplantation owing to vascular nephrosclerosis, treated with belatacept, mycophenolate mophetile and prednisone. She was admitted to hospital for acute dyspnoea. During hospitalisation, she presented with intestinal bleeding, but the endoscopic intervention at the first colonoscopy was not successful. She was referred to the Department of Hepatogastroenterology of the Institute of Clinical and Experimental Medicine and subsequent colonoscopy revealed a 15 cm long part of ileum with ulcerations as the source of bleeding. The histological assessment described a severe CMV enteritis. The CMV DNA blood level established by PCR was higher than 10 000 000 U/ml. The patient was treated with intravenous ganciclovir and she underwent selective embolization of the inferior mesenteric artery with an excellent clinical effect. Conclusions: CMV enteritis may be associated with a high mortality. The approach to therapy is multidisciplinary and needs collaboration of gastroenterologist, endoscopist and interventional radiologist.
Keywords:
CMV – GIT bleeding – immunosuppression – Transplantation
Autoři: Varyš D. 1; Slatinská J. 2; Pítová V. 1; Chmelová K. 1; Julius Špičák 1
; Novotný J. 3; Fabián O. 4; Šperl J. 1; Fraňková S. 1
Působiště autorů: Klinika hepatogastroenterologie IKEM, Praha 1; Klinika nefrologie IKEM, Praha 2; Pracovičtě radiodia gnostiky a intervenční radiologie, IKEM, Praha 3; Pracoviště klinické a transplantační patologie, IKEM, Praha 4
Vyšlo v časopise: Gastroent Hepatol 2021; 75(4): 304-310
Kategorie: Klinická a experimentální gastroenterologie: kazuistika
doi: https://doi.org/10.48095/ccgh2021304Souhrn
Úvod: Cytomegalovirová (CMV) nemoc gastrointestinálního traktu (GIT) je raritní u imunokompetentních osob, ale časté a závažně onemocnění u pacientů po transplantaci orgánu, kostní dřeně a u pacientů s AIDS s poklesem CD4 lymfocytů < 100/mm3. Nejčastěji bývá postiženo tlusté střevo a onemocnění může být komplikováno těžkou enteroragií. V léčbě CMV nemoci s postižením GIT se uplatňuje protivirová léčba a v případě krvácení endoskopické metody nebo metody intervenční radiologie. Popis případu: Prezentujeme případ 74leté pacientky 3 roky po transplantaci ledviny pro vaskulární nefrosklerózu, na imunosupresivní terapii belataceptem, mykofenolát mofetilem a prednisonem. Pro náhle vzniklou dušnost byla pacientka hospitalizována ve spádovém zdravotnickém zařízení, během pobytu v nemocnici se u ní rozvinula enteroragie. Zdroj krvácení v terminálním ileu se nepodařilo endoskopicky ošetřit. Pacientka byla referována na Kliniku hepatogastroenterologie IKEM, kde byl nalezen 15cm úsek vícečetných ulcerací v oblasti terminálního ilea. Histologické vyšetření prokázalo těžkou CMV enteritidu. CMV DNA v krvi vyšetřená metodou PCR (polymerase chain reaction) byla > 10 000 000 U/ml. Pacientka byla léčena ganciklovirem a pro endoskopicky neošetřitelné krvácení podstoupila selektivní embolizaci a. mesenterica superior s dobrým klinickým efektem. Závěr: CMV enteritida je onemocnění spojené s vysokou mortalitou pacientů. Riziko vzniku CMV nemoci je závislé na typu a výši imunosuprese. Léčba krvácení do GIT při CMV nemoci vyžaduje multidisciplinární spolupráci gastroenterologa-endoskopisty a intervenčního radiologa.
Klíčová slova:
CMV – krvácení do GIT – imunosuprese – transplantace
Úvod
Cytomegalovirus (CMV) je DNA virus patřící do čeledi Herpesviridae a podčeledi Betaherpesviridae. Po primoinfekci, stejně jako ostatní herpesviry (např. HSV-1, -2, EBV), perzistuje v organizmu v latentní formě. Séroprevalence CMV se zvyšuje s věkem a je cca 40 % v zemích západní Evropy, onemocnění je o něco častější u žen [1,2]. CMV infikuje a je schopen replikace v řadě buněk, jako jsou fibroblasty, makrofágy, dendritické buňky, hepatocyty, buňky cévního endotelu nebo buňky slizničního epitelu, což umožňuje snadný přenos infekce. K přenosu CMV dochází přímým kontaktem s tělními tekutinami (sliny, moč, mateřské mléko), krevní cestou, pohlavním stykem nebo transplantovaným orgánem [3]. V mononukleárních leukocytech a myeloidních buňkách kostní dřeně vede CMV k latentní infekci, která je schopna reaktivace. U imunokompromitovaných pacientů může být CMV nemoc život ohrožujícím onemocněním [4,5].
Primoinfekce CMV je definována jako replikace viru nebo pozitivita CMV IgM protilátek u doposud IgG séronegativních pacientů. Příznaky onemocnění jsou podobné mononukleóze (angina, febrilie), téměř u 70 % symptomatických pacientů dochází k elevaci jaterních testů. Orgánové postižení je méně časté a může zahrnovat onemocnění GIT (enteritidu a kolitidu), pneumonii, retinitidu u HIV pozitivních osob nebo encefalitidu u pacientů po transplantaci kostní dřeně [6,7].
K reaktivaci latentní infekce může dojít u jedinců s již přítomnými IgG protilátkami, nejčastěji u pacientů po transplantaci orgánů, kostní dřeně nebo u pacientů s AIDS s poklesem CD4 lymfocytů < 100/mm3 [8]. Podle klinických projevů rozlišujeme CMV infekci, tedy záchyt viremie (CMV DNA v krvi) bez klinických projevů, CMV nemoc, tj. průkaz viremie doprovázený nespecifickými příznaky, jako jsou teploty, myelosuprese, bolesti svalů a kloubů, nebo CMV nemoc s orgánovým postižením. CMV DNA v krvi nemusí být v případě orgánového postižení vždy prokazatelná [9].
K primoinfekci po orgánových transplantacích dochází nejčastěji u séronegativních příjemců, kteří obdrželi štěp od séropozitivního dárce. Primoinfekce má u imunosuprimovaných jedinců závažnější průběh a klinicky se projeví až v 60 % případů. K reaktivaci CMV dochází u séropozitivních příjemců orgánů po podání imunosupresivní léčby [10,11]. U transplantovaných jedinců je nejvyšší incidence CMV nemoci mezi 2. a 3. měsícem po transplantaci, v případě, že je podávána CMV profylaxe, může dojít k rozvoji CMV nemoci až po jejím ukončení. Rizikovými faktory pro vznik onemocnění je typ a dávka imunosuprese, epizoda akutní celulární rejekce, koinfekce jinými viry (např. HHV 6 a 7), bakteriální nebo kvasinkové infekce [9].
Ke snížení rizika rozvoje CMV nemoci po orgánové transplantaci se obvykle podává tzv. univerzální profylaxe v trvání 3–6 měsíců všem pacientům [12]. Profylaxe významně snižuje incidenci CMV nemoci v časném potransplantačním období. V současnosti lze použít několik preparátů. U méně rizikových skupin se užívá aciklovir nebo valaciklovir, zatímco u rizikové skupiny séronegativních příjemců se obvykle užívá ganciklovir nebo valganciklovir.
Detekce protilátek není v případě transplantovaných pacientů dostačující diagnostickou metodou. Sérologie poskytuje pouze nepřímý průkaz akutní nebo dříve prodělané infekce, detekují se anti-CMV protilátky v třídách IgM a IgG [13]. K průkazu replikace viru se používá vyšetření CMV DNA metodou PCR (polymerase chain reaction) z plazmy nebo z plné krve. Kvantitativní stanovení viremie (CMV DNA) pomocí této metody je vyšetřením volby u imunokompromitovaných pacientů. Výhodou vyšetření je rovněž možnost časné detekce onemocnění a zároveň monitorování úspěšnosti léčby. Kvantitativní stanovení přítomnosti CMV DNA pomocí PCR je vysoce senzitivní metoda [14]. Při podezření na orgánové postižení při CMV nemoci je vždy základní diagnostickou metodou biopsie. Histologický nález je založen na průkazu virových bazofilních intranukleárních inkluzí, podezření na CMV nemoc je poté verifikováno imunohistochemicky [15].
Popis případu
Prezentujeme případ 74leté pacientky po transplantaci ledviny v únoru 2018 pro selhání ledvin při vaskulární nefroskleróze. Pacientka se roky léčila pro arteriální hypertenzi, dyslipidemii a diabetes mellitus 2. typu. V pooperačním období pro hematom v ráně 2krát podstoupila operační revizi s jeho evakuací. Imunosupresivní protokol zahrnoval tacrolimus, mykofenolát mofetil, prednison a indukční podání thymoglobulinu. Nástup funkce štěpu byl opožděný, a proto byla 9. pooperační den provedena biopsie štěpu s nálezem trombotické mikroangiopatie (TMA). Z důvodu TMA byla redukována dávka tacrolimu, který byl následně zcela vysazen a vyměněn za belatacept. S kombinací belataceptu (podáván 1× měsíčně), mykofenolát mofetilu a prednisonu byla pacientka dimitována do ambulantní péče. Celkem 6 měsíců po transplantaci byla podávána profylaxe reaktivace CMV infekce (valganciklovir per os, 450 mg denně). Funkce štěpu byla excelentní, se sérovým kreatininem dlouhodobě mezi 80 a 100 μmol/l.
Dne 18. 3. 2021 byla pacientka přivezena do nemocnice v místě bydliště pro náhle vzniklou dušnost. Vstupně byl vyloučen akutní koronární syndrom, byla provedena skiagrafie hrudníku bez průkazu zánětlivých změn, CT angiografie plicnice vyloučila plicní embolii. Den poté pacientka poprvé prodělala epizodu masivní enteroragie vyžadující podání 6 erymas, 4 čerstvě mražených plazem a 2 transfuzních jednotek trombocytů z aferézy. Den poté byla provedena koloskopie s nálezem krvácejících lézí terminálního ilea 15 cm od Bauhinské chlopně, která byla ošetřena opichem adrenalinem a hemoklipem. V noci 22. 3. 2021 došlo opět k masivní enteroragii – pacientce byly podány 2 erymasy a 2 čerstvě mražené plazmy, následně byla referována na Kliniku hepatogastroenterologie IKEM.
Při příjmu byla pacientka hemodynamicky stabilní, a proto bylo indikováno provedení koloskopie po standardní přípravě 4 l roztoku makrogolu. Vzhledem k anamnéze transplantace ledviny a podávání imunosupresivní léčby byla vyšetřena CMV DNA, která byla neměřitelně vysoká (> 10 000 000 U/ml). Dne 23. 3. 2021 pacientka podstoupila koloskopii s nálezem 15 cm úseku rozsáhlých ulcerací v terminálním ileu, endoskopické ošetření těchto rozsáhlých lézí nebylo možné. Během vyšetření byly odebrány biopsie z postiženého úseku terminálního ilea, histologické vyšetření potvrdilo těžkou CMV enteritidu s extrémně vysokým množstvím virových inkluzí (obr. 1). Již na základě morfologie nálezu v terminálním ileu byla ihned po výkonu zahájena intravenózní léčba ganciklovirem (425 mg po 12 hodinách).
Obr. 1. a) Sliznice tenkého střeva s přítomností početných cytomegalovirových inkluzí v endoteliích a stromálních buňkách lamina propria. V okolní sliznici je edém, drobné hemoragie a smíšená zánětlivá celulizace kolísající intenzity (hematoxylin a eozin, 200x).
Fig. 1a) Small intestinal mucosa with the presence of numerous cytomegalovirus inclusions in the endothelium and stromal cells of lamina propria. Musocal oedema, minor hemorrhages and mixed inflammatory cellulitis of variable intensity in the surrounding mucosa are present (hematoxylin and eosin, 200x).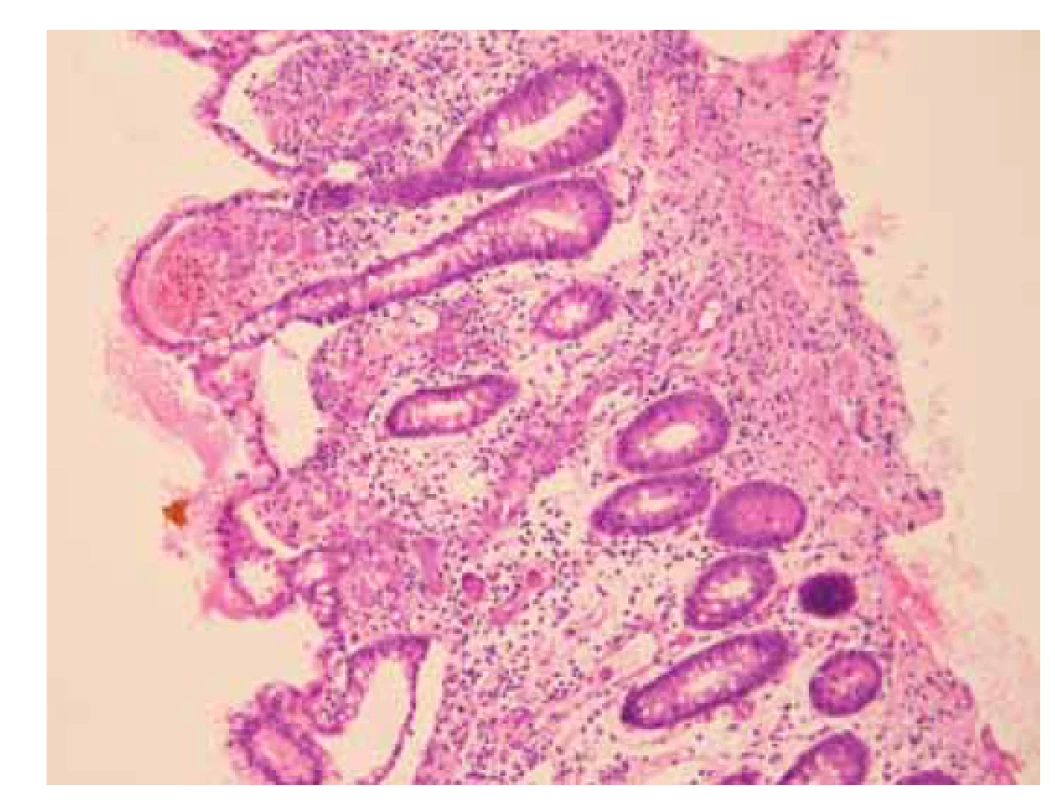
Obr. 1b) Pozitivní imunohistochemický průkaz cytomegaloviru ve sliznici tenkého střeva (200x).
Fig. 1b) Positive immunohistochemical detection of cytomegalovirus in the small intestine mucosa (200x).
Navzdory podané léčbě docházelo následující dny k opakovaným enteroragiím, které vyžadovaly transfuzní léčbu. Při krvácení se postupně prohlubovala koagulopatie, která si posléze vyžádala podání čerstvě mražené plazmy a koncentrátů koagulačních faktorů. Vzhledem k celkově špatnému internímu stavu pacientky nepřipouštějící možnost operační revize tenkého střeva byla ve snaze ozřejmit zdroj krvácení provedena CT angiografie, která prokázala únik kontrastní látky do tenkého střeva (obr. 2). Bezprostředně poté byla provedena selektivní angiografie arteria mesenterica superior, z jejíchž dvou periferních větví docházelo ke krvácení. Tyto větve byly následně pomocí 3 Cook coil Tornado selektivně embolizovány (obr. 3).
Obr. 2a) Patrný únik kontrastní látky v pravé jámě kyčelní v oblasti terminálního ilea v arteriální fázi (označeno šipkou).
Fig. 2a) Significant leakage of contrast medium in the area of terminal ileum during the arterial phase (indicated by an arrow).
Obr. 2b) Zesílení signálu ve venózní fázi (označeno šipkou).
Fig. 2b) Signal amplification in the venous phase (indicated by an arrow).
Obr. 3. Úspěšná selektivní embolizace dvou větví arteria mesenterica superior pomocí 3 coilů Tornado® (Cook Medical, USA).
Fig. 3. Successful selective embolization of two branches of the superior mesenteric artery using 3 Tornado® coils (Cook Medical, USA).
Efekt selektivní embolizace větví a. mesenterica superior nebyl bezprostředně patrný, během následujícího dne pokračovala enteroragie, již však s nižší frekvencí než v předcházejících dnech. Vzhledem k těžké koagulopatii a hypofibrinogenemii byly pacientce opakovaně podány koagulační faktory. K zástavě krvácení došlo 3. den hospitalizace na naší klinice. Teprve 7. den léčby ganciklovirem byl rovněž patrný pokles CMV DNA (575 000 U/ml). Mohutná transfuzní terapie (15 deleukotizovaných erymas, 5 čerstvě mražených plazem a 3 trombokoncetráty) a s ní spojená značně pozitivní tekutinová bilance zapříčinila městnavé srdeční selhání, které bylo následně léčeno intravenózními diuretiky s dobrým klinickým efektem. Imunosupresivní léčba byla upravena, belatacept a mykofenolát byly přechodně vysazeny a byla podána pouze substituční léčba hydrocortisonem v dávce 200 mg denně.
Diskuze
S přítomností krve ve stolici se za život setká až 15 % dospělých jedinců, ale pouze 14 % z tohoto počtu vyhledá lékařskou pomoc [16,17]. Ve skupině pacientů < 50 let jsou nejčastějším zdrojem krvácení hemoroidy [18]. Ve skupině starších pacientů jsou častým zdrojem krvácení divertikly tlustého střeva (5–42 %). Ačkoli krvácení z divertiklů obvykle spontánně ustane, může se opakovat a být zdrojem významné krevní ztráty. Až 16 % nádorových onemocnění tračníku se může manifestovat enteroragií [19]. Vzácněji se můžeme setkat s krvácením z angiodysplazií (do 3 %). Rovněž zánětlivá onemocnění tenkého i tlustého střeva se mohou projevit krvácením. U starších pacientů se srdečním selháním či arytmiemi se setkáváme s ischemickou kolitidou [20]. Dlouhodobé průjmy, hmotnostní úbytek a extraintestinální příznaky mohou být známkou probíhajícího nespecifického střevního zánětu. Nadužívání nesteroidních antiflogistik může být spojeno s obrazem nespecifické kolitidy a může vést ke krvácení z preexistujících lézí tračníku či zapříčinit relaps nespecifického střevního zánětu [21]. Ačkoli je krvácení z jícnových varixů, vředů žaludku či duodena nebo jiných lézí kraniálně od Treitzova ligamenta spojeno spíše s melénou nebo hematemezou, až u 20 % enteroragií je zdroj krvácení lokalizován mimo tlusté střevo [22,23].
CMV nemoc je velmi vzácnou příčinou krvácení do trávicího traktu. V rámci GIT se nejčastěji setkáváme s CMV kolitidou. Jejími obvyklými příznaky jsou průjem, bolesti břicha, febrilie a hmotnostní úbytek. Při postižení tenkého střeva jsou příznaky onemocnění identické.
Imunokompetentní jedinci bývají postiženi CMV kolitidou raritně [24]. Galiatsatos et al retrospektivně analyzovali publikované případy CMV kolitidy mezi lety 1980 a 2002 [25]. Metaanalýza zahrnovala 44 případů pacientů neužívajících imunosupresivní léčbu. V souboru pacientů dále bylo 16 pacientů léčených s nespecifickým střevním zánětem, 2 těhotné ženy, 8 pacientů se selháním ledvin, 6 pacientů s diabetes mellitus a 3 pacienti s maligním onemocněním. Pouze 10 pacientů nemělo významnou komorbiditu. Ve sledovaném souboru 14 pacientů zemřelo, 11 v souvislosti s kolitidou nebo chirurgickým výkonem. Celkem 10 pacientů virus spontánně eliminovalo. Nejvyšší mortality dosahovali pacienti s idiopatickými střevními záněty i přesto, že neužívali imunosupresivní léčbu. Protivirová léčba byla podána pouze u 34 % pacientů.
Nemocí CMV jsou ohroženi zejména pacienti užívající chronicky imunosupresivní léčbu, pacienti po orgánových transplantacích, po transplantaci kostní dřeně a pacienti s AIDS s počtem CD4 lymfocytů < 100/mm3. U pacientů s nespecifickým střevním zánětem může CMV kolitida imitovat relaps základního onemocnění [26].
Bylo publikováno pouze několik prací dokumentujících enteroragii u případů CMV enteritidy či kolitidy. Morunglav et al publikovali případ 72letého pacienta s těžkou CMV jejunitidou hospitalizovaného pro bolesti břicha a masivní enteroragii [27]. Zdroj krvácení nebylo možno endoskopicky ošetřit a navzdory zahájené léčbě ganciklovirem a následné selektivní embolizaci zdroje krvácení podstoupil pacient urgentní resekci postiženého segmentu střeva. Pacient následně zemřel na kardiální komplikace. Keates et al publikovali případ 55letého pacienta s těžkou CMV duodenitidou diagnostikovanou 38. den po transplantaci kostní dřeně [28]. Bezprostředně po provedení gastroskopie byla zahájena léčba CMV nemoci ganciklovirem a krvácení po 4 dnech ustalo. Dolgin et al publikovali obdobný případ 6měsíční dívky s AIDS, která zemřela v důsledku masivního krvácení z mnohočetných ulcerací tenkého střeva [29]. Stav byl komplikován obstrukcí střeva koaguly z krevních ztrát a následně perforací.
Riziko CMV nemoci, ať již primoinfekce, či reaktivace, je po orgánových transplantacích ovlivněno typem a výší imunosupresivní terapie. Riziko onemocnění je zároveň 3–5krát vyšší u CMV séronegativních příjemců, kteří obdrželi štěp od séropozitivního dárce [24].
V současné době je nejužívanějším protokolem imunosupresivní léčby po orgánových transplantacích trojkombinace tacrolimu, mykofenolátu a prednisonu. Kumulativní incidence CMV nemoci u pacientů po transplantaci jater v letech 1996–2015 byla dle Chmelové et al 19,4 %, přičemž charakter nemoci s orgánovým postižením mělo onemocnění ve 38,2 % případů [9]. V případě režimu založeném na tacrolimu byla kumulativní incidence 17,3 %, režimu založeném na cyklosporinu 28,9 %. Riziko CMV nemoci při léčbě tacrolimem bylo nižší v časném potransplantačním období při podávání profylaxe, po ukončení profylaxe se incidence CMV nemoci nelišila mezi oběma skupinami imunosupresivních režimů. K obdobným výsledkům došla analýza European FK506 Multicentre Liver Study Group – kumulativní incidence CMV nemoci byla u pacientů po transplantaci jater užívajících tacrolimus 15,5 % a 21,9 % užívajících cyklosporin, rozdíl však nebyl statisticky významný [30]. U pacientů po transplantaci ledviny byla situace dle analýzy Mayera et al v rámci FK506 Multicentre Renal Study Group obdobná, kumulativní incidence CMV nemoci byla u pacientů užívajících tacrolimus 13,5 % a 16,6 % užívajících cyklosporin, rovněž zde bez statisticky významného rozdílu [31].
Belatacept je nové imunosupresivum bez nefrotoxického účinku, a tak je s výhodou užíván u pacientů po transplantaci ledviny. Léčba belataceptem je spojena s lepší funkcí štěpu ledviny a obecně se sníženým kardiovaskulárním rizikem. Principem účinku belataceptu je selektivní inhibice vazby CD 80/86 molekul, čímž brání interakci mezi prezentující buňkou a naivním T lymfocytem. Karadkhele et al sledovali CMV viremii u pacientů po transplantaci ledviny, přičemž klinicky signifikantní viremie byla definována jako CMV DNA > 1 000 U/ml [32]. U pacientů léčených belataceptem byla vyšší kumulativní incidence signifikantní CMV viremie oproti pacientům léčených tacrolimem ve 2 letech po transplantaci (49,5 vs. 33,7 %). Dle Chavarota et al byla kumulativní incidence CMV nemoci v souboru 223 pacientů léčených belataceptem 17,9 % (40 pacientů), CMV kolitidu vyvinulo 32 pacientů (80 %), u 4 pacientů (10 %) vedlo onemocnění k úmrtí [33]. V 95 % případů CMV nemoc nastala po ukončení CMV profylaxe s mediánem vzniku onemocnění 25,7 měsíců po transplantaci ledviny (8,7–49,8 měsíců).
Základem léčby CMV nemoci s postižením GIT je podání antivirotik, případná enteroragie je ošetřena endoskopicky či metodami intervenční radiologie. Antivirotikem volby je ganciklovir podávaný v dávce 5 mg/kg po dobu 2–3 týdnů. Možným nežádoucím účinkem léčby je myelosuprese. V případě rezistence CMV ke gancikloviru je možno k léčbě využít foscarnet. V případě selhání léčby, rezistence ke gancikloviru nebo u pacientů s extrémně vysokou viremií lze k léčbě použít specifický CMV imunoglobulin (Cytotect®), který však není toho času v ČR registrován.
Po úspěšné léčbě CMV nemoci u transplantovaných pacientů je vhodné pokračovat v preventivním užívání perorálního valgancikloviru.
Zlatý standard léčby enteroragie představuje koloskopie. Ačkoli názor na její urgentnost není jednotný, většina evropských center preferuje provedení elektivní koloskopie po přípravě 4–6 l roztoku makrogolu. Dle řady studií není významný rozdíl v délce hospitalizace, v množství krevních převodů a morbidity mezi pacienty, kteří podstoupili koloskopii urgentně, nebo elektivně [23,34,35]. Elektivní koloskopie je spojena s nižším rizikem opětovného krvácení. V potvrzení diagnózy orgánového postižení při CMV hraje důležitou úlohu odběr biopsií a imunohistochemické vyšetření tkáně s typickým nálezem virových inkluzí. Stanovení CMV viremie metodou PCR může napomoci určení správné diagnózy, avšak negativní viremie CMV nemoc nevylučuje.
Metody intervenční radiologie sehrávají důležitou roli v diagnostice a léčbě endoskopicky neošetřitelného krvácení. Moderní CT přístroje jsou schopny detekovat krevní ztrátu 0,3–0,5 ml/minutu [36]. Selektivní angiografie by měla následovat v 90 minutách po úspěšném určení zdroje krvácení. Následně provedená selektivní embolizace je vysoce účinná metoda, která dosahuje kontroly krvácení až v 97 % případů [37].
Doručeno/Submitted: 19. 7. 2021
Přijato/Accepted: 4. 8. 2021
MUDr. David Varyš
Klinika hepatogastroenterologie
Institut klinické a experimentální medicíny
Vídeňská 1958/9
140 21 Praha 4
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašují, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Článek není podpořen grantem ani nevznikl za podpory žádné společnosti.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their names and e-mails in the published article/ manuscript.
Dedication: The article/ manuscript is not supported by a grant nor has it been created with the support of any company.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Zdroje
1. Stadler LP, Bernstein DI, Callahan ST et al. Seroprevalence of cytomegalovirus (CMV) and risk factors for infection in adolescent males. Clin Infect Dis 2010; 51 (10): e76–81. doi: 10.1086/656918.
2. Cannon MJ, Schmid DS, Hyde TB. Review of cytomegalovirus seroprevalence and demographic characteristics associated with infection. Rev Med Virol 2010; 20 (4): 202–213. doi: 10.1002/rmv.655.
3. Evans AS. Infectious mononucleosis and related syndromes. Am J Med Sci 1978; 276 (3): 325–339. doi: 10.1097/00000441-197811000-00 010.
4. Sinclair J. Human cytomegalovirus: latency and reactivation in the myeloid lineage. J Clin Virol 2008; 41 (3): 180–185. doi: 10.1016/j.jcv.2007.11.014.
5. Stanier P, Taylor DL, Kitchen AD et al. Persistence of cytomegalovirus in mononuclear cells in peripheral blood from blood donors. BMJ 1989; 299 (6704): 897–898. doi: 10.1136/bmj.299.6704.897.
6. Leonardsson H, Hreinsson JP, Love A et al. Hepatitis due to Epstein-Barr virus and cytomegalovirus: clinical features and outcomes. Scand J Gastroenterol 2017; 52 (8): 893–897. doi: 10.1080/00365521.2017.1319972.
7. Bonnet F, Neau D, Viallard JF et al. Clinical and laboratory findings of cytomegalovirus infection in 115 hospitalized non-immunocompromised adults. Ann Med Interne (Paris) 2001; 152 (4): 227–235.
8. Kalil AC, Florescu DF. Prevalence and mortality associated with cytomegalovirus infection in nonimmunosuppressed patients in the intensive care unit. Crit Care Med 2009; 37 (8): 2350–2358. doi: 10.1097/CCM.0b013e3181a3aa43.
9. Chmelova K, Frankova S, Jirsa M et al. IL28B rs12979860 T allele protects against CMV disease in liver transplant recipients in the post-prophylaxis and late period. Transpl Infect Dis 2019; 21 (4): e13124. doi: 10.1111/tid.13124.
10. Hibberd PL, Tolkoff-Rubin NE, Cosimi AB et al. Symptomatic cytomegalovirus disease in the cytomegalovirus antibody seropositive renal transplant recipient treated with OKT3. Transplantation 1992; 53 (1): 68–72. doi: 10.1097/00007890-199201000-00013.
11. Drouet E, Colimon R, Michelson S et al. Monitoring levels of human cytomegalovirus DNA in blood after liver transplantation. J Clin Microbiol 1995; 33 (2): 389–394. doi: 10.1128/jcm.33.2.389-394.1995.
12. Murray BM. Management of cytomegalovirus infection in solid-organ transplant recipients. Immunol Invest 1997; 26 (1–2): 243–255. doi: 10.3109/08820139709048930.
13. Chou S. Newer methods for diagnosis of cytomegalovirus infection. Rev Infect Dis 1990; 12 Suppl 7: S727–S736. doi: 10.1093/clinids/12.supplement_7.s727.
14. Kraft CS, Armstrong WS, Caliendo AM. Interpreting quantitative cytomegalovirus DNA testing: understanding the laboratory perspective. Clin Infect Dis 2012; 54 (12): 1793–1797. doi: 10.1093/cid/cis212.
15. Kotton CN, Kumar D, Caliendo AM et al. Updated international consensus guidelines on the management of cytomegalovirus in solid-organ transplantation. Transplantation 2013; 96 (4): 333–360. doi: 10.1097/TP.0b013e31829df29d.
16. Talley NJ, Jones M. Self-reported rectal bleeding in a United States community: prevalence, risk factors, and health care seeking. Am J Gastroenterol 1998; 93 (11): 2179–2183. doi: 10.1111/j.1572-0241.1998.00530.x.
17. Dent OF, Goulston KJ, Zubrzycki J et al. Bowel symptoms in an apparently well population. Dis Colon Rectum 1986; 29 (4): 243–247. doi: 10.1007/BF02553027.
18. Korkis AM, McDougall CJ. Rectal bleeding in patients less than 50 years of age. Dig Dis Sci 1995; 40 (7): 1520–1523. doi: 10.1007/BF02285201.
19. Helfand M, Marton KI, Zimmer-Gembeck MJ et al. History of visible rectal bleeding in a primary care population. Initial assessment and 10-year follow-up. JAMA 1997; 277 (1): 44–48.
20. Chavalitdhamrong D, Jensen DM, Kovacs TO et al. Ischemic colitis as a cause of severe hematochezia: risk factors and outcomes compared with other colon diagnoses. Gastrointest Endosc 2011; 74 (4): 852–857. doi: 10.1016/j.gie.2011.05.039.
21. Kaufmann HJ, Taubin HL. Nonsteroidal anti-inflammatory drugs activate quiescent inflammatory bowel disease. Ann Intern Med 1987; 107 (4): 513–516. doi: 10.7326/00 03-4819-107-4-513.
22. Jensen DM, Machicado GA. Diagnosis and treatment of severe hematochezia. The role of urgent colonoscopy after purge. Gastroenterology 1988; 95 (6): 1569–1574. doi: 10.1016/s0016-5085 (88) 80079-9.
23. Laine L, Shah A. Randomized trial of urgent vs. elective colonoscopy in patients hospitalized with lower GI bleeding. Am J Gastroenterol 2010; 105 (12): 2636–2641. doi: 10.1038/ajg.2010.277.
24. Sissons JG, Carmichael AJ. Clinical aspects and management of cytomegalovirus infection. J Infect 2002; 44 (2): 78–83. doi: 10.1053/jinf.2001.0949.
25. Galiatsatos P, Shrier I, Lamoureux E et al. Meta-analysis of outcome of cytomegalovirus colitis in immunocompetent hosts. Dig Dis Sci 2005; 50 (4): 609–616. doi: 10.1007/s106 20-005-2544-6.
26. Levin A, Yaari S, Stoff R et al. Diagnosis of cytomegalovirus infection during exacerbation of ulcerative colitis. Digestion 2017; 96 (3): 142–148. doi: 10.1159/000479865.
27. Morunglav M, Theate I, Bertin G et al. CMV enteritis causing massive intestinal hemorrhage in an elderly patient. Case Rep Med 2010; 2010. doi: 10.1155/2010/385795.
28. Keates J, Lagahee S, Crilley P et al. CMV enteritis causing segmental ischemia and massive intestinal hemorrhage. Gastrointest Endosc 2001; 53 (3): 355–359. doi: 10.1016/s0016-510 7 (01) 70417-8.
29. Dolgin SE, Larsen JG, Shah KD et al. CMV enteritis causing hemorrhage and obstruction in an infant with AIDS. J Pediatr Surg 1990; 25 (6): 696–698. doi: 10.1016/0022-3468 (90) 90369-k.
30. Randomised trial comparing tacrolimus (FK506) and cyclosporin in prevention of liver allograft rejection. European FK506 Multicentre Liver Study Group. Lancet 1994; 344 (8920): 423–428.
31. Mayer AD, Dmitrewski J, Squifflet JP et al. Multicenter randomized trial comparing tacrolimus (FK506) and cyclosporine in the prevention of renal allograft rejection: a report of the European Tacrolimus Multicenter Renal Study Group. Transplantation 1997; 64 (3): 436–443. doi: 10.1097/00007890-199708150-00012.
32. Karadkhele G, Hogan J, Magua W et al. CMV high-risk status and posttransplant outcomes in kidney transplant recipients treated with belatacept. Am J Transplant 2021; 21 (1): 208–221. doi: 10.1111/ajt.16132.
33. Chavarot N, Divard G, Scemla A et al. Increased incidence and unusual presentations of CMV disease in kidney transplant recipients after conversion to belatacept. Am J Transplant 2021; 21 (7): 2448–2458. doi: 10.1111/ajt.16430.
34. van Rongen I, Thomassen BJW, Perk LE. Early versus standard colonoscopy: a randomized controlled trial in patients with acute lower gastrointestinal bleeding: results of the BLEED study. J Clin Gastroenterol 2019; 53 (8): 591–598. doi: 10.1097/MCG.0000000000001 048.
35. Green BT, Rockey DC, Portwood G et al. Urgent colonoscopy for evaluation and management of acute lower gastrointestinal hemorrhage: a randomized controlled trial. Am J Gastroenterol 2005; 100 (11): 2395–2402. doi: 10.1111/j.1572-0241.2005.00306.x.
36. Kuhle WG, Sheiman RG. Detection of active colonic hemorrhage with use of helical CT: findings in a swine model. Radiology 2003; 228 (3): 743–752. doi: 10.1148/radiol.2283020 756.
37. Strate LL, Naumann CR. The role of colonoscopy and radiological procedures in the management of acute lower intestinal bleeding. Clin Gastroenterol Hepatol 2010; 8 (4): 333–343. doi: 10.1016/j.cgh.2009.12.017.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Kvíz z klinické praxeČlánek Heydeho syndróm
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2021 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Klinická a experimentální gastroenterologie
- Kvíz z klinické praxe
- Infekce SARS-CoV-2 a postižení slinivky břišní
- Parkinsonova choroba a postihnutie GITu
- Heydeho syndróm
- Cytomegalovirová enteritida jako neobvyklý zdroj krvácení do gastrointestinálního traktu
- Význam sarkopenie a myosteatózy u kandidátů transplantace jater na peritransplantační průběh a přežívání pacientů a štěpů
- Sérové protilátky proti laminarinu u kolorektálního karcinomu: prospektivní pilotní studie
- Endoscopic management of ampullary tumors: European Society of Gastrointestinal Endoscopy (ESGE) Guideline and Endoscopic management of superficial nonampullary duodenal tumors: European Society of Gastrointestinal Endoscopy (ESGE) Guideline
- Neobvyklý případ systémové AA amyloidózy
- Vitamín D a nealkoholová steatóza pečene u detí
- Vliv CDED diety na rozvoj remise u pacienta s přetrvávající aktivitou Crohnovy choroby – kazuistické sdělení a zkušenosti pracoviště
- Aktualita z kongresu EASL-ILC: pokroky v poznání a léčbě primární biliární cholangitidy
- Výběr z mezinárodních časopisů
- Správná odpověď na předchozí kvíz Dlouhodobé bolesti břicha
- Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Heydeho syndróm
- Infekce SARS-CoV-2 a postižení slinivky břišní
- Vliv CDED diety na rozvoj remise u pacienta s přetrvávající aktivitou Crohnovy choroby – kazuistické sdělení a zkušenosti pracoviště
- Vitamín D a nealkoholová steatóza pečene u detí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



