-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vitamín D a nealkoholová steatóza pečene u detí
Vitamin D and non-alcoholic fatty liver disease in children
Background: Insulin resistance (IR) plays a key role in the pathogenesis of non-alcoholic fatty liver disease (NAFLD). Hypovitaminosis D is associated with several diseases, including hepatic steatosis and obesity. Vitamin D (VD) affects insulin secretion and improves tissue sensitivity to insulin, suggesting that hypovitaminosis D is also associated with IR. The leptin-to-adiponectin ratio (LAR) was investigated as a new marker of IR. Aim: The aim of our study was to determine the association between the VD status, NAFLD and IR in paediatric overweight or obese patients. Methods: The study ran from January 2018 to August 2020 and included 100 subjects. We measured their anthropometric parameters, determined their basic laboratory parameters and the level of leptin and adiponectin, calculated BMI, WHR, WHtR, LAR and HOMA-IR. We measured the degree of hepatic steatosis by obtaining the hepatorenal index (HRI) using ultrasonography, and used real-time elastography to determine the elasticity of the liver parenchyma (LFI). Subsequently, we compared the groups of patients with and without hepatic steatosis and looked for correlations in relation to the level of VD and IR. Results: 4.4% of patients had a severe VD deficiency, 55% of the children had hypovitaminosis D, 28.6% had VD insufficiency and 12% of patients had sufficient VD levels. Patients with significant hepatic steatosis (HRI 1.5 and more) had the lowest level of VD (16.61 ±5.62 μg/l, P = 0.015). The level of VD in patients with hepatic steatosis was inversely correlated with waist circumference, hip circumference, height, weight, triacylglycerols, GMT, C-peptide, insulin, HOMA-IR, HRI and LFI. Leptin levels were highest in patients with hepatic pre-steatosis. LAR was highest in the group with hepatic steatosis, but we did not observe significant correlations in relation to other parameters. Conclusion: VD levels are inversely associated with the degree of hepatic steatosis in overweight or obese paediatric patients. HOMA-IR inversely correlates with VD levels and positively with LFI. The LAR value was highest in the group of patients with steatosis, although we did not find out any significant correlations in relation to VD status and HRI.
Keywords:
vitamin D – non-alcoholic fatty liver disease – insulin resistance – leptin – Adiponectin – obesity – childhood
Autoři: T. Kráľová 1
; Pršo M. 1; Čierny D. 2; Michnová Z. 1; Havlíčeková Z. 1; Kostková M. 1
Působiště autorů: Klinika detí a dorastu JLF UK a UN Martin 1; Ústav klinickej biochémie JLF UK v Martine 2
Vyšlo v časopise: Gastroent Hepatol 2021; 75(4): 335-343
Kategorie: Dětská gastroenterologie: původní práce
doi: https://doi.org/10.48095/ccgh2021335Souhrn
Úvod: Inzulínová rezistencia (IR) zohráva kľúčovú úlohu v patogenéze nealkoholovej steatózy pečene (NAFLD). Hypovitaminóza D sa spája s množstvom ochorení, vrátane steatózy pečene a obezity. Vitamín D (VD) ovplyvňuje inzulínovú sekréciu a zlepšuje senzitivitu tkanív na inzulín, z čoho vyplýva, že hypovitaminóza D sa tiež spája s IR. Pomer leptínu k adiponektínu (LAR) bol skúmaný ako nový marker IR. Cieľ: Cieľom našej práce boli zistiť spojitosť medzi hladinou VD, NAFLD a IR u detských pacientov s nadváhou alebo obezitou. Metodika: Štúdia prebiehala od januára 2018 do augusta 2020 a bolo do nej zaradených 100 probandov. U respondentov sme zmerali antropometrické parametre, stanovili základné laboratórne parametre a hladinu leptínu a adiponektínu, vypočítali BMI, WHR, WHtR, LAR a HOMA-IR. Pomocou ultrasonografie získaním hepatorenálneho indexu (HRI) sme určili stupeň steatózy pečene a prostredníctvom real-time elastografie elasticitu pečeňového parenchýmu (LFI). Následne sme porovnávali skupiny pacientov bez steatózy a so steatózou pečene a hľadali vzájomné korelácie vo vzťahu k VD a IR. Výsledky: Závažnú deficienciu VD malo 4,4 % pacientov, hypovitaminózu D 55 %, insuficienciu VD 28,6 % a suficientné hladiny VD malo 12 % pacientov. Pacienti so signifikantnou steatózou pečene (HRI 1,5 a viac) mali najnižšiu hladinu VD (16,61 ± 5,62 μg/l, p = 0,015). Hladina VD u pacientov so steatózou pečene negatívne korelovala s obvodom pása, obvodom bokov, výškou, hmotnosťou, triacylglycerolmi, GMT, C-peptidom, inzulínom, HOMA-IR, HRI a LFI. Hladina leptínu bola najvyššia u pacientov s presteatózou pečene. LAR bol najvyšší v skupine so steatózou pečene, ale signifikantné korelácie vo vzťahu k ostatným parametrom sme nedokázali. Záver: Hladina VD inverzne koreluje so stupňom steatózy pečene u detských pacientov s nadváhou alebo obezitou. HOMA-IR nepriamo úmerne koreluje s hladinou VD a pozitívne s LFI. LAR bol najvyšší v skupine pacientov so steatózou, aj keď sme nepreukázali signifikantné korelácie vo vzťahu k VD a HRI.
Klíčová slova:
vitamín D – nealkoholová steatóza pečene – inzulínová rezistencia – leptin – adiponektín – obezita – detský vek
Úvod
Vitamín D (VD) sa za posledné desaťročia dostal do povedomia vedcov aj lekárov pre svoje širokospektrálne účinky. Prestal byť vnímaným len ako „slnečný“ vitamín, ktorý zohráva dôležitú úlohu v kostnom metabolizme. Spolu s narastajúcim množstvom informácií o VD stúpala aj prevalencia jeho nedostatku v populácii. Nedostatok vitamínu D postihuje všetky vekové kategórie a v súčasnosti môžeme hovoriť o celosvetovej pandémii hypovitaminózy D. Spája sa s množstvom ochorení vrátane kardiovaskulárnych ochorení, infekčných ochorení, malignít, autoimunitných ochorení, ochorení dýchacieho systému, metabolických ochorení a s mnohými ďalšími [1,2]. V posledných rokoch narástla aj globálna prevalencia metabolického syndrómu a jeho zložiek vrátane obezity, inzulínovej rezistencie, diabetes mellitus, dyslipidémie a hypertenzie u detí, adolescentov i dospelých [3]. Obezita je v súčasnosti najrozšírenejšou metabolickou poruchou na celom svete. Stúpla aj prevalencia nealkoholovej steatózy pečene (NAFLD – non-alcoholic fatty liver disease), ktorá je najčastejšou chronickou chorobou pečene a mnohí autori ju považujú za orgánový prejav metabolického syndrómu. NAFLD predstavuje spektrum ochorení od jednoduchej steatózy cez nealkoholovú steatohepatitídu (NASH – non-alcoholic steatohepatitis), ktorá môže progredovať do fibrózy pečene až cirhózy a zvyšuje riziko hepatocelulárneho karcinómu [4–6]. Existujú viaceré hypotézy vysvetľujúce patogenézu NAFLD, medzi ktoré v súčasnosti patrí najrozšírenejšia teória „viacerých úderov“. Podľa tejto teórie akumulácia tuku v hepatocytoch a inzulínová rezistencia zvyšujú senzitivitu pečene na ďalšie „údery“, akými sú oxidačný stres a peroxidácia lipidov, mitochondriálna dysfunkcia, črevná mikroflóra, dysfunkcia tukového tkaniva a sekrécia adipocytokínov. Tieto faktory pôsobia súčinne a postupne vedú k progresii poškodenia pečene, následne k jej zápalu a fibróze [6]. Zlatým štandardom v diagnostike NAFLD je biopsia pečene, avšak vzhľadom na to, že ide o invazívny výkon, prináša viaceré riziká, zvlášť u detí. V posledných rokoch sa do popredia dostávajú viaceré neinvazívne zobrazovacie vyšetrenia, ktoré nám pomáhajú v diagnostike, ale aj pri sledovaní terapeutickej odpovede u pacientov s NAFLD, ale aj s inými pečeňovými ochoreniami [7]. K takýmto zobrazovacím vyšetreniam, pomocou ktorých vieme kvantifikovať množstvo tuku v pečeni patrí stanovenie hepatorenálneho indexu pomocou ultrasonografie, meranie kontrolného atenuovaného parametra zabudovaného v prístroji FibroScan® alebo protónová magnetická rezonančná spektroskopia [5,8,9]. Na posúdenie fokálnych lézií pečene sa dostáva do popredia dynamická kontrastná ultrasonografia (CEUS – contrast-enhanced ultrasound) [10]. Na meranie elasticity pečene sa používa tranzientná elastografia, kontrolný atenuovaný parameter, real-time elastografia, elastografia s ultrazvukovým tlakovým impulzom (ARFI – acoustic radiation force impulse elastography), či MR elastografia pečene [8,11].
Úloha vitamínu D v patogenéze NAFLD patrí k aktívnej oblasti výskumu. V literatúre boli popísané možné mechanizmy, ktorými vitamín D zasahuje do patogenézy tohto ochorenia, avšak mnohé boli prezentované len na zvieracích modeloch [12]. Dôležitú úlohu v patogenéze NAFLD zohráva inzulínová rezistencia, taktiež vitamín D ovplyvňuje sekréciu inzulínu, senzitivitu tkanív na inzulín, syntézu adipokínov a systémový zápal [12,13]. K najznámejším neinvazívnym nástrojom na posúdenie inzulínovej rezistencie patrí index inzulínovej rezistencie (HOMA-IR – Homeostatic Model Assessment for Insulin Resistance) [13]. U obéznych pacientov, ktorí sú ohrození vznikom inzulínovej rezistencie, a tým aj rozvojom metabolického syndrómu, dochádza k zníženej sekrécii adiponektínu hypertrofickými adipocytmi, zatiaľ čo hladina leptínu sa zvyšuje. Hladiny leptínu a adiponektínu pozitívne a negatívne korelujú s obezitou, s diabetes mellitus, hypertenziou a metabolickým syndrómom. Leptín a adiponektín majú tiež opačný účinok na zápalové markery, a tým na subklinický zápal. Leptín sa považuje za prozápalový cytokín, pretože up-reguluje prozápalové cytokíny, ako sú TNF-a a IL-6. Naopak adiponektín vykazuje protizápalové vlastnosti prostredníctvom down-regulácie expresie a uvoľňovania prozápalových mediátorov [2,6]. Keďže adipocytokíny zohrávajú dôležitú úlohu v patogenéze obezity, začalo sa uvažovať o novom prediktore inzulínovej rezistencie, a to pomeru leptínu k adiponektínu (LAR – leptin-to-adiponectin ratio) [14].
Cieľom našej práce bolo zistiť spojitosť medzi NAFLD, hladinou vitamínu D, inzulínovou rezistenciou a adipocytokínmi u detských pacientov s nadváhou alebo obezitou. Prítomnosť a stupeň stukovatenia pečene sme zisťovali pomocou ultrasonografie stanovením hepatorenálneho indexu (HRI – hepatorenal index) a elasticitu pečene sme posudzovali pomocou real-time elastografie stanovením indexu fibrózy pečene (LFI – liver fibrosis index).
Súbor pacientov a metodika
Klinická štúdia bola realizovaná na Klinike detí a dorastu (KDaD) Jesseniovej lekárskej fakulty v Martine Univerzity Komenského (JLF UK) a Univerzitnej nemocnici Martin (UNM) v spolupráci s Ústavom klinickej biochémie JLF UK a UNM v období od januára 2018 do augusta 2020 a bola schválená etickou komisiou JLF UK (číslo protokolu EK 65/2020). Celkový súbor tvorilo 100 pacientov, z toho 49 dievčat a 51 chlapcov. Do štúdie neboli zaradení pacienti, ktorým bolo diagnostikované dedičné metabolické ochorenie, pacienti s vírusovou hepatitídou, či autoimunitnou hepatitídou. Súbor tvorili detskí pacienti od 5 rokov do ukončených 19 rokov trpiacich nadváhou alebo obezitou, hospitalizovaní na KDaD JLK UK a UNM, dispenzarizovaní v Ambulancii pediatrickej endokrinológie, diabetológie a porúch látkovej premeny a výživy KDaD JLF UK a UNM a v Ambulancii pediatrickej gastroenterológie, hepatológie a výživy KDaD JLF UK a UNM. Na jeseň a v zime bolo realizovaných 40 vyšetrení a na jar a v lete 60 vyšetrení. Podľa klasifikácie Medzinárodnej pracovnej skupiny pre obezitu (IOTF – International Obesity Task Force [15]), ktorá zohľadňuje index telesnej hmotnosti (BMI – body mass index) pre daný vek a pohlavie, trpelo v našom súbore nadváhou 21 detí, obezitou 1. stupňa 37 a obezitou 2. stupňa 42 detí. Podľa kritérií Medzinárodnej diabetologickej federácie (IDF – International Diabetes Federation [16]) sme diagnostikovali metabolický syndróm u 30 detí (22 chlapcov a 8 dievčat). V súbore boli 3 pacienti liečení na diabetes mellitus 2. typu (2 chlapci a 1 dievča). U všetkých pacientov sme vykonali antropometrické merania: meranie výšky, hmotnosti, obvod pása a bokov (podľa odporúčaní WHO [17]), tlak krvi a následne sme vypočítali BMI, pomer obvodu pása k bokom (WHR – waist-to-hip ratio) a pomer obvodu pása k výške (WHtR – waist-to-height ratio). Po 12-hodinovom lačnení sme odobrali pacientom krv venepunkciou a vyšetrili nasledovné laboratórne parametre: glykémia, inzulín, C-peptid, glykovaný hemoglobín (Hb1Ac), hepatobiliárne enzýmy (alanínaminotransferázu – ALT, aspartátaminotransferázu – AST, gama-glutamyltransferázu – GMT, alkalickú fosfatázu – ALP, celkový a konjugovaný bilirubín), albumín, celkové bielkoviny, močovina, kreatinín, kyselina močová, lipidový profil (celkový cholesterol, triacylglyceroly – TAG, LDL-cholesterol, HDL-cholesterol), C-reaktívny proteín (CRP), vápnik, fosfor, parathormón, kortizol a vitamín D. Zo získaných laboratórnych parametrov sme vypočítali index inzulínovej rezistencie (HOMA-IR – Homeostatic Model Assessment for Insulin Resistance) podľa nasledovného vzorca: [hladina inzulínu nalačno (μU/ml) × hladina glukózy nalačno (mmol/l) ] / 22,5 [18]. U 80 pacientov sme odobrali aj ďalšiu vzorku venóznej krvi na stanovenie hladiny leptínu a adiponektínu. Imunochemickou enzýmovou imunoanalýzou (ELISA – enzyme-linked immunosorbent assay) sme v spolupráci s Ústavom klinickej biochémie stanovili plazmatickú hladinu leptínu a adiponektínu. Pri vyšetrení boli použité komerčné ELISA kity – Human Leptin ELISA Kit (katalógové číslo ab179884, Abcam, Spojené kráľovstvo) so senzitivitou detekcie 4,65 pg/ml a Human Adiponectin ELISA Kit (katalógové číslo ab99968, Abcam, Spojené kráľovstvo) so senzitivitou detekcie < 25 pg/ml. Vzorky boli vyšetrené v duplikátoch. Z nameraných hodnôt sme vypočítali pomer leptínu k adiponektínu. Následne sme pomocou ultrasonografie zisťovali prítomnosť steatózy pečene. Najprv sme pomocou zabudovanej softvérovej funkcie histogram v utrasonografickom prístroji (Hitachi Preirus) zmerali HRI. Ten bol stanovený pomerom mediánov echogenity pečene a echogenity kôry pravej obličky (obr. 1). Hodnoty HRI prislúchajúce jednotlivým stupňom steatózy boli stanovené na základe meraní získaných u dospelých pacientov s biopticky potvrdenou nealkoholovou steatózou pečene (tab. 1) [9,19]. Pomocou real-time elastografie sme merali elasticitu pečeňového parenchýmu. Tá bola posudzovaná podľa hodnoty LFI. Pri meraní sa nám vykreslila elastografická mapa, z ktorej sme označili najvhodnejšiu oblasť záujmu (bez prítomnosti veľkých ciev a žlčových ciest, v hĺbke aspoň 1 cm pod pečeňovou kapsulou) a následne softvérom vypočítaná hodnota LFI. Meranie LFI sme zopakovali trikrát za sebou a výslednú hodnotu uvádzame ako aritmetický priemer (obr. 2).
Obr. 1. Hodnotenie stupňa steatózy pečene stanovením hepatorenálneho indexu (HRI 1,61) pomocou ultrasonografie u adolescentnej obéznej pacientky (BMI 43,07).
Fig. 1. Evaluation of the degree of hepatic steatosis using the hepatorenal index (HRI 1,61) obtained by ultrasonography in an adolescent obese patient (BMI 43,07).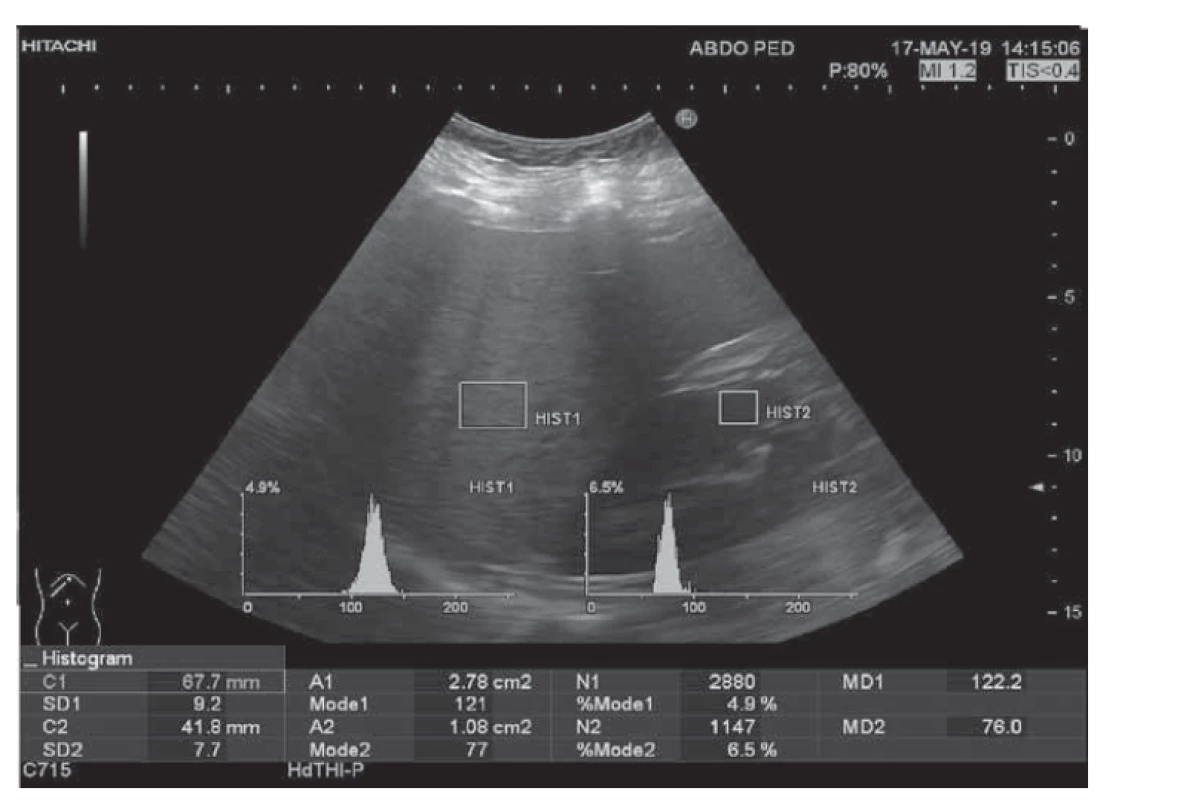
Tab. 1. Ultrasonografické hodnotenie steatózy pečene [19].
Tab. 1. Assessment of hepatic steatosis by ultrasound [19].![Ultrasonografické hodnotenie steatózy pečene [19].<br>
Tab. 1. Assessment of hepatic steatosis by ultrasound [19].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/271a1b959dce710ddf0a0dd3d85eba11.png)
Obr. 2. Stanovenie liver fibrosis indexu (LFI 2,35) pomocou real-time elastografie u pacienta so signifikantnou steatózou pečene (HRI 1,85).
Fig. 2. Determination of liver fibrosis index (LFI 2,35) by real-time elastography in a patient with significant hepatic steatosis (HRI 1,85).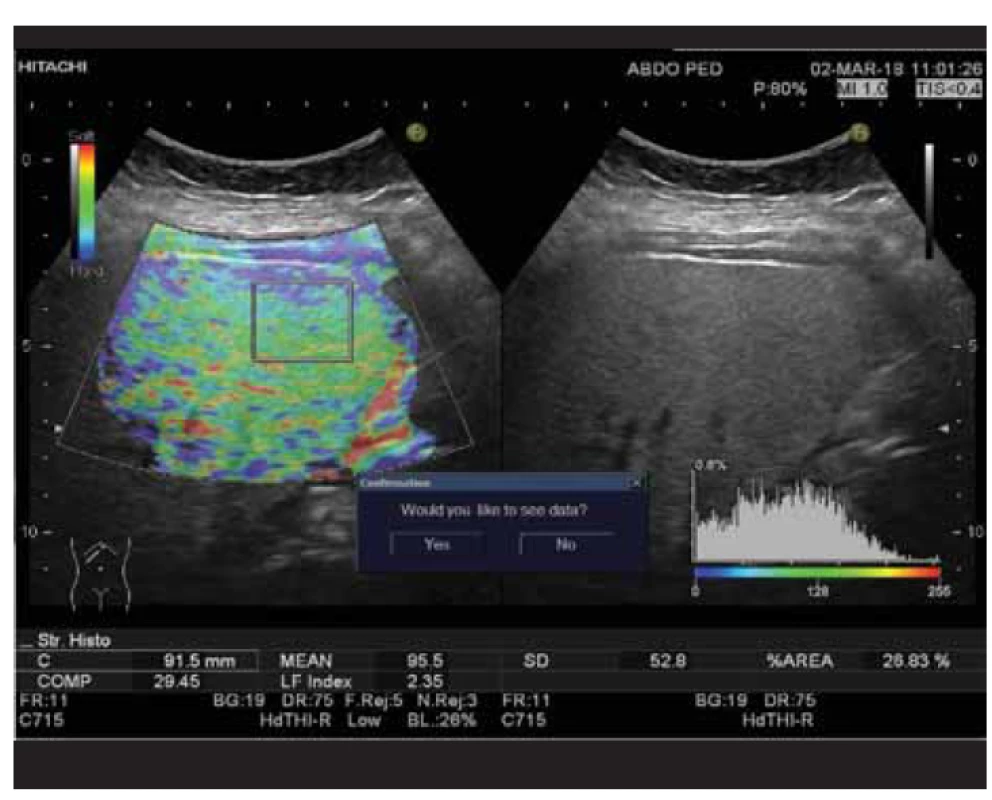
Na základe hodnôt HRI, sme pacientov rozdelili do troch skupín: skupina pacientov bez steatózy pečene (HRI 1,0–1,2), s presteatózou (HRI 1,2–1,49) a so signifikantnou steatózou pečene (HRI 1,5–viac). Medzi uvedenými skupinami sme hľadali rozdiely v antropometrických parametroch, laboratórnych parametroch, vitamínom D, hladinách adipocytokínov a markeroch inzulínovej rezistencie (HOMA-IR, LAR) (tab. 2–4). V skupine pacientov s presteatózou a steatózou pečene sme následne skúmali vzájomné korelácie medzi hladinou vitamínu D, stupňom steatózy pečene a elasticitou pečene, adipocytokínmi, LAR a HOMA-IR.
Tab. 2. Charakteristika antropometrických parametrov v skupinách pacientov bez steatózy, s presteatózou a so signifikantnou steatózou pečene.
Tab. 2. Characteristics of anthropometric parameters in groups of patients without steatosis, with pre-steatosis and with significant hepatic steatosis.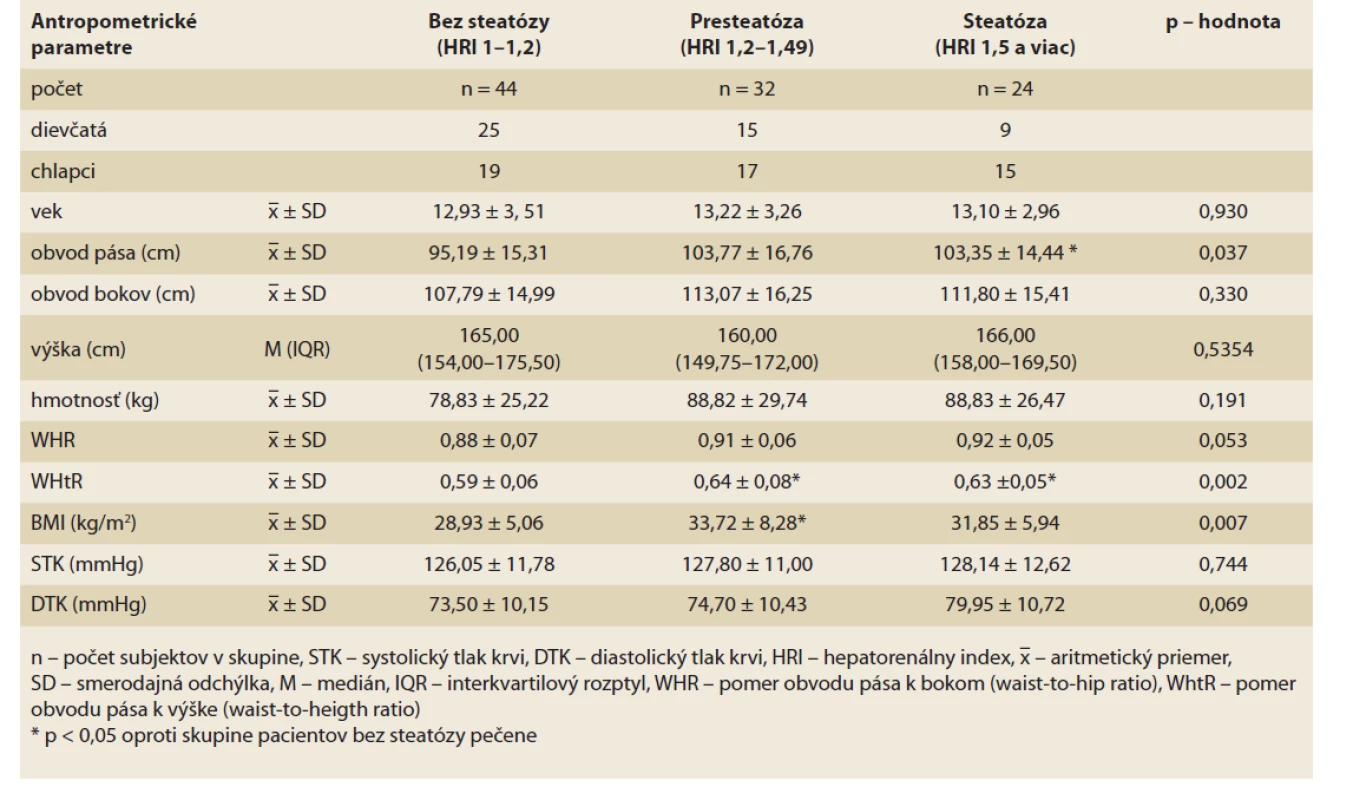
Tab. 3. Charakteristika laboratórnych parametrov v skupinách pacientov bez steatózy, s presteatózou a so signifikantnou steatózou pečene.
Tab. 3. Characteristics of laboratory parameters in groups of patients without steatosis, with pre-steatosis and with significant hepatic steatosis.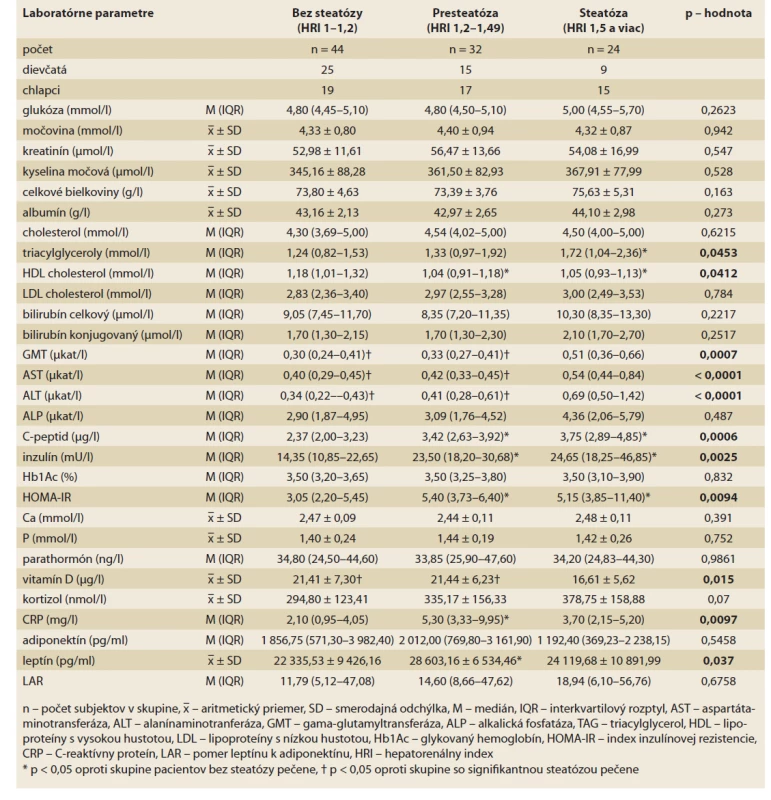
Tab. 4. Charakteristika ultrasonografických parametrov v skupinách pacientov bez steatózy, s presteatózou a so signifikantnou steatózou pečene.
Tab. 4. Characteristics of ultrasonographic parameters in groups of patients without steatosis, with pre-steatosis and with significant hepatic steatosis.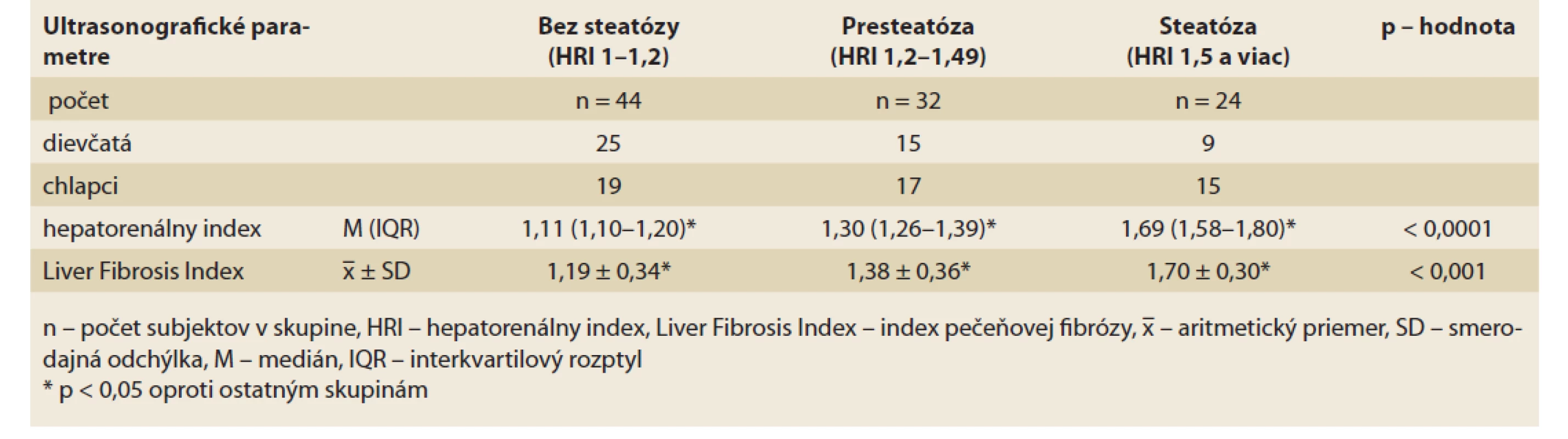
Na štatistickú analýzu sme použili štatistický program MedCalc 11.6.1.0 (MedCalc Software bvba, Ostend, Belgicko). Pomocou D’Agostino-Pearsonovho testu sme hodnotili normalitu distribúcie dát (t.j. gaussovského a negaussovského rozloženie). Na porovnanie jednotlivých parametrov medzi skupinami sme použili jednofaktorovú analýzu rozptylu (ANOVA – analysis of variance) s post-hoc Student-Newman-Keulsovým testom pri parametroch s gaussovským rozložením. Na medziskupinové porovnanie parametrov s negaussovským rozložením bol použitý Kruskalov-Wallisov test s post-hoc testom. Na zhodnotenie korelácie medzi dvoma premennými sme použili Pearsonov korelačný koeficient pre parametrické premenné, alebo Spearmanov korelačný koeficient pre neparametrické premenné. Výsledky sú uvedené ako aritmetický priemer (x–) ± smerodajná odchýlka (SD) pre parametrické premenné a pre neparametrické premenné ako medián (M) a interkvartilový rozptyl (IQR). Za štatisticky významné boli považované hodnoty p < 0,05.
Výsledky
V našom súbore malo závažnú deficienciu VD (t.j. VD ≤ 10 μg/l) 4,4 % pacientov, hypovitaminózu D (t.j. VD = 10–20 μg/l) 55 % detí, insuficienciu VD (t.j. VD = 21–29 μg/l) 28,6 % a suficientné hladiny VD (VD nad 30 μg/l) malo 12 % pacientov (hodnotené podľa Račanskej [20]). Priemerná hodnota VD u pacientov, ktorých sme vyšetrovali v zimných mesiacoch, bola 19,65 ± 7,07 μg/l a v jarných mesiacoch 20,64 ± 6,76 μg/l. Medzi sérovými hladinami vitamínu D nebol signifikantný rozdiel v závislosti od ročného obdobia (p = 0,5073).
Na začiatku sme zisťovali rozdiely v získaných parametroch medzi pohlaviami. V súbore bolo 49 dievčat a 51 chlapcov s nadváhou alebo obezitou. Chlapci v porovnaní s dievčatami mali signifikantne (p < 0,05) väčší obvod pása, výšku, hmotnosť, WHR a WHtR. V hodnotách obvodu bokov, BMI a krvného tlaku neboli medzi pohlaviami výrazné rozdiely. Z laboratórnych parametrov boli sérové hladiny glukózy, kreatinínu, kyseliny močovej, pečeňových enzýmov (AST, ALT, ALP), vápnika a leptínu signifikantne (p < 0,05) vyššie u chlapcov v porovnaní s dievčatami. V ostatných laboratórnych výsledkoch a vo vypočítaných parametroch (HOMA-IR, LAR) sme medzi pohlaviami nezaznamenali výrazné rozdiely. Štyria pacienti mali hyperbilirubinémiu a jeden z nich aj geneticky potvrdený Gilbertov syndróm. Z týchto pacientov jeden nemal steatózu pečene a traja mali presteatózu pečene podľa HRI. Medzi pohlaviami sme nezaznamenali signifikantný rozdiel v hodnotách HRI ani LFI.
Základné charakteristické údaje jednotlivých skupín rozdelených podľa HRI, vrátane antropometrických, laboratórnych a ultrasonografických parametrov sú uvedené v tab. 2–4. Medzi jednotlivými skupinami sme zaznamenali viaceré signifikantné rozdiely. Pacienti so signifikantnou steatózou pečene mali výrazne väčší obvod pása v porovnaní s pacientami bez steatózy pečene. Pacienti bez steatózy mali výrazne nižšiu hodnotu WHtR oproti ostatným skupinám. Hodnoty BMI boli v skupine pacientov s presteatózou signifikantne vyššie oproti skupine pacientov bez steatózy (tab. 2). Pacienti so signifikantnou steatózou pečene mali oproti ostatným skupinám signifikantne vyššiu sérovú hladinu TAG a pečeňových enzýmov (ALT, AST, GMT) a signifikantne najnižšiu hladinu VD (16,61 ± 5,62 μg/l, p = 0,015). Naopak pacienti bez steatózy pečene mali oproti ostatným skupinám výrazne vyššiu hladinu HDL-cholesterolu a signifikantne nižšiu hladinu C-peptidu a inzulínu a tiež výrazne nižší HOMA-IR. Hladina leptínu a CRP bola signifikantne najvyššia v skupine probandov s presteatózou pečene. Pacienti so steatózou pečene mali najnižšie plazmatické hodnoty adiponektínu. Hodnota pomeru leptínu k adiponektínu bola najvyššia v skupine so steatózou pečene, aj keď sme štatisticky signifikantný rozdiel oproti ostatným skupinám nezaznamenali (tab. 3). Hodnoty HRI aj LFI sa signifikantne líšili medzi jednotlivými skupinami (p < 0,0001 pre HRI, p < 0,001 pre LFI) (tab. 4).
V skupine pacientov s presteatózou a so steatózou pečene (spolu 56 probandov) sme hodnotili korelácie medzi vybranými parametrami. Z antropometrických parametrov sme zaznamenali signifikantnú inverznú koreláciu medzi hladinou VD a obvodom pása (r = –0,376; p = 0,0084), obvodom bokov (r = –0,404; p = 0,0049), výškou (r = –0,375; p = 0,0066), hmotnosťou (r = –0,38; p = 0,0059) a diastolickým tlakom krvi (DTK) (r = –0,46; p = 0,0011). Z laboratórnych parametrov hladina VD inverzne korelovala so sérovou hladinou TAG (r = –0,357; p = 0,01), GMT (r = –0,365; p = 0,0084), C-peptidom (r = –0,421; p = 0,0026), inzulínom (r = –0,363; p = 0,0088) a HOMA-IR (r = –0,355; p = 0,0106), tiež s hodnotami HRI (r = –0,366; p = 0,0082) a LFI (r = –0,292; p = 0,0492).
Hodnota HOMA-IR pozitívne korelovala s obvodom pása (r = 0,402; p = 0,0032), obvodom bokov (r = 0,420; p = 0,0022), s výškou (r = 0,294; p = 0,0291), hmotnosťou (r = 0,379; p = 0,0043), BMI (r = 0,326; p = 0,0151), hodnotou LFI (r = 0,284; p = 0,0457). Negatívnu koreláciu sme zaznamenali so sérovou hladinou HDL-cholesterolu (r = –0,382; p = 0,0048) a VD (r = –0,355; p = 0,0106). Plazmatická hladina leptínu pozitívne súvisela s obvodom bokov (r = 0,358; p = 0,0253), WHtR (r = 0,349; p = 0,0292), BMI (r = 0,359; p = 0,0194), Hb1Ac (r = 0,452; p = 0,0038). Naopak negatívne korelovala s TAG (r = –0,315; p = 0,0445) a AST (r = –0,344; p = 0,0259). Adiponektín inverzne koreloval s hladinou C-peptidu (r = –0,404; p = 0,0089) a hodnotou LFI (r = –0,338; p = 0,0408).
Nezaznamenali sme signifikantné korelácie medzi LAR vo vzťahu k hladine VD, HRI či LFI.
HRI pozitívne koreloval so sérovými hladinami hepatálnych enzýmov – AST (r = 0,557; p < 0,0001), ALT (r = 0,523; p < 0,0001) a GMT (r = 0,45; p = 0,0005) a s hodnotou LFI (r = 0,305; p = 0,0294). Negatívne koreloval s hladinou VD (r = –0,366; p = 0,0082). V prípade LFI sme zistili viaceré signifikantne pozitívne korelácie, a to s obvodom pása (r = 0,430; p = 0,0016), obvodom bokov (r = 0,342; p = 0,0151), hmotnosťou (r = 0,423; p = 0,002), WHtR (r = 0,396; p = 0,0041), BMI (r = 0,489; p = 0,0003), DTK (r = 0,474; p = 0,0009), kyselinou močovou (r = 0,333; p = 0,0195), GMT (r = 0,299; p = 0,0328), Hb1Ac (r = 0,311; p = 0,0331), inzulínom (r = 0,33; p = 0,0218), HOMA-IR (r = 0,284; p = 0,0457) a HRI (r = 0,305; p = 0,0294). LFI inverzne koreloval s hladinou adiponektínu (r = –0,338; p = 0,0408).
Diskusia
Nedostatok vitamínu D v súčasnosti predstavuje celosvetový problém. V našom súbore malo závažnú deficienciu vitamínu D 4,4 % pacientov, hypovitaminózou D trpelo 55 % detí, insuficienciou VD 28,6 % a suficientnú hladinu VD malo len 12 % pacientov (hodnotené podľa Račanskej [20]). Hoci, hladinu vitamínu D ovplyvňuje ročné obdobie, v našom súbore sme nezaznamenali výrazný rozdiel v hladinách vitamínu D medzi ročnými obdobiami.
Posledné štúdie odhalili, že vitamín D má široký vplyv na imunitnú moduláciu, diferenciáciu buniek, proliferáciu a reguláciu zápalu. Medzi možné mechanizmy, ktoré vysvetľujú súvislosť medzi hladinou vitamínu D a NAFLD, patrí zlepšenie sekrécie inzulínu a úprava inzulínovej rezistencie sprostredkované vitamínom D, pokles zápalu tukového tkaniva a pečeňového zápalu a fibrózy prostredníctvom regulácie receptora vitamínu D a niekoľkých cytokínov, ako napr. interleukínu-6, TNF-a alebo adiponektínu [13]. Spojitosť medzi hypovitaminózou D a NAFLD bola dokázaná vo viacerých štúdiach, ktoré použili na diagnostiku NAFLD buď zobrazovacie vyšetrenia [21], alebo bioptické vyšetrenie pečene [22]. Nízke hladiny vitamínu D boli spojené s histologickou závažnosťou NAFLD/NASH [22,23]. Aj v našej štúdii hladina vitamínu D negatívne korelovala so stupňom steatózy pečene u detských pacientov s nadváhou alebo obezitou. Signifikantne najnižšiu hladinu vitamínu D mala skupina pacientov so signifikantnou steatózou (HRI 1,5 a viac) oproti skupine pacientov bez steatózy a s presteatózou pečene.
Skupina pacientov so signifikantnou steatózou mala oproti pacientom bez steatózy väčší obvod pása, WHtR, vyššiu sérovú hladinu TAG a pečeňových enzýmov (AST, ALT, GMT). Naopak pacienti bez steatózy mali najvyššiu hladinu HDL cholesterolu a najnižšiu hladinu C-peptidu a inzulínu.
Adipocytokíny zohrávajú dôležitú úlohu v patogenéze NAFLD. Pomer leptínu k adiponektínu sa v posledných rokoch začal skúmať ako možný nový marker inzulínovej rezistencie a kardiometabolického rizika. Podľa niektorých štúdií tento biomarker koreluje s inzulínovou rezistenciou lepšie ako samotný adiponektín alebo leptín alebo dokonca HOMA. Viaceré štúdie u detí aj dospelých s NAFLD zaznamenali pozitívnu koreláciu medzi inzulínovou rezistenciou a NAFLD vo vzťahu k adipocytokínom a/alebo LAR [14,24–26]. Vo francúzskej štúdii publikovanej v roku 2016 skúmali súvislosť medzi hladinou vitamínu D, leptínom, adiponektínom a LAR a ich zmenami po 1-ročnej intervencii zmeny životného štýlu u detí. V tejto štúdii pozorovali vysokú prevalenciu nedostatku vitamínu D (40 %) u zdravých detí a adolescentov, ktorí neužívali doplnky vitamínu D a u obéznych detí a adolescentov boli zistené výrazne nižšie sérové koncentrácie 25 (OH) D v porovnaní s ostatnými. Lineárny regresný model však ukázal, že sérové koncentrácie 25 (OH) D súviseli s inzulínovou rezistenciou, ale nie významne s obezitou a pomerom LAR. Po 1-ročnej intervencii zmeny životného štýlu (vrátane úpravy stravovacích návykov a zvýšení fyzickej aktivity) sa koncentrácie 25 (OH) D významne zvýšili, čo potvrdzuje, že zdravý životný štýl chráni pred deficienciou vitamínu D u detí a adolescentov a takisto pred vznikom obezity [18]. V japonskej štúdii u dospelých pacientov LAR koreloval so steatózou pečene diagnostikovanej pomocou ultrasonografie. LAR koreloval aj s hladinou TAG a s pomerom celkového cholesterolu k HDL cholesterolu [27].
Hodnoty adipocytokínov v našom súbore sa líšili medzi skupinami. Signifikantne najvyššie plazmatické hodnoty leptínu boli v skupine pacientov s presteatózou. Najnižšie hodnoty adiponektínu mali pacienti so signifikantnou steatózou. Pomer leptínu k adiponektínu bol najvyšší v skupine pacientov so signifikantnou steatózou, hoci sme nezaznamenali štatisticky významný rozdiel medzi jednotlivými skupinami. HOMA-IR bol signifikantne najnižší v skupine pacientov bez steatózy pečene. Hladina leptínu u pacientov s presteatózou a signifikantnou steatózou pozitívne korelovala s obvodom bokov, WHtR, BMI a Hb1Ac. Negatívnu koreláciu sme zaznamenali vo vzťahu k TAG a AST. Plazmatická hladina adiponektínu u týchto pacientov negatívne korelovala s hladinou C-peptidu a hodnotou LFI.
Na diagnostiku hepatálnej steatózy sa v súčasnosti dostávajú do popredia rôzne neinvazívne zobrazovacie vyšetrenia či skórovacie algoritmy [5,8]. Stanovenie HRI pomocou ultrasonografie patrí k jednoduchým neinvazívnym a presným nástrojom na posúdenie stupňa steatotického poškodenia pečene. Stupeň steatózy pečene závisí od hodnoty HRI priamo úmerne [9,19]. U našich pacientov so steatózou pečene bola hodnota HRI 1,69 (1,58–1,80). HRI signifikantne pozitívne koreloval s hladinami pečeňových enzýmov a negatívne s hladinou VD.
Pomocou real-time elastografie sme stanovili elasticitu pečeňového parenchýmu, tzv. LFI, ktorý sa ukázal ako citlivý marker poukazujúci na skoré zmeny elasticity pečene u obéznych pacientov [9]. V skupine pacientov so steatózou LFI signifikantne pozitívne koreloval s obvodom pása, obvodom bokov, hmotnosťou, WHtR, BMI, kyselinou močovou, GMT, Hb1Ac, C-peptidom a HOMA-IR. LFI inverzne koreloval s hladinou VD a adiponektínom.
Hoci, boli popísané viaceré patomechanizmy ako nedostatok vitamínu D zasahuje do patogenézy NAFLD, je stále otázne aký vplyv má jeho suplementácia na priebeh tohto ochorenia. Bolo vykonaných viacero štúdií či už u dospelých, alebo detských pacientov, no výsledky sú často rozporuplné. Dasarathy et al skúmali vplyv suplementácie 2 000 IU VD denne u pacientov s NASH a jednoduchou steatózou pečene po dobu 6 mesiacov. Zistili, že táto dávka VD nebola dostačujúca na úpravu hypovitaminózy D u väčšiny pacientov s NASH [28]. Naopak, v štúdii egyptských autorov, kde skúmali efekt intramuskulárne podávaného vitamínu D jedenkrát mesačne, a to v dávke 200 000 IU po dobu 6 mesiacov, zistili signifikantný účinok VD na laboratórne parametre ako aj zlepšenie parametrov získaných tranzientnou elastografiou (kontrolný atenuovaný parameter a meranie tuhosti pečene) oproti skupine pacientov, ktorej bolo podávané placebo [29]. V ďalšej štúdii skúmali vplyv jednorázovej intramuskulárnej dávky vitamínu D (600 000 IU) v kombinácii so zmenou životného štýlu na NAFLD oproti skupine pacientov, ktorí zredukovali hmotnosť, ale nedostávali VD. V prvej skupine pacientov došlo k signifikantnému zlepšeniu sérovej hladiny AST a hladiny adiponektínu [30]. Je ešte potrebné vykonať viacero štúdií s cieľom zistiť optimálnu dávku vitamínu D, ktorá by viedla k zlepšeniu a úprave NAFLD spolu v kombinácii s úpravou životného štýlu.
Záver
Hypovitaminóza D postihuje veľké množstvo detských pacientov trpiacich nadváhou alebo obezitou. Súčasne obezita predstavuje aj významný rizikový faktor v rozvoji NAFLD. Vyše polovica pacientov s nadváhou alebo obezitou z nášho súboru mala utrasonograficky diagnostikovanú presteatózu alebo signifikantnú steatózu pečene. Zistili sme viaceré korelácie medzi hladinou vitamínu D a NAFLD u detí, či už v rámci antropometrických meraní, alebo v laboratórnych parametroch. Najnižšiu hladinu vitamínu D mali pacienti so signifikantnou steatózou (HRI 1,5 a viac). Hladina adipocytokínov sa taktiež menila so stupňom steatózy pečene a hypovitaminózy D, hoci sme nezaznamenali štatisticky signifikantnú koreláciu. Spoločným faktorom v patomechanizme NAFLD a hypovitaminózy D je inzulínová rezistencia. Hodnota HOMA-IR u pacientov s NAFLD negatívne korelovala s hladinou vitamínu D a pozitívne s hodnotou LFI. Aj keď bol preukázaný vzťah medzi hypovitaminózou D a NAFLD, otáznou ostáva úloha a vplyv suplementácie VD na priebeh tohto ochorenia. V ďalších štúdiách je potrebné sa zamerať na stanovenie dávky vitamínu D vhodnej na suplementáciu pre jednotlivé vekové kategórie a zistiť, aká optimálna dávka vedie k zlepšeniu NAFLD a úprave IR. Na sledovanie a posúdenie jednotlivých zmien, progresie či regresie ochorenia je vhodným nástrojom ultrasonografické stanovenie HRI a pomocou real-time elastografie LFI, najmä pre ich neinvazívnosť, časovú nenáročnosť a vysokú senzitivitu.
Doručené/Submitted: 11. 5. 2021
Prijaté/Accepted: 25. 5. 2021
MUDr. Marek Pršo, PhD.
Klinika detí a dorastu
JLF UK a UN Martin
Kollárova 2
036 01 Martin
Konflikt záujmov: Autori deklarujú, že text článku zodpovedá etickým štandardom, bola dodržaná anonymita pacientov, a vyhlasujú, že v súvislosti s predmetom článku nemajú finančné, poradenské ani iné komerčné záujmy.
Publikačná etika: Príspevok nebol doteraz publikovaný ani nie je v súčasnosti zaslaný do iného časopisu na posúdenie. Autori súhlasia s uverejnením svojho mena a e-mailového kontaktu v publikovanom texte.
Dedikácia: Práca bola podporená grantom VEGA1/ 0310/ 18 a grantom UK č. UK/ 257/ 2019.
Redakčná rada potvrdzuje, že rukopis práce splnil ICMJE kritériá pre publikácie zasielané do biomedicínskych časopisov.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their name and e-mail in the published article/ manuscript.
Dedication: The work was supported by grant VEGA1/ 0310/ 18 and grant UK no. UK/ 257/ 2019.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Zdroje
1. Pludowski P, Holick MF, Grant WB et al. Vitamin D supplementation guidelines. J Steroid Biochem Mol Biol 2018; 175 : 125–135. doi: 10.1016/j.jsbmb.2017.01.021.
2. Nosáková L, Bánovčin P, Pindura M et al. Prevalencia hypovitaminózy D a poruchy glukózovej tolerancie u pacientov s neuroendokrinnými tumormi podstupujúcich liečbu somatostatínovými analógmi. Gastroent Hepatol 2020; 74 (5): 410–414. doi: 10.14735/amgh2020410.
3. Ayina CN, Endomba FT, Mandengue SH et al. Association of the leptin-to-adiponectin ratio with metabolic syndrome in a sub-Saharan African population. Diabetol Metab Syndr 2017; 9 (1): 66. doi: 10.1186/s13098-017 - 0265-6.
4. Siebert T, Malachovský I, Statelová D et al. Motivational interviewing for improving periodontal health. Bratisl Lek Listy 2020; 121 (9): 670–674. doi: 10.4149/BLL_2020_110.
5. Brůha R, Dvořák K, Fejfar T et al. Doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu nealkoholové tukové choroby jater. Gastroent Hepatol 2020; 74 (2): 103–110. doi: 10.14735/amgh2020103.
6. Cimini FA, Barchetta I, Carotti S et al. Relationship between adipose tissue dysfunction, vitamin D deficiency and the pathogenesis of non-alcoholic fatty liver disease. World J Gastroenterol 2017; 23 (19): 3407–3417. doi: 10.3748/wjg.v23.i19.3407.
7. Shah J, Okubote T, Alkhouri N. Overview of updated practice guidelines for pediatric nonalcoholic fatty liver disease. Gastroenterol Hepatol 2018; 14 (7): 407–414.
8. Fedelešová M, Kupčová V, Szántová M et al. Možnosti použitia neinvazívnych metód pri nealkoholovej tukovej chorobe pečene. Gastroent Hepatol 2017; 71 (4): 325–332. doi: 10.14735/amgh2017325.
9. Pršo M, Kozár M, Kráľová T et al. Ultrasonografické hodnotenie steatózy pečene u obéznych pediatrických pacientov. Gastroent Hepatol 2018; 72 (6): 473–478. doi: 10.14735/amgh2018473.
10. Michnová Z, Pršo M, Zúbriková L et al. Diagnostika ložiskových lézí jater u dětí s využitím kontrastní ultrasonografie. Gastroent Hepatol 2019; 73 (6): 481–487. doi: 10.14735/amgh2019481.
11. Serai SD, Panganiban J, Dhyani M et al. Imaging modalities in pediatric NAFLD. Clin Liver Dis 2021; 17 (3): 200–208. doi: 10.1002/cld.994.
12. Eliades M, Spyrou E. Vitamin D: a new player in non-alcoholic fatty liver disease? World J Gastroenterol 2015; 21 (6): 1718–1727. doi: 10.3748/wjg.v21.i6.1718.
13. Chen LW, Chien CH, Kuo SF et al. Low vitamin D level was associated with metabolic syndrome and high leptin level in subjects with nonalcoholic fatty liver disease: a community-based study. BMC Gastroenterol 2019; 19 (1): 126. doi: 10.1186/s12876-019-1040-y.
14. Angın Y, Arslan N, Kuralay F. Leptin-to-adiponectin ratio in obese adolescents with nonalcoholic fatty liver disease. Turk J Pediatr 2014; 56 (3): 259–266.
15. Cole TJ, Lobstein T. Extended international (IOTF) body mass index cut-offs for thinness, overweight and obesity. Pediatr Obes 2012; 7 (4): 284–294. doi: 10.1111/j.2047-6310.2012.00064.x.
16. Zimmet P, Alberti KG, Kaufman F et al. IDF Consensus Group. The metabolic syndrome in children and adolescents – an IDF consensus report. Pediatr Diabetes 2007; 8 (5): 299–306. doi: 10.1111/j.1399-5448.2007.00271.x.
17. WHO. Waist circumference and waist-hip ratio. 2008 [online]. Available from: http: //apps.who.int/iris/bitstream/handle/10665/44583/ 9789241501491_eng.pdf; jsessionid=F20C447A 6049B0A6E960C774A000F65A?sequence=1.
18. Rambhojan C, Larifla L, Clepier J et al. Vitamin D status, insulin resistance, leptin-to-adiponectin ratio in adolescents: results of a 1-year lifestyle intervention. Open Access Maced J Med Sci 2016; 4 (4): 596–602. doi: 10.3889/oamjms.2016.131.
19. Webb M, Yeshua H, Zelber-Sagi S et al. Diagnostic value of a computerized hepatorenal index for sonographic quantification of liver steatosis. AJR Am J Roentgenol 2009; 192 (4): 909–914. doi: 10.2214/AJR.07.4016.
20. Račanská E. Vitamín D – hormón, ktorý nám chýba. Prakt lekárn 2014; 4 (2–3): 53–55.
21. Zhai HL, Wang NJ, Han B et al. Low vitamin D levels and non-alcoholic fatty liver disease, evidence for their independent association in men in East China: a cross-sectional study (Survey on Prevalence in East China for Metabolic Diseases and Risk Factors (SPECT-China)). Br J Nutr 2016; 115 (8): 1352–1359. doi: 10.1017/S0007114516000386.
22. Manco M, Ciampalini P, Nobili V. Low levels of 25-hydroxyvitamin D (3) in children with biopsy-proven nonalcoholic fatty liver disease. Hepatology 2010; 51 (6): 2229. doi: 10.1002/hep.23 724.
23. Nelson JE, Roth CL, Wilson LA et al. Vitamin D deficiency is associated with increased risk of non-alcoholic wteatohepatitis in adults with non-alcoholic fatty liver disease: possible role for MAPK and NF-kB? Am J Gastroenterol 2016; 111 (6): 852–863. doi: 10.1038/ajg.2016.51.
24. Nier A, Huber Y, Labenz C et al. Adipokines and endotoxemia correlate with hepatic steatosis in Non-Alcoholic Fatty Liver Disease (NAFLD). Nutrients 2020; 12 (3): 699. doi: 10.3390/nu12030699.
25. Ramírez-Vélez R, González-Ruíz K, González-Jiménez E et al. Serum leptin as a mediator of the influence of insulin resistance on hepatic steatosis in youths with excess adiposity. Nutr Metab Cardiovasc Dis 2021; 31 (4): 1308–1316. doi: 10.1016/j.numecd.2020.12.014.
26. Małecki P, Mania A, Tracz J et al. Adipocytokines as risk factors for development of nonalcoholic fatty liver disease in children. 2021 [online]. Avaible from: https: //www.sciencedirect.com/science/article/abs/pii/S0973688321000 542.
27. Mikami K, Endo T, Sawada N et al. Leptin/adiponectin ratio correlates with hepatic steatosis but not arterial stiffness in nonalcoholic fatty liver disease in Japanese population. Cytokine 2020; 126 : 154927. doi: 10.1016/j.cyto.2019.154927.
28. Dasarathy J, Varghese R, Feldman A et al. Patients with nonalcoholic fatty liver disease have a low response rate to vitamin D supplementation. J Nutr 2017; 147 (10): 1938–1946. doi: 10.3945/jn.117.254292.
29. Gad AI, Elmedames MR, Abdelhai AR et al. Efficacy of vitamin D supplementation on adult patients with non-alcoholic fatty liver disease: a single-center experience. Gastroenterol Hepatol Bed Bench 2021; 14 (1): 44–52.
30. Sakpal M, Satsangi S, Mehta M et al. Vitamin D supplementation in patients with nonalcoholic fatty liver disease: a randomized controlled trial. JGH Open 2017; 1 (2): 62–67. doi: 10.1002/jgh3.12010.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Kvíz z klinické praxeČlánek Heydeho syndróm
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2021 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Klinická a experimentální gastroenterologie
- Kvíz z klinické praxe
- Infekce SARS-CoV-2 a postižení slinivky břišní
- Parkinsonova choroba a postihnutie GITu
- Heydeho syndróm
- Cytomegalovirová enteritida jako neobvyklý zdroj krvácení do gastrointestinálního traktu
- Význam sarkopenie a myosteatózy u kandidátů transplantace jater na peritransplantační průběh a přežívání pacientů a štěpů
- Sérové protilátky proti laminarinu u kolorektálního karcinomu: prospektivní pilotní studie
- Endoscopic management of ampullary tumors: European Society of Gastrointestinal Endoscopy (ESGE) Guideline and Endoscopic management of superficial nonampullary duodenal tumors: European Society of Gastrointestinal Endoscopy (ESGE) Guideline
- Neobvyklý případ systémové AA amyloidózy
- Vitamín D a nealkoholová steatóza pečene u detí
- Vliv CDED diety na rozvoj remise u pacienta s přetrvávající aktivitou Crohnovy choroby – kazuistické sdělení a zkušenosti pracoviště
- Aktualita z kongresu EASL-ILC: pokroky v poznání a léčbě primární biliární cholangitidy
- Výběr z mezinárodních časopisů
- Správná odpověď na předchozí kvíz Dlouhodobé bolesti břicha
- Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Heydeho syndróm
- Infekce SARS-CoV-2 a postižení slinivky břišní
- Vliv CDED diety na rozvoj remise u pacienta s přetrvávající aktivitou Crohnovy choroby – kazuistické sdělení a zkušenosti pracoviště
- Vitamín D a nealkoholová steatóza pečene u detí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



