-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Akutní poškození ledvin v gastroenterologii
Acute kidney injury in gastroenterology
Introduction: Acute kidney injury (AKI) is a common and mostly severe clinical syndrome associated with worsening morbidity and mortality of patients in many fields of medicine, including gastroenterological diseases.
Backgrounds: Many of gastroenterological disorders are associated with acute kidney injury (AKI) or with chronic nephropathies. The pathophysiology of AKI in gastroenterology is mostly multifactorial and the influence of these factors on histopathological findings in renal tissue may be considerable.
Aims: Appropriate AKI diagnosis and disease severity with possibility of decrease progression of AKI to chronic nephropathy. Necessary is also an adequate therapy of primary gastroenterological disease.
Conclusion: Early diagnosis of secondary AKI and initiation of adequate preventive and therapeutic measures can improve patient‘s outcome and decrease a progression to chronic nephropathy.
Conflict of Interest: The authors declare that the article/manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/manuscript has not been published or is currently being submitted for another review. The authors agree to publish their name and e-mail in the published article/ manuscript.
Dedication: The article/manuscript is not supported by a grant nor has it been created with the support of any company.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for bio medical papers.
Keywords:
glomerulonephritis – tubulointerstitial nephritis – acute kidney injury – oxalate nephropathy
Autoři: Petejová N. 1,2,3; Martínek A. 1,2; Zadražil J. 3; Teplan V. 2,4,5
Působiště autorů: Interní klinika FN Ostrava 1; Katedra interních oborů, LF OU, Ostrava 2; III. Interní klinika – nefrologická, revmatologická a endokrinologická, LF UP a FN Olomouc 3; Klinické a výzkumné centrum pro střevní záněty ISCARE a. s., Praha 4; Subkatedra nefrologie, Institut postgraduálního vzdělávání ve zdravotnictví, Praha 5
Vyšlo v časopise: Gastroent Hepatol 2020; 74(4): 339-349
Kategorie: Vybrané kapitoly z vnitřního lékařství: přehledová práce
doi: https://doi.org/10.14735/amgh2020339Souhrn
Úvod: Akutní poškození ledvin (AKI – acute kidney injury) je závažný klinický syndrom vedoucí ke zvýšené mortalitě a morbiditě pacienta v mnoha oborech medicíny, nevyjímaje pacienty s gastroenterologickými nemocemi.
Východisko: Mnoho gastroenterologických onemocnění je asociováno s akutním anebo s chronickým poškozením ledvin. Patofyziologicky se na vzniku renálního poškození podílí mnoho faktorů, a ovlivňuje tím výsledný klinický a histopatologický obraz AKI.
Cíle: Diagnostika AKI a tíže renálního poškození s možností pozitivního ovlivnění progrese AKI při správně vedené terapii základního onemocnění a sekundárního poškození ledvin.
Závěr: Včasná diagnóza sekundárního AKI a zahájení preventivních a terapeutických postupů mohou napomoci ke zlepšení klinického výstupu nemocných a zpomalit progresi do chronické nefropatie.
Klíčová slova:
akutní poškození ledvin – tubulointersticiální nefritida – glomerulonefritida – oxalátová nefropatie
Úvod
Diagnostika akutního poškození ledvin (AKI – acute kidney injury) jako závažného klinického stavu s náhle vzniklým poklesem renálních funkcí prošla v posledních dekádách několika revizemi s cílem zejména rychlého rozpoznání choroby, včasného zahájení léčby a zlepšení klinického výstupu pacienta. Typicky bývá AKI součástí syndromu multiorgánové dysfunkce u kriticky nemocného a přispívá ke zvýšené morbiditě a mortalitě této skupiny pacientů. Samotná diagnostika AKI je založena na hodnocení dvou základních parametrů:
- elevace sérového kreatininu;
- poklesu diurézy.
Podle těchto parametrů jsou pacienti klasifikováni do tří stadií definovaných podle KDIGO (Kidney Disease Improving Global Outcomes) klasifikace [1]. V nejtěžším stadiu je pacient obvykle oligo/anurický a/nebo s hodnotou sérového kreatininu > 353,6 μmol/l anebo jeho stav vyžaduje zahájení léčby mimotělní eliminační náhradou (RRT – renal replacement therapy). Uvedená KDIGO doporučení pro diagnostiku a následně také pro léčbu AKI byla komplexně definována v roce 2012. V mezidobí se situace zejména v intenzivní medicíně měnila v závislosti na přibývajících infekčních, nefrotoxických a environmentálních etiologických faktorech a některá doporučení i definice bylo nutné upravit. V roce 2017 iniciativa zaměřená na akutní onemocnění (tzv. ADQI – Acute Dialysis Quality Initiative) ve svém 16. konsenzu upravila stávající klasifikaci AKI s přesnější definicí syndromu akutní renální choroby (AKD – acute kidney dis-ease) a s hodnocením návratu renálních funkcí. Podle závěrů ADQI je AKI definováno jako náhlá ztráta renálních funkcí bezprostředně po inzultu a AKD je akutní nebo subakutní poškození ledvin trvající v průběhu 7–90 dní od inzultu. Po uplynutí této doby již onemocnění ledvin označujeme jako chronické v případě, že přetrvává snížení renálních funkcí nebo je nadále potřeba RRT terapie [2].
Epidemiologie a etiologie akutního poškození ledvin v gastroenterologii
Z klinického hlediska je AKI děleno podle epidemiologických a etiologických činitelů na:
- v komunitě získané;
- nozokomiální;
- AKI u kriticky nemocných.
Z hlediska patofyziologie jsou příčiny vzniku AKI buď prerenální, renální a postrenální, anebo ischemicko-reperfuzní, septické a toxické.
V samotné gastroenterologii doprovází tento syndrom mnoho onemocnění a patofyziologie vzniku AKI a AKD je zásadně ovlivněna vyvolávajícím patologickým inzultem anebo také nezbytnou následnou potenciálně nefrotoxickou farmakoterapií. Obecnou incidenci AKI v gastroenterologii lze stanovit jen velmi obtížně a obvykle je udávána u jednotlivých podtypů onemocnění. Možné příčiny vzniku AKI v gastroenterologii jsou uvedeny v tab. 1 [3,4].
Tab. 1. Možné příčiny akutního poškození ledvin v gastroenterologii.
Possible causes of acute kidney injury in gastroenterology.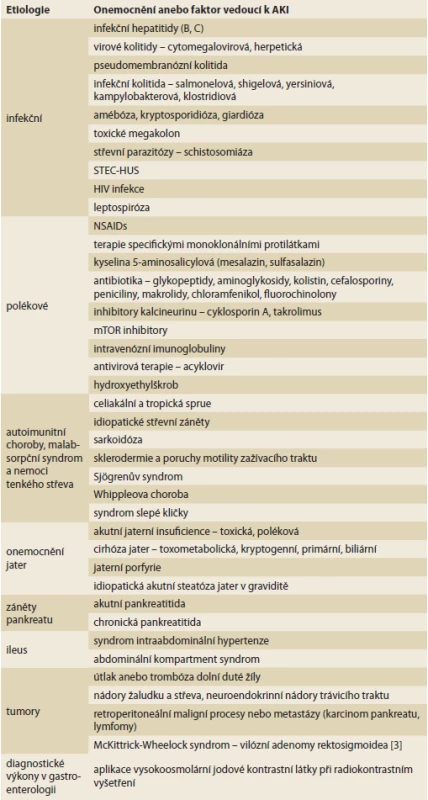
AKI – akutní poškození ledvin, STEC-HUS – shigatoxin Escherichie coli – hemolyticko-uremický syndrom, HIV – human immunodefi ciency virus, NSAIDs – nesteroidní antifl ogistika – pokračování. Možné příčiny akutního poškození ledvin v gastroenterologii.
– continuing. Possible causes of acute kidney injury in gastroenterology.
AKI – akutní poškození ledvin, IgG4 – imunoglobuln G4 Klinicko-patologické stavy vedoucí k AKI mohou rovněž způsobovat chronickou nefropatii (CKD – chronic kidney disease) v závislosti na tíži renálního postižení, stavu ledvin v předchorobí a na vyvolávajícím činiteli.
Mnoho onemocnění gastrointestinálního traktu (GIT) vede sekundárně k onemocnění ledvin, které se od svého počátku jeví jako chronické např. chronické glomerulonefritidy (GN) typu imunoglobulin A (IgA) nefropatie, membranózní GN anebo k sekundární amyloidóze. V jejich terénu také může dojít k akutnímu poklesu renálních funkcí při jiné vyvolávající příčině, např. vlivem dehydratace anebo potenciálně nefrotoxické léčby.
Klinický obraz akutního poškození ledvin
Klinické a metabolické důsledky AKI jsou pro pacienta obvykle závažné a může docházet k uvedeným komplikacím:
Oligo/anurie s rizikem těžkého tekutinového přetížení a s obrazem kardiálního selhání, otoku mozku, poruchy plicní poddajnosti a jejich edému, k poruše funkce jater při venostáze, k poruše hojení ran, ke střevní malabsorpci a ke snížení perfuzního tlaku v ledvinách. Důsledkem renální hypoperfuze a hypervolemie je zvýšení intersticiálního tlaku v ledvinném parenchymu a pokles glomerulární filtrace (eGFR – estimated glomerular filtration rate) se zadržováním solí a vody [5]. V klinickém obraze je nutné zhodnotit hmotnostní přírůstek, přítomnost otoků (nemusí být prezentovány u neadekvátní sekrece antidiuretického hormonu – Schwartz-Bartterův syndrom), podle možností vyloučit venostázu na rentgenovém snímku plic a zhodnotit hemodynamické ukazatele (krevní tlak, centrální žilní tlak).
Metabolický rozvrat s rizikem vzniku hyperkalemie (K+ > 6,5 mmol/l) a poruch srdečního rytmu ve smyslu komorové tachykardie a fibrilace. Dalším důsledkem je metabolická acidóza při poruše acidifikační schopnosti ledvin charakterizovaná poklesem pH < 7,35 a standardních bikarbonátů < 22 mmol/l s klinickými projevy hyperventilace, obnubilace vědomí a tachykardie.
Další iontové dysbalance, které mohou mít souvislost s primární příčinou onemocnění a AKI, bývají také jejich důsledkem:
- hyperkalcemie (Ca2+ > 2,8 mmol/l, ionizované kalcium > 1,4 mmol/l) – může být paraneoplastickým projevem anebo v kombinaci s akutní pankreatitidou a dehydratací je nezbytné myslet na primární hyperparatyreózu;
- hypo-/hypernatremie (Na+ <135 mmo/l anebo Na+ > 145 mmol/l – je zpravidla asociována se změnou v metabolizmu sodíku a extracelulární tekutiny – může být spojena s hypervolemií, normovolemií anebo s dehydratací pacienta [6];
- hypokalemie (K+ < 3,5 mmol/l) – může se projevit poruchami srdečního rytmu a být spojena s dehydratací a průjmem (vhodné je vyloučení endokrinního nádoru GIT – např. vipom).
Samotné zvracení, nadužívání laxativ, průjem a malabsorpce vedou často k AKI, ale mohou způsobovat rovněž hypokalemii a metabolickou alkalózu. U jaterní cirhózy může být hypokalemie asociována se sekundárním hyperaldosteronizmem při jaterním onemocnění.
V této přehledové práci se pokusíme přiblížit nejčastější formy a příčiny AKI v souvislosti s onemocněním a/nebo s léčbou onemocnění trávicího traktu.
Ischemicko-reperfuzní akutní poškození ledvin
Ischemicko-reperfuzní AKI je charakterizováno poruchou anebo akutní blokádou prokrvení ledvinné tkáně s následnou obnovou krevního průtoku a reoxygenací. Nastupující reoxygenace a obnova perfuze tkáně je spojena s aktivací zánětlivé odpovědi a nezřídka s poškozením parenchymu ledvin. Zánětlivá reakce na ischemii orgánu s poškozením cévního endotelu a na mikrovaskulární dysfunkci zahrnuje vrozenou i získanou imunitní odpověď, aktivaci komplementu, trombocytů a neadekvátní aktivaci koagulační kaskády. Konečným výsledkem probíhajícího patofyziologického procesu je aktivace buněčné smrti apoptózou, autofagií anebo programovanou nekrózou. Predilekčně bývají postiženy buňky proximálního tubulu ledvin [7]. S uvedenou formou AKI se můžeme v gastroenterologii setkat po transplantaci orgánů, např. po transplantaci jater, kde přispívá ke zvýšené mortalitě pacientů anebo k případné potřebě chronické hemodialyzační terapie. Vysokým rizikovým faktorem pro vznik a vývoj posttransplantačního AKI je u pacientů s jaterní cirhózou tzv. MELD (model for end-stage liver disease) skóre, jímž je hodnocena závažnost a pokročilost onemocnění jater. Z jiných koincidujících faktorů lze uvést ischemické poškození jater se sekundárním AKI, perioperační a postoperační krvácení a šokové stavy [8,9]. Za zmínku také stojí, že až 70 % AKI u pacientů s jaterní cirhózou je vyvoláno prerenálními faktory [10]. Další příčinou ischemie ledvin může být těžký pokles renálního perfuzního tlaku při dehydrataci a šoku jakékoli etiologie např. při gastroenteritidě anebo při kolitidě, event. i v kombinaci s nefrotoxickým působením patogenu. Uvést lze těžkou bakteriální, virovou, pseudomembranózní kolitidu, průjem a zvracení, akutní pankreatitidu s únikem tekutin do intersticia (tab. 1) anebo dále velké tekutinové ztráty u pacientů s ileostomií [11].
Glomerulonefritida
Poškození glomerulů na podkladě aktivace imunitních, zánětlivých anebo hereditárních mechanizmů ve smyslu GN může probíhat akutně i chronicky.
Pro úplnost přehledu je nezbytné vzpomenout také tuto neméně závažnou nefrologickou diagnózu asociovanou s některými z gastroenterologických onemocnění. GN může být doprovázena různým stupněm tíže poškození ledvin i s obrazem těžkého AKI a nutností urgentního zahájení RRT. Základní rozdělení, klinický a laboratorní nález a možná souvislost s gastroenterologickou nemocí jsou komplexně shrnuty v tab. 2 [12–18].
Tab. 2. Glomerulonefritidy – rozdělení a možná asociace s gastroenterologickým a do gastrointestinální traktu zasahujícím onemocněním [12–18].
Glomerulonephritis – division and possible association with gastroenterological and gastrointestinal diseases affecting the disease [12–18].![Glomerulonefritidy – rozdělení a možná asociace s gastroenterologickým a do gastrointestinální traktu zasahujícím onemocněním [12–18].<br>
Glomerulonephritis – division and possible association with gastroenterological and gastrointestinal diseases affecting the disease [12–18].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/d2570a9c66206e92406c871580e5ff05.png)
GN – glomerulonefritida, GIT – gastrointestinální trakt, eGFR – glomerulární filtrace, AKI – akutní poškození ledvin, HELLP syndrom – hemolýza, elevace jaterních enzymů, trombocytopenie, HUS – hemolyticko-uremický syndrom, CMV – cytomegalovirus, HIV – human immunodeficiency virus, MCD – minimální změny glomerulů, Ig – imunoglobulin, TBC – tuberkulóza, NSAIDs – nesteroidní antiflogistika, ANCA – protilátky proti cytoplasmě neutrofilů, GBM – glomerulární bazální membrána V diferenciální diagnostice GN může napomoct vyšetření specifických autoimunitních protilátek. U membranózní GN bývají pozitivní anti-PLA2R (proti receptoru fosfolipázy A2) a anti-THSD7A (trombospondin). Antinukleární protilátky, protilátky proti cytoplazmě neutrofilů (ANCA – antineutrophil cytoplasmic antibodies) a protilátky pro bazální membráně glomerulů (antiGBM), jsou přítomny u rychle progredujících GN se srpky. Protilátky proti extrahovatelným endonukleárním antigenům a antinukleární protilátky nacházíme u systémových onemocnění pojiva. K přesnější diagnóze a následné adekvátní léčbě může nefrologovi napomoct provedení biopsie ledviny.
Akutní tubulointersticiální nefritida
Akutní tubulointersticiální nefritida (TIN) je jednou z případně reverzibilních možností AKI a bývá velmi často asociována s potenciálně nefrotoxickou terapií. Klinicky se projevuje různým stupněm AKI, zpravidla malou proteinurií (< 1,0 g/24 hod), eozinofilurií, mikroskopickou hematurií, zvýšenou teplotou a kožní dermatitidou (rash). Z léčiv frekventně užívaných v gastroenterologii je v souvislosti s akutní TIN zmiňována kyselina 5-aminosalicylová (5-ASA – mesalazin, sulfasalazin), využívaná zejména v léčbě idiopatických střevních zánětů (IBD – inflammatory bowel disese) [19]. Sulfasalazin v renálních tubulárních buňkách indukuje mitochondriální dysfunkci a těžký oxidační stres s tvorbou reaktivních kyslíkových radikálů [20]. Jiným projevem akutní nefrotoxicity sulfasalazinu může být těžká krystalická nefropatie [21]. Obraz akutní TIN se může vyskytovat také u pacientů dlouhodobě léčených infliximabem v kombinaci s 5-ASA [22] anebo u pacientů s Crohnovou nemocí (CD – Crohn’s disease) léčených vedolizumabem [23]. Histopatologický nález u akutní polékové TIN je charakterizován difuzní eozinofilní a zánětlivou infiltrací v renálních tubulech a v intersticiu. Extraintestinální nález bývá u CD doprovázen lymfocytární infiltrací také jiných orgánů než střeva, ale obecně nebývají přítomny eozinofily. Tento fakt může napomoct v diferenciální diagnostice polékového a jiného AKI, zejména u této skupiny pacientů [24]. Závažnou polékovou komplikací může být akutní TIN vyvolaná blokátory protonové pumpy (PPI – proton-pump inhibitors), které jsou velmi často používanými léky právě v gastroenterologii, dále antibiotiky (např. cefalosporiny, fluorochinolony, sulfonamidy, peniciliny, karbapenemy) nebo kombinací léčiv [25]. Ze 133 biopticky potvrzených případů akutní TIN připadalo až 70 % na polékové komplikace, 20 % na autoimunitní choroby a pouze 4 % byly infekční. Významnou roli může také hrát věk pacienta, kdy se polékové akutní TIN vyskytují obecně častěji u pacientů starších 65 let než v mladším věku [26]. Ve studii zahrnující 290 592 pacientů starších 66 let léčených PPI byla zjištěna incidence AKI u 13,49/1 000 osob ročně a akutní TIN u 0,32/1 000 osob ročně oproti kontrolní skupině, kde byla incidence nemocí nižší [27]. Kromě AKI (míra relativního rizika (RR) 1,44) a akutní TIN (RR 3,61) mohou PPI nežádoucím způsobem přispívat k rozvoji CKD (RR 1,36) a terminálního stadia ledvin (RR 1,42) s eventuální potřebou hemodialyzační terapie [28].
Akutní TIN může být rovněž jedním z projevů IgG4 vázaných onemocnění, na které je třeba myslet v rámci komplexní diferenciálně diagnostické rozvahy [29]. Bývá přítomna také u systémových autoimunitních chorob, z nichž lze zmínit Sjögrenovu nemoc. Granulomatózní akutní TIN se může vyskytovat jako součást multisystémového onemocnění u sarkoidózy s klinickým obrazem zahrnujícím mimo lymfatického a plicního postižení také např. akutní pankreatitidu a vředové onemocnění duodena [30].
Akutní poškození ledvin u pacientů s IBD
U mnoha gastroenterologických onemocnění dochází k poškození ledvin kombinovaným způsobem, ale IBD jsou oproti jiným poněkud specifičtější. Extraintestinální symptomy bývají častěji vyjádřeny u CD oproti ulcerózní kolitidě (UC – ulcerative colitis), ale to nic nemění na faktu, že AKI může být podmíněno mnoha patofyziologickými procesy, které mají IBD společné. Na vzniku AKI se tak může na jedné straně podílet dehydratace a hypovolemie při akutní exacerbaci průjmového onemocnění a na straně druhé také imunologické a zánětlivé mechanizmy podmíněné primárním onemocněním střeva a nezbytnou farmakoterapií. Histopatologický obraz renálního postižení u pacientů s IBD byl podle závěrů americké studie různorodý a ve 24 % případů odpovídal IgA nefropatii, v 19 % akutní nebo chronické intersticiální nefritidě, ve 12 % arterioskleróze, v 8 % akutnímu tubulárnímu poškození, ve 23 % jiným GN (fokálně segmentální glomeruloskleróza, membranózní GN, minimální změny glomerulů, pauciimunní GN), ostatní nálezy odpovídaly amyloidóze, trombotickým změnám, cholesterolové embolii, C1q nefropatii a nemoci tenkých membrán [12]. V případě pozitivity ANCA protilátek a nálezu nefrotické proteinurie s náhlým poklesem renálních funkcí lze předpokládat rozvoj rychle progredující GN s nutností zahájení specifické imunosupresivní terapie. V případové studii byla potvrzena u pacienta s CD IgA nefropatie se srpky [18]. To znamená, že postižení ledvin u tohoto typu onemocnění není jednoduchou záležitostí a při diferenciálně diagnostických rozpacích, event. při vyloučení,,běžných“ příčin, jako je dehydratace a hypovolemie, v případě, že renální poškození a zejména proteinurie dále progreduje, je namístě zvážit biopsii ledvin.
Akutní tubulární nekróza
Těžší formu AKI než v případě TIN představuje akutní nekróza tubulárních buněk (ATN) následována zpravidla velmi rychlým poklesem renálních funkcí. V posledních letech je dávána do popředí teorie, že se více jedná o programovanou anebo regulovanou nekrózu, tzv. nekroptózu, s poškozením různých renálních buněk a predilekčním postižením buněk proximálního tubulu. Nekroptóza je spojena s aktivací tvorby specifických proteinů, např. RIPK1, RIPK3 a MLKL podle charakteru spouštěcího inzultu a jeho vazby na transmembránový protein, např. pro TNF-, lipopolysacharid anebo receptor pro interferony. Může být asociována s ischemickým poškozením ledvin, lékovou toxicitou (cisplatina, glykopeptidová antibiotika, aminoglykosidy) anebo vzniknout v souvislosti s rhabdomyolýzou (RM) [31]. Formy buněčné smrti s aktivací jednotlivých signálních drah, které k ní vedou, závisí na etiologickém faktoru anebo na jejich kombinaci, a tak se můžeme u zmíněných stavů setkat i s tzv. ferroptózou, parthanatos anebo s apoptózou. Ischemie a RM mohou doprovázet těžkou hemoragicko-nekrotizující akutní pankreatitidu anebo akutní gastroenteritidu jakékoli etiologie a také IBD, jak již bylo zmíněno. Návrat renálních funkcí v tomto případě závisí na tíži původního inzultu a trvání choroby. Jednou z možných příčin AKI u pacientů s jaterní cirhózou může být také ATN, kde bývá asociována se systémovým zánětem při infekci anebo s kardiální dysfunkcí a poruchou perfuze ledvin [32].
Hemolyticko-uremický syndrom
Hemolyticko-uremický syndrom (HUS) je charakterizován mikroangiopatickou hemolytickou anémií, sekundárním AKI a trombocytopenií. Etiologie HUS může být různorodá, od formy asociované se shigatoxinem Escherie coli (STEC-HUS), polékové, paraneoplastické, geneticky podmíněné až po tzv. atypickou formu. Patofyziologicky se jedná o protrombotický a proinflamační stav endoteliálního povrchu buněk s následnou aktivací fibrinu a trombocytů, s tvorbou trombů v kapilárách a arteriolách vedoucí k výsledné klinické triádě. S gastroenterologií úzce souvisí STEC-HUS, který se typicky projevuje hemoragickou gastroenteritidou s krvavým průjmem, bolestmi břicha, horečkou a zvracením. Kromě renálního poškození se může STEC-HUS prezentovat také postižením srdce (infarkt myokardu), neurologickou symptomatologií, nekrózou a perforací střeva, akutní pankreatitidou anebo cholecystitidou [33]. V séru pacienta je při prehepatálním typu ikteru způsobeném hemolýzou zvýšený nekonjugovaný bilirubin, laktátdehydrogenáza, renální parametry (urea a kreatinin), pozitivní je nález schistocytů, anémie a snížená je koncentrace haptoglobinu. V moči je přítomna hematurie a proteinurie anebo je pacient zcela oligo/anurický. Součástí diagnostického postupu je také kultivace stolice a průkaz bakteriálního toxinu. V některých klinických případech je nutné diferenciálně diagnosticky odlišit především IBD anebo jiné kolitidy [34].
Sekundární amyloidóza
Obecně rozlišujeme několik typů amyloidózy a k základním patří AL amyloidóza (lehké řetězce Ig) a sekundární AA amyloidóza. Všechny typy amyloidózy jsou způsobeny extracelulární depozicí amyloidu a v případě nefropatie dochází k poškození tubulů, intersticia, glomerulů (mezangium) a cév ledvin. Poškození ledvin sekundární amyloidózou při onemocněních GIT je způsobeno sérovým amyloidem A (AA amyloidóza) při chronicky probíhající aktivní zánětlivé nemoci, různých maligních onemocněních a u některých vrozených abnormalit. S geneticky podmíněnými syndromy jsou asociovány např. apolipoproteinová anebo lyzozymová amyloidóza [35]. Klinicky a laboratorně se amyloidóza ledvin projevuje různě závažnou proteinurií, v případě nefrotického typu může být doprovázena otoky, hypertenzí a snížením renálních funkcí. Diagnóza je stanovena biopticky s potvrzením depozitů amorfní bílkoviny barvící se konžskou červení v ledvinném parenchymu. Prevalence AA amyloidózy u pacientů s IBD byla ve studii zahrnující 1 006 pacientů 0,5 % a obecně 1 % u pacientů s CD [36].
Oxalátová nefropatie
Gastrointestinální onemocnění může vést k AKI ve formě sekundární oxalátové nefropatie vznikající zvýšeným ukládáním oxalátu v ledvinném parenchymu. Oxalát vzniká oxidací z glyoxalátu a metabolickou přeměnou kyseliny askorbové a tryptofanu. Oxaláty jsou za fyziologických okolností vstřebávány v tenkém střevě (ileum) a tzv. hyperoxalurie vzniká při jejich zvýšeném přísunu v potravě anebo při malabsorpci tuků a žlučových kyselin se zvýšenou vazbou kalcia a také při zvýšené střevní absorpci oxalátů. Ke zvýšené oxalurii napomáhá mimo jiného také dehydratace a nízké pH moči [37]. Vyskytovat se tak může u pacientů se steatoreou při chronické pankreatitidě, při celiakální a tropické sprue, u biliární cirhózy, u idiopatických anebo infekčních střevních zánětů anebo u stavů po resekcích tenkého střeva s gastrickými a intestinálními bypassy. Prevalence hyperoxalurie u pacientů s chronickou pankreatitidou je vysoká a pokles renálních funkcí přímo úměrně klesá s koncentrací oxalátů v moči [38]. Kromě oxalátové litiázy a kalcium oxalátových depozitů se může u akutní oxalátové nefropatie vyskytovat subnefrotická proteinurie (< 3,5 g/24 hod) a u třetiny případů také hematurie. Závažnou komplikací je enterická hyperoxalurie u pacientů s CD, u nichž může vést k recidivující urolitiáze, CKD a k systémové oxalóze [39]. Histopatologicky lze v renálním parenchymu objektivizovat depozita oxalátových krystalů v tubulech anebo v intersticiu, akutní tubulární poškození, atrofii tubulárních buněk a intersticiální mononukleární infiltraci. Z klinického hlediska u AKI vzniklého sekundární oxalátovou nefropatií vyžadovalo až 55 % ze 108 sledovaných pacientů podle dostupných pramenů hemodialyzační terapii [40].
Hepatorenální syndrom
Zvláštní postavení mezi příčinami AKI má hepatorenální syndrom (HRS) a řadí se k příčinám především prerenálním, nejedná se tedy primárně o onemocnění ledvinného parenchymu. Podmínkou pro to, aby mohla být vůbec diagnóza HRS stanovena, je vždy přítomnost jaterní cirhózy, akutního selhání jater anebo akutního selhání jater v terénu chronické hepatopatie a ascitu původně s objektivizovaným poklesem renálních funkcí a s elevací sérového kreatininu o 26,5 µmol/l (0,3 mg/dl). Zároveň je pro diagnostiku HRS podle ICA (International Club of Ascites) důležité, že nedojde k signifikantnímu zlepšení renálních funkcí ani za 48 hod po vysazení diuretik, event. po podání tekutinové expanze s albuminem, přičemž za maximální dávku albuminu je považováno 100 g/den (obvykle aplikovaná dávka je 20–40 g/den). Dále je důležité, že pacient by neměl být v šokovém stavu prezentovaném hypotenzí a tachykardií, prokazatelně nepožíval recentně žádnou nefrotoxickou medikaci a rovněž u něj není známá chronická nefropatie v předchorobí [41]. Známkami chronické nefropatie se min. rozumí přítomnost proteinurie > 0,5 g/den a/nebo mikroskopické hematurie s abnormálním sonografickým nálezem na ledvinném parenchymu, s elevací kreatininu a/nebo s poklesem eGFR po dobu alespoň 3 měsíců [41].
Doplněním diagnostických kritérií je frakční exkrece sodíku (FENa) < 0,2 %, přičemž hodnoty FENa < 0,1 % jsou považovány za vysoce prediktivní pro HRS, kde je předpoklad renální vazokonstrikce [42]. Nová klasifikace jednotlivých podtypů HRS je uvedena v tab. 3.
Tab. 3. Nová klasifikace hepatorenálního syndromu (upraveno dle International Club of Ascites [41, 42]).
New classification of hepatorenal syndrome (adjusted according to the International Club of Ascites [41, 42]).![Nová klasifikace hepatorenálního syndromu (upraveno dle International Club of Ascites [41, 42]).<br>
New classification of hepatorenal syndrome (adjusted according to the International Club of Ascites [41, 42]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ccf479ba533a96dc3c4074b9ece4649c.png)
HRS – hepatorenální syndrom, AKI – akutní poškození ledvin, Skreat – sérový kreatinin, AKD – akutní onemocnění ledvin, eGFR – glomerulární filtrace, CKD – chronická nefropatie Dodatečná a nápomocná diagnostická kritéria pro HRS zahrnují hyponatremii se sérovou koncentraci Na+ < 130 mmol/l, dále močovou koncentraci Na+ < 10 mmol/l, vyšší osmolalitu moči než plazmy, pokles diurézy < 500 ml/den a počet erytrocytů v močovém sedi-mentu < 50 [43,44].
Obecně uváděná incidence HRS jako příčiny AKI u hospitalizovaných pacientů s jaterní cirhózou varíruje v rozmezí 11–23 % v závislosti na studii, samotné AKI různé etiologie se vyskytuje téměř u 19–50 % pacientů s jaterní cirhózou [45–48].
Patofyziologicky je HRS podmíněn několika mechanizmy, mezi něž patří splanchnická vazodilatace při portální hypertenzi se zvýšenou produkcí lokálně působících substancí, např. oxidu dusnatého a prostanoidů s následnou renální vazokonstrikcí při aktivaci systému renin-angiotenzin-aldosteron. Dalšími možnými faktory podílejícími se na vzniku HRS jsou kardiální dysfunkce, adrenální insuficience a aktivace systémového zánětu. Systémová inflamace při portální hypertenzi úzce souvisí s bakteriální translokací a aktivací monocytů a s uvolněním prozánětlivých cytokinů, např. TNF- a IL-6. Poslední zmíněný faktor je také dáván do souvislosti s AKI mimo HRS u pacientů s cirhózou jater [42,45].
Kontrastem indukovaná nefropatie
S dalším typem AKI u gastroenterologických pacientů se můžeme setkat po provedení zobrazovacího vyšetření s použitím vysokoosmolární ionizující jodové kontrastní látky. Prakticky je tohoto typu vyšetření využíváno ve formě CT nebo angio-CT z diagnostické anebo terapeutické indikace u akutních, např. zánětlivých, chirurgických anebo nádorových onemocnění.
Kontrastem indukovaná nefropatie (CIN – contrast-induced nephropathy) je definována zvýšením sérového kreatininu o 25 % oproti výchozí hodnotě anebo obecně absolutním zvýšením kreatininu o 44 µmol/l v průběhu 12 hod až 5 dní po podání jodové kontrastní látky. Incidence CIN varíruje podle stavu a výchozích predispozicí pacienta od 0 do 24 % [49]. Patofyziologicky se na vzniku CIN podílí několik mechanizmů zahrnujících přímou toxicitu jodové kontrastní látky na tubulární buňky, vazokonstrikci v renálním parenchymu a s rizikem vzniku tzv. osmotické nefrózy. Zmíněný patologický stav vzniká i po aplikaci jiných osmoticky aktivních látek, jako je manitol, intravenózní (i.v.) Ig anebo hydroxyethylškrob s nálezem vakuolizace a otoku proximálních tubulárních buněk. Docházelo k němu zejména po podání hyperosmolárních ionizujících látek, což se v posledních letech změnilo a jodové kontrastní látky jsou izoosmolární a neionizující s předpokládaným menším rizikem vzniku CIN [50]. Nicméně trvá riziko ze strany pacienta s predisponujícími faktory, k nimž patří diabetes mellitus, periprocedurální dehydratace, preexistující chronická nefropatie, šokový stav, anémie, věk, proteinurie v anamnéze, nádorové onemocnění anebo současná nefrotoxická medikace [1].
Možnosti prevence a léčby akutního poškození ledvin v gastroenterologii
Terapeutický přístup k pacientovi s AKI je v zásadě dvojího charakteru:
- konzervativní;
- invazivní v závislosti na možnostech jejich použití a klinického stavu.
Principy prevence a léčby pacientů s AKI jsou obecné pro všechny nemocné, ale mohou být také specializované podle typu a tíže vyvolávající příčiny. V první řadě musí lékař komplexně zhodnotit klinické a laboratorní ukazatele, vyloučit obstrukci urotraktu a posoudit velikost a tvar ledvin sonograficky, s případným zavedením permanentního močového katétru. Pokud to metabolický a klinický stav pacienta dovoluje, lze pokračovat konzervativním způsobem. Obvykle se jedná o pacienta s AKI ve stupni 1–2 podle KDIGO, bez závažného iontového rozvratu, hemodynamicky stabilního, bez známek hyperhydratace a oligurie. V klinické medicíně jsme nicméně někdy v neinvazivním přístupu nuceni pokračovat také v tom případě, kdy není žádný jiný postup dále možný. Obecné konzervativní postupy zahrnují mimo jiného korekci vnitřního prostředí – zejména iontové dysbalance, úpravu tekutinové bilance podle stavu hydratace s případným použitím kličkových diuretik (furosemid) při potřebě nutnosti potencovat diurézu. Kontrola a korekce krevního tlaku, tělesné hmotnosti a hodinové diurézy jsou vždy součástí léčby, ale také prevence rozvoje dalšího poškození ledvin. Vždy je vhodné přihlížet na podávanou terapii s případným vyhnutím se nefrotoxické léčbě anebo min. upravit její dávkování. Uvedené doporučení je obvykle nutné brát s určitou rezervou u těžce septického pacienta, kdy jsou z hlediska primární příčiny sepse indikovány např. aminoglykosidy, kolistin anebo vankomycin s jejich známou nefrotoxicitou. Dávkování těchto antibiotik je pravidelně upravováno podle jejich sérových koncentrací ve spolupráci s klinickým farmakologem [51].
V případě selhání konzervativní léčby, u těžkých stavů komplikovaných hemodynamickou nestabilitou, sepsí s dysfunkcí několika orgánových systémů anebo u těžkých, život ohrožujících metabolických poruch je vhodné zvážit invazivní terapii. Touto léčbou se v nefrologii rozumí použití RRT a jiných očišťovacích metod krve. Typicky se RRT dělí na intermitentní (IRRT) a kontinuální (CRRT), jež se mezi sebou liší zejména v délce trvání metody a její účinnosti. IRRT léčba trvá v řádu hodin (2–8 hod) a CRRT procedury v řádu dní. O účinnosti RRT léčby rozhoduje také fyzikální princip léčby, např. u hemodialýzy se jedná o difuzi, u hemofiltrace o konvekci a u hemodiafiltrace o kombinaci obou principů.
Ve výběru metody se řídíme především hemodynamickou stabilitou pacienta, rychlostí potřeby úpravy vnitřního prostředí a v neposlední řadě také možnostmi pracoviště. U hemodynamicky nestabilních pacientů je vhodnější zvážit použití některé z CRRT metod, přičemž nejpoužívanější je v současné době kontinuální venovenózní hemodialýza (CVVHD) s citrátovou regionální antikoagulací. Jedná se o bezpečnou terapii, ale s nutností kontroly vnitřního prostředí pacienta a ionizovaného kalcia s udržením fyziologických hodnot. Tuto léčbu lze použít téměř u všech pacientů a především tam, kde je reálná hrozba eventuálního krvácení. Jisté opatrnosti je nutno zaujmout při akutní jaterní insuficienci a reagovat případnou úpravou dávky citrátu a dialýzy. Mezi základními typy RRT léčby zaujímá zvláštní postavení hybridní metoda – pomalá nízkoúčinná hemodialýza. Používá se primárně jako náhrada za CRRT anebo jako tzv. weaning od CRRT s postupným přechodem na intermitentní hemodialýzu. Z jiných očišťovacích metod krve můžeme uvést výměnnou plazmaferézu, kterou lze použít např. u hypertriglyceridemické pankreatitidy, erytropoetické porfyrie anebo u akutního selhání jater otrava Amanitou phalloidés, HELLP (hemolysis, elevated liver enzymes, low platelet count) syndrom, akutní selhání jater v graviditě. Plazmaferéza má své stálé použití v transplantologii při nutnosti desenzitizovat příjemce anebo u akutní protilátkové rejekce. U těchto pacientů lze také zvážit použití imunoadsorpce. K léčbě těžké akutní jaterní insuficience, zejména u intoxikací, je možné na specializovaných pracovištích použít albuminovou dialýzu v systému MARS (molecular adsorbent recirculating system) anebo systém Prometheus s frakcionovanou plazmatickou separací a adsorpcí.
Jiný přístup vyžadují také pacienti s GN a s amyloidózou prezentovanými proteinuriemi, nefritickým anebo nefrotickým syndromem. Pokud jsou tyto závažné stavy podmíněny jiným onemocněním, a jsou tedy sekundární, je nezbytná kromě jiného vždy adekvátní léčba základního onemocnění v režii gastroenterologa. V případě klinické nutnosti a závažnosti proteinurie je namístě zvážení biopsie ledviny, pokud to stav pacienta dovoluje. Proteinurii a otoky u pacienta lze, mimo adekvátní imunosupresivní nefrologické terapie podle výsledku renální biopsie, ovlivnit také korekcí krevního tlaku podáním inhibitorů angiotenzin konvertujícího enzymu anebo sartanů, kličkových diuretik, omezením příjmu soli a korekcí bilance tekutin. Součástí terapie by měla být adekvátní léčba případných infekčních komplikací a antiagregační terapie. Zahájení antikoagulační terapie u pacientů s nefrotickým syndromem se řídí podle doporučení KDIGO z roku 2012 u pacientů s poklesem albuminu < 25 g/l a jsou přítomny také další rizikové faktory pro trombózu [52]. Použít lze nízkomolekulární heparin s úpravou dávkování podle aktuálních renálních funkcí pacienta, warfarin nebo aktuálně probíhají i případové studie s novými přímo působícími antikoagulancii v této indikaci [53].
V léčebné strategii akutní polékové TIN (taktéž ATN) je namístě vysadit suspektní terapii a zaměnit za jiný preparát s pečlivým monitorováním renálních funkcí. V případě, že není jasná příčina AKI a v léčbě je nutno pokračovat (např. infliximab, sulfasalazin), je u pacientů s IBD možné, jak již bylo uvedeno, zvážit biopsii ledvin [18,24]. V léčbě akutní polékové TIN lze podat kortikosteroidy v režimu metylprednizolon 250–500 mg i.v., následován perorální léčbou prednizonem v dávce 1 mg/kg/den (nejvíce 60 mg/den) po dobu min. 4–6 týdnů s postupnou detrakcí dávky podle klinického a laboratorního stavu [54]. U pacientů s ATN se řídíme obecnými postupy v léčbě AKI za pečlivého monitoringu renálních funkcí. Jak již bylo uvedeno, prognóza návratu renálních funkcí závisí mimo jiného na tíži inzultu a na stavu renálního parenchymu v předchorobí.
Léčba pacientů se STEC-HUS je obvykle multioborová a zahrnuje dostatečnou hydrataci izotonickými roztoky, hemodialýzu v případě oligo/anurie, podání krevní plazmy, event. provedení výměnné plazmaferézy anebo imunoadsorpce. K antibiotické terapii je odmítavý postoj, ale v případě těžkých septických komplikací se jí pravděpodobně nelze vyhnout. Někteří autoři dávají v léčbě přednost bakteriostaticky působícím preparátům typu azithromycinu [55,56]. Enterálně mohou být k léčbě přidávána probiotika, ke kterým je také zaujímán u pacientů se STEC-HUS mírně skeptický postoj [57]. Do popředí léčebného zájmu se aktuálně dostává terapie anti-C5 protilátkou – eculizumabem, jejíž aplikace je opodstatněná potřebou blokády aktivovaného komplementu. V tomto případě bude nicméně nutné vyčkat výsledků klinických studií [58].
V léčbě je kromě obecných doporučení pro léčbu AKI u pacientů s oxalátovou nefropatií vhodná dostatečná hydratace, adekvátní léčba základního gastroenterologického onemocnění a, pokud to renální funkce pacienta umožňují, lze zvážit alkalizaci moči např. perorálním podáním citrátu [37].
V prevenci kontrastem indukované nefropatie je vždy důležitá dostatečná hydratace pacienta, minimální množství použité kontrastní látky a zajištění adekvátního perfuzního tlaku ledvin při hemodynamické stabilitě, které mohou snížit riziko vzniku CIN také u rizikových pacientů.
Specifická nadále zůstává otázka preprocedurální a postprocedurální aplikace N-acetylcysteinu. Pokud se jedná o kriticky nemocného pacienta na jednotce intenzivní péče, který vyžaduje urgentní provedení vyšetření s použitím kontrastní látky, není v tomto případě prostor pro rozsáhlejší preventivní opatření kromě podání dostatečného objemu tekutin s preferencí krystaloidů. Ale i toto opatření se řídí zachovanou diurézou a stavem hydratace pacienta. K podání N-acetylcysteinu se intenzivní medicína staví opatrně a jeho indikace spadá do kategorie 2B–C [59]. U stabilních rizikových pacientů je podáván před vyšetřením a po vyšetření v dávce 600 mg i.v. anebo perorálně. Problematika podávání statinu v této indikaci je víceméně rezervována pro pacienty před koronární intervencí nebo před kardiochirurgickými výkony [59].
Specifická je také léčba hepatorenálního syndromu, kde se obvykle podává i.v. terlipressin (0,5–1 mg à 4–6 hod), albumin ve zvyklé dávce 20–40 g/den a antibiotika (cefalosporiny třetí generace). Kombinace terlipressinu a albuminu má prokázanou lepší efektivitu v léčbě HRS typu 1 (HRS-AKI) se zlepšením renálních funkcí v porovnání s pacienty, kteří ve studii REVERSE dostávali pouze samotný albumin [60]. Nežádoucím účinkem aplikace terlipressinu může být prohloubení hyponatremie, proto je nezbytné u pacienta pečlivě monitorovat kromě renálních a jaterních funkcí také iontogram. Obecně jsou ve státech, kde není dostupný terlipressin (např. USA), v léčbě HRS podávány jiné vazokonstrikčně působící léky, např. noradrenalin, midodrin (1-adrenergní agonista) a oktreotid (analog somatostatinu) [61]. Konečným opatřením a pomocí pro pacienta je zvážení v indikovaných případech transplantace jater [10].
Závěr
AKI je závažný syndrom komplikující stav pacienta téměř ve všech oborech medicíny. Některé gastroenterologické nemoci jsou navíc přímo s onemocněním ledvin asociovány. V klinické praxi je proto velmi důležité na poškození ledvin diferenciálně diagnosticky myslet a v případě nutnosti konzultovat nefrologa se zvážením další diagnostiky a léčby.
Doručeno/Submitted: 28. 4. 2020
Přijato/Accepted: 9. 7. 2020
MUDr. Nadežda Petejová, Ph.D. MSc.
Interní klinika FN Ostrava
17. listopadu 1790/5
708 52 Ostrava-Poruba
petejova@seznam.cz
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašují, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Článek není podpořen grantem ani nevznikl za podpory žádné společnosti.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bio medicínských časopisů.
Zdroje
1. Kellum JA, Lameire N, Aspelin P et al. KDIGO clinical practice guideline for acute kidney injury. Kidney Inter Suppl 2012; 2 (1): 1–138. doi: 10.1038/kisup.2012.2.
2. Chawla LS, Bellomo R, Bihorac A et al. Acute kidney disease and renal recovery: consensus report of the Acute Disease Quality Initiative (ADQI) 16 Workgroup. Nat Rev Nephrol 2017; 13 (4): 241–257. doi: 10.1038/nrneph.2017.2.
3. Guney I, Burgucu HC, Ergul F et al. A rare case of acute kidney injury: McKittrick-Wheelock syndrome. Iran J Kidney Dis 2019; 13 (2): 132–133.
4. Silva M, Cardoso H, Gomes S et al. Severe acute kidney injury as a complication of collagenous colitis. Int J Colorectal Dis 2016; 31 (6): 1247–1248. doi: 10.1007/s00384-015-2449-6.
5. O’Connor ME, Prowle JR. Fluid overload. Crit Care Clin 2015; 31 (4): 803–821. doi: 10.1016/j.ccc. 2015.06.013.
6. Schuck O. Poruchy metabolismu vody a elektrolytů v klinické praxi. 1. vyd. Praha: Grada Publishing 2000 : 222.
7. Eltzschig HK, Eckle T. Ischemia and reperfusion from mechanism to translation. Nat Med 2011; 17 (11): 1391–1401. doi: 10.1038/nm.2507.
8. Umbro I, Tinti F, Scalera I et al. Acute kidney injury and post-reperfusion syndrome in liver transplantation. World J Gastroenterol 2016; 22 (42): 9314–9323. doi: 10.3748/wjg.v22.i42.9314.
9. De Haan JE, Hoorn EJ, de Geus HRH. Acute kidney injury after liver transplantation: recent insights and future perspectives. Best Pract Res Clin Gastroenterol 2017; 31 (2): 161–169. doi: 10.1016/j.bpg. 2017.03.004.
10. Fernandez-Lorente L, Martin-Moreno PL, Arteaga J. Acute kidney failure in the cirrhotic patient: management, kidney biopsy and dual kidney liver transplantation indication. Nephrol Dial Transplant 2020; 35 (3): 408–410. doi: 10.1093/ndt/gfz068.
11. Kochhar G, Edge P, Blomme C et al. Clostridium difficle enteropathy is associated with a higher risk for acute kidney injury in patients with an ileostomy – a case-control study. Inflamm Bowel Dis 2018; 24 (2): 402–409. doi: 10.1093/ibd/izx034.
12. Ambruzs JM, Walker PD, Larsen CP. The histopathologic spectrum of kidney biopsies in patients with inflammatory bowel disease. Clin J Am Soc Nephrol 2014; 9 (2): 265–270. doi: 10.2215/CJN.04660513.
13. Fogo AB. Causes and pathogenesis of focal segmental glomerulosclerosis. Nat Rev Nephrol 2015; 11 (2): 76–87. doi: 10.1038/nrneph. 2014.216.
14. Pouria S, Barratt J. Secondary IgA nephropathy. Semin Nephrol 2008; 28 (1): 27–37. doi: 10.1016/j.sem nephrol.2007.10.004.
15. Rennke HG. Kidney pathology part one and two. Intensive review of nephrology. Brigham and Woman’s hospital, Harvard medical school, postgdraduate medical education, USA. 2019. Collection of presentations: 110–218.
16. Singh AK. Approach to proteinuria and hematuria. 41. annual intensive review of internal medicine. Brigham and Woman’s Hospital, Harvard medical school, postgdraduate medical education, USA. 2018. Collection of presentations: 121–135.
17. Vivarelli M, Massella L, Ruggiero B et al. Minimal change disease. Clin J Am Soc Nephrol 2017; 12 (2): 332–345. doi: 10.2215/CJN.0500051.
18. Teplan V. Glomerulopatie u pacientů s idiopatickými střevními záněty. Gastroent Hepatol 2020; 74 (1): 1–6. doi: 10.14735/amgh20201.
19. Tekin F, Ozütemiz O, Ilter T. Acute tubulointerstitial nephritis due to 5-aminosalicylic acid in a patient with ulcerative colitis and chronic renal failure. Turk J Gastroenterol 2006; 17 (2): 153–154.
20. Niknahad H, Heidari R, Mohammadzadeh R et al. Sulfasalazine induces mitochondrial dysfunction and renal injury. Ren Fail 2017; 39 (1): 745–753. doi: 10.1080/0886022X.2017.1399908.
21. Durando M, Tiu H, Kim JS. Sulfasalazine-induced crystalluria causing severe acute kidney injury. Am J Kidney Dis 2017; 70 (6): 869–873. doi: 10.1053/j.ajkd.2017.05.013.
22. Yoo YJ, Chung SY, Gu DH et al. A case of late onset-acute tubulointerstitial nephritis with infliximab and mesalazine treatment in a patient with Crohn’s disease. Korean J Gastroenterol 2014; 63 (5): 308–312. doi: 10.4166/kjg.2014.63.5.308.
23. Bailly E, Von Tokarski F, Beau-Salinas F et al.Interstitial nephritis secondary to vedolizumab treatment in Crohn disease and safe rechallenge using steroids: a case report. Am J Kidney Dis 2018; 71 (1): 142–145. doi: 10.1053/j.ajkd.2017. 08.008.
24. Sato T, Kawasaki Y, Ito A et al. Infliximab-induced tubulointerstitial nephritis with image findings of striated nephrogram in Crohn’s disease. Tohoku J Exp Med 2018; 245 (3): 149–152. doi: 10.1620/tjem. 245.149.
25. Zadražil J. Jsou inhibitory protonové pumpy bezpečné pro ledviny? Prezentace na XV. konferenci III. interní kliniky FN Olomouc. 20. 10. 2017.
26. Muriithi AK, Leung N, Valeri AM et al. Biopsy-proven acute interstitial nephritis, 1993–2011: a case series. Am J Kidney Dis 2014; 64 (4): 558–566. doi: 10.1053/j.ajkd.2014.04.027.
27. Antoniou T, Macdonald EM, Hollands S et al. Proton pump inhibitors and the risk of acute kidney injury in older patients: a population-based cohort study. CMAJ Open 2015; 3 (2): E166–E171. doi: 10.9778/cmajo.20140074.
28. Nochaiwong S, Ruengorn C, Awiphan R et al. The association between proton pump inhibitor use and the risk of adverse kidney outcomes: a systematic review and meta-analysis. Nephrol Dial Transplant 2018; 33 (2): 331–342. doi: 10.1093/ndt/gfw470.
29. Pozdzik AA, Matos C, Rorive S et al. Diffusion-weighted magnetic resonance imaging as a new diagnostic tool of subclinical IgG4-related acute tubulointerstitial nephritis. Clin Kidney J 2013; 6 (2): 235–237. doi: 10.1093/ckj/sft005.
30. Hong YA, Park WS, Chang YK et al. “Rare” manifestation of “rare” disease: sarcoidosis presenting as pancreatitis, duodenal ulcer and severe acute kidney injury. Int Urol Nephrol 2016; 48 (12): 2115–2117. doi: 10.1007/s11255-016-1395-8.
31. Anders HJ. Necroptosis in acute kidney injury. Nephron 2018; 139 (4): 342–348. doi: 10.1159/0004 89940.
32. Davenport A, Sheikh MF, Lamb E et al. Acute kidney injury in acute-on-chronic liver failure: where does hepatorenal syndrome fit? Kidney Int 2017; 92 (5): 1058–1070. doi: 10.1016/j.kint. 2017.04.048.
33. Cody EM, Dixon BP. Hemolytic uremic syndrome. Pediatr Clin North Am 2019; 66 (1): 235–246. doi: 10.1016/j.pcl.2018.09.011.
34. Bianchi L, Gaiani F, Vincenzi F et al. Hemolytic uremic syndrome: differential diagnosis with the onset of inflammatory bowel diseases. Acta Biomed 2018; 89 (9-S): 153–157. doi: 10.23750/abm.v89i9-S.7911.
35. Sethi S, Theis JD. Pathology and diagnosis of renal non-AL amyloidosis. J Nephrol 2018; 31 (3): 343–350. doi: 10.1007/s40620-017-0426-6.
36. Serra I, Oller B, Mañosa M et al. Systemic amyloidosis in inflammatory bowel disease: retrospective study on its prevalence, clinical presentation, and outcome. J Crohns Colitis 2010; 4 (3): 269–274. doi: 10.1016/j.crohns. 2009.11.009.
37. Teplan V et al. Praktická nefrologie. 2. zcela přepracované a doplněné vydání. Praha: Grada Publishing 2006 : 254–256.
38. Demoulin N, Issa Z, Crott R et al. Enteric hyperoxaluria in chronic pancreatitis. Medicine (Baltimore) 2017; 96 (19): e6758. doi: 10.1097/MD. 0000000000006758.
39. Hueppelshaeuser R, von Unruh GE, Habbig S et al. Enteric hyperoxaluria, recurrent urolithiasis, and systemic oxalosis in patients with Crohn’s disease. Pediatr Nephrol 2012; 27 (7): 1103–1109. doi: 10. 1007/s00467-012-2126-8.
40. Lumlertgul N, Siribamrungwong M, Jaber BL et al. Secondary oxalate nephropathy: a systematic review. Kidney Int Rep 2018; 3 (6): 1363–1372. doi: 10.1016/j.ekir.2018.07.020.
41. International Club of Ascites. Guidelines. Criteria for the diagnosis of hepatorenal syndrome. [online]. Available from: http: //www.icascites.org/about/guidelines/.
42. Angeli P, Garcia-Tsao G, Nadim MK et al. News in pathophysiology, definition and classification of hepatorenal syndrome: a step beyond the International Club of Ascites (ICA) consensus document. J Hepatol 2019; 71 (4): 811–822. doi: 10.1016/j.jhep.2019.07.002.
43. Regner KR, Singbartl K. Kidney injury in liver disease. Crit Care Clin 2016; 32 (3): 343–355. doi: 10.1016/j.ccc.2016.03.005.
44. Teplan V. Příspěvek k problematice hepatorenálního poškození a selhání. Gastroent Hepatol 2018; 72 (3): 242–250. doi: 10.14735/amgh 2018242.
45. Amin AA, Alabsawy EI, Jalan R et al. Epidemiology, pathophysiology, and management of hepatorenal syndrome. Semin Nephrol 2019; 39 (1): 17–30. doi: 10.1016/j.semnephrol.2018.10.002.
46. Allegretti AS, Parada XV, Eneanya ND et al. Prognosis of patients with cirrhosis and AKI who initiate RRT. Clin J Am Soc Nephrol 2018; 13 (1): 16–25. doi: 10.2215/CJN.03610417.
47. Garcia-Tsao G, Parikh CR, Viola A. Acute kidney injury in cirrhosis. Hepatology 2008; 48 (6): 2064–2077. doi: 10.1002/hep.22605.
48. Low G, Alexander GJ, Lomas DJ. Renal impairment in cirrhosis unrelated to hepatorenal syndrome. Can J Gastroenterol Hepatol 2015; 29 (5): 253–257. doi: 10.1155/2015/967683.
49. Hossain MA, Costanzo E, Cosentino J et al. Contrast-induced nephropathy: pathophysiology, risk factors, and prevention. Saudi J Kidney Dis Transpl 2018; 29 (1): 1–9. doi: 10.4103/1319 -2442.225199.
50. Dickenmann M, Oettl T, Mihatsch MJ. Osmotic nephrosis: acute kidney injury with accumulation of proximal tubular lysosomes due to administration of exogenous solutes. Am J Kidney Dis 2008; 51 (3): 491–503. doi: 10.1053/j.ajkd.2007.10.044.
51. Petejova N, Martinek A, Zadrazil J et al. Acute toxic kidney injury. Ren Fail 2019; 41 (1): 576–594. doi: 10.1080/0886022X.2019.1628780.
52. Kellum JA, Lameire N, Aspelin P et al. KDIGO clinical practice guideline for glomerulonephritis. Kidney Inter Suppl 2012; 2 : 139–274.
53. Derebail VK, Rheault MN, Kerlin BA. Role of direct oral anticoagulants in patients with kidney disease. Kidney Int 2020; 97 (4): 664–675. doi: 10.1016/j.kint.2019.11.027.
54. Moledina DG, Perazella MA. Drug-induced acute interstitial nephritis. Clin J Am Soc Nephrol 2017; 12 (12): 2046–2049. doi: 10.2215/CJN.07630717.
55. Bruyand M, Mariani-Kurkdjian P, Gouali M et al. Hemolytic uremic syndrome due to Shiga toxin-producing Escherichia coli infection. Med Mal Infect 2018; 48 (3): 167–174. doi: 10.1016/j.medmal. 2017.09.012.
56. Nitschke M, Sayk F, Härtel C et al. Association between azithromycin therapy and duration of bacterial shedding among patients with Shiga toxin-producing enteroaggregative Escherichia coli O104: H4. JAMA 2012; 307 (10): 1046 –1052. doi: 10.1001/jama.2012.264.
57. Giordano M, Baldassarre ME, Palmieri V et al. Management of STEC Gastroenteritis: Is there a role for probiotics? Int J Environ Res Public Health 2019; 16 (9): 1649. doi: 10.3390/ijerph 16091649.
58. Loos S, Oh J, Kemper MJ. Eculizumab in STEC-HUS: need for a proper randomized controlled trial. Pediatr Nephrol 2018; 33 (8): 1277–1281. doi: 10.1007/s00467-018-3972-9.
59. Joannidis M, Druml W, Forni LG et al. Prevention of acute kidney injury and protection of renal function in the intensive care unit: update 2017: Expert opinion of the Working Group on Prevention, AKI section, European Society of Intensive Care Medicine. Intensive Care Med 2017; 43 (6): 730–749. doi: 10.1007/s00134-017-4832-y.
60. Boyer TD, Sanyal AJ, Wong F et al. Terlipressin plus albumin is more effective than albumin alone in improving renal function in patients with cirrhosis and hepatorenal syndrome type 1. Gastroenterology 2016; 150 (7): 1579 –1589. e2. doi: 10.1053/j.gastro.2016.02.026.
61. Mattos ÂZ, Schacher FC, Mattos AA. Vasoconstrictors in hepatorenal syndrome – a critical review. Ann Hepatol 2019; 18 (2): 287–290. doi: 10.1016/j.aohep.2018.12.002.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2020 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Klinická a experimentální gastroenterologie
- Elektrogastrografie u systémové sklerodermie – pilotní studie
- Portopulmonální hypertenze u pacientů indikovaných k transplantaci jater – zkušenosti transplantačního centra IKEM
- EUS navigované gastrointestinální anastomózy – nové možnosti terapeutické endoskopie
- Akutní pankreatitida u pacientů po transplantaci jater
- Použitelnost Glasgow-Blatchford skóre při predikci nízkorizikových pacientů s krvácením do horní části gastrointestinálního traktu – první data z České republiky
- Autonómna dysregulácia pri syndróme dráždivého čreva, funkčnej dyspepsii a globus pharyngeus – prehľad literatúry a pilotné výsledky
- Whippleova choroba – dvě kazuistiky
- Akutní poškození ledvin v gastroenterologii
- Výběr z mezinárodních časopisů
- Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Jorveza® – očekávaný preparát k léčbě eozinofilní ezofagitidy
- Hemové železo v substituci sideropenie a sideropenní anémie u pacientů s IBD
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- EUS navigované gastrointestinální anastomózy – nové možnosti terapeutické endoskopie
- Jorveza® – očekávaný preparát k léčbě eozinofilní ezofagitidy
- Whippleova choroba – dvě kazuistiky
- Použitelnost Glasgow-Blatchford skóre při predikci nízkorizikových pacientů s krvácením do horní části gastrointestinálního traktu – první data z České republiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



