-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kožní problematika u pacientů s idiopatickými střevními záněty
Skin conditions in patients with inflammatory bowel diseases
Inflammatory bowel diseases (IBD) may also manifest on the skin. Skin manifestation can occur in 22–44% of patients with Crohn’s disease (CD) and it is the most common extraintestinal manifestation of CD. Specific lesions, reactive lesions, and associated diseases are among the skin manifestations of CD. Specific lesions have the same histopathological findings as CD. Erythema nodosum, pyoderma gangrenosum, and aphthous stomatitis are among the reactive lesions of CD and each presents a different histopathological picture. Psoriasis, atopic dermatitis, and hidradenitis suppurativa are also diseases associated with CD. Peristomal dermatitis and dermatosis due to malabsorption and malnutrition are another issue in CD patients. Dermatosis caused by IBD treatment is another important problem in patients with IBD. Skin side-effects can occur in 20% patients undergoing biological treatment. The most common dermatosis in these patients is atopic dermatitis, paradoxical reactions, and bacterial skin diseases, such as pyoderma. A paradoxical reaction is defined as the induction or exacerbation of a disease by a drug(s) approved for the disease. In the case of skin manifestations, it is not always necessary to withdraw the prescribed drug. Given the relatively high occurrence of diverse skin reactions in patients suffering from IBD, close cooperation between gastroenterologists and dermatologists is highly recommended.
Key words:
inflammatory bowel diseases – skin manifestations – psoriasis – atopic dermatitis – skin neoplasms – infection
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
20. 1. 2017Accepted:
26. 1. 2017
Autoři: K. Jůzlová; M. Krásová; J. Hercogová
Působiště autorů: Dermatovenerologická klinika 2. LF UK a Nemocnice Na Bulovce, Praha
Vyšlo v časopise: Gastroent Hepatol 2017; 71(1): 40-48
Kategorie: Kapitoly z vnitřního lékařství: přehledová práce
doi: https://doi.org/10.14735/amgh201740Idiopatické střevní záněty (IBD – inflammatory bowel diseases) se mohou manifestovat také na kůži. U Crohnovy nemoci (CD – Crohn’s disease) lze kožní projevy zaznamenat až u 22– 44 % pacientů a patří tak mezi nejčastější extraintestinální manifestaci nemoci. Ke kožním projevů IBD řadíme specifické změny, které mají stejný histopatologický obraz jako CD, dále reaktivní změny s odlišným histopatologickým obrazem, mezi které patří erythema nodosum, pyoderma gangrenosum či aftózní stomatitida, a asociované choroby jako je psoriáza, atopická dermatitida nebo hidradenitis suppurativa. U pacientů s IBD se také setkáváme s problematikou dermatóz v okolí stomie, vzácněji pak dermatóz z malabsorpce či malnutrice.
Souhrn
Idiopatické střevní záněty (IBD – inflammatory bowel diseases) se mohou manifestovat také na kůži. U Crohnovy nemoci (CD – Crohn’s disease) lze kožní projevy zaznamenat až u 22 – 44 % pacientů a patří tak mezi nejčastější extraintestinální manifestaci nemoci. Ke kožním projevů IBD řadíme specifické změny, které mají stejný histopatologický obraz jako CD, dále reaktivní změny s odlišným histopatologickým obrazem, mezi které patří erythema nodosum, pyoderma gangrenosum či aftózní stomatitida, a asociované choroby jako je psoriáza, atopická dermatitida nebo hidradenitis suppurativa. U pacientů s IBD se také setkáváme s problematikou dermatóz v okolí stomie, vzácněji pak dermatóz z malabsorpce či malnutrice. Poslední poměrně důležitou kapitolou jsou dermatózy vzniklé v důsledku léčby IBD. Až u 20 % pacientů s IBD na biologické léčbě se objevují vedlejší kožní reakce. U těchto pacientů nejčastěji zaznamenáváme atopickou dermatitidu, dále pak paradoxní reakce a bakteriální kožní infekce tzv. pyodermie. Za paradoxní reakci považujeme indukci či exacerbaci nemoci (např. psoriázy, palmoplantární pustulózy) v průběhu léčby IBD v důsledku podávaného léku (infliximab, adalimumab), který se běžně používá k léčbě indukované nemoci. Při vzniku kožních projevů není vždy nutné podávaný lék vysadit. Vzhledem k častému výskytu rozmanitých kožních reakcí u pacientů s IBD je vhodná spolupráce gastroenterologa s dermatologem.
Klíčová slova:
idiopatické střevní záněty – kožní manifestace – psoriáza – atopická dermatitida – kožní nádory – infekceKožní projevy IBD
Kožní projevy Crohnovy nemoci (CD – Crohn’s disease) patří mezi nejčastější extraintestinální projevy této choroby, vyskytují se u 22 – 44 % pacientů a mohou předcházet o několik měsíců až let střevní obtíže [1,2]. U CD se na kůži mohou vyskytovat specifické změny, které mají stejný histopatologický obraz. Jedná se o nekaseifikující granulomy z obrovských buněk s lymfocytárními perivaskulárními infiltráty. Rozlišujeme metastatickou, orální a perianální formu.
Za metastatickou formu CD je považováno rozšíření granulomatózního zánětu mimo gastrointestinální oblast. Aktivita kožních projevů nekoreluje s aktivitou střevních obtíží. V klinickém obraze se objevují plaky, noduly a ulcerace predilekčně na končetinách a v intertriginózních oblastech [1 – 5].
Orální forma CD je rozšíření granulomatózního zánětu do dutiny ústní. Tato forma CD se vyskytuje asi u 8 – 9 % pacientů s CD. Projevuje se otoky rtů, dásní a sliznice. V endoskopickém obraze bývá patrný typický obraz dlažebních kostek [3 – 5].
Perianálně se vyskytují fisury, fistuly, dále se mohou v této oblasti objevit přilehlé výrůstky, tzv. strážné hrbolky („skin tag“), které jsou obvykle klasifikovány do dvou skupin. Do první skupiny řadíme nebolestivé, široce vyvýšené hrboly, solitární či mnohočetné, jemné nebo tvrdé, nazývané v anglické literatuře jako „elephant ears“ (obr. 1). Druhý typ je charakterizován jako bolestivé edematózní léze, často tvrdé, cyanotické, vycházející z anální fisury, vředu či hemoroidu [2,4,5].
Obr. 1. Perianální projevy Crohnovy nemoci typu „elephant ears“. Fig. 1. Perianal Crohn’s disease – ”elephant ears“. 
Dále se u pacientů s CD a ulcerózní kolitidou (UC – ulcerative colitis) vyskytují tzv. reaktivní změny, které mají odlišný histopatologický obraz než gastrointestinální projevy. Do této skupiny chorob patří erythema nodosum (EN), pyoderma gangrenosum (PG), pyostomatitis vegetans (PV), aftózní stomatitida (AS), Sweetův syndrom, kožní forma polyarteritis nodosa, vaskulitida či epidermolysis bullosa aquisita [3 – 5].
Erythema nodosum
EN je onemocnění charakterizované vznikem bolestivých podkožních nodulů vyskytujících se nejčastěji na bércích. U více než 1/ 3 nemocných je etiologie EN nejasná. EN může být důležitým kožním příznakem mnoha systémových chorob. Vyskytuje se u 4 – 6 % pacientů s IBD, častěji u CD než u UC. Dále se může objevit u pacientů se sarkoidózou, s infekčním onemocněním streptokokové etiologie, virovou infekcí respiračního traktu, bakteriální gastroenteritidou, u pacientů užívajících hormonální antikoncepci, sulfonamidy, penicilin, anti-TNF (tumor nekrotizující faktor) preparáty aj. Většinou bývají postiženy ženy mladšího a středního věku [3 – 6].
Pyoderma gangrenosum
PG (obr. 2) je vzácná ulcerózní dermatóza s chronickým průběhem, která bývá sdružena se systémovými chorobami. Nejčastěji se vyskytuje u pacientů s UC a CD. Mezi další asociované gastrointestinální choroby patří divertikulóza, polypóza, karcinom střev, vředy žaludku a duodena. Vzhledem k iniciálnímu masivnímu nálezu infiltrátu neutrofilů ve tkáních s následným cévním postižením je řazena mezi neutrofilní dermatózy [7]. Častěji se vyskytuje u pacientů starších 40 let. Nejdříve se na kůži objeví pustuly a noduly, které postupně splývají a tvoří plošně se šířící vředy. Okraje jsou podminované, zatímco v centru dochází k hojení. Vzniká tzv. kribriformní jizva [1]. Predilekční lokalizace bývá na dolních končetinách, ale může vzniknout na kterémkoli místě kožního povrchu [8], často v místě traumatu (patergie). U lokalizovaných forem lze využít v počáteční fázi místní kortikosteroidy či takrolimus, účinná bývá také intralezionální aplikace kortikosteroidů. U většiny pacientů bývá nutná systémová léčba kortikosteroidy, event. dalšími imunosupresivy jako jsou azathioprin, cyklosporin, dapson, kolchicin či klofazimin. V léčbě jsou účinné také inhibitory TNF, nejrychlejší terapeutická odpověď je zaznamenaná po aplikaci infliximabu [3,7].
Obr. 2. Pyoderma gangrenosum. Fig. 2. Pyoderma gangrenosum. 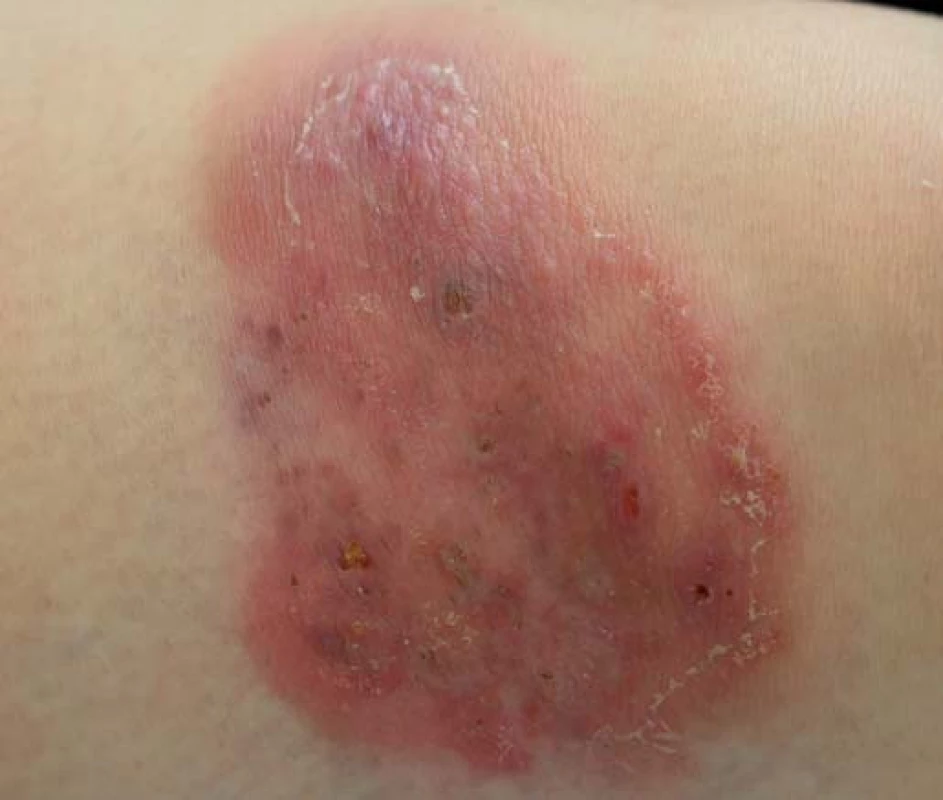
Pyostomatitis vegetans
PV je vzácné onemocnění sliznice dutiny ústní charakterizované vznikem pustul a ulcerací. Bývá považována za slizniční formu PG [7]. V literatuře bylo publikováno asi 40 případů, které byly vždy popsány u pacientů s IBD. PV může často předcházet vzniku UC. Častěji se vyskytuje u žen všech věkových skupin. Diferenciálně diagnosticky zvažujeme bulózní dermatózy a infekce sliznice dutiny ústní [7]. V lokální léčbě se využívají antiseptické ústní vody a kortikosteroidy, systémová léčba odpovídá terapii IBD [4 – 6].
Aftózní stomatitida
AS je poměrné časté ulcerativní onemocnění dutiny ústní [4]. Příčinou vzniku afty je pravděpodobně nižší odolnost epitelu ústní sliznice vůči řadě různých nox [9]. Může se jednat o idiopatické onemocnění, ale také o chorobu vyskytující se u systémových nemocí, jako jsou IBD, systémový lupus erythematosus, HIV infekce, morbus Behcet, reaktivní artritida aj. Poněkud kontroverzní příčina AS se zvažuje nedostatek vitaminu B12, folátů či železa [6]. Projevuje se vznikem silně bolestivých ulcerací lokalizovaných v nerohovějících partiích ústní sliznice. Afta se hojí spontánně během 5 – 10 dnů, u pacientů s CD bývá průběh AS těžší a dochází k rekurenci [9]. Aktivita AS u pacientů s CD často koreluje s aktivitou střevních obtíží [1]. V diferenciální diagnostice lze zvažovat herpetickou gingivostomatitidu, erythema multiforme, kontaktní stomatitidu. Histologický obraz je nespecifický, u časných lézí bývá přítomný submukózní infiltrát neutrofilů. Ke zmírnění příznaků AS se používají lokální kortikosteroidy, lokální anestetika nebo lokální takrolimus. Při nutnosti systémové terapie lze užít kolchicin, dapson či thalidomid [4 – 6].
Sweetův syndrom
Sweetův syndrom je vzácné onemocnění, které je řazeno díky svému histologickému obrazu mezi neutrofilní dermatózy. Většinou se vyskytuje u pacientů s myeloproliferativním onemocněním, dále u některých nádorových a systémových chorob. Někdy může být vyvolán léky. Nejčastěji se objevuje při akutní exacerbaci UC. Jedná se o akutní onemocnění, které se projevuje teplotami, cefaleou, artralgiemi, na kůži se objevují červené tuhé papuly, noduly, někdy i vezikuly či pustuly. Kožní projevy mohou být lokalizovány v obličeji, krku, na trupu i končetinách. Pacienti si stěžují na pálení až bolestivost projevů. V léčbě se využívá především prednison a antipyretika [4 – 7].
Další kožní projevy jsou u pacientů s CD a UC označovány jako asociované. Do této skupiny chorob se řadí vitiligo, psoriáza, atopická dermatitida (AD), paličkovité prsty, hidradenitis suppurativa (HS) a acrodermatitis enteropathica [3 – 5].
Psoriáza
Psoriáza je autoimunitní zánětlivé kožní onemocnění, jehož prevalence se v Evropě i USA pohybuje okolo 1,5 – 4,7 %, vyskytující se u obou pohlaví [10,11]. Na etiopatogenezi se podílí jak genetická predispozice, tak faktory vnějšího prostředí. Jedná se o proces, který je navozen a udržován T lymfocyty (Th1, Th17 a Th22) a jejich zánětlivými produkty. Výslednou interakcí dendritických buněk, T lymfocytů a keratinocytů je hyperproliferace epidermis. Mezi důležité cytokiny uplatňující se v etiopatogenezi psoriázy patří TNF-α, IFN-γ, IL-12, IL-23, IL-17, IL-22. V klinickém obraze dominují erytematoskvamózní plaky lokalizované nejčastěji nad extenzory. Psoriáza není pouze kožní nemoc, ale manifestuje se také řadou dalších mimokožních projevů, tzv. komorbidit, mezi které patří psoriatická artritida, metabolický syndrom, ateroskleróza, depresivní syndrom a v neposlední řadě také gastrointestinální nemoci, jako jsou IBD a celiakie. Podle některých autorů je prevalence CD až 7× vyšší u pacientů s psoriázou než v běžné populaci [12]. Léčba spočívá v místní aplikaci kortikosteroidů, derivátů vitaminu D3, topických imunomodulátorů, keratolytik a dehtů. Další terapeutickou možností je světloléčba. Při neúčinnosti místní léčby a fototerapie připadá v úvahu systémová léčba cyklosporinem, acitretinem či metotrexátem. Dalším krokem je biologická léčba infliximabem, etanerceptem, adalimumabem, ustekinumabem a nověji také inhibitory interleukinu IL-17 – sekukinumabem či ixekizumabem.
Atopická dermatitida
AD je nejčastější chronická či chronicky relabující zánětlivá neinfekční dermatóza. Do klinického obrazu patří intenzivní pruritus, erytém, papuly, séropapuly, vezikuly, krusty, šupiny a lichenifikace (obr. 3 a 4). V histopatologickém obraze nacházíme spongiózu, akantózu, hyperparakeratózu, lymfocytární infiltrát a často též eozinofily. Prevalence AD je ve vyspělých zemích za posledních 30 let na vzestupu. V Evropě se AD vyskytuje asi u 15 – 20 % dětí a u 2 – 5 % dospělých. U pacientů s AD bývá pozitivní atopie v rodinné anamnéze. Jedná se o multifaktoriální onemocnění, na jehož etiopatogenezi se podílí porucha kožní bariéry v důsledku poruchy keratinizace a sníženého množství ceramidů, dále snížená schopnost vázat vodu, zvýšené ztráty vody a přehnaná odpověď na zevní podněty. Na rozvoji AD se podílí imunologická dysbalance spočívající v inhibici reakcí Th1 lymfocytů s převahou Th2 reakcí a cytokinového spektra IL-4, IL-5, IL-13. V léčbě AD dominuje místní léčba kortikoidy či lokálními imunomodulátory (pimekrolimus, takrolimus). Nezbytnou součástí léčby je podpůrná léčba emoliencii. Z dalších léčebných možností využíváme koupele, fototerapii UVB a při závažném průběhu také systémovou léčbu cyklosporinem, azathioprinem či metotrexátem. Ve fázi klinických studií je dupilumab – monoklonální protilátka proti IL-4 a IL-13, který představuje slibnou možnost v léčbě těžké AD [13].
Obr. 3. Atopická dermatitida ve kštici. Fig. 3. Atopic dermatitis on scalp. 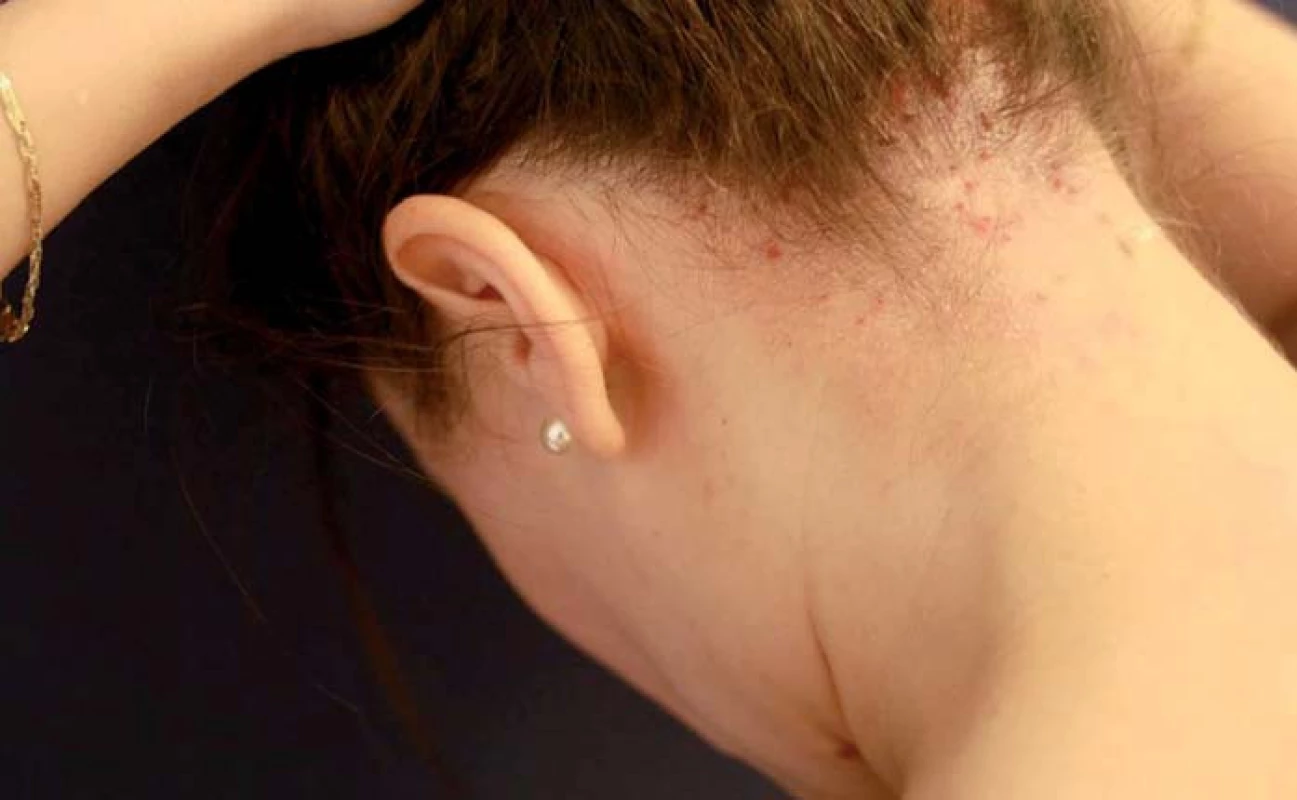
Obr. 4. Atopická dermatitida. Fig. 4. Atopic dermatitis. 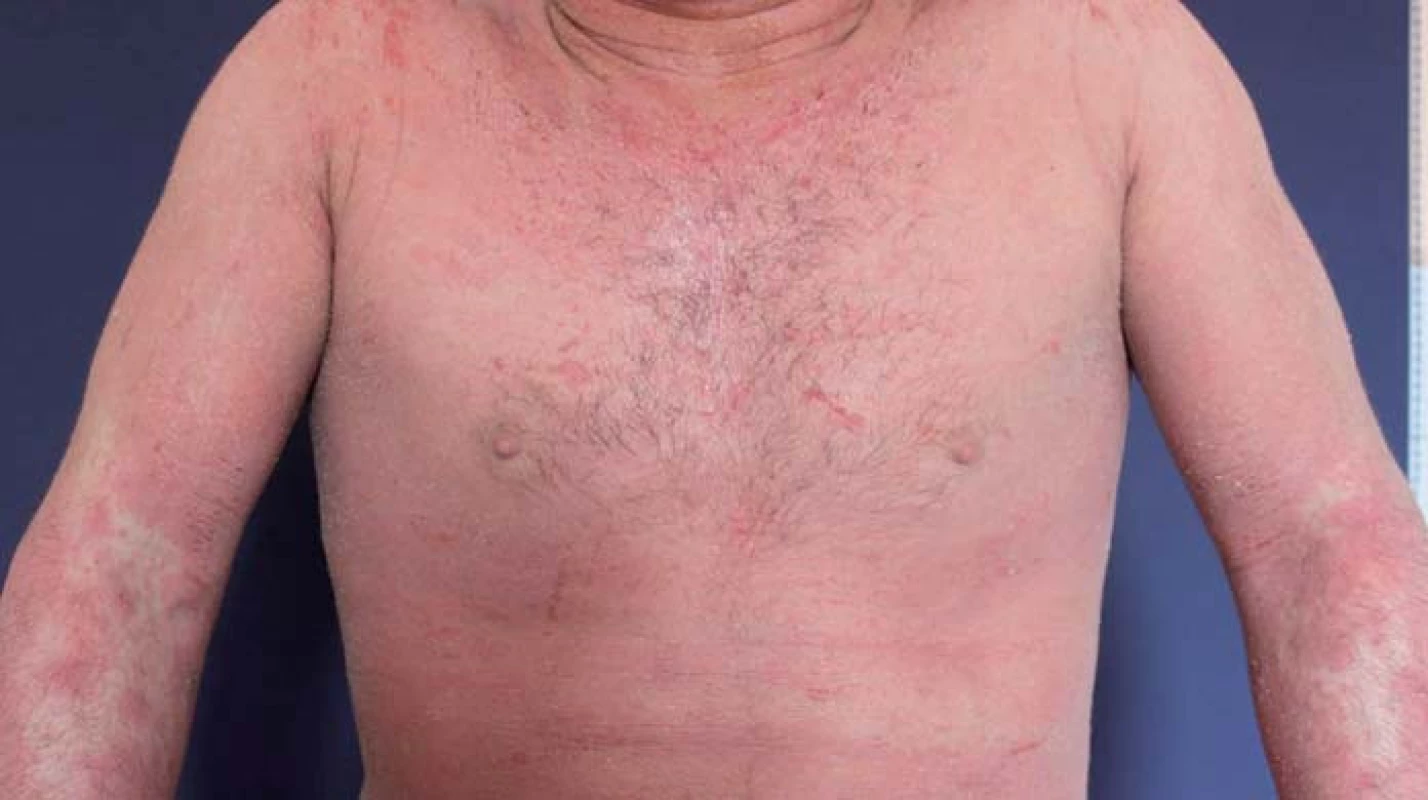
Hidradenitis suppurativa
HS neboli acne inversa je chronické zánětlivé kožní onemocnění, do jehož klinického obrazu patří recidivující zánětlivé noduly a píštěle v intertriginózní lokalizaci, tzn. v axilách, pod prsy, v oblasti třísel, zevního genitálu a hýždí (obr. 5). Za rizikové faktory je považováno kouření, ženské pohlaví, obezita a diabetes mellitus. V etiopatogenezi se uplatňuje především hyperkeratóza folikulárního ústí vedoucí k okluzi folikulu, následně k jeho ruptuře a rozvoji zánětlivé reakce přecházející na apokrinní žlázy. HS může vést k jizvení a vzniku striktur. HS je podobně jako CD řazena k multifaktoriálním nemocem, na jejímž vzniku se podílí genetická dispozice a faktory vnějšího prostředí. Dle závažnosti nemoci se v léčbě využívají místní antibiotika (např. klindamycin), v případě rozsáhlejšího postižení s hnisavou sekrecí lze využít kombinaci klindamycinu a rifampicinu podávaných perorálně. Jinou možností jsou imunosupresiva nebo chirurgická léčba. Nejmodernější volbou je biologická léčba (adalimumab), která se užívá také v léčbě CD, a naznačuje tak autoimunitní původ nemoci. Podle posledních poznatků je HS považována za nemoc asociovanou s CD vyskytující se u 1,2 – 23 % pacientů s CD. V případě výskytu HS u CD bývá průběh CD závažnější. Většinou se nejdříve objeví CD a teprve s odstupem dochází k rozvoji HS. V běžné populaci se HS vyskytuje častěji u žen, kdežto výskyt HS u pacientů s CD bývá častější u mužů. V případě, že HS postihuje pouze anogenitální oblast, může být odlišení od CD obtížné, neboť klinický i histopatologický obraz mohou být v tomto případě shodné [14,15].
Obr. 5. Hidradenitis suppurativa. Fig. 5. Hidradenitis suppurativa. 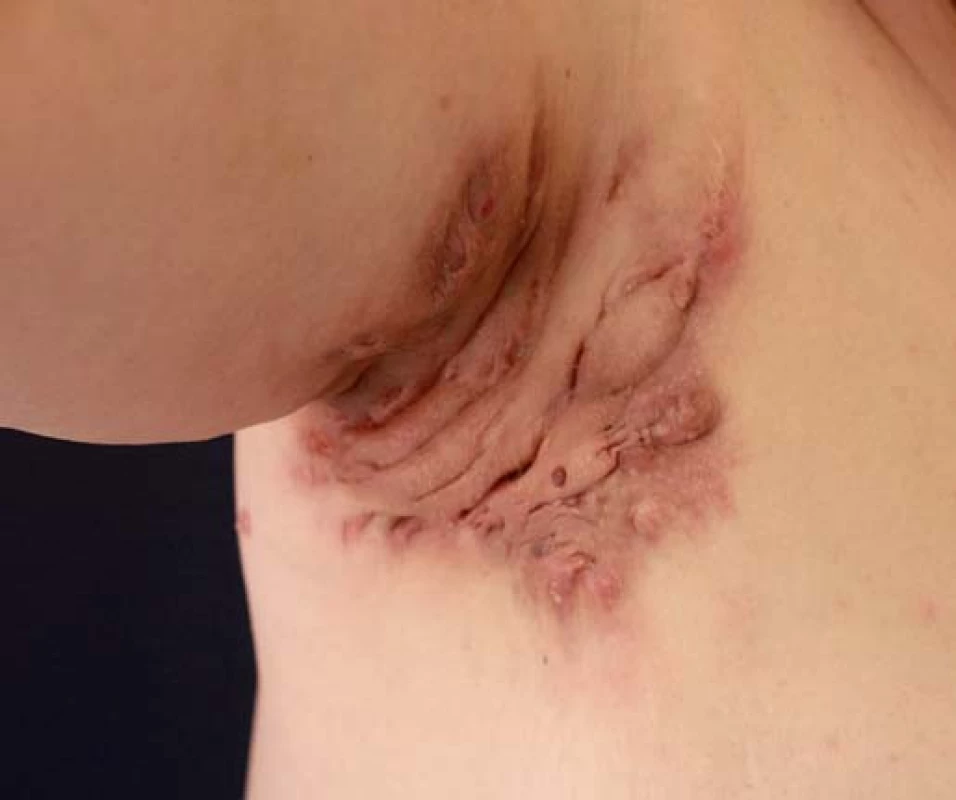
Dermatózy v okolí stomie
Mezi nejčastější dermatózy vyskytující se v oblasti stomie patří kontaktní iritační dermatitida (obr. 6), která vzniká v důsledku iritace kůže stolicí nebo potem. Dále se zde objevují tzv. preexistující kožní choroby jako psoriáza, atopická či seboroická dermatitida. Často bývá oblast okolo stomie kolonizována bakteriemi (Staphylococcus aureus), kvasinkami, dermatofyty, event. viry (Herpes simplex virus). Vzácněji se u pacientů může vyskytovat kontaktní alergická dermatitida nejčastěji na součásti stomie nebo na prostředky používané k péči o stomie. Mezi nepříjemnou komplikaci vznikající v okolí stomie může být také PG [4 – 6]. Diagnostika PG v okolí stomie bývá obtížná, na počátku bývá zaměňována za kontaktní iritační či alergickou dermatitidu. Může se objevit již za 2 měsíce po zavedení stomie nebo až za několik let [3].
Obr. 6. Iritační dermatitida v okolí stomie. Fig. 6. Peristomal irritant contact dermatitis. 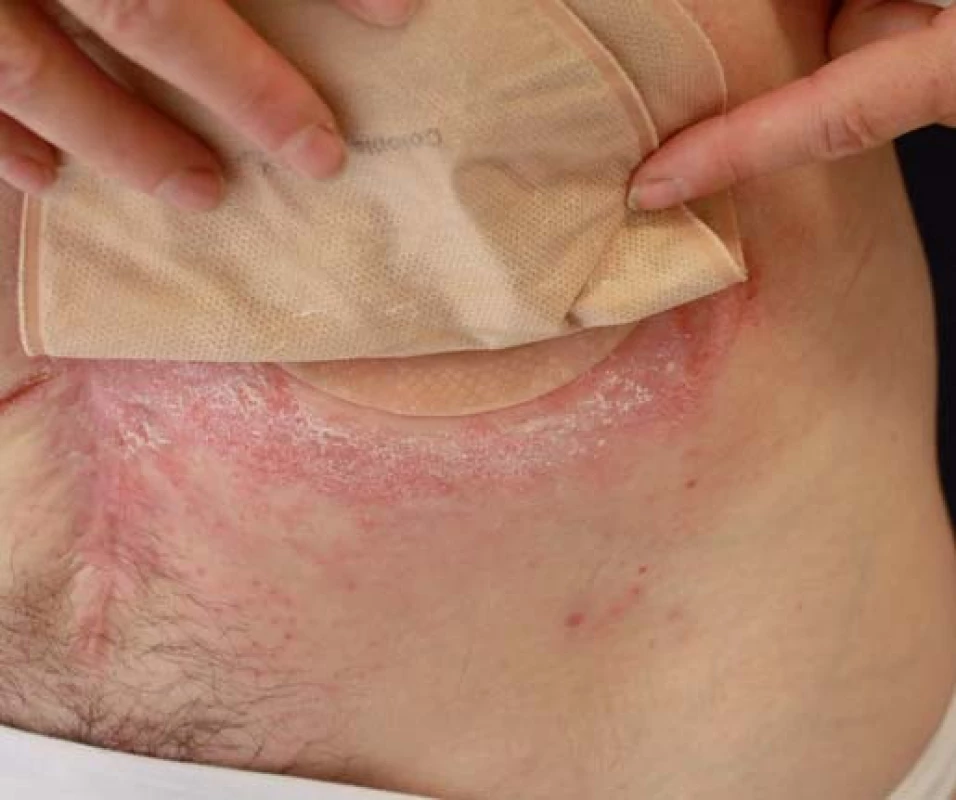
Dermatózy v důsledku malabsorpce a malnutrice
Samostatnou skupinu doprovázející gastrointestinální nemoci tvoří choroby vznikající v důsledku malabsorpce a malnutrice.
Při protrahovaných průjmech může dojít k deficienci zinku, která se může na kůži manifestovat jako acrodermatitis enteropathica. Periorificálně a akrálně bývají přítomny mokvající ložiska, vezikuly, pustuly až krusty, které mohou připomínat projevy psoriázy. Do klinického obrazu této choroby dále patří alopecie, paronychium či průjem.
Při nedostatku vitaminu B3 (niacinu) může dojít k rozvoji pelagry, která je charakterizována vznikem červených až hnědofialových makul v solární lokalizaci v místech mechanické iritace, následně může dojít až ke vzniku bul a deskvamací.
Vzácněji se může objevit i kwashiorkor. Toto onemocnění vzniká z nedostatku bílkovin, na kůži se mohou objevit v místě tření hyperpigmentace, hypopigmentace, vezikuly až buly či eroze [1,4,5].
Dermatózy vznikající v důsledku léčby IBD
V léčbě IBD se používají aminosalicyláty, antibiotika, kortikoidy, imunosupresiva a v poslední době stále častěji biologické preparáty. Mezi imunosupresiva používaná v léčbě IBD patří především azathioprin či metotrexát. Z biologik se nejčastěji a nejdéle využívají anti-TNF preparáty – infliximab, adalimumab, certolizumab, golimumab, dále antiintegrinová protilátka vedolizumab a nověji také inhibitor IL-12/ IL-23 ustekinumab. Každý systémově podávaný lék může potenciálně vést ke vzniku nežádoucího účinku.
Nežádoucí účinky systémových kortikoidů na kůži jsou dobře známy. Jedná se především o atrofii kůže a vznik tzv. papírové kůže, dále vznik petechií, hematomů, teleangiektázií, acne steroidea. U žen se může objevit hirsutizmus. V průběhu užívání kortikoidů je zaznamenáno zhoršené hojení ran.
Častým imunosupresivním lékem používaným v léčbě IBD je azathioprin. Při jeho užívání je vhodné pacienty poučit o riziku fototoxické reakce, tzn. možnosti vzniku exantému po expozici UV záření. Dalším důvodem fotoprotekce u pacientů užívajících tento lék je také zvýšené riziko maligních kožních nádorů v kombinaci s UV zářením (viz dále). U pacientů léčených azathioprinem častěji zaznamenáváme kožní infekční komplikace, a to především virové etiologie jako virové veruky, genitální bradavice, rekurentní infekce herpes simplex či herpes zoster. Virové veruky bývají často mnohočetné a rezistentní na léčbu.
Až u 20 % pacientů s IBD léčených biologickou léčbou se objevují kožní reakce [16,17]. Tyto kožní komplikace lze jako u ostatních imunosupresiv rozdělit na infekční a nádorové. Dále se u pacientů léčených anti-TNF preparáty setkáváme s tzv. paradoxními reakcemi, které jsou poměrně dobře popsanou problematikou. Kromě zmíněných nežádoucích kožních účinků dochází u pacientů ke vzniku či exacerbaci AD.
Za paradoxní reakci považujeme indukci či exacerbaci nemoci (např. psoriázy, palmoplantární pustulózy) v průběhu léčby základní nemoci (IBD, revmatoidní artritidy) v důsledku podávaného léku (infliximab, adalimumab), který se běžně používá k léčbě indukované nemoci. V případě anti-TNF preparátů se incidence těchto reakcí pohybuje v rozmezí 0,6 – 5,3 % [18]. Mezi nejčastější paradoxní reakce patří psoriáza (obr. 7) a palmoplantární pustulóza (obr. 8). Možným vysvětlením paradoxní reakce je zvýšená produkce interferonu alfa (INF-α) dendritickými buňkami v důsledku inhibice TNF-α [19 – 22]. Psoriatické plaky u pacientů s IBD léčených inhibitory TNF jsou charakterizovány infiltrací Th1 lymfocytů exprimujících INF-γ a Th17 lymfocytů exprimujících IL-17A a IL-22 [22].
Obr. 7. Psoriáza. Fig. 7. Psoriasis. 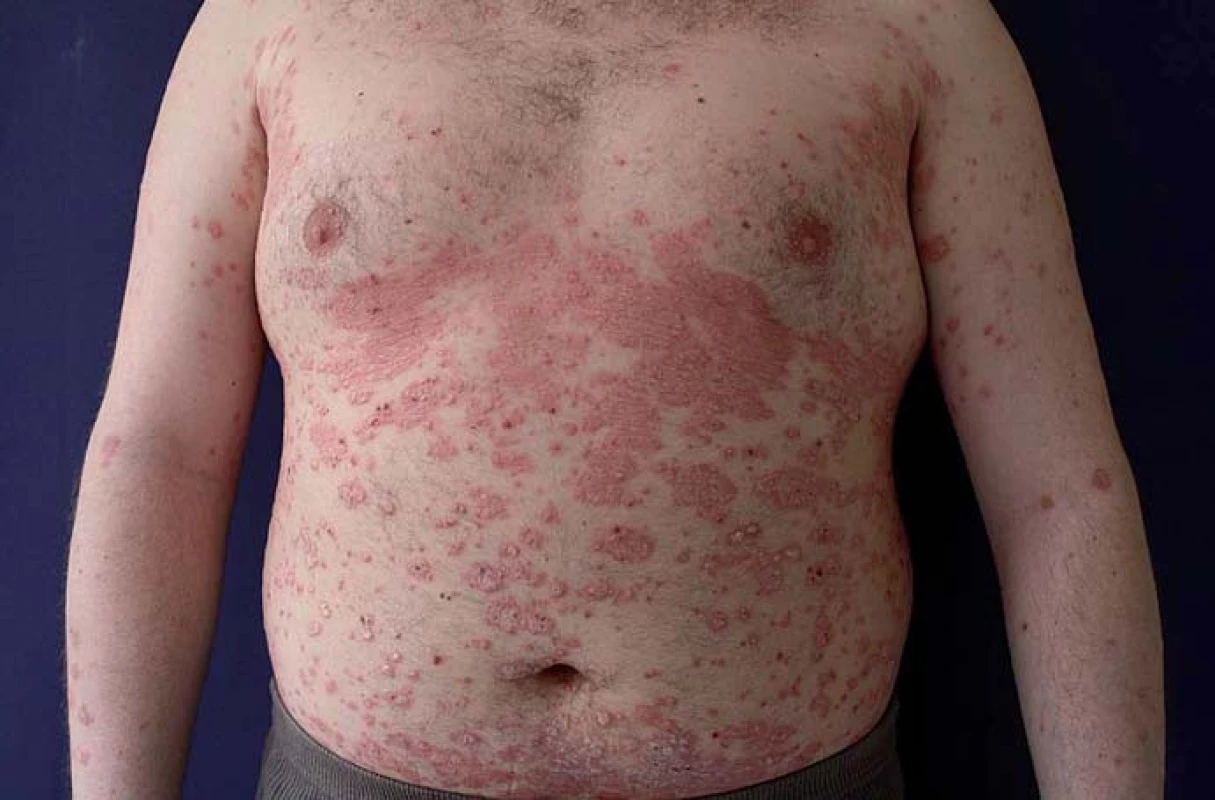
Obr. 8. Palmoplantární pustulóza. Fig. 8. Palmoplantar pustulosis. 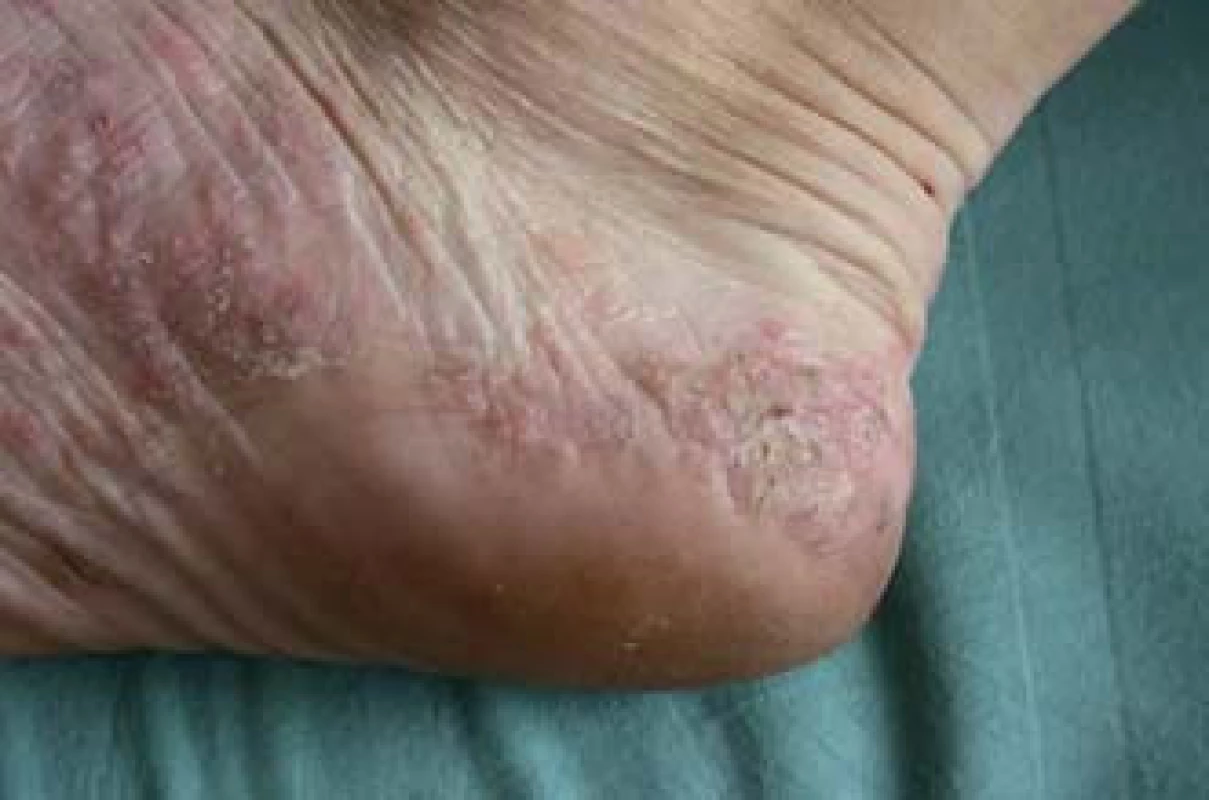
V případě vzniku psoriázy v průběhu léčby zahajujeme místní terapii kortikoidy, deriváty vitaminu D3, dehty či keratolytiky. V případě vzniku paradoxní reakce je vždy nutná vzájemná spolupráce s gastroenterologem. Pokud je z gastroenterologického hlediska nutno v léčbě anti-TNF pokračovat a místní léčba není dostatečná, na řadu přichází systémová léčba psoriázy nejčastěji acitretinem či metotrexátem [19]. Světloléčba nebývá u těchto pacientů vhodná, neboť bývají současně či anamnesticky léčeni azathioprinem, jehož užívání v kombinaci s UV zářením zvyšuje riziko nemelanomových kožních nádorů. Výměna infliximabu za adalimumab či naopak nebývá příliš úspěšná, neboť paradoxní reakce po výměně preparátu často přetrvává nebo se objeví později [17,20]. Slibnou možností je v případě těžké psoriázy ustekinumab [22,23].
Ekrinní potní žlázy ve dlaních a na ploskách za normálních okolností exprimují TNF. Michaelsson et al předpokládají, že zánět v podobě palmoplantární pustulózy je navozen inhibicí TNF-α v důsledku léčby [24]. V systémové léčbě palmoplantární psoriázy upřednostňujeme acitretin, který bývá velice účinný. Výhodou acitretinu je především fakt, že nemá imunosupresivní účinek. Na druhou stranu jeho užití má i jisté limity. Jedná se především o teratogenní účinek, který přetrvává ještě 2 roky po jeho vysazení. Z dalších nepříjemných vedlejších účinků je vhodné zmínit suchost kůže a sliznic, výpad vlasů a elevaci jaterních testů a triglyceridů.
Podle některých autorů jsou paradoxní reakce častější u žen [19]. Vyšší BMI a kouření byly v jiné studii shledány jako rizikové faktory pro rozvoj paradoxní psoriázy [22,25]. Medián v rozvoji psoriázy se u těchto pacientů pohybuje okolo 9,5 měsíce od zahájení léčby. Paradoxní reakce se ovšem může objevit i po jedné aplikaci, ale také za 63 měsíců po zahájení léčby [26]. Z toho vyplývá, že paradoxní reakce se mohou objevit kdykoli v průběhu léčby [19].
Mezi jiné paradoxní reakce se řadí PG, IBD, sarkoidóza, uveitida či vaskulitida. Za hlavní příčinu paradoxních reakcí je považována dysbalance rovnováhy TNF-α a IFN-α [20,21,27].
V některých případech je na základě klinického i histologického obrazu těžké rozhodnout, zda se jedná o psoriázu či ekzém. Histologicky pak u těchto případů vídáme spongiotickou dermatitidu (tzn. ekzém), často však s psoriaziformními rysy (papilomatóza, pravidelná akantóza, hyperparakeróza) (obr. 9). Kožní reakce tohoto charakteru bývají podobně jako AD komplikovány stafylokokovou superinfekcí. Tyto projevy se většinou daří zvládnout intenzivní místní léčbou bez vysazení preparátu. V případě výrazného postižení kštice s mohutnou deskvamací a výpadem vlasů se u většiny případů přikláníme k vysazení preparátu, neboť právě v tomto případě nebývá místní léčba úspěšná.
Obr. 9. Psoriaziformní dermatitida. Fig. 9. Psoriasiform dermatitis. 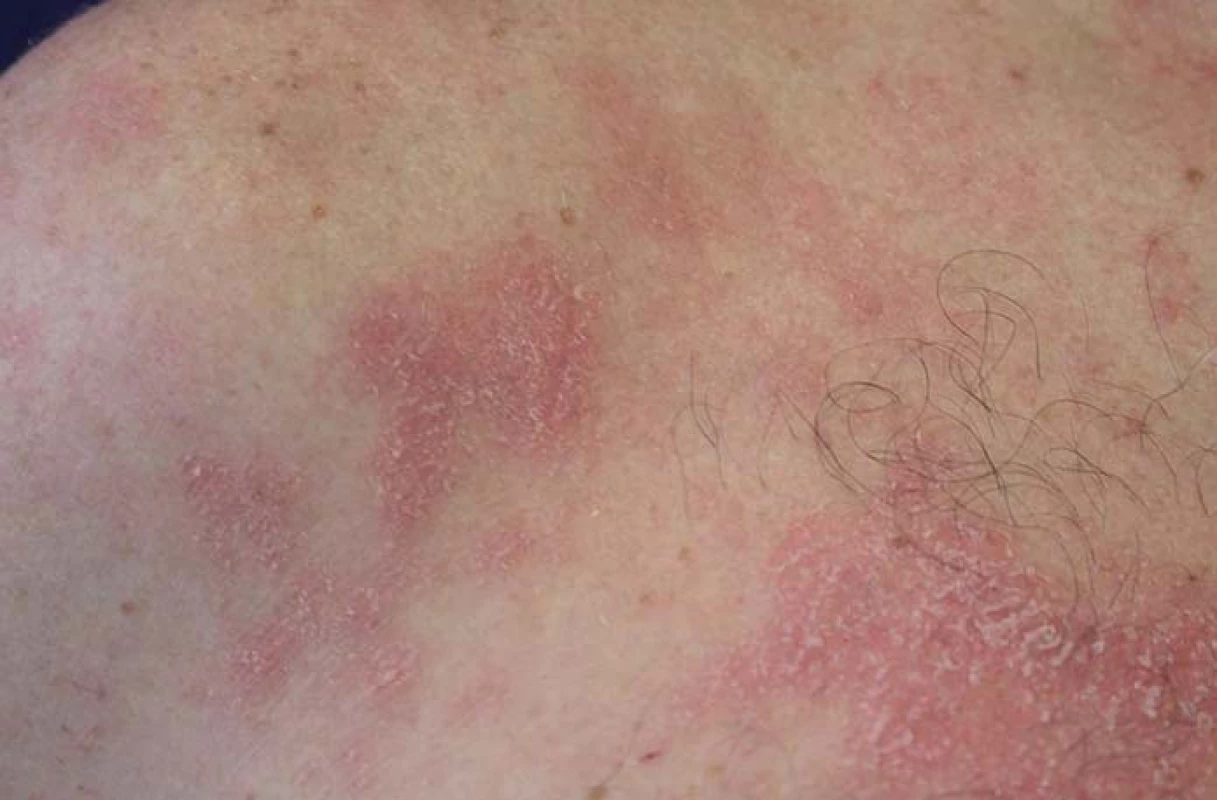
Po vysazení léku dochází u většiny pacientů ke spontánnímu zhojení kožních projevů, ovšem u některých pacientů mohou kožní projevy přetrvávat i několik měsíců po vysazení vyvolávajícího léku. Na základě našich zkušeností konstatujeme, že při závažném postižení kštice přetrvávají kožní projevy i za současné intenzivní místní léčby v řádu několika měsíců, někdy dojde k plnému zhojení ad integrum až za rok od vysazení léku.
Ve srovnání s paradoxními reakcemi chybí často v publikovaných pracích zmínka o exacerbaci či zhoršení AD, kterou u pacientů léčených inhibitory TNF vídáme ze všech kožních reakcí nejčastěji [28]. Někdy se u těchto pacientů vyskytují pouze frustní formy v podobě extrémní suchosti kůže či svědění bez výraznějšího specifického exantému. Možným vysvětlením vzniku či exacerbace AD je fakt, že při léčbě inhibitory TNF dochází k poruše rovnováhy Th1 – Th2 ve smyslu snížení produkce Th1 cytokinů (IL-1, TNF-α, IFN-γ), a tudíž k následné manifestaci chorob s převahou Th2 lymfocytů, tedy AD [29]. AD bývá často komplikována superinfekcí Staphylococcus aureus (obr. 10). Průběh dermatitidy bývá při konkomitantní terapii azathioprinem dle našich zkušeností mírnější než v monoterapii inhibitory TNF. Důležité je včas zahájit intenzivní místní léčbu. U většiny pacientů nebývá nutnost vysazení preparátu.
Obr. 10. Atopická dermatitida s impetiginizací. Fig. 10. Atopic dermatitis with impetiginization. 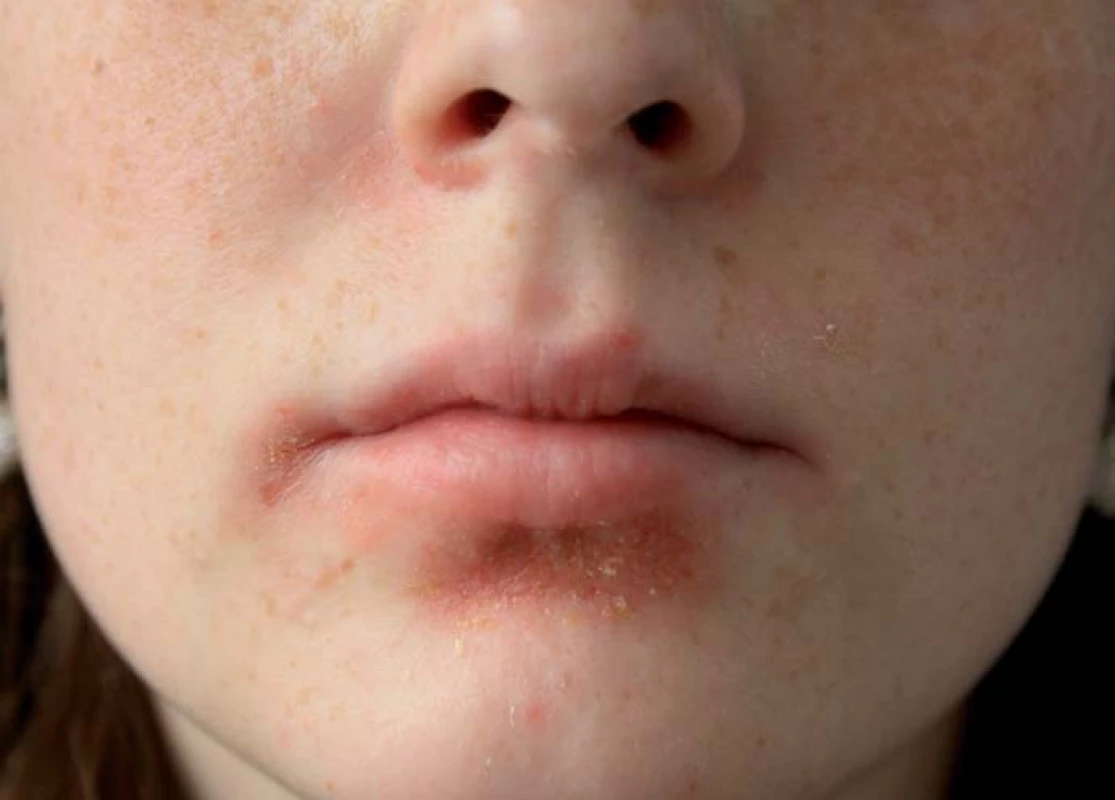
Z našich zkušeností vyplývá, že mezi nejčastější kožní infekční komplikace u pacientů na biologické léčbě se vyskytuje impetigo, folikulitida či abscesy. Jedná se o tzv. pyodermie, tedy bakteriální kožní infekce způsobené pyogenními koky nejčastěji Staphylococcus aureus [17]. Většinou stačí místní, popř. systémová antibiotická terapie bez nutnosti přerušení či ukončení biologické léčby. U recidivujících pyodermií se u našich pacientů osvědčuje antiseptické mýdlo s hexamidinem, chlorhexidinem a chlorkresolem. V případě vzniku rozsáhlého abscesu či abscedující flegmóny je na místě dočasné přerušení biologické léčby.
U některých pacientů léčených biologickými preparáty dochází v důsledku imunosuprese k recidivujícímu herpes simplex. Může být způsoben Herpes simplex virus 1 nebo 2. Mezi časté lokalizace patří ret, nos, hýždě nebo oblasti genitálu. V těchto případech se doporučuje profylaktická terapie aciklovirem nebo valaciklovirem.
Kožní nádorové komplikace
Mezi nejčastější maligní kožní nádory v běžné populaci patří bazocelulární karcinom (BCC – basal cell carcinoma). Jedná se o nemelanomový kožní nádor vycházející z bazálních buněk epidermis a terminálního folikulu, který infiltruje okolí a může způsobit až jeho destrukci. Nemá tendenci k metastazování. Druhým nejčastějším maligním kožním nádorem v běžné populaci je spinocelulární karcinom (SCC – squamous cell carcinoma). U imunosuprimovaných pacientů je nejčastějším kožním maligním tumorem právě SCC. Patří mezi nemelanomové kožní nádory a vzniká maligní proliferaci keratinocytů epidermis a kožních adnex. Na rozdíl od BCC může SCC metastazovat do regionálních lymfatických uzlin a následně i do vzdálenějších orgánů. Toto riziko se odhaduje na 2 – 5 % [30].
Nádory u imunosuprimovaných pacientů jsou často mnohočetné, recidivují a mají tendenci k agresivnějšímu chování s časným metastazováním [30 – 33]. Významnou roli kromě známých rizikových faktorů sehrává typ a délka imunosuprese, která působí jednak přímo karcinogenně na keratinocyty, zároveň také ovlivňuje imunitní kontrolní mechanizmy buňky.
V populaci pacientů po orgánových transplantacích jsou za nejvíce rizikové považovány kalcineurinové inhibitory (cyklosporin, takrolimus), naopak protektivní efekt je pozorován u mTOR inhibitorů (mammalian target of rapamycin – sirolimus, everolimus) [30,34]. V případě léčby IBD je v souvislosti s kožními tumory potřeba zmínit především azathioprin, který zvyšuje citlivost buněk k UVA indukovanému poškození [30,35]. To potvrzuje, že nejen UVB, ale také UVA sehrává roli v karcinogenezi u pacientů na dlouhodobé imunosupresi.
U pacientů s IBD je často obtížné odhadnout riziko vzniku maligního nádoru pro jednotlivá imunosupresiva, protože jsou preparáty užívány v kombinaci, dále u většiny pacientů předchází biologické léčbě např. léčba azathioprinem a v průběhu léčby dochází často ke střídání různých preparátů.
Co se týče výskytu maligního melanomu a nemelanomových kožních nádorů u pacientů s IBD léčených inhibitory TNF, nebyla metaanalýzami ani v TREAT (Crohn’s Therapy, Resource, Evaluation, and Assessment Tool) registru zaznamenána zvýšená inicidence [36,37]. Zvýšené riziko nemelanomových kožních nádorů bylo potvrzeno u pacientů s IBD léčených azathioprinem nebo v kombinované terapii azathioprinem a inhibitory TNF. V kombinované terapii zvyšuje riziko nemelanomových kožních nádorů azathioprin [38]. Proto je u těchto pacientů potřeba dbát na důslednou fotoprotekci.
Reakce v místě aplikace
Jedná se o poměrně časté vedlejší kožní reakce vyskytující se u pacientů, u kterých jsou subkutánně aplikovány monoklonální protilátky. Do klinického obrazu patří erytém, svědění, pálení či bolest v okolí vpichu. Většinou se tyto reakce objeví za 1 – 2 dny po aplikaci a spontánně odezní, nejpozději do 1 měsíce. Při opakované aplikaci intenzita reakce slábne. U pacientů s CD léčených adalimumabem se reakce v místě vpichu objevuje asi u 4,2 % pacientů [28]. V případě výraznějšího pálení či svědění se doporučuje místní aplikace kortikosteroidů.
Závěr
Kožní projevy IBD se mohou vyskytovat současně nebo mohou i o několik let předcházet střevnímu postižení. Dermatolog tak může přispět k včasné diagnostice střevní nemoci. Vzhledem k rozmanitým kožním chorobám, jež se vyskytují u pacientů s IBD nebo vznikají v důsledku léčby IBD, je na místě spolupráce gastroenterologa s dermatologem. Vždy je potřeba individuální přístup ke konkrétnímu pacientovi. V případě vzniku kožní choroby v průběhu léčby není vždy nutné daný lék vysadit.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 20. 1. 2017
Přijato: 26. 1. 2017
MU Dr. Kateřina Jůzlová, Ph.D.
Dermatovenerologická klinika
2. LF UK a Nemocnice Na Bulovce
Budínova 67/ 2
180 81 Praha 8
katerina.juzlova@gmail.com
MUDr. Kateřina Jůzlová, Ph.D.
Autorka se narodila 16. prosince 1983 v Písku. V roce 2009 promovala na 1. LF UK v Praze. Od roku 2009 pracuje na Dermatovenerologické klinice 2. LF UK a Nemocnice Na Bulovce a od roku 2015 také na Dermatovenerologickém oddělení IKEM. V roce 2014 složila atestaci z dermatovenerologie a v roce 2016 z korektivní dermatologie. Od roku 2014 působí jako odborný asistent na 2. LF UK v Praze. V roce 2015 úspěšně ukončila doktorandské studium a obhájila titul Ph.D. v oboru preventivní medicína, ve své dizertační práci se zaměřila na prevalenci střevních zánětlivých onemocnění u pacientů s psoriázou. Ve svém oboru se věnuje především biologické léčbě psoriázy, venerologii, dermatoonkologii a estetické dermatologii. Podílí se na řešení grantových projektů (např. GAUK – „Prevalence metabolického syndromu a aterosklerózy u psoriatiků “, IGA – „Rizikové faktory komorbidit psoriázy využitelné v sekundární prevenci“ nebo AZV – „Změny ve složení mikrobiomu jako rizikový faktor v rozvoji psoriázy“). Je autorkou a spoluautorkou odborných publikací v českých i zahraničních periodicích. V roce 2016 získala cenu prof. Novotného za nejlepší publikaci mladým dermatologem na téma psoriázy.
Zdroje
1. Fialová J, Vojáčková N, Stránská J et al. Kožní projevy Crohnovy choroby. Čes Dermatoven 2012; 2(3): 168 – 172.
2. Bonheur JL, Braunstein J, Korelitz BI et al. Anal skin tags in inflammatory bowel disease: new observations and a clinical review. Inflamm Bowel Dis 2008; 14(9): 1236 – 1239. doi: 10.1002/ ibd.20458.
3. Thrash B, Patel M, Shah KR et al. Cutaneous manifestations of gastrointestinal disease: part II. J Am Acad Dermatol 2013; 68(2): 211.e1 – 211.e33. doi: 10.1016/ j.jaad.2012.10.036.
4. Jůzlová K, Votrubová J, Fialová J et al. Kožní projevy gastrointestinálních chorob. Postgrad Med 2013; 15(3): 34 – 37.
5. Jůzlová K, Hercogová J. Kůže – zrcadlo vnitřních nemocí. Vnitř Lék 2016; 62(7 – 8): 575 – 581.
6. Bolognia JL, Jorizzo JL, Rapini RP. Dermatology. 2nd ed. New York: Mosby 2008.
7. Cetkovská P, Pizinger K, Štork J. Kožní změny u interních onemocnění. 1. vyd. Praha: Grada Publishing 2010 : 51 – 59.
8. Braun-Falco O, Plewig G, Wolff HH et al. Dermatology. 2nd ed. Berlin, Heidelberg, New York: Springer 2000 : 912 – 915.
9. Slezák K, Dřízhal I. Atlas onemocnění ústní sliznice. Praha: Quintessenz 2004 : 190 – 192.
10. Hercogová J. Psoriasis. Čes Dermatoven 2011; 1(1): 8 – 26.
11. Votrubova J, Juzlova K, Smerhovsky Z et al. Risk factors for comorbidities in Czech psoriatic patients: results of a hospital-based case-control study. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2014; 158(2): 288 – 294.
12. Jůzlová K, Votrubová J, Krásová M et al. Rizikové faktory komorbidit psoriázy využitelné v sekundární prevenci. Čes Dermatoven 2016; 6(2): 7 – 23.
13. Darsow U, Raap U, Ständer S. Atopic dermatitis. In: Carstens E, Akiyama T (eds). Itch: mechanisms and treatment. Boca Raton (FL): CRC Press 2014.
14. Yazdanyar S, Miller IM, Jemec GB. Hidradenitis suppurativa and Crohn’s disease: two cases that support an association. Acta Dermatovenerol Alp Pannonica Adriat 2010; 19(3): 23 – 25.
15. Van der Zee HH, van der Woude CJ, Florencia EF et al. Hidradenitis suppurativa and inflammatory bowel disease: are they associated? Results of a pilot study. Br J Dermatol 2010; 162(1): 195 – 197. doi: 10.1111/ j.1365-2133.2009.09430.x.
16. Fidder H, Schnitzler F, Ferrante M et al. Long-term safety of infliximab of inflammatory bowel disease: a single centre cohort study. Gut 2009; 58(4): 501 – 508. doi: 10.1136/ gut.2008.163642.
17. Fréling E, Baumann C, Cuny JF et al. Cumulative incidence of, risk factors for, and outcome of dermatological complications of anti-TNF therapy in inflammatory bowel disease: a 14-year experience. Am J Gastroenterol 2015; 110(8): 1186 – 1196. doi: 10.1038/ ajg.2015.205.
18. Ko JM, Gottlieb AB, Kerbleski JF. Induction and exacerbation of psoriasis with TNF-blockade therapy: a review and analysis of 127 cases. J Dermatolog Treat 2009; 20(2): 100 – 108. doi: 10.1080/ 0954663 0802441234.
19. Collamer AN, Guerrero KT, Henning JS et al. Psoriatic skin lesions induced by tumor necrosis factor antagonist therapy: a literature review and potential mechanisms of action. Arthritis Rheum 2008; 59(7): 996 – 1001. doi: 10.1002/ art.23835.
20. Cullen G, Kroshinsky D, Cheifetz AS et al. Psoriasis associated with anti-tumour necrosis factor therapy in inflammatory bowel disease: a new series and a review of 120 cases from the literature. Aliment Pharmacol Ther 2011; 34(11 – 12): 1318 – 1327. doi: 10.1111/ j.1365-2036.2011.04866.x.
21. de Gannes GC, Ghoreishi M, Pope J et al. Psoriasis and pustular dermatitis triggered by TNF-{alpha} inhibitors in patients with rheumatologic conditions. Arch Dermatol 2007; 143(2): 223 – 231.
22. Tillack C, Ehmann LM, Friedrich Met al. Anti-TNF antibody-induced psoriasiform skin lesions in patients with inflammatory bowel disease are characterised by interferon-γ-expressing Th1 cells and IL-17A/ IL-22-expressing Th17 cells and respond to anti-IL-12/ IL-23 antibody treatment. Gut 2014; 63(4): 567 – 577. doi: 10.1136/ gutjnl-2012-302853.
23. Sansó Sureda A, Rocamora Durán V, Sapiña Camaró A et al. Ustekinumab in a patient with Crohn’s disease and anti-TNF-α-induced psoriasis. Gastroenterol Hepatol 2011; 34(8): 546 – 550. doi: 10.1016/ j.gastrohep.2011.04.003.
24. Michaëlsson G, Kajermo U, Michaëlsson A et al. Infliximab can precipitate as well as worsen palmoplantar pustulosis: possible linkage to the expression of tumour necrosis factor-alpha in the normal palmar eccrine sweat duct? Br J Dermatol 2005; 153(6): 1243 – 1244.
25. Pugliese D, Guidi L, Ferraro PM et al. Paradoxical psoriasis in a large cohort of patients with inflammatory bowel disease receiving treatment with anti-TNF alpha: 5-year follow-up study. Aliment Pharmacol Ther 2015; 42(7): 880 – 888. doi: 10.1111/ apt.13352.
26. Wollina U, Hansel G, Koch A et al. Tumor necrosis factor-alpha inhibitor-induced psoriasis or psoriasiform exanthemata: first 120 cases from the literature including a series of six new patients. Am J Clin Dermatol 2008; 9(1): 1 – 14. Erratum in: Am J Clin Dermatol 2008; 9(5): 347.
27. Medkour F, Babai S, Chanteloup E et al. Development of diffuse psoriasis with alopecia during treatment of Crohn’s disease with infliximab. Gastroenterol Clin Biol 2010; 34(2): 140 – 141. doi: 10.1016/ j.gcb.2009.10.021.
28. Bremmer M, Deng A, Gaspari AA. A mechanism-based classification of dermatologic reactions to biologic agents used in the treatment of cutaneous disease: part 2. Dermatitis 2009; 20(5): 243 – 256.
29. Chan JL, Davis-Reed L, Kimball AB. Counter-regulatory balance: atopic dermatitis in patients undergoing infliximab infusion therapy. J Drugs Dermatol 2004; 3(3): 315 – 318.
30. Džambová M, Sečníková Z, Rob F et al. Spinocelulární karcinom. Čes Dermatoven 2015; 5(1): 7 – 18.
31. Mackintosh LJ, Geddes CC, Herd RM. Skin tumours in the West of Scotland renal transplant population. Br J Dermatol 2013; 168(5): 1047 – 1053. doi: 10.1111/ bjd.12129.
32. Bernat García J, Morales Suárez-Varela M, Vilata JJ et al. Risk factors for non-melanoma skin cancer in kidney transplant patients in a Spanish population in the Mediterranean region. Acta Derm Venereol 2013; 93(4): 422 – 427. doi: 10.2340/ 000 15555-1525.
33. Zwald FO, Brown M. Skin cancer in solid organ transplant recipients: advances in therapy and management: part I. Epidemiology of skin cancer in solid organ transplant recipients. J Am Acad Dermatol 2011; 65(2): 253 – 261. doi: 10.1016/ j.jaad.2010.11.062.
34. Sečníková Z, Džambová M, Vojáčková N et al. Kožní nemoci u pacientů po transplantaci. Čes Dermatovener 2012; 2(4): 244 – 249.
35. Sečníková Z, Džambová M, Hercogová J. Role virů, UV záření a imunosuprese v patogenezi kožních nádorů u pacientů po transplantaci orgánů. Čes Dermatovener 2014; 4(2): 88 – 93.
36. Singh JA, Wells GA, Christensen R et al. Adverse effects of biologics: a network meta-analysis and Cochrane overview. Cochrane Database Syst Rev 2011; 2: CD008794. doi: 10.1002/ 14651858.CD008794.pub2.
37. Lichtenstein GR, Feagan BG, Cohen RDet al. Serious infection and mortality in patients with Crohn’s disease: Serious infection and mortality in patients with Crohn’s disease: more than 5 years of follow-up in the TREAT™ registry. Am J Gastroenterol 2012; 107(9): 1409 – 1422. doi: 10.1038/ ajg.2012.218.
38. Targownik LE, Bernstein CN. Infectious and malignant complications of TNF inhibitor therapy in IBD. Am J Gastroenterol 2013; 108(12): 1835 – 1842. doi: 10.1038/ ajg.2013.294.
Štítky
Alergologie a imunologie Dermatologie Dětská dermatologie Dětská gastroenterologie Dětská pneumologie Gastroenterologie a hepatologie Chirurgie všeobecná Pneumologie a ftizeologie Praktické lékařství pro dospělé
Článek Novinky v roce 2017Článek Gastrointestinální infekceČlánek RealistaČlánek Jaká je Vaše diagnóza?Článek Recenze knihyČlánek Správná odpověď na kvíz
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2017 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
-
Všechny články tohoto čísla
- Czech Working Group for Paediatric Gastroenterology and Nutrition guidelines for diagnostics and treatment of inflammatory bowel diseases in children – 1stedition update
- Léčba vedolizumabem u pacientů s idiopatickými střevními záněty v České republice
- Intraoperačná enteroskopia je bezpečná a je prínosom v určení rozsahu resekčného výkonu pri Crohnovej chorobe
- Možnosti miniinvazivní chirurgie u pacientů s Crohnovou nemocí a ulcerózní kolitidou
- Ustekinumab – nové biologikum v terapii Crohnovy nemoci
- Kožní problematika u pacientů s idiopatickými střevními záněty
- Imunoglobulin G4 asociovaná sklerozující cholangitida u pacienta s Crohnovou nemocí
- Receptorové mechanizmy aktivácie pažerákových nervov kyselinou
- Celiakie, která není celiakií?
- Novinky v roce 2017
- Mění se chirurgická léčba stenotického karcinomu rekta?
- Recenze knihy
- Looking back at the XVth intensive IBD course for doctors and nurses
- 14th Training and Discussion Gastroenterology Days
-
Gastrointestinal infections
Herbert Tilg Lecture – Gastro Update Europe 2016, Prague - Výběr z mezinárodních časopisů
- Realista
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test
- Ginkor Fort® s obsahem extraktu z jinanu dvoulaločnatého
- Jaká je Vaše diagnóza?
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Kožní problematika u pacientů s idiopatickými střevními záněty
- Celiakie, která není celiakií?
- Ginkor Fort® s obsahem extraktu z jinanu dvoulaločnatého
- Mění se chirurgická léčba stenotického karcinomu rekta?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




