-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kombinovaná léčba chronické hepatitidy B
Combination therapy of chronic hepatitis B
Chronic hepatitis B infection is still a major global medical problem because of the risk it poses for progression to liver cirrhosis and its associated complications (portal hypertension, liver failure, and hepatocellular carcinoma). However, a very effective therapy based on nucleos(t)ide analogues is now available. This therapy, which is associated with a very low risk of development of resistant mutations, is very effective for the suppression of hepatitis B virus DNA. However, it has a minimal effect on the intracellular reservoir of hepatitis B virus (covalently closed circular DNA) and has a no effect on HBsAg synthesis; thus, it does not provide a definitive cure. Medication must be taken long-term (eventually lifelong), because stopping treatment leads to the reemergence of viremia. Therapy with pegylated interferon is another treatment option. Interferon, with its antiviral and imunomodulatory properties, can lead to clearance of infected hepatocytes and therefore a decrease in the level of covalently closed circular DNA in the liver. This therapy is taken only for a limited duration (48 weeks) and, although it has more side effects than nucleos(t)ide analogue therapy, it is associated with a higher chance of eliminating HBsAg. This paper will review the feasibility of using combinatory therapy with nucleos(t)ide analogues and pegylated interferon to shorten of length of therapy and increase the chance of obtaining a definitive cure for HBV infection, i.e., HBsAg clearance.
Key words:
HBV – HBsAg – nucleos(t)ide analogue – PEG-IFN
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
30. 10. 2015Accepted:
1. 12. 2016
Autoři: V. Hejda
Působiště autorů: Gastroenterologické a hepatologické oddělení, 1. interní klinika LF UK a FN Plzeň
Vyšlo v časopise: Gastroent Hepatol 2016; 70(1): 65-73
Kategorie: Hepatologie: přehledová práce
doi: https://doi.org/10.14735/amgh201665Souhrn
Chronická hepatitida B zůstává závažným zdravotním problémem především pro svoje riziko progrese do jaterní cirhózy s rozvojem komplikací (portální hypertenze, jaterní selhání, hepatocelulární karcinom). V současné době máme k dispozici velmi účinnou a efektivní léčbu nukleos(t)idovými analogy, která mají velmi nízké riziko rozvoje mutací vedoucích k rezistenci a velmi účinně suprimují hladinu HBV DNA, která je hlavním rizikovým faktorem rozvoje uvedených komplikací. Tyto léky však nemají žádný efekt na intracelulární rezervoár viru – kovalentně vázanou cirkulární DNA – a neovlivňují syntézu HBsAg. Šance na eliminaci HBsAg, a tedy eradikaci infekce, je velmi nízká, a tyto léky je proto nutné užívat dlouhodobě (event. doživotně), neboť při ukončení léčby dochází k novému vzestupu viremie. Léčba pegylovaným interferonem je druhou možností terapie chronické infekce virem hepatitidy B. Interferon svým protivirovým a imunomudulačním účinkem částečně vede k eliminaci infikovaných hepatocytů, a tím snižuje pool kovalentně vázané cirkulární DNA v játrech. Tato léčba je časově ohraničená a je spojena s vyšší šancí na eliminaci HBsAg, ale je zatížena řadou nežádoucích účinků. Je logickou otázkou, zda kombinace obou skupin léků (nukleos(t)idová analoga a pegylovaný interferon) nemůže vést k uplatnění výhod obou preparátů a ke zvýšení účinnosti léčby a event. k jejímu zkrácení, především ve vztahu k optimálnímu vyústění léčby, tedy eliminaci HBsAg.
Klíčová slova:
HBV – HBsAg – nukleos(t)idová analoga – PEG-IFNÚvod
Na celém světě je chronicky infikováno virem hepatitidy B (HBV) přibližně 350 mil. osob a toto onemocnění je příčinou cca 600 tis. až 1 mil. úmrtí ročně [1]. Ve vyspělých zemích vč. ČR došlo v posledních dekádách k významnému poklesu incidence akutní hepatitidy B, především v důsledku plošného očkování [2,3]. Stále se však v populaci vyspělých zemí nachází řada nemocných infikovaných v minulosti, u kterých onemocnění dospělo do pokročilého stadia, a kteří tedy vyžadují účinnou a efektivní léčbu. Prevalence chronické HBV infekce v EU je odhadována na 0,1 – 0,7 %. Asi u 20 – 30 % nemocných s chronickou hepatitidou B se vyvine jaterní cirhóza s asi 25% rizikem následného rozvoje hepatocelulárního karcinomu (HCC); roční riziko rozvoje HCC u pacientů s HBV cirhózou se pohybuje mezi 2 a 5 % [4,5].
Hlavním cílem léčby chronické virové hepatitidy B je prevence progrese do pokročilé fáze jaterního onemocnění, tedy cirhózy jater s rizikem rozvoje komplikací. Obr. 1 ukazuje základní cíle léčby chronické HBV infekce. Ideálním vyústěním léčby by byla definitivní a kompletní remise onemocnění, čemuž nejlépe odpovídá eliminace HBsAg (event. optimálně HBs sérokonverze). Dosažení tohoto cíle je však v klinické praxi poměrně vzácné. Dalším faktorem, který je zásadní pro průběh onemocnění, je viremie (hladina HBV DNA v séru). Ve studii REVEAL bylo prokázáno, že dlouhodobá prognóza pacientů a především riziko progrese onemocnění je determinováno viremií. Pacienti s vyšší viremií mají významně vyšší riziko progrese hepatitidy B do cirhózy a mají významně vyšší riziko rozvoje HCC [6,7]. Stejní autoři poté retrospektivně prokázali podobnou souvislost i mezi kvantitou HBsAg a rizikem uvedených komplikací. Riziko rozvoje HCC během 20 let sledování bylo 1,4; 4,5 a 9,2 % pro pacienty se sérovou hladinou HBsAg < 100, 100 – 999 a ≥ 1 000 IU/ ml [8]. Podobně ve studii ERADICATE bylo potvrzeno, že incidence HCC u HBeAg negativních pacientů závisí především na hladině HBsAg. Tento závěr nebyl potvrzen u HBeAg pozitivních pacientů [9]. Pacienti s eliminací HBsAg mají velmi nízké riziko rozvoje HCC [6]. Pacienti s kompenzovanou jaterní cirhózou, kteří eliminovali HBsAg, mají dobrou prognózu a téměř 100% přežití po 14 letech sledování [10].
Obr. 1. Cíle léčby HBV. Fig. 1. Goals of HBV treatment. 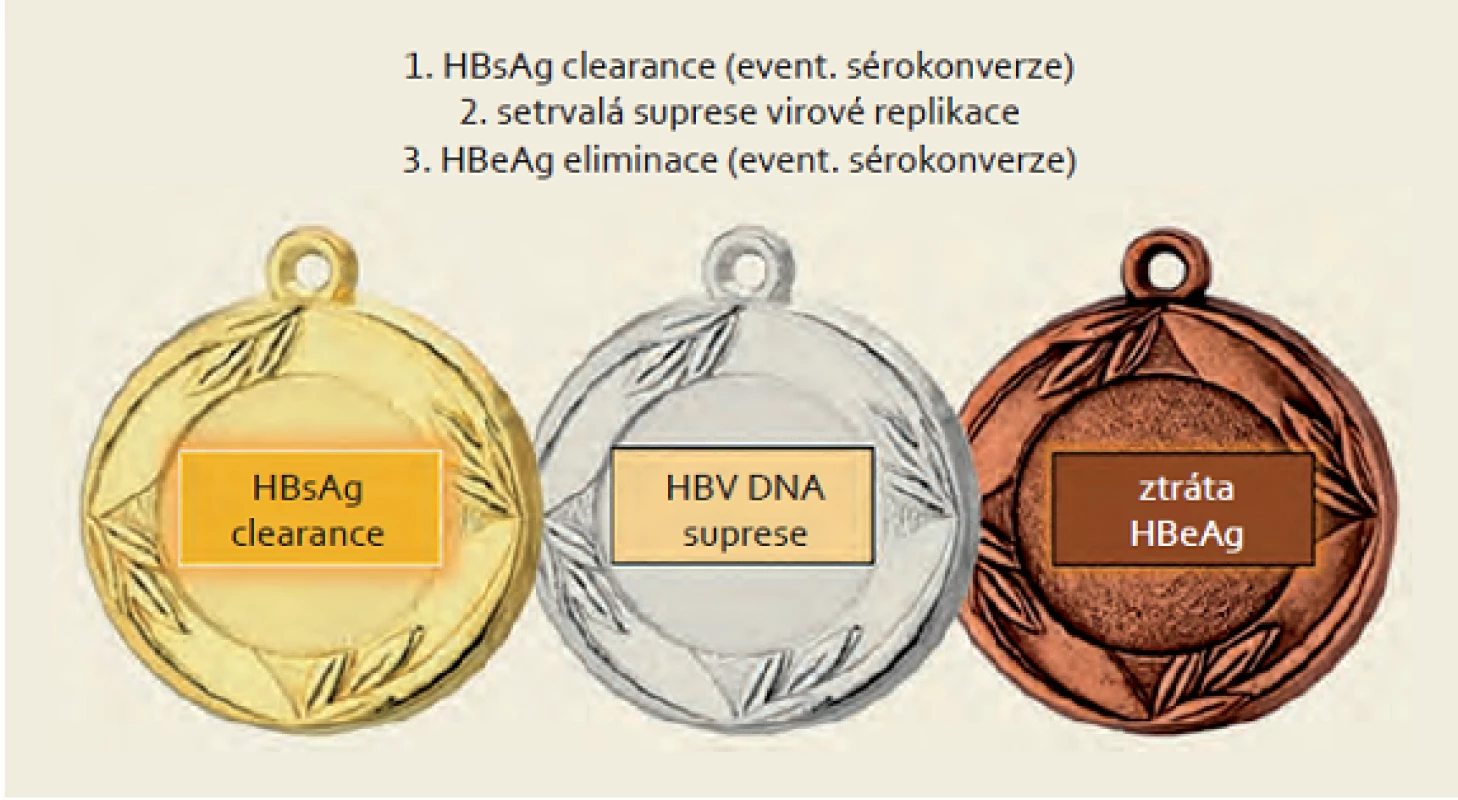
Virová replikace a syntéza HBsAg a význam kovalentně vázané cirkulární DNA v tomto procesu
Pro pochopení, proč lze clearance HBsAg považovat za marker vyléčení, a tedy prioritní cíl léčby, je nutné znát mechanizmus jeho syntézy a vztahu ke kovalentně vázané cirkulární DNA (cccDNA). HBsAg není produkt virové replikace, ale je produkován jako výsledek translace mRNA pocházející z transkripčně aktivní cccDNA nebo HBV DNA integrované v hostitelském genomu. Intracelulární cccDNA funguje jako virový minichromozom v jádře hepatocytu a slouží jako templát pro HBV transkripci v jádře, udržuje HBV infekci a přítomnost cccDNA v jádře je příčinou selhání virové clearance a relapsu virové aktivity po ukončení antivirové terapie. HBsAg opouští buňku dvěma odlišnými cestami, resp. ve dvou formách. HBsAg po zpracování reverzní transkriptázou vytváří kompletně infekční partikule (viriony) schopné infikovat další hepatocyty. Druhou cestou je přesun HBsAg do Golgiho komplexu a následně je z buňky exportován jako prostý sférický či filamentózní neinfekční HBsAg ve formě subvirových částic. Množství HBsAg v séru (neinfekční HBsAg) v podstatě odráží aktivitu replikace viru. Pokud je ale vlastní replikace viru pod kontrolou (buď spontánně, nebo pomocí inhibitorů reverzní transkriptázy), dochází k poklesu až negativizaci produkce infekčních virionů, což klinicky odráží negativní viremie (HBV DNA v séru), ale produkce neinfekčního tubulárního HBsAg z cccDNA zůstává přítomná a je detekovatelná (kvantifikovatelná) v séru. Množství cccDNA (intracelulární marker infekce HBV) v jádře hepatocytu se v běžné klinické praxi nedá změřit, ale zdá se, že kvantita HBsAg (měřitelná v séru) nepřímo odráží koncentraci cccDNA, a tím i počet infikovaných hepatocytů [11 – 14]. Měření koncentrace HBsAg a její kvantifikace před léčbou umožňuje odhadnout úspěšnost léčby. Dynamické sledování HBsAg během léčby potom umožňuje stanovit šanci na optimální vyústění léčby, tedy eliminaci HBsAg [15]. Vstupní hladinu HBsAg a monitorace HBsAg během léčby je tedy možné považovat za prediktor odpovědi na léčbu (neboť HBV DNA je negativní relativně časně) a šanci na eliminace HBsAg [16].
Eliminaci HBsAg je potom možné s určitou rezervou (vzhledem k přetrvávající přítomnosti cccDNA v jádře hepatocytu) považovat za vyléčení z chronické virové hepatitidy B. Ztráta HBsAg je spojena se zlepšením prognózy pacientů [15]. Zdá se však, že i přes eliminaci HBsAg doprovázenou poklesem cccDNA v hepatocytech (zábrana infikace dalších hepatocytů a „naředění“ infikovaných hepatocytů proliferační aktivitou zdravých hepatocytů) bude stále v játrech přetrvávat nízká koncentrace cccDNA [17].
Současná terapie HBV infekce a mechanizmus jejího účinku
V současné době máme k dispozici dvě základní skupiny léků: interferon (IFN), resp. pegylovaný interferon (PEG-IFN) a nukleos(t)idová analoga (NA); preparáty první volby jsou v současné době akceptovány pouze entecavir (ETV) a tenofovir (TDF). Další protivirové preparáty jsou jako léky první volby buď opuštěné, nebo vyhrazené pro speciální klinické situace – lamivudin (LAM), adefovir dipivoxil (ADV) [18].
Mezi oběma skupinami léků jsou zásadní rozdíly v podávání, toleranci a nežádoucích účincích, účinnosti a především mechanizmu účinku. Tyto rozdíly ukazuje tab. 1. Mezi preparáty ze skupiny NA (ETV a TDF) nejsou zásadní rozdíly v účinnosti ani v riziku vzniku rezistentních mutací (které je velmi nízké až nulové).
Tab. 1. Srovnání PEG-IFN a NA v léčbě chronické HBV infekce. Tab. 1. Comparison of PEG-IFN and NA in the treatment of chronic HBV infection. 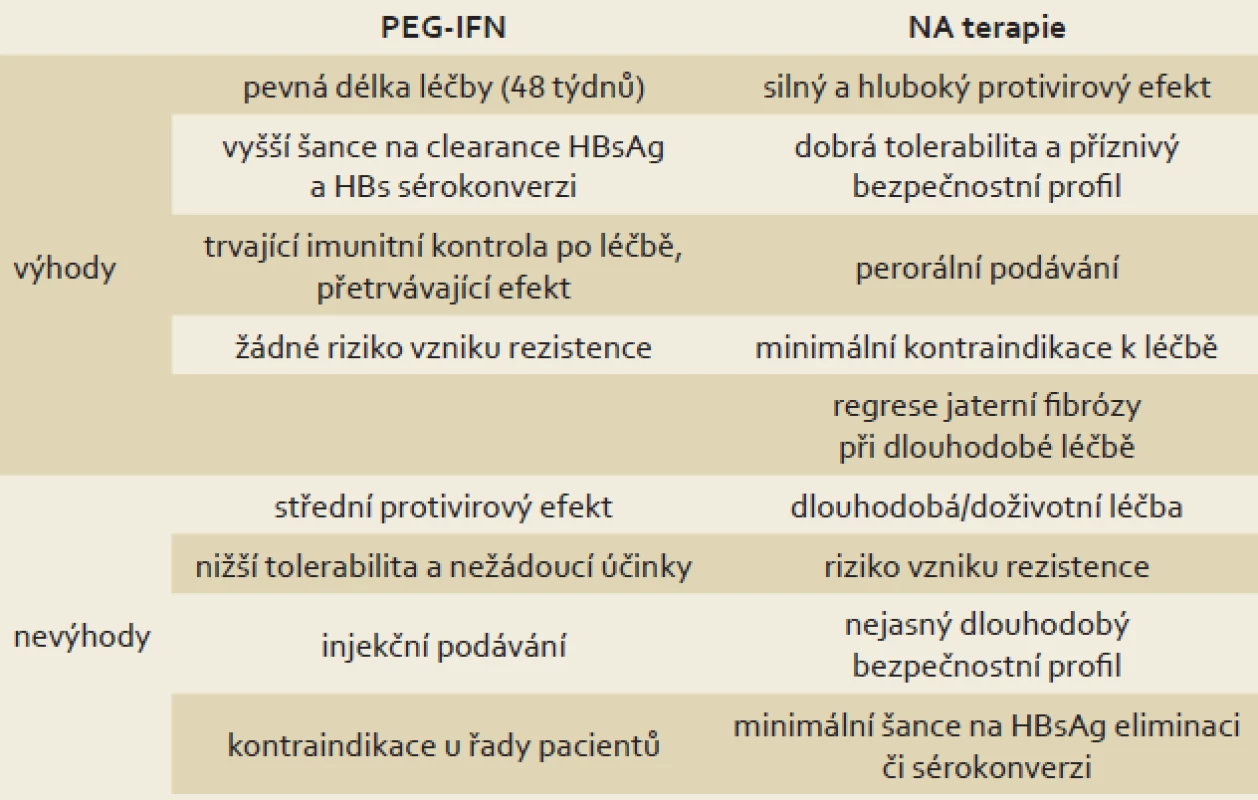
PEG-IFN – pegylovaný interferon, NA – nukleos(t)idová analoga Léčba NA je cílena na redukci viru (viremie) inhibicí reverzní transkriptázy HBV DNA polymerázy. I tento efekt a rychlé dosažení negativní viremie znamená zlepšení prognózy pacientů a snížení rizika progrese onemocnění (viz výše). NA nemají žádný přímý efekt na transkripci a translaci HBsAg a nemají žádný (nebo minimální) efekt na koncentraci a aktivitu cccDNA v jádrech hepatocytů. U léčby NA dochází pouze k pozvolnému poklesu HBsAg (jehož hladina odráží koncentraci cccDNA), který nekoreluje s relativně časnou negativizací viremie. Léčba NA vede tedy k efektivní zástavě replikace viru, ale nikoli k eliminaci cccDNA v jádře hepatocytu, kde pokračuje i nadále sekrece HBsAg (i když neinfekční ve formě filament). Jak ukazuje graf 1 a jak prokázaly dvě studie zabývající se sledováním či matematickým modelováním kinetiky poklesu koncentrace HBsAg, šance na eliminaci HBsAg při léčbě NA (především ETV a TDF) je velmi nízká. První studie udává medián trvání léčby do eliminace HBsAg 36 (10 – 93) let u HBeAg pozitivních pacientů a 39 (1,3 – 90) let u HBeAg negativních pacientů [19]. Ve druhé studii francouzští autoři u dlouhodobě sledovaných a léčených pacientů s HBV infekcí a za pomoci matematického modelování vypočítali časový medián k eliminaci HBsAg na 52,2 let (interquartile range (IQR) 30,8 – 142,7), což dovozuje nutnost dlouhodobé či doživotní léčby NA u pacientů s chronickou hepatitidou B, zvláště u pacientů HBeAg negativních (v ČR převažují), kde eliminace HBsAg je v současné době jedinou akceptovanou možností, jak lze léčbu NA ukončit [18,20]. U pacientů HBeAg negativních dojde většinou po ukončení terapie NA k relapsu onemocnění s elevací ALT a HBV DNA v séru [21].
Graf 1. Šance na dosažení eliminace HBsAg v závislosti na typu a délce léčby. Graph 1. The likelihood of HBsAg elimination according to the type and duration of treatment. 
Léčba IFN, resp. PEG-IFN, která je podávána po časově omezenou dobu (48 týdnů), kombinuje přímý protivirový účinek a imunomodulační a imunostimulační účinek a PEG-IFN interferuje s řadou jednotlivých kroků virové replikace a ovlivňuje buněčnou protivirovou imunitu. PEG-IFN tedy indukuje imunitní odpověď vůči infikovaným hepatocytům, což může vést v určitém procentu případů k eliminaci HBsAg, nicméně tento žádaný cíl je i zde relativně vzácný (ztráta HBsAg u 3 – 7 % pacientů) [18,20].
Odlišným mechanizmem účinku obou skupin léčiv lze tedy vysvětlit rozdíl mezi určitou šancí na eliminaci HBsAg při léčbě IFN a v podstatě nulovou šancí na ztrátu HBsAg při léčbě NA, především u HBeAg negativních pacientů (graf 1).
V současné době tedy máme k dispozici velmi účinné preparáty, které vedou k rychlé a hluboké supresi HBV DNA. Nemáme však k dispozici žádné preparáty, které by vedly současně jak k supresi HBV DNA, tak i ke clearance HBsAg. Tento fakt vedl řadu autorů k myšlence, zda by event. kombinace preparátů z obou skupin (NA + PEG-IFN) nemohla vést ke zvýšení účinnosti léčby a ke zkrácení či omezení délky podávání NA. Teoreticky by kombinace preparátů z obou skupin mohla mít aditivní či synergický efekt, který má i teoretické zdůvodnění. NA vedou efektivně k zástavě replikace viru a zabrání infikaci nových hepatocytů či recyklaci cccDNA novými infekčními viriony (dochází k pomalému poklesu koncetrace cccDNA v hepatocytech) [22] a IFN léčbu intenzifikuje přímým protivirovým a imunomodulačním účinkem vedoucím ke snížení obsahu cccDNA a imunitní eliminaci infikovaných hepatocytů. Z tohoto důvodu se hlavní pozornost zaměřila na kombinaci PEG-IFN s NA, nikoli na kombinaci několika NA, neboť jejich efekt je podobný a šance na eliminaci HBsAg nízká.
V současné době nejsou žádné jasné informace a dostupné výsledky, které by opravňovaly zahájení kombinační léčby v běžné klinické praxi a EASL guidelines [18] zatím tuto léčbu nedoporučují, resp. ji nezmiňují. V poslední době se však objevila řada prací, které se kombinovanou léčbou HBV infekce zabývají a které přinesly nový pohled na tento problém. Nutné je zmínit, že zatím jedinou akceptovanou výjimkou v této oblasti je kombinovaná léčba ETV + TDF u pacientů s vyvinutou mnohočetnou rezistencí na různé NA, která je považována za záchrannou terapii [23].
Kombinovaná léčba HBV – historie
První pokus o kombinovanou léčbu studoval kombinaci lamivudinu (LAM) a PEG-IFN. Kombinace PEG-IFN + LAM ve všech studiích prokázala rychlejší a silnější virologickou a biochemickou odpověď během léčby než větve s monoterapií. Setrvalá odpověď se však po ukončení léčby nelišila od monoterapie PEG-IFN. PEG-IFN prokázal ve většině studií vyšší účinnost při dosažení HBeAg sérokonverze u HBeAg pozitivních pacientů. Kombinace celkově však neprokázala klinický benefit po 48 týdnech léčby a následném sledování a nenabídla vyšší efekt než monoterapie PEG-IFN i s přihlédnutím k šanci na eliminaci HBsAg [24]. Vyšší účinnost kombinační léčby byla spojena s nižším rizikem vzniku rezistence na LAM [24 – 26].
Kombinaci ADV s PEG-IFN zkoumaly pouze malé, nekontrolované studie. Studie prokázaly, že tato kombinace vedla k větší redukci cccDNA v hepatocytech (opakované jaterní biopsie) a k vyšší pravděpodobnosti eliminace HBsAg než léčba monoterapií [27 – 29]. Tyto studie měly již delší trvání léčby (48 týdnů kombinované léčby s následnou léčbou 96 týdnů monoterapií ADV). Kombinovaná léčba inhibovala virovou produkci z 99 %, kdežto následná monoterapie ADV pouze ze 76 % [27]. Výsledky byly poté potvrzeny ve větší skupině pacientů (90 pacientů, 48 HBeAg negativních) léčených kombinací PEG-IFN a ADV, kde došlo k vymizení HBsAg u 11 % HBeAg pozitivních pacientů a u 17 % HBeAg negativních pacientů dva roky po ukončení léčby [29]. Hlavním (a jediným) prediktorem pozitivního výsledku léčby (clearance HBsAg) byla nízká hladina HBsAg před léčbou.
Kombinovaná léčba HBV – ETV a TDF v kombinaci s PEG-IFN
V poslední době se studie zaměřily na kombinovanou léčbu PEG-IFN s účinnějšími NA, tedy s ETV nebo s TDF.
V nizozemské studii [30] bylo celkem 175 pacientů s HBeAg pozitivní HBV infekcí randomizováno buď do větve 24 týdnů ETV s následným přidáním PEG-IFN po dobu dalších 24 týdnů, nebo pokračovali v monoterapii ETV. Po 48. týdnu pokračovala monoterapie ETV do 72. týdne u respondérů či do 96. týdne u nonrespondérů. Hlavním cílem v této studii byla clearance HBeAg v kombinaci s negativní viremií (HBV DNA < 200 IU/ ml). Tohoto cíle bylo dosaženo na konci léčby (48. týden) u 19 % pacientů ve větvi ETV + PEG-IFN a u 10 % ve větvi ETV (p = 0,095) a tento efekt přetrvával i 24 týdnů po ukončení léčby (32 vs. 18 %; p = 0,032). Kombinovaná léčba vedla k signifikantnímu poklesu koncentrací HBsAg, HBeAg a HBV DNA (p < 0,001). Primárního cíle tedy (ze statistického hlediska) dosaženo nebylo, ale kombinační větev prokázala vyšší účinnost. K eliminaci HBsAg došlo pouze u jednoho pacienta ve větvi s kombinovanou terapií.
V jiné studii bylo zařazeno 218 pacientů s HBeAg pozitivní HBV infekcí [31], kteří byli randomizováni pro monoterapii PEG-IFN po dobu 48 týdnů, nebo v kombinaci s přidáním ETV od 24. do 48. týdne či předléčení ETV s následným přidáním PEG-IFN. V této studii bylo sice dosaženo signifikantního poklesu HBV DNA ve skupině s přidáním ETV během léčby PEG-IFN, ale tento pokles nebyl setrvalý po ukončení léčby. V žádné skupině kombinované léčby nebylo prokázáno, že by byla více efektivní než monoterapie PEG-IFN.
V červenci 2015 byla publikována studie, která prokazuje pozitivní efekt na HBeAg sérokonverzi po přidání PEG-IFN k již probíhající dlouhodobé léčbě ETV u HBeAg pozitivních pacientů, kteří během předchozí dlouhodobé léčby ETV nedosáhli HBeAg sérokonverze [32]. Celkem 197 pacientů bylo randomizováno do větve s přidáním PEG-IFN po dobu 48 týdnů nebo pokračovali v původní monoterapii ETV a hlavním cílem byla HBeAg sérokonverze po 48 týdnech od začátku léčby. Ve skupině s kombinovanou léčbou dosáhlo po 48 týdnech léčby sérokonverze 44 % pacientů vs. 6 % ve skupině monoterapie ETV (p < 0,0001). Ke clearance HBsAg došlo však pouze u dvou pacientů (4 %) v kombinační skupině vs. žádný pacient ve skupině monoterapie (p = 0,4949).
V roce 2014 byla formou abstraktu prezentována studie, při které byl HBeAg negativním pacientům (183 pacientů), kteří byli na dlouhodobé léčbě NA (ETV či TDF) s dlouhodobě negativní HBV DNA, přidán randomizovaně PEG-IFN k již probíhající léčbě ETV či TDF. Ve 48. týdnu léčby došlo k eliminaci HBsAg u 8 % nemocných na kombinované léčbě oproti žádnému pacientovi, kteří pokračovali v monoterapii NA [33]. Hlavním prediktivním faktorem eliminace HBsAg byla jeho nízká vstupní hladina.
Recentní studií, která se zabývá kombinací PEG-IFN a TDF, je studie Marcellina publikovaná v říjnu roku 2015 [34]. Tato studie je největší a dosud nejlépe uspořádaná. Do studie bylo zařazeno 740 dosud neléčených pacientů s chronickou hepatitidou B bez pokročilého onemocnění jater (Metavir F3 a F4 byla vylučovací kritéria)
Hlavními cíli této studie byly:
- detekce ztráty HBsAg v 72. týdnu léčby,
- ověření hypotézy, že kombinovaná léčba PEG-IFN a TDF je nejefektivnější ve vztahu k eliminaci HBsAg.
Sekundárními cíli této studie byly:
- sérokoverze HBsAg,
- pokles HBsAg,
- negativní viremiie HBV DNA,
- ztráta HBeAg a sérokonverze,
- analýza rezistence na TDF.
Uspořádání studie a počty pacientů v jednotlivých ramenech ukazuje graf 2. Pacienti byli randomizováni do čtyř ramen. V prvním ramenu byli pacienti léčeni 48 týdnů kombinací TDF + PEG-IFN. Ve druhém ramenu byli léčeni 16 týdnů kombinovanou léčbou s následnou monoterapií TDF. Ve třetím ramenu byli pacienti léčeni standartní dlouhodobou, časově neomezenou monoterapií TDF a ve čtvrtém ramenu měli pacienti monoterapii PEG-IFN po dobu 48 týdnů. Zhodnocení efektu bylo poté provedeno ve 48. týdnu léčby a poté v 72. týdnu. V souboru bylo 60 % pacientů HBeAg pozitivních a 40 % HBeAg negativních. V žádných důležitých aspektech (věk, pohlaví, genotyp viru, viremie atd.) se uvedené skupiny nelišily (p > 0,05). Jak ukazuje graf 3, k nejrychlejšímu a nejhlubšímu poklesu koncentrace HBsAg došlo ve větvi kombinované léčby PEG-IFN + TDF, naopak nejnižší pokles koncentrace HBsAg vykázali pacienti s monoterapií TDF.
Graf 2. Uspořádání studie GS-US-174-0149. Graph 2. Study GS-US-174-0149 arrangement. 
Graf 3. Změna koncentrace HBsAg během léčby ve 48. týdnu. Graph 3. Change of HBsAg concentration during treatment at week 48. 
Graf 4 ukazuje přesvědčivě, že pro dosažení eliminace HBsAg je klíčové podání PEG-IFN a délka jeho aplikace. Clearance HBsAg bylo po 48 týdnech léčby dosaženo u 7,3 % pacientů léčených 48 týdnů kombinací PEG-IFN a TDF. Naopak ke ztrátě HBsAg nedošlo u žádného pacienta léčeného monoterapií TDF. Tyto výsledky se ještě dále zvýraznily v 72. týdnu studie (48 týdnů léčby a 24 týdnů sledování), kdy k eliminaci HBsAg došlo u 9 % pacientů z prvního ramene (kombinovaná léčba) a naopak u žádného pacienta s monoterapií TDF. U dalších větví s PEG-IFN (monoterapie či léčba 16 týdnů s následným TDF) došlo k eliminaci HBsAg u 2,8 % pacientů. K eliminaci HBeAg došlo rovněž nejčastěji ve větvi kombinované léčby (29,6 %) než v obou ramenech monoterapie (25,5 % u PEG-IFN a 14,7 % u TDF) a k sérokonverzi HBeAg došlo u 25 % pacientů v kombinované větvi a u 24,5 % s monoterapií PEG-IFN a pouze u 12,8 % pacientů léčených monoterapií TDF. Po ukončení léčby došlo k vzestupu viremie u drtivé většiny pacientů, kde byla léčba ukončena, ale naopak v 72. týdnu léčby byla HBV DNA nadále negativní u 72 % pacientů ve skupině i nadále léčených TDF. U většiny pacientů (54 – 61 %) s ukončením léčby ve 48. týdnu bez eliminace HBsAg musela být zahájena léčba TDF pro vzestup viremie či vzplanutí hepatitidy. Z hlediska tolerance a bezpečnosti byly všechny stanovené léčebné režimy dobře tolerované a výskyt nežádoucích účinků byl podobný ve všech větvích studie. Závažné nežádoucí účinky byly popsány u 10 – 11 % pacientů v PEG-IFN větvích studie a u 7 % pacientů léčených monoterapií TDF.
Graf 4. Ztráta HBsAg ve 48. a 72. týdnu. Graph 4. Loss of HBsAg in week 48 and 72. 
Kombinace ETV a TDF
Ve většině studií neprokázala kombinace ETV s TDF žádný benefit ve srovnání s monoterapií. Avšak u pacientů s opakovaným selháním léčby v monoterapii různými NA či u pacientů s rezistencí proti řadě NA může tato kombinace znamenat profit a nejspíše poslední možnost léčby (rescue terapie).
Ve studii, která neprokázala žádný benefit kombinované léčby u naivních pacientů, bylo sledováno 379 dosud neléčených pacientů s chronickou HBV infekcí. Nemocní byli randomizováni buď do větve s monoterapií ETV, či do větve s kombinací ETV a TDF po dobu 100 týdnů. Počet pacientů s negativní viremií byl v 96. týdnu léčby shodný v obou větvích. Rovněž nebyl prokázán rozdíl v počtu HBeAg sérokonverzí či ztráty HBeAg [35]. Tato studie prokazuje, že kombinace různých NA u dosud neléčených pacientů nemá žádný význam.
V otevřené, multicentrické studii byla kombinovaná léčba ETV + TDF indikována u celkem 57 pacientů s pokročilým onemocněním jater a prokázanou rezistencí na řadu protivirových léků či s inkompletní virologickou odpovědí či selháním přechozí léčby [23]. Pacienti byli před zařazením do této studie léčeni průměrně třemi různými antivirotiky (většinou ADV či LAM). U pacientů léčených kombinovanou terapií došlo po šesti měsících k negativizaci viremie u 51 z celkem 57 zařazených (89 %). Celkem pět pacientů eliminovalo HBeAg a u jednoho pacienta došlo k HBsAg sérokonverzi. U pacientů s pokročilým onemocněním jater nedošlo k žádné klinické dekompenzaci jaterního onemocnění. Po normalizaci viremie a ALT byla léčba deeskalována zpět na monoterapii. Studie prokazuje záchranný efekt této kombinované léčby u nemocných s multirezistencí na řadu NA.
Diskuze
S ohledem na požadovaný efekt léčby HBV infekce je v uvedených studiích sledována především šance na eliminaci HBsAg. Úvodní studie s kombinovanou léčbou, publikované mezi roky 2004 a 2005, které studovaly kombinaci PEG-IFN a LAM, prokázaly silnější protivirový efekt kombinované léčby, který však nepřetrval po ukončení léčby, přidání LAM k PEG-IFN nezvýšilo efekt léčby a studie neprokázaly ani aditivní efekt, který by vedl ke zvýšení šance na HBsAg eliminaci. Následující studie s kombinací PEG-IFN + ADV byly malé, s různorodým uspořádáním, nicméně kombinovaná léčba byla již podávána déle (48 týdnů) a opět bylo prokázáno, že kombinace PEG-IFN a NA vede k silnější protivirové aktivitě. Tyto studie rovněž prokázaly výrazně vyšší protivirovou aktivitu kombinované léčby, která se projevila poklesem počtu infikovaných hepatocytů (HBsAg a HBcAg pozitivní hepatocyty), poklesem intracelulární koncetrace cccDNA a především vyšší efektivitou při eliminaci HBsAg u HBeAg negativních pacientů.
V poslední době se analýza efektu kombinované léčby zaměřila především na kombinaci PEG-IFN s potentními NA, tedy s ETV a TDF. V těchto studiích již bylo zařazeno větší množství pacientů. Nizozemská studie publikovaná v roce 2015 (175 pacientů) zahrnovala pouze HBeAg pozitivní pacienty a jejím cílem bylo především dosažení eliminace HBeAg v kombinaci s nízkou viremií. Tato studie prokázala silnější protivirový efekt kombinované léčby, který ale nebyl dostatečně statisticky významný. K eliminaci HBsAg došlo pouze u jednoho pacienta ve větvi kombinované léčby. Je však možné, že tato délka léčby (24 týdnů kombinované terapie) je nedostatečná. Během kombinované terapie docházelo ke statisticky významnému poklesu HBsAg a je otázkou, zda by při prodloužení léčby nebyly výsledky výraznější, neboť dynamika poklesu HBsAg a jeho vstupní koncentrace jsou hlavními prediktivními faktory jeho eliminace. Rovněž studie z roku 2014 zahrnovala pouze HBeAg pozitivní pacienty. I zde byl protivirový účinek kombinované léčby silnější, ale k eliminaci HBsAg došlo jen u dvou nemocných léčených kombinací. Ve studiích, které se zabývaly ETV, tedy nebyly dosažené výsledky dostatečné k prokázání zřetelného, resp. zásadního klinického benefitu. Kombinovaná léčba byla relativně krátká, nebyla primárně cílena na eliminaci HBsAg (většinou byli zařazeni pacienti HBeAg pozitivní a HBe sérokonverze byla primárním cílem), a žádná studie proto nebyla dostatečně robustní k prokázání tohoto efektu. Největší, nejlépe organizovaná, randomizovaná, multicentrická studie, která se zabývala primárně efektem kombinované léčby PEG-IFN + TDF na ztrátu HBsAg (tedy optimálním cílem léčby HBV chronické infekce), byla publikována v říjnu 2015 [34]. Studie byla organizována tak, aby nedokonalé aspekty předchozích prací eliminovala. Umožnila porovnat efekt různé délky kombinované léčby i časově omezené léčby monoterapií PEG-IFN. Jedná se o první studii, kde byla kombinovaná léčba PEG-IFN + NA porovnávána jak s monoterapií NA, tak i monoterapií PEG-IFN. Rychlost poklesu koncentrace HBsAg (jehož dynamika je markerem šance na jeho eliminaci [16]) byla největší ve větvi s kombinovanou léčbou a významně se odlišovala od všech dalších větví. Eliminace HBsAg byla významně častější (i statisticky) ve větvi kombinované léčby (dosahuje 9 % v 72. týdnu) proti ostatním skupinám vč. 48týdenní léčby monoterapií PEG-IFN (což je parametr, který dosud nebyl prokázán). S ohledem na dosud známá fakta, kdy šance na eliminaci HBsAg je možná i po ukončení léčby PEG-IFN (graf 1), je možné, že dojde ještě v dalším průběhu sledování ke zvýraznění tohoto efektu. Studie poskytuje nepochybný důkaz, že pacienti léčení potentními NA v kombinaci s PEG-IFN mohou častěji eliminovat HBsAg než pacienti léčení monoterapií. K podobným výsledkům z hlediska eliminace HBsAg u pacientů HBeAg negativních, kteří již byli dlouhodobě léčeni NA a měli negativní HBV DNA, došla francouzská PEGAN studie (zatím dostupná ve formě abstraktu), kde v kombinované větvi došlo ve 48. týdnu ke ztrátě HBsAg u 8 % nemocných oproti nulové šanci ve větvi NA. Její nevýhodou byla jednak absence větve s monoterapií PEG-IFN a dále nízká tolerance, kdy ve větvi s kombinovanou léčbou ukončilo 20 % pacientů léčbu předčasně pro nižší toleranci nežádoucích účinků PEG-IFN a obecně bylo problematické pacienty, kteří byli dlouhodobě léčeni NA bez nežádoucích účinků, ke vstupu do studie přesvědčit.
Závěr
V současné době máme k dispozici účinné léky (především TDF a ETV), které s minimem nežádoucích účinků vedou k poměrně rychlé a účinné virologické responzi a negativizaci viremie HBV, což je velmi důležitý aspekt zlepšení prognózy. Tyto preparáty mají však i nevýhody, kterými je především velmi omezená šance na eliminaci HBsAg. Léky je nutné podávat (především u HBeAg negativních pacientů) dlouhodobě či doživotně, přičemž jejich bezpečnostní profil je sice velmi příznivý, ale při dlouhodobém podávání s sebou nese jisté riziko nežádoucích účinků [36,37]. Terapie PEG-IFN vede u malé části pacientů ke clearance HBsAg, ale je zatížena nežádoucími účinky. Eventuálně kombinovaná terapie PEG-IFN a NA, která by využívala aditivních či synergických efektů obou skupin léků a odlišného mechanizmu účinku, je možnou cestou, jak tyto nevýhody překonat. Prvotní výsledky kombinované terapie nebyly přesvědčivé. Žádná kombinovaná léčba nevedla k zásadně lepší účinnosti než dosavadní monoterapie. Poslední studie shodně prokazují, že efektivita kombinované léčby je z hlediska eliminace HBsAg vyšší, nicméně stále není nikterak zásadní či optimální (clearance HBsAg u 8 – 10 % pacientů po 48 týdnech kombinované léčby) a je stále otázkou, zda je tento výsledek dostatečný ke změně klinické praxe. Je možné, že úpravou délky léčby PEG-IFN či konsolidační terapie po ukončení PEG-IFN, přesnější definicí vstupních charakteristik pacientů spojených s pozitivní odpovědí na kombinační léčbu a stanovením on-treatment monitorace (především vstupní hladina HBsAg a rychlost jeho poklesu) bude možné výsledky dále zlepšit. V současné době je již ve fázích II klinických studií celá řada nových preparátů z oblasti inhibice vstupu viru do buňky, inhibitorů tvorby virové kapsidy, inhibitory tvorby cccDNA a její stability, imunomodulační látky, terapeutické vakcíny atd. [38]. V této situaci asi nelze předpokládat, že bude možné zorganizovat podobně rozsáhlou studii (Marcellinova studie) zaměřenou na podobné cíle. Je tedy nutné vycházet z toho, že kombinovaná léčba PEG-IFN + NA má nepochybně vyšší účinnost při eliminaci HBsAg při podobné bezpečnosti jako monoterapie PEG-IFN. Je tedy asi možné vysoce selektovaně, na individuální bázi, u nemocných bez pokročilého onemocnění jater a bez kontraindikace IFN a za pečlivého monitorování HBV DNA a ideálně i hladiny HBsAg (dostupné v ČR velmi omezeně) tento alternativní postup (po pečlivé edukaci nemocného) nabídnout a realizovat.
Publikace vznikla za podpory Gilead Sciences.
Podpořeno MZ ČR – RVO (FN Plzeň – FNPl, 00669806).
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 30. 10. 2015
Přijato: 1. 12. 2016MU Dr. Václav Hejda
Gastroenterologické a hepatologické oddělení
1. interní klinika LF UK a FN Plzeň
Alej Svobody 80
304 60 Plzeň-Lochotín
hejdav@fnplzen.cz
Zdroje
1. Lavanchy D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures. J Viral Hepat 2004; 11(2): 97 – 107.
2. Wasley A, Grytdal S, Gallagher K. Surveillance for acute viral hepatitis – United States, 2006. MMWR Surveill Summ 2008; 57(2): 1 – 24.
3. Státní zdravotní ústav. Vybrané infekční nemoci v ČR v letech 2005 – 2014 – absolutně. [online]. Dostupné z: www.szu.cz/ publikace/ data/ vybrane-infekcni-nemoci-v-cr-v-letech-2003-2012-absolutne.
4. Cadranel JF, Lahmek P, Causse X et al. Epidemiology of chronic hepatitis B infection in France: risk factors for significant fibrosis – results of a nationwide survey. Aliment Pharmacol Ther 2007; 26(4): 565 – 576.
5. Hatzakis A, Wait S, Bruix J et al. The state of hepatitis B and C in Europe: report from the hepatitis B and C summit conference. J Viral Hepat 2011; 18 (Suppl 1): 1 – 16. doi: 10.1111/ j.1365-2893.2011.01499.x.
6. Chen CJ, Yang HI, Su J et al. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. JAMA 2006; 295(1): 65 – 73.
7. Iloeje UH, Yang HI, Su J et al. Predicting cirrhosis risk based on the level of circulating hepatitis B viral load. Gastroenterology 2006; 130(3): 678 – 686.
8. Lee MH, Yang HI, Liu J et al. Prediction models of long-term cirrhosis and hepatocellular carcinoma risk in chronic hepatitis B patients: risk scores integrating host and virus profiles. Hepatology 2013; 58(2): 546 – 554. doi: 10.1002/ hep.26385.
9. Tseng TC, Liu CJ, Yang HC et al. Serum hepatitis B surface antigen levels help predict disease progression in patients with low hepatitis B virus loads. Hepatology 2013; 57(2): 441 – 450.
10. Fattovich G, Giustina G, Sanchez-Tapias J et al. Delayed clearance of serum HBsAg in compensated cirrhosis B: relation to interferon alpha therapy and disease prognosis. European Concerted Action on Viral Hepatitis (EUROHEP). Am J Gastroenterol 1998; 93(6): 896 – 900.
11. Chan HL, Wong VW, Chim AM et al. Serum HBsAg quantification to predict response to peginterferon therapy of e antigen positive chronic hepatitis B. Aliment Pharmacol Ther 2010; 32(11 – 12): 1323 – 1331. doi: 10.1111/ j.1365-2036.2010.04474.x.
12. Nguyen T, Thompson AJ, Bowden S et al. Hepatitis B surface antigen levels during the natural history of chronic hepatitis B: a perspective on Asia. J Hepatol 2010; 52(4): 508 – 513. doi: 10.1016/ j.jhep.2010.01.007.
13. Seeger C, Mason WS. Hepatitis B virus biology. Microbiol Mol Biol Rev 2000; 64(1): 51 – 68.
14. Thompson AJ, Nguyen T, Iser D et al. Serum hepatitis B surface antigen and hepatitis B e antigen titers: disease phase influences correlation with viral load and intrahepatic hepatitis B virus markers. Hepatology 2010; 51(6): 1933 – 1944. doi: 10.1002/ hep.23571.
15. Martinot-Peignoux M, Lapalus M, Asselah T et al. HBsAg quantification: useful for monitoring natural history and treatment outcome. Liver Int 2014; 34 (Suppl 1): 97 – 107. doi: 10.1111/ liv.12403.
16. Moucari R, Mackiewicz V, Lada O et al. Early serum HBsAg drop: a strong predictor of sustained virological response to pegylated interferon alfa-2a in HBeAg-negative patients. Hepatology 2009; 49(4): 1151 – 1157. doi: 10.1002/ hep.22744.
17. Rehermann B, Ferrari C, Pasquinelli C et al. The hepatitis B virus persists for decades after patients’ recovery from acute viral hepatitis despite active maintenance of a cytotoxic T-lymphocyte response. Nat Med 1996; 2(10): 1104 – 1108.
18. European Association for the Study of the Liver. EASL clinical practice guidelines: management of chronic hepatitis B virus infection. J Hepatol 2012; 57(1): 167 – 185. doi: 10.1016/ j.jhep.2012.02.010.
19. Zoutendijk R, Hansen BE, van Vuuren AJet al. Serum HBsAg decline during long-term potent nucleos(t)ide analogue therapy for chronic hepatitis B and prediction of HBsAg loss. J Infect Dis 2011; 204(3): 415 – 418. doi: 10.1093/ infdis/ jir282.
20. Husa P, Šperl J, Urbánek P et al. Diag-nosis and therapy of chronic hepatitis B: Czech national guidelines. Klin Mikrobiol Infekc Lek 2014; 20(4): 121 – 132.
21. Hadziyannis SJ, Tassopoulos NC, Heathcote EJ et al. Long-term therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B. N Engl J Med 2005; 352(26): 2673 – 2681.
22. Chevaliez S, Hézode C, Bahrami S et al. Long-term hepatitis B surface antigen (HBsAg) kinetics during nucleoside/ nucleotide analogue therapy: finite treatment duration unlikely. J Hepatol 2013; 58(4): 676 – 683. doi: 10.1016/ j.jhep.2012.11.039.
23. Petersen J, Ratziu V, Buti M et al. Entecavir plus tenofovir combination as rescue therapy in pre-treated chronic hepatitis B patients: an international multicenter cohort study. J Hepatol 2012; 56(3): 520 – 526. doi: 10.1016/ j.jhep.2011.09.018.
24. Marcellin P, Lau GK, Bonino F et al. Peginterferon alfa-2a alone, lamivudine alone, and the two in combination in patients with HBeAg-negative chronic hepatitis B. N Engl J Med 2004; 351(12): 1206 – 1217.
25. Lau GK, Piratvisuth T, Luo KX et al. Peg-interferon Alfa-2a, lamivudine, and the combination for HBeAg-positive chronic hepatitis B. N Engl J Med 2005; 352(26): 2682 – 2695.
26. Janssen HL, van Zonneveld M, Senturk H et al. Pegylated interferon alfa-2b alone or in combination with lamivudine for HBeAg-positive chronic hepatitis B: a randomised trial. Lancet 2005; 365(9454): 123 – 129.
27. Wursthorn K, Lutgehetmann M, Dandri M et al. Peginterferon alpha-2b plus adefovir induce strong cccDNA decline and HBsAg reduction in patients with chronic hepatitis B. Hepatology 2006; 44(3): 675 – 684.
28. Lutgehetmann M, Volzt T, Quaas A et al. Sequential combination therapy leads to biochemical and histological improvement despite low ongoing intrahepatic hepatitis B virus replication. Antivir Ther 2008; 13(1): 57 – 66.
29. Takkenberg RB, Jansen L, de Niet A et al. Baseline hepatitis B surface antigen (HBsAg) as predictor of sustained HBsAg loss in chronic hepatitis B patients treatedwith pegylated interferon-alpha2a and adefovir. Antivir Ther 2013; 18(7): 895 – 904.
30. Brouwer WP, Xie Q, Sonneveld MJ et al. Adding pegylated interferon to entecavir for hepatitis B e antigen-positive chronic hepatitis B: A multicenter randomized trial (ARES study). Hepatology 2015; 61(5): 1512 – 1522. doi: 10.1002/ hep.27586.
31. Xie Q, Zhou H, Bai X et al. A randomized, open-label clinical study of combined pegylated interferon Alfa-2a (40KD) and entecavir treatment for hepatitis B „e“ antigen-positive chronic hepatitis B. Clin Infect Dis 2014; 59(12): 1714 – 1723. doi: 10.1093/ cid/ ciu702.
32. Li GJ, Yu YQ, Chen SL et al. Sequential combination therapy with pegylated interferon leads to loss of hepatitis B surface antigen and hepatitis B e antigen (HBeAg) seroconversion in HBeAg-positive chronic hepatitis B patients receiving long-term entecavir treatment. Antimicrob Agents Chemother 2015; 59(7): 4121 – 4128. doi: 10.1128/ AAC.00249-15.
33. Bourlière M, Rabiega P, Ganne-Carrie N et al. HBsAg clearance afer addition of 48 weeks of PEGIFN in HBeAg negative CHB patients on nucleos(t)ide therapy with undetectable HBV DNA for at least one year: a multicenter randomized controlled phase III trial ANRS-HB06 PEGAN study: preliminary findings. Hepatology 2014; 60 (Suppl): 1094A (abstr. 1863).
34. Marcellin P, Ahn SH, Ma X et al. Combination of tenofovir disoproxil fumarate and peginterferon alfa-2a increases loss of hepatitis B surface antigen in patients with chronic hepatitis B. Gastroenterology 2016; 150(1): 134 – 144. doi: 10.1053/ j.gastro.2015.09.043.
35. Lok AS, Trinh H, Carosi G et al. Efficacy of entecavir with or without tenofovir disoproxil fumarate for nucleos(t)ide-naive patients with chronic hepatitis B. Gastroenterology 2012; 143(3): 619 – 628. doi: 10.1053/ j.gastro.2012.05.037.
36. Manns MP, Akarca US, Chang TT et al. Long-term safety and tolerability of entecavir in patients with chronic hepatitis B in the rollover study ETV-901. Expert Opin Drug Saf 2012; 11(3): 361 – 368. doi: 10.1517/ 14740338.2012.653340.
37. Pipili C, Cholongitas E, Papatheodoridis G. Review article: nucleos(t)ide analogues in patients with chronic hepatitis B virus infection and chronic kidney disease. Aliment Pharmacol Ther 2014; 39(1): 35 – 46. doi: 10.1111/ apt.12538.
38. Liang TJ, Block TM, McMahon BJ et al. Present and future therapies of hepatitis B: from discovery to cure. Hepatology 2015; 62(6): 1893 – 1908. doi: 10.1002/ hep.28025.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Miniinvazivní chirurgie v léčbě nespecifických střevních zánětů – výhody, rizika a perspektivyČlánek Jubilejní rok 2016…Článek Lékařské uměníČlánek XXI. Gastrofórum 2016Článek Správná odpověď na kvízOportunní infekce Mycobacterium marinum u imunokompromitovaného pacientaČlánek Autodidaktický test: IBD
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2016 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Doporučení pro podávání biologické terapie u idiopatických střevních zánětů: třetí, aktualizované vydání
- Skúsenosti s liečbou biosimilárnym infliximabom CT-P13 u pacientov s nešpecifickými zápalovými ochoreniami čreva – retrospektívna štúdia
- Dlouhodobé funkční výsledky a kvalita života nemocných s ulcerózní kolitidou po proktokolektomii s ileopouch-anální anastomózou
- Soutěž o dvě nejlepší původní práce 2016
- Imunopatologické komplikace biologické léčby blokátory TNF-α
- Fekální mikrobiální transplantace u idiopatických střevních zánětů
- Miniinvazivní chirurgie v léčbě nespecifických střevních zánětů – výhody, rizika a perspektivy
- Atypický průběh Crohnovy choroby s postižením tlustého střeva u mladého nemocného
- Kombinovaná léčba chronické hepatitidy B
- Jubilejní rok 2016…
- Nový člen redakční rady časopisu
-
XXI. Gastrofórum 2016
20.– 23. január 2016 - Lékařské umění
- 21st Gastroforum, 2016
- Výběr z mezinárodních časopisů
- Kožní změny u pacienta s ulcerózní kolitidou vyžadují multioborovou spolupráci
-
Správná odpověď na kvíz
Oportunní infekce Mycobacterium marinum u imunokompromitovaného pacienta - Autodidaktický test: IBD
- Cortiment® – první orální budesonid pro léčbu mírně až středně aktivní ulcerózní kolitidy
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Cortiment® – první orální budesonid pro léčbu mírně až středně aktivní ulcerózní kolitidy
- Fekální mikrobiální transplantace u idiopatických střevních zánětů
- Dlouhodobé funkční výsledky a kvalita života nemocných s ulcerózní kolitidou po proktokolektomii s ileopouch-anální anastomózou
- Imunopatologické komplikace biologické léčby blokátory TNF-α
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



