-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Doporučení České revmatologické společnosti pro farmakoterapii revmatoidní artritidy 2017
2017 recommendations of the Czech Society for Rheumatology for the pharmacological treatment of rheumatoid arthritis.
Based on the current knowledge about the treatment of rheumatoid arthritis (RA), the working group of the Czech Society for Rheumatology presents the updated recommendations for the pharmacotherapy of RA. The basic prerequisite for successful treatment is early diagnosis of the disease and prompt initiation of effective therapy. Pharmacotherapy of RA should be based on the treat to target strategy, the substance of which is the assessment of disease activity using composite indices at regular time intervals and adjustment of the therapy according to whether the predetermined target for treatment has been reached. Treat to target approach applies generally, irrespective of the medication. The goal of treatment for RA is a state of remission or at least low clinical disease activity, which should be achieved quickly, usually within six months of commencement of the treatment, and this condition should be permanently maintained. The treatment should be initiated with a monotherapy using a conventional synthetic disease-modifying anti-rheumatic drug (csDMARD), in most cases, methotrexate. In case of contraindication of or intolerance to methotrexate administration of leflunomide or sulfasalazine can be considered. In patients with high activity at the onset of the disease or with relapse during established RA glucocorticoids can be used with a gradual reduction of the dose until withdrawal (ideally for a period shorter than three months). If high disease activity persists after 3 months of intensive treatment, or if the treatment target is not achieved after 6 months, the treatment should be adjusted accordingly. The treatment approach after the failure of the first csDMARD is driven by the presence of unfavorable prognostic factors (high disease activity, positivity of autoantibodies, and early erosive joint damage). If there are no risk factors for severe disease course present, changing to a different csDMARD, possibly a combination of more csDMARD, can be considered. In patients with unfavorable prognostic factors after failure of csDMARD administration of biologic therapy is recommended. There are no substantial differences in efficiency among the various biological agents. Thus, as the first-line drug TNFα inhibitors (adalimumab, certolizumab pegol, etanercept, golimumab, infliximab, including biosimilar products) are usually employed. However, abatacept, rituximab or tocilizumab can be used as well. Once targeted synthetic agents (tsDMARD, e.g. Janus kinase inhibitors) are available in the Czech Republic, it will be possible to consider these products as well. If a loss of response to first-line biological therapy occurs, it is appropriate to switch to another biological agent or tsDMARD. After treatment failure of a TNFα inhibitor, a different TNFα inhibitor or a drug with a different mechanism of action can be used. In patients in sustained remission lasting at least six months, who are not receiving glucocorticoids anymore, it is possible to consider reducing the dose of the biological agent or extending its administration interval. Discontinuation of biological therapy often leads to a flare, especially in patients with longstanding RA. The presented recommendations of the Czech Society for Rheumatology are not a binding regulation, rather a practical guide on how to proceed with treatment of patients with RA. In their application another aspects must also be taken into account, such as the general health condition, other diseases, concomitant therapy, and contraindications that can modify the treatment approach.
Keywords:
Rheumatoid arthritis, recommendations, disease - modifying anti-rheumatic drugs, remission
Autoři: L. Šenolt; H. Mann; J. Závada; K. Pavelka; J. Vencovský
Působiště autorů: Revmatologický ústav, Revmatologická klinika 1. LF UK, Praha
Vyšlo v časopise: Čes. Revmatol., 25, 2017, No. 1, p. 8-24.
Kategorie: Doporučení
Souhrn
Na podkladě současných poznatků o léčbě revmatoidní artritidy (RA) předkládá pracovní skupina České revmatologické společnosti aktualizovaná doporučení pro farmakoterapii RA. Základní podmínkou úspěšné léčby je včasná diagnostika onemocnění a okamžité zahájení účinné terapie. Farmakoterapie RA by měla být založena na strategii léčby k cíli, jejíž podstatou je posuzování aktivity onemocnění pomocí kompozitních indexů v pravidelných časových intervalech a úprava terapie podle toho, zda byl dosažen předem stanovený cíl léčby. Strategie léčby k cíli platí obecně, bez ohledu na použité léky. Cílem léčby RA je stav remise nebo alespoň nízké klinické aktivity nemoci, kterých by mělo být dosaženo rychle, zpravidla do šestého měsíce od zahájení léčby a tento stav by měl být trvale udržován. V úvodu by měla být zahájena monoterapie konvenčním syntetickým chorobu modifikujícím antirevmatikem (csDMARD), ve většině případů methotrexátem. Při kontraindikaci nebo intoleranci methotrexátu lze zvážit nasazení leflunomidu nebo sulfasalazinu. U nemocných s vysokou aktivitou na počátku onemocnění nebo při relapsu etablované RA je možné použít glukokortikoidy s pozvolnou redukcí dávky až do vysazení (ideálně na dobu kratší než 3 měsíce). Pokud po 3 měsících intenzivní léčby přetrvává vysoká aktivita nemoci nebo po 6 měsících není dosaženo cíle léčby, pak je nutné léčbu upravit. Léčebný postup po selhání prvního csDMARD se řídí přítomností nepříznivých prognostických faktorů (vysoká aktivita nemoci, pozitivní autoprotilátky a časné erozivní poškození kloubů). Pokud nejsou přítomny rizikové faktory závažného průběhu onemocnění, lze zvážit změnu za jiný csDMARD, eventuálně kombinaci více csDMARD. U nemocných s nepříznivými prognostickými faktory je po selhání csDMARD doporučeno podání biologické léčby. Mezi jednotlivými biologickými přípravky nejsou podstatné rozdíly v účinnosti, v první linii obvykle nasazujeme inhibitory TNFα (adalimumab, certolizumab pegol, etanercept, golimumab, infliximab, včetně biosimilárních přípravků), ale lze použít i abatacept, tocilizumab nebo rituximab. Až budou v České republice dostupné cílené syntetické léky (tsDMARD, např. inhibitory janus kinázy), bude možné zvážit i tyto přípravky. Pokud dojde k selhání účinku první linie biologické léčby, pak je na místě nasazení jiného biologického léku nebo tsDMARD. Po selhání léčby inhibitorem TNFα je možné nasadit jiný inhibitor TNFα, nebo lék s jiným mechanismem účinku. U nemocných v setrvalé remisi trvající minimálně půl roku, kteří již nejsou léčeni glukokortikoidy, je možné zvážit snížení dávky biologického léku nebo prodloužení intervalu podávání. Úplné vysazení biologického léku vede často, zejména u pacientů s dlouhotrvající RA, ke vzplanutí nemoci. Předložené doporučené postupy České revmatologické společnosti nejsou závazným předpisem, ale spíše praktickým návodem jak postupovat při léčbě pacientů s RA. Při jejich uplatnění je nutné také přihlížet k celkovému stavu, dalším onemocněním, doprovodné terapii a kontraindikacím, které mohou přístup modifikovat.
Klíčová slova:
Revmatoidní artritida, doporučené postupy, chorobu modifikující antirevmatická léčba, remiseÚvod
Revmatoidní artritida (RA) je závažné autoimunitní onemocnění charakterizované chronickou progresivní polyartritidou, která je často spojená s řadou mimokloubních projevů a komorbidit (1). V posledních dvou dekádách došlo k významnému prohloubení znalostí o etiopatogenezi a prognóze RA a rozšíření léčebných možností. Onemocnění samotné zůstává ve většině případů nevyléčitelné, ale při včasném zahájení léčby a využití účinných léčebných strategií lze u většiny nemocných usilovat o dosažení klinické remise nebo nízké klinické aktivity, zlepšení funkčních schopností a zabránění vzniku nevratného poškození.
Česká revmatologická společnost (ČRS) se na podkladě nových poznatků o léčbě RA rozhodla vydat nová doporučení k léčbě RA, která částečně vychází a zároveň rozšiřují původní doporučené postupy ČRS 2010 (2). Pracovní skupina byla schválena výborem ČRS a sestávala z pěti revmatologů s dlouholetými zkušenostmi v léčbě RA. Doporučené postupy byly připravovány a diskutovány pracovní skupinou v průběhu roku 2016. Metodologicky vycházely z doporučených postupů ČRS 2010 (2) a přihlížely k novým doporučením Evropské ligy proti revmatismu (EULAR) a Americké revmatologické asociace (ACR) (4), včetně recentních poznatků a systematických přehledových článků. Na finálním znění textu se pracovní skupina shodla počátkem roku 2017 a text byl následně připomínkován členy výboru ČRS a zástupcem výkonného výboru pacientské organizace Revma Liga České republiky. Cílem tohoto textu je poskytnout revmatologům v České republice obecný návod pro účelnou farmakoterapii RA na základě současných poznatků. Tato doporučení nejsou závazným předpisem, ale spíše praktickým návodem jak postupovat v nejčastějších situacích.
Na úvod je vhodné zdůraznit skutečnost, že RA je chronické onemocnění vyžadující dlouhodobou léčbu, proto je velmi důležitá edukace nemocných o povaze choroby a o principech léčby. Základem farmakoterapie RA jsou tzv. chorobu modifikující antirevmatické léky (DMARD) – syntetické a biologické, které prokazatelně ovlivňují dlouhodobý průběh onemocnění a zpomalují strukturální progresi (tabulka 1). Nesteroidní antirevmatika (NSA) nejsou v těchto aspektech účinná, působí pouze symptomaticky, a z důvodu gastrointestinální a kardiovaskulární toxicity by jejich podávání mělo být co nejmenší. Součástí péče o nemocné s RA je dále léčba bolesti, fyzioterapie a léčebná rehabilitace včetně balneoterapie, důležitá je také sociální a psychologická podpora. U nemocných se strukturálním poškozením se uplatňují chirurgické metody. V neposlední řadě je třeba také dbát na odhalování a léčbu komorbidit, zejména kardiovaskulárních.
Tab. 1. Rozdělení chorobu-modifikujících léků (DMARD) pro revmatoidní artritidu. 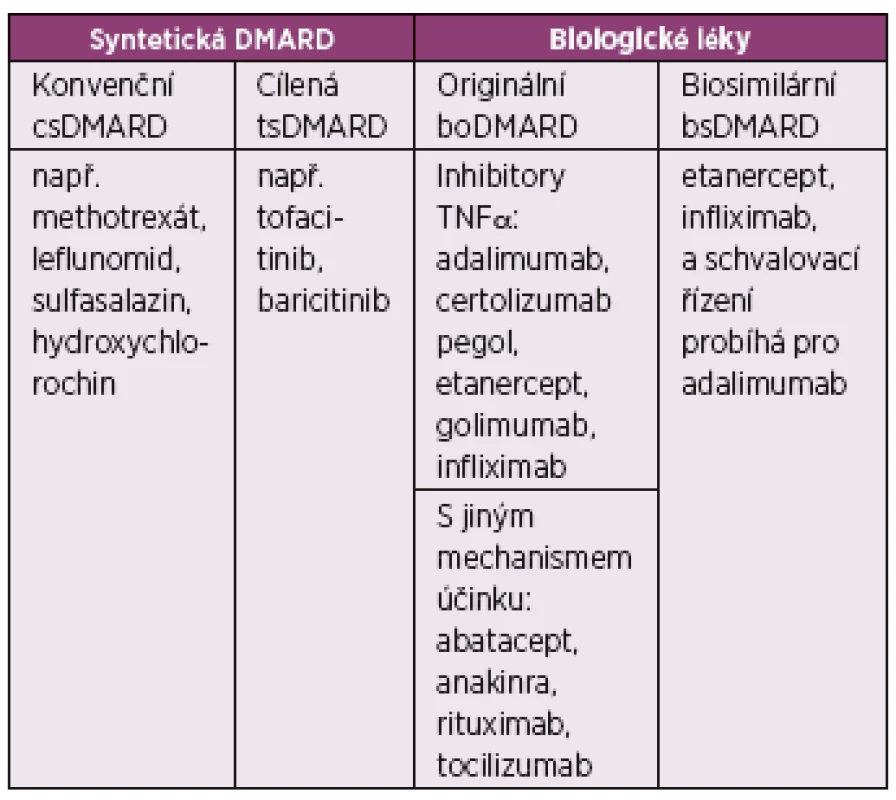
TNFα: tumor nekrotizující faktor alfa Vysvětlení zkratek vycházejících z anglické nomenklatury: DMARD – disease- -modifying antirheumatic drugs, csDMARD – conventional synthetic DMARD, tsDMARD – targeted synthetic DMARD, boDMARD – biological original DMARD, bsDMARD - biosimilar DMARD. Upraveno podle: Smolen JS, van der Heijde D, Machold KP et al. Proposal for a new nomenclature of disease-modifying antirheumatic drugs. Ann Rheum Dis. 2014;73:3-5. Diagnóza revmatoidní artritidy
RA je klinická diagnóza založená na klinickém nálezu a výsledcích pomocných vyšetření. Předpokladem úspěšné léčby je její včasné zahájení, ideálně během několika málo týdnů od prvních symptomů. Za časnou RA pak považujeme onemocnění s trváním symptomů do 6 měsíců. V praxi se diagnóza RA většinou opírá o splnění klasifikačních kritérií ACR/EULAR z roku 2010 (5). Předpokladem pro použití kritérií ACR/EULAR je přítomnost klinicky zjevné artritidy alespoň jednoho kloubu, kterou nelze lépe vysvětlit jinou příčinou. Onemocnění lze klasifikovat jako RA, pokud na základě zhodnocení klinických a laboratorních parametrů nemocný dosáhne alespoň šesti bodů z deseti možných (tabulka 2). Alternativně lze onemocnění klasifikovat jako RA i na základě přítomnosti typických kostních erozí (6).
Tab. 2. Klasifikační kritéria ACR/EULAR pro revmatoidní artritidu. 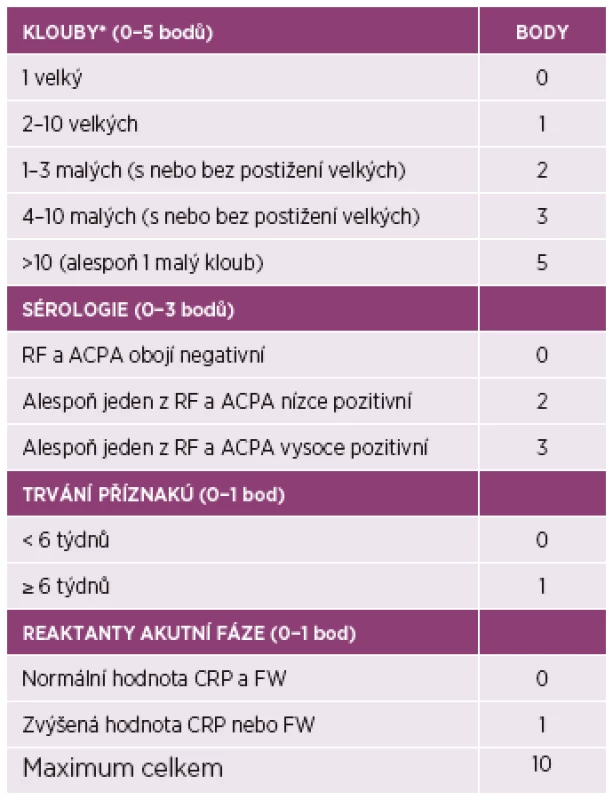
Onemocnění je klasifikováno jako revmatoidní artritida při nálezu otoku alespoň v jednom kloubu, který byl určen klinickým vyšetřením zkušeným hodnotitelem a při dosažení ≥ 6 bodů z celkem 10 možných. *Při hodnocení rozsahu kloubního postižení se nepočítají klouby typicky postihované osteoartrózou (distální interfalangeální klouby, karpometakarpální klouby palců rukou a 1. metatarzofalangeální klouby nohou). ACPA: protilátky proti citrulinovaným proteinům, CRP: C-reaktivní protein, FW: sedimentace erytrocytů, RF: revmatoidní faktory, ACR: Americká revmatologická asociace (American College of Rheumatology), EULAR, Evropská liga proti revmatismu (European League Against Rheumatism). Upraveno podle: Aletaha D, Neogi T, Silman A, et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/ European League Against Rheumatism ollaborative initiative. Ann Rheum Dis 2010; 69: 1580–88 Hodnocení aktivity a funkčního stavu
Hodnocení aktivity RA by se mělo provádět při většině návštěv. U pacientů s krátkým trváním nemoci nebo s vyšší klinickou aktivitou by měla být aktivita hodnocena v intervalu 1-3 měsíce, po dosažení cíle léčby lze frekvenci snížit na jednou za 3–6 měsíců. K hodnocení aktivity doporučujeme využívat některý z kompozitních indexů aktivity (DAS28, SDAI nebo CDAI, příp. DAS44) (tabulka 3) (7).
Tab. 3. Kompozitní indexy pro hodnocení aktivity revmatoidní artritidy. A) Požadované parametry pro výpočet kompozitních indexů. B) Způsob výpočtu kompozitních indexů. C) Rozmezí aktivity onemocnění definované podle jednotlivých kompozitních indexů. 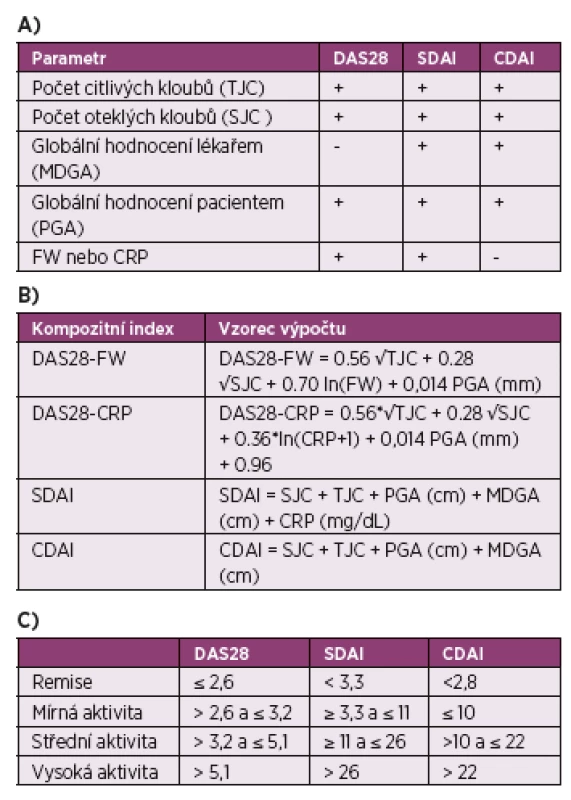
DAS, skóre aktivity nemoci (Disease Activity Score) CDAI, klinický index aktivity nemoci (Clinical Disease Activity Index) SDAI, zjednodušený index aktivity nemoci (Simplified Disease Activity Index) Přestože lze používat kterýkoliv z těchto nástrojů, mezi nimiž byla v minulosti prokázána vysoká korelace, kloníme se k použití indexu DAS28, se kterým jsou v Evropě a v České republice největší zkušenosti, nebo indexu SDAI, který je součástí definice remise podle ACR/EULAR (8). Kromě hodnocení remise podle indexu je možné užít i relativně jednoduchou, tzv. „jednotkovou“ definici remise, která vychází z Booleova modelu definice: počet bolestivých kloubů ≤1, počet oteklých kloubů ≤1, CRP ≤1 (= 1 mg/dl neboli 10 mg/l) a pacientovo globální hodnocení ≤1 (na škále 0–10). Ne vždy jsou v běžné praxi reaktanty zánětu k dispozici okamžitě, proto je možné toto hodnocení provést i bez CRP. Při použití této definice remise by se pokud možno měly vyšetřovat i kotníky a drobné klouby nohou. Je třeba mít na paměti, že kritéria remise podle DAS28 jsou ve srovnání s ACR/EULAR remisí méně přísná a jejich splnění nemusí být dostatečné k zastavení strukturální progrese. Vzhledem k tomu, že ultrazvukové vyšetření je více senzitivní i specifické než klinické vyšetření při hodnocení synovitidy či tenosynovitidy (9), může být vhodným doplňkem při monitoraci pacientů s RA. Muskuloskeletální ultrazvuk lze použít při diagnostice onemocnění nebo při hodnocení léčebné odpovědi. V současné době však neexistují přesvědčivé důkazy, že by se terapeutická rozhodnutí měla provádět čistě na základě ultrazvukem hodnocené aktivity onemocnění (10).
Velmi důležité je také hodnocení celkových funkčních schopností pacienta. I pro běžnou klinickou praxi lze doporučit používání dotazníku Health Assessment Questionnaire for Rheumatoid Arthritis (HAQ) nebo alespoň některé z jeho modifikovaných a jednodušších verzí (MHAQ, mdHAQ) (11). Český překlad dotazníku HAQ (12) byl validizován a slouží také při posuzování invalidity u nemocných s RA (k dispozici na: http://www.revmatologicka-spolecnost.cz/dokumenty/haq.pdf). Změny funkčních schopností doporučujeme v běžné klinické praxi hodnotit alespoň jednou ročně, optimálně však každých 6 měsíců.
Hodnocení strukturální progrese
Strukturální progrese je rovněž důležitým aspektem hodnocení úspěšnosti léčby. V klinických studiích bývá k hodnocení rentgenové progrese používáno tzv. Sharpovo skóre, nejčastěji v modifikaci podle van der Heijde (13). Hodnotí se v něm počet erozí a stupeň zúžení kloubních štěrbin vybraných kloubů, které se pak sčítají v tzv. celkovém Sharpově skóre. Optimální by bylo i v běžné klinické praxi používat k hodnocení rentgenové progrese validizovaný, numerický ukazatel, ale je nutné akceptovat, že hodnocení dle Sharpa je v běžné klinické praxi obtížně proveditelné. Minimálním požadavkem však musí být alespoň semikvantitativní posouzení, zda u nemocného dochází k rychlé, pomalé nebo žádné rentgenové progresi. Rentgenovou progresi doporučujeme hodnotit pomocí periodického snímkování rukou a nohou vstupně a následně v ročních intervalech především v prvních 2–5 letech onemocnění, kdy dochází k až 75 % celkového strukturální poškození (14), následně je možné frekvenci snímkování individuálně upravit. U pacientů s klinickým podezřením na postižení krční páteře by mělo být provedeno zhodnocení funkční stability krční páteře pomocí laterálního snímku ve flexi a v neutrální poloze. V případě pozitivního rentgenového nálezu nebo při klinickém podezření na postižení krční páteře by mělo být doplněno vyšetření magnetickou rezonancí (15).
Obecné principy léčby revmatoidní artritidy
Léčba RA je komplexní a kromě základní farmakologické léčby zahrnuje i nefarmakologické a chirurgické léčebné postupy, které byly stručně popsány v doporučeních ČRS pro léčbu RA z roku 2010 (2). Léčbu RA by měl řídit lékař specialista – revmatolog. Je třeba usilovat o zajištění co nejlepší péče na základě sdíleného rozhodnutí nemocného a ošetřujícího revmatologa. Rozhodnutí o terapeutickém postupu vycházejí z aktivity onemocnění s přihlédnutím k dalším faktorům, jako jsou například progrese strukturálního poškození, komorbidity a bezpečnost léčby. Revmatoidní artritida, jako invalidizující choroba, je spojena s významnými společenskými, individuálními a medicínskými náklady a všechny tyto aspekty by měly být zohledněny při výběru vhodné terapie.
Na počátku onemocnění by měl být každý nemocný dostatečně poučen o charakteru svého onemocnění, cílech léčby a o přínosu i možných rizicích léčebných postupů. Pacient by měl být vždy informován o změně dosavadní léčby a jejích důvodech. Terapeutická rozhodnutí by měla být výsledkem sdíleného rozhodování mezi lékařem a pacientem a měla by respektovat pacientovy preference a hodnoty. Vhodná je konzultace fyzioterapeuta a nemocný by měl být motivován k pravidelnému cvičení s cílem zachovat maximální kloubní rozsah a funkční schopnost. Důležitý může být odkaz na vhodné webové stránky a pacientské organizace. V pokročilejších případech je potřebná konzultace protetika, případně ortopeda se znalostí problematiky revmatochirurgie. Nejdůležitější roli při léčbě RA hraje farmakoterapie, které je také podrobněji věnována tato část doporučených postupů.
Cílem léčby RA je potlačení zánětlivé aktivity, které je spojeno se zpomalením rentgenové progrese a se zlepšením funkčních schopností, kvality života, sociální participace a práceschopnosti.
Glukokortikoidy
Existuje řada důkazů o tom, že racionálně vedená léčba glukokortikoidy může mít u pacientů s RA příznivý vliv na zlepšení kontroly zánětlivé aktivity onemocnění a zpomalení strukturální progrese (16). Užívání systémových glukokortikoidů je ale také spojeno s rizikem řady nežádoucích účinků. Mezi nejčastější nežádoucí účinky patří např. zvýšené riziko kardiovaskulárních onemocnění, diabetes mellitus, hyperlipoproteinémie, osteoporóza, přírůstek hmotnosti, rekurentní infekce, katarakta, glaukom a další. Před zahájením léčby glukokortikoidy je vždy důležité zvážit všechny komorbidity nemocného, které predisponují k rozvoji nežádoucích účinků a vysvětlit nemocnému cíl léčby a potenciální rizika (17, 18). V běžné klinické praxi je u nemocných léčených glukokortikoidy nutné provádět screening osteoporózy, monitorovat glykémie, a myslet na riziko glaukomu a katarakty (18).
Nejistota i určité kontroverze stran vyhodnocení poznatků o poměru jejich příznivých a nežádoucích účinků je překážkou pro jednoznačné a univerzálně platné vymezení role systémových glukokortikoidů v rámci doporučených algoritmů pro léčbu RA. Jednotlivé národní i mezinárodní expertní panely k této otázce proto nezaujímají jednotné stanovisko (2, 3, 4).
Podle EULAR doporučení pro léčbu RA jsouglukokortikoidy indikovány současně s nasazením konvenčních syntetických DMARD (csDMARD), nebo při jejich změně. Tato nová doporučení zdůrazňují krátkodobost podání, tedy maximálně do 3 a naprosto výjimečně do 6 měsíců. Změnou proti předchozím doporučením EULAR, která doporučovala nízkou dávku glukokortikoidu (≤7,5 mg prednisonu denně), je fakt, že současná doporučení nedefinují dávku, protože několik klinických hodnocení (19, 20) z poslední doby ukázalo významný prospěch i krátkodobě podávaných středních dávek glukokortikoidů (>7,5 mg, ale ≤30 mg prednisonu denně). Kromě rychlého ovlivnění aktivity RA a přemostění doby do nástupu účinku csDMARD má krátkodobá léčba glukokortikoidy i tzv. strukturu modifikující efekt a přispívá ke zpomalení rentgenové progrese a to i v době po ukončení kortikoterapie (21, 22). Již minulá doporučení ČRS byla prakticky v souladu s novým doporučením EULAR a umožňovala použití nízké až střední dávky glukokortikoidů. Je však třeba zmínit nejednotnost stanoviska k léčbě RA glukokortikoidy, ke které se poslední doporučení ACR nestaví příliš pozitivně a poukazují na nedostatek kvalitních dokladů o jejich účinnosti a na chybějící dlouhodobá bezpečnostní data (4).
Na podkladě recentních poznatků navrhujeme u aktivní RA zvážit krátkodobé podání glukokortikoidů při zahájení nebo změně léčby csDMARD. Úvodní dávka a způsob podání je ponechán na zvážení příslušného revmatologa. V některých případech je možné zvážit krátkodobou léčbu glukokortikoidy pro překonání relapsu onemocnění. V každém případě je vhodné dávku redukovat a vysadit tak rychle, jak jen to klinický stav umožňuje, pokud možno do 3 měsíců.
Je nutné konstatovat, že neexistuje bezpečná dávka glukokortikoidů. Pokud se glukokortikoidy nepodaří v některých případech zcela vysadit, je nezbytné, aby byla dávka přípravku co nejnižší. V klinické praxi mohou i dávky nižší než 5 mg prednisonu přispívat k udržení klinické remise nebo nízké aktivity, i když chybí důkazy, že tyto nízké dávky mají strukturu modifikující efekt (16). Dlouhodobé podávání dávek prednisonu vyšších než 5 mg je ale pravděpodobně u většiny pacientů spojeno s převahou nežádoucích účinků nad potenciálním benefitem, přičemž dlouhodobá léčba samostatnými glukokortikoidy není doporučena a vždy by se mělo hledat lepší řešení.
Přestože neexistují přímé studie hodnotící vliv intraartikulárního podání glukokortikoidů na strukturální progresi, měl by se tento přístup stát základem intenzivní léčebné strategie (23). Cílená intraartikulární aplikace glukokortikoidu je v potlačení zánětlivé aktivity postiženého kloubu účinnější než intramuskulární podání glukokortikoidu (24), vzhledem k převážně lokálnímu působení je spojena s nižším rizikem nežádoucích účinků a navíc v kombinaci s intenzivně vedenou konvenční léčbou vykazuje lepší klinický efekt (25, 26).
Konvenční syntetické chorobu modifikující léky
Lékem první volby RA zůstává methotrexát (MTX). MTX představuje klíčový lék nejen pro iniciální léčbu, ale jedná se o přípravek vhodný pro kombinaci s dalšími csDMARD nebo biologickými DMARD (bDMARD). V naprosté většině případů je vhodné léčbu MTX zahájit dávkou v rozmezí 10–15 mg MTX týdně, která by měla být podle tolerance navyšována každé 2–4 týdny během několika málo týdnů do maximální dávky 25–30 mg týdně. Rychlá eskalace dávky MTX je účinnější (27), ale i tak úplného účinku MTX bývá dosaženo až po 4–6 měsících. Při nedostatečném účinku nebo gastrointestinální intoleranci perorálního MTX je vhodné změnit aplikační formu na subkutánní přípravek. Souběžně s MTX je doporučováno užívání 10 mg kyseliny listové týdně (obvykle den po užití MTX), což přispívá ke snížení rizika gastrointestinální a hepatální toxicity MTX, včetně snížení rizika stomatitidy a pravděpodobně i myelosuprese (28).
U nemocných se závažnou intolerancí nebo kontraindikací léčby MTX (např. vážné onemocnění jater nebo ledvin), může být jako lék první linie nasazen leflunomid nebo sulfasalazin. Obvyklá terapeutická dávka leflunomidu je 20 mg denně a sulfasalazinu 3 g denně. Starší klinické studie prokázaly u těchto přípravků účinnost srovnatelnou s MTX, ten byl ale podáván v nižších dávkách, než je v současnosti obvyklé (29, 30). Bezpečnostní rizika a kontraindikace jsou u zmíněných léků podobné. Antimalarikum hydroxychlorochin je v monoterapii vyhrazen pouze pro velmi mírné formy RA, důležitou roli hraje v kombinacích s jinými csDMARD. Určitou výhodou sulfasalazinu a hydroxychlorochinu může být jejich relativní bezpečnost během gravidity a laktace (31).
Použití ostatních csDMARD (např. soli zlata, cyklosporin nebo azathioprin), nelze z důvodu převyšujících nežádoucích účinků v současné době pro léčbu RA doporučit (32).
Biologické léky a cílené syntetické DMARD
Užití biologických léků znamenalo přelom v léčbě RA. V současné době je k dispozici 8 biologik, 5 cílících na tumor nekrotizující faktor α (TNFα), a 3 s jiným mechanismem účinku (tabulka 4). Anakinra (Kineret), antagonista receptoru pro interleukin 1, je sice indikována pro léčbu RA, ale její účinek je ve srovnání s ostatními biologiky výrazně slabší a v podstatě se v této indikaci u dospělých pacientů nepoužívá. Základní charakteristika biologických léků je uvedena v tabulce 4, včetně v současné době platných pravidel pro jejich podávání v České republice. Tato pravidla se mohou lišit od obsahu SPC a případně i od názoru EULAR či ČRS, a proto jsou tyto informace také uvedeny. K dispozici jsou také dva cílené syntetické DMARD (tsDMARD), inhibitory janus kinázy tofacinib a baricitinib, jejichž schválení v Evropské unii.
Přestože se biologické léky liší svou strukturou a místem zásahu, je jejich účinnost v kombinaci s MTX u RA dosti podobná. V současné době je biologická léčba indikována po selhání dostatečně intenzivní léčby MTX nebo jiným účinným csDMARD.
K destrukcím kosti a úbytku chrupavky, tedy k progresi radiologického poškození, které je doprovázeno postupným vznikem deformit, zhoršením funkčních schopností a ztrátou práceschopnosti, dochází nejen při vysoké, ale též při střední aktivitě RA. Cílem léčby by tedy mělo být navození remise nebo nízké klinické aktivity všemi námi dostupnými prostředky, tak aby k tomuto nevratnému poškození nedocházelo. Bez ohledu na dosaženou klinickou odpověď, biologika díky svému mechanismu účinku tlumí rentgenovou progresi účinněji než MTX. Všechny biologické přípravky by měly být podávány v kombinaci s MTX nebo s jiným csDMARD. Pokud je nutné podávat biologickou léčbu v monoterapii, pak se jako nejvhodnější jeví léčba inhibitorem IL-6 (33, 34). V budoucnu bude u nemocných s kontraindikací nebo intolerancí csDMARD možné zvážit také monoterapii inhibitory janus kinázy (35, 36).
Tab. 4. Biologické léky používané v léčbě revmatoidní artritidy. 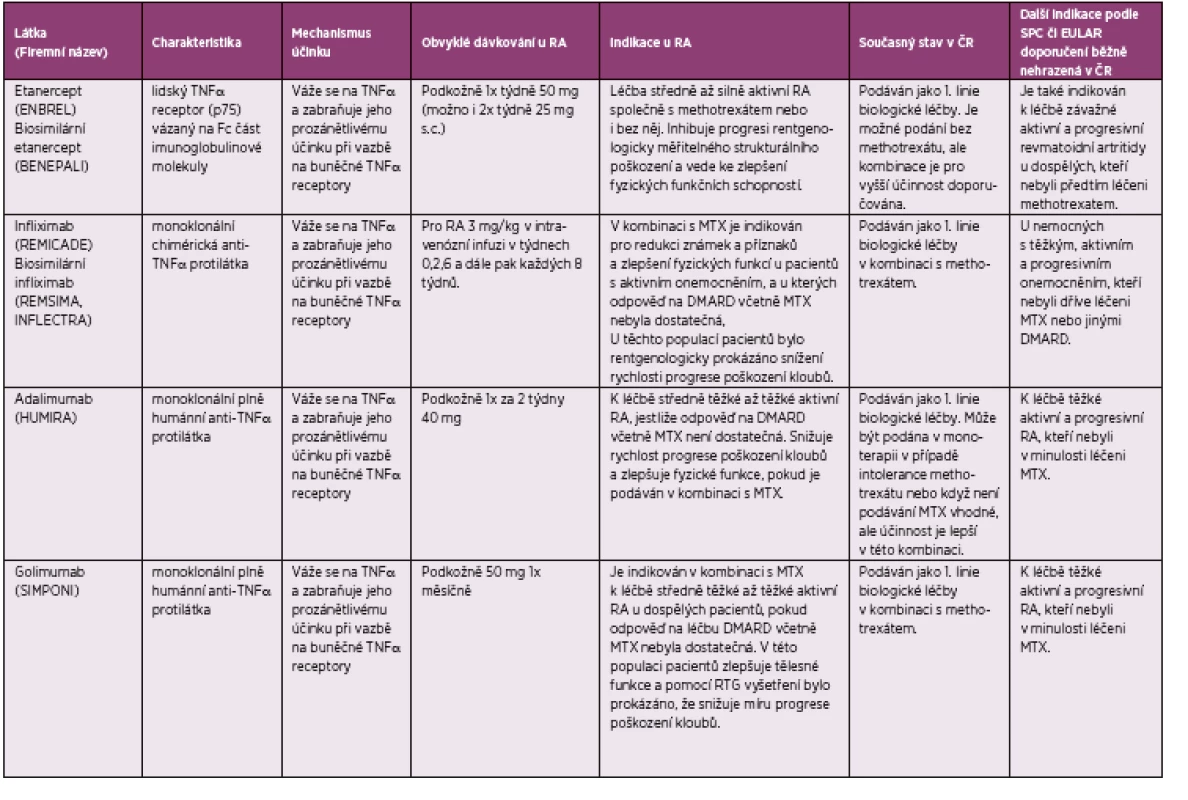

DMARD, chorobu-modifikující antirevmatické léky (disease-modifying antirheumatic drugs) IL, interleukin MTX, methotrexát TNFα, tumor nekrotizující faktor α Pokud nemocný nedosáhne dostatečné účinnosti s pomocí kombinace MTX + biologický lék, je indikována změna léčby. Měl by být použit jiný TNFα inhibitor, jiný biologický lék s odlišným mechanismem účinku, či případně inhibitor janus kinázy. Záměna jednoho TNFα inhibitoru za jiný TNFα inhibitor z důvodu neúčinnosti může být provedena již po 12 týdnech podávání, což může přinést další optimalizaci v přístupu k léčbě (37). S expozicí jednotlivým (biologickým) lékům frekvence pacientů, kteří odpovídají na léčbu, klesá.
Imunogenita
Podávaná biologika jsou imunogenní a mohou vyvolat protireakci organismu ve formě tvorby protilátek proti biologickému léku (ADAb). Platí to především pro inhibitory TNFα, u ostatních biologik je tento fenomén vyjádřen mnohem méně. I inhibitory TNFα se v imunogenitě mezi sebou liší, především etanercept tvorbu významných neutralizačních protilátek téměř nevyvolává. Stanovit počet nemocných, kteří vyvinou ADAb v průběhu léčby, je obtížné, poslední metaanalýza uvádí 13 %, ale vše je závislé na použitých metodikách stanovení (38). Současné užití MTX tvorbu ADAb výrazně snižuje. Protilátky proti podávanému léku mohou biologikum neutralizovat, hladina biologika v séru je tak snížená nebo nedetekovatelná. Výsledkem tvorby ADAb může být ztráta efektu či vznik nežádoucích účinků.
Vede se diskuse, zda pravidelně stanovovat hladiny léku a případně ADAb a podle toho přizpůsobovat léčbu biologikem. Doporučení nejsou jednotná a názor ČRS v tuto chvíli spíše nepodporuje rutinní pravidelné kontroly. Výjimečně mohou nastat okolnosti, kdy stanovení hladiny biologika a/nebo ADAb může přinést prospěšnou informaci, např. při selhání léčby TNFα inhibitorem způsobené tvorbou ADAb lze nadále zvažovat další TNFα inhibitor, zatímco pokud ADAb přítomné nejsou, spíše přichází v úvahu náhrada lékem s jiným mechanismem účinku.
Strategie léčby revmatoidní artritidy
Léčba csDMARD by měla být zahájena co nejdříve, tedy při splnění klasifikačních kritérií ACR/EULAR 2010 pro RA (5). Cílem léčby by měla být remise nebo alespoň nízká aktivita nemoci (7, 39, 40). Tento koncept bývá označován jako tzv. léčba k cíli (treat-to-target, T2T), jehož podstatou je posuzování aktivity onemocnění pomocí kompozitních indexů a následná úprava terapie v pravidelných časových intervalech (40). Cíle léčby by mělo být dosaženo co nejrychleji, a následně je třeba jej dlouhodobě udržovat. Existují doklady (41), že pokud nedojde k významnému zlepšení (pokles aktivity přibližně o méně než 30–50 %) po 3 měsících léčby, není velká šance na dosažení cíle léčby po 6 měsících a později. Je nutné zdůraznit, že strategie léčby k cíli se uplatňuje bez ohledu na konkrétní použitý lék. Na druhé straně je třeba zmínit, že při uplatnění léčby k cíli je nutné také přihlížet k celkovému stavu pacienta, přidruženým komorbiditám, doprovodné terapii a kontraindikacím, které mohou tento přístup modifikovat.
Strategie léčby RA se liší v pohledu na kombinovanou léčbu csDMARD. Doporučení EULAR z roku 2013 navrhovala u pacientů s časnou RA zvážit jako úvodní léčbu monoterapii MTX nebo kombinaci více csDMARD, kde základním lékem je MTX (3). Existují doklady o lepší účinnosti a srovnatelné bezpečnosti kombinované léčby csDMARD (MTX + sulfasalazin + hydroxychlorochin) v porovnání s monoterapií MTX (29, 42). Recentní Cochranská metaanalýza dokonce prokázala podobnou účinnost mezi trojkombinací csDMARD a biologickou léčbou s MTX (29). Ukazuje se také, že úvodní monoterapie MTX vyžaduje častější úpravu medikace, včetně častějšího nasazení biologické léčby, což je spojeno s většími finančními náklady v porovnání s iniciálně podanou trojkombinací (43). Nedávné práce ale ukazují, že iniciální trojkombinace vede sice k rychlejšímu dosažení léčebného cíle, ale účinek trojkombinace není ve srovnání s monoterapií MTX lepší (43–45). Tyto výsledky podporuje systematický přehled literatury o účinnosti sekvenční monoterapie MTX s glukokortikoidy, která pokud je vedena v intencích léčby k cíli, tak umožňuje dosáhnout stejného klinického účinku jako iniciální trojkombinace csDMARD (46). Proto také nová doporučení ACR (4) a EULAR jednoznačně podporují u pacientů s RA zahájit iniciálně monoterapii MTX, což je v souladu s minulými (2) i současnými doporučeními ČRS pro léčbu RA.
Z praktického pohledu je monoterapie pro pacienty přijatelnější, než užívání mnoha tablet denně. Navíc se v běžné praxi z důvodu obav z intolerance a vyššího rizika nežádoucích účinků (třebaže mírných) může stát, že jsou při použití trojkombinace podávány nižší dávky léku. Nicméně pro pacienty, kteří mají aktivní onemocnění s přítomností rizikových faktorů a vyžadují rychlejší nástup účinku léčby, může být po vzájemné dohodě výhodnější zvážit trojkombinaci. V běžné praxi je také možné využít prokazatelně lepší účinnosti kombinace MTX + leflunomid, která je dobře tolerována a nemá významně vyšší výskyt nežádoucích účinků v porovnání s monoterapií (47). Na druhé straně je při použití této kombinace vhodné upozornit na obezřetnost z důvodu zvýšeného rizika myelotoxicity a hepatotoxicity u starších a polymorbidních pacientů.
Zdá se, že existuje tzv. okno příležitosti, které trvá do 10–15 týdnů od nástupu příznaků, kdy lze u malé části (5–10 %) nemocných při včasné agresivní léčbě navodit stav remise, při které není dále vyžadována jakákoliv farmakologická léčba. Některé recentní práce u časné RA poukazují na lepší a rychlejší účinek iniciálně podané biologické léčby v porovnání s léčbou konvenční (48, 49), dokonce i na možnost udržení remise po vysazení veškeré léčby a to u významně většího počtu jedinců, kteří byli iniciálně léčeni biologickým přípravkem (49). Nelze vyloučit, že se v budoucnu stane intenzivní nebo chceme-li agresivní léčebný přístup s využitím indukční biologické terapie základem pro léčbu selektované skupiny jedinců s aktivní RA se špatnými prognostickými faktory. V současnosti ale není dostatek důkazů, že by indukční léčba biologickými přípravky, tj. ještě před zahájením MTX, byla proti intenzivně vedené léčbě csDMARD v kombinaci s glukokortikoidy prospěšnější v dlouhodobém horizontu. Zdá se, že pokud je použit biologický lék s určitým zpožděním u nemocných, kteří na iniciální léčbu MTX neodpověděli dostatečně, nemá toto zpoždění podstatný vliv na další efekt léčby a osud nemocných (48). Navíc neumíme dostatečně přesně vyselektovat pacienty s vyšším rizikem nepříznivého vývoje a mohli bychom tak značnou část pacientů, kteří by dobře odpověděli i na konvenční léčbu, exponovat zbytečně agresivní (a neúměrně nákladné) terapii.
Pokud při léčbě csDMARD první linie nedosáhneme cíle léčby, pak je třeba zvážit přítomnost rizikových faktorů spojených s horší prognózou RA (např. velmi vysoká klinická aktivita, přítomnost erozí, pozitivita RF a/nebo ACPA). U nemocných bez těchto rizikových faktorů můžeme v druhé linii zahájit léčbu jiným csDMARD, případně kombinací těchto léků. U nemocných s nepříznivými prognostickými faktory je po selhání léčby csDMARD první linie vhodné zvažovat nasazení biologické léčby – TNFα inhibitory, abatacept nebo tocilizumab, a to bez hierarchie, včetně možnosti biosimilárních léků. Rituximab je doporučován u pacientů, u nichž selhala předchozí léčba csDMARD a alespoň jedním TNFα inhibitorem. U nemocných s kontraindikacemi jiné biologické léčby, jako je výskyt lymfomu či demyelinizačního onemocnění, je možné zvážit i rituximab v první linii, přičemž rituximab ukázal výbornou účinnost i u pacientů s časnou RA (50).
Biologická léčba je prokazatelně účinnější v kombinaci s MTX, a proto by všechny biologické léky měly být podávány v kombinaci s MTX, případně jiným csDMARD. Jak je uvedeno výše, u nemocných s kontraindikací nebo nesnášenlivostí csDMARD, lze biologickou léčbu podávat i samostatně, přičemž se jako nejvhodnější pro monoterapii v současné době jeví inhibice IL-6 (34, 35), v brzké době budou k dispozici pro takové případy také inhibitory Janus kináz (36, 37). Chimerické protilátky (infliximab a rituximab) a abatacept musí být v souladu s platným SPC podávány v kombinaci s MTX.
Přítomnost autoprotilátek může někdy ovlivnit výběr biologického léku. TNFα inhibitory zpravidla fungují stejně dobře u pacientů s přítomností i bez přítomnosti autoprotilátek, ale některé práce ukazují na jejich lepší efekt u séropozitivních RA pacientů (51), ačkoli výsledky nejsou jednotné (52). U rituximabu je naopak dlouhodobě znám lepší účinek v případě séropozitivního onemocnění (53), což bylo nově popsáno také u abataceptu, přičemž lepší účinnost byla pozorována převážně u jedinců s velmi vysokou hladinou protilátek proti citrulinovaným peptidům (ACPA) (54). Podávání abataceptu je v porovnání s TNFα blokující léčbou spojeno s menším rizikem infekcí (55), což může ovlivnit výběr přípravku u rizikových pacientů.
Pokud se při biologické léčbě nepodaří dosáhnout cíle léčby, pak je na místě změna za jiný biologický přípravek. Při primárním selhání účinku, tj. když není účinku dosaženo od počátku podávání léčby, je asi vhodnější změnit za biologický lék s jiným mechanismem účinku (56). Ovšem i po primárním selhání léčby prvním TNFα inhibitorem je možné zvolit druhý inhibitor TNFα (37). Při selhání účinku dvou a více TNFα inhibitorů doporučujeme nasadit léčbu biologickým přípravkem s jiným mechanismem účinku. Při selhání účinku biologického léku s jiným mechanismem účinku u pacientů, kteří dosud neměli TNFα inhibitor, je doporučeno nasadit TNFα inhibitor, pokud není k této léčbě kontraindikace. Při selhání účinku minimálně jednoho TNFα inhibitoru a minimálně jednoho biologického léku s jiným mechanismem účinku je doporučeno nasadit lék s jiným mechanismem účinku. U pacientů s refrakterním průběhem nemoci, u kterých nastane selhání všech dostupných biologických léků, je vhodné vyzkoušet TNFα inhibitor, který dosud nebyl podáván, nebo přípravek, který měl nejlépe dokumentovaný účinek, případně tsDMARD.
Redukce léčby u pacientů v remisi
U pacientů v dlouhodobé remisi je vhodné zvážit redukci intenzity léčby. O redukci léčby by se mělo uvažovat u pacientů, kteří splňují kritéria remise na dvou následujících návštěvách v intervalu 6 měsíců. První by měly být vysazeny glukokortikoidy, protože jejich podávání, a to zejména v dávkách nad 5 mg prednisonu nebo jeho ekvivalentu na den, je spojeno s významnými nežádoucími účinky. Pokud je pacient v dlouhodobé remisi bez glukokortikoidů, může následovat redukce dávek nebo prodloužení dávkovacího intervalu biologického léku, či eventuálně jeho úplné vysazení. Udržení remise po úplném vysazení biologického léku je pravděpodobnější u časné RA (48). U pacientů s déletrvajícím onemocněním, u ACPA pozitivních pacientů a u pacientů s reziduální klinickou, laboratorní nebo sonograficky zjistitelnou kloubní aktivitou je udržení remise méně pravděpodobné, proto se úplné vysazení biologické léčby nedoporučuje (57–59). Redukce dávky csDMARD (např. MTX) se provádí (především z farmakoekonomických důvodů) až jako poslední. Poznatky o důsledcích redukce dávek či úplného přerušení léčby csDMARD jsou omezené. Především u pacientů s déle trvajícím onemocněním a u RF-pozitivních a ACPA-pozitivních je šance na udržení dlouhodobé remise bez léčby csDMARD malá a riziko vzplanutí ve srovnání s pokračováním léčby csDMARD značné (57, 60, 61). Pokus o úplné přerušení léčby csDMARD proto zřejmě není u většiny pacientů vhodný, s možnou výjimkou u pacientů, kteří byli léčeni již ve velmi časné fázi RA, tj. do 3 měsíců trvání symptomů (60, 61). Při rozhodování o redukci léčby je vždy třeba vzít v potaz preference a hodnoty pacienta a vytvořit plán pro další monitoraci aktivity onemocnění a rychlého zvládnutí případného relapsu.
EULAR a ACR periodicky formulují svá doporučení k léčbě RA, která jsou opřena o nejčerstvější přehled literatury a tím o informovanou diskuzi, která vede ke konečnému textu. Jednotlivé revmatologické společnosti při tvorbě vlastních doporučení z těchto textů vycházejí. Po zvážení doporučených postupů EULAR i ACR a všech nových poznatků navrhuje pracovní skupina ČRS následující principy léčby RA (obr. 1):
Obr. 1. Princip léčby revmatoidní artritidy (upraveno podle Smolen J, a kol. Ann Rheum Dis v tisku). 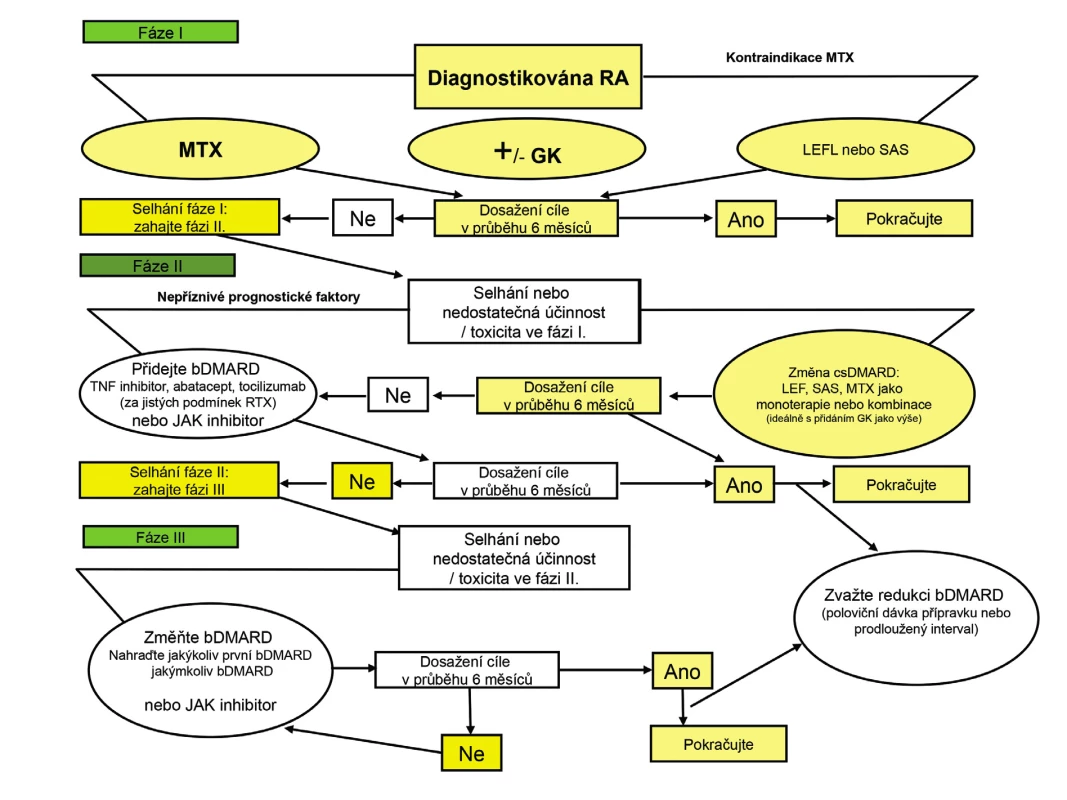

Zkratky vycházející z anglické nomenklatury: DMARD - disease-modifying antirheumatic drugs, csDMARD – conventional synthetic DMARD, tsDMARD – targeted synthetic DMARD, boDMARD – biological original DMARD, bsDMARD – biosimilar DMARD. Závěr
Současné doporučené postupy ČRS by měly sloužit jako praktický návod pro revmatology, jak podle nejnovějších poznatků nejlépe postupovat při léčbě RA. Důraz je kladen na včasnou diagnostiku, okamžité zahájení terapie a uplatňování principů léčby k cíli ve snaze navodit remisi nebo alespoň nízkou aktivitu nemoci. V současnosti nedokážeme u konkrétního pacienta jednoznačně předpovědět účinnost ani bezpečnost konkrétního léku. Pro klinickou praxi je nejlepším ukazatelem dlouhodobě dobré odpovědi významné zlepšení aktivity v krátkém časovém intervalu po zahájení léčby, obvykle již po 3 měsících. Při zahájení léčby by měla být nasazena monoterapie csDMARD (preferenčně MTX), u aktivního onemocnění často v kombinaci s glukokortikoidy, a při selhání tohoto postupu je doporučeno do kombinace přidat biologickou léčbu. Zmíněny byly i přípravky biosimilární, jejichž účinnost a bezpečnost je srovnatelná s originálními přípravky a jejich zavedení do praxe v řadě zemí významně snížilo vysoké ekonomické náklady na léčbu RA. Předběžně byla diskutována i tsDMARD (inhibitory Janus kinázy), jejichž postavení v léčebném algoritmu RA si pravděpodobně vyžádá dodatek ke stávajícím doporučeným postupům. Je nutné si uvědomit, že syntetické i biologické léky mohou mít i řadu závažných nežádoucích účinků, jejichž přehled a doporučení pro monitorování bezpečnosti léčby, včetně speciálních situací bude předmětem samostatné přehledné práce.
Zkratky
ACPA, protilátky proti citrulinovaným peptidům (anti-citrullinated peptide antibodies)
ACR, Americká revmatologická asociace (American College of Rheumatology)
ADAb, protilátky proti biologickému léku (anti-drug antibodies)
CDAI, klinický index aktivity nemoci (Clinical Disease Activity Index)
ČRS, Česká revmatologická společnost
DAS, skóre aktivity nemoci (disease activity score)
DMARD, chorobu modifikující antirevmatické léky (disease-modifying antirheumatic drugs)
csDMARD, konvenční syntetické (conventional synthetic) DMARD
tsDMARD, cílené syntetické (targeted synthetic) DMARD
boDMARD, biologické originální (biological original) DMARD
bsDMARD, biosimilární (biosimilar) DMARD
EULAR, Evropská liga proti revmatismu (European League Against Rheumatism)
HAQ, dotazník pro hodnocení zdravotního stavu (Health Assessment Questionnaire)
IL, interleukin
MTX, methotrexát
RA, revmatoidní artritida
SDAI, zjednodušený index aktivity nemoci (Simplified Disease Activity Index)
TNFα, tumor nekrotizující faktor α
Poděkování:
Poděkování patří všem členům České revmatologické společnosti a předsedkyni výkonného výboru Revma Ligy Česká republika Editě Müllerové za připomínky k navrženým doporučeným postupům.
Podpořeno projektem Ministerstva zdravotnictví pro koncepční rozvoj výzkumné organizace 023728.
adresa pro korespondenci:
Prof. MUDr. Ladislav Šenolt, Ph.D.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: senolt@revma.cz
Zdroje
1. Smolen JS, Aletaha D, McInnes IB. Rheumatoid arthritis. Lancet. 2016; 388(10055): 2023–2038.
2. Pavelka K, Vencovský J. Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy Čes Revmatol 2010; 4 : 182–191.
3. Smolen JS, Landewé R, Bijlsma J, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis. 2017 Mar 6. pii: annrheumdis-2016-210715. doi: 10.1136/annrheumdis-2016-210715. [Epub ahead of print]
4. Singh JA, Saag KG, Bridges SL Jr, et al. 2015 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Rheumatol. 2016; 68(1): 1–26.
5. Aletaha D, Neogi T, Silman A, et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/ European League Against Rheumatism collaborative initiative. Ann Rheum Dis 2010; 69 : 1580–88.
6. van der Heijde D, van der Helm-van Mil AH, Aletaha D, et al. EULAR definition of erosive disease in light of the 2010 ACR/EULAR rheumatoid arthritis classification criteria. Ann Rheum Dis 2013; 72 : 479–81.
7. Farheen K, Agarwal SK. Assessment of disease activity and treatment outcomes in rheumatoid arthritis. J Manag Care Pharm 2011; 17(9 Suppl B): S09–13.
8. Felson DT, Smolen JS, Wells G, et al. American College of Rheumatology/European League against Rheumatism provisional definition of remission in rheumatoid arthritis for clinical trials. Ann Rheum Dis 2011; 70(3): 404–13.
9. Naredo E, Bonilla G, Gamero F, et al. Assessment of inflammatory activity in rheumatoid arthritis: a comparative study of clinical evaluation with grey scale and power Doppler ultrasonography. Ann Rheum Dis 2005; 64 : 375–81.
10. Dale J, Stirling A, Zhang R, et al. Targeting ultrasound remission in early rheumatoid arthritis: the results of the TaSER study, a randomised clinical trial. Ann Rheum Dis 2016; 75(6): 1043–50.
11. Maska L, Anderson J, Michaud K. Measures of functional status and quality of life in rheumatoid arthritis: Health Assessment Questionnaire Disability Index (HAQ), Modified Health Assessment Questionnaire (MHAQ), Multidimensional Health Assessment Questionnaire (MDHAQ), Health Assessment Questionnaire II (HAQ-II), Improved Health Assessment Questionnaire (Improved HAQ), and Rheumatoid Arthritis Quality of Life (RAQoL). Arthritis Care Res (Hoboken) 2011; 63 Suppl 11: S4–13.
12. Šléglová O, Dušek L, Olejárová M, Tegzová D, Vencovský J, Pavelka K. Posuzování funkční schopnosti u pacientů s revmatoidní artritidou; validace české verze Stanfordského dotazníku Health Assessment Questionnaire (HAQ). Čes Revmatol 2010; 18 : 73–83.
13. van der Heijde DM, van Riel PL, Nuver-Zwart IH, Gribnau FW, vad de Putte LB. Effects of hydroxychloroquine and sulphasalazine on progression of joint damage in rheumatoid arthritis. Lancet 1989; 1(8646): 1036–8.
14. Lindqvist E, Jonsson K, Saxne T, Eberhardt K. Course of radiographic damage over 10 years in a cohort with early rheumatoid arthritis. Ann Rheum Dis 2003; 62(7): 611–6.
15. Colebatch AN, Edwards CJ, Østergaard M, et al. EULAR recommendations for the use of imaging of the joints in the clinical management of rheumatoid arthritis. Ann Rheum Dis 2013; 72(6): 804–14.
16. Pincus T, Cutolo M. Clinical trials documenting the efficacy of low-dose glucocorticoids in rheumatoid arthritis. Neuroimmunomodulation 2015; 22 : 46–50.
17. van der Goes MC, Jacobs JW, Bijlsma JW. Toward safer treatment with glucocorticoids: via patient and rheumatologist perspectives to recommendations on monitoring for adverse events. Clin Exp Rheumatol 2011; 29(5 Suppl 68): S116–20.
18. Hoes JN, Jacobs JW, Verstappen SM, et al. Adverse events of low - to medium-dose oral glucocorticoids in inflammatory diseases: a meta-analysis. Ann Rheum Dis 2009; 68(12): 1833–8.
19. den Uyl D, ter Wee M, Boers M, et al. A non-inferiority trial of an attenuated combination strategy (‘COBRA-light’) compared to the original COBRA strategy: clinical results after 26 weeks. Ann Rheum Dis 2014; 73(6): 1071–8.
20. Kuijper TM, Luime JJ, de Jong PH, et al. Tapering conventional synthetic DMARDs in patients with early arthritis in sustained remission: 2-year follow-up of the tREACH trial. Ann Rheum Dis 2016; 75(12): 2119–2123.
21. Goekoop-Ruiterman YP, de Vries-Bouwstra JK, Allaart CF, et al. Clinical and radiographic outcomes of four different treatment strategies in patients with early rheumatoid arthritis (the BeSt study): a randomized, controlled trial. Arthritis Rheum 2005; 52 : 3381–90.
22. Hafström I, Albertsson K, Boonen A, et al. BARFOT Study Group. Remission achieved after 2 years’ treatment with low-dose prednisolone in addition to disease-modifying anti-rheumatic drugs in early rheumatoid arthritis is associated with reduced joint destruction still present after 4 years: an open 2-year continuation study. Ann Rheum Dis 2009; 68(4): 508–13.
23. Hørslev-Petersen K, Hetland ML, Ørnbjerg LM, et al. OPERA Study-Group. Clinical and radiographic outcome of a treat-to-target strategy using methotrexate and intra-articular glucocorticoids with or without adalimumab induction: a 2-year investigator-initiated, double-blinded, randomised, controlled trial (OPERA). Ann Rheum Dis. 2016; 75(9): 1645–53.
24. Konai MS, Vilar Furtado RN, Dos Santos MF, Natour J. Monoarticular corticosteroid injection versus systemic administration in the treatment of rheumatoid arthritis patients: a randomized double-blind controlled study. Clin Exp Rheumatol 2009; 27(2): 214–21.
25. Grigor C, Capell H, Stirling A, et al. Effect of a treatment strategy of tight control for rheumatoid arthritis (the TICORA study): a single-blind randomised controlled trial. Lancet 2004; 364(9430): 263–9.
26. Hetland ML, Stengaard-Pedersen K, Junker P, et al. CIMESTRA Study Group. Combination treatment with methotrexate, cyclosporine, and intraarticular betamethasone compared with methotrexate and intraarticular betamethasone in early active rheumatoid arthritis: an investigator-initiated, multicenter, randomized, double-blind, parallel-group, placebo-controlled study. Arthritis Rheum 2006; 54(5): 1401–9.
27. Gaujoux-Viala C, Smolen JS, Landewé R, et al. Current evidence for the management of rheumatoid arthritis with synthetic disease-modifying antirheumatic drugs: a systematic literature review informing the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis 2010; 69(6): 1004–9.
28. Pincus T. Folic and folinic acid supplementation reduces methotrexate gastrointestinal side effects in rheumatoid arthritis. Clin Exp Rheumatol 1998; 16(6): 667–8.
29. Hazlewood GS, Barnabe C, Tomlinson G, et al. Methotrexate monotherapy and methotrexate combination therapy with traditional and biologic disease modifying antirheumatic drugs for rheumatoid arthritis: abridged Cochrane systematic review and network meta-analysis. BMJ 2016; 353: i1777.
30. O’Dell JR, Haire CE, Erikson N, et al. Treatment of rheumatoid arthritis with methotrexate alone, sulfasalazine and hydroxychloroquine, or a combination of all three medications. N Engl J Med 1996; 334(20):1287–91.
31. Götestam Skorpen C, Hoeltzenbein M, Tincani A, et al. The EULAR points to consider for use of antirheumatic drugs before pregnancy, and during pregnancy and lactation. Ann Rheum Dis 2016; 75(5): 795–810.
32. Zeidler HK, Kvien TK, Hannonen P, et al. Progression of joint damage in early active severe rheumatoid arthritis during 18 months of treatment: comparison of low-dose cyclosporin and parenteral gold. Br J Rheumatol 1998; 37(8): 874–82.
33. Gabay C, Emery P, van Vollenhoven R, et al. Tocilizumab monotherapy versus adalimumab monotherapy for treatment of rheumatoid arthritis (ADACTA): a randomised, double-blind, controlled phase 4 trial. Lancet 2013; 381(9877): 1541–50.
34. Burmester GR, Lin Y, Patel R, et al. Efficacy and safety of sarilumab monotherapy versus adalimumab monotherapy for the treatment of patients with active rheumatoid arthritis (MONARCH): a randomised, double-blind, parallel-group phase III trial. Ann Rheum Dis 2016 Nov 17 [Epub ahead of print].
35. Fleischmann R, Kremer J, Cush J, et al. ORAL Solo Investigators. Placebo-controlled trial of tofacitinib monotherapy in rheumatoid arthritis. N Engl J Med 2012; 367(6): 495–507.
36. Fleischmann R, Schiff M, van der Heijde D, et al. Baricitinib, Methotrexate, or Combination in Patients with Rheumatoid Arthritis and No or Limited Prior Disease-Modifying Antirheumatic Drug Treatment. Arthritis Rheumatol. 2016 doi: 10.1002/art.39953. [Epub ahead of print]
37. Smolen JS, Burmester GR, Combe B. Head-to-head comparison of certolizumab pegol versus adalimumab in rheumatoid arthritis: 2-year efficacy and safety results from the randomised EXXELERATE study. Lancet 2016; 388(10061): 2763–74.
38. Thomas SS, Borazan N, Barroso N, et al. Comparative Immunogenicity of TNF Inhibitors: Impact on Clinical Efficacy and Tolerability in the Management of Autoimmune Diseases. A Systematic Review and Meta-Analysis. BioDrugs. 2015; 29(4): 241–58.
39. Stoffer MA, Schoels MM, Smolen JS, et al. Evidence for treating rheumatoid arthritis to target: results of a systematic literature search update. Ann Rheum Dis 2016; 75(1): 16–22.
40. Smolen JS, Breedveld FC, Burmester GR, et al. Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force. Ann Rheum Dis 2016; 75(1): 3–15.
41. Aletaha D, Alasti F, Smolen JS. Optimisation of a treat-to-target approach in rheumatoid arthritis: strategies for the 3-month time point. Ann Rheum Dis. 2016; 75(8): 1479–85.
42. Möttönen T, Hannonen P, Leirisalo-Repo M, et al. Comparison of combination therapy with single-drug therapy in early rheumatoid arthritis: a randomised trial. FIN-RACo trial group. Lancet 1999; 353(9164): 1568–73.
43. de Jong PH, Hazes JM, Han HK, et al. Randomised comparison of initial triple DMARD therapy with methotrexate monotherapy in combination with low-dose glucocorticoid bridging therapy; 1-year data of the tREACH trial. Ann Rheum Dis 2014; 73(7): 1331–9.
44. Verschueren P, De Cock D, Corluy L, et al. Effectiveness of methotrexate with step-down glucocorticoid remission induction (COBRA Slim) versus other intensive treatment strategies for early rheumatoid arthritis in a treat-to-target approach: 1-year results of CareRA, a randomised pragmatic open-label superiority trial. Ann Rheum Dis 2016 Jul 18. pii: annrheumdis-2016-209212. doi: [Epub ahead of print].
45. ter Wee MM, den Uyl D, Boers M, et al. Intensive combination treatment regimens, including prednisolone, are effective in treating patients with early rheumatoid arthritis regardless of additional etanercept: 1-year results of the COBRA-light open-label, randomised, non-inferiority trial. Ann Rheum Dis 2015; 74(6): 1233–40.
46. Gaujoux-Viala C, Nam J, Ramiro S, et al. Efficacy of conventional synthetic disease-modifying antirheumatic drugs, glucocorticoids and tofacitinib: a systematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis 2014; 73(3): 510–5.
47. Bird P, Griffiths H, Tymms K, et al. The SMILE study – safety of methotrexate in combination with leflunomide in rheumatoid arthritis. J Rheumatol 2013; 40(3): 228–35.
48. Smolen JS, Emery P, Fleischmann R, et al. Adjustment of therapy in rheumatoid arthritis on the basis of achievement of stable low disease activity with adalimumab plus methotrexate or methotrexate alone: the randomised controlled OPTIMA trial. Lancet 2014; 383(9914): 321–32.
49. Bijlsma JW, Welsing PM, Woodworth TG, et al. Early rheumatoid arthritis treated with tocilizumab, methotrexate, or their combination (U-Act-Early): a multicentre, randomised, double-blind, double-dummy, strategy trial. Lancet 2016; 388(10042): 343–55.
50. Porter D, van Melckebeke J, Dale J, et al. Tumour necrosis factor inhibition versus rituximab for patients with rheumatoid arthritis who require biological treatment (ORBIT): an open-label, randomised controlled, non-inferiority, trial. Lancet 2016; 388(10041): 239–47.
51. Braun-Moscovici Y, Markovits D, Zinder O, et al. Anti-cyclic citrullinated protein antibodies as a predictor of response to anti-tumor necrosis factor-α therapy in patients with rheumatoid arthritis. J Rheumatol 2006; 33 : 497–500.
52. Van den Broek M, Dirven L, Klarenbeek NB, et al. The association of treatment response and joint damage with ACPA-status in recent-onset RA: a subanalysis of the 8-year follow-up of the BeSt study. Ann Rheum Dis 2012; 71 : 245–8.
53. Emery P, Gottenberg JE, Rubbert-Roth A, et al. Rituximab versus an alternative TNF inhibitor in patients with rheumatoid arthritis who failed to respond to a single previous TNF inhibitor: SWITCH-RA, a global, observational, comparative effectiveness study. Ann Rheum Dis 2015; 74(6): 979–84.
54. Sokolove J, Schiff M, Fleischmann R, et al. Impact of baseline anti-cyclic citrullinated peptide-2 antibody concentration on efficacy outcomes following treatment with subcutaneous abatacept or adalimumab: 2-year results from the AMPLE trial. Ann Rheum Dis 2016; 75(4): 709–14.
55. Yun H, Xie F, Delzell E, et al. Comparative Risk of Hospitalized Infection Associated With Biologic Agents in Rheumatoid Arthritis Patients Enrolled in Medicare. Arthritis Rheumatol 2016; 68(1): 56–66.
56. Gottenberg JE, Brocq O, Perdriger A, et al. Non-TNF-Targeted Biologic vs a Second Anti-TNF Drug to Treat Rheumatoid Arthritis in Patients with Insufficient Response to a First Anti-TNF Drug: A Randomized Clinical Trial. JAMA 2016; 316(11): 1172–1180.
57. Schett G, Emery P, Tanaka Y, et al. Tapering biologic and conventional DMARD therapy in rheumatoid arthritis: current evidence and future directions. Ann Rheum Dis 2016;75(8): 1428–37.
58. van der Woude D, Young A, Jayakumar K, et al. Prevalence of and predictive factors for sustained disease-modifying anti-rheumatic drug-free remission in rheumatoid arthritis: results from two large early arthritis cohorts. Arthritis Rheum 2009; 60 : 2262–71.
59. Kuijper TM, Luime JJ, de Jong PH, et al. Tapering conventional synthetic DMARDs in patients with early arthritis in sustained remission: 2-year follow-up of the tREACH trial. Ann Rheum Dis 2016 Jun 9 pii: annrheumdis-2016-209272. doi: 10.1136/annrheumdis-2016-209272. [Epub ahead of print].
60. Klarenbeek NB, van der Kooij SM, Güler-Yüksel M, et al. Discontinuing treatment in patients with rheumatoid arthritis in sustained clinical remission: exploratory analyses from the BeSt study. Ann Rheum Dis 2011; 70(2): 315–9.
61. van der Woude D, Visser K, Klarenbeek NB, et al. Sustained drug-free remission in rheumatoid arthritis after DAS-driven or non-DAS-driven therapy: a comparison of two cohort studies. Rheumatology (Oxford) 2012; 51(6): 1120–8.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2017 Číslo 1- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Sjögrenův syndrom
- Využití Mezinárodní klasifikace funkčních schopností, disability a zdraví u pacientů s artrózou kolenního a kyčelního kloubu
- Vztah solubilních faktorů imunitního systému k fenotypu idiopatických zánětlivých myopatií
- Úvodník
- Oznámení
- Doporučení České revmatologické společnosti pro farmakoterapii revmatoidní artritidy 2017
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Sjögrenův syndrom
- Doporučení České revmatologické společnosti pro farmakoterapii revmatoidní artritidy 2017
- Využití Mezinárodní klasifikace funkčních schopností, disability a zdraví u pacientů s artrózou kolenního a kyčelního kloubu
- Vztah solubilních faktorů imunitního systému k fenotypu idiopatických zánětlivých myopatií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




