-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
C-reaktivní protein: biomarker sekundární osteoporózy a zlomenin při chronických zánětlivých onemocněních
C-reactive protein: a biomarker of secondary osteoporosis and fractures in chronic inflammatory diseases
High sensitivity C-reactive protein (hsCRP), an acute phase serum component involved in inflammation, is associated with factors critical for physiology of musculoskeletal system. An association between circulating hsCRP level and bone mineral density, biochemical bone turnover markers and increased risk of fracture has been observed in rheumatoid arthritis, ankylosing spondylitis, inflammatory bowel disease, and other inflammatory diseases. Moreover, subclinical low-grade systemic inflammation may be an important factor in bone turnover rate and bone mass. In healthy individuals, serum hsCRP concentrations greater than upper limit of reference range are associated with higher bone turnover rate and osteoporosis and/or osteopenia, and affect the risk of low impact fractures. CRP is negatively associated with appendicular lean mass
Key words:
High sensitivity C-reactive protein, osteoporosis, sarcopenia, fracture
Autoři: J. Štěpán
Působiště autorů: Revmatologická klinika 1. LF UK Praha ; Revmatologický ústav Praha
Vyšlo v časopise: Čes. Revmatol., 24, 2016, No. 3, p. 70-77.
Kategorie: Přehledový článek
Souhrn
C-reaktivní protein (CRP), sérová složka reaktantů akutní fáze, je asociován s faktory, které se uplatňují ve fyziologii muskuloskeletálního systému. Hodnoty vysoce senzitivního CRP (hsCRP) jsou asociovány s denzitou kostního minerálu, markery kostní remodelace a zvýšeným rizikem zlomenin při celé řadě chronických zánětlivých onemocnění. Remodelaci kosti a množství a kvalitu kostní hmoty však může významně ovlivnit i subklinický systémový zánět. Pokud jsou sérové hodnoty hsCRP u zdravých osob vyšší než horní hranice referenčních mezí, jsou také asociovány s osteopenií nebo osteoporózou a vyšším rizikem nízkotraumatických fraktur. Při interpretaci těchto zjištění je ale třeba zvažovat také negativní asociace hsCRP se hmotou kosterních svalů.
Klíčová slova:
Vysoce senzitivní C-reaktivní protein, osteoporóza, sarkopenie, zlomeninyÚvod
Exogenní a endogenní podněty zánětlivé reakce navozují tvorbu řady mediátorů zánětu, jako jsou mj. prozánětlivé cytokiny. Uvolnění IL-1 a TNFα z místa zánětu a následné zvýšená tvorba IL-6 navozují (nebo tlumí) v játrech produkci řady reaktantů akutní fáze, z nichž C–reaktivní protein (CRP) má nejlépe ověřenou klinickou výpověď [1–3]. Jedná se o fylogeneticky uchovávanou molekulu s pěti podjednotkami (pentraxin), z nichž každá váže dva ionty vápníku. CRP je významnou složkou vrozeného imunitního systému; váže se na řadu mikroorganismů, v jejichž membráně je fosforylcholin, aktivuje systém komplementu, účastní se opsonizace infekčních agens a poškozených buněk a moduluje funkce monocytů a makrofágů [4]. Plazmatická koncentrace CRP se zvyšuje již za 4 hodiny po navození reakce akutní fáze a v průběhu prvních dvou dnů jeho koncentrace vzroste až o 2 řády. Stanovení CRP tedy má výpovědní hodnotu už pro včasné zjištění zánětlivého onemocnění. Nevýhodou CRP je jeho nízká specifita, protože přetrvávající zvýšení hodnot CRP informuje o přítomnosti zánětu, nikoli však o jeho příčině [5].
Horní referenční mez plazmatické koncentrace hsCRP u žen ve věku 19–49 let je 3,33 mg/l, ve věku 50–64 let je 8,5 mg/l, ve věku nad 65 let je 6,6 mg/l. Hodnoty hsCRP však u žen závisejí mj. na věku, na hodnotě triglyceridů, leukocytů, BMI, a na užívání kontraceptiv a antibiotik. Horní referenční mez hsCRP u mužů ve věku 19–39 let je 2,68 mg/l, ve věku 40–49 let 4,80 mg/l, ve věku 50–64 let 7,90 mg/l a ve věku 65–99 let 6,80 mg/l, přičemž hodnoty závisejí zejména na věku, hmotnosti, kouření, hodnotě leukocytů, AST a na užívání antihistaminik [6–8]. Podobně jako hodnoty hsCRP, také sérové koncentrace prozánětlivých cytokinů (zejména IL–6, TNFα a IL–10) i CRP se zvyšují s věkem a jsou asociovány se zhoršováním kognitivních a fyzických funkcí a s vyšší mortalitou [9–14]. Hodnoty CRP > 3 mg/l jsou zejména spojovány s vysokým rizikem kardiovaskulárních onemocnění [15]. Klinická výpověď CRP je také zvažována při zajišťování opatření ke snížení kardiovaskulární morbidity a mortality [13, 16] a v diagnostice a monitorování léčby při sepsi a při zánětlivých revmatologických a střevních onemocněních [17, 18]. Méně je známo o asociaci mezi CRP a poruchami růstu kostí u dětí [19], zhoršováním kvality kosti, a zvyšování rizika zlomenin, a to i v případech, kdy k léčbě zánětu nejsou užívány glukokortikoidy. Chronická zánětlivá onemocnění zrychlují úbytek a zhoršování kvality kostní hmoty a patří proto k nejzávažnějším klinickým rizikovým faktorům zlomenin.
Riziko osteoporózy a nízkotraumatických zlomenin při chronických zánětlivých onemocněních se zvýšenými hodnotami hsCRP
Při revmatoidní artritidě je riziko radiologicky průkazných zlomenin obratlových těl 2krát až třikrát vyšší ve srovnání se zdravou populaci mužů i žen ve všech věkových kategoriích, a to nezávisle na BMD axiálního skeletu (obr. 1) [20–23]. Relativní riziko zlomeniny v oblasti kyčle je zvýšeno 2krát, relativní riziko zlomeniny obratle je zvýšeno 2,4krát a klinické zlomeniny 1,5krát [24]. Riziko zlomenin je obdobné u žen i u mužů a zůstává zvýšené i po adjustaci na léčbu glukokortikoidy. V době diagnózy revmatoidní artritidy se osteodenzitometricky neprokazuje zvýšená prevalence osteoporózy a výpověď BMD jako prediktoru rizika zlomenin je malá. Při ankylozující spondylitis se prevalence systémové osteopenie nebo osteoporózy uvádí mezi 19–62 % [25]. Syndesmofyty činí výpověď DXA bederní páteře prakticky nepoužitelnou. Klinicky významnou výpověď má měření BMD obratlových těl metodou QCT [26]. Prevalence zlomenin obratlů při ankylozující spondylitis je 10–30% [27]. Pravděpodobnost klinické zlomeniny obratle při AS je proti kontrolám zvýšena 3,3krát [28]. Při systémovém lupus erythematodes (SLE) se u žen před menopauzou, dlouhodobě trpících onemocněním SLE a užívajících glukokortikoidy se osteoporóza uvádí u 12–16 % pacientů [29]. Relativní riziko zlomenin je pětkrát zvýšené a zlomeniny se prokazují u mladších osob (v průměru ve 48 letech).
Obr. 1. Vlevo: Incidence zlomenin u 47 036 pacientů s revmatoidní artritidou v porovnání s incidencí u 826 606 kontrol [94]. Vpravo: Incidence zlomenin u 6 027 nemocných se zánětlivým střevním onemocněním v porovnání s incidencí u 60 027 kontrol. ![Vlevo: Incidence zlomenin u 47 036 pacientů s revmatoidní artritidou v porovnání s incidencí u 826 606 kontrol [94].
Vpravo: Incidence zlomenin u 6 027 nemocných se zánětlivým střevním onemocněním v porovnání s incidencí u 60 027 kontrol.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/ee029845cd3de65bad9e82810a9fe475.jpg)
Upraveno podle [37]. Při chronické obstrukční chorobě bronchopulmonální se prevalence osteoporózy, posuzovaná podle BMD nebo zlomenin obratlů uvádí 24 % až 80 % [30–34].
Při zánětlivých onemocněních střev se osteopenie nebo osteoporóza (hodnocená měřením BMD) uvádí u 38 až 72 % pacientů [35, 36]. Podle výsledků studie u 6 027 pacientů se zánětlivým onemocněním střev byla v porovnání s 60 027 osobami z běžné populace zvýšena incidence zlomenin obratlů o 74 %, kyčle o 59 %, distálního předloktí o 33 %, žeber o 25 % a všech zlomenin o 41 % [37].
V klinicky diagnostikovaných situacích je hodnota hsCRP významně asociována se zrychleným úbytkem kostní hmoty a zvýšeným rizikem nízkotraumatických zlomenin. Pro praxi je ale také důležitá otázka asociace mezi hsCRP a rizikem zlomenin při nízkém stupni zánětu v běžné populaci, protože včasná diagnóza a léčení základního onemocnění mohou zastavit zhoršování stavu kostní hmoty [38].
C-reaktivní protein a riziko nízkotraumatických zlomenin v populačních studiích
Asociaci mezi hodnotami hsCRP a rizikem nízkotraumatických zlomenin prokázaly jen některé populační studie. V populační studii u 919 italských žen a mužů (věk 40–79 let) sledovaných po dobu 5 let bylo po adjustaci riziko nízkotraumatických zlomenin 9,4x vyšší (95% CI, 3,6–24,8) při hsCRP v horním tertilu (≥ 2,5 mg/, medián 4,6 mg/l), než v dolním tertilu (< 1,1 mg/l, medián 0,7 mg/l) (p < 0,001) (obr. 2) [39]. Podobné výsledky byly v prospektivní populační studii u japonských žen [8]. Asijské ženy však mají hodnoty hsCRP významně nižší, než ženy z kavkazské skupiny.
Obr. 2. Asociace sérových koncentrací hsCRP a rizika nízkotraumatických zlomenin během 15 let u 250 žen a mužů v Tyrolsku. 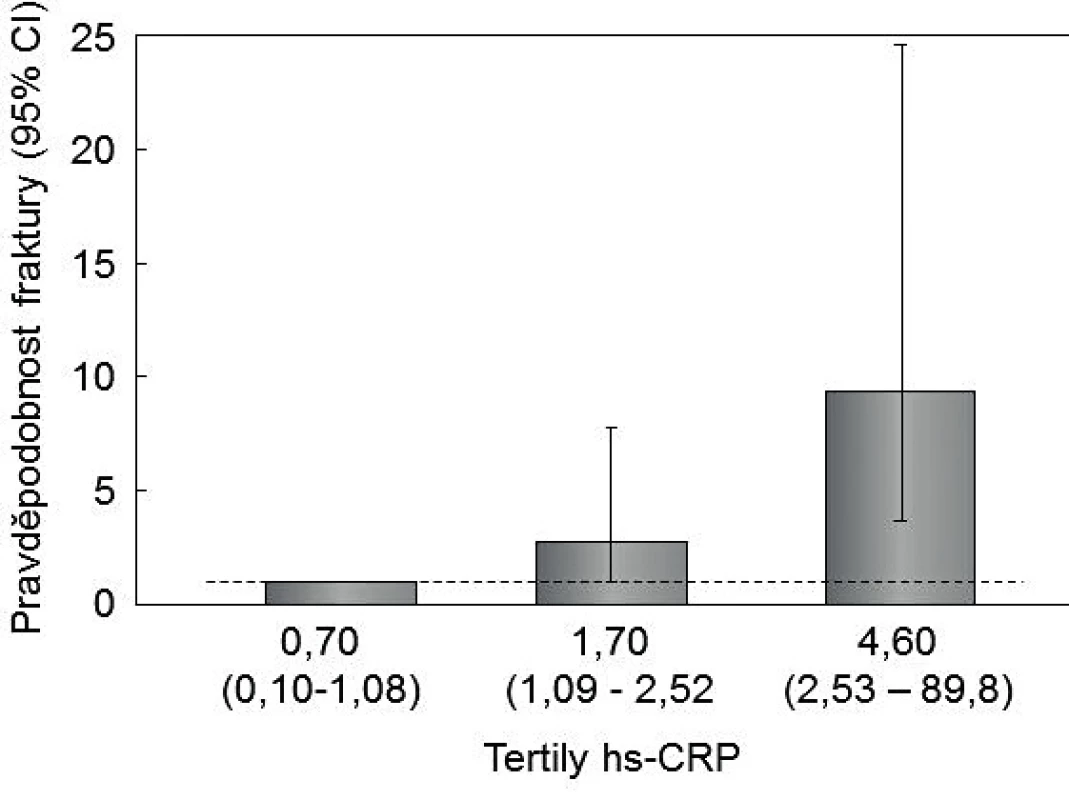
Upraveno podle [39]. V prospektivní populační studii MrOS u 3 014 švédských mužů ve věku 69–81 let (průměr 75 let), sledovaných po dobu 5,4 let, bylo po adjustaci riziko nízkotraumatických zlomenin obratlů nebo končetin při hodnotách hsCRP v horním tertilu (3,26–7,92 mg/l, medián 4,31 mg/l) o 48 % vyšší (95% CI, 1,20–1,82), než u mužů s hsCRP ve středním tertilu (1,98–2,40 mg/l, medián 2,17 mg/l) a dolním tertilu (1,31–1,67 mg/l, medián 1,51 mg/l) [40]. Rozdílné výsledky poskytla studie u 1 044 švédských žen ve věku ≥ 75 let, sledovaných průměrně 11,6 let. U žen s hsCRP v horním kvartilu (průměr 5,74 mg/l) byla BMD v krčku femuru a v celkovém prox. femuru vyšší a riziko nízkotraumatických zlomenin významně nižší, než u žen s hsCRP v dolním kvartilu (průměr 0,63 mg/l). Nicméně ženy ve věku 75 až 85 let a s hodnotami CRP ≥ 3 mg/l ztratily během 10 let sledování významně více BMD v krčku femuru a v celkovém prox. femuru, než ženy s hsCRP < 3 mg/l [41].
V australské populační studii se po průměrně 5,5 roku trvajícím sledování 444 žen (věk ≥ 65 let, medián hsCRP 2,44 mg/l) riziko klinické zlomeniny zvýšilo o 23% s každým zvýšením hsCRP o 1 SD. Tato asociace ale nezávisela na BMD, prevalentní zlomenině, markerech kostní remodelace (S-CTX, S-kostní ALP, životním stylu ani komorbiditách [42]. V prospektivní populační studii u 18 586 britských žen a mužů ve věku 40–79 let sledovaných po dobu 14,8 let měla asociace mezi CRP a rizikem zlomenin tvar U. Nejnižší riziko bylo u mužů a žen s CRP 1,1–2 mg/l [43]. V prospektivní populační studii u 1 872 amerických žen byl zjištěn lineární nárůst rizika zlomenin až při hodnotách CRP ≥ 3 mg/l [44].
Srovnání klinické výpovědi měření hsCRP a prozánětlivých cytokinů poskytla prospektivní populační studie u 2 985 zdravých amerických žen a mužů ve věku 70–79 let, sledovaných po dobu 5,8 ± 1,6 let. Pravděpodobnost zlomenin u žen s hodnotami IL-6 v horním kvartilu byla zvýšena o 28 % (95% CI 0,95-1,74). Pravděpodobnost zlomenin u žen s hodnotami TFNα v horním kvartilu byla zvýšena o 52 % (95% CI 0,97-1,70). Statisticky významně však vypovídalo o zvýšeném riziku zlomenin až hodnocení kombinace hsCRP, IL-6 a TNFα (p = 0,0035) [45], nebo měření solubilních receptorů pro interleukiny (IL-2sR, IL-6sR), nebo TNFα (TNFαsR) [45-47].
Obr. 3. Asociace sérových koncentrací hsCRP a rizika nízkotraumatických zlomenin během šesti let u žen a mužů v USA, po adjustaci na věk, rasu, pohlaví, místo zlomeniny, BMD celkového prox. femuru, hmotnost, kouření, pády v posledním roce, fyzickou aktivitu, změna hmotnosti o 5 liber v posledním roce, diabetes mellitus, bronchopulmonální onemocnění, revmatoidní artritidu, artrózu, iktus, a užívání glukokortikoidů, statinů, thiazidových diuretik, NSAIDS, estrogenů, antiosteoporotických léků, přípravků vápníku a vitaminu D. 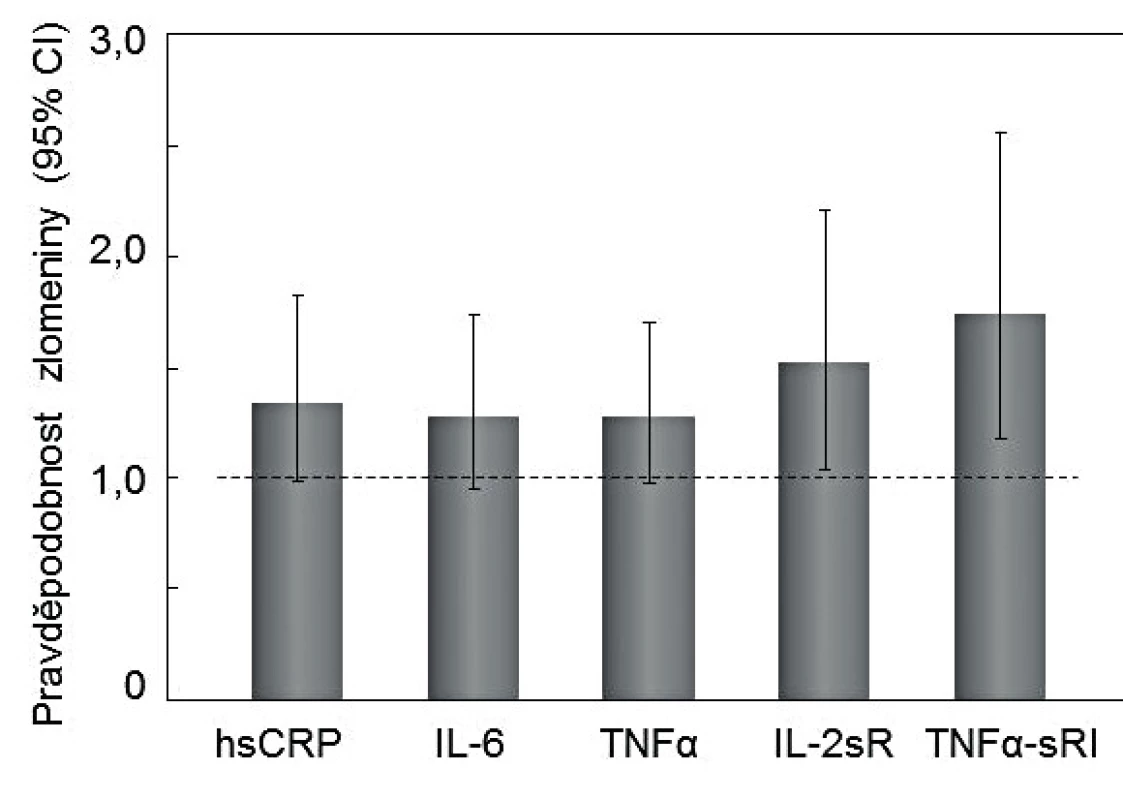
Upraveno podle [45]. Interpretace zvýšených hodnot hsCRP v populačních studiích
Reaktanty akutní fáze a zejména hodnoty hsCRP citlivě vypovídají o uvolnění IL-1 a TNFα z místa zánětu a následné zvýšené tvorbě IL-6. Prozánětlivé cytokiny po navázání na své receptory stimulují expresi RANKL v osteoblastech a osteocytech a přímo zvyšují osteoresorpci [48]. Prozánětlivé cytokiny, jako např. TNFα, však také tlumí osteoblastickou novotvorbu kosti zvýšením exprese DKK1. Navíc, remodelace kosti je regulována také nepřímo mechanickými podněty a řadou endokrinních a imunitních mechanismů [49]. Při zánětlivém procesu se mohou interakce mezi kostní hmotou a imunitním systémem projevit výrazněji, než při deficitu sexagenů, hyperkortizolismu nebo při stárnutí [50, 51]. Jak zvýšení osteoresorpce, tak snížení novotvorby kosti navozují zhoršení kvality a snížení množství kostní hmoty. Výrazem toho je průkazná asociace mezi hodnotami hsCRP a mikroarchitekturou kosti (ukazatelem kvality kostní hmoty) v populačních studiích. V prospektivní studii u 1 872 amerických žen byly údaje o délce a šířce krčku femuru získané při osteodenzitometrii použity k výpočtu kombinovaného indexu pevnosti krčku femuru. Hodnota tohoto indexu (na rozdíl od BMD) významně zvyšovala výpověď CRP o riziku zlomenin [44]. Potvrzuje se tak potřeba doplnit výpovědní hodnotu samotného měření BMD pro predikci rizika zlomenin dalšími rizikovými faktory. Ověřeným ukazatelem pevnosti kosti je mikroarchitektura trámčité kosti. Ta byla v jedné ze studií hodnocena pomocí hr-pQCT distálního radiu a tibie. V této prospektivní populační studii u francouzských mužů ve věku 19–87 let (731 mužů ve věku < 72 let, průměr 54 let a 417 mužů ve věku ≥ 72 let, průměr 78 let) nebyla zjištěna významná asociace mezi hsCRP a BMD, ani mezi biochemickými markery remodelace kosti a hsCRP, a až do věku 72 let ani asociace mezi hsCRP a mikroarchitekturou kosti. Nicméně muži starší 72 let, kteří měli zvýšenou hodnotou hsCRP (> 5 mg/l), měli významně nižší počet a denzitu trámců a vyšší separaci a heterogenitou distribuce trámců distálního radiu, než muži s hsCRP < 5 mg/l. Při hodnotách hsCRP v horním kvartilu (> 3,69 mg/l) byly uvedené ukazatele mikroarchitektury trámčité kosti významně zhoršené v porovnání se stavem při hsCRP ve třech nižších kvartilech. Muži s hsCRP > 5 mg/l měli v porovnání s muži s hsCRP < 1 mg/l vyšší prevalenci zlomenin (2,22, 95% CI 1,29–3,82) [52].
Vzhledem k rozdílným charakteristikám populací nejsou ve většině populačních studií jednoznačně průkazné asociace hsCRP s denzitou kostního minerálu (BMD). Ve studii u zdravých korejských žen se uvádí statisticky významná pravděpodobnost snížené kostní hmoty (osteopenie nebo osteoporózy) až při hodnotách hsCRP v horním kvantilu referenčních mezí stanovení tohoto markeru [53]. U 168 mužů a žen z běžné populace v Tasmánii byla inverzní asociace mezi hodnotu hsCRP a celotělovou hodnotu BMD (nikoli však BMD páteře nebo kyčle) [54]. Také u 5 261 mužů a 5 214 žen z National Health and Nutrition Examination Survey (NHANES) byla zjištěna inverzní asociace mezi hodnotu hsCRP a celotělovou hodnotu BMD [55]. V dalších populačních studiích však po adjustaci na další proměnné nebyla asociace mezi hodnotami hsCRP a denzitou kostního minerálu (BMD) v bederní páteři a prox. femuru průkazná [8, 40, 42, 44, 56, 57].
Ani asociace mezi hodnotami hsCRP a biochemickými markery remodelace kosti nebyla v populačních studiích jednoznačně prokázána. Ve studiích nebyly hodnoceny markery kostní novotvorby kosti, a pozornost byla věnována primárně markerům osteoresorpce. U 39 zdravých žen před menopauzou a 150 žen po menopauze byla pozitivní asociace mezi hsCRP a hodnotami markeru osteoresorpce (močového N-terminálního telopeptidu kolagenu typu I, U-NTx). U žen s hsCRP v nejvyšším kvartilu (≥ 1,6 mg/l) byly hodnoty U-NTx po adjustaci na věk, BMI a dobu po menopauze významně vyšší v porovnání se ženami s hsCRP v nejnižším kvartilu (≤ 0,6 mg/l) (p = 0,001) [56]. Naopak v populační studii u 919 italských žen a mužů (věk 40–79 let) byly hodnoty hsCRP významně negativně asociovány se sérovými koncentracemi βCTX a osteokalcinu u osob s hodnotami hsCRP < 7,5 mg/l (p < 0,001), zatímco při vyšších hodnotách CRP byly tyto asociace pozitivní (p = 0,03) [39].
Asociaci mezi hodnotami hsCRP a vyšším rizikem nízkotraumatických zlomenin v běžné populaci žen a mužů tady dokazují jen některé studie. Spolehlivější informace byla očekávána od metaanalýzy. Metaanalýza šesti prospektivních studií sice prokázala, že každé zvýšení hodnoty hsCRP o 1 mg/l je asociováno se zvýšením rizika zlomenin o 17 %, a že osoby s hsCRP v horním tertilu mají riziko nové zlomeniny významně vyšší, než osoby s hsCRP v dolním tertilu (2,14, 95% CI 1,51–3,05), ale tato metaanalýza nezahrnula dvě další studie s odlišnými výsledky [58]. Kauzální vztah mezi hsCRP a zvýšeným rizikem zlomeniny kyčle konečně nepotvrdila ani genetická randomizační analýza, užitá u prospektivní populační studie u 6 386 holandských žen a mužů ve věku průměrně 69 let, sledovaných po dobu průměrně 11,6 let, přestože v této studii byly hodnoty hsCRP asociovány se zvýšeným rizikem zlomeniny kyčle (1,09, 95% CI 1,02–1,17) i obratlů (1,34, 95% CI 1,14–1,58) [59].
Na asociaci mezi hsCRP a zvýšeným rizikem zlomenin by se tedy mohly podílet další, v dosavadních studiích neověřované faktory. Významným a dosud málo zvažovaným faktorem je stav svalové hmoty. Mezi poklesem svalové a kostní hmoty s věkem je u mužů i u žen úzká závislost [60]. Na interakci metabolismu kosti a svalu se uplatňují genetické faktory, vlivy prostředí v časném vývoji, fyzická aktivita (mechanostat) a endokrinní vlivy, ale také faktory tvořené kostí a ovlivňující metabolismus svalu a naopak faktory tvořené svalem a ovlivňující metabolismus kostní hmoty [61]. Pomocí vysokorozlišující periferní QCT byla prokázána významná pozitivní korelace mezi svalovou hmotou těla a objemem a tloušťkou kostních trámců a mezi svalovou hmotou těla a tloušťkou kortikální kostní hmoty [62]. Zlomenina je multifaktoriální děj, na kterém se může podílet nejenom zhoršení množství a kvality kostní hmoty, ale také rizikové faktory pádů. S věkem klesá nejenom množství kostní hmoty a zhoršuje se její kvalita, ale paralelně s tím klesá množství hmoty kosterního svalstva a zhoršuje se fyzická výkonnost [63–65]. Chronický pokles svalové hmoty se uvádí u 5–13 % osob ve věku 60–70 let, a u poloviny všech osob starších 80 let [66, 67]. Pokles svalové síly, zejména dolních končetin, je nezávislým faktorem rizika pádů [68]. Pokles svalové síly kvadricepsu je nezávislým prediktorem rizika zlomenin u mužů [69]. Biologický mechanismus zodpovědný za pokles hmoty kosterních svalů v závislosti na věku není znám. Jedna z hypotéz uvádí tento pokles v asociaci se systémovým chronickým zánětem [70–75]. Souhlasí s tím také zjištění, že ukazatele zánětu jsou nižší u fyzicky aktivních osob [76–79]. Také experimentální studie prokázaly, že rychlost proliferace myoblastů z m. vastus lateralis je významně negativně asociována s hodnotou CRP v kultivačním mediu [78], ale nikoli s věkem donora séra [80, 81]. Hodnoty CRP jsou tedy asociovány nejenom s poklesem množství kostní hmoty, ale také s poklesem hmoty kosterního svalstva.
Přestože je klinická výpověď hsCRP o riziku netraumatických klinických zlomenin srovnatelná s výpovědí měření IL-1, IL-6,a TFNα, nemusí být hsCRP pouze zástupným ukazatelem zánětlivého procesu, biomarkerem, ale může být přímým mediátorem patofyziologických procesů. Dokladem toho jsou experimentální zjištění, že CRP také může tlumit zánětlivou odpověď [82, 83]. Naopak prozánětlivé účinky CRP umožňuje jeho interakce s jeho ligandy (fosforylcholin). CRP se váže na apoptotické a nekrotické buňky [84], zvyšuje tvorbu prozánětlivých cytokinů a může aktivovat signální cestu NF-κB [85]. Otázka, zda a v jakém stupni zánět (CRP) ovlivňuje metabolické interakce mezi kostí a svalem (a naopak) zatím nebyla řešena.
Závěr
Syndrom zlomenin (osteoporóza) je závažným zdravotním a sociálním problémem stárnoucí populace většiny evropských zemí. V České republice trpí osteoporózou kolem 21 % žen a 6 % mužů starších 50 let [86]. Osteoporóza, tedy pokles množství a zhoršování kvality kostní hmoty, má dvě hlavní příčiny. Především to je snižování novotvorby kostní hmoty s věkem (involuční osteoporóza). Druhou příčinou osteoporózy a vyššího rizika nízkotraumatických zlomenin mohou být v kterémkoli věku sekundární příčiny zrychleného úbytku kostní hmoty, jako je snížená tvorba estrogenů, hyperkortisolismus, hypertyreóza, hyperparatyreóza, nežádoucí účinky některých léků a velmi často chronická zánětlivá onemocnění. I v populačních studiích se s věkem zvyšuje hodnota CRP jako výraz s věkem se zvyšující produkce TNFα, který mj. upreguluje produkci reaktivních metabolitů kyslíku (ROS) a následně zvyšuje endogenní produkci glukokortikoidů [87, 88], navozuje apoptózu osteoblastů a osteocytů a navozuje proliferaci T-buněk a diferenciaci osteoklastů [89–91]. Dosavadní výsledky klinických studií potvrzují, že hsCRP lze považovat za jeden z významných klinických faktorů rizika zlomenin.
Při vyšetření pacientů s osteoporózou má proto stanovení a interpretace hodnot hsCRP klinický význam nejen v ordinaci revmatologa a specialistů, ale zejména v ordinaci praktického lékaře. Klinická výpověď hsCRP o riziku netraumatických klinických zlomenin je srovnatelná s výpovědí měření IL–1, IL–6 a TFNα. Stanovení hsCRP může včas identifikovat pacienty s chronickým zánětlivým onemocněním, které je sekundární příčinou úbytku kostní hmoty. Při nálezu zvýšené hodnoty hsCRP je vhodné ověřit BMD bederní páteře a prox. femuru metodou DXA a stupeň remodelace kostní hmoty. Ani u pacientů s dokumentovaným chronickým zánětlivým onemocněním, ani u jinak zdravých osob v běžné populaci však není zvýšení hsCRP důvodem k zahájení antiosteoporotické léčby. První volbou je včasná diagnostika chronického zánětlivého onemocnění, jehož včasná léčba pak může předejít závažným zlomeninám a s nimi spojeného zhoršení kvality života pacientů [38, 92]. Současně je třeba zajišťovat opatření vedoucí ke zlepšení hmoty kosterního svalstva a svalové síly, protože u fyzicky aktivních osob jsou nižší ukazatele zánětu [79] a zlepšuje se svalová koordinace a snižují rizika pádů [93].
Práce byla podpořena projektem Ministerstva zdravotnictví v rámci koncepčního rozvoje výzkumné organizace 00023728 (Revmatologický ústav).
Prohlášení ke konfliktu zájmů. Autor prohlašuje, že text práce nevznikl za žádné komerční nebo finanční podpory nebo spolupráce, která by mohla být považována za potenciální konflikt zájmu.
Adresa pro korespondenci:
Prof. MUDr. Jan Štěpán, DrSc.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e–mail: stepan@revma.cz
Zdroje
1. Gabay C, Kushner I. Acute-phase proteins and other systemic responses to inflammation. N Engl J Med 1999; 340(6): 448–54.
2. Weinhold B, Ruther U. Interleukin-6-dependent and -independent regulation of the human C-reactive protein gene. Biochem J 1997; 327 (Pt 2): 425–9.
3. Yoshida N, Ikemoto S, Narita K, et al. Interleukin–6, tumour necrosis factor alpha and interleukin-1beta in patients with renal cell carcinoma. Br J Cancer 2002; 86(9): 1396–400.
4. Jain S, Gautam V, Naseem S. Acute–phase proteins: As diagnostic tool. Journal of pharmacy & bioallied sciences 2011; 3(1): 118–27.
5. Watson J, Round A, Hamilton W. Raised inflammatory markers. BMJ 2012; 344: e454.
6. Chenillot O, Henny J, Steinmetz J, et al. High sensitivity C-reactive protein: biological variations and reference limits. Clin Chem Lab Med 2000; 38(10): 1003–11.
7. Herbeth B, Siest G, Henny J. High sensitivity C-reactive protein (CRP) reference intervals in the elderly. Clin Chem Lab Med 2001; 39(11): 1169–70.
8. Nakamura K, Saito T, Kobayashi R, et al. C-reactive protein predicts incident fracture in community–dwelling elderly Japanese women: the Muramatsu study. Osteoporos Int 2011; 22(7): 2145–50.
9. Harris TB, Ferrucci L, Tracy RP, et al. Associations of elevated interleukin-6 and C-reactive protein levels with mortality in the elderly. Am J Med 1999; 106(5): 506–12.
10. Ferrucci L, Guralnik JM. Inflammation, hormones, and body composition at a crossroad. Am J Med 2003; 115(6): 501–2.
11. Weaver JD, Huang MH, Albert M, et al. Interleukin–6 and risk of cognitive decline: MacArthur studies of successful aging. Neurology 2002; 59(3): 371–8.
12. McGeer PL, McGeer EG. Inflammation, autotoxicity and Alzheimer disease. Neurobiol Aging 2001; 22(6): 799–809.
13. Kritchevsky SB, Cesari M, Pahor M. Inflammatory markers and cardiovascular health in older adults. Cardiovasc Res 2005; 66(2): 265–75.
14. Giovannini S, Onder G, Liperoti R, et al. Interleukin-6, C-reactive protein, and tumor necrosis factor–alpha as predictors of mortality in frail, community-living elderly individuals. J Am Geriatr Soc 2011; 59(9): 1679–85.
15. Pearson TA, Mensah GA, Alexander RW, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: A statement for healthcare professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation 2003; 107(3): 499–511.
16. Hradec J. Farmakologické ovlivnění hladiny C-reaktivního proteinu a jeho souvislost s kardiovaskulárním rizikem. Remedia 2009; 19(2): 158–62.
17. Calder PC. n-3 polyunsaturated fatty acids and cytokine production in health and disease. Ann Nutr Metab 1997; 41(4): 203–34.
18. Heller A, Koch T, Schmeck J, et al. Lipid mediators in inflammatory disorders. Drugs 1998; 55(4): 487–96.
19. Stephensen CB. Burden of infection on growth failure. J Nutr 1999; 129(2S Suppl): 534S–8S.
20. Orstavik RE, Haugeberg G, Uhlig T, et al. Incidence of vertebral deformities in 255 female rheumatoid arthritis patients measured by morphometric X-ray absorptiometry. Osteoporos Int 2005; 16(1): 35–42.
21. Huusko TM, Korpela M, Karppi P, et al. Threefold increased risk of hip fractures with rheumatoid arthritis in Central Finland. Ann Rheum Dis 2001; 60(5): 521–2.
22. Walsh NC, Crotti TN, Goldring SR, et al. Rheumatic diseases: the effects of inflammation on bone. Immunol Rev 2005; 208 : 228–51.
23. Spector TD, Hall GM, McCloskey EV, et al. Risk of vertebral fracture in women with rheumatoid arthritis. BMJ 1993; 306(6877): 558.
24. van Staa TP, Geusens P, Bijlsma JW, et al. Clinical assessment of the long–term risk of fracture in patients with rheumatoid arthritis. Arthritis Rheum 2006; 54(10): 3104–12.
25. Ghozlani I, Ghazi M, Nouijai A, et al. Prevalence and risk factors of osteoporosis and vertebral fractures in patients with ankylosing spondylitis. Bone 2009; 44(5): 772–6.
26. Lange U, Kluge A, Strunk J, et al. Ankylosing spondylitis and bone mineral density––what is the ideal tool for measurement? Rheumatol Int 2005; 26(2): 115–20.
27. Feldtkeller E, Vosse D, Geusens P, et al. Prevalence and annual incidence of vertebral fractures in patients with ankylosing spondylitis. Rheumatol Int 2006; 26(3): 234–9.
28. Vosse D, Landewe R, van der Heijde D, et al. Ankylosing spondylitis and the risk of fracture: results from a large primary care–based nested case–control study. Ann Rheum Dis 2009; 68(12): 1839–42.
29. Gilboe IM, Kvien TK, Haugeberg G, et al. Bone mineral density in systemic lupus erythematosus: comparison with rheumatoid arthritis and healthy controls. Ann Rheum Dis 2000; 59(2): 110–5.
30. Vrieze A, de Greef MH, Wijkstra PJ, et al. Low bone mineral density in COPD patients related to worse lung function, low weight and decreased fat-free mass. Osteoporos Int 2007; 18(9): 1197–202.
31. Graat–Verboom L, van den Borne BE, Smeenk FW, et al. Osteoporosis in COPD outpatients based on bone mineral density and vertebral fractures. J Bone Miner Res 2011; 26(3): 561–8.
32. Biskobing DM. COPD and osteoporosis. Chest 2002; 121(2): 609–20.
33. Jaramillo JD, Wilson C, Stinson DS, et al. Reduced bone density and vertebral fractures in smokers. Men and COPD patients at increased risk. Ann Am Thorac Soc 2015; 12(5): 648–56.
34. Romme EA, Murchison JT, Edwards LD, et al. CT–measured bone attenuation in patients with chronic obstructive pulmonary disease: relation to clinical features and outcomes. J Bone Miner Res 2013; 28(6):1369–77.
35. Larussa T, Suraci E, Nazionale I, et al. Bone mineralization in celiac disease. Gastroenterol Res Pract 2012; 2012 : 198025.
36. Zanchetta MB, Longobardi V, Bai JC. Bone and celiac disease. Curr Osteoporos Rep 2016; 14(2): 43–8.
37. Bernstein CN, Blanchard JF, Leslie W, et al. The incidence of fracture among patients with inflammatory bowel disease. A population-based cohort study. Ann Intern Med 2000; 133(10): 795–9.
38. Haugeberg G, Conaghan PG, Quinn M, et al. Bone loss in patients with active early rheumatoid arthritis: infliximab and methotrexate compared with methotrexate treatment alone. Explorative analysis from a 12-month randomised, double-blind, placebo–controlled study. Ann Rheum Dis 2009; 68(12): 1898–901.
39. Schett G, Kiechl S, Weger S, et al. High–sensitivity C-reactive protein and risk of nontraumatic fractures in the Bruneck study. Arch Intern Med 2006; 166(22): 2495–501.
40. Eriksson AL, Moverare–Skrtic S, Ljunggren O, et al. High-sensitivity CRP is an independent risk factor for all fractures and vertebral fractures in elderly men: the MrOS Sweden study. J Bone Miner Res 2014; 29(2): 418–23.
41. Berglundh S, Malmgren L, Luthman H, et al. C–reactive protein, bone loss, fracture, and mortality in elderly women: a longitudinal study in the OPRA cohort. Osteoporos Int 2015; 26(2): 727–35.
42. Pasco JA, Kotowicz MA, Henry MJ, et al. High–sensitivity C–reactive protein and fracture risk in elderly women. JAMA 2006; 296(11): 1353–5.
43. Ahmadi–Abhari S, Luben RN, Wareham NJ, et al. C-reactive protein and fracture risk: European prospective investigation into Cancer Norfolk Study. Bone 2013; 56(1): 67–72.
44. Ishii S, Cauley JA, Greendale GA, et al. C-reactive protein, bone strength, and nine–year fracture risk: data from the Study of Women’s Health Across the Nation (SWAN). J Bone Miner Res 2013; 28(7): 1688–98.
45. Cauley JA, Danielson ME, Boudreau RM, et al. Inflammatory markers and incident fracture risk in older men and women: the health aging and body composition study. J Bone Miner Res 2007; 22(7): 1088–95.
46. Barbour KE, Boudreau R, Danielson ME, et al. Inflammatory markers and the risk of hip fracture: the Women’s Health Initiative. J Bone Miner Res 2012; 27(5): 1167–76.
47. Barbour KE, Lui LY, Ensrud KE, et al. Inflammatory markers and risk of hip fracture in older white women: the study of osteoporotic fractures. J Bone Miner Res 2014; 29(9): 2057–64.
48. Agrawal M, Arora S, Li J, et al. Bone, inflammation, and inflammatory bowel disease. Curr Osteoporos Rep 2011; 9(4): 251–7.
49. Hardy R, Cooper MS. Bone loss in inflammatory disorders. J Endocrinol 2009; 201(3): 309–20.
50. Pacifici R. The immune system and bone. Arch Biochem Biophys 2010; 503(1): 41–53.
51. Li JY, Tawfeek H, Bedi B, et al. Ovariectomy disregulates osteoblast and osteoclast formation through the T-cell receptor CD40 ligand. Proc Natl Acad Sci U S A 2011; 108(2): 768–73.
52. Rolland T, Boutroy S, Vilayphiou N, et al. Poor trabecular microarchitecture at the distal radius in older men with increased concentration of high–sensitivity C-reactive protein - the STRAMBO study. Calcif Tissue Int 2012; 90(6): 496–506.
53. Koh JM, Khang YH, Jung CH, et al. Higher circulating hsCRP levels are associated with lower bone mineral density in healthy pre – and postmenopausal women: evidence for a link between systemic inflammation and osteoporosis. Osteoporos Int 2005; 16(10):1263–71.
54. Ding C, Parameswaran V, Udayan R, et al. Circulating levels of inflammatory markers predict change in bone mineral density and resorption in older adults: a longitudinal study. J Clin Endocrinol Metab 2008; 93(5): 1952–8.
55. de Pablo P, Cooper MS, Buckley CD. Association between bone mineral density and C-reactive protein in a large population–based sample. Arthritis Rheum 2012; 64(8): 2624–31.
56. Kim BJ, Yu YM, Kim EN, et al. Relationship between serum hsCRP concentration and biochemical bone turnover markers in healthy pre - and postmenopausal women. Clin Endocrinol (Oxf) 2007; 67(1): 152–8.
57. Ganesan K, Teklehaimanot S, Tran TH, et al. Relationship of C-reactive protein and bone mineral density in community–dwelling elderly females. J Natl Med Assoc 2005; 97(3): 329–33.
58. Wu ZJ, He JL, Wei RQ, et al. C-reactive protein and risk of fracture: a systematic review and dose–response meta–analysis of prospective cohort studies. Osteoporos Int 2015; 26(1): 49–57.
59. Oei L, Campos-Obando N, Dehghan A, et al. Dissecting the relationship between high–sensitivity serum C-reactive protein and increased fracture risk: the Rotterdam Study. Osteoporos Int 2014; 25(4): 1247–54.
60. Ferretti JL, Capozza RF, Cointry GR, et al. Gender-related differences in the relationship between densitometric values of whole-body bone mineral content and lean body mass in humans between 2 and 87 years of age. Bone 1998; 22(6): 683–90.
61. Edwards MH, Dennison EM, Aihie Sayer A, et al. Osteoporosis and sarcopenia in older age. Bone 2015; 80 : 126–30.
62. Madeira E, Mafort TT, Madeira M, et al. Lean mass as a predictor of bone density and microarchitecture in adult obese individuals with metabolic syndrome. Bone 2013; 59 : 89–92.
63. Novotny SA, Warren GL, Hamrick MW. Aging and the muscle–bone relationship. Physiology (Bethesda) 2015; 30(1): 8–16.
64. Frost M, Nielsen TL, Brixen K, et al. Peak muscle mass in young men and sarcopenia in the ageing male. Osteoporos Int 2015; 26(2): 749–56.
65. Rezaei A, Dragomir–Daescu D. Femoral strength changes faster with age than BMD in both women and Men: A biomechanical study. J Bone Miner Res 2015; 30(12): 2200–6.
66. Morley JE. Sarcopenia: diagnosis and treatment. J Nutr Health Aging 2008; 12(7): 452–6.
67. Cruz–Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People. Age Ageing 2010; 39(4): 412–23.
68. Moreland JD, Richardson JA, Goldsmith CH, et al. Muscle weakness and falls in older adults: a systematic review and meta–analysis. J Am Geriatr Soc 2004; 52(7): 1121–9.
69. Pham HM, Nguyen ND, Center JR, et al. Contribution of quadriceps weakness to fragility fracture: A prospective study. J Bone Miner Res 2016; 31(1): 208–14.
70. Franceschi C, Bonafe M, Valensin S, et al. Inflamm-aging. An evolutionary perspective on immunosenescence. Ann N Y Acad Sci 2000; 908 : 244–54.
71. Giunta S. Exploring the complex relations between inflammation and aging (inflammaging): anti-inflamm-aging remodelling of inflamm - aging, from robustness to frailty. Inflamm Res 2008; 57(12): 558–63.
72. Cesari M, Kritchevsky SB, Baumgartner RN, et al. Sarcopenia, obesity, and inflammation––results from the Trial of Angiotensin Converting Enzyme Inhibition and Novel Cardiovascular Risk Factors study. Am J Clin Nutr 2005; 82(2): 428–34.
73. Hamer M, Molloy GJ. Association of C-reactive protein and muscle strength in the English Longitudinal Study of Ageing. Age (Dordr) 2009; 31(3): 171–7.
74. Schaap LA, Pluijm SM, Deeg DJ, et al. Higher inflammatory marker levels in older persons: associations with 5-year change in muscle mass and muscle strength. J Gerontol A Biol Sci Med Sci 2009; 64(11): 1183–9.
75. Visser M, Pahor M, Taaffe DR, et al. Relationship of interleukin–6 and tumor necrosis factor–alpha with muscle mass and muscle strength in elderly men and women: the Health ABC Study. J Gerontol A Biol Sci Med Sci 2002; 57(5): M326–32.
76. Geffken DF, Cushman M, Burke GL, et al. Association between physical activity and markers of inflammation in a healthy elderly population. Am J Epidemiol 2001; 153(3): 242–50.
77. Shanely RA, Nieman DC, Henson DA, et al. Inflammation and oxidative stress are lower in physically fit and active adults. Scand J Med Sci Sports 2013; 23(2): 215–23.
78. Wahlin-Larsson B, Carnac G, Kadi F. The influence of systemic inflammation on skeletal muscle in physically active elderly women. Age (Dordr) 2014; 36(5): 9718.
79. Colbert LH, Visser M, Simonsick EM, et al. Physical activity, exercise, and inflammatory markers in older adults: findings from the Health, Aging and Body Composition Study. J Am Geriatr Soc 2004; 52(7): 1098–104.
80. Alsharidah M, Lazarus NR, George TE, et al. Primary human muscle precursor cells obtained from young and old donors produce similar proliferative, differentiation and senescent profiles in culture. Aging Cell 2013; 12(3): 333–44.
81. George T, Velloso CP, Alsharidah M, et al. Sera from young and older humans equally sustain proliferation and differentiation of human myoblasts. Exp Gerontol 2010; 45(11): 875–81.
82. Zhong W, Zen Q, Tebo J, et al. Effect of human C-reactive protein on chemokine and chemotactic factor–induced neutrophil chemotaxis and signaling. J Immunol 1998; 161(5): 2533–40.
83. Rodriguez W, Mold C, Kataranovski M, et al. C-reactive protein–mediated suppression of nephrotoxic nephritis: role of macrophages, complement, and Fcgamma receptors. J Immunol 2007; 178(1): 530–8.
84. Gershov D, Kim S, Brot N, et al. C-Reactive protein binds to apoptotic cells, protects the cells from assembly of the terminal complement components, and sustains an antiinflammatory innate immune response: implications for systemic autoimmunity. J Exp Med 2000; 192(9): 1353–64.
85. Liang YJ, Shyu KG, Wang BW, et al. C-reactive protein activates the nuclear factor-kappaB pathway and induces vascular cell adhesion molecule-1 expression through CD32 in human umbilical vein endothelial cells and aortic endothelial cells. J Mol Cell Cardiol 2006; 40(3): 412–20.
86. Svedbom A, Hernlund E, Ivergård M, et al. Osteoporosis in the European Union: a compendium of country-specific reports. Arch Osteoporos 2013; 8(137): 35–42.
87. Wilkinson CW, Petrie EC, Murray SR, et al. Human glucocorticoid feedback inhibition is reduced in older individuals: evening study. J Clin Endocrinol Metab 2001; 86(2): 545–50.
88. Reynolds RM, Dennison EM, Walker BR, et al. Cortisol secretion and rate of bone loss in a population-based cohort of elderly men and women. Calcif Tissue Int 2005; 77(3): 134–8.
89. Almeida M, Han L, Ambrogini E, et al. Glucocorticoids and tumor necrosis factor alpha increase oxidative stress and suppress Wnt protein signaling in osteoblasts. J Biol Chem 2011; 286(52): 44326–35.
90. Pathak JL, Bakker AD, Luyten FP, et al. Systemic inflammation affects human osteocyte–specific protein and cytokine expression. Calcif Tissue Int 2016; 98(6): 596–608.
91. Bertolini DR, Nedwin GE, Bringman TS, et al. Stimulation of bone resorption and inhibition of bone formation in vitro by human tumour necrosis factors. Nature 1986; 319(6053): 516–8.
92. Orsolini G, Adami G, Adami S, et al. Short-term effects of TNF inhibitors on bone turnover markers and bone mineral density in rheumatoid arthritis. Calcif Tissue Int 2016; 98(6): 580–5.
93. Shea B, Bonaiuti D, Iovine R, et al. Cochrane Review on exercise for preventing and treating osteoporosis in postmenopausal women. Eura Medicophys 2004; 40(3): 199–209.
94. Kim SY, Schneeweiss S, Liu J, et al. Risk of osteoporotic fracture in a large population-based cohort of patients with rheumatoid arthritis. Arthritis Res Ther 2010; 12(4): R154.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2016 Číslo 3- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Abstrakta satelitních sympozií
- Abstrakta sekce nelékařských zdravotnických pracovníků
- C-reaktivní protein: biomarker sekundární osteoporózy a zlomenin při chronických zánětlivých onemocněních
- Účinnost první a následné linie léčby adalimumabem u revmatoidní artritidy: analýza dat Českého národního registru ATTRA
- 60. výroční sjezd českých a slovenských revmatologů
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- C-reaktivní protein: biomarker sekundární osteoporózy a zlomenin při chronických zánětlivých onemocněních
- 60. výroční sjezd českých a slovenských revmatologů
- Účinnost první a následné linie léčby adalimumabem u revmatoidní artritidy: analýza dat Českého národního registru ATTRA
- Abstrakta sekce nelékařských zdravotnických pracovníků
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



