-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Bezpečnost biologické léčby – doporučení České revmatologické společnosti
Safety of biological therapy – Guidelines of the Czech Society for Rheumatology
In 2007, Czech Society for Rheumatology published the indications for initiation of biological therapy within the guidelines on the treatment of rheumatoid arthritis. This report follows the indication criteria, and provides an overview on safety aspects of biological therapy - most of all, the conditions for its commencement, monitoring of adverse events, and listing the reasons for its discontinuation. Particular attention is given to aspects of possible infections and malignant diseases. The issue of the detection of latent tuberculosis is discussed, and the suggestions for its detection and monitoring with up-to-date tests are given. Other situations are discussed as well, such as necessary diagnostics of hepatitis, administration of biological therapy during pregnancy and lactation, approach to biological therapy in the context of surgical intervention, and the issue of vaccination. Cardiovascular aspects are briefly mentioned as well. The necessity of long-term monitoring of all patients treated with biological therapy in a standardised way within a registry is emphasized.
Key words:
rheumatoid arthritis, anti-TNF therapy, rituximab, abatacept, tocilizumab, tuberculosis, infections, tumours
Autoři: J. Vencovský; výbor České gerontologické a geriatrické společnosti ČLS JEP *
Působiště autorů: Revmatologický ústav, Praha
Vyšlo v časopise: Čes. Revmatol., 17, 2009, No. 3, p. 146-160.
Kategorie: Doporučení k léčbě
Souhrn
Česká revmatologická společnost publikovala indikace k nasazení biologické léčby v rámci doporučení pro léčbu revmatoidní artritidy (RA) v roce 2007. Tento článek navazuje na indikační kritéria a podává přehled týkající se bezpečnostních aspektů biologické léčby. Jde především o podmínky pro její zahájení, sledování možných nežádoucích účinků a konečně uvedení důvodů pro její ukončení. Jsou zejména zmíněny aspekty možných infekcí a maligních onemocnění. Je probrána problematika detekce latentní tuberkulózy, jsou uvedeny návrhy pro její detekci a monitorování za použití moderních testů. Jsou také uvedeny zvláštní situace, jako je potřebná diagnostika hepatitidy, podání biologické léčby v těhotenství a při kojení, přístup k biologické léčbě v souvislosti s chirurgickým zákrokem a problematika vakcinace. Zmíněny jsou i aspekty kardiovaskulární problematiky. Je zdůrazněna potřeba dlouhodobého sledování všech pacientů léčených biologickou terapií standardizovaným způsobem v registru.
Klíčová slova:
revmatoidní artritida, anti-TNF terapie, rituximab, abatacept, tocilizumab, tuberkulóza, infekce, nádoryÚVOD
První doporučení k léčbě biologickými léky neutralizujícími TNF včetně sledování jejich bezpečnosti publikovala Česká revmatologická společnost v roce 2004 (1). Do té doby byla většina uveřejněných poznatků získána ze základních randomizovaných klinických studií. Pečlivé sledování rozsáhlých počtů nemocných v národních registrech pacientů, postmarketingová hlášení, četná krátkodobá či dlouhodobá klinická hodnocení a jejich metaanalýzy přinesly další údaje týkající se bezpečnosti jejich podávání. Nově se také v běžném užívání objevily další léky této skupiny s jiným mechanismem účinku a tedy i jiným spektrem možné toxicity. Indikace k podávání těchto nových biologických léků, hodnocení účinnosti a sledování efektu byly součástí doporučení k léčbě RA publikované v roce 2007 (2). Tento článek podává inovované údaje týkající se bezpečnosti podávání léků neutralizujících TNF a dále těch s jiným mechanismem účinku, které jsou v běžném používání v ČR (rituximab, abatacept), či velmi pravděpodobně v blízké budoucnosti budou (tocilizumab). Článek nenahrazuje všechny aspekty týkající se bezpečnosti vyjmenované v sumárních charakteristikách jednotlivých léků, které jsou uvedeny v příbalových dokumentacích a je potřebí se jimi řídit. Měl by sloužit především jako strategický dokument postupů v některých speciálních případech a jako shrnutí informací, které by mělo umožnit informované rozhodnutí ve variabilních situacích, pro které nelze stanovit předem jednotný návod.
BEZPEČNOST LÉČBY ANTAGONISTY TNF
Nejdůležitější potenciální rizika, která jsou asociována s anti-TNF alfa terapií, zahrnují infekce, malignity, infuzní reakce nebo reakce v místech vpichu, neurologické projevy, hematologické změny, kardiovaskulární, plicní, kožní, autoimunitní a případně další komplikace.
Infekce
Anti-TNF léčba obecně zvyšuje náchylnost k infekcím, především jsou o něco častější běžné infekční komplikace (3, 4). Méně jednoty panuje kolem vážných infekcí, které buď nejsou nijak výrazně zvýšené, pokud jsou pacienti srovnáváni s těmi, kteří berou léky modifikující průběh choroby (DMARD), nebo např. podle švédského registru jsou častější jen v prvním roce léčby (5). K podobnému závěru došlo pozorování v USA (6). Vyšší frekvenci infekcí včetně vážných, popisuje však německý registr (7). Zvýšenou incidenci vážných infekcí předkládá také metaanalýza klinických hodnocení s anti-TNF monoklonálními protilátkami (8). Jsou popisovány častější infekce v některých specifických místech – kůže, měkké tkáně, klouby. Nedávno byla prokázána vyšší frekvence herpes zoster v souvislosti s léčbou infliximabem a adalimumabem (9). Incidence infekcí se prudce zvyšuje při kombinaci biologických léků, především anti-TNF s anakinrou a abataceptem.
V poslední době bylo zdůrazněno nebezpečí infekce histoplazmózou a dalšími invazivními mykotickými infekcemi, jako jsou kokcidiomykóza a blastomykóza (10). Americká FDA (Food and Drug Administration) podotýká, že tyto infekce mohou být systémové či lokalizované a že protilátkový test na histoplazmózu může být u některých pacientů negativní, navzdory aktivní infekci. Obecně je zvýšena tendence ke granulomatózním infekcím. Vedle tuberkulózy (viz dále) a již jmenovaných mykotických infekcí jde např. o listeriózu, kandidózu, nokardiózu a infekce netuberkulózními mykobakteriemi (11, 12).
Pravděpodobně je také zvýšená frekvence reaktivace chronické infekce hepatitidou B (4, 13). Zřejmě však není zvýšená toxicita anti-TNF u nemocných s hepatitidou C, kazuisticky zde bylo dokonce popsáno zlepšení stavu (14).
Doporučení
- Anti-TNF léky se nedoporučuje podávat v případě vážnější nebo oportunní infekce, jmenovitě by neměly být podány při septické artritidě, infikované endoprotéze, akutním abscesu, osteomyelitidě, sepsi, systémové mykotické infekci a při listerióze. Léčba může být zahájena až po zhojení infekce.
- Pacienti by měli být klinicky monitorováni pro možný vývoj systémové mykotické infekce, včetně sledování teploty, únavnosti, poklesu na hmotnosti, pocení, kašle, dušnosti, plicních infiltrátů či případně dalších systémových příznaků. Pokud se prokáže tato infekce, léčba anti-TNF se přerušuje do úplného zhojení (10).
- TNF blokující látky by neměly být používány u nemocných s hepatitidou B. V případě, že se hepatitida B objeví nově během léčby, je doporučováno podání antivirové terapie. U hepatitidy C není dostatek poznatků, ale terapie je v zásadě možná, nicméně je potřebná důsledná monitorace jaterních testů a virémie během léčby.
- Před terapií anti-TNF se podobně jako před terapií methotrexatem doporučuje vyšetření na přítomnost virové hepatitidy. Podrobně je tato problematika probrána v článku Šléglové a spol. (13). Souhrnně by měly být vyšetřeny tyto testy: HBsAg, anti-HBs a anti-HBc pro posouzení přítomnosti hepatitidy B a anti-HCV pro posouzení hepatitidy C. U pacientů, kteří budou mít pozitivní HBsAg, nebo pozitivní anti-HBs + anti-HBc, nebo pozitivní anti-HBc, je nutné kompletní sérologické vyšetření (HBeAg, anti-HBe) včetně kvantitativního stanovení HBV-DNA. Kvantitativní stanovení HBV je nezbytné i k odlišení tzv. pre-core mutace viru, kde nelze užít HBeAg jako ukazatel infekčnosti (10). Velmi informativní přehled doporučuje u pacientů HBsAg negativních a anti-HBc pozitivních monitorovat HBsAg lx měsíčně a léčit lamivudinem, pokud se objeví HBsAg pozitivita (15).
U pacientů s pozitivním anti-HCV je nezbytné doplnit kvantitativní vyšetření HCV - RNA (10, 16).
Zdá se, že terapie inaktivních nosičů HBsAg je možná po preventivním podání lamivudinu (17). Ten má pak být podáván ještě 10–12 měsíců po ukončení anti-TNF léčby.
U všech pacientů chronicky infikovaných HBV či HCV virem podstupujících anti-TNF léčbu je nutné provádět pravidelně monitoraci HBV-DNA (u hepatitidy B) či HCV-RNA (u hepatitidy C) a ALT k časnému zachycení eventuální reaktivace infekce.
Tuberkulóza
Anti-TNF terapie je spojena s vyšším rizikem tuberkulózy (TBC) (18). První na tuto skutečnost upozornil Keane, který popsal 70 nemocných s TBC v souvislosti s léčbou infliximabem (19). Většina nemocných měla nejspíše reaktivaci latentní TBC, protože se vyskytla v prvních měsících léčby, s mediánem nástupu nemoci 12 týdnů. U více než 50 % případů šlo o mimoplicní TBC. TBC v souvislosti s etanerceptem popsal první Mohan, vznik onemocnění byl pozdější, s mediánem 11,5 měsíce, což odpovídá buď nově získané infekci, nebo pomalejšímu vzniku reaktivace latentní TBC (20). I zde měla nadpoloviční část nemocných (52 %) mimoplicní TBC. Mimoplicní lokalizace byly různé, např. hepatobiliární systém, kosti, CNS a další.
Přibývá důkazů o tom, že častěji je TBC spjata s monoklonálními protilátkami, než s etanerceptem (21, 22). Nejčastěji uváděné hodnoty výskytu jsou 54/100 000 začátků léčby s infliximabem a 28/100 000 začátků léčby s etanerceptem (11, 23), což je asi 8x a 4x více, než v běžné populaci. Jednotlivé statistiky se dost liší, určitý přehled podává recentní publikace (24). U adalimumabu byl před zavedením opatření na prevenci TBC počet udán 1300/100 000 paciento-roků (p-r), po zavedení prevence pak 330/100 000 p-r v Evropě a 80/100 000 p-r v USA (25).
Od doby zahájení preventivních opatření se frekvence TBC v souvislosti s léčbou anti-TNF preparáty většinou výrazně snížila. Jako modelový příklad se uvádí zkušenost ze Španělska, kde podrobná anamnéza, RTG plic, opakovaný test Mantoux a terapie INH v indikovaných případech před začátkem anti-TNF terapie vedly ke snížení výskytu TBC o 83 % (26–28). Při analýze vzniklých případů TBC se často ukázalo, že většina těch, kdo dostali TBC, neměla proveden opakovaný Mantoux II test, ač podle lokálních doporučení mít měla (29). Nicméně, TBC se objeví i tam, kde byli pacienti pečlivě vyšetřeni na latentní TBC, jak se ukázalo např. v klinickém hodnocení START nebo v analýze případů TBC v USA (30, 31). Recentní analýza z francouzského registru u pacientů léčených mezi roky 2004 až 2007 (tedy již v době prováděného skríninku na TBC) ukazuje incidenci TBC 116,7/100 000 p-r, přičemž pro adalimumab byla roční incidence TBC spočítána na 215/100 000, pro infliximab 187,5/100 000 a pro etanercept 9,3/100 000 (22). Tyto údaje naznačují, že skrínink nedokáže vždy efektivně identifikovat pacienty s rizikem TBC, poněvadž u 67 % nemocných, kteří vyvinuli TBC a měli proveden tuberkulinový test, byl tento test pod 5 mm (21, 22). Falešně negativní tuberkulinový test může být důsledkem předcházející imunosupresivní léčby (32). Pacienti, kteří obdrží preventivní terapii INH však téměř nikdy TBC nevyvinou (33). Délka doporučení ohledně podávání INH se liší, v USA a některých evropských zemích je to 9 měsíců, v České republice či např. ve Velké Británii 6 měsíců. Zajímavé ovšem je to, že přehledná publikace zhodnocující provedené studie (34) považuje 6měsíční podávání INH za nedostatečné a doporučuje 9–10měsíční podání.
Zvýšená frekvence infekce TBC v souvislosti s anti-TNF léčbou si vynutila přísnou kontrolu pacientů, kteří mají takovou léčbu dostat. Existují lokální doporučení v různých zemích, která se od sebe více či méně liší, ale prakticky vždy je vyžadován tuberkulinový test, rtg hrudníku, podrobná anamnéza směrem k prodělanému tuberkulóznímu onemocnění, jeho léčbě, kontaktu, včetně kontaktu s TBC v minulosti, původu či pobytu v endemické oblasti. Kožní test s tuberkulinem nevyžadují např. doporučení ve Velké Británii (35). Vycházejí z názoru, že jeho vypovídací schopnost u imunosuprimovaných nemocných je nízká a spíše kalkulují riziko vzniku TBC podle individuální situace nemocného v závislosti na jeho původu a možnosti nákazy TBC v minulosti. Protože riziko závažného jaterního poškození v souvislosti s léčbou izoniazidem [definováno jako hepatitida stupně 3 (5–20násobné zvýšení aminotransferáz nad horní hranici), nebo stupně 4 (více jak 20násobné zvýšení aminotransferáz)] se udává v průměru jako 278/100 000 nemocných, kalkulují, co převáží, zda riziko TBC či riziko hepatitidy po INH, a podle těchto údajů doporučují nebo nedoporučují preventivní terapii. Řada doporučení nebere v úvahu předchozí BCG vakcinaci a považuje velikost indurace v tuberkulinovém testu 5 mm a více jako pozitivní, protože se domnívá, že po více letech je efekt BCG vakcinace na pozitivitu tohoto testu již malý a je zvažován také tlumící příspěvek glukokortikoidní a imunosupresivní léčby. V populaci našich nemocných, kteří byli kandidáti na biologickou léčbu v posledních 2 letech, byl test Mantoux II 5 mm a více přítomen v 39 % a 15 mm a více v 11 %, v čemž zřejmě BCG vakcinace roli hraje, takže se domníváme, že tento fakt nelze zcela pominout.
V poslední době se uplatňuje stanovení odpovídavosti T lymfocytů na specifické tuberkulózní antigeny v in vitro testech (36, 37). Nejrozšířenější je test QuantiFERON TB-Gold (QFT) či test ELISPOT (38). Oba testy měří uvolnění interferonu gama (IFNγ) T lymfocyty po krátkodobé inkubaci (maximálně 24 hodin) se specifickými antigeny získanými z mycobacterium tuberculosis (MT). Krátkodobá inkubace vede k tomu, že stimulovány jsou zřejmě pouze cirkulující výkonné paměťové buňky, které pokud reagují pozitivně, jsou pravděpodobným indikátorem významnější latentní nebo aktivní TBC (39). Ke srovnání slouží sekrece IFNγ produkovaného lymfocyty bez stimulace nebo po stimulaci nespecifickým mitogenem. Pokud T lymfocyty po stimulaci antigeny MT vytvoří vyšší množství IFNγ, slouží test jako důkaz jejich předchozí senzibilizace antigeny MT v těle a tedy průkaz latentní tuberkulózní infekce (LTBI). Test může mít neurčitý výsledek, pokud je již z nějakého důvodu spontánní produkce vysoká, nebo naopak ani silný impulz nespecifickým syntetickým mitogenem nedokáže vyvolat sekreci IFNγ. To se výjimečně může stát problémem, jak bylo publikováno z USA u pacientů s RA (40), nicméně většina zkušeností, včetně našich (41), ukazuje na akceptovatelnou frekvenci neurčitých výsledků. Porovnání a užitečnost testů Quantiferon či Elispot s tuberkulinovým testem probíhá. Řada údajů naznačuje, že testy měřící produkci IFNγ jsou specifičtější a asi i senzitivnější než kožní test s tuberkulinem, a to zejména u imunosuprimovaných pacientů (38, 42–44). V našich podmínkách, kde prakticky všichni jsou vakcinováni pomocí BCG, je test přínosný, protože není touto vakcinací ovlivněn.
Doporučení
Sekce pro tuberkulózu České pulmonologické a ftizeologické společnosti publikovala zápis z jednání v roce 2005, kde navrhla postup na detekci latentní tuberkulózy, zejména se zřetelem k možné biologické léčbě (http://www.pneumologie.cz/zapisy/2005/sekce-TBC-20051201.php). Tento zápis byl pak diskutován a nepatrně pozměněn. Sekce doporučuje, aby každý nemocný byl před zahájením biologické léčby vyšetřen pneumologem za účelem vyloučení latentní TBC infekce, inaktivní nebo aktivní tuberkulózy. Pneumolog pak postupuje podle návodu, který udává souhrnně tabulka 1. Tato doporučení měla být uvedena do praxe ve všech centrech biologické léčby. V průběhu 3–4 let jejich používání se ukázalo, že se jedná o doporučení, která jsou ovšem v denní běžné rutině obtížně realizovatelná. V dotazníkové akci organizované Českou revmatologickou společností v centrech biologické léčby odpověděla jen 3 centra ze 17, že pneumolog si automaticky zve pacienty na kontroly každé 3 měsíce, tedy v souhlase s publikovaným zápisem (tab. 1). Jen 1 pracoviště provádí kontroly Quantiferonu každé 3 měsíce během prvního roku. Vyšetření Quantiferonu v tříměsíčních intervalech během prvního roku je většinou obtížně dosažitelné. V tom hrají roli místní poměry a zvyklosti, reálná dostupnost testu a i náklady na toto vyšetření. Opakované provedení kožního tuberkulinového testu a RTG hrudníku každé 3 měsíce nebylo realizováno na většině pracovišť. Navíc se ukázalo, že často nevede preventivní terapii ftizeolog, ale revmatolog, někdy vysloveně na žádost pneumologa.
Tab. 1. Doporučení sekce pro tuberkulózu ČPFS (http://www.pneumologie.cz/zapisy/2005/sekce-TBC-20051201.php) s následnou modifikací pro situaci 5 (slovní sdělení). 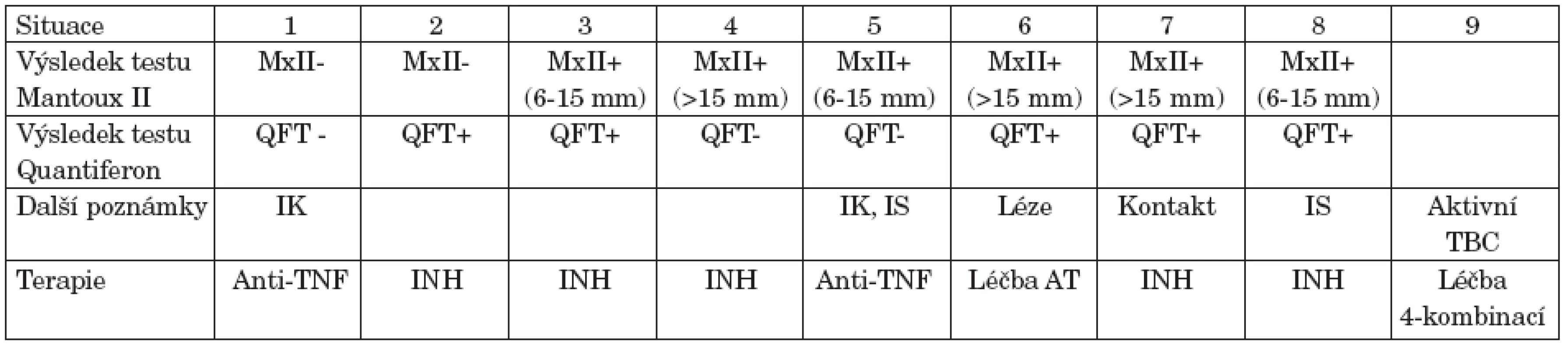
Vysvětlivky: +: pozitivní, -: negativní, MxII: tuberkulinový kožní test Mantoux II, QFT: Quantiferon-TB Gold test, QFT- : QFT test negativní pod 0,35 IU/ml, QFT+ : QFT test pozitivní nad 0,35 IU/ml, IK: imunokompetentní pacient, IS: imunosuprimovaný pacient, INH: isoniazid, Anti-TNF: biologická léčba anti-TNF možná bez preventivních opatření. AT: antituberkulotika Bez TBC v rodinné a osobní anamnéze, bez současného kontaktu s TBC, asymptomatický z hlediska TBC, normální skiagram hrudníku – situace 1, 2, 3, 4, 5, 8. Bez současného kontaktu s TBC. Vrcholové fibrózní léze nejasné aktivity – situace 6 V kontaktu s aktivní TBC, normální skiagram hrudníku – situace 7 Při biologické léčbě sledování ve tříměsíčních intervalech první rok, poté 1x ročně – situace 2-9. V situaci 1 vyšetření před, po 3, 6 a 12 měsících, poté 1x ročně. Preventivní terapie isoniazidem (INH) 5 mg/kg 6 měsíců, nebo léčba antituberkulotiky či 4-kombinací antituberkulotik. Biologická léčba je možná po 2 měsících léčby antituberkulotikem. Zavedení vyšetření na latentní TBC před biologickou léčbou velmi pravděpodobně snížilo počet případů TBC v ČR. Nicméně, další případy tuberkulózy se v souvislosti s blokádou TNFα v České republice objevují. To se stalo i přes tato doporučení, která jsou ve srovnání s doporučenými postupy v jiných zemích výrazně náročnější. V registru České revmatologické společnosti je evidováno 11 případů TBC, z toho 6 po zavedení preventivních opatření, což zřejmě neznamená menší výskyt TBC v ČR při anti-TNF terapii ve srovnání s jinými státy se srovnatelným rizikem.
Riziko vzniku TBC v souvislosti s blokádou TNFα v organismu nelze podceňovat a preventivní opatření jsou nutná. Ta opatření, navržená Sekcí pro tuberkulózu ČPFS lze považovat za ideální a doporučitelná vždy, pokud je možné je dosáhnout. Protože se však ukázalo, že tomu tak vždy není, navrhuje Česká revmatologická společnost minimální preventivní opatření, která je potřebí dodržovat vždy.
Před zahájením terapie je zapotřebí provést tuberkulinový test, test produkce interferonu gama (v našich podmínkách nejspíše Quantiferon TB-Gold test), RTG hrudníku a odebrat pečlivou rodinnou a osobní anamnézu z hlediska výskytu TBC a možného kontaktu s touto chorobou. Opakovat Quantiferon-TB Gold (QFT) test po 3 měsících terapie a po prvním roce léčby. RTG hrudníku zkontrolovat po prvním roce léčby. Pneumolog by měl být konzultován před zahájením anti-TNF terapie vždy, s výjimkou kompletně negativních nálezů. Konzultace plicního odborníka je nutná i v případě pozitivní anamnézy prodělané TBC nebo recentního kontaktu. Kontrolní vyšetření pneumologem po 3 měsících a po 1 roce se doporučuje tehdy, pokud již byla konzultace potřebná před zahájením terapie nebo v případě jakéhokoliv nálezu odchylného od normy. Obecně je doporučena maximální opatrnost a na možnost TBC myslet při každé návštěvě nemocného. Neustále je také potřebné mít na paměti, že více než 50 % případů TBC při anti-TNF léčbě může být v mimoplicní lokalizaci. Přeléčení isoniazidem (INH) nebo jinými antituberkulotiky indikuje odborník na TBC. Nejčastěji půjde o šestiměsíční podávání INH v dávce 5 mg/kg, maximálně 300 mg denně (45). Podle SPC přípravku isoniazid se pro prevenci neuropatie současně podává 10 mg pyridoxinu denně, při neuritidě se tato dávka zvyšuje až na 50 mg denně. Pokud se nejedná o aktivní TBC, je možné podle posledních názorů zahájit léčbu anti-TNF buď současně s podáním INH, nebo raději s odstupem 1 měsíce, tak aby bylo možné diferencovaně ohodnotit případnou toxicitu antituberkulózní léčby (4). Terapii vede ftizeolog či po dohodě revmatolog. V průběhu chemoprofylaxe je třeba provádět pravidelné kontroly jaterních testů: před zahájením léčby, prvé 3 měsíce po 4 týdnech, později po 6–8 týdnech. Zvýšení hodnot aminotransferáz, které nepřesáhnou dvojnásobek náležité hodnoty, nemusí být důvodem k přerušení léčby (46).
Kontroly v dalších letech jsou závislé na stavu pacienta. Při podezření na TBC je doporučeno vyšetření podobně jako před zahájením anti-TNF terapie.
V případě, že výsledek testu Quantiferon je neurčitý, doporučuje se toto vyšetření opakovat. Při perzistujícím neurčitém výsledku je rozhodnutí o antituberkulózní léčbě výsledkem zvážení rizika TBC podle dalších vyšetření, tedy především anamnézy, tuberkulinového testu a RTG plic.
Když se během terapie anti-TNF změní QFT či tuberkulinový test na pozitivní, je indikováno vyšetření odborníkem na TBC a preventivní antituberkulózní terapie. Není dostatek údajů k tomu, aby bylo možné podat jednoznačné doporučení jak se zachovat s anti-TNF terapií v těchto případech. Bude záležet na klinickém stavu pacienta/ky a ve většině případů bude správné terapii na několik týdnů přerušit a znovu zahájit po ujištění, že nejde o aktivní tuberkulózní infekci.
Pokud vznikne aktivní TBC během anti-TNF léčby, terapii ukončujeme. Po zhojení TBC a skončení léčby antituberkulotiky je možné v indikovaném případě znovu podat TNF neutralizující lék (47).
Nádorové onemocnění
Nemocní s RA mají zvýšené riziko vzniku lymfomu (48). Toto riziko je vyšší u pacientů s vysokou zánětlivou aktivitou onemocnění (49) a nesouvisí zřejmě s terapií běžnými bazálními antirevmatiky (50). Recentní rozsáhlá metaanalýza v souhrnu neukazuje zvýšené riziko malignit u nemocných s RA ve srovnání s běžnou populací, ale při podrobnějším rozboru jednotlivých malignit se ukazuje, že je mírně zvýšená frekvence lymfomů a nádorů plic (51). Poněkud nižší frekvence byla naopak pozorována pro kolorektální karcinom a nádory prsu.
Názory na vliv anti-TNF terapie nejsou zcela jednotné. Rozsáhlá studie, která shrnula 3 databáze v USA a Kanadě nenašla vztah mezi anti-TNF terapií a vyšší frekvencí lymfomů ani solidních tumorů (52). S podobným negativním vztahem dopadla analýza Národní banky pro revmatické choroby v USA (53).
Metaanalýza klinických hodnocení s infliximabem a adalimumabem ukázala na dávce závislý vzestup rizika malignit, především nemelanomových kožních nádorů (8). Práce byla podrobena metodologické kritice, nicméně je určitým varovným signálem (54, 55). Stejná skupina provedla i metaanalýzu klinických hodnocení s etanerceptem a zjistila nesignifikantní vzestup rizika malignit u těchto pacientů (56).
U kuřáků s RA léčených anti-TNF byla nalezena zvýšená frekvence s kouřením asociovaných tumorů (57).
Velmi recentní kongresová abstrakta s výsledky z britského a německého registru nepozorují zvýšenou incidenci nádorů; španělský registr udává mírně zvýšené riziko v prvních 6 měsících terapie. Tyto registry také neukázaly, že by byl zvýšený výskyt rekurence tumoru při anti-TNF terapii. Existuje však zřejmě mírně zvýšené riziko opakování malignity u těch nemocných s RA, u kterých byl v minulosti diagnostikován melanom. Abstrakt z roku 2008, zkoumající vliv anti-TNF terapie u nemocných, kteří měli v minulosti lymfom, ukazuje nejednoznačné výsledky.
Je potřebné zmínit, že zřejmě také záleží na konkomitantní medikaci, protože v klinickém hodnocení u Wegenerovy granulomatózy, kde pacienti dostávali etanercept s cyklofosfamidem, byla nalezena zvýšená frekvence solidních nádorů (58). Rovněž je raritně popsána zvýšená frekvence hepatosplenického T-lymfomu u adolescentů léčených infliximabem a azathioprinem či merkaptopurinem (59). V těchto případech byli nemocní léčeni pro Crohnovu chorobu či ulcerózní kolitidu. FDA nedávno doporučila přidat tuto informaci do příbalového letáku.
V srpnu 2009 dokončila FDA novou analýzu maligních onemocnění u nemocných léčených anti-TNF preparáty a vydala stanovisko o asociovaném zvýšeném riziku (http: //www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/DrugSafetyInformationforHeathcareProfessionals/ucm174474.htm). Doporučila přidat tuto informaci do dokumentace k produktu.
První část této informace se týká 48 malignit u dětí a dospívajících. U přibližně poloviny z nich šlo o lymfomy, mezi další patřily leukémie, melanomy a solidní nádory orgánů. Popsány byly i leiomyosarkom, maligní onemocnění jater a karcinom ledviny. Celkem byla podána zpráva o 11 úmrtích, z nich se v 9 případech jednalo o hepatosplenický T buněčný lymfom a lx o T buněčný lymfom. Většina z těchto 48 nemocných (88 %) dostávala i další imunosupresivní léky.
FDA rovněž zhodnotila 147 postmarketingových zpráv o leukémiích vzniklých při použití blokátorů TNF u dospělých a dětí. Šlo nejčastěji o akutní myeloidní leukémie (44 případů), chronické lymfatické leukémie (31 případů) a chronické myeloidní leukémie (23 případů). Větší část nemocných dostávala současně další imunosupresivní léky (61 %). Celkem bylo nahlášeno 30 úmrtí, z toho 26 přisouzeno leukémii. Průměrná doba do vzniku leukémie byla 1–2 roky léčby. FDA diskutuje komplikovanou interpretaci těchto údajů, poněvadž epidemiologické údaje prokazují zvýšené riziko těchto onemocnění u RA, nezávisle na terapii anti-TNF. Nicméně, FDA nakonec uzavírá, že existuje možná souvislost mezi léčbou TNF blokátory a rozvojem leukémie a doporučuje zdůraznit tuto skutečnost v informacích o lécích.
Doporučení
Vzhledem k výše uvedeným skutečnostem, není doporučováno zahajovat terapii anti-TNF u nemocných, kteří prodělali v předchozích 5 letech lymfom. Pokud je toto onemocnění v delší anamnéze, je potřebí anti-TNF terapii pečlivě zvážit a indikovat jen po rozhovoru s pacientem a dokonalém vysvětlení možných rizik. To samé platí pro pacienty, kteří mají v bližší či vzdálenější anamnéze solidní tumor. Pravděpodobné další zvýšení rizika je také potřebné vysvětlit kuřákům.
Objeví-li se tumor během terapie, doporučuje se léčbu ukončit. Jak se zachovat v případech úplného odstranění nádoru a v případech nízké potenciální invazivnosti je zcela nejasné a postup závisí na individuálním zvážení rizika po rozhovoru s pacientem.
Zatím by neměla být anti-TNF terapie kombinována s cyklofosfamidem a azathioprinem.
Je zapotřebí mít při každé návštěvě na paměti možnost vzniku lymfomu a dalších maligních onemocnění, specificky též leukémie.
Těhotenství a kojení
Většina současných údajů neukazuje na výrazně zvýšené riziko při těhotenství a dopad na plod u žen, které byly vystaveny anti-TNF terapii po nějakou dobu během těhotenství. Jednoznačné stanovisko však nelze zaujmout, protože chybí dostatečný počet zpráv a pokud jsou k dispozici, jejich výpovědní hodnota je modifikována tím, že značná část žen dostávala současně po nějakou dobu obvykle ještě methotrexat nebo leflunomid. IgG se může dostat z matčina oběhu přes placentu do oběhu plodu, především ve 2. a 3. trimestru. Nedávno byl popsán případ dítěte, které mělo terapeutické hladiny infliximabu v séru 6 týdnů po narození, přičemž poslední infuzi infliximabu (10 mg/kg) dostala matka 2 týdny před porodem (60).
Dosavadní publikované údaje o infliximabu a adalimumabu neukazovaly na vyšší frekvenci potratů, předčasných porodů nebo strukturálních abnormalit plodů (61, 62). Podobně je tomu u etanerceptu, s výjimkou popisu 1 dítěte, které se narodilo matce léčené 100 mg etanerceptu týdně a které mělo mnohotné abnormality kompatibilní se syndromem VACTERL (63). Pro vysvětlení: VATER je zkratka pro nenáhodnou asociaci kongenitálních malformací (vertebrální defekty [V], anální atrézie [A], tracheoezofageální fistula/ezofageální atrézie [TE] a renální defekty [R]); VACTERL zahrnuje širší spektrum abnormalit, tedy navíc kardiovaskulární abnormality [C] končetinové [limb] defekty [L]). Pro diagnózu asociace VATER (VACTERL) by měly být přítomny > 3 tyto abnormality.
Nejnověji byla publikována analýza hlášení FDA mezi roky 1999 až 2005 týkající se kongenitálních abnormalit u pacientů léčených anti-TNF (64). Celkem bylo pozorováno 61 kongenitálních abnormalit u 41 dětí, jejichž matky měly ve 22 případech etanercept a v 19 případech infliximab. Nejčastější kongenitální anomálií byly různé formy srdečních defektů. Padesát devět procent dětí mělo jednu nebo více abnormalit, které jsou součástí VACTERL. Některé tyto anomálie byly pozorovány statisticky významně častěji ve srovnání s historickými kontrolami. Diagnóza VACTERL však byla stanovena jen v jediném případě. Autoři doporučují opatrnost při podávání TNF neutralizujících léků těhotným ženám. Doprovodný editoriální článek podrobil výše zmíněnou publikaci neobvykle silné kritice vzhledem k omezením a selekci, které spontánní hlášení pro FDA může mít (65).
Množství IgG1, které se dostane do mateřského mléka je minimální. Infliximab nebyl detekován v mateřském mléce (60). Etanercept byl nalezen v mateřském mléce v koncentraci, která by při plném kojení a pokud by byl vstřebán, mohla dosáhnout asi 1/4 koncentrace terapeutické hladiny (66). Pravděpodobnost vstřebání intaktního IgG1 nebo etanerceptu je však nízká. O adalimumabu nejsou žádné zprávy.
Efekt anti-TNF na fertilitu u mužů není znám, jedinou zprávou je práce popisující sníženou motilitu spermií a počtu normálních oválních forem (67).
Doporučení
Protože údaje o výsledku těhotenství jsou rozporuplné, doporučuje se ukončit léčbu anti-TNF v graviditě. Nicméně, je potřebí zdůraznit, že v tomto doporučení nepanuje nikde jednota vzhledem k dobrému výsledku většiny těhotenství, ve kterých byly TNF inhibitory podávány.
Anti-TNF léky se dostávají do mateřského mléka minimálně a jsou pak pravděpodobně zničeny v trávicím traktu. Přesto momentální postoj spíše nedoporučuje kojení pro absenci dostatečně spolehlivých údajů.
Kardiovaskulární systém
Zvláštní situace se týká městnavého srdečního selhání. Při těchto stavech byly nalezeny vyšší hladiny TNF, které přispívají k celkové i srdeční kachexii, únavě, dysfunkci myocytů a změnám základních myokardiálních bílkovin. Léčba pomocí blokády TNF se však ukázala jako neúčinná a byla předčasně ukončena v případě etanerceptu, s nevýznamnou tendencí ke zhoršení. Vysoké dávky infliximabu (10 mg/kg) byly asociovány se zvýšeným rizikem zhoršení městnavého srdečního selhání a se zvýšenou mortalitou u takových nemocných (68).
Studie, které hodnotily riziko srdečního selhání u pacientů s RA na TNF inhibitorech, přinesly nestejné výsledky. Poslední poznatky hovoří o nezvýšeném riziku a dokonce o protektivním efektu na riziko srdečního selhání (69).
Zvažuje se, že anti-TNF může redukovat i výskyt infarktu myokardu či cévní mozkové příhody (70, 71).
Efekt anti-TNF terapie na hladinu lipidů je nejasný (4).
Doporučení
Zatím se nedoporučuje podávat anti-TNF terapii nemocným s kardiálním selháváním s NYHA III nebo IV a pacientů s ejekční frakcí pod 50 % (72). U pacientů, u kterých se vyvine srdeční selhání se anti-TNF terapie ukončuje.
Autoimunitní syndromy
Při blokádě TNF byl popsán vznik antinukleárních protilátek (11–62 %), pozitivita anti-ds DNA protilátek (6–15 %), zcela výjimečně s vyvoláním syndromu, který se podobá systémovému lupus erythematodes (SLE) (73). Je možná indukce antifosfolipidového syndromu. Z hlediska četnosti a závažnosti nepředstavuje vznik autoimunitní reakce větší praktický problém. Pacienti, kteří vyvinou známky SLE syndromu ukončí léčbu, což vede k vymizení symptomů (73, 74). U ostatních, kteří mají pouze autoimunitní laboratorní fenomén, léčba může pokračovat. Pravidelné kontroly možného vzniku autoprotilátek při absenci příznaků vznikajícího systémového onemocnění nejspíše nejsou potřebné.
Vakcinace
Vakcinace proti chřipce či použití polysacharidové pneumokokové vakcíny vede k vybudování dostatečné odpovědi i během anti-TNF terapie, i když titry protilátek jsou většinou popisovány nižší, než ve srovnávané skupině bez anti-TNF (75). V některých zemích je doporučena rutinní imunizace proti pneumokokům (např. ve Velké Británii), ale obecným doporučením to není. Podání živé vakcíny v průběhu anti-TNF terapie by mohlo vést k diseminaci onemocnění. To se týká např. vakcíny proti spalničkám příušnicím a zarděnkám, proti varicele/herpes zoster, proti žluté zimnici, nazální chřipkové vakcíny, perorální polio a konečně BCG vakcíny.
Vzhledem ke zprávám o vyšší frekvenci herpes zoster u nemocných na anti-TNF terapii doporučuje Americká kolej revmatologů zvážit očkování s použitím vakcíny proti herpes zoster u pacientů nad 60 let, u kterých je pravděpodobnost, že budou léčeni blokádou TNF. Poslední doporučení dovoluje provést tuto vakcinaci i u nemocných, kteří jsou léčeni methotrexatem a malou dávkou glukokortikoidů.
Doporučení
- Pravidelná vakcinace proti chřipce a proti pneumokokům je možná a účinná i v průběhu anti-TNF terapie. Je možné rutinně zvážit vakcinaci proti pneumokokům, chřipce a hepatitidě B u pacienta před zahájením neutralizace TNF, jak např. doporučuje Americká kolej revmatologů (72). O přeočkování proti tetanu nejsou žádné informace, nicméně dá se předpokládat podobný efekt a přístup.
- Vakcinace živými vakcínami je kontraindikována. Pokud je nutná, je možné podat nejméně 3 týdny (ale raději 4 týdny) před zahájením biologické léčby, nebo po alespoň 3 měsících od ukončení imunosupresivní léčby, či po 5 poločasech příslušného léku, případně až po 6 měsících od ukončení infliximabu (76) či jiné anti-TNF.
Injekční a infuzní reakce
Infuzní reakce a reakce v místech vpichu jsou asociovány s imunogenicitou preparátů a jsou většinou jen mírné. Vzácně se mohou vyskytnout závažné reakce, především při intravenózní aplikaci infliximabu, které vyžadují intenzivní terapii a jsou absolutní kontraindikací dalšího podávání. Tyto příhody jsou způsobeny hlavně hypersenzitivní reakcí na myší protein, jež je obsažený v imunoglobulinové molekule infliximabu. Myší část chimérické molekuly infliximabu je zodpovědná za možnou indukci tvorby protilátek (HACA – human antichimeric antibodies), která může vést ke snížení účinnosti léčby (77, 78) a zvýšenému riziku infuzních reakcí (79). Z tohoto důvodu je při léčbě infliximabem indikovaná současná aplikace methotrexatu, který tvorbu protilátek proti infliximabu tlumí. U adalimumabu je problém imunogenicity částečně redukován, nicméně i zde může dojít ke tvorbě protilátek, které mohou mít vliv na snížení účinnosti (77). Infuzní reakce jsou většinou zvládnuty podáním glukokortikoidů a antihistaminik, nebo zpomalením rychlosti infuze (4, 79). U dětí se méně infuzních reakcí objevuje při použití vyšší dávky infliximabu 6 mg/kg než při 3 mg/kg (4). Při terapii etanerceptem je nejčastěji udáván vznik lokální reakce v místě aplikace.
Hematologické komplikace
Zřídka se může objevit aplastická anémie a pancytopenie (4). V takovém případě by měla být anti-TNF terapie přerušena.
Zvýšení aminotransferáz
U části nemocných může dojít při léčbě anti-TNF k vzestupu aminotransferáz. Proto by měly být tyto parametry sledovány, již také v závislosti na podání doprovodných imunosupresivních léků. Vzhledem k možné aktivaci hepatitidy při anti-TNF léčbě je nutné myslet při elevaci aminotransferáz i na tuto možnost.
Neurologické onemocnění
Vzácně byla pozorována centrální a periferní demyelinizační onemocnění, včetně Guillian-Barré syndromu (4). V některých případech pak došlo ke zlepšení po ukončení anti-TNF medikace. Proto by tato léčba neměla být zahajována u nemocných s anamnézou demyelinizace a neuritidy optiku. Pokud se během léčby objeví symptomy naznačující možnost demyelinizace, např. parestezie, poruchy vidění, zmatenost, sfinkterové problémy, poruchy rovnováhy, poruchy chůze, paréza n. facialis a případně další symptomy, je indikované přerušení anti-TNF, konzultace neurologa a případné podrobné vyšetření včetně MRI mozku a míchy, lumbál - ní punkce a vyšetření evokovaných potenciálů (80).
Plicní postižení
Vzácně bylo pozorováno akutní a těžké a někdy i fatální intersticiální plicní onemocnění (4). Velmi vzácně jsou popsány granulomatózní plicní reakce podobné sarkoidóze (81, 82). Ukončení anti-TNF vede většinou k vylepšení.
Kožní onemocnění
Popsány byly případy psoriázy, psoriasiformní léze, nebo exacerbace lupénky (4, 83). V některých případech pomohla záměna TNF blokujícího preparátu. Zřídka se vyskytly případy Stevens Johnsonova syndromu, erythema multiforme, toxické epidermální nekrolýzy a granulomatózních kožních reakcí (4).
Perioperační období
Spolehlivé údaje k jasnému doporučení neexistují. Některé poznatky shrnuje přehledný článek o léčbě v perioperačním období u RA (84). Po chirurgickém zákroku u Crohnovy choroby nebyly pozorovány signifikantní rozdíly v počtu infekcí, i když trend byl pro jejich častější výskyt při terapii anti-TNF. V jiném sledování však nebyla žádná taková souvislost pozorována. Při ortopedických zákrocích na noze a kotníku měla skupina nemocných, kteří byli na anti-TNF terapii dokonce méně komplikací. Na rozdíl od tohoto pozorování, retrospektivní studie z Johns Hopkins našla větší výskyt pooperačních vážných infekcí u pacientů s anti-TNF. Recentní studie nepopisuje rozdíl v počtu infekcí v místě chirurgického zákroku u nemocných, kteří měli v perioperačním období anti-TNF terapii ve srovnání s těmi, kteří ji neměli (85). Jedenkrát byla popsána osteomyelitida po zubním chirurgickém zákroku u pacienta na terapii infliximabem (86).
Doporučení
Při absenci dostatečně podložených důkazů se zatím doporučuje vynechat anti-TNF terapii v předoperačním období alespoň na jeden cyklus (tj. etanercept 1 týden, adalimumab 2 týdny, infliximab 6–8 týdnů) a zahájit terapii znovu po tom, co se rána zhojila tak, že bylo možné odstranit stehy (84). V případech zubního ošetření s rizikem infekce (absces, extrakce zubu atd.) se doporučuje preventivní podání antibiotik (80).
Laboratorní sledování léčby
Kromě výše zmíněných specifických opatření je před zahájením léčby vhodné vyšetřit krevní obraz a diferenciální rozpočet, jaterní testy, kreatinin a moč + sediment. Kontrolu je vhodné provést v odstupu 2–4 týdnů. Pokud pacient dostává doprovodnou terapii methotrexatem či jiným DMARD, řídí se kontroly podle této léčby, případně je vhodné kontrolovat tyto parametry 1x za 8–12 týdnů, samozřejmě s případnou úpravou v případě abnormálních laboratorních výsledků či klinického nálezu.
BEZPEČNOST LÉČBY RITUXIMABEM
Infuzní reakce
Infuzní reakce jsou nejčastějším nežádoucím projevem podání rituximabu (87). Objevují se asi v 35 % při prvním podání a jejich frekvence v dalším průběhu léčby klesá. Nejčastěji se uvádí výskyt bolestí hlavy, hypertenzní reakce, nauzea, pruritus, kopřivka, zčervenání. Někdy mohou být reakce závažné. Jsou pravděpodobně důsledkem lýzy B lymfocytů.
Doporučení
Premedikace intravenózními glukokortikoidy ve formě 100 mg Solu-Medrolu 30 minut před infuzí rituximabu snižuje frekvenci infuzních reakcí. Rovněž je možné podat paracetamol a antihistaminikum. Pomůže i zpomalení rychlosti infuze. Při podávání rituximabu musí být k dispozici základní resuscitační prostředky.
Infekce
Pravděpodobně je mírně zvýšena frekvence závažných infekcí v souvislosti s léčbou rituximabem 2 x 1000 mg (4). Nebyl pozorován vzestup oportunních infekcí, tuberkulózy či reaktivace virové infekce (21, 88). Čerstvá kongresová abstrakta neukazují na zvyšující se frekvenci infekcí spolu s opakovaným podáním rituximabu (do 5 opakování). Údaje o infekcích v souvislosti s mírou a délkou deplece B lymfocytů a s hladinami imunoglobulinů nejsou jasné. Zdá se, že snad je větší množství infekcí při prolongované depleci B lymfocytů (více než 3 roky) a při poklesu IgM a IgG (89). Publikace týkající se poklesu hlavních izotopů imunoglobulinů se liší, ale spíše se zdá, že postupně k jejich poklesu dochází (90).
Použití rituximabu může vést k reaktivaci hepatitidy B, především u HBsAg pozitivních pacientů, ale i u HBsAg negativních anti-HBc pozitivních jedinců (91). Rituximab byl opakovaně použit k léčbě onemocnění spjatých s hepatitidou C, takže v tomto případě je jeho podání možné.
Doporučení
Přestože se nezdá, že by riziko bylo signifikantně zvýšeno, doporučuje se opatrné sledování pacientů ohledně infekcí, zejména tam, kde se podává rituximab opakovaně a kde poklesnou hladiny imunoglobulinů pod dolní hranici.
Doporučuje se provést stanovení hladiny IgM, IgA a IgG před zahájením terapie a případná kontrola v případech infekcí, nicméně zatím není jasné, jaký přínos mohou tyto kontroly mít. Vhodné je také vyšetřit hladiny imunoglobulinů před opakovaným podáním rituximabu, kdy nízké hladiny IgG budou signalizovat větší nebezpečí infekčních komplikací.
Samozřejmě zde platí nezahajovat terapii v případě vážnějších či oportunních infekcí, podobně jako u anti-TNF léčby.
Nemocné je potřebné vyšetřit na přítomnost hepatitidy. Platí zde to samé, co pro anti-TNF preparáty. Pozornost je potřebí věnovat anti-HBc pozitivním pacientům a monitorovat HBsAg během léčby, případně další parametry ke zjištění případné reaktivace hepatitidy B. U HBsAg pozitivních pacientů s maligním onemocněním vedlo preventivní podávání lamivudinu ke snížení frekvence reaktivace a mortality na hepatitidu B (92).
Není potřebné provádět skrínink na přítomnost latentní TBC, i když většina nemocných bude mít tato vyšetření provedena, vzhledem k současně platné indikaci rituximabu po selhání anti-TNF léčby. K dispozici není dostatečné množství údajů o zahájení rituximabu u nemocných s LTBI, ale vzhledem k nezvýšené frekvenci TBC v souvislosti s jeho použitím je spíše možné ho podat bez předchozí potřeby podání antituberkulotika.
Vakcinace
Vzhledem k povaze léčby je vhodné vakcinovat pacienty před podáním rituximabu. Pokud je potřebné vakcinovat po rituximabu, je to možné, ale je potřebí očekávat suboptimální odpověď (93). Jinak platí stejná doporučení jako u anti-TNF.
Těhotenství a kojení
Rituximab je IgG1 molekula a přestupuje placentou. Pokud je podán ve druhém a třetím trimestru mohou jeho hladiny v séru narozeného dítěte dosáhnout srovnatelných hladin s matkou. To může vést k poklesu či vymizení B lymfocytů u dítěte. Není jasné, jaké jsou dlouhodobé dopady na dítě. Výrobce doporučuje ukončení rituximabu 12 měsíců před koncepcí (94). O přestupu do mateřského mléka nejsou údaje.
Nádorová onemocnění
Zvýšená frekvence nádorových onemocnění nebyla u rituximabu popsána. Nicméně, doporučuje se pečlivé sledování nemocných zejména směrem k solidním nádorům.
Neurologická onemocnění
Progresivní multifokální leukoencefalopatie (PML) byla popsána u 57 HIV-negativních nemocných léčených rituximabem. Z toho šlo o 52 lymfoproliferativních onemocnění a 5 případů autoimunitních chorob; 2x o SLE a 1x o RA (95). Další oznámený, ale dosud nepublikovaný případ, se vyskytl u dermatomyozitidy. Většina nemocných byla léčena ještě dalšími imunosupresivními postupy. PML se vyskytuje i u nemocných se stejnými diagnózami bez podání rituximabu. Protože je však PML spjata s až 80–100% fatálním vyústěním, jedná se o závažnou komplikaci. Je proto zapotřebí ptát se na možné neurologické komplikace ve formě zmatenosti, motorické slabosti, parézy, poruch řeči, poruch vidění, a konzultovat časně neurologa v případě změn.
Kožní reakce
Po rituximabu byly popsány případy psoriázy u nemocných s RA, SLE a non-Hodgkinských lymfomů (96, 97). Rituximab byl ale také úspěšně použit u případu psoriázy (98).
Plicní postižení
Vzácně byl popsánu nemocných s hematologickým onemocněním vznik intersticiálního plicního postižení (ILD) po rituximabu. U pacientů, kteří vyvinou dušnost, horečku a kašel by mělo být na tuto možnost pomýšleno a v případě průkazu ILD zahájit terapii glukokortikoidy (99).
Neutropenie
V průběhu léčby rituximabem se může vyskytnout opožděná neutropenie (100). Léčba by v takovém případě měla být přerušena, dokud se nezjistí zda příčina je v případné doprovodné infekci, v jiném léku či nádoru nebo je způsobená rituximabem (101).
Bezpečnost léčby jiným biologickým preparátem po podání rituximabu
Genovese a spol. nedávno uveřejnili analýzu 185 pacientů, kteří dostali po ukončení rituximabu jinou biologickou léčbu, většinou anti-TNF (102). Skoro 90 % nemocných mělo v době zahájení následné biologické léčby depleci periferních B lymfocytů. Vážné infekce se objevily ve frekvenci 6,99/100 000 p-r u těch, kteří ukončili rituximab, ale ještě nezahájili další biologikum a ve frekvenci 5,49/100 000 p-r u těch s dalším biologickým lékem. Neobjevily se žádné fatální ani oportunní infekce. Jde o omezenou skupinu pacientů, ale zdá se, že následná terapie jiným biologickým preparátem po použití rituximabu není spojena s větší incidencí vážných infekcí.
Laboratorní sledování léčby
Před zahájením léčby je vhodné vyšetřit krevní obraz a diferenciální rozpočet, jaterní testy, kreatinin a moč + sediment. Kontrolu je vhodné provést v odstupu 4 týdnů. Pokud pacient dostává doprovodnou terapii methotrexatem či jiným DMARD, řídí se kontroly podle této léčby, případně je vhodné kontrolovat tyto parametry 1x za 12 týdnů. Podobně postupujeme před opakovaným podáním rituximabu. Další vyšetření jsou zmíněna ve specifických oddílech, viz výše.
BEZPEČNOST LÉČBY ABATACEPTEM
Infekce
Při léčbě abataceptem je pozorován vyšší počet bakteriálních infekcí, včetně vážných (103). Počet infekcí zůstává během léčby stejný. Byly pozorovány jen jednotlivé případy TBC a frekvence se nezdá při léčbě abataceptem zvýšená. U pacientů s chronickou obstrukční pulmonální nemocí (CHOPN) léčených abataceptem byly častější infekce respiračního traktu. Kombinace abataceptu s anti-TNF léky či inhibitory účinku IL-1 výrazně zvyšuje frekvenci infekcí. V klinických hodnoceních nebyly pozorovány případy hepatitidy B a C.
Doporučení
Pacienti by neměli začínat léčbu s aktivní infekcí. Měli by být sledováni pro možné projevy bakteriální infekce. Léčba nemocných s CHOPN by se měla dít s velkou opatrností. Přestože TBC se nezdá problémem, dokud nebude dostatek údajů, stále se doporučuje vyšetření na latentní TBC jako u anti-TNF preparátů (viz výše). Nedoporučuje se kombinace s anti-TNF nebo anakinrou. Protože není zcela znám efekt na hepatitidu B a C, měl by se provést skrínink před nasazením abataceptu, podobně jako u anti-TNF.
Nádory
V iniciálních klinických hodnoceních bylo pozorováno více nádorů plic u kuřáků než u běžné populace (4). Incidence proti RA nebyla významně zvýšena. Lymfomy byly v klinických hodnoceních s abataceptem pozorovány, ale ne ve zvýšené frekvenci proti tomu, co se dá očekávat u RA (4). Recentní detailní analýza všech programů z abataceptem neprokázala zvýšenou frekvenci lymfomů ani solidních nádorů proti srovnatelné populaci nemocných s revmatoidní artritidou, ač bylo podotknuto, že do klinických hodnocení jsou vybíráni nemocní s nižším potenciálem vzniku nádoru vzhledem k jejich pečlivému vyšetření (104). Ze solidních nádorů byly nejčastěji pozorovány nemelanomové kožní nádory (102). Protože nejsou další informace k dispozici, mohou se konkrétní doporučení týkat pouze pečlivého sledování pacientů během léčby. Nedávná doporučení kontraindikují nemocné s jakýmkoli nádorem v posledních 5 letech, kromě kompletně odstraněného nemelanomového nádoru kůže (103). Abatacept by se měl většinou ukončit, pokud se objeví nádorové onemocnění, nicméně bude závislé na druhu nádoru a okolnostech nemoci (103).
Vakcinace
Byl pozorován pokles v odpovědi na chřipkovou, pneumokokovou a tetanickou vakcinaci, takže je lépe provést očkování před podáním abataceptu (105). Nicméně, neživé vakcíny je možné v průběhu léčby abataceptem podat. Vakcinace proti chřipce se doporučuje (103). Ohledně živé očkovací látky nejsou údaje, ale vzhledem k navozené imunosupresi je nejspíše použití živé vakcíny kontraindikované a v případě nutnosti očkování léčbu přerušit alespoň na 3 měsíce a pokračovat s léčbou nejdříve za 2, ale raději za 4 týdny (103).
Těhotenství
U zvířat překračuje abatacept placentární bariéru. Údaje o vlivu abataceptu na průběh těhotenství a možné poškození plodu u člověka jsou minimální. Osm gravidit během klinických hodnocení skončilo ve 3 případech spontánním potratem, ve 2 případech umělým přerušením a u dalších není osud znám (103). Existující doporučení mluví o možné koncepci za 10 týdnů (94), za 18 týdnů (103), nebo podle výrobce za 14 týdnů po ukončení léčby. V případě gravidity během léčby abataceptem bude správné léčbu přerušit.
Kojení v průběhu léčby abataceptem se nedoporučuje, u zvířat se abatacept objevuje v mateřském mléce.
Perioperační období
Protože nejsou k dispozici vůbec žádné údaje, postup bude zatím stejný jako v případě anti-TNF léků.
Laboratorní sledování léčby
Nejsou specifická doporučení, a protože abatacept je podáván spolu s methotrexatem, řídí se kontroly touto léčbou. Před zahájením léčby je vhodné vyšetřit krevní obraz a diferenciální rozpočet, jaterní testy, kreatinin a moč + sediment. Kontrolu je vhodné provést v odstupu 2 a 4 týdnů. Abatacept je podle doporučení podáván spolu s methotrexatem, takže další kontroly se řídí podle této léčby, případně je vhodné kontrolovat tyto parametry 1x za 8–12 týdnů, samozřejmě v s případnou úpravou v případě abnormálních laboratorních výsledků či klinického nálezu.
BEZPEČNOST LÉČBY TOCILIZUMABEM
Tocilizumab je nejnovějším přírůstkem v rodině biologických léků. V době vytváření těchto doporučení je schválen Evropskou lékovou agenturou (EMEA) k léčbě dospělých pacientů se středně závažnou až závažnou aktivní revmatoidní artritidou, kde se používá v kombinaci s methotrexatem u pacientů, kteří netolerovali nebo neodpovídali na léčbu jedním nebo více DMARDs nebo anti-TNF. V případě intolerance nebo nevhodnosti podání methotrexatu, může být tocilizumab podán jako monoterapie.
Jeho bezpečnostní profil je znám prakticky jen z klinických randomizovaných hodnocení a jejich extenzí. Nejdelší zkušenosti s použitím tocilizumabu jsou v Japonsku, kde mají vypracovaná kritéria pro léčbu, včetně sledování bezpečnosti a naše doporučení vycházejí převážně z této (106) a další dokumentace (4, 107, 108).
Infekce
V průběhu klinických hodnocení byla pozorována vyšší frekvence infekcí. Neutralizace účinku IL-6 může zastřít některé projevy, které normálně infekci provázejí, jako je vzestup CRP, FW, neutrofilních leukocytů nebo horečka.
Nedoporučuje se zahajovat léčbu tocilizumabem v průběhu aktivní infekce. Zvláštní pozornost by měla být věnována pacientům s vyšším rizikem, jako jsou nemocní vyššího věku, s plicními chorobami, léčbou glukokortikoidy nebo špatnou pohyblivostí. V Japonsku doporučují zvážit pokles nebo ukončení glukokortikoidů před nasazením tocilizumabu a vakcinaci proti chřipce a pneumokokům u pacientů nad 65 let.
Tocilizumab nehraje roli ve formaci granulomů a pravděpodobně neinterferuje s obranou proti tuberkulóze. Protože však dochází k útlumu imunitní odpovědi a nejsou dosud známá všechna rizika, doporučuje se skrínink podobně jako u anti-TNF léčby a případně preventivní přeléčení.
Byly pozorovány jednotlivé případy herpes zoster, bez jasného vztahu k léčbě. Není jasné, zda tocilizumab způsobuje reaktivaci EBV infekce, vzhledem k 1 fatálnímu případu je v Japonsku doporučeno vyloučení chronické aktivní EBV; příbalová informace tento postup nevyžaduje.
Gastrointestinální postižení
Bylo popsáno několik případů perforace střeva se sekundární peritonitidou, zejména jako komplikace divertikulitidy. Tocilizumab by proto měl být použit opatrně u nemocných s anamnézou divertikulózy a ulcerací v gastrointestinálním traktu.
Elevace lipidů a kardiovaskulární komplikace
Během léčby tocilizumabem může dojít k vzestupu sérových lipidů. V případě monoterapie to bylo ve 38%, v případě kombinované léčby ve 23 %. Vzestup se týká celkového cholesterolu, LDL a triglyceridů, méně nebo minimálně HDL cholesterolu, i když většina pramenů uvádí, že nedochází k významnému vzestupu celkového aterogenního indexu u většiny pacientů. Po 4–8 týdnech léčby by měla být zkontrolována hladina lipidů a při hyperlipidémii by měla být zahájena příslušná léčba. Uvádí se, že bývá dobrá odpověď na statiny.
Byla pozorována hypertenze, infarkt myokardu, kardiální selhání, mozkové krvácení a úmrtí na tyto komplikace u japonských pacientů. Podle tiskové zprávy vydané výrobcem v Japonsku, firmou Chugai, nebyly tyto komplikace častější ve srovnání s podobnými projevy u nemocných léčených TNF neutralizujícími preparáty.
Neutropenie
Byl pozorován pokles neutrofilních leukocytů pod 1 x 109 u 3,4 % a pod 0,5 x 109 u 0,3 % nemocných, u poloviny z nich do 8 týdnů po zahájení terapie (108). U většiny nebyl vztah k infekční komplikaci. Pokles trombocytů byl zaznamenán u 1,7 % nemocných.
Výrobce doporučuje opatrnost použití tocilizumabu u nemocných s počtem neutrofilů pod 2 x 109 a trombocytů pod 100 x 103, a nepodávat léčbu při počtech neutrofilů pod 0,5 x 109 a trombocytů pod 50 x 103.
Počty neutrofilních leukocytů a trombocytů by měly být zkontrolovány po 4–8 týdnech a dále pak 1x za 12 týdnů. Při poklesu neutrofilů mezi 0,5 x 109 a 1,0 x 109 a trombocytů mezi 50 x 103 a 100 x 103 je vhodné snížit dávku na 4 mg/kg.
Infuzní reakce
Mohou se vyskytnout infuzní reakce ve formě hypertenze, bolestí hlavy a kožní vyrážky. Klinicky významné hypersenzitivní reakce byly řídké, byly nejčastěji pozorovány mezi druhou až pátou infuzí. Při podávání tocilizumabu musí být k dispozici základní resuscitační prostředky.
Laboratorní abnormality
Tocilizumab může vyvolávat elevaci aminotransferáz, zejména v kombinaci s nebiologickými DMARDs. Zvýšení je obvykle přechodné. Nebyly zaznamenány případy závažného postižení jater. U nemocných s mírnou elevací aminotransferáz může být terapie tocilizumabem s opatrností zahájena. Kontroly by měly být po 4–8 týdnech a dále pak každých 12 týdnů. Při vzestupu na 3násobek normy se doporučuje poklesnout s dávkou na polovinu, při hodnotě nad 5násobek normy se léčba nemá podávat.
Těhotenství a kojení
U zvířat bylo zjištěno vyšší riziko spontánních potratů a úmrtí embrya při podání vysokých dávek tocilizumabu. V humánní medicíně je riziko nejasné a tocilizumab by neměl být podáván v těhotenství.
Údaje o přechodu tocilizumabu do mateřského mléka nejsou k dispozici a doporučení je zatím stejné jako pro anti-TNF.
Maligní onemocnění
Frekvence malignit nebyla v klinických hodnoceních zvýšená (109). Je však k dispozici málo údajů a proto by se mělo postupovat podobně jako při použití inhibice TNF.
Perioperační období
Efekt tocilizumabu na hojení ran není znám, zvažuje se však možnost zpomaleného hojení (106). Nedávno byly publikovány pozitivní zkušenosti u kohorty nemocných, kteří v průběhu léčby tocilizumabem podstoupili ortopedický zákrok (110). Případné známky pooperační infekce mohou být efektem tocilizumabu maskovány. Proto se chirurgický zákrok v průběhu léčby nedoporučuje, případně až po 14 dnech po poslední dávce.
Vakcinace
U dětí s JIA byla prokázána účinnost a bezpečnost vakcinace pneumokokovou vakcínou v průběhu léčby tocilizumabem (4). Živé vakcíny by neměly být podávány.
ZÁVĚR
Základní údaje o bezpečnosti léčby jsou získávány z klinických hodnocení. U méně častých nežádoucích účinků poskytují podrobnější informace postmarketingová hlášení. Systém sledování nemocných v registrech biologické léčby a sběr údajů o specifických nežádoucích účincích je z tohoto hlediska zásadní k poznání rizikovosti biologické terapie. Je nutné zdůraznit potřebnost pečlivého hlášení nežádoucích účinků. Informace o bezpečnosti léčby jsou pak neustále doplňovány a zpřesňovány.
Text tohoto článku poskytuje základ, ke kterému je potřebné sledovat a doplňovat si nejnovější informace o bezpečnosti léčby biologickými preparáty. Tyto informace bývají také obsaženy v souhrnu charakteristik léku (SPC), který není tímto článkem nahrazován.
Podpořeno v rámci řešení výzkumných záměrů Ministerstva zdravotnictví ČR číslo 00023728.
* Výbor České revmatologické společnosti ve složení: Prof. MUDr. Karel Pavelka, DrSc., Prof. MUDr. Zbyněk Hrnčíř, DrSc., Doc. MUDr. Pavel Horák, CSc., Doc. MUDr. Radim Bečvář, CSc., MUDr. Marie Sedláčková, MUDr. Dana Němcová, MUDr. Roman Záhora, MUDr. Petr Vítek, MUDr. Sevda Augustinová, MUDr. Jiří Štolfa, MUDr. Marta Olejárová, CSc., Jana Korandová.
Zdroje
1. Vencovský J, Tegzová D, Krofta K, Pavelka K. Doporučení české revmatologické společnosti k biologické léčbě blokádou TNF – doplněk standardních léčebných postupů u revmatoidní artritidy. Čes Revmatol 2004; 12 : 20–29.
2. Bečvář R, Vencovský J, Němec P, Suchý D, Procházková L, Pavelka K. Doporučení České revmatologické společnosti pro léčbu revmatoidní artritidy. Účinnost a strategie léčby. Čes Revmatol 2007; 15 : 73–90.
3. Furst DE, Keystone EC, Kirkham B, Kavanaugh A, Fleischmann R, Mease P, et al. Updated consensus statement on biological agents for the treatment of rheumatic diseases, 2008. Ann Rheum Dis 2008; 67 Suppl 3: iii2–25.
4. Furst DE, Keystone EC, Winthrop K, Dörner T, Van Vollenhoven R, Breedveld FC, et al. Updated consensus statement on biological agents for the treatment of rheumatic diseases, 2009. Ann Rheum Dis 2009 (v tisku).
5. Askling J, Fored CM, Brandt L, Baecklund E, Bertilsson L, Feltelius N, et al. Time-dependent increase in risk of hospitalisation with infection among Swedish RA patients treated with TNF antagonists. Ann Rheum Dis 2007; 66 : 1339–44.
6. Curtis JR, Patkar N, Xie A, Martin C, Allison JJ, Saag M, et al. Risk of serious bacterial infections among rheumatoid arthritis patients exposed to tumor necrosis factor α antagonists. Arthritis Rheum 2007; 56 : 1125–33.
7. Listing J, Strangfeld A, Kary S, Rau R, von Hinueber U, Stoyanova-Scholz M, et al. Infections in patients with rheumatoid arthritis treated with biologic agents. Arthritis Rheum 2005; 52 : 3403–12.
8. Bongartz T, Sutton AJ, Sweeting MJ, Buchan I, Matteson EL, Montori V. Anti-TNF antibody therapy in rheumatoid arthritis and the risk of serious infections and malignancies: systematic review and meta-analysis of rare harmful effects in randomized controlled trials. JAMA 2006; 295 : 2275–85.
9. Strangfeld A, Listing J, Herzer P, Liebhaber A, Rockwitz K, Richter K, et al. Risk of herpes zoster in patients with rheumatoid arthritis treated with anti-TNFα agents. JAMA 2009; 301 : 737–744.
10. http: //www.fda.gov/cder/drug/InfoSheets/HCP/TNF_blockersHCP.htm
11. Wallis RS, Broder MS, Wong JY, Hanson ME, Beenhouwer DO. Granulomatous infectious diseases associated with tumor necrosis factor antagonists. Clin Infect Dis 2004; 38 : 1261–5.
12. Winthrop KL, Yamashita S, Beekmann SE, Polgreen PM; Infectious Diseases Society of America Emerging Infections Network. Mycobacterial and other serious infections in patients receiving anti-tumor necrosis factor and other newly approved biologic therapies: case finding through the Emerging Infections Network. Clin Infect Dis 2008; 46 : 1738–40.
13. Šléglová O, Mareček Z, Urbánek P, Pavelka K. Bezpečnost podání anti-TNF alfa léčby u revmatických pacientů s chronickou hepatitidou B nebo C. Čes Revmatol 2007; 15 : 105–111.
14. Giannitti C, Bellisai F, Ferri C, Galeazzi M. Treatment strategies for a patient with rheumatoid arthritis and hepatitis C. Expert Opin Pharmacother 2009; 10 : 579–87.
15. Nathan DM, Angus PW, Gibson PR. Hepatitis B and C virus infections and anti-tumor necrosis factor-alpha therapy: guidelines for clinical approach. J Gastroenterol Hepatol 2006; 21 : 1366–71.
16. Ferri C, Ferraccioli G, Ferrari D, Galeazzi M, Lapadula G, Montecucco C, et al. Safety of anti-tumor necrosis factor-alpha therapy in patients with rheumatoid arthritis and chronic hepatitis C virus infection. J Rheumatol 2008; 35 : 1944–9.
17. Zingarelli S, Frassi M, Bazzani CH, Scarsi M, Puoti M, Airo P. Use of tumor necrosis factor-a-blocking agents in hepatitis B virus-positive patients: report of 3 cases and review of the literature. J Rheumatol 2009; doi: 10.3899/jrheum.081246.
18. Gardam MA, Keystone EC, Menzies R, Manners S, Skamene E, Long R, et al. Anti-tumor necrosis factor agents and tuberculosis risk: mechanisms of action and clinical management. Lancet Infect Dis 2003; 3 : 148–55.
19. Keane J, Gershon S, Wise RP, Mirabile-Levens E, Kasznica J, Schwieterman WD, et al. Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent. N Engl J Med 2001; 345 : 1098–104.
20. Mohan AK, Coté TR, Block JA, Manadan AM, Siegel JN, Braun MM. Tuberculosis following the use of etanercept, a tumor necrosis factor inhibitor. Clin Infect Dis 2004; 39 : 295–9.
21. Furst DE. The Risk of Infections with Biologic Therapies for Rheumatoid Arthritis. Semin Arthritis Rheum 2008 (v tisku).
22. Tubach F, Salmon D, Ravaud P, Allanore Y, Goupille P, Bréban M, et al. Risk of tuberculosis is higher with anti-tumor necrosis factor monoclonal antibody therapy than with soluble tumor necrosis factor receptor therapy: The three-year prospective french research axed on tolerance of biotherapies registry. Arthritis Rheum 2009; 60 : 1884–1894.
23. Wallis RS, Broder M, Wong J, Beenhouwer D. Granulomatous infections due to tumor necrosis factor blockade: correction. Clin Infect Dis 2004; 39 : 1254–5.
24. Toussirot E, Streit G, Wendling D. Infectious complications with anti-TNFalpha therapy in rheumatic diseases: a review. Recent Pat Inflamm Allergy Drug Discov 2007; 1 : 39–47.
25. Schiff MH, Burmester GR, Kent JD, Pangan AL, Kupper H, Fitzpatrick SB, et al. Safety analyses of adalimumab (HUMIRA) in global clinical trials and US postmarketing surveillance of patients with rheumatoid arthritis. Ann Rheum Dis 2006; 65 : 889–94.
26. Gómez-Reino JJ, Carmona L, Valverde VR, Mola EM, Montero MD. Treatment of rheumatoid arthritis with tumor necrosis factor inhibitors may predispose to significant increase in tuberculosis risk. Arthritis Rheum 2003; 48 : 2122–7.
27. Carmona L, Gómez-Reino JJ, Rodríguez-Valverde V, Montero D, Pascual-Gómez E, Mola EM, et al. Effectiveness of recommendations to prevent reactivation of latent tuberculosis infection in patients treated with tumor necrosis factor antagonists. Arthritis Rheum 2005; 52 : 1766–72.
28. Lin J, Ziring D, Desai S, Kim S, Wong M, Korin Y, et al. TNFalpha blockade in human diseases: an overview of efficacy and safety. Clin Immunol 2008; 126 : 13–30.
29. Gómez-Reino JJ, Carmona L, Angel Descalzo M; Biobadaser Group. Risk of tuberculosis in patients treated with tumor necrosis factor antagonists due to incomplete prevention of reactivation of latent infection. Arthritis Rheum 2007; 57 : 756–61.
30. Raval A, Akhavan-Toyserkani G, Brinker A, Avigan M. Brief communication: characteristics of spontaneous cases of tuberculosis associated with infliximab. Ann Intern Med 2007; 147 : 699–702.
31. Westhovens R, Yocum D, Han J, Berman A, Strusberg I, Geusens P, et al. The safety of infliximab, combined with background treatments, among patients with rheumatoid arthritis and various comorbidities: a large, randomized, placebo-controlled trial. Arthritis Rheum 2006; 54 : 1075–86.
32. Ponce de León D, Acevedo-Vásquez E, Sánchez-Torres A, Cucho M, Alfaro J, Perich R, et al. Attenuated response to purified protein derivative in patients with rheumatoid arthritis: study in a population with a high prevalence of tuberculosis. Ann Rheum Dis 2005; 64 : 1360–1.
33. Sichletidis L, Settas L, Spyratos D, Chloros D, Patakas D. Tuberculosis in patients receiving anti-TNF agents despite chemoprophylaxis. Int J Tuberc Lung Dis 2006; 10 : 1127–32.
34. Comstock GW. How much isoniazid is needed for prevention of tuberculosis among immunocompetent adults? Int J Tuberc Lung Dis 1999; 3 : 847–50.
35. British Thoracic Society Standards of Care Committee. BTS recommendations for assessing risk and for managing Mycobacterium tuberculosis infection and disease in patients due to start anti-TNF-alpha treatment. Thorax 2005; 60 : 800–5.
36. Menzies D, Pai M, Comstock G. Meta-analysis: new tests for the diagnosis of latent tuberculosis infection: areas of uncertainty and recommendations for research. Ann Intern Med 2007; 146 : 340–54.
37. Pai M, Zwerling A, Menzies D. Systematic review: T-cell-based assays for the diagnosis of latent tuberculosis infection: an update. Ann Intern Med 2008; 149 : 177–84.
38. Villiger PM, Zellweger JP, Möller B. Novel screening tools for latent tuberculosis: time to leave an old friend? Curr Opin Rheumatol 2009; 21 : 238–43.
39. Leyten EM, Arend SM, Prins C, Cobelens FG, Ottenhoff TH, van Dissel JT. Discrepancy between Mycobacterium tuberculosis-specific gamma interferon release assays using short and prolonged in vitro incubation. Clin Vaccine Immunol 2007; 14 : 880–5.
40. Greenberg JD, Reddy SM, Schloss SG, Kurucz OS, Bartlett SJ, Abramson SB, et al. Comparison of an in vitro tuberculosis interferon-gamma assay with delayed-type hypersensitivity testing for detection of latent Mycobacterium tuberculosis: a pilot study in rheumatoid arthritis. J Rheumatol 2008; 35 : 770–5.
41. Vencovský J, Havelková M, Forejtová Š, Jarošová K, Půtová I. Performance of Quantiferon-TB Gold test in screening for latent tuberculosis before and during anti-TNF treatment. Ann Rheum Dis 2007; 66(suppl. II): 194.
42. Vencovsky J, Forejtova S, Jarosova K, Putova I. Prevention of tuberculosis in patients treated with TNF inhibitors. Int J Rheum Dis 2008; 11 (Suppl 1): A116 P1E–05.
43. Matulis G, Jüni P, Villiger PM, Gadola SD. Detection of latent tuberculosis in immunosuppressed patients with autoimmune diseases: performance of a Mycobacterium tuberculosis antigen-specific interferon gamma assay. Ann Rheum Dis 2008; 67 : 84–90.
44. Sellam J, Hamdi H, Roy C, Baron G, Lemann M, Puéchal X, et al. Comparison of in vitro-specific blood tests with tuberculin skin test for diagnosis of latent tuberculosis before anti-TNF therapy. Ann Rheum Dis 2007; 66 : 1610–5.
45. Křepela K. Diagnostika a léčba tuberkulózy dětí a mladistvých v ČR. Pediatr pro Praxi 2007; 8 : 208–210.
46. Křepela K. Dětská tuberkulóza a BCG vakcinace. Vox Pediatriae 2002; 2 : 24–25.
47. Aslanidis S, Pyrpasopoulou A, Douma S, Petidis K. Is it safe to readminister tumor necrosis factor alpha antagonists following tuberculosis flare? Arthritis Rheum 2008; 58 : 327–8.
48. Askling J, Fored CM, Baecklund E, Brandt L, Backlin C, Ekbom A, et al. Haematopoietic malignancies in rheumatoid arthritis: lymphoma risk and characteristics after exposure to tumour necrosis factor antagonists. Ann Rheum Dis 2005; 64 : 1414–20.
49. Baecklund E, Ekbom A, Sparen P, Feltelius N, Klareskog L. Disease activity and risk of lymphoma in patients with rheumatoid arthritis: nested case-control study. BMJ 1998; 317 : 180–81.
50. Baecklund E, Iliadou A, Askling J, Ekbom A, Backlin C, Granath F, et al. Association of chronic inflammation, not its treatment, with increased lymphoma risk in rheumatoid arthritis. Arthritis Rheum 2006; 54 : 692–701.
51. Smitten AL, Simon TA, Hochberg MC, Suissa S. A meta-analysis of the incidence of malignancy in adult patients with rheumatoid arthritis. Arthritis Res Ther 2008; 10: R45.
52. Setoguchi S, Solomon DH, Weinblatt ME, Katz JN, Avorn J, Glynn RJ, et al. Tumor necrosis factor alpha antagonist use and cancer in patients with rheumatoid arthritis. Arthritis Rheum 2006; 54 : 2757–64.
53. Wolfe F, Michaud K. Biologic treatment of rheumatoid arthritis and the risk of malignancy: analyses from a large US observational study. Arthritis Rheum 2007; 56 : 2886–95.
54. Dixon W, Silman A. Is there an association between anti-TNF monoclonal antibody therapy in rheumatoid arthritis and risk of malignancy and servus infection? Commentary on the meta-analysis by Bongartz et al. Arthritis Res Ther 2006; 8 : 111.
55. Matteson EL, Bongartz T, Sutton AJ, Buchan I. Response to commentary by Dixon and Silman on the systematic review and meta-analysis by Bongartz et al. Arthritis Res Ther 2006; 8 : 404.
56. Bongartz T, Warren FC, Mines D, Matteson EL, Abrams KR, Sutton AJ. Etanercept therapy in rheumatoid arthritis and the risk of malignancies. A systematic review and individual patient data meta-analysis of Randomized Controlled Trials. Ann Rheum Dis 2008; Nov 19 [Elektronická publikace před tiskem].
57. Askling J, Fored CM, Brandt L, Baecklund E, Bertilsson L, Feltelius N, et al. Risks of solid cancers in patients with rheumatoid arthritis and after treatment with tumour necrosis factor antagonists. Ann Rheum Dis 2005; 64 : 1421–6.
58. Stone JH, Holbrook JT, Marriott MA, Tibbs AK, Sejismundo LP, Min YI, et al. Solid malignancies among patients in the Wegener‘s Granulomatosis Etanercept Trial. Arthritis Rheum 2006; 54 : 1608–18.
59. Mackey AC, Green L, Liang LC, Dinndorf P, Avigan M. Hepatosplenic T cell lymphoma associated with infliximab use in young patients treated for inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2007; 44 : 265–7.
60. Vasiliauskas EA, Church JA, Silverman N, Barry M, Targan SR, Dubinsky MC. Case report: evidence for transplacental transfer of maternally administered infliximab to the newborn. Clin Gastroenterol Hepatol 2006; 4 : 1255–8.
61. Įstensen M, Lockshin M, Doria A, Valesini G, Meroni P, Gordon C, et al. Update on safety during pregnancy of biological agents and some immunosuppressive anti-rheumatic drugs. Rheumatology (Oxford) 2008; 47 Suppl 3: iii28–31.
62. Vinet E, Pineau C, Gordon C, Clarke AE, Bernatsky S. Biologic therapy and pregnancy outcomes in women with rheumatic diseases. Arthritis Rheum 2009; 61 : 587–92.
63. Carter JD, Valeriano J, Vasey FB. Tumor necrosis factor-alpha inhibition and VATER association: a causal relationship. J Rheumatol 2006; 33 : 1014–7.
64. Carter JD, Ladhani A, Ricca LR, Valeriano J, Vasey FB. A safety assessment of tumor necrosis factor antagonists during pregnancy: a review of the Food and Drug Administration database. J Rheumatol 2009; 36 : 635–41.
65. Koren G, Inoue M. Do tumor necrosis factor inhibitors cause malformations in humans? J Rheumatol 2009; 36 : 465–6.
66. Įstensen M, Eigenmann GO. Etanercept in breast milk. J Rheumatol 2004; 31 : 1017–8.
67. Mahadevan U, Terdiman JP, Aron J, Jacobsohn S, Turek P. Infliximab and semen quality in men with inflammatory bowel disease. Inflamm Bowel Dis 2005; 11 : 395–9.
68. Lin J, Ziring D, Desai S, Kim S, Wong M, Korin Y, Braun J, Reed E, Gjertson D, Singh RR. TNFalpha blockade in human diseases: an overview of efficacy and safety. Clin Immunol 2008; 126 : 13–30.
69. Danila MI, Patkar NM, Curtis JR, Saag KG, Teng GG. Biologics and heart failure in rheumatoid arthritis: are we any wiser? Curr Opin Rheumatol 2008; 20 : 327–33.
70. Avouac J, Allanore Y. Cardiovascular risk in rheumatoid arthritis: effects of anti-TNF drugs. Expert Opin Pharmacother 2008; 9 : 1121–8.
71. Naranjo A, Sokka T, Descalzo MA, Calvo-Alen J, Horslev-Petersen K, Luukkainen R, et al. Cardiovascular disease in patients with rheumatoid arthritis. Results from the QUEST-RA study. Arthritis Res Ther 2008; 10: R30.
72. Saag KG, Teng GG, Patkar NM, Anuntiyo J, Finney C, Curtis JR, et al. American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease-modifying antirheumatic drugs in rheumatoid arthritis. Arthritis Rheum 2008; 59 : 762–84.
73. Williams EL, Gadola S, Edwards CJ. Anti-TNF-induced lupus. Rheumatology (Oxford) 2009; 48 : 716–20.
74. Shakoor N, Michalska M, Harric CA, Block JA. Drug-induced systemic lupus erythematosus associated with etanercept therapy. Lancet 2002; 359 : 579–80.
75. Duchet-Niedziolka P, Coutsinos Z, Hanslik T, Launay O. Anti-TNFalpha therapy and vaccination of adults. Joint Bone Spine 2007; 74 : 563–5.
76. Duchet-Niedziolka P, Launay O, Coutsinos Z, Ajana F, Arlet P, Barrou B, et al. Vaccination in adults with auto-immune disease and/or drug related immune deficiency: results of the GEVACCIM Delphi survey. Vaccine 2009; 27 : 1523–9.
77. Radstake TR, Svenson M, Eijsbouts AM, van den Hoogen FH, Enevold C, van Riel PL, et al. Formation of antibodies against infliximab and adalimumab strongly correlates with functional drug levels and clinical responses in rheumatoid arthritis. Ann Rheum Dis 2008 [Epub ahead of print].
78. Haraoui B, Cameron L, Ouellet M, White B. Anti-infliximab antibodies in patients with rheumatoid arthritis who require higher doses of infliximab to achieve or maintain a clinical response. J Rheumatol 2006; 33 : 31–6.
79. Lequerré T, Vittecoq O, Klemmer N, GoĎb V, Pouplin S, Menard JF, et al. Management of infusion reactions to infliximab in patients with rheumatoid arthritis or spondyloarthritis: experience from an immunotherapy unit of rheumatology. J Rheumatol 2006; 33 : 1307–14.
80. Pham T, Claudepierre P, Deprez X, Fautrel B, Goupille P, Hilliquin P, et al. Clinical tool guide elaborated by the Club Rhumatismes et Inflammations (CRI), section of the French Society of Rheumatology (Société Franćaise de Rhumatologie, SFR). Joint Bone Spine 2005; 72 Suppl 1: S1–58.
81. Phillips K, Weinblatt M. Granulomatous lung disease occurring during etanercept treatment. Arthritis Rheum 2005; 53 : 618–20.
82. Daēen CI, Monnier A, Claudepierre P, Constantin A, Eschard JP, Houvenagel E, et al. Sarcoid-like granulomatosis in patients treated with tumor necrosis factor blockers: 10 cases. Rheumatology (Oxford) 2009 [Epub ahead of print].
83. Ko JM, Gottlieb AB, Kerbleski JF. Induction and exacerbation of psoriasis with TNF-blockade therapy: a review and analysis of 127 cases. J Dermatolog Treat 2009; 20 : 100–8.
84. Scanzello CR, Figgie MP, Nestor BJ, Goodman SM. Perioperative management of medications used in the treatment of rheumatoid arthritis. HSS J. 2006; 2 : 141–7.
85. den Broeder AA, Creemers MC, Fransen J, de Jong E, de Rooij DJ, Wymenga A, et al. Risk factors for surgical site infections and other complications in elective surgery in patients with rheumatoid arthritis with special attention for anti-tumor necrosis factor: a large retrospective study. J Rheumatol 2007; 34 : 689–95.
86. Ciantar M, Adlam DM. Treatment with infliximab: Implications in oral surgery? A case report. Br J Oral Maxillofac Surg 2007; 45 : 507–10.
87. Genovese MC, Breedveld FC, Emery P, Cohen S, Keystone E, Matteson EL, et al. Safety of biologic therapies following rituximab treatment in rheumatoid arthritis patients. Ann Rheum Dis 2009 [Epub ahead of print].
88. Salliot C, Dougados M, Gossec L. Risk of serious infections during rituximab, abatacept and anakinra treatments for rheumatoid arthritis: meta-analyses of randomised placebo-controlled trials. Ann Rheum Dis 2009; 68 : 25–32.
89. Fleischmann RM. Safety of biologic therapy in rheumatoid arthritis and other autoimmune diseases: focus on rituximab. Semin Arthritis Rheum 2009; 38 : 265–80.
90. Popa C, Leandro MJ, Cambridge G, Edwards JC. Repeated B lymphocyte depletion with rituximab in rheumatoid arthritis over 7 yrs. Rheumatology (Oxford).
91. Fukushima N, Mizuta T, Tanaka M, Yokoo M, Ide M, Hisatomi T, et al. Retrospective and prospective studies of hepatitis B virus reactivation in malignant lymphoma with occult HBV carrier. Ann Oncol 2009. [Epub ahead of print].
92. Ziakas PD, Karsaliakos P, Mylonakis E. Effect of prophylactic lamivudine for chemotherapy-associated hepatitis B reactivation in lymphoma: a meta-analysis of published clinical trials and a decision tree addressing prolonged prophylaxis and maintenance. Haematologica 2009; 94 : 998–1005.
93. Oren S, Mandelboim M, Braun-Moscovici Y, Paran D, Ablin J, Litinsky I, et al. Vaccination against influenza in patients with rheumatoid arthritis: the effect of rituximab on the humoral response. Ann Rheum Dis 2008; 67 : 937–41.
94. Įstensen M, Förger F. Management of RA medications in pregnant patients. Nat Rev Rheumatol 2009; 5 : 382–90.
95. Carson KR, Evens AM, Richey EA, Habermann TM, Focosi D, Seymour JF, et al. Progressive multifocal leukoencephalopathy after rituximab therapy in HIV-negative patients: a report of 57 cases from the Research on Adverse Drug Events and Reports project. Blood 2009; 113 : 4834–40.
96. Dass S, Vital EM, Emery P. Development of psoriasis after B cell depletion with rituximab. Arthritis Rheum 2007; 56 : 2715–8.
97. Mielke F, Schneider-Obermeyer J, Dörner T. Onset of psoriasis with psoriatic arthropathy during rituximab treatment of non-Hodgkin lymphoma. Ann Rheum Dis 2008; 67 : 1056–7.
98. Cohen JD. Successful treatment of psoriatic arthritis with rituximab. Ann Rheum Dis 2008; 67 : 1647–8.
99. Wagner SA, Mehta AC, Laber DA. Rituximab-induced interstitial lung disease. Am J Hematol 2007; 82 : 916–9.
100. Voog E, Morschhauser F, Solal-Céligny P. Neutropenia in patients treated with rituximab. N Engl J Med 2003; 348 : 2691–4. 2007; 46 : 626–30.
101. Pham T, Fautrel B, Gottenberg JE, Goupille P, Hachulla E, Masson C, et al. Rituximab (MabThera) therapy and safety management. Clinical tool guide. Joint Bone Spine 2008; 75 (Suppl 1): S1–99.
102. Genovese MC, Schiff M, Luggen M, Becker JC, Aranda R, Teng J, et al. Efficacy and safety of the selective co-stimulation modulator abatacept following 2 years of treatment in patients with rheumatoid arthritis and an inadequate response to anti-tumour necrosis factor therapy. Ann Rheum Dis 2008; 67 : 547–54.
1 03. Pham T, Claudepierre P, Constantin A, Fautrel B, Gossec L, Gottenberg JE, et al. Abatacept therapy and safety management. Joint Bone Spine 2009; 76 Suppl 1: S3–S55.
104. Simon TA, Smitten AL, Franklin J, Askling J, Lacaille D, Wolfe F, et al. Malignancies in the rheumatoid arthritis abatacept clinical development program: An epidemiological assessment. Ann Rheum Dis 2008 [Epub ahead of print].
105. Tay L, Leon F, Vratsanos G, Raymond R, Corbo M. Vaccination response to tetanus toxoid and 23-valent pneumococcal vaccines following administration of a single dose of abatacept: a randomized, open-label, parallel group study in healthy subjects. Arthritis Res Ther 2007; 9: R38.
106. Koike R, Harigai M, Atsumi T, Amano K, Kawai S, Saito K, et al. Japan College of Rheumatology 2009 guidelines for the use of tocilizumab, a humanized anti-interleukin-6 receptor monoclonal antibody, in rheumatoid arthritis. Mod Rheumatol 2009 Jul 10, v tisku.
107. Mann H. Interleukin 6 u revmatických onemocnění. Čes. Revmatol 2009; 17 : 30–35.
108. http: //www.roactemra.com/portal/eipf/pb/actemra/roactemra/safety_and_tolerability
109. Smolen JS, Beaulieu A, Rubbert-Roth A, Ramos-Remus C, Rovensky J, Alecock E, et al. Effect of interleukin-6 receptor inhibition with tocilizumab in patients with rheumatoid arthritis (OPTION study): a double-blind, placebo-controlled, randomised trial. Lancet 2008; 371(9617): 987–97.
110. Hirao M, Hashimoto J, Tsuboi H, Nampei A, Nakahara H, Yoshio N, et al. Laboratory and febrile features after joint surgery in patients with rheumatoid arthritis treated with tocilizumab. Ann Rheum Dis 2009; 68 : 654–7.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek Vzdělávací akce IPVZ
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2009 Číslo 3- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Konkomitující fibromyalgie u pacientů s revmatoidní artritidou
- Rituximab v rukou nefrologa – první zkušenosti
- Péče o pacienty se zlomeninou horního konce stehenní kosti. I. Ortopedická péče. Doporučené postupy České revmatologické společnosti a Společnosti pro metabolická onemocnění skeletu
- Bezpečnost biologické léčby – doporučení České revmatologické společnosti
- Současný pohled na etiopatogenezi fibromyalgie
- Vaskulární endotelový růstový faktor u zánětlivých revmatických nemocí
- Akcelerovaná ateroskleróza u systémového lupus erythematodes
- Vzdělávací akce IPVZ
- Informace České revmatologické společnosti ČLS JEP
- VIII. Slapské symposium Měřín
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Péče o pacienty se zlomeninou horního konce stehenní kosti. I. Ortopedická péče. Doporučené postupy České revmatologické společnosti a Společnosti pro metabolická onemocnění skeletu
- Vaskulární endotelový růstový faktor u zánětlivých revmatických nemocí
- Konkomitující fibromyalgie u pacientů s revmatoidní artritidou
- Bezpečnost biologické léčby – doporučení České revmatologické společnosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



