-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Akcelerovaná ateroskleróza u systémového lupus erythematodes
Accelerated atherosclerosis in systemic lupus erythematosus
Accelerated atherosclerosis (ATS) in connective tissue diseases is a very serious late disease-related complication. In systemic lupus erythematosus (SLE), the risk of ATS is sevenfold increased in comparison to an age-matched healthy population, and comparable to Cushing’s syndrome (e.g. more than threefold increased in comparison to diabetes mellitus). It is therefore important to pay attention to primary, as well as secondary prevention. An inflammatory process involving the vascular wall, presence of some specific antibodies, dyslipidemia, endothelial dysfunction, and an increased appearance of traditional risk factors play a significant role in the pathophysiology of ATS. The existence of these factors has various causes; they result from the autoimmune character of SLE, with participation of the used therapy. High cumulative doses of glucocorticoids, and cyclosporin A have a negative effect on ATS, whereas antimalarial drugs, mycophenolate mofetil, or some new biological agents have a protective effect. Accelerated atherosclerosis in SLE is a very complex and complicated process, and deserves sufficient attention, especially since the consequences of ATS significantly participate in the morbidity and mortality of SLE.
Key words:
accelerated atherosclerosis, systemic lupus erythematosus, dyslipidemia, glucocorticoids, cyclosporin A, antimalarial drugs
Autoři: A. Smržová; P. Horák; M. Skácelová; H. Ciferská
Působiště autorů: III. interní klinika FN a LF UP Olomouc
Vyšlo v časopise: Čes. Revmatol., 17, 2009, No. 3, p. 173-178.
Kategorie: Přehledné referáty
Souhrn
Akcelerovaná ateroskleróza (ATS) u systémových onemocnění pojiva je velice závažná pozdní komplikace choroby. U systémového lupus erythematodes (SLE) je její riziko až sedminásobně vyšší ve srovnání s běžnou populací stejného věku a je srovnatelné s Cushingovým syndromem (např. až více než trojnásobně vyšší než u diabetes mellitus). Proto je důležité věnovat pozornost prevenci jak primární, tak sekundární. V patofyziologii ATS hraje významnou roli zánětlivý proces postihující stěnu cév, přítomnost některých specifických protilátek, dyslipidémie, dysfunkcí endotelu a vyšší zastoupení tradičních rizikových faktorů. Příčiny existence těchto faktorů jsou různé, vyplývají z autoimunitního charakteru SLE, podílí se na nich používaná terapie. Negativní vliv na ATS mají vysoké kumulativní dávky glukokortikoidů, cyklosporin A, naopak protektivně působí antimalarika, mykofenolát mofetil či některé nové biologické preparáty. Akcelerovaná ateroskleróza u SLE je děj velmi komplexní a složitý a zasluhuje si dostatečnou pozornost zvláště k výraznému podílu následků ATS na morbiditě a mortalitě SLE.
Klíčová slova:
akcelerovaná ateroskleróza, systémový lupus erythematodes, dyslipidémie, glukokortikoidy, cyklosporin A, antimalarikaÚvod
Systémový lupus erythematodes (SLE) je autoimunitní onemocnění postihující řadu orgánových systémů, kardiovaskulární nevyjímaje. V polovině 20. století bylo toto onemocnění spojeno s velmi špatnou prognózou a vysokou mortalitou. Léčba nemocných se SLE během posledních desetiletí však pokročila, 5leté přežití nemocných nyní činí více než 90 % (1). Morbidita i mortalita přesunuly své těžiště do pozdějších fází choroby. Rovněž nízký věk pacientů a manifestace onemocnění nejčastěji mezi 15. až 40. rokem věku vyžaduje předvídavý postoj lékaře směrem k možným komplikacím choroby i nežádoucímu vlivu terapie (1). Mezi nejčastější příčiny úmrtí patří vysoká aktivita choroby, infekční komplikace a kardiovaskulární postižení, mimo jiné následky akcelerované aterosklerózy (ATS) (2, 3, 4, tab. 1).
Tab. 1. Příčiny úmrtí u SLE ve třech epidemiologických studiích. 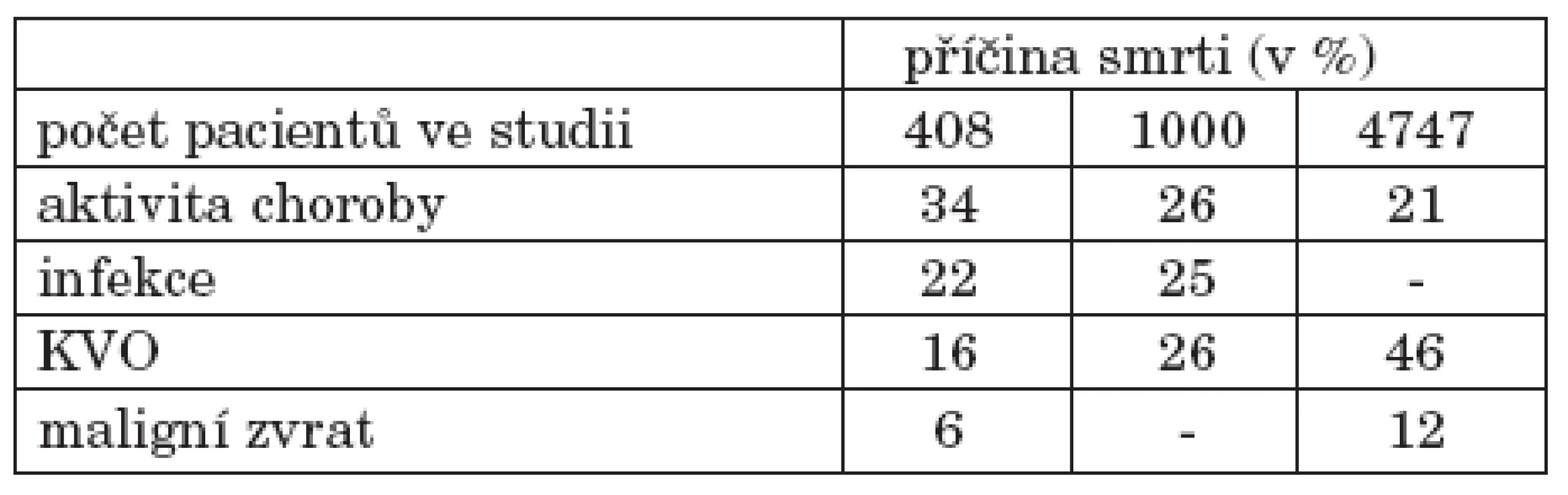
Kardiovaskulární onemocnění u SLE (KVO)
Kardiovaskulární postižení je v rámci SLE velmi rozmanité. Je přítomno až u 50 % nemocných (5). Nejčastěji je přítomna perikarditida, dále chlopenní vady jako je mitrální regurgitace či Libman-Sacksova endokarditida (6, 7), myokarditida, převodní poruchy (zvláště AV blokáda 1. stupně) a arteriální hypertenze. V menší míře se vyskytuje také plicní hypertenze a koronární arteritida (8). Žilní trombóza v přímé souvislosti se SLE se vyskytuje asi v 10 % (9). I přes zpočátku většinou asymptomatický průběh se kardiovaskulární postižení projeví zvýšenou morbiditou i mortalitou nemocných. Některé typy postižení kardiovaskulárního systému jsou spojeny s přítomností specifických protilátek. Až 78 % pacientů s KVO má pozitivitu antifosfolipidových protilátek, zvláště se pak vyskytují ve spojitosti s Libman-Sacksovou endokarditidou, mitrální regurgitací, trombembolickou chorobou a plicní hypertenzí (10). Atrioventrikulární blokády u dětí s lupus neonatorum se naopak častěji pojí s pozitivitou anti-Ro/SSA a anti-La/SSB autoprotilátek.
Akcelerovaná ateroskleróza
Diagnostika a léčebné ovlivnění akcelerované aterosklerózy u SLE nabývá na významu vzhledem k prodloužení doby přežívání nemocných. ATS se mnohdy manifestuje i před 40. rokem věku a to nejčastěji anginou pectoris, infarktem myokardu či náhlou smrtí (11).
Epidemiologie
Prevalence ATS u SLE se nachází při bioptických nálezech až v 54 % případů (12). Relativní riziko (RR) akcelerované ATS u SLE je 7,1, u mladých žen se SLE je RR až 50krát vyšší než u zdravé populace stejného věku a relativní riziko infarktu myokardu a cévní mozkové příhody je 2,27 resp. 2,05 vyšší. Rovněž městnavá choroba srdeční se projevuje až 3,8krát častěji (11).
Ve srovnání četnosti výskytu ATS s jinými autoimunitními chronickými chorobami se SLE řadí na přední pozice. Riziko ATS je u SLE dokonce vyšší než u diabetes mellitus a je téměř srovnatelné s Cushingovým syndromem (12, 13, 14, 15 graf 1).
Graf 1. Relativní riziko aterosklerózy u vybraných revmatických a metabolických chorob. 
Patofyziologie ATS u SLE
ATS je komplexní proces s významným podílem zánětlivých mechanismů, které zahrnují aktivaci imunitních buněk, tvorbu plaku a nakonec jeho rupturu. U SLE se v rámci patogeneze ATS uplatňují jak tradiční rizikové faktory, tak specifika tohoto autoimunitního onemocnění a někdy také nežádoucí účinek imunosupresivní léčby. Tradiční rizikové faktory spojené s rozvojem ATS jako diabetes mellitus, hyperlipidémie, arteriální hypertenze, abdominální obezita, předčasná menopauza, sedavý způsob života či dyslipidémie se zvýšenými low density lipoproteins (LDL) a triglyceridy (TG) jsou u SLE také četnější než v běžné populaci (16). Až 32 % nemocných se SLE má vyjádřen metabolický syndrom (17). ATS je u SLE však častější, než odpovídá prevalenci zmiňovaných obecných rizikových faktorů. Ze studie, která srovnávala pacienty se SLE s různým stupněm ATS, vyplývá, že u nemocných s nevýznamně rozdílnými tradičními rizikovými faktory, protilátkovou aktivitou, orgánovým postižením či kumulativními dávkami imunosupresiv byl signifikantní rozdíl v tíži postižení tepen aterosklerózou, a to v závislosti na délce trvání choroby a její klinické aktivitě (hodnoceno indexy aktivity choroby a kumulativního postižení SLEDAI, SLICC-ACR). Také se zde projevila rozdílnost hladin vysoce senzitivního (high sensitivity) C-reaktivního proteinu (hsCRP), který je rovněž v běžné populaci považován za velmi silný indikátor kardiovaskulárního rizika (18). U SLE byly také prokázány vyšší hladiny homocysteinu, a to v závislosti na stabilitě či progresi aterosklerotického plátu, kdy stabilní plát vykazoval proti nestabilnímu nižší, ačkoliv stále nadnormální expresi homocysteinu. Homocystein se zdá být u SLE dobrým prediktorem progrese ATS (19).
Imunokomplexy
Lze tedy usuzovat na existenci dalších specifických faktorů rozvoje aterosklerózy u SLE. Chronický autoimunitní zánětlivý proces zprostředkovaný depozicemi imunokomplexů v cévním endotelu může způsobovat mikrotraumata a umožňuje tak zvýšenou kumulaci cholesterolu ve vznikajícím plátu. Imunokomplexy se váží na endoteliální receptory a zvyšují vazbu adhezivních molekul (E-selectin, ICAM-1, VCAM-1) na makrofágy a T lymfocyty a umožňují vstup lipoproteinů do endotelu cév. Do tohoto mechanismu také zasahují heat shock proteins, zvláště 60 a 65, které jsou exprimovány endotelem jako reakce na buněčný stres vyvolaný např. dyslipidémií, arteriální hypertenzí, ale také toxiny tabákového kouře (20).
Další charakteristikou zánětlivého procesu u SLE je vazba kostimulačních molekul CD40 a CD40L při prezentaci antigenu aktivovanými T a B buňkami, která je důležitým faktorem odpovědným za tvorbu autoprotilátek. Exprese CD40L je oproti fyziologickému stavu u SLE zvýšená, a to zvláště při lupusové nefritidě. CD40L dále stimuluje expresi adhezivních molekul a následně opět zvýšený vstup lipoproteinů do cévního endotelu.
Protilátky
U části nemocných se na vzniku ATS podílejí antifosfolipidové protilátky, rozeznávající fosfolipidové struktury fosfolipoproteinů (jako kardiolipin, beta-2-glykoprotein I a protrombin) a vytvářející s nimi komplexy. Fosfatidylcholin, nejčastější součást buněčných membrán, je hydrolyzován fosfolipázou A2 na lysofosfatidylcholin a je následně zodpovědný za vznik oxidovaných LDL jako výrazné proaterogenní komponenty ATS plátů. U SLE je exprese fosfolipázy A2 zvýšena stejně jako koncentrace oxLDL a lysofosfatidylcholinu (21).
Dyslipoproteinémie
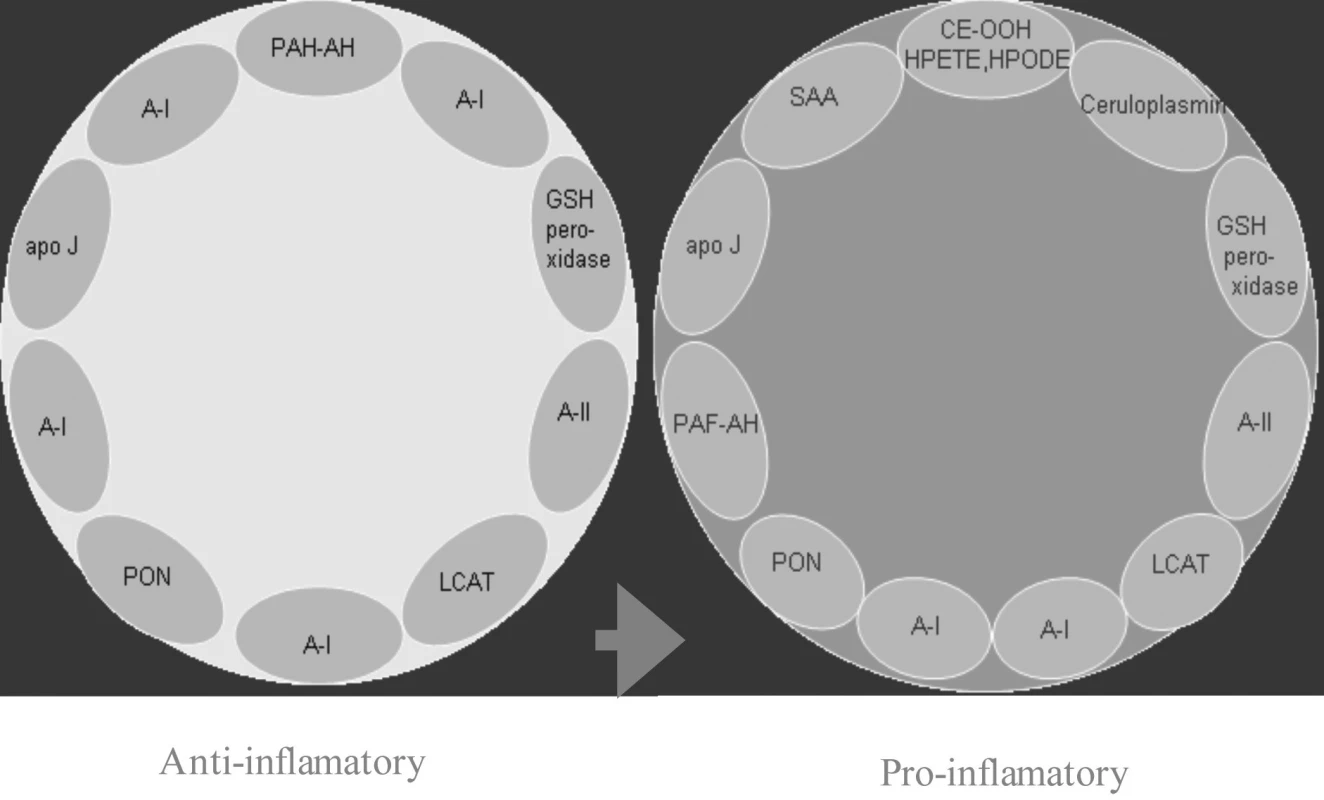
U SLE je v lipidovém profilu podobná situace jako u pacienta bez chronické autoimunitní choroby s vysokým aterogenním rizikem, bývá tak často zvýšená hladina celkového cholesterolu, zvláště LDL a VLDL a hodnoty triglyceridů mohou být elevovány. Navíc je však pro dyslipoproteinémi přítomnou až u 50 % nemocných se SLE typické snížení protektivního HDL, který je redukovaný až u 79 % aktivních nemocných a u 29 % pacientů v remisi choroby a nárůst hladin tzv. proaterogenní forma HDL (22, obr. 1). Tento typ HDL molekul vzniká na podkladě nízkých titrů apolipoprotienu A1 zejména u nemocných s antikardiolipinovými protilátkami (23) a dobře koreluje s hladinou anti ds DNA protilátek (24).
Bývá rovněž snížená aktivita paraoxonázy jako blokátoru prozánětlivého účinku oxLDL. Nízká aktivita parooxonázy je spojena s přítomností protilátek proti HDL a beta2glykoproteinu-1 zvláště u antifosfolipidového syndromu (25).
Endoteliální dysfunkce
Jedním z dalších faktorů rozvoje aterosklerózy u SLE je dysfunkce endotelu cév. Vzniká na podkladě hemodynamických změn v cévách s mechanickým endoteliálním poškozením a aktivací destiček, působení cytokinů, glykací buněčných lipoproteinů, toxickým agens či modifikací endotelu. Zvýšená exprese interferonu alfa způsobuje abnormální reparaci endotelu a angiogenních buněk (26). Následné vyšší hladiny modifikovaného dimethylarginin a inhibitoru aktivátoru plasminogenu pak dobře korelují s přítomností endoteliální dysfunkce u SLE (27).
Klinický průběh
Klinický průběh je často asymptomatický s následnými ireverzibilními změnami, dále se může ATS projevovat typicky jako ischemická či tromboembolická cévní mozková příhoda, ischemická choroba srdeční či jako ischemická choroba dolních končetin. Její projevy mohou být také značně heterogenní a atypické. Podle některých studií se u pacientů se u SLE s nespecifickými symptomy jako např. dyspnoe objevuje až ve 43 % těžký stupeň ATS s přítomností kalcifikací či plátů (28).
Diagnostika
Symptomatický klinický průběh se projevuje typickými projevy aterosklerózy v různých lokalizacích. Závažnost prognózy aterosklerózy u SLE, patrná z epidemiologických trendů zvyšující se morbidity a mortality akcelerované ATS, však klade požadavky na včasnou diagnostiku i subklinických či atypických forem. EKG a echokardiografie nejsou dostatečně senzitivní a specifické. Určité možnosti včasné diagnostiky nabízí dopplerometrické metody měření tloušťky intimy medie (intima-media thickness – IMT) a hodnocení ankel-brachial indexu (ABI). Podle některých dat se abnormální ABI vyskytuje až u 26,4 % nemocných se SLE a z klinických ukazatelů dobře koreluje s délkou trvání choroby (29). Dopplerometrie krčních tepen měří průtok tepnou a IMT. U pacientů se SLE je hodnota IMT vyšší až ve 37 % a je asociovaná s lupusovou nefritidou, snížením komplementu a užíváním některých imunosupresiv (30). Lze použít i některé invazivní či zobrazovací metody, jako například SPECT s hodnocením kalciového skóre či koronarografii. Počítačovou tomografií lze detekovat kalcifikace koronárních arterií, ty se pak vyskytují u SLE u 28–31 % oproti 9 % u zdravých kontrol (31).
V laboratorní diagnostice je třeba zaměřit pozornost na stanovení hladin anti dsDNA protilátek, cirkulujících imunokomplexů a hladin složek komplementu, zvláště snížení C3 složky komplementu (25), které korelují se stupněm aterosklerózy. Také anti Sm protilátky jsou častěji spojeny s ATS (32). Z nespecifických markerů aktivity zánětu jsou přítomny již výše zmíněné úzké korelace hsCRP či homocysteinu.
Nezbytné je rovněž zhodnocení kompletního lipidogramu včetně apoA a apoB, posouzení ledvinných funkcí, přítomnost nefrotického syndromu či závažné hypoalbuminémie. Pro posouzení rizika aterogeneze je také třeba vyšetřit profil antifosfolipidových protilátek. Mezi elektivní markery endotelového postižení pak patří ICAM-1, VCAM-1, trombomodulin, PAI, tPA, či von Wilebrandův faktor.
Vliv imunosupresiv na ATS u SLE a její terapie
Léky podávané za účelem kontroly zánětlivé aktivity lupusu na jedné straně působí z hlediska aterosklerózy protektivně, na druhé straně některé z nich hrají negativní roli v rozvoji rizikových faktorů ATS, zvláště dyslipidémie. Z tohoto vyplývá, že volba medikace je velmi důležitá pro dlouhodobé přežití nemocných a je nutné pečlivě titrovat co možná nejnižší udržovací dávku rizikových léků v době remise choroby.
Základem každé terapie by mělo být seznámení pacienta s charakterem onemocnění, riziky krátkodobými jakož i dlouhodobými, dále vysvětlení režimových opatření a případných omezení v životě nemocného, včetně prevence tradičních rizikových faktorů ATS. Ze starších studií vyplývá nedostatečná informovanost nemocných o své chorobě, kdy až 87 % pacientů nevědělo o vysokém kardiovaskulárním riziku u SLE (33). K dobré compliance pacienta také přispívá nastínění možných nežádoucích účinků užitých imunosupresivní i ostatních léků.
Proaterogenně působící imunosupresiva jsou především glukokortikoidy a cyklosporin A.
Glukokortikoidy hrají v terapii SLE zásadní roli. Jejich vliv na akcelerovanou aterosklerózu není jednoznačný. Na jedné straně stojí jejích pozitivní vliv na útlum aktivity choroby, na druhou stranu zásadně zasahují do lipidového spektra včetně oxidace lipoproteinů přes inhibici NO-syntetázy či indukci periferní inzulinové rezistence a výrazně tedy zvyšují i tradiční rizikové faktory. Na velkých počtech pacientů byl prokázán nárůst kardiovaskulárních onemocnění ve srovnání s probandy, kteří glukokortikoidy neužívali (byla stanovena riziková dávka prednisonu ≥ 7,5 mg denně déle než šest měsíců, či jeho ekvivalent), kdy riziko se zvyšovalo více než 2,5krát (34, 35, tab. 2). Zároveň byl prokázán vliv mezi dávkou (zvláště pak kumulativní dávkou) a délkou užívání glukokortikoidů a ve vztahu k nárůstu výskytu KVO. Také kontinuální podávání oproti intermitentní např. pulzní aplikaci glukokortikoidů má negativnější efekt na ATS. Na druhé straně při užívání dávky nižší než 7 mg prednisonu nebyla prokázán rozdíl v hodnotách IMT karotických tepen (jako prediktoru subklinické ATS) ve srovnání s pacienty neužívající glukokortikoidy (36).
Tab. 2. Negativní účinek glukokortikoidů na vybrané kardiovaskulární parametry. 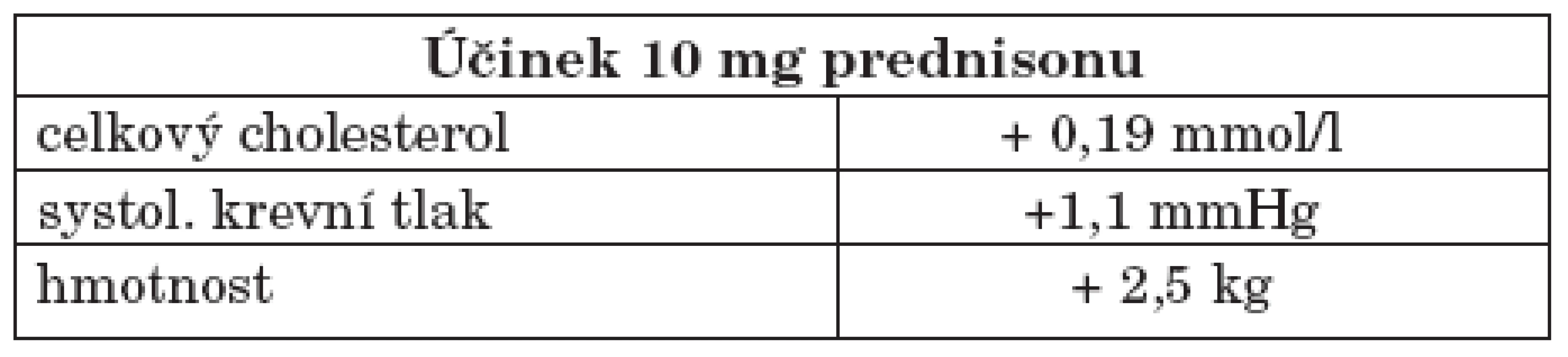
Cyklosporin A se v terapii SLE používá sice méně než v transplantační medicíně, ale zejména nemocní s membranózními typy glomerulonefritid mají z jeho podávání značný benefit. Jako kalcineurinový blokátor zvyšuje výskyt arteriální hypertenze na podkladě vasokostrikce aferentních renálních arteriol, zasahuje do metabolismu lipidů a purinů, signifikantně zvyšuje agregabilitu krevních destiček (37).
Antimalarika, zvláště hydroxychlorochin, mají protektivní vliv na vznik ATS. Mechanismus pozitivního účinku není detailně znám, předpokládá se především jejich antiagregační efekt (38). Rovněž mají pozitivní vliv na arteriální hypertenzi či dyslipidémii, kdy pacienti užívající antimalarika mají až o 11% nižší hodnoty celkového cholesterolu než nemocní bez antimalarické terapie. Také snižují glukokortikoidy indukovanou dyslipidémii a byly zjištěny i nižší hodnoty IMT u pacientů léčených antimalariky (38, 39).
Mykofenolát mofetil se v terapii lupusu zatím neužívá zcela běžně, proto nejsou dostatečně velké studie hodnotící jeho aterosklerotické účinky u SLE, v transplantologii jsou však patrné pozitivní účinky na inhibici vaskulární rejekce orgánu, zvláště ledvin a srdce (40). Jeho účinek při léčbě lupusové nefritidy (vliv na stabilizaci renálních funkcí, snížení proteinurie) rovněž působí z hlediska rozvoje aterosklerózy protektivně.
Užívání dalších imunosupresiv je spjato s projektivním účinkem na ATS. Mezi tato farmaka patří methotrexate a cyklofosfamid (41), účinky azathioprinu se z hlediska ATS zdají být neutrální.
Z rozvíjející se biologické léčby u SLE potencionálně antiateroskleroticky působí rituximab s dobrým účinkem na zlepšení profilu dyslipidémie, což je dobře dokumentované u revmatoidní artritidy (42). Podobný účinek je prokázán u anti CD 22 a CD 40 preparátů (43).
Závěr
Akcelerovaná ateroskleróza u SLE je složitý proces. K zabránění jejích následků pro nemocné se SLE je důležitá předvídavost a vhodné vybrání druhu terapie či případné kombinace preparátů a titrace dávek glukokortikoidů. Je důležité pravidelné sledování rizikových faktorů rozvoje aterosklerózy a adekvátní terapeutický zásah zvláště u dyslipidémie, lupusové nefritidy a arteriální hypertenze.
prezentace problematiky na Třeboňských revmatologických dnech 2009
MUDr. Andrea Smržová
III. interní klinika FN a LF UP Olomouc
I.P. Pavlova 6
772 00 Olomouc
e-mail: andrea.smrzova@atlas.cz
Zdroje
1. Cervera R, Khamashta MA, Font J, et al. Morbidity and mortality in systemic lupus erythematosus during a 10-year period: a comparison of early and late manifestations in a cohort of 1,000 patients. Medicine (Baltimore) 2004; 83 : 1–17.
2. Ward MM, Pyun E, Studenski S. Causes of death in SLE. Long-term followup of an inception cohort. Arthritis Rheum 1995; 38 : 1492–9.
3. Cervera R, Khamashta MA, Font J, et al. Morbidity and mortality in systemic lupus erythematosus during a 10-year period: a comparison of early and late manifestations in a cohort of 1,000 patients. Medicine (Baltimore) 2003; 82 : 299–308.
4. Bjornadal L, Yin L, Granath F, et al. Cardiovascular disease a hazard despite improved prognosis in patients with systemic lupus erythematosus: results from a Swedish population based study 1964–95. J Rheumatol 2004; 31 : 713–9.
5. Moder KG, Miller TD, Tazellar HD. Cardiac involvement in systemic lupus erythematosus. Mayo Clin Proc 1999; 74 : 275–84.
6. Evangelopoulos ME, Alevizaki M, Toumanidis S, et al. Mitral valve prolapse in systemic lupus erythematosus patients: clinical and immunological aspects. Lupus 2003; 12 : 308–311.
7. Moyssakis I, Tektonidou MG, Vasilliou VA, et al. Libman-Sacks endocarditis in systemic lupus erythematosus: prevalence, associations, and evolution. Am J Med 2007; 120 : 636–42.
8. Wallace JD., Hahn BH. DuboisęLupus erythematosus 2007; 663–677.
9. Calvo-Alen, J, Toloza, SM, Fernandez, M, et al. Systemic lupus erythematosus in a multiethnic US cohort (LUMINA). XXV. Smoking, older age, disease activity, lupus anticoagulant, and glucocorticoid dose as risk factors for the occurrence of venous thrombosis in lupus patients. Arthritis Rheum 2005; 52 : 2060–8.9.
10. Farzaneh-Far A, Roman MJ, Lockshin MD, et al. Relationship of antiphospholipid antibodies to cardiovascular manifestations of systemic lupus erythematosus. Arthritis Rheum 2006; 54 : 3918–25.
11. Wallace JD, Hahn BH. DuboisęLupus erythematosus 2007; 670–671. 111.
12. Urowitz MB, et al. Atherosclerotic vascular events in a single large lupus cohort: Prevalence and risk factors. J Rheumatol 2007; 34 : 70–5.
13. Wei L, et al. Taking glucocorticoids by prescription is associated with subsequent cardiovascular disease. Ann Intern Med 2004; 141 : 764–70.
14. Almdal T, et al. The independent effect of type 2 diabetes mellitus on ischemic heart disease, stroke, and death. Arch Intern Med 2004; 164 : 1422–26.
15. Denny MF, Thacker S, Mehta H, et al. Interferon-alpha promotes abnormal vasculogenesis in lupus: a potential pathway for premature atherosclerosis. Blood 2007; 110 : 2907–15.
16. Chung CP, Avalos I, Oeser A, et al. High prevalence of the metabolic syndrome in patients with systemic lupus erythematosus: association with disease characteristics and cardiovascular risk factors. Ann Rheum Dis 2007; 66 : 1542–43.
17. Jimenez S. at al, Preclinical vascular disease in SLE a primary AS. Rheumatology 2005; 44 : 756–761.
18. Roman MJ, Crow MK, Lockshin MD, et al. Rate and determinants of progression of atherosclerosis in systemic lupus erythematosus. Arthritis Rheum 2007; 56 : 3412–19.
19. Wallace JD, Hahn BH. DuboisęLupus erythematosus 2007; 663–665.
20. Manzi S, et al. Inflammation-mediated rheumatic diseases and atherosclerosis. Ann Rheum Dis 2000; 59 : 321–325.
21. Wallace JD, Hahn BH. DuboisęLupus erythematosus 2007; 3591.
22. Vuilleumier N, Reber G, James R, Burger D, de Moerloose P, Dayer JM, Roux-Lombard P. Presence of autoantibodies to apolipoprotein A-1 in patients with acute coronary syndrome further links autoimmunity to cardiovascular disease. J Autoimmun 2004; Dec; 23(4): 353–60.
23. Zhang CY, Lu LJ, et al. People‘s Republic of China. Evaluation of risk factors that contribute to high prevalence of premature atherosclerosis in Chinese premenopausal systemic lupus erythematosus patiens. J Clin Rheumatol 2009 Apr;15(3): 111–6.
24. Petri M. Thrombosis and systemic lupus erythematosus: the Hopkins Lupus Cohort perspective. Scand J Rheumatol 1996; 25 : 191–3.
25. Bruce IN, Urowitz MB, Gladman DD, et al. Risk factors for coronary heart disease in women with systemic lupus erythematosus: the Toronto Risk Factor Study. Arthritis Rheum 2003; 349 : 2399–406.
26. Bultink IE, Teerlink T, Heijst JA, et al. Raised plasma levels of asymmetric dimethylarginine are associated with cardiovascular events, disease activity, and organ damage in patients with systemic lupus erythematosus. Ann Rheum Dis 2005; 64 : 1362–65.
27. Sun SS, Shiau YC, Tsai SC, et al. The role of technetium-99m sestamibi myocardial perfusion single-photon emission computed tomography (SPECT) in the detection of cardiovascular involvement in systemic lupus erythematosus patients with non-specific chest complaints. Rheumatology (Oxford) 2001; 40 : 1106–11.
28. Asanuma Y, et al. Premature coronary-artery atherosclerosis in systemic lupus erythematosus. N Engl J Med 2003; 349 : 2407–15.
29. Thompson T, et al. Progression of carotid intima-media thickness and plaque in women with systemic lupus erythematosus. Arthritis Rheum 2008; 58 : 835–42.
30. Manger K, Kusus M, Forster, C, et al. Factors associated with coronary artery calcification in young female patients with SLE. Ann Rheum Dis 2003; 62 : 846–50.
31. Kiani AN, Mahoney JA, Petri M. Asymmetric dimethylarginine is a marker of poor prognosis and coronary calcium in systemic lupus erythematosus. J Rheumatol 2007 Jul; 34(7): 1502–5.
32. Petri M, Spence D, Bone LR, Hochberg MC. Coronary artery disease risk factors in the Johns Hopkins Lupus Cohort: prevalence, recognition by patients, and preventive practices. Medicine (Baltimore) 1992; 71 : 291–302.
33. Wei L, MacDonald TM, Walker BR. Taking glucocorticoids by prescription is associated with subsequent cardiovascular disease. Ann Intern Med 2004; 141 : 764.
34. Lee AB, et al. Traditional risk factor assessment does not capture the extent of cardiovascular risk in systemic lupus erythematosus. Intern Med J 2006; 36 : 237.
35. Hafström I, Rohani M, Deneberg S, Wörnert M, Jogestrand T, FrostegĆrd J. Effects of low-dose prednisolone on endothelial function, atherosclerosis, and traditional risk factors for atherosclerosis in patients with rheumatoid arthritis a randomized study. J Rheumatol 2007; Sep; 34(9): 1810–6.
36. Małyszko J, Małyszko JS, Takada A, Myśliwiec M. Effects of immunosuppressive drugs on platelet aggregation in vitro. Ann Transplant 2002; 7(1): 55–68.
37. Rahman P, Gladman DD, Urowitz MB, et al. The cholesterol lowering effect of antimalarial drugs is enhanced in patients with lupus taking corticosteroid drugs. J Rheumatol 1999; 26 : 325–30.
38. Belizna CC, Richard V, Primard E, Kerleau JM, Cailleux N, Louvel JP, Marie I, Hamidou M, Thuillez C, Lévesque H. Early atheroma in primary and secondary antiphospholipid syndrome: an intrinsic finding. Semin Arthritis Rheum 2008; Jun; 37(6): 373–80.
39. Gibson WT, Hayden MR. Centre for Molecular Medicine and Therapeutics, Child and Mycophenolate mofetil and atherosclerosis: results of animal and human studies. Ann N Y Acad Sci 2007 Sep; 1110 : 209–21.
40. Roman MJ, Shanker BA, Davis A, et al. Prevalence and correlates of accelerated atherosclerosis in systemic lupus erythematosus. N Engl J Med 2003; 349 : 2399–406.
41. Kerekes G, Soltész P, Dér H, Veres K, Szabó Z, Végvári A, Szegedi G, Shoenfeld Y, Szekanecz Z. Effects of rituximab treatment on endothelial dysfunction, carotid atherosclerosis, and lipid profile in rheumatoid arthritis. Clin Rheumatol 2009; Jun; 28(6): 705–10, Epub 2009 Mar 25.
42. Sidiropoulos PI, Siakka P, Pagonidis K, Raptopoulou A, Kritikos H, Tsetis D, Boumpas DT. Sustained improvement of vascular endothelial function during anti-TNFalpha treatment in rheumatoid arthritis patients. Scand J Rheumatol 2009 Jan-Feb; 38(1): 6–10.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek Vzdělávací akce IPVZ
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2009 Číslo 3- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Konkomitující fibromyalgie u pacientů s revmatoidní artritidou
- Rituximab v rukou nefrologa – první zkušenosti
- Péče o pacienty se zlomeninou horního konce stehenní kosti. I. Ortopedická péče. Doporučené postupy České revmatologické společnosti a Společnosti pro metabolická onemocnění skeletu
- Bezpečnost biologické léčby – doporučení České revmatologické společnosti
- Současný pohled na etiopatogenezi fibromyalgie
- Vaskulární endotelový růstový faktor u zánětlivých revmatických nemocí
- Akcelerovaná ateroskleróza u systémového lupus erythematodes
- Vzdělávací akce IPVZ
- Informace České revmatologické společnosti ČLS JEP
- VIII. Slapské symposium Měřín
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Péče o pacienty se zlomeninou horního konce stehenní kosti. I. Ortopedická péče. Doporučené postupy České revmatologické společnosti a Společnosti pro metabolická onemocnění skeletu
- Vaskulární endotelový růstový faktor u zánětlivých revmatických nemocí
- Konkomitující fibromyalgie u pacientů s revmatoidní artritidou
- Bezpečnost biologické léčby – doporučení České revmatologické společnosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání