-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam sentinelové uzliny u pacientek s časným karcinomem děložního hrdla
Sentinel lymph node concept in early stages cervical cancer
Objective: Summary of current evidence about sentinel lymph node concept in early stages cervical cancer.
Design: Review.
Setting: Department of Obstetrics and Gynaecology, General University Hospital, First Faculty of Medicine, Charles University, Prague.
Methods: First, a comprehensive search of a peer-reviewed journals in gynaecological oncology was conducted based on a wide range of key words used in PubMed database. Second, the reference section for each article found was searched in order to find additional articles. Third, extensive personal clinical and scientifical experience with sentinel lymph node concept in cervical cancer was utilized.
Results: Sentinel lymph node biopsy is routinely used in the management of early stages cervical cancer with high detection rate in skilled surgeon’s hands. It has high sensitivity and low false negative rate. The intraoperative sentinel lymph node examination (i.e. frozen section) has low accuracy because it fails to detect about half of cases with lymph node involvement. Final pathological examination with intensive protocol for ultrastaging detects additional 10% of patients with small metastases (i.e. micrometastasis), who would be otherwise missed. There are limited data about the importance of micrometastasis involvement in sentinel lymph node; there is also growing evidence about negative prognostic impact and patients with micrometastasis should be managed with the same criteria as patients with macrometastasis.
Conclusion: Sentinel lymph node biopsy followed by full pelvic lymph node dissection is currently standard of care until ongoing prospective trials answer question about oncological safety of less radical surgical approach with sentinel lymph node biopsy only.
Keywords:
Prognosis – sensitivity – cervical cancer – sentinel lymph node – detection rate – false negative rate – frozen section – ultrastaging – micrometastasis
Autoři: R. Kocián
Působiště autorů: Gynekologicko‑porodnická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. A. Martan, DrSc.
Vyšlo v časopise: Ceska Gynekol 2020; 85(5): 344-351
Kategorie: Přehledový článek
Souhrn
Cíl studie: Shrnutí současné evidence o významu sentinelové uzliny u pacientek s karcinomem děložního hrdla.
Typ studie: Přehledový článek.
Název a sídlo pracoviště: Gynekologicko-porodnická klinika VFN a 1. LF UK Praha.
Metodika: Byla provedena systematická rešerše recenzovaných článků stěžejních periodik a vědeckých týmů věnujících se problematice. Využita byla databáze PubMed s klíčovými slovy a zhodnocena osobní kontinuální klinická zkušenost s managementem pacientek s karcinomem děložního hrdla pomocí biopsie sentinelové uzliny.
Výsledky: Biopsie sentinelové uzliny má své pevné místo v managementu pacientek s časným karcinomem děložního hrdla. Jedná se o metodu s vysokou úspěšností detekce v rukou zkušeného operatéra, s vysokou senzitivitou a nízkou falešnou negativitou pro stav pánevních uzlin. Intraoperační vyšetření sentinelové uzliny je málo přesné, mine až polovinu všech metastáz. Definitivní extenzivní patologické zpracování pomocí protokolu pro ultrastaging detekuje navíc zhruba 10 % pacientek s malými metastázami, tzv. mikrometástázami, které by jinak byly považovány za uzlinově negativní. Data o prognostickém významu mikrometastatického postižení sentinelové uzliny jsou limitována, současně existuje narůstající evidence o negativním vlivu mikrometastázy na parametry přežití a tyto pacientky by měly mít identický management jako ty s makrometastázou.
Závěr: Současným doporučeným postupem chirurgické léčby pacientek s časným karcinomem děložního hrdla je biopsie sentinelové uzliny společně se systematickou pánevní lymfadenektomií. Otázku onkologické bezpečnosti méně radikálního přístupu spočívajícího jen v biopsii sentinelové uzliny odpoví právě probíhající prospektivní onkologické studie.
Klíčová slova:
karcinom děložního hrdla – sentinelová uzlina – úspěšnost detekce – falešná negativita – intraoperační vyšetření – senzitivita – ultrastaging – mikrometastáza – prognóza
ÚVOD
Článek předkládá dostupné souhrnné informace o významu biopsie sentinelové uzliny u pacientek s časným karcinomem děložního hrdla. Většina gynekologických zhoubných nádorů včetně karcinomu děložního hrdla metastazuje lymfogenně, zhodnocení stavu lymfatických uzlin je proto zásadní jak pro staging onemocnění, tak pro plánování léčby pro konkrétní pacientku. Stav regionálních lymfatických uzlin ovlivňuje prognózu, jejich pozitivita je považována tradičně za silný nezávislý negativní prognostický faktor a je spojena s vyšším rizikem recidivy onemocnění po primární léčbě [2, 18, 21, 23, 24, 35, 37]. Biopsie sentinelové uzliny (SLNB – sentinel lymph node biopsy) má hned několik cílů. Umožňuje vyšetřit pro další management i prognózu onemocnění právě ty nejdůležitější „strážné“ uzliny s největším rizikem postižení a jejich extenzivní patologické zpracování pomocí tzv. protokolu pro „ultrastaging“ je pak rozhodující pro detekci velmi malých metastáz, tzv. mikrometastáz (0,2–2,0 mm), které mají podle dostupné a recentně narůstající evidence důležitý prognostický význam pro parametry přežití [25]. Intraoperační vyšetření sentinelové uzliny pomocí metody zmrazených řezů (tzv. frozen section) není příliš spolehlivé, s limitovanou senzitivitou umožňuje triáž pacientek ve smyslu dokončení radikálního operačního výkonu v případě jejich negativity a naopak v případě intraoperační pozitivity sentinelových uzlin pak dokončení uzlinového stagingu, neprovedení radikální pánevní operace a odeslání pacientky k definitivní primární chemoradioterapii [15].
Biopsie sentinelové uzliny u karcinomu děložního hrdla je doporučenou metodou pro časná stadia onemocnění a je pevnou součástí současných evropských (ESGO-ESTRO-ESP Guidelines) [16] i amerických (NCCN Guidelines) doporučených postupů [29]. Současným standardem operační léčby je biopsie sentinelové uzliny, která je kombinovaná s následnou systematickou pánevní lymfadenektomií [16].
INDIKACE BIOPSIE SENTINELOVÉ UZLINY
Metoda detekce sentinelové uzliny byla u karcinomu děložního hrdla extenzivně studována a je velmi dobře standardizována; je publikována její velmi nízká falešná negativita pro finální stav pánevních lymfatických uzlin. Chirurgicko-patologický staging regionálních pánevních lymfatických uzlin je zlatým standardem pro zhodnocení prognózy a stanovení další terapie u časných stadií karcinomu děložního hrdla (stadia T1a, T1b, T2a1), není indikován pro nejnižší stadium onemocnění, tzn. T1a1 bez známek lymfovaskulární invaze [16]. Biopsie jen sentinelové uzliny je jako samostatný stagingový výkon v současnosti akceptovatelná pouze u pacientek ve stadiu T1a [16].
Biopsie sentinelové uzliny je doporučenou metodou pro stadia T1b až T2a, ale vždy v kombinaci se systematickou pánevní lymfadenektomií v případě její negativity nebo nebyla-li intraoperačně sentinelová uzlina vyšetřena. Mezi doporučené techniky značení pak patří kombinace patentní modři a radiokoloidu nebo jen samostatné použití fluorescenční metody s indokyaninovou zelení [16].
KONCEPT BIOPSIE SENTINELOVÉ UZLINY
První studie zkoumající biopsii sentinelové uzliny u karcinomu děložního hrdla byly publikovány před více než 20 lety [8, 17], pouze ojedinělé práce se věnovaly významu jen biopsie sentinelové uzliny bez provedení systematické lymfadenektomie [30].
Zhodnocení stavu lymfatických uzlin s oboustrannou detekcí a intraoperačním patologickým vyšetřením sentinelových uzlin je prvním krokem chirurgického výkonu. Za sentinelové uzliny jsou považovány všechny modré a/nebo radioaktivní a/nebo fluorescentní uzliny, které jsou následně exstirpovány a odeslány na intraoperační histologické vyšetření (FS – frozen section). Pokud je patologem detekováno jejich metastatické postižení makrometastázou (> 2 mm) nebo mikrometastázou (0,2–2,0 mm), je většinou od dalšího radikální operace, pánevní lymfadenektomie a radikální hysterektomie, upuštěno. Pacientka je referována k definitivní primární chemoradioterapii. Je vhodné dokončit chirurgický paraaortální staging do výše inferiorní mezenterické arterie eventuálně transponovat funkční nádorem nepostižená ovaria mimo budoucí ozářené pole. Tato intraoperační triáž pacientek má zabránit nežádoucí kombinaci obou léčebných modalit, radikální chirurgie a chemoradioterapie, která bývá spojena s největší závažnou, zejména pozdní morbiditou.
Na peroperační vyšetření je vhodné odeslat kromě sentinelových i evidentně suspektní uzliny, v případě nečekaného nálezu zvětšených pánevních uzlin, které nebyly zřejmé na předoperačním ultrazvukovém nebo MRI vyšetření. Je vhodné provést exstirpaci postižených uzlin eventuálně v kombinaci s paraaortálním stagingem. Pacientka je následně referována k definitivní chemoradioterapii [16].
TECHNIKA ZNAČENÍ A DETEKCE SENTINELOVÉ UZLINY
K označení sentinelové uzliny je možné použít několika technik. Pro vyšší úspěšnost značení (DR – detection rate) je preferována kombinace detekčních látek (tzv. tracers), barviva metylenové nebo izosulfanové modři (BD – blue dye) s techneciem-99m značeným radiokoloidem (RC – radiocoloid 99mTc). Samostatně lze použít fluorescenční techniku s indokyaninovou zelení (ICG – indocyanine green), která má vyšší udávanou úspěšnost v oboustranné detekci sentinelové uzliny [9].
Pro značení radiokoloidem existují dva protokoly podle velikosti použitých partikulí a času aplikace detekční látky. V dlouhém protokolu je radiokoloid (Senti-Scint©) aplikován den před operací, v krátkém pak zhruba 20 minut před začátkem operace (Nanocoll©). Patentní modř i indokyaninová zeleň je aplikována při vaginální přípravě na začátku operačního výkonu.
K mapování sentinelových uzlin pomocí radiokoloidu je nutné mít k dispozici zázemí oddělení nukleární medicíny, které po objednání pro pacientku předem připraví a doručí techneciem-99m značený radiokoloid o celkové aktivitě 80–110 MBq rozdělený do čtyř dávek a určený k aplikaci do čtyř kvadrantů děložního hrdla. Je možné provést předoperační scintigrafii, která má udávanou nižší senzitivitu pro detekci sentinelových uzlin [32]. K intraoperační detekci slouží příruční scintilační gama kamera (sonda), která registruje radioaktivitu, množství impulzů za sekundu. Radioaktivní (hot) sentinelová uzlina má vyšší aktivitu ve srovnání s pozadím, okolní tkání.
Úspěšná technika aplikace detekční látky do děložního hrdla musí být povrchová, dostatečně pomalá, aplikace je provedena volně bez většího odporu, do zdravé tkáně stromatu hrdla v těsném okolí nádoru (obr. 1). Celková dávka je v případě radiokoloidu 4×20 MBq, pro patentní modř pak jedna 2ml ampule v 5ml injekci nezředěná nebo zředěná v 2 ml fyziologického roztoku a pro indocyaninovou zeleň pak jedna 5ml ampule zředěná v 20 ml fyziologického roztoku v dávce 2×2 ml pro intracervikální aplikaci. U objemných nádorů, kde není patrný zbývající zdravý lem děložního hrdla, je možné použít speciální dlouhou spinální jehlu a značku aplikovat za nádor do zdravé tkáně [19]. Jehlu je pak dobré ponechat v hrdle několik vteřin jako prevenci úniku značky z místa vpichu. Opatrnosti je zapotřebí v případě užití patentní modři, které může být spojeno s alergickou reakcí, je vhodné proto předem informovat anesteziologa. Hodnoty saturace měřené pulzní oxymetrií mohou v důsledku zředění barviva v plazmě a interferací s fotometrickou technikou měření falešně poklesnout [31].
Obr. 1. Aplikace detekční látky do děložního hrdla 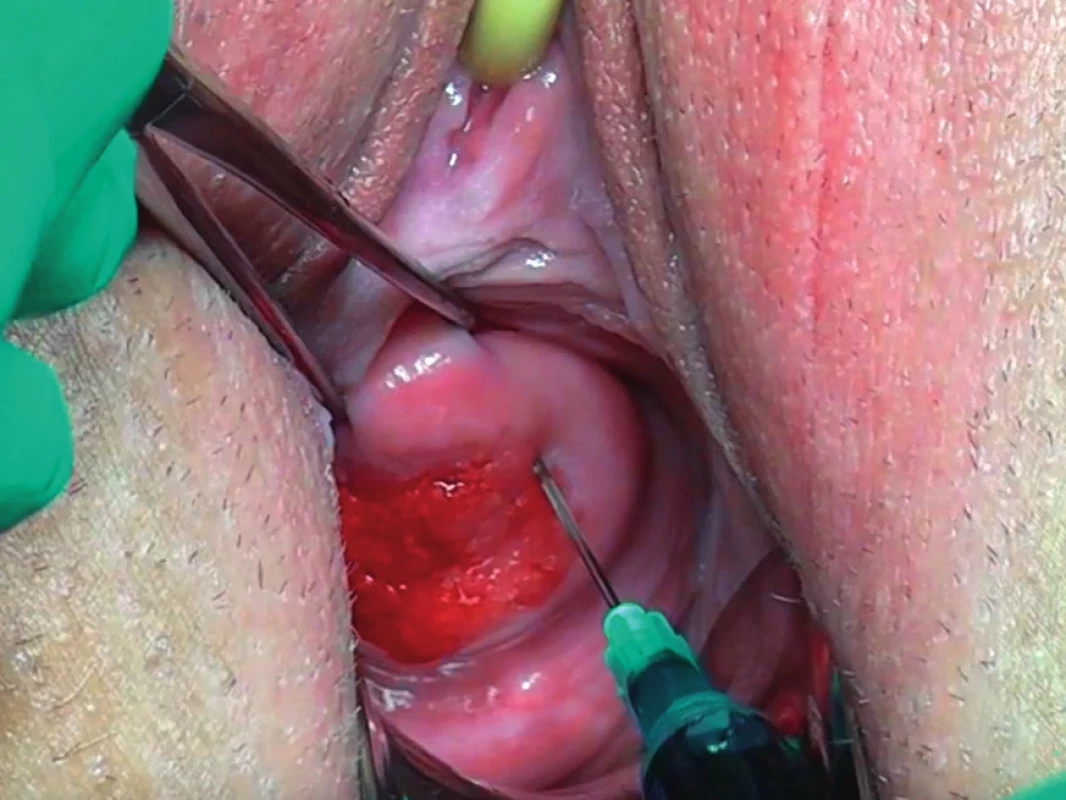
Během operace je otevřeno retroperitoneum pánve a pečlivě prohlédnuto sedm anatomicky dobře definovaných oblastí s možným výskytem sentinelových uzlin, pánevní úrovně I a II [10]. Ideálně sledujeme označené aferentní lymfatické cévy a kolektory, které nás dovedou k označeným sentinelovým uzlinám. Nejčastěji se jedná o oblast zevních ilických cév, interilickou bifurkaci při vstupu do obturatorní fosy a obturatorní fosu samotnou [32]. Pokud sentinelové uzliny nenajdeme v těchto pravděpodobných oblastech výskytu, je nutné pečlivě prohlédnout celou pánev včetně parametrií, společných ilických cév, vnitřních ilických cév a presakrální oblasti. Byly popsány atypické lokalizace výskytu zhruba u 2–5 % sentinelových uzlin [6, 34]. Je nepravděpodobné, že by aferentní lymfatické cesty přemostily všechny pánevní uzliny a vedly přímo do paraaortální oblasti. Tato atypická lokalizace sentinelových uzlin paraaortálně byla popsána ve dvou francouzských studiích s prevalencí 5 % ve starší práci a pouze 1,5 % z výsledků analýzy obou studií [4, 6].
Jako sentinelová je označena každá uzlina, která je modře označená barvivem a/nebo radioaktivní a/nebo fluorescenční. Všechny takové jsou exstirpovány bez zhmoždění či narušení jejich pouzdra. Koncept sentinelové uzliny předpokládá odstranění obvykle malého množství jedné až dvou uzlin z každé strany pánve. S narůstající délkou výkonu se mohou zabarvit i další, tzv. sekundární uzliny, které však nejsou z definice uzlinami sentinelovými (prvními strážnými uzlinami). Po odstranění sentinelových uzlin je důležité v případě užití radiokoloidu pečlivě pátrat po možné reziduální radioaktivitě v pánvi, a zabránit tak přehlédnutí ponechaných radioaktivních sentinelových uzlin.
Sentinelové uzliny jsou následně odeslány k intraoperačnímu vyšetření a následnému definitivnímu patologickému zpracování pomocí ultrastagingu. V případě úspěšné oboustranné detekce sentinelových uzlin a jejich negativity z intraoperačního vyšetření většinou následuje systematická pánevní lymfadenektomie a radikální hysterektomie. V případě jejich metastatického postižení je od radikální hysterektomie a systematické pánevní lymfadenektomie upuštěno a je proveden paraaortální uzlinový staging.
ÚSPĚŠNOST DETEKCE A FALEŠNÁ NEGATIVITA
Biopsie sentinelové uzliny je dobře standardizována a dosahuje vysoké míry úspěšnosti oboustranné detekce (tzv. DR – detection rate) a nízkou falešnou negativitu (FNR – false negative rate). Takto dobrých výsledků se dosahuje zejména v centrech s předchozí zkušeností s technikou jejího provádění. Úspěšnost oboustranné detekce sentinelové uzliny je v literatuře udávána v rozmezí od 60 do 90 % [28], a to v závislosti na stáří a typu studie, použité technice a velikosti souboru. Starší práce, kdy se technika biopsie sentinelové uzliny teprve rozvíjela, udávaly nižší DR, a to zejména u větších nádorů [36]. Vysokou celkovou DR 88,6 % (95% CI 85,8–91,1 %) zejména pak pro nádory ≤ 2 cm, 94,0 % (95% CI 90,2–96,6 %) a s užitím kombinace patentní modře a radiokoloidu 93,5 % (95% CI 90,3–96,0%) udává starší německá prospektivní multicentrická studie, která byla provedena na početném souboru 590 pacientek [1]. Americká retrospektivní studie z MD Anderson na kohortě 188 pacientek popsala unilaterální DR 90 % a bilaterální DR jen 62 %, celková úspěšnost detekce nebyla ovlivněna předchozí kónizací, BMI (≤ nebo > 30 kg/m2) nebo velikostí nádoru (< nebo ≥ 2 cm), současně zjistila významně nižší úspěšnost oboustranné detekce u pacientek s BMI > 30 kg/m2 (OR = 0,49, 95% CI 0,26–0,94 %, p = 0,03) [34].
Tým profesora Roba publikoval v roce 2013 souhrnný článek, kde tzv. stranově specifická míra detekce (SSDR – side specific detection rate) dosáhla rozdílu 25 % ve prospěch menších nádorů; tzn. 84,1 % SSDR pro nádory < 2 cm (n =786) a SSDR 58,8 % pro nádory > 2 cm (n = 724) (OR 0,27; 95% CI: 0,2116–0,3445; p = 0,0001) [32].
Byly dobře popsány faktory, které negativně ovlivňují úspěšnost detekce, jako jsou vyšší BMI, vyšší věk, malá zkušenost centra s technikou výkonu, přítomnost lymfovaskulární invaze a podání neoadjuvantní chemoterapie [3, 38]. S dobře zvládnutou technikou biopsie sentinelové uzliny se ve více recentních studiích rozdíly v úspěšnosti detekce u větších tumorů nepotvrdily. Na našem souboru 350 pacientek jsme prokázali podobně vysokou bilaterální úspěšnost detekce pro nádory < 2 cm, 2–3,9 cm, > 4 cm (79 %, 83 %, 76 %), p = 0,460 [19]. Úspěšnosti oboustranné detekce bylo v 72 % dosaženo v největším retrospektivním multicentrickém souboru 645 pacientek [11] a podobně vysoká bilaterální DR 76 % ve francouzské prospektivní studii Senticol se 145 pacientkami s nádory do 4 cm. Autoři vysokou úspěšnost detekce odůvodňovali výběrem malých nádorů, zkušeností s technikou biopsie sentinelové uzliny, využitím předoperační lymfoscintigrafie a rutinním užitím kombinované metody značení [26].
Zlepšení techniky detekce se rovněž významně promítlo do výsledků kombinované analýzy souboru 405 pacientek ze dvou prospektivních francouzských studií Senticol I a Senticol II, které prokázaly vysokou úspěšnost detekce v 94,1 % s alespoň jednostrannou detekcí a v 80,5 % úspěšnou oboustrannou detekci sentinelové uzliny [3]. V uvedených studiích bylo současně dosaženo velmi nízké falešné negativity, tzn. situace, kdy i přes negativitu extenzivně zpracované sentinelové uzliny byla nalezena metastáza v uzlině non-sentinelové při finálním histologickém zpracování. Ve francouzské prospektivní studii Senticol dosáhla senzitivita metody 100 % při 0% FNR pro 104 pacientek s oboustrannou detekcí [26]. Retrospektivní americká analýza z MD Anderson velmi podobně pak u kohorty 188 pacientek dosáhla 96,4% senzitivity (95% CI 79,8–99,8 %) sentinelové uzliny pro detekci metastatického uzlinového postižení s nízkou FNR 3,6 % [3]. Jen jedna pacientka měla falešně negativní nález v sentinelové uzlině. I v největší retrospektivní multicentrické analýze (n = 645) byla senzitivita 97 % (95% CI 91–99 %) a falešná negativita dosáhla 1,3 % [11]. Recentní retrospektivní studie (n = 350) pak ukázala zanedbatelně nízké riziko falešné negativity sentinelové uzliny pro pánevní uzlinový staging nezávisle na velikosti nádoru (1% FNR pro nádory pod 2 cm, 1% FNR pro velikost nádoru 2–3,9 cm, 0% pro nádory ≥ 4 cm) [19].
INTRAOPERAČNÍ VYŠETŘENÍ (FROZEN SECTION)
Intraoperační vyšetření sentinelové uzliny pomocí zmražených řezů je metodou málo přesnou, mine až polovinu všech metastaticky postižených lymfatických uzlin. Podle recentní publikované analýzy z multicentrické prospektivní studie Sentix má intraoperační vyšetření sentinelové uzliny senzitivitu 75,9 % pro makrometastázy, ale jen 45,8% senzitivitu pro jakoukoliv uzlinovou pozitivitu (tzn. makrometastázy a mikrometastázy). Mikrometastázy byly v 90 % případů detekovány až při definitivním intenzivním vyšetření pomocí ultrastagingu, stejně tak i všechny případy izolovaných nádorových buněk [13].
Spolehlivost intraoperačního vyšetření je významně ovlivněna intenzitou patologického zpracování sentinelové uzliny, které je závislé na požadované přesnosti na jedné straně a na časové náročnosti a množství zpracovaných řezů na straně druhé. Velké množství vyšetřených řezů by neúměrně prodlužovalo operaci a vedlo by ke ztrátě a vykrojení materiálu uzliny pro definitivní zpracování. Sentinelová uzlina by měla být šetrně oddělena od okolní tukové tkáně a vyšetřena v 2mm řezech, pro menší uzliny to znamená jejich prosté rozpůlení. Z každého bločku jsou pak vyšetřeny jeden nebo dva řezy. Je postačující, aby uzlina se zřejmým metastatickým postižením byla vyšetřena pouze v jednom řezu, v tomto případě je dobré ponechat okolní tukovou tkáň kolem uzliny k posouzení prorůstání a šíření metastázy přes její pouzdro [14].
Udávaná senzitivita intraoperačního vyšetření sentinelové uzliny je v dostupné literatuře značně rozdílná, pohybuje se v rozmezí 33–100 % [28]. Pro přítomnost mikrometastáz a makrometastáz je následující: 45 % (Bats, 2009), 46 % (Cibula, 2020), 47 % (Dostálek, 2020), 63 % (Sláma, 2013), 81 % (Rychlik 2020), 88 % (Papadia, 2019), 89 % (Martinez, 2013) [33].
Multicentrická francouzská prospektivních studie Senticol 1 retrospektivně analyzovala na souboru 102 pacientek přesnost intraoperačního vyšetření sentinelové uzliny pomocí metody zmrazených řezů (97) a otiskové cytologie (5) a zjistila velmi nízkou celkovou senzitivitu 22,7 % (95%CI: 7,8–45,4%) a negativní prediktivní hodnotu 93,0% (95%CI: 89,0–95,9%), intraoperační vyšetření minulo 77 % metastaticky postižených uzlin, všechny mikrometastázy a 5/9 makrometastáz (senzitivita pro MAC 55,6%; 95%CI: 21,2–86,3%) [5]. Intraoperační vyšetření bylo protokolem studie doporučeno jen u makroskopicky suspektních uzlin, metoda zmrazeného řezu spočívala v rozpůlení uzliny v dlouhé ose a vyšetření jedné poloviny v jedné úrovni barvením H&E, otisková cytologie pak otiskem obou polovin uzliny na podložní sklíčko.
Novou metodou intraoperačního vyšetření sentinelové uzliny na přítomnost makrometastáz, mikrometastáz a izolovaných nádorových buněk je tzv. OSNA (one-step nucleic acid amplification). Jedná se o rychlou esej, která umožňuje kvantitativně detekovat přítomnost cytokeratinu 19 mRNA v lyzátu sentinelové uzliny. Limitací je však možná ztráta materiálu uzliny při zpracování jejího lyzátu pomocí OSNA, falešná pozitivita v případě benigních epiteliálních mülleriánských inkluzí (např. endosalpingióza, endometrióza) a nedostatek evidence o přesnosti metody [7].
Lze tedy shrnout, že intraoperační vyšetření sentinelové uzliny detekuje jen asi 50 % uzlinově pozitivních pacientek. Detekuje většinu makrometastáz a používá se k intraoperační triáži, která má za cíl zamezit nežádoucí kombinaci radikální chirurgické léčby a radioterapie. Limitací metody je skutečnost, že nedetekuje naprostou většinu mikrometastáz.
DEFINITIVNÍ HISTOLOGICKÉ ZPRACOVANÍ (PROTOKOL PRO ULTRASTAGING)
Sentinelové uzliny jsou poté, co byly vyšetřeny intraoperačně, definitivně zpracovány pomocí extenzivního patologického protokolu pro ultrastaging (obr. 2). Toto podrobné vyšetření je pro celý koncept sentinelové uzliny zásadní, zejména při neprovedení systematické pánevní lymfadenektomie. Opomenutí ultrastagingu by mohlo mít závažné následky v podobě nerozpoznaného metastatického uzlinového postižení. V takovém případě by pacientka byla ponechána s vysokým rizikem recidivy onemocnění. Prováděný ultrastaging nemá v současnosti mezinárodně jednotný doporučený protokol. Jedním z důvodů je časová, personální a finanční náročnost velmi podrobného vyšetření v mnoha úrovních z každého řezu sentinelové uzliny. Informace o počtu vyšetřených úrovní z každého histologického bločku, každého 2mm řezu, uvedení intervalu mezi jednotlivými úrovněmi (v mikrometrech), představují hlavní parametry protokolu pro ultrastaging a takto by měly být uvedeny v definitivní histologické zprávě, stejně tak i v publikaci věnující se konceptu sentinelové uzliny.
Obr. 2. Protokol pro ultrastaging při vyšetření sentinelových uzlin 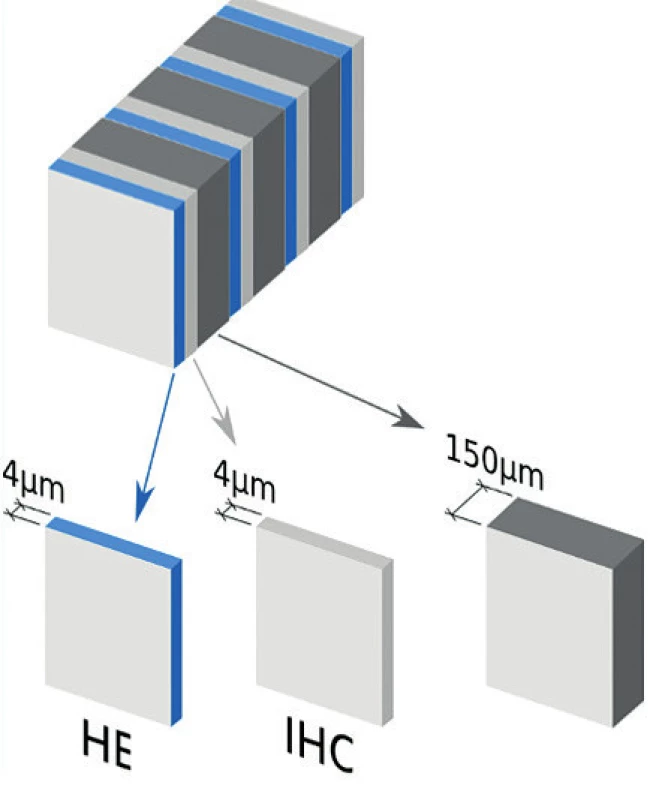
Recentně publikovaný souhrnný článek věnující se patologickému vyšetření sentinelové uzliny popisuje značné rozdíly v intenzitě a kvalitě zpracování mezi jednotlivými institucemi, které snižují senzitivitu ultrastagingu a mohou mít za důsledek přehlédnutí mikrometastáz i malých makrometastáz. Ze 127 uvedených studií chybí u 24 % jakákoliv informace o způsobu patologického vyšetření, v 7 % nebyly uzliny vyšetřeny ultrastagingem, tloušťka řezů je značně variabilní (1 až 5 mm), stejně tak počet vyšetřených úrovní (0 až žádná ponechaná tkáň uzliny), různí se i intervaly mezi úrovněmi (40 až 1000 µm) a počet řezů v jednotlivých úrovních (1 až 5) [20].
Je nutné najít konsenzus a kompromis mezi kvalitou vyšetření sentinelové uzliny garantující vysokou senzitivitu pro stav všech pánevních uzlin a kvantitou zpracovaných řezů realizovatelné v každodenní praxi. S rostoucí evidencí o prognostické důležitosti mikrometastáz byl navržen protokol pro ultrastaging, který bezpečně zachytí všechny makrometastázy a většinu mikrometastáz. Zachycení izolovaných nádorových buněk by vyžadovalo mnoho set řezů z každé sentinelové uzliny a vyšetření stejného počtu skel, což nelze rutinně provádět. Tento doporučený protokol spočívá ve zpracování sentinelové uzliny v 2mm intervalech, 4 řezech v 200 µm intervalech (1 barvený H&E, 1 vyšetřený imunohistochemicky protilátkami proti pancytokeratinu AE1 a AE3 a 2 nebarvené), a to celkem v tolika úrovních, dokud nezůstane žádná nezpracovaná tkáň uzliny [14].
PROGNOSTICKÝ VÝZNAM MIKROMETASTÁZ
Postižení sentinelové lymfatické uzliny je rozděleno do několika kategorií podle velikosti metastáz. TMN klasifikace tak definuje následující stavy: pN1(sn) pro makrometastázu o velikosti > 2 mm, pN1 (mic) (sn) pro mikrometastázu o velikosti 0,2 mm až 2,0 mm a pN0 (i+) (sn) stav pro přítomnost tzv. (shluků) izolovaných nádorových buněk o celkové velikosti < 0,2 mm. Pozitivita lymfatických uzlin, přítomnost makrometastázy (MAC), je u karcinomu děložního hrdla nejdůležitějším nezávislým negativním prognostickým faktorem [11].
Díky konceptu biopsie sentinelové uzliny a jejímu intenzivnímu histologickému zpracování pomocí protokolu pro ultrastaging je u 10–15 % pacientek diagnostikována mikrometastáza (MIC) a/nebo shluky izolovaných nádorových buněk (ITC). O prognostickém významu tohoto typu postižení sentinelové uzliny, tzv. low volume disease, existuje nedostatek prospektivní evidence. Pro získání důkazu o prognostickém významu mikrometastáz nebo izolovaných nádorových buněk bychom potřebovali vzorek tisíců pacientek s ohledem na nízký výskyt tohoto typu postižení a nízké riziko recidivy. Pro klinický management je však jejich význam důležitý. Mají-li mikrometastázy negativní vliv na prognózu, je pak opodstatněno extenzivní histologické zpracování sentinelové uzliny pomocí ultrastagingu a je indikováno zajištění takových pacientek adjuvantní radioterapií, stejně jako u těch s makrometastázou.
Ve velkém recentním retrospektivním souboru z našeho centra (n = 226) byla mikrometastáza v sentinelové uzlině identifikována jako nezávislý negativní prognostický faktor a tyto pacientky měly horší prognózu v signifikantně zkrácených parametrech přežití bez nemoci (DFS – disease free survival) i celkového přežití (OS – overall survival) ve srovnání s pacientkami s makrometastázou [25]. Přežití bez nemoci (DFS) bylo 90 % pro celou kohortu, 89 % pro makrometastázu (MAC), 69 % pro mikrometastázu (MIC) a 87 % pro pacientky s izolovanými nádorovými buňkami (ITC), s mediánem sledování 65 měsíců. Podobné závěry o vyšším riziku recidivy a zkráceném přežití byly zjištěny i dalšími autory (tab. 1). Recentní ad hoc analýza prospektivní francouzské studie Senticol1 neprokázala zkrácený DFS u pacientek s mikrometastázou nebo izolovanými nádorovými buňkami v sentinelové uzlině [22]. Je nutné poznamenat, že studie nebyla navržena způsobem, aby na tuto otázku odpověděla.
Tab. 1. Výsledky významných studií 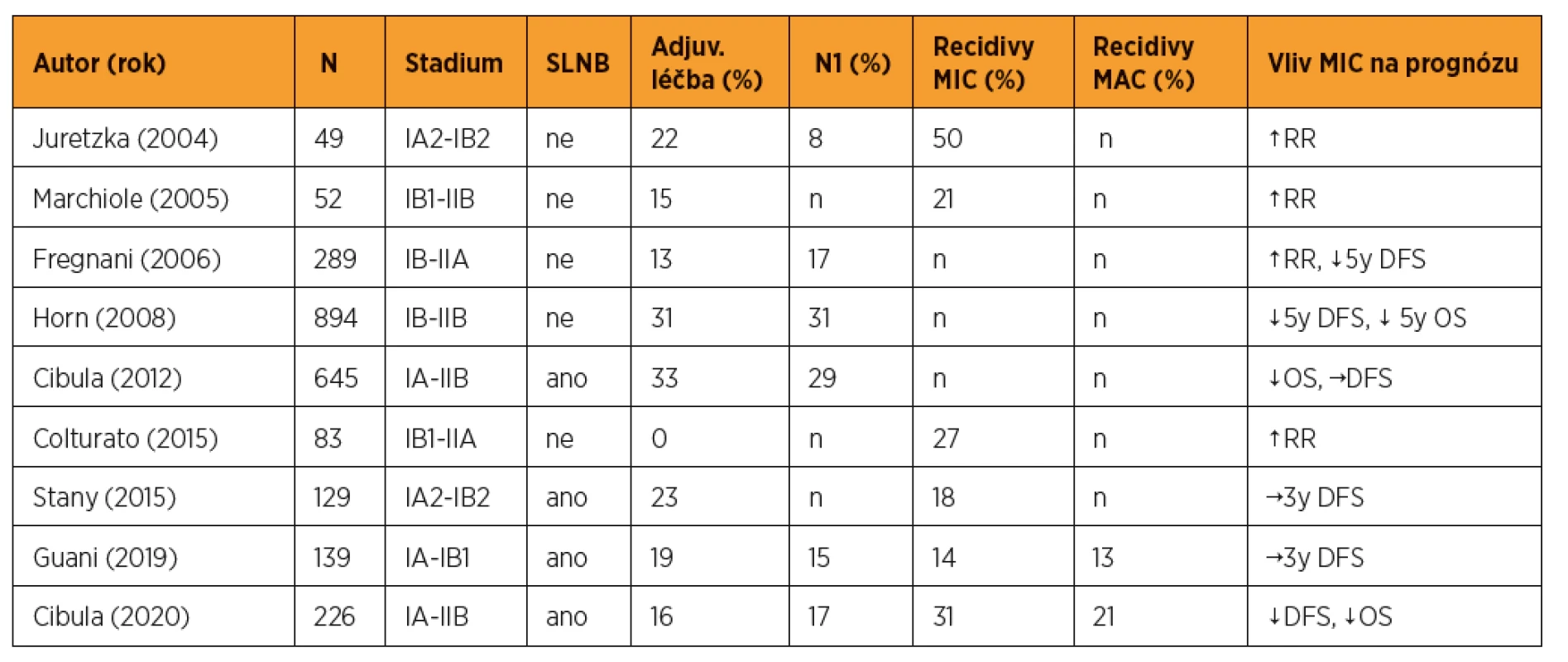
DFS-přežití bez nemoci, N-počet, N1-uzlinově pozitivní, MIC-mikrometastáza, MAC-makrometastáza, OS-celkové přežití, RR-četnost recidivy, SLNB-biopsie sentinelové uzliny, ↑ zvyšuje, ↓ snižuje, → neměnní. Upraveno podle Kocian R., et al. Micrometastases in Sentinel Lymph Nodes Represent a Significant Negative Prognostic Factor in Early-Stage Cervical Cancer: A Single-Institutional Retrospective Cohort Study, Cancers (Basel), 2020,12(6), 1438 I přes zřejmé diskrepance existuje narůstající evidence o negativním prognostickém významu mikrometastáz v sentinelové uzlině se všemi důsledky pro klinický management takových pacientek. Pacientky s mikrometastázou v sentinelové uzlině by měly mít identický management jako ty s makrometastázou, a to včetně zavedení vyšetření sentinelové uzliny pomocí ultrastagingu do rutinní praxe.
ZÁVĚR
Biopsie sentinelové uzliny je metodou spolehlivou s vysokou úspěšností oboustranné detekce v rukou zkušeného operatéra, a to i u větších nádorů (>2 cm, >4 cm). Má nízkou falešnou negativitu pro definitivní stav pánevních lymfatických uzlin, a to zejména pro makrometastázy. Intraoperační vyšetření sentinelové uzliny je doporučeno v časných stadiích karcinomu děložního hrdla, detekuje většinu makrometastáz, a umožňuje tak intraoperační triáž pacientek mezi radikálním pánevním výkonem a primární chemoradioterapií ve snaze nekombinovat obě modality léčby, a zabránit tak zejména pozdní závažné morbiditě. Intraoperační vyšetření má však nízkou senzitivitu pro detekci mikrometastáz. Definitivní extenzivní patologické zpracování sentinelové uzliny pomocí protokolu pro ultrastaging detekuje mikrometastázu navíc u asi 10 % pacientek, které by jinak byly povážovány za uzlinově negativní. O jejím důležitém negativním prognostickém významu a výskytu zvýšeného rizika recidivy máme k dispozici recentně více evidence, chybí ale data z prospektivních studií. Pokud vyloučíme všechny pacientky s uzlinovým postižením (MAC, MIC, ITC), má uzlinově negativní kohorta po primární radikální léčbě excelentní prognózu. Biopsie sentinelové uzliny v kombinaci se systematickou pánevní lymfadenektomií je stále standardem a součástí doporučených postupů v léčbě časných stadií karcinomu děložního hrdla (stadia IB). Právě probíhající prospektivní studie Sentix (NCT02494063) a SENTICOLIII (NCT03386734) by měly přinést evidenci o onkologické bezpečnosti biopsie sentinelové uzliny bez systematické lymfadenektomie [12, 27].
Poděkování
patří mému školiteli prof. MUDr. Davidu Cibulovi, CSc.
MUDr. Roman Kocián
Gynekologicko-porodnická klinika
VFN a l. LF UK
Apolinářská 18
128 00 Praha 2
e-mail: Roman.Kocian@vfn.cz
Zdroje
1. Altgassen, C., Hertel, H., Brandstädt, A., et al. Multicenter Validation Study of the Sentinel Lymph Node Concept in Cervical Cancer: AGO Study Group. J Clin Oncol, 2008, 26(18), p. 2943–2951.
2. Alvarez, RD., Soong, SJ., Kinney, WK., et al. Identification of prognostic factors and risk groups in patients found to have nodal metastasis at the time of radical hysterectomy for early-stage squamous carcinoma of the cervix. Gynecol Oncol, 1989, 35, p. 130–135.
3. Balaya, V., Bresset, A., Guani, B., et al. Risk factors for failure of bilateral sentinel lymph node mapping in early-stage cervical cancer. Gynecol Oncol, 2020, 156(1), p. 93–99.
4. Balaya, V., Mathevet, P., Magaud, L., et al. Predictive factors of unexpected lymphatic drainage pathways in early-stage cervical cancer. Gynecol Oncol, 2019, 154(1), p. 102–109.
5. Bats, A., Buénerd, A., Querleu, D., et al. Diagnostic value of intraoperative examination of sentinel lymph node in early cervical cancer: A prospective, multicenter study. Gynecol Oncol, 2011, 123, p. 230–235.
6. Bats, A., Mathevet, P., Buenerd, A., et al. The Sentinel Node Technique Detects Unexpected Drainage Pathways and Allows Nodal Ultrastaging in Early Cervical Cancer: Insights from the Multicenter Prospective SENTICOL Study. Ann Surg Oncol, 2013, 20, p. 413–422.
7. Bizzarri, N., Pedone Anchora, L., Zannoni, GF., et al. Role of one-step nucleic acid amplification (OSNA) to detect sentinel lymph node low-volume metastasis in early-stage cervical cancer. Int J Gynecol Cancer, 2020, 30(3), p. 364–371.
8. Brown, JS., Sawaya, G., Thom, DH., Grady, D. Hysterectomy and urinary incontinence: a systematic review. Lancet, 2000, 356(9229), p. 535–539.
9. Buda, A., Crivellaro, C., Elisei, F., et al. Impact of indocyanine green for sentinel lymph node mapping in early stage endometrial and cervical cancer: comparison with conventional radiotracer 99mTc and/or blue dye. Ann Surg Oncol, 2016, 23, p. 2183–2191.
10. Cibula, D., Abu-Rustum, NR. Pelvic lymphadenectomy in cervical cancer – surgical anatomy and proposal for a new classification system. Gynecol Oncol, 2010, 116, p. 33–37.
11. Cibula, D., Abu-Rustum, N., Dusek, L., et al. Prognostic significance of low volume sentinel lymph node disease in early-stage cervical cancer. Gynecol Oncol, 2012, 124, p. 496–501.
12. Cibula, D., Dusek, J., Jarkovsky, J., et al. A prospective multicenter trial on sentinel lymph node biopsy in patients with early stage cervical cancer (SENTIX). Int J Gynecol Cancer, 2019, 29(1), p. 212–215.
13. Cibula, D., Kocian, R., Plaikner, A., et al. Sentinel lymph node mapping and intraoperative assessment in a prospective, international, multicentre, observational trial of patients with cervical cancer: The SENTIX trial Eur J Cancer, 2020, in press.
14. Cibula, D., McCluggage, WG. Sentinel lymph node (SLN) concept in cervical cancer: Current limitations and unanswered questions. Gynecol Oncol, 2019, 152(1), p. 202–207.
15. Cibula, D., Oonk, MH., Abu-Rustum, NR. Sentinel lymph node biopsy in the management of gynecologic cancer. Curr Opin Obstet Gynecol, 2015, 27(1), p. 66–72.
16. Cibula, D., Pötter R., Planchamp, F., et al. The European Society of Gynaecological Oncology/European Society for Radiotherapy and Oncology/European Society of Pathology Guidelines for the management of patients with cervical cancer. Int J Gynecol Cancer, 2018, 28, p. 641–655.
17. Dargent, D., Martin X., Mathevet, P. Laparoscopic assessment of the sentinel lymph node in early stage cervical cancer. Gynecol Oncol, 2000, 79(3), p. 411–415.
18. Delgado, G., Bundy, B., Zaino, R., et al. Prospective surgical-pathological study of disease-free interval in patients with stage IB squamous cell carcinoma of the cervix: A Gynecologic Oncology Group study. Gynecol Oncol, 1990, 38, p. 352–357.
19. Dostálek, L., Zikan, M., Fischerova, D., et al. SLN biopsy in cervical cancer patients with tumors larger than 2 cm and 4 cm. Gynecol Oncol, 2018, 148, p. 456–460.
20. Dundr, P., Cibula, D., Nemejcova, K., et al. Pathologic protocols for sentinel lymph nodes ultrastaging in cervical cancer. Arch Pathol Lab Med 2019, 10.5858/arpa.2019-0249-RA, doi:10.5858/arpa.2019-0249-RA.
21. Grisaru, DA., Covens, A., Franssen, E., et al. Histopathologic score predicts recurrence free survival after radical surgery in patients with stage IA2-IB1-2 cervical carcinoma. Cancer, 2003, 97, p. 1904–1908.
22. Guani, B., Dorez, M., Magaud, L., et al. Impact of micrometastasis or isolated tumor cells on recurrence and survival in patients with early cervical cancer: SENTICOL Trial. Int J Gynecol Cancer, 2019, 29, p. 447–452.
23. Ho, CM., Chien, TY., Huang, SH., et al. Multivariate analysis of the prognostic factors and outcomes in early cervical cancer patients undergoing radical hysterectomy. Gynecol Oncol, 2004, 93, p. 458–464.
24. Kamura, T., Tsukamoto, N., Tsuruchi, N., et al. Multivariate analysis of the histopathologic prognostic factors of cervical cancer in patients undergoing radical hysterectomy. Cancer, 1992, 69, p. 181–186.
25. Kocian, R., Slama, J., Fischerova, D., et al. Micrometastases in Sentinel Lymph Nodes Represent a Significant Negative Prognostic Factor in Early-Stage Cervical Cancer: A Single-Institutional Retrospective Cohort Study. Cancers (Basel), 2020,12(6), p. 1438.
26. Lecuru, F., Mathevet, P., Querleu, D., et al. Bilateral negative sentinel nodes accurately predict absence of lymph node metastasis in early cervical cancer: results of the SENTICOL study. J Clin Oncol, 2011, 29(13), p. 1686–1691.
27. Lecuru, FR., McCormack, M., Hillemanns, P., et al. SENTICOL III: an international validation study of sentinel node biopsy in early cervical cancer. A GINECO, ENGOT, GCIG and multicenter study. Int J Gynecol Cancer, 2019, 29(4), p. 829–834.
28. Martínez, A., Mery, E., Filleron, T., et al. Accuracy of intraoperative pathological examination of SLN in cervical cancer. Gynecol Oncol, 2013, 130(3), p. 525–529.
29. NCCN. Cervical Cancer – NCCN Clinical Practice Guidelines in Oncology (version 2. 2020 - July 24, 2020). https://www.nccn.org/professionals/physician_gls/pdf/cervical.pdf.
30. Niikura, H., Okamoto, S., Otsuki, T., et al. Prospective Study of Sentinel Lymph Node Biopsy Without Further Pelvic Lymphadenectomy in Patients With Sentinel Lymph Node–Negative Cervical Cancer. Int J Gynecol Cancer, 2012, 22, p. 1244–1250.
31. Piñero, A., Illana, J., García-Palenciano, C., et al. Effect on Oximetry of Dyes Used for Sentinel Lymph Node Biopsy: Are There Differences? Arch Surg., 2004,139(11), p. 1204–1207.
32. Rob, L., Robova, H., Halaska, MJ., et al. Current status of sentinel lymph node mapping in the management of cervical cancer. Expert Rev Anticancer Ther, 2013, 13, p. 861–870.
33. Rychlik, A., Angeles, M., Migliorelli, F., et al. Frozen section examination of sentinel lymph nodes can be used as a decisional tool in the surgical management of early cervical cancer. Int J Gynecol Cancer, 2020, 30, p. 358–363.
34. Salvo, G., Ramirez, PT., Levenback, CF., et al. Sensitivity and negative predictive value for sentinel lymph node biopsy in women with early-stage cervical cancer. Gynecol Oncol, 2017, 145(1), p. 96–101.
35. Sevin, BU., Lu, Y., Bloch, DA., et al. Surgically defined prognostic parameters in patients with early cervical carcinoma. A multivariate survival tree analysis. Cancer, 1996, 78, p. 1438–1446.
36. Wydra, D., Sawicki, S., Wojtylak, S., et al. Sentinel node identification in cervical cancer patients undergoing transperitoneal radical hysterectomy: a study of 100 cases. Int J Gynecol Cancer, 2006, 16(2), p. 649–654.
37. Yuan, CC., Wang, PH., Lai, CR., et al. Prognosis-predicting system based on factors related to survival of cervical carcinoma. Int J Gynecol Obstet, 1998, 63, p. 163–167.
38. Zarganis, P., Kondi-Pafiti, A., Arapantoni-Dadioti, P., et al. The sentinel node in cervical cancer patients: role of tumor size and invasion of lymphatic vascular space. In Vivo, 2009, 23(3), p. 469–473.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek Klinický význam rutinního ultrazvukového screeningu růstové restrikce ve třetím trimestru gravidityČlánek Laparoskopická sterilizace bilaterální salpingektomií – profylaktický benefit araritní komplikaceČlánek Simplifikace odběru dělohy k transplantaci: robotický přístup a odtok krve ovariálními žílamiČlánek Prehabilitace
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2020 Číslo 5- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Mají ženy rodící vaginálně po předchozím císařském řezu větší riziko avulzního poranění musculus levator ani?
- Klinický význam rutinního ultrazvukového screeningu růstové restrikce ve třetím trimestru gravidity
- Typický rozštěp rtu a patra v 2D ultrasonografii
- Kompletní mola hydatidosa u perimenopauzální pacientky imitující zhoubný nádor dělohy
- Úspešné podanie trombolytickej liecby tehotnej pacientke s ischemickou náhlou cievnou mozgovou príhodou
- Extrakorporeální rázová vlna v terapii indukované bolesti po perineálním poranění
- Laparoskopická sterilizace bilaterální salpingektomií – profylaktický benefit araritní komplikace
- Cervikální sekret – důležitý faktor reprodukce
- Simplifikace odběru dělohy k transplantaci: robotický přístup a odtok krve ovariálními žílami
- Význam sentinelové uzliny u pacientek s časným karcinomem děložního hrdla
- Prehabilitace
- Suplementace vitaminem D a kalciem – význam v gynekologii
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Klinický význam rutinního ultrazvukového screeningu růstové restrikce ve třetím trimestru gravidity
- Laparoskopická sterilizace bilaterální salpingektomií – profylaktický benefit araritní komplikace
- Kompletní mola hydatidosa u perimenopauzální pacientky imitující zhoubný nádor dělohy
- Cervikální sekret – důležitý faktor reprodukce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



