-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Fytoestrogeny v menopauze: mechanismus účinku a výsledky léčby v sestavě 28 pacientek
Phytoestrogenes in menopause: working mechanisms and clinical results in 28 patients
Objective:
Comparison of phytoestrogen treatment efficacy in menopausal women with and without ability to metabolise phytoestrogens.Design:
Clinical trial.Setting:
Department of Obstetrics and Gynaecology, Regional Hospital, Mlada Boleslav.Methods:
28 menopausal women were treated with phytoestrogens in dose 80 mg daily. Before start and after finishing of treatment urinary concentrations of active metabolite S-equol were measured using ELISA method. Similarly before and after treatment Kupperman’s index was measured. Patients with urinary concentrations of S-equol above 1 ng/ml were considered as S-equol producers, remaining patients formed control group.Results:
16 out of 28 women were considered as S-equol producers, remainig 12 as a non-producers. Initial urinary concentrations of S-equol were 0.34 ± 0.37 ng/ml in producers group and 0.29 ± 0.30 ng/ml in non-producers. After finishing of therapy urinary concentration of S-equol increased to 10.67 ± 11.57 ng/ml (p = 0.002) in producers group and 0.34 ± 0.30 ng /ml (p = 0.701) in non-producers. Kupperman’s index values were 23.44 ± 11.57 in producers group and 17.25 ± 7.78 in non-producers. After therapy value of Kupperman’s index decreased to 14.44 ± 9.97 (p = 0.003) in producers and to 12.00 ± 7.18 (p = 0.100) in non-producers. No correlation between improvement in Kupperman’s index and urinary concentration of S-equol after therapy was found similarly as between urinary concentration of S-equol before and after therapy in producents group.Conclusion:
Significant phytoestrogen treatment effect in menopausal women producing S-equol was proven. Testing method for S-equol production introduced by our team togehter with suggested threshold urine concentration level of 1 ng/ml allows precise distinction of producers and non-producers of S-equol and subsequently to predict better treatment effect of phytoestrogens.Key words:
phytoestrogens, equol, menopause, clinical trial.
Autoři: V. Bičíková 1; L. Sosvorová 2; O. Bradáč 3; M. Pán 1; M. Bičíková 2
Působiště autorů: Gynekologicko-porodnické oddělení, Oblastní nemocnice, Mladá Boleslav, primář MUDr. M. Pán 1; Endokrinologický ústav, Praha 2; Neurochirurgická klinika 1. LF UK, ÚVN a IPVZ, Praha 3
Vyšlo v časopise: Ceska Gynekol 2012; 77(1): 10-14
Kategorie: Původní práce
Souhrn
Cíl studie:
Srovnání účinnosti léčby fytoestrogeny u menopauzálních žen se schopností metabolizace fytoestrogenů a bez ní.Typ studie:
Klinická studie.Název a sídlo pracoviště:
Gynekologicko-porodnické oddělení, Klaudiánova nemocnice Mladá Boleslav.Metody:
Celkem 28 menopauzálním pacientkám byla podána tříměsíční léčba fytoestrogenovými přípravky v dávce 80 mg na den. Před léčbou a po ní byla zaznamenána močová koncentrace účinného metabolitu S-equolu metodou ELISA. Stejně tak byly zaznamenány hodnoty Kuppermanova indexu před léčbou a po léčbě. Pacientky po léčbě s koncentrací S-equolu větší než 1ng/ml byly považovány za producentky S-equolu, ostatní tvořily kontrolní skupinu.Výsledky:
Z celkového počtu 28 pacientek bylo 16 pacientek určeno jako producentky S-equolu, zbylých 12 jako non-producentky. Bazální hladiny S-equolu byly 0,34 ± 0,37 ng/ml ve skupině producentek a 0,29 ± 0,30 ng/ml ve skupině non-producentek. Po terapii se ve skupině producentek zvýšila močová koncentrace S-equolu na 10,67 ± 11,57 ng/ml (p = 0,002) a na 0,34 ± 0,30 ng /ml (p = 0,701) ve skupině non-producentek. Hodnota Kuppermanova indexu u producentek před terapií dosahovala 23,44 ± 11,57 bodu u non-producentek 17,25 ± 7,78 bodu. Po terapii se průměrná hodnota Kuppermanova indexu snížila u producentek na 14,44 ± 9,97 bodu (p = 0,003) a na 12,00 ± 7,18 bodu (p = 0,100) u non-producentek. Korelace mezi hodnotou zlepšení Kuppermanova indexu a močovou koncentrací S-equolu po terapii nebyla u producentek nalezena. Stejně tak nebyla nalezena korelace mezi vstupní a konečnou hodnotou močové koncentrace S-equolu ve skupině producentek.Závěr:
Efekt léčby fytoestrogeny byl u pacientek v menopauze schopných produkovat S-equol jednoznačně prokázán. Zavedená forma testování pacientek na produkci S-equolu společně s navrženou rozhodující hladinou koncentrace močového S-equolu po terapii 1 ng/ml dobře koresponduje s rozdělením pacientek na producentky a non-producentky S-equolu, a tím s lepším klinickým efektem podání fytoestrogenových preparátů.Klíčová slova:
fytoestrogeny, equol, menopauza, klinická studie.ÚVOD
Fytoestrogeny jsou látky rostlinného původu, jejichž metabolity mají schopnost vyvolat účinky typické pro endogenní estrogeny. Poprvé byly objeveny v roce 1946 v souvislosti s poruchami plodnosti australských ovcí pasených na jetelových loukách (Trifolium subterraneum, Fabaceae). Dále byly tyto látky studovány především v kontextu jejich negativních dopadů na fertilitu zvířat. Medicína se o fytoestrogeny začala zajímat v osmdesátých letech dvacátého století v souvislosti s provedením několika epidemiologických studií. Nižší výskyt menopauzálních obtíží u asijské populace je některými studiemi přičítán právě značné konzumaci sójových produktů, jednoho z hlavních zdrojů fytoestrogenů. Z recentních prací jmenujme studii Somekawyho a kol. [23].
Nejaktivnějšími fytoestrogeny jsou izoflavonoidy, především daidzein a genistein, přírodní látky vyskytující se hlavně v uštěninách. Bylo zjištěno, že izoflavonoidy mají potenciál redukovat výskyt klimakterických obtíží [14], snižují kardiovaskulární riziko [3], mají pozitivní vliv na kostní denzitu [2] a byl u nich pozorován také kanceroprotektivní efekt [4]. Na druhé straně jiné práce tyto efekty zpochybňují [11, 25]. Nejbohatšími zdroji izoflavonoidů jsou sója (Glycine max, Fabaceae) a červený jetel (Trifolium pratense, Fabaceae).
BIOCHEMIE A MECHANISMUS ÚČINKU FYTOESTROGENŮ
Izoflavonoidy jsou v idském těle dále metabolizovány [4]. Část z ich je v átrech konjugována s lukuronáty a sulfáty. Volné izoflavonoidy jsou dále dehydroxylovány, demetylovány a mění se aromatický kruh [21]. Všechny tyto transformace se odehrávají pravděpodobně v tlustém střevě. Nejdůležitější transformací je metabolická přeměna daidzeinu přes dihydrodaidzein na equol nebo O-desmethylangolensin prostřednictvím střevní mikroflóry [8]. Oproti O-desmethylangolensinu vykazuje equol značnou estrogenní aktivitu a je považován za nejsilnější známý fytoestrogen [1]. Equol byl poprvé izolován roku 1932 Marrianem a Haslewoodem z oči březích klisen jako kontaminant při izolaci hormonu hydroxyestrinu [12]. V idské moči byl equol poprvé izolován roku 1982 Axelsonem [1].
Estrogenní aktivita equolu může být vysvětlena strukturní podobností se 17-ß-estradiolem [18], díky které je umožněna vazba na estrogenové receptory (ER). Fytoestrogeny celkově vykazují vyšší afinitu k ER ß.
Na rozdíl od endogenních estrogenů působí fytoestrogeny pouze jako slabí agonisté, jejichž estrogenicita se projeví až v odmínkách nedostatku estrogenů endogenních, v postmenopauze.
Ačkoli téměř všechny živočišné druhy dokážou produkovat equol, u lidí to tak jednoznačné není. Publikované články ukazují, že pouze 30–60 % populace je schopno daidzein přeměnit na equol [19, 20, 10, 17]. Tato část populace je nazývána producenty equolu.
Produkce equolu závisí na přítomností equol-produkujících střevních bakterií. V dnešní době jsou v lidském střevu známy 2 rody těchto bakterií – Egghertella sp. a Adlercreutzia equolifaciens [13, 28]. Thaworkuno a kol. objevili v roce 2009 v krysím střevu nový rod equol-produkující bakterie – Asacharobacter celatus [27]. Equol je chirální látka, vyskytuje se ve 2 enantiomerních formách: R - a S-equol. Činností střevní mikroflóry vzniká vždy S-equol, R-equol byl připraven pouze synteticky [22]. S-equol vykazuje 13krát vyšší afinitu k ERß než R equol, proto má vyšší estrogenní aktivitu. R-equol preferuje pro svou vazbu ERα, který zprostředkovává vyšší estrogenní odezvu [15]. Na rozdíl od jiných látek takřka 50 % S-equolu cirkuluje v rvi ve volné nevázané formě. Oproti tomu, množství volného daidzeinu v rvi je menší než 20 % a estradiol cirkuluje v rvi ve volné formě pouze v éně než 5 %. Vzhledem k omu, že pouze volná frakce je schopna navázat se na příslušný receptor, může tento fakt také zapříčiňovat estrogenní aktivitu S equolu [16].
SOUBOR PACIENTEK A METODIKA
Studie byla prováděna ve spolupráci s Endokrinologickým ústavem v Praze. Celkem bylo vyšetřeno 60 pacientek. Do studie bylo zařazeno 28 pacientek. Většina z 32 nezařazených pacientek nebyla ochotná platit vysoké sumy za fytoestrogenní léčbu, ostatní se zapomněly dostavit k druhému odběru vzorků či nebyly prokázány normální postmenopauzální hodnoty hormonů. Deset z pacientek zařazených do studie bylo pacientkami gynekologické ambulance Klaudiánovy nemocnice v Mladé Boleslavi. Všechny pacientky byly v klimakteriu a měly normální menopauzální hodnoty estradiolu, LH a FSH. Pacientkám byla změřena bazální hladina S-equolu v moči a poté podána tříměsíční kúra fytoestrogenových přípravků založených na extraktech ze sóji (Isoflavone cps.) či červeného jetele (Menoflavon). Denní dávka byla 80 mg izoflavonoidů. Po ukončení terapie byly opět stanoveny hladiny S-equolu v moči. Stanovení koncentrace S-equolu bylo provedeno metodou nepřímé kompetitivní imunoanalýzy (ELISA), vyvinutou pro účely této studie pracovníky Endokrinologického ústavu v Praze. Podrobnosti ohledně metodiky stanovení koncentrací S equolu byly již publikovány v práci Sosvorové a kol. [24]. Všechny pacientky měly normální stravovací návyky a podepsaly informovaný souhlas se vstupem do studie. Zároveň byl stanoven Kuppermanův index klimakterických obtíží [9] (tab. 1) před zahájením terapie a po jejím ukončení. Pacientky byly rozděleny na producentky a non-producentky S-equolu podle močové koncentrace S-equolu po terapii. Pacientky s hladinami koncentrace do 1 ng/ml byly považovány za non-producentky, pacientky s koncentracemi vyššími za producentky. Pro srovnání koncentrací S-equolu před terapií a po ní, stejně jako pro srovnání Kuppermanova indexu před terapií a po ní byly použity Studentovy t-testy. Pro výpočet závislosti mezi proměnnými byl použit Pearsonův korelační koeficient. Jako hladina statistické významnosti byla použita hodnota p = 0,05. Pro statistické zhodnocení byl použit program STATISTICA 10.0 (StatSoft ČR, s.r.o.).
Tab. 1. Výpočet Kuppermanova indexu 
VÝSLEDKY
Z celkového počtu 28 pacientek bylo 16 pacientek určeno jako producentky S-equolu, zbylých 12 jako non-producentky. Bazální hladiny S-equolu byly 0,34 ± 0,37 ng/ml ve skupině producentek a 0,29 ± 0,30 ng/ml ve skupině non-producentek. Po terapii se ve skupině producentek zvýšila močová koncentrace S-equolu na 10,67 ± 11,57 ng/ml (p = 0,002) a na 0,34 ± 0,30 ng /ml (p = 0,701) ve skupině non-producentek. Hodnota Kuppermanova indexu u producentek před terapií dosahovala 23,44 ± 11,57 bodu u non-producentek 17,25 ± 7,78 bodu. Po terapii se průměrná hodnota Kuppermanova indexu snížila u producentek na 14,44 ± 9,97 bodu (p = 0,003) a na 12,00 ± 7,18 bodu (p = 0,100) u non-producentek. Průměrné zlepšení u producentek dosáhlo 9,00 ± 7,69 bodu. Výsledky jsou shrnuty v tabulce 2, signifikantní rozdíly jsou vyznačeny tučně. Korelace mezi hodnotou zlepšení Kuppermanova indexu a močovou koncentrací S-equolu po terapii nebyla u producentek nalezena, Pearsonův korelační koefcient byl r = 0,28, při p = 0,298. Stejně tak nebyla nalezena korelace mezi vstupní a konečnou hodnotou močové koncentrace S equolu ve skupině producentek, r = 0,10, při p = 0,737.
Tab. 2. Hodnoty jsou uvedeny jako průměr ± SD, KI = Kuppermanův index 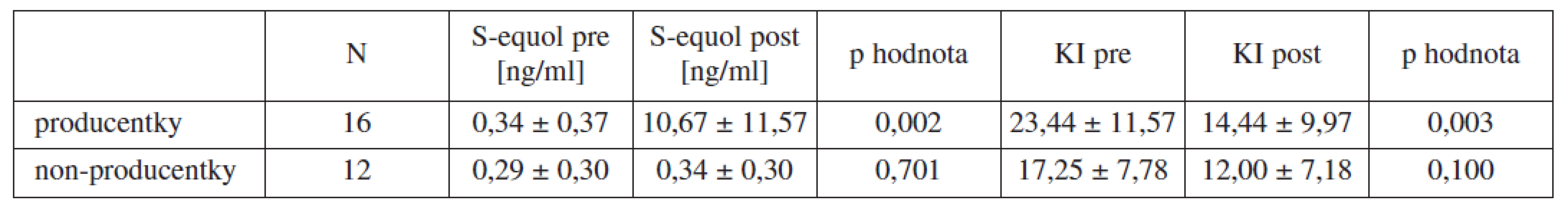
DISKUSE
Koncentrace močového S-equolu 1 ng/ml se ukázala jako vhodné kritérium pro rozdělení pacientek na producentky a non-producentky. Průměrný pokles Kuppermanova indexu ve skupině producentek byl 9 bodů, ve skupině non-producentek 5 bodů. Pokles ve skupině non-producentek lze přičítat placebo efektu, neboť koncentrace močového S-equolu byla před terapií i po terapii velmi podobná, statisticky signifikantní rozdíl zaznamenán nebyl. Na druhé straně je třeba uvážit existenci placebo efektu i ve skupině producentek, nicméně pokles Kuppermanova indexu ve skupině producentek byl téměř dvojnásobný v porovnání se skupinou non-producentek. Vzhledem k nestejným obtížím před terapií v obou skupinách (průměrný Kuppermanův index 23,44 vs 17,25) dává lepší představu relativní pokles Kuppermanova indexu, který ve skupině non-producentek dosáhl přibližně 30 %, ve skupině producentek přibližně 40 %. Efekt terapie fytoestrogeny je tedy zřejmý i na našem relativně malém vzorku pacientek. Naše výsledky dobře korespondují s placebem kontrolovanými dvojitě zaslepenými prospektivními studiemi z edávné doby [5, 6, 7], kde byl ve všech případech zaznamenán signifikantní pokles Kuppermanova indexu u pacientek léčených fytoestrogeny i u pacientek léčených placebem (v naší studii pokles ve skupině non-producentek, kterou lze vzhledem k neměněným hodnotám koncentrace močového S-equolu po terapii považovat za kontrolní skupinu, dosáhl pokles jen marginální signifikance na hladině p = 0,1). Pokles obtíží byl po podání fytoestrogenů ve všech výše uvedených studiích výraznější a všechny studie konstatují zejména významné zlepšení vazomotorických projevů menopauzy – návalů horka. Studie Heyericka a kol. [7] se zaměřila též na dávkování fytoestrogenů, nicméně nenachází žádnou závislost dávka-účinek. Tento výsledek opět zřetelně odpovídá výsledkům naší studie, kdy nebyla ve skupině producentek nalezena korelace mezi močovou koncentrací S-equolu před terapií a po ní, stejně jako u producentek nebyla nalezena korelace mezi močovou koncentrací S equolu po terapii a velikostí poklesu Kuppermanova indexu. Z koncentrace S-equolu při terapii tedy nelze soudit na velikost klinického efektu, stejně jako nelze predikovat výslednou koncentraci močového S-equolu po terapii. Nemá tedy hlubší smysl zabývat se otázkou dávkování fytoestrogenů ve vztahu k obtížím studovaným v rámci Kuppermanova dotazníku. Námi zvolená dávka 80 mg denně se ukázala jako dostatečná pro spolehlivé rozdělení pacientek na producentky a non-producentky a zároveň dostatečná pro průkaz klinického efektu podání fytoestrogenů ve skupině producentek S-equolu.
V naší studii jsme se zaměřili na hodnocení menopauzálních obtíží pacientek pomocí Kuppermanova indexu. Zcela stranou zůstaly stát obtíže spojené s osteoporózou. Efekt užívání fytoestrogenů na tyto obtíže je diskutabilní a studie zabývající se touto problematikou nepřináší jasnou odpověď, jak ukazuje metaanalýza Taku a kol. [26].
ZÁVĚR
Efekt léčby fytoestrogeny byl u pacientek v menopauze schopných produkovat S-equol jednoznačně prokázán. Zavedená forma testování pacientek na produkci S equolu společně s navrženou rozhodující hladinou koncentrace močového S-equolu po terapii 1 ng/ml dobře koresponduje s rozdělením pacientek na producentky a non-producentky S-equolu, a tím s lepším klinickým efektem podání fytoestrogenových preparátů.
Práce vznikla za podpory projektu GAČR 303/08/0958.
MUDr. V. Bičíková
Oblastní nemocnice Mladá Boleslav
oddělení gynekologicko-porodnické
Václava Klementa 147
293 50 Mladá Boleslav
Zdroje
1. Axelson, M., Kirk, DN., Farrant, RD., et al. The identification of the weak oestrogen equol [7-hydroxy-3-(4’-hydroxyphenyl)chroman] in human urine. Biochem J, 1982, 201, p. 353-357.
2. Chen, YM., Ho, SC., Lam, SS., et al. Soy isoflavones have a favorable effect on bone loss in Chinese postmenopausal women with lower bone mass: a double-blind, randomized, controlled trial. J Clin Endocrinol Metab, 2003, 88, p. 4740-4747.
3. Clarkson, TB. Soy, soy phytoestrogens and cardiovascular disease. J Nutr, 2002, 132, p. 566S-569S.
4. Cornwell, T., Cohick W., Raskin, I. Dietary phytoestrogens and health. Phytochemistry, 2004, 65, p. 995-1016.
5. Erkkola, R., Vervarcke, S., Vansteelandt, S., et al. A randomized, double-blind, placebo-controlled, cross-over pilot study on the use of a standardized hop extract to alleviate menopausal discomforts. Phytomedicine, 2010, 17, p. 389-396.
6. Ferrari, A. Soy extract phytoestrogens with high dose of isoflavones for menopausal symptoms. J Obstet Gynaecol Res, 2009, 35, p. 1083-1090.
7. Heyerick, A., Vervarcke, S., Depypere, H., et al. A first prospective, randomized, double-blind, placebo-controlled study on the use of a standardized hop extract to alleviate menopausal discomforts. Maturitas, 2006, 54, p. 164-175.
8. Joannou, GE., Kelly, GE., Reeder, AY., et al. A urinary profile study of dietary phytoestrogens. The identification and mode of metabolism of new isoflavonoids. J Steroid Biochem Mol Biol, 1995, 54, p. 167-184.
9. Kupperman, HS., Blatt, MH., Wiesbader, H., et al. Comparative clinical evaluation of estrogenic preparations by the menopausal and amenorrheal indices. J Clin Endocrinol Metab, 1953, 13, p. 688-703.
10. Lampe, JW., Karr, SC., Hutchins, AM., et al. Urinary equol excretion with a soy challenge: influence of habitual diet. Proc Soc Exp Biol Med, 1998, 217, p. 335-339.
11. Levis, S., Strickman-Stein, N., Ganjei-Azar, P., et al. Soy isoflavones in the prevention of menopausal bone loss and menopausal symptoms: a randomized, double-blind trial. Arch Intern Med, 2011, 171, p. 1363-1369.
12. Marrian, GF., Haslewood, GAD. Observations of the constitution of the oestrus-producting hormone. Lancet, 1932, 260, p. 282-284.
13. Maruo, T., Sakamoto, M., Ito, C., et al. Adlercreutzia equolifaciens gen. nov., sp. nov., an equol-producing bacterium isolated from human faeces, and emended description of the genus Eggerthella. Int J Syst Evol Microbiol, 2008, 58, p. 1221‑1227.
14. Murkies, AL., Lombard, C., Strauss, BJ., et al. Dietary flour supplementation decreases post-menopausal hot flushes: effect of soy and wheat. Maturitas, 1995, 21, p. 189-195.
15. Muthyala, RS., Ju, YH., Sheng, S., et al. Equol, a natural estrogenic metabolite from soy isoflavones: convenient preparation and resolution of R - and S-equols and their differing binding and biological activity through estrogen receptors alpha and beta. Bioorg Med Chem, 2004, 12, p. 1559-1567.
16. Nagel, SC., vom Saal FS., Welshons, WV. The effective free fraction of estradiol and xenoestrogens in human serum measured by whole cell uptake assays: physiology of delivery modifies estrogenic activity. Proc Soc Exp Biol Med, 1998, 217, p. 300‑309.
17. Rowland, IR., Wiseman, H., Sanders, TA., et al. Interindividual variation in metabolism of soy isoflavones and lignans: influence of habitual diet on equol production by the gut microflora. Nutr Cancer, 2000, 36, p. 27-32.
18. Sathyamoorthy, N., Wang TT. Differential effects of dietary phyto-oestrogens daidzein and equol on human breast cancer MCF-7 cells. Eur J Cancer, 1997, 33, p. 2384-2389.
19. Setchell, KD., Borriello, SP., Hulme, P., et al. Nonsteroidal estrogens of dietary origin: possible roles in hormone-dependent disease. Am J Clin Nutr, 1984, 40, p. 569-578.
20. Setchell, KD., Brown, NM., Desai, PB., et al. Bioavailability, disposition, and dose-response effects of soy isoflavones when consumed by healthy women at physiologically typical dietary intakes. J Nutr, 2003, 133, p. 1027-1035.
21. Setchell, KD., Brown NM., Lydeking-Olsen, E. The clinical importance of the metabolite equol-a clue to the effectiveness of soy and its isoflavones. J Nutr, 2002, 132, p. 3577-3584.
22. Setchell, KD., Clerici, C., Lephart, ED., et al. S-equol, a potent ligand for estrogen receptor beta, is the exclusive enantiomeric form of the soy isoflavone metabolite produced by human intestinal bacterial flora. Am J Clin Nutr, 2005, 81, p. 1072-1079.
23. Somekawa, Y., Chiguchi, M., Ishibashi, T., et al. Soy intake related to menopausal symptoms, serum lipids, and bone mineral density in postmenopausal Japanese women. Obstet Gynecol, 2001, 97, p. 109-115.
24. Sosvorová, L., Lanková, P., Bičíková, M., et al. Elisa for free S-equol in human urine. Czech J Food Sci, 2011, 29, p. 57-64.
25. Tai, TY., Tsai, KS., Tu, ST., et al. The effect of soy isoflavone on bone mineral density in postmenopausal Taiwanese women with bone loss: a 2-year randomized double-blind placebo-controlled study. Osteoporos Int, 2011.
26. Taku, K., Melby, MK., Kurzer, MS., et al. Effects of soy isoflavone supplements on bone turnover markers in menopausal women: systematic review and meta-analysis of randomized controlled trials. Bone, 2010, 47, p. 413-423.
27. Thawornkuno, C., Tanaka, M., Sone, T., et al. Biotransformation of daidzein to equol by crude enzyme from Asaccharobacter celatus AHU1763 required an anaerobic environment. Biosci Biotechnol Biochem, 2009, 73, p. 1435‑1438.
28. Yokoyama, S., Suzuki, T. Isolation and characterization of a novel equol-producing bacterium from human feces. Biosci Biotechnol Biochem, 2008, 72, p. 2660-2666.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2012 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Fytoestrogeny v menopauze: mechanismus účinku a výsledky léčby v sestavě 28 pacientek
- Psychosociální potřeby novorozence v kontextu perinatální péče
- Nové kolposkopické znaky – výběžky a vnitřní hranice
- Představuje asymptomatické nosičství mutace FV Leiden a FII protrombin v heterozygotní konfiguraci zvýšené riziko trombembolických komplikací v průběhu těhotenství, porodu a šestinedělí?
- Centralizace gynekologicko-porodnické péče
- Rizikové faktory pro vznik recidivy u borderline nádorů ovaria
- Je hysteroskopie správná volba pro řešení reziduí těhotenských tkání?
- Nákladová efektivita a další ekonomické aspekty strategií prenatálního screeningu trizomie 21 v České republice
- Infekce dolních močových cest u žen – možnosti diferencovaného přístupu léčby a prevence
- Neinvazívne meranie dĺžky bunkového cyklu v prvých dňoch embryonálneho vývoja - objektívne merateľný ukazovateľ životaschopnosti ľudských embryí
- Genetické faktory v etiopatogenezi děložních myomů
- Invazivní karcinom cervixu od depistážních akcí k národnímu screeningu v České republice
- Reakce na závěry Sekce UZ diagnostiky ČGPS publikované v Zpravodaji SSG ČR 4, 2011
- Reakce na připomínky MUDr. Petra Poláka, CSc., k dokumentům České gynekologické a porodnické společnosti (ČGPS) České lékařské společnosti (ČLS) Jana Evangelisty Purkyně (JEP)
- Změny ve specializačním vzdělávání v gynekologii a porodnictví od roku 2012
- PERIPARTÁLNÍ ŽIVOT OHROŽUJÍCÍ KRVÁCENÍ mezioborové konsenzuální stanovisko
- Problematika nabízení LBC v rámci screeningu karcinomu děložního hrdla v gynekologických ordinacích za úhradu pacientkou
- Metoda redukce odlesku v kolposkopii
- CELOSTÁTNÍ KONFERENCE České gynekologické porodnické společnosti ČLS JEP a Sdružení soukromých gynekologů ČR
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Je hysteroskopie správná volba pro řešení reziduí těhotenských tkání?
- Nové kolposkopické znaky – výběžky a vnitřní hranice
- Rizikové faktory pro vznik recidivy u borderline nádorů ovaria
- Psychosociální potřeby novorozence v kontextu perinatální péče
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



