-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Fyziologie stárnutí
Physiology of ageing
Aging is a process of gradually reducing abilities and functional capacities of the organism. It is a universal process with a considerable degree of variability that is characteristic of all higher animals. Among the theories of ageing, the theory of damage accumulation, which integrates the mechanisms of ageing known to date, is currently widely accepted. This theory is based on pathophysiological processes, injurious changes can occur in the human body. These changes can be understood as damage. Due to the continuous accumulation of damage, the whole system is subsequently deteriorated. The aim of the present work is to characterize the basic pathophysiological mechanisms of aging (damage) in the light of current scientific knowledge and to show them in their hierarchical context.
Keywords:
Physiology – aging – genome – cell
Autoři: Pavel Borský 1; Drahomíra Holmannová 1; Zdeněk Fiala 1; Lenka Borská 1; Libor Hruška 2; Otto Kučera 3
Působiště autorů: Ústav preventivního lékařství LF UK v Hradci Králové 1; Klinika onkologie a radioterapie LF UK a FN Hradec Králové 2; Ústav fyziologie LF UK v Hradci Králové 3
Vyšlo v časopise: Čas. Lék. čes. 2022; 161: 11-16
Kategorie: Přehledový článek
Souhrn
Stárnutí je proces postupného snižování schopností a funkčních kapacit organismu. Jedná se o univerzální děj se značným stupněm variability, který je charakteristický pro všechny vyšší živočichy. Mezi teoriemi popisujícími stárnutí dominuje v současné době teorie akumulace poškození, která integruje dosud známé mechanismy stárnutí. Teorie se opírá o skutečnost, že při patofyziologických procesech může v lidském těle docházet k nežádoucím změnám, které lze chápat jako poškození. Vlivem průběžné akumulace těchto poškození dochází následně k deterioraci celého systému. Uvádíme základní patofyziologické mechanismy stárnutí (poškození) s ohledem na nejnovější vědecké poznatky a ukazujeme jejich hierarchické souvislosti.
Klíčová slova:
stárnutí – genom – buňka – fyziologie
ÚVOD
Stárnutí (aging) je proces postupného snižování funkčních kapacit lidského těla. Dochází při něm ke strukturálním změnám všech tělních systémů, orgánů, tkání i buněk (1). Vysoký věk je nejvýznamnějším rizikovým faktorem celé řady onemocnění, neboť úmrtnost na kardiovaskulární, metabolická, onkologická a jiná onemocnění stoupá během života exponenciálně (2, 3). Stárnutí je sice univerzální proces vyskytující se u všech obratlovců, neměří však všem druhům stejně. Studie popisují, že zvířata s vysokou klidovou tepovou frekvencí rychleji stárnou a dožívají se kratšího života než ta s frekvencí nižší (4). I když tedy stárneme všichni, nestárneme stejně rychle. Odlišné rychlosti stárnutí nalezneme mezi jedinci stejného druhu, různě stárnou dokonce i jednotlivé tkáně (5).
PŘÍČINY STÁRNUTÍ
Během posledních dekád se objevila řada teorií popisujících příčiny stárnutí (6). Tou, která v posledních letech nabývá na vědeckém významu, je teorie akumulace poškození. Snaží se totiž integrovat všechny doposud známé patofyziologické mechanismy stárnutí. Uvádí, že při každém procesu v lidském těle může docházet s různou mírou pravděpodobnosti k poškození, ke vzniku chyby. Průběžnou akumulací chyb během života postupně dochází k deterioraci celého systému (7).
Tento nový pohled na příčiny stárnutí dal vzniknout jednotnému názoru na změny odehrávající se v jeho průběhu, které byly přehledně shrnuty v publikaci „The hallmarks of aging“ (8). Tato významná práce rozdělila znaky stárnutí na 9 vzájemně propojených typů poškození, u nichž je prokázáno, že jejich ovlivněním lze ve větší či menší míře ovlivnit délku života pokusných subjektů. Těmito znaky stárnutí jsou genomová nestabilita, epigenetické změny, zkracování telomer, porucha homeostázy proteinů, narušení cest vnímání nedostatku živin, mitochondriální dysfunkce, buněčná senescence, vyčerpání kmenových buněk a změny v mezibuněčné komunikaci (8). Popis vzájemných mimoúrovňových vztahů jednotlivých znaků stárnutí zachycuje v hierarchickém uspořádání obr. 1.
Obr. 1. Hierarchie změn v organismu, molekulárních až systémových 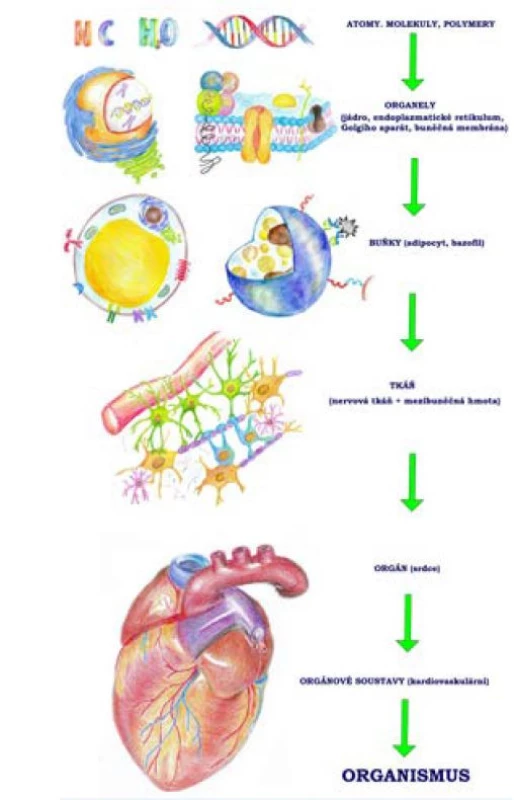
MOLEKULÁRNÍ ZMĚNY
Genomová nestabilita
Vyšší míra poškození DNA zvyšuje pravděpodobnost časného úmrtí (9). V průběhu života je genetická informace negativně ovlivňována chemicky (například volnými radikály a mutageny), fyzikálně (například ionizujícím zářením) i biologicky (například viry nebo chybami při replikaci DNA), čímž dochází k hromadění defektů DNA. Se zvyšujícím se počtem defektů buňka stárne a roste riziko smrti buňky nebo maligní transformace (10). Ochranou proti hromadění defektů DNA jsou reparační mechanismy, jejichž účinnost však během života postupně klesá (11).
Genetické faktory (geny a jejich varianty) mohou délku života zkracovat, jsou však popsány i varianty genů, které predisponují k dlouhověkosti (12). Význam genetických faktorů v procesu stárnutí potvrzuje existence vzácných genetických syndromů, které vedou k předčasnému stárnutí (např. progerie). Společným znakem těchto onemocnění je mutace/poškození genů zodpovědných za opravu genetické informace nebo stabilizaci struktur jádra či jaderné DNA. Tyto syndromy mají časný nástup některých fenotypových projevů stáří (například aterosklerózy, osteoporózy, maligních nádorů a cukrovky) již v dětství a jsou příčinami předčasných úmrtí (13, 14).
Zkracování telomer
Dostatečně dlouhé koncové části chromosomů (telomery), jsou jednou ze základních podmínek pro úspěšné buněčné dělení. Při mitotickém dělení se telomery zkracují. Po dosažení určité kritické délky telomer dojde k zástavě procesu dělení a buňka se již dále dělit nemůže (maximální počet dělení buněk je nazýván Hayflickův limit). Buňky, které exprimují enzym telomerázu, jsou schopné telomery prodlužovat (15).
Vysoká aktivita telomerázy je typická nejen pro zárodečné a kmenové buňky, ale i pro maligně transformované buňky. Na jednu stranu tak nepřítomnost telomerázy může bránit vývoji maligního bujení, na straně druhé však brání obnově a dělení zdravých buněk (8, 15). Nicméně poslední studie naznačují, že zvýšená aktivita telomerázy nevede ke zvýšenému riziku malignit, ale naopak k prodloužení střední délky života. U laboratorních myší, kterým byla aktivita telomerázy zvýšena (metodami genového inženýrství), došlo k prodloužení střední délky života až o 24 % (16).
Epigenetické změny
Stárnutí vede k významným změnám organizace chromatinu i DNA. Dochází při něm ke snížení množství heterochromatinu, ke ztrátě a remodelaci nukleosomů a ke změnám na histonech. Metylace DNA je ve stáří celkově snížena, nicméně některé oblasti DNA mohou být i hypermetylovány (cytosin-fosfát-guaninové ostrůvky; CpG) (17).
Během stárnutí se mění exprese velkého množství genů. Míra této exprese se velmi liší nejen mezi jedinci různých druhů, ale i téhož druhu, a může se lišit i mezi různými tkáněmi u stárnoucího jedince. Tento jev je známkou dysregulace genové exprese. I dysregulace si udržuje určité typické změny, vzorce genové exprese typické pro stárnutí, např. exprese genů a proteinů, které úzce souvisejí s funkcemi mitochondrií, bývají obvykle sníženy. Naopak se zvyšuje exprese genů a proteinů, které souvisejí s oxidačním stresem, zánětlivou odpovědí organismu a reparačními enzymy (18). V souvislosti se stárnutím byly rovněž popsány změny v kvalitě a kvantitě mikroRNA (miRNA) (19).
Oxidační stres
V průběhu fyziologických procesů, například zpracování živin, imunitní odpovědi a buněčného dýchání, vznikají reaktivní intermediáty, které jsou schopny oxidovat další biomakromolekuly. Jedná se o kyslíkové (ROS – reactive oxygen species), dusíkové (RNS – reactive nitrogen species) a uhlíkové intermediáty, které mohou mít charakter radikálový (například superoxidový aniont či hydroxylový radikál) nebo neradikálový (například peroxid vodíku). Intermediáty plní řadu důležitých fyziologických funkcí (například usmrcování patogenů při imunitních reakcích), nicméně pro udržení buněčné homeostázy je nezbytná regulace jejich hladin antioxidačními systémy (20).
Je zřejmé, že oxidační stres se podílí na urychlení stárnutí a progresi degenerativních procesů v organismu. Je spojený mimo jiné i s nestabilitou DNA, stresem endoplazmatického retikula, poškozením mitochondrií, apoptózou buněk, zánětovým procesem a nádorovým bujením (21, 22).
Porucha homeostázy proteinů
V lidském těle dochází k neustálé obměně bílkovin. Z důvodu postupné změny v jejich produkci se vlivem narůstajícího věku tato obměna zpomaluje, a hlavně selhávání mechanismů degradace starých či nefunkčních proteinů. Současně se snižuje i aktivita mechanismů, které se podílejí na správném prostorovém uspořádání nově exprimovaných proteinových molekul. Akumulace chybně složených nebo agregovaných polypeptidových řetězců potom přispívá k vývoji degenerativních onemocnění. Odstraňování starých, poškozených či změněných makromolekul, zejména proteinové povahy, zajišťují lyzosomy a ubikvitin-proteasomový systém. Degradační aktivita obou zmíněných cest se během stárnutí snižuje, což vede ke hromadění pozměněných bílkovinných makromolekul, například vznikají agregáty β-amyloidu, α-synukleinu a τ-proteinu u neurodegenerativních onemocnění (23).
Narušené vnímání dostupnosti živin (narušená autofagie)
Růst a vývoj je u savců regulován růstovým hormonem a jeho sekundárním mediátorem, inzulinu podobným růstovým faktorem 1 (IGF-1). Intracelulární signální cesta IGF-1 je analogická signální cestě pro inzulin, a proto bývá souhrnně označována jako signální cesta inzulinu a IGF-1 (IIS) (8). Dosud provedené studie naznačují, že organismy s konstitutivně sníženou aktivitou IIS se dožívají vyššího věku v důsledku nižší úrovně metabolismu a buněčného růstu, a tím pravděpodobně i pomalejší akumulace poškození (24, 25). Dlouhodobá aktivace této signální dráhy v dospělosti má za následek nežádoucí stimulaci dalšího vývoje organismu bez ohledu na ukončení jeho vývojového období. To vede k akumulaci poškození a k urychlení procesu stárnutí (26).
Při snížení aktivity IIS a některých jiných signálních drah zahajuje buňka proces autofagie, který vede k efektivní degradaci a recyklování nepotřebných nebo poškozených komponent buněk, a tím zpomaluje proces stárnutí organismu (27).
Významnými faktory v oblastech buněčného růstu, dostupnosti živin a autofagie jsou také mTOR (serin/threoninová kináza) a komplexy, které mTOR vytváří (mTORC1) (28). V případě dostatku živin podporuje mTORC1 buněčný růst a suprimuje autofagii (29).
Posttranslační modifikace
Co se týče změn v metabolismu se u stárnoucích osob, často se setkáváme s vyššími hodnotami glykémie, porušenou glukózovou tolerancí a inzulinovou rezistencí. Vyšší hladiny glukózy v krvi vedou k posttranslační modifikaci biomakromolekul, zejména proteinů. Tento děj je spojený s jejich strukturními a funkčními změnami a se změnami v jejich zapojení do dalších fyziologických procesů (30). Nejznámějšími proteinovými modifikacemi spojenými s vyššímu hodnotami cukrů jsou produkty pokročilé glykace (AGEs – advanced glycation endproducts). Glykace bílkovin mezibuněčné hmoty (například kolagenu či elastinu) výrazně mění vlastnosti a funkce pojivových tkání ve smyslu snížení jejich elasticity a odolnosti (31, 32). Dalším typem časté posttranslační modifikace je karbamylace (33), která postihuje především proteiny v oblasti N-konce aminokyselin lysinu a argininu.
ORGANELOVÉ ZMĚNY
Mitochondrie
Mitochondrie jsou jedním z nejdůležitějších buněčných zdrojů ROS a hlavním místem produkce adenosintrifosfátu (ATP). Hrají rovněž klíčovou úlohu v procesu buněčné smrti (34). Dlouhodobým působením ROS během stárnutí organismu dochází k poškozování mitochondriální DNA, matrixových mitochondriálních proteinů a komplexů respiračního řetězce (35, 36). Rovněž dochází k ultrastrukturálním změnám mitochondrií. Výsledkem uvedených změn je pokles produkce ATP. S nárůstem věku dochází ke snižování efektivity procesů mitofagie a mitoptózy (procesů zániku a odstraňování mitochondrií), což má za následek kumulaci poškozených mitochondrií v buňkách (37, 38). Patologicky změněné mitochondrie se zapojují do rozvoje chronického afunkčního zánětu ve stáří (inflammaging). Změněná morfologie i funkce mitochondrií jsou tedy příčinou i důsledkem stárnutí (39).
Endoplazmatické retikulum
Změny probíhající v organismu během stárnutí se projevují rovněž v endoplazmatickém retikulu (ER). ER se podílí na udržování řady důležitých dějů, včetně proteostázy (translace, skládání a degradace proteinů), homeostázy vápníku a syntézy lipidů. Důležitým dějem v ER je též posttranslační modifikace proteinů (40).
Se zvyšujícím se věkem jsou patrné narůstající změny v syntéze a dalším zpracování polypeptidových řetězců. Důsledkem je přetížení kapacity ER, do něhož ve zvýšené míře přestupují lineární či špatně složené polypeptidové řetězce (41, 42). Narušení procesu zpracování a degradace proteinů v ER vede k jejich akumulaci v této buněčné organele a dalšímu rozvratu buněčného prostředí (43).
Lyzosomy
Dalšími organelami, které se mění v průběhu stárnutí, jsou lyzosomy. Lyzosomy recyklují a odstraňují poškozené či cizorodé látky z buňky. Obsahují velké množství hydrolytických enzymů zasahujících do procesů autofagie, endocytózy a fagocytózy. Jak bylo zmíněno výše, s věkem se efektivita autofagie snižuje, což má za následek kumulaci nežádoucích produktů a poškozených struktur buňky (44).
Dle tzv. garbage accumulation theory se s věkem zvyšuje počet lyzosomů, nicméně nové organely jsou náchylnější k poškození, které může být vyvoláno např. oxidačním stresem (45). U nových organel je také narušená funkce. Dochází totiž k omezení fúze lyzosomů s fagosomy a autofagosomy, ke snižování aktivity lyzosomových enzymů a k nedostatečné acidifikaci jejich obsahu. Uvnitř lyzosomů se tak nachází více sekundárně modifikovaných, špatně rozložitelných substrátů (například lipofuscin) (46, 47).
Proteasomy a ribosomy
Proteasom-ubikvitinový systém se podílí na degradaci poškozených a chybně vzniklých proteinů a je nezbytný pro udržení proteostázy. Ubikvitinované proteiny jsou rozpoznávány proteasomem 26S, ve kterém jsou rozloženy. S věkem dochází k poklesu aktivity proteasom-ubikvitinového systému s následným hromaděním proteinů, které mohou agregovat a poškozovat buňku. Za pokles aktivity je zodpovědná snížená exprese proteasomových podjednotek, narušené sestavování proteasomů a oxidační stres (48, 49).
Ribosomy jsou odpovědné za translaci genetické informace do polypeptidového řetězce. Proces stárnutí je spojen s několika hlavními změnami v morfologii a funkcích ribosomů. Dochází ke snížení biogeneze, tj. počtu ribosomů v buňce. Klesá též translační aktivita ribosomů, a to hlavně u proteinů kódujících mRNA, chránících buňku před poškozením a zajišťující její reparaci (50, 51). Navíc dochází i k translačním chybám v inkorporaci jednotlivých aminokyselin do polypeptidového řetězce (52).
Cytoskelet
Zachování integrity cytoskeletu je nezbytné prakticky pro všechny klíčové buněčné procesy. Jako příklady lze uvést fagocytózu, pohyb materiálu a organel v buňce, pohyb buňky, adhezi, dělení buněk, myelinizaci axonů a axonální transport. Během stárnutí dochází ke snížení produkce a k nežádoucí agregaci a posttranslační modifikaci cytoskeletálních proteinů (např. mikrofilament, intermediárních filament a mikrotubulů). Uvedené poškozující mechanismy mění charakter a funkci proteinů, které jsou navíc omezeně degradovány. Tím jsou ovlivněny i procesy, jichž se proteiny účastní a významně se urychluje degenerace celého organismu (53, 54).
Buněčné membrány
Buněčné membrány se neomezují jen na povrch buňky, ale ohraničují i jednotlivé organely. S membránami je svázáno velké množství klíčových biochemických procesů (například dýchací řetězec, oxidativní fosforylace, endocytóza) a jejich poškození má negativní dopad na funkce a životaschopnost buněk (55).
Molekulární změny, které postihují membrány, jsou úzce spjaty s faktory stárnutí. Významnou roli přitom hraje oxidační stres, při kterém volné radikály reagují s lipidy membrán (peroxidace lipidů). Důležité jsou také věkem podmíněné změny v lipidovém složení membrán. Například v membránách neuronů dochází s narůstajícím věkem ke snižování zastoupení gangliosidů a cholesterolu. Tento jev má negativní dopad na fuzogenitu membrán (schopnost fúze), čímž se zpomaluje uvolňování vezikul s neurotransmitery (56).
BUNĚČNÉ ZMĚNY A EXTRACELULÁRNÍ MATRIX
Buněčná senescence
Buněčná senescence je proces přeměny buněk z hlediska funkčního i morfologického. Senescentními se buňky stávají po absolutním zkrácení délky telomer, které neumožňuje jejich další dělení, nebo pod vlivem významného poškození DNA (35). Senescentní buňky se nachází ve stavu trvalé zástavy buněčného cyklu. Tyto buňky jsou vyřazeny z buněčného dělení, nicméně vykazují zvýšenou odolnost vůči apoptóze. Proces senescence brání poškozeným buňkám v dalším dělení a zabraňuje tak šíření nežádoucích mutací v těle.
Senescentní buňky produkují velké množství působků, které ovlivňují také imunitní buňky, a tedy i zánět. Mohou podpořit reparaci tkání, bránit tumorigenezi a jsou nezbytné i pro zdárnou embryogenezi, během které parakrinně ovlivňují vývoj končetin a remodelaci tkání (57). S rostoucím věkem se však počet senescentních buněk ve tkáních zvyšuje, což vede k chronické dysfunkční stimulaci imunitního systému (inflammagingu), který k procesu stárnutí naopak přispívá (8, 57).
Buněčné poškození a buněčná smrt
Programovaná buněčná smrt má různé formy. Patří k nim apoptóza, autofagie, nekróza, nekroptóza, pyroptóza, NETóza, oxeiptóza a alkaliptóza. Forma smrti, kterou projde buňka, závisí na druhu buňky, na typu a tíži poškození a na mikroprostředí, v němž se buňka nachází (58).
Zvýšená míra poškození buněk během stárnutí má za následek vyšší výskyt buněčné smrti. Naopak klesají funkce imunitního systému, včetně fagocytózy, díky níž jsou odstraňovány zaniklé buňky a jejich části. Pokud k tomu nedojde, jsou imunitnímu systému odhalovány intracelulární antigeny, s nimiž se za fyziologických podmínek nesetkává. Ze zaniklých buněk se také uvolňují i složky, které mají funkci alarminů (DAMPs – damage-associated molecular patterns,) a aktivují zánětlivou imunitní odpověď. V takovém prostředí může dojít k prolomení imunologické tolerance a rozvoji autoimunitního onemocnění, což dokládá i jejich zvýšený výskyt ve stáří (59).
Vyčerpání kmenových buněk
Jednou z nejvýznačnějších charakteristik stárnutí je ztráta regeneračního potenciálu tkání. S věkem dochází nejen ke snížení hematopoézy, ale také k postupnému snížení funkce všech ostatních kmenových buněk (8). Studie na myších prokázaly, že hematopoetické kmenové buňky starších myší jsou schopny podstoupit menší množství buněčných dělení než buňky od myší mladých (60). To je způsobeno zejména akumulací poškození DNA a postupným zkracováním telomer kmenových buněk (8, 61).
Mikrobiota
V současnosti je mikrobiotě (zejména střevní) věnována značná pozornost a některé studie naznačují, že změny v jejím složení by mohly být ukazatelem délky dožití (62). Během stárnutí dochází ke snižování diverzity mikrobioty a mění se též zastoupení bakteriálních druhů. Nárůst zaznamenávají například bakterie rodů Bacteroides, Enterobacteriaceae, Clostridiaceae a Eubacterium a výrazně se mění poměr mezi rody Firmicutes a Bacteroides. Zdá se, že změny bakteriálního zastoupení mohou mít vliv na vznik metabolických onemocnění a pokles kognitivních funkcí (63, 64).
Změněná mezibuněčná komunikace a imunitní systém
Změny v mezibuněčné komunikaci jsou během stárnutí patrné na úrovni autokrinní, parakrinní, endokrinní, neuroendokrinní i neuronální. Průvodním jevem stárnutí savců je zánět (inflammaging), který je důsledkem kombinace celé řady faktorů. Jedná se o akumulaci poškození ve tkáních, snížení schopnosti organismu efektivně se zbavovat patogenů (nefunkčních a poškozených tělních struktur), zvýšení tvorby prozánětlivých působků senescentními buňkami a buňkami imunitního systému a snížení autofagie (8, 65).
V imunitním systému dochází během stárnutí k mnoha změnám. Byly popsány změny jak v počtu imunitních buněk, tak i v jejich funkcích. Funkční změny zahrnují zejména sníženou schopnost prezentace antigenu, chemotaxe, fagocytózy, respiračního vzplanutí a změny v produkci cytokinů, ve které převažuje produkce prozánětlivých cytokinů. Výsledkem je chronický systémový zánět nízkého stupně. Ve specifické imunitě klesá počet naivních lymfocytů ve prospěch lymfocytů paměťových. Dochází také k poklesu počtu regulačních T lymfocytů a nárůstu prozánětlivých TH17 lymfocytů (66-68). Z uvedeného je zřejmé, že dysregulace imunitního systému (spojená se stárnutím) snižuje ochranné a hojivé funkce ve prospěch imunopatologických dějů.
Extracelulární matrix
Extracelulární matrix (ECM) poskytuje díky přímému kontaktu s integriny a dalšími povrchovými molekulami buněk buňkám strukturální podporu, mechanickou stabilitu a modifikuje jejich funkce. I v ECM se vlivem stárnutí projevují změny, které primárně souvisejí s produkcí, modifikací a degradací jejích složek (69). Během stárnutí buněk dochází ke snižování míry syntézy jednotlivých složek a jsou produkovány narušené a k fragmentaci náchylné molekuly, jejichž přítomnost negativně ovlivňuje strukturu ECM. Dalším negativním jevem jsou i změny v posttranslační modifikaci proteinů a glykoproteinů ve smyslu jejich glykace a karbamylace. S věkem navíc dochází ke zvyšování produkce matrixových metaloproteáz, které štěpí mezibuněčnou hmotu (70, 71).
TKÁŇOVÉ, ORGÁNOVÉ A SYSTÉMOVÉ ZMĚNY
Výše diskutované změny na molekulární a buněčné úrovni mají za následek změny na úrovni tkáňové. Tyto změny mají podobu atrofií, fibróz, ztráty elasticity a pevnosti tkání a spolu se snížením reparačních procesů vedou k omezování až ztrátám funkcí na úrovni orgánů a orgánových systémů. Velmi dobře viditelné jsou změny na pokožce, která vinou narušené produkce součástí mezibuněčné matrix ztrácí svoji pružnost a své bariérové a ochranné funkce. Stejně dobře je viditelná sarkopenie (svalová atrofie) provázená dinapedií (ztrátou svalové síly) (72, 73).
Změny v ostatních orgánech a systémech se projevují méně zřetelněji, nicméně po překročení určité kapacitní hranice ve vyšším věku mohou velmi rychle progredovat. Dobře byly popsány například změny v kardiovaskulárním systému, kde dochází k postupné diastolické a systolické dysfunkci, fibrotizaci a kalcifikaci chlopní, poruchám převodního aparátu a ke snížení senzitivity k vegetativnímu nervovému systému (74, 75).
Dochází rovněž ke změnám funkcí respiračního systému. Změny zahrnují redukci vitální kapacity plic, alteraci dýchacích svalů a snížení propustnosti alveolokapilární membrány, která klesá s rostoucí mírou fibrotizace. Stárnoucí populace má nižší plicní rezervu, sníženou sílu kašle a díky postupující dysfunkci řasinkového epitelu je očista plic obtížnější (76).
V gastrointestinálním traktu bývá narušena bariérová funkce, která spolu s mikrobiální dysbiózou může vést ke zvýšenému vstupu bakteriálních produktů i baktérií samotných do organismu (77). Obzvláště problematické bývají degenerativní změny v centrální nervové soustavě, které se projevují poklesem mentálních funkcí, postupným úpadkem osobnosti a omezením soběstačnosti (78).
Tkáňové, orgánové a systémové změny jsou v učebnicích medicíny obvykle popisovány jako nemoci. Je velmi důležité si uvědomit jejich úzkou souvislost s procesem stárnutí (dlouhodobé akumulace poškození), tedy s procesem probíhajícím od jemných molekulárních a buněčných změn až k propuknutí nemoci na úrovni orgánu nebo celého systému.
ZÁVĚR
Každý z uvedených znaků a procesů stárnutí má vliv jak na délku života, tak i na dobu života strávenou ve zdraví. Stárnutí představuje komplex velmi úzce propojených skupin patologických dějů, v jejichž důsledku dochází k akumulaci poškození na buněčné a molekulární úrovni a následně k poškozování celých tělních systémů. Uvedený proces vede nevyhnutelně ke zvýšené morbiditě a mortalitě jedinců ve stáří.
Stárnutí je přirozený proces postupného snižování strukturních a funkčních kapacit lidského těla, který má biologický podklad. Změna paradigmatu vnímání stárnutí spočívá v přesunu pozornosti od chronologického věku jako neovlivnitelného rizikového faktoru na věk biologický, který je faktorem ovlivnitelným. Stárnutí by podle posledních poznatků nemuselo být považováno za předurčený, neměnný a neovlivnitelný proces. Je pravděpodobné, že stárnutí je dějem proměnlivým a ovlivnitelným, který závisí na superpozici všech fyziologických stavů/procesů v těle jedince. Není pochyb o tom, že podrobnějším zkoumáním procesů stárnutí bude možné přispět k lepší charakterizaci vnímavosti jedince ke vzniku a rozvoji onemocnění a k prodloužení doby života strávené ve zdraví.
Čestné prohlášení
Autoři prohlašují, že nejsou ve střetu zájmů.
Adresa pro korespondenci:
MUDr. Pavel Borský
Ústav preventivního lékařství LF UK
Šimkova 870, 500 38 Hradec Králové
e-mail: borskyp@lfhk.cuni.cz
Zdroje
1. Kong Y, Trabucco SE, Zhang H. Oxidative stress, mitochondrial dysfunction and the mitochondria theory of aging. Interdiscip Top Gerontol 2014; 39 : 86–107.
2. Dhingra R, Vasan RS. Age as a risk factor. Med Clin North Am 2012; 96(1): 87–91.
3. Pernar CH, Ebot EM, Wilson KM, Mucci LA. The epidemiology of prostate cancer. Cold Spring Harb Perspect Med 2018; 8(12): a030361.
4. Levine HJ. Rest heart rate and life expectancy. J Am Coll Cardiol 1997; 30(4): 1104–1106.
5. Horvath S. DNA methylation age of human tissues and cell types. Genome Biol 2013; 14(10): R115.
6. da Costa JP, Vitorino R, Silva GM et al. A synopsis on aging-theories, mechanisms and future prospects. Ageing Res Rev 2016; 29 : 90–112.
7. Phoenix C, de Grey AD. A model of aging as accumulated damage matches observed mortality patterns and predicts the life-extending effects of prospective interventions. Age (Dordr) 2007; 29(4): 133–189.
8. Lopez-Otin C, Blasco MA, Partridge L et al. The hallmarks of aging. Cell 2013; 153(6): 1194–1217.
9. Whittemore K, Martinez-Nevado E, Blasco MA. Slower rates of accumulation of DNA damage in leukocytes correlate with longer lifespans across several species of birds and mammals. Aging (Albany, NY) 2019; 11(21): 9829–9845.
10. Qiu GH, Zheng X, Fu M et al. The protective function of non-coding DNA in DNA damage accumulation with age and its roles in age-related diseases. Biogerontology 2019; 20(6): 741–761.
11. Lagunas-Rangel A, Bermúdez-Cruz F, Bermúdes-Cruz RM. The role of DNA repair in cellular aging process. DNA Repair - an update [online]. Intech Open, 2019.
12. Xu Y, Sun Z. Molecular basis of Klotho: from gene to function in aging. Endocr Rev 2015; 36(2): 174–193.
13. Lu L, Jin W, Wang LL. Aging in Rothmund-Thomson syndrome and related RECQL4 genetic disorders. Ageing Res Rev 2017; 33 : 30–35.
14. Laugel V. Cockayne syndrome: the expanding clinical and mutational spectrum. Mech Ageing Dev 2013; 134(5–6): 161–170.
15. Aubert G, Lansdorp PM. Telomeres and aging. Physiol Rev 2008; 88(2): 557–579.
16. Bernardes de Jesus B, Vera E, Schneeberger K et al. Telomerase gene therapy in adult and old mice delays aging and increases longevity without increasing cancer. EMBO Mol Med 2012; 4(8): 691–704.
17. Kane AE, Sinclair DA. Epigenetic changes during aging and their reprogramming potential. Crit Rev Biochem Mol Biol 2019; 54(1): 61–83.
18. Booth LN, Brunet A. The aging epigenome. Mol Cell 2016; 62(5): 728–744.
19. Wagner KH, Cameron-Smith D, Wessner B, Franzke B. Biomarkers of aging: from function to molecular biology. Nutrients 2016; 8(6): 338.
20. Pizzino G, Irrera N, Cucinotta M et al. Oxidative stress: harms and benefits for human health. Oxid Med Cell Longev 2017; 2017 : 8416763.
21. Schottker B, Brenner H, Jansen EH et al. Evidence for the free radical/oxidative stress theory of ageing from the CHANCES consortium: a meta-analysis of individual participant data. BMC Med 2015; 13 : 300.
22. Vina J. The free radical theory of frailty: Mechanisms and opportunities for interventions to promote successful aging. Free Radic Biol Med 2019; 134 : 690–694.
23. Koga H, Kaushik S, Cuervo AM. Protein homeostasis and aging: The importance of exquisite quality control. Ageing Res Rev 2011; 10(2): 205–215.
24. Harrison DE, Strong R, Sharp ZD et al. Rapamycin fed late in life extends lifespan in genetically heterogeneous mice. Nature 2009; 460(7253): 392–395.
25. Bitto A, Ito TK, Pineda VV et al. Transient rapamycin treatment can increase lifespan and healthspan in middle-aged mice. Elife 2016; 5.
26. Blagosklonny MV. Rapamycin for the aging skin. Aging (Albany, NY) 2019; 11(24): 12822–12826.
27. Stead ER, Castillo-Kvan JI, Miguel VEM et al. Agephagy - adapting autophagy for health during aging. Front Cell Dev Biol 2019; 7 : 308.
28. Papadopoli D, Boulay K, Kazak L et al. mTOR as a central regulator of lifespan and aging. F1000Res 2019; 8: F1000 Faculty Rev-998.
29. Tan VP, Miyamoto S. Nutrient-sensing mTORC1: integration of metabolic and autophagic signals. J Mol Cell Cardiol 2016; 95 : 31–41.
30. Chaudhuri J, Bains Y, Guha S et al. The role of advanced glycation end products in aging and metabolic diseases: bridging association and causality. Cell Metab 2018; 28(3): 337–352.
31. Bansode S, Bashtanova U, Li R et al. Glycation changes molecular organization and charge distribution in type I collagen fibrils. Sci Rep 2020; 10(1): 3397.
32. Senatus LM, Schmidt AM. The AGE-RAGE axis: implications for age-associated arterial diseases. Front Genet 2017; 8 : 187.
33. Badar A, Arif Z, Alam K. Role of Carbamylated biomolecules in human diseases. IUBMB Life 2018; 70(4): 267–75.
34. Dan Dunn J, Alvarez LA, Zhang X, Soldati T. Reactive oxygen species and mitochondria: A nexus of cellular homeostasis. Redox Biol 2015; 6 : 472–485.
35. Drew B, Phaneuf S, Dirks A et al. Effects of aging and caloric restriction on mitochondrial energy production in gastrocnemius muscle and heart. Am J Physiol Regul Integr Comp Physiol 2003; 284(2): R474–R480.
36. Sas K, Szabo E, Vecsei L. Mitochondria, oxidative stress and the kynurenine system, with a focus on ageing and neuroprotection. Molecules 2018; 23(1): 191.
37. Zorov DB, Popkov VA, Zorova LD et al. Mitochondrial aging: Is there a mitochondrial clock? J Gerontol A Biol Sci Med Sci 2017; 72(9): 1171–1179.
38. Zorov DB, Krasnikov BF, Kuzminova AE et al. Mitochondria revisited. Alternative functions of mitochondria. Biosci Rep 1997; 17(6): 507–520.
39. Chaabane W, User SD, El-Gazzah M et al. Autophagy, apoptosis, mitoptosis and necrosis: interdependence between those pathways and effects on cancer. Arch Immunol Ther Exp (Warsz) 2013; 61(1): 43–58.
40. Schwarz DS, Blower MD. The endoplasmic reticulum: structure, function and response to cellular signaling. Cell Mol Life Sci 2016; 73(1): 79–94.
41. Gidalevitz T, Stevens F, Argon Y. Orchestration of secretory protein folding by ER chaperones. Biochim Biophys Acta 2013; 1833(11): 2410–2424.
42. Graner MW, Lillehei KO, Katsanis E. Endoplasmic reticulum chaperones and their roles in the immunogenicity of cancer vaccines. Front Oncol 2014; 4 : 379.
43. Krammes L, Hart M, Rheinheimer S et al. Induction of the endoplasmic-reticulum-stress response: microRNA-34a targeting of the IRE1alpha-branch. Cells 2020; 9(6): 1442.
44. Xu H, Ren D. Lysosomal physiology. Annu Rev Physiol 2015; 77 : 57–80.
45. Stroikin Y, Dalen H, Brunk UT, Terman A. Testing the "garbage" accumulation theory of ageing: Mitotic activity protects cells from death induced by inhibition of autophagy. Biogerontology 2005; 6(1): 39–47.
46. Nagakannan P, Tabeshmehr P, Eftekharpour E. Oxidative damage of lysosomes in regulated cell death systems: Pathophysiology and pharmacologic interventions. Free Radic Biol Med 2020; 157 : 94–127.
47. Guha S, Coffey EE, Lu W et al. Approaches for detecting lysosomal alkalinization and impaired degradation in fresh and cultured RPE cells: evidence for a role in retinal degenerations. Exp Eye Res 2014; 126 : 68–76.
48. Lefaki M, Papaevgeniou N, Chondrogianni N. Redox regulation of proteasome function. Redox Biol 2017; 13 : 452–458.
49. Aiken CT, Kaake RM, Wang X, Huang L. Oxidative stress-mediated regulation of proteasome complexes. Mol Cell Proteomics 2011; 10(5): R110 006924.
50. Steffen KK, Dillin A. A ribosomal perspective on proteostasis and aging. Cell Metab 2016; 23(6): 1004–1012.
51. Waldera-Lupa DM, Kalfalah F, Florea AM et al. Proteome-wide analysis reveals an age-associated cellular phenotype of in situ aged human fibroblasts. Aging (Albany, NY) 2014; 6(10): 856–878.
52. Turi Z, Lacey M, Mistrik M, Moudry P. Impaired ribosome biogenesis: mechanisms and relevance to cancer and aging. Aging (Albany, NY) 2019; 11(8): 2512–2540.
53. Cheng J, Turkel N, Hemati N et al. Centrosome misorientation reduces stem cell division during ageing. Nature 2008; 456(7222): 599–604.
54. Lai WF, Wong WT. Roles of the actin cytoskeleton in aging and age-associated diseases. Ageing Res Rev 2020; 58 : 101021.
55. Zs-Nagy I. Aging of cell membranes: facts and theories. Interdiscip Top Gerontol 2014; 39 : 62–85.
56. Egawa J, Pearn ML, Lemkuil BP et al. Membrane lipid rafts and neurobiology: age-related changes in membrane lipids and loss of neuronal function. J Physiol 2016; 594(16): 4565–4579.
57. Calcinotto A, Kohli J, Zagato E et al. Cellular senescence: aging, cancer, and injury. Physiol Rev 2019; 99(2): 1047–1078.
58. Galluzzi L, Vitale I, Aaronson SA et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death Differ 2018; 25(3): 486–541.
59. Ardoin SP, Pisetsky DS. The role of cell death in the pathogenesis of autoimmune disease: HMGB1 and microparticles as intercellular mediators of inflammation. Mod Rheumatol 2008; 18(4): 319–326.
60. Ho TT, Warr MR, Adelman ER et al. Autophagy maintains the metabolism and function of young and old stem cells. Nature 2017; 543(7644): 205–210.
61. Flores I, Blasco MA. The role of telomeres and telomerase in stem cell aging. FEBS Lett 2010; 584(17): 3826–3830.
62. Vaiserman AM, Koliada AK, Marotta F. Gut microbiota: a player in aging and a target for anti-aging intervention. Ageing Res Rev 2017; 35 : 36–45.
63. Odamaki T, Kato K, Sugahara H et al. Age-related changes in gut microbiota composition from newborn to centenarian: a cross-sectional study. BMC Microbiol 2016; 16 : 90.
64. Biagi E, Franceschi C, Rampelli S et al. Gut microbiota and extreme longevity. Curr Biol 2016; 26(11): 1480–1485.
65. Aunan JR, Watson MM, Hagland HR, Soreide K. Molecular and biological hallmarks of ageing. Br J Surg 2016; 103(2): e29–e46.
66. Reber AJ, Chirkova T, Kim JH et al. Immunosenescence and challenges of vaccination against influenza in the aging population. Aging Dis 2012; 3(1): 68–90.
67. Montecino-Rodriguez E, Berent-Maoz B, Dorshkind K. Causes, consequences, and reversal of immune system aging. J Clin Invest 2013; 123(3): 958–965.
68. Cunha LL, Perazzio SF, Azzi J et al. Remodeling of the immune response with aging: Immunosenescence and its potential impact on COVID-19 immune response. Front Immunol 2020; 11 : 1748.
69. Robert L, Labat-Robert J, Robert AM. Physiology of skin aging. Clin Plast Surg 2012; 39(1): 1–8.
70. McNulty M, Spiers P, McGovern E, Feely J. Aging is associated with increased matrix metalloproteinase-2 activity in the human aorta. Am J Hypertens 2005; 18(4 Pt 1): 504–509.
71. Yu TY, Pang JH, Wu KP et al. Aging is associated with increased activities of matrix metalloproteinase-2 and -9 in tenocytes. BMC Musculoskelet Disord 2013; 14 : 2.
72. Cooper R, Bann D, Wloch EG et al. „Skeletal muscle function deficit“ in a nationally representative British birth cohort in early old age. J Gerontol A Biol Sci Med Sci 2015; 70(5): 604–607.
73. Safdar A, Hamadeh MJ, Kaczor JJ et al. Aberrant mitochondrial homeostasis in the skeletal muscle of sedentary older adults. PLoS One 2010; 5(5): e10778.
74. Fiechter M, Fuchs TA, Gebhard C et al. Age-related normal structural and functional ventricular values in cardiac function assessed by magnetic resonance. BMC Med Imaging 2013; 13 : 6.
75. Dong M, Yang Z, Fang H et al. Aging attenuates cardiac contractility and affects therapeutic consequences for myocardial infarction. Aging Dis 2020; 11(2): 365–376.
76. Lowery EM, Brubaker AL, Kuhlmann E, Kovacs EJ. The aging lung. Clin Interv Aging 2013; 8 : 1489–1496.
77. Takiishi T, Fenero CIM, Camara NOS. Intestinal barrier and gut microbiota: shaping our immune responses throughout life. Tissue Barriers 2017; 5(4): e1373208.
78. Vidal-Pineiro D, Parker N, Shin J et al. Cellular correlates of cortical thinning throughout the lifespan. Sci Rep 2020; 10(1): 21803.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
2022 Číslo 1- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Fyziologie stárnutí
- Přispívají kliničtí farmaceuti k minimalizaci pádů pacientů ve zdravotnických zařízeních i v Česku? 10leté sledování a zkušenosti z ÚVN Praha
- Multioborová spolupráce při záchytu prvního českého případu varianty SARS-CoV-2 omikron
- Domácí transfuze v kontextu poskytování paliativní péče v Česku
- Současné možnosti léčby monogenních syndromů periodických horeček – úloha inhibitorů interleukinu 1
- Doporučení pro léčbu závislosti na tabáku
- 17. Šonkův den
- Ohlédnutí za konferencí IZS Karlovy Vary 2021
- Odešel nestor české geriatrie docent Jiří Neuwirth
- PŘEDNÁŠKOVÉ VEČERY SPOLKU ČESKÝCH LÉKAŘŮ V PRAZE (DUBEN – ČERVEN 2022)
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Fyziologie stárnutí
- Doporučení pro léčbu závislosti na tabáku
- Přispívají kliničtí farmaceuti k minimalizaci pádů pacientů ve zdravotnických zařízeních i v Česku? 10leté sledování a zkušenosti z ÚVN Praha
- Multioborová spolupráce při záchytu prvního českého případu varianty SARS-CoV-2 omikron
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



