-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaDesaturázy mastných kyselin: patofyziologie a klinický význam
Desaturases of fatty acids (FADS) and their physiological and clinical implication
States associated with insulin resistance, as overweight/obesity, type 2 diabetes mellitus (DM2), cardiovascular diseases (CVD), some cancers and neuropsychiatric diseases are characterized with a decrease of long-chain polyunsaturated fatty acids (LC-PUFA) levels. Amounts of LC-PUFA depend on the exogenous intake of their precursors [linoleic (LA) and α-linolenic acid (ALA)] and by rate of their metabolism, which is influenced by activities of enzymes, such as Δ6-desaturase (D6D, FADS2), D5D, FADS1, elongases (Elovl2, -5, 6).
Altered activities of D5D/D6D were described in plenty of diseases, e.g. neuropsychiatric (depressive disorders, bipolar disorder, dementia), metabolic (obesity, metabolic syndrome, DM2) and cardiovascular diseases (arterial hypertension, coronary heart disease), inflammatory states and allergy (Crohn’s disease, atopic eczema) or some malignancies. Similar results were obtained in studies dealing with the associations between genotypes/haplotypes of FADS1/FADS2 and above mentioned diseases, or interactions of dietary intake of LA and ALA on one hand and of the polymorphisms of minor allels of FADS1/FADS2, usually characterized by lower activities, on the other hand.
The decrease of the desaturases activities leads to decreased concentrations of products with concomitant increased concentrations of substrates. Associations of some SNP FADS with coronary heart disease, concentrations of plasma lipids, oxidative stress, glucose homeostasis, and inflammatory reaction, were described. Experimental studies on animal models and occurrence of rare diseases, associated with missing or with marked fall activities of D5D/D6D emphasized the significance of desaturases for healthy development of organism as well as for pathogenesis of some disease.Keywords:
delta-5-desaturase, delta-6-desaturase, genes FADS1/FADS2, polyunsaturated fatty acids, inflammation, oxidative stress, cardiovascular and metabolic diseases
Autoři: prof. MUDr. DrSc. Aleš Žák; prof. MUDr. DrSc. Adolf Slabý; RNDr. CSc. Eva Tvrzická; RNDr. Ph.D. Marie Jáchymová; MUDr. Ph.D. Jaroslav Macášek; RNDr. Ph.D. Marek Vecka; doc. MUDr. CSc. Miroslav Zeman; Mgr. Barbora Staňková
Působiště autorů: IV. interní klinika 1. LF UK a VFN, U Nemocnice , Praha , 1 8 1; Ústav klinické biochemie a laboratorní diagnostiky 1. LF UK a VFN, U Nemocnice 2, Praha 2, 128 2
Vyšlo v časopise: Čas. Lék. čes. 2016; 155: 69-75
Kategorie: Přehledové články
Souhrn
Stavy asociované s inzulinovou rezistencí, jako jsou nadváha/obezita, diabetes mellitus 2. typu (DM2), kardiovaskulární onemocnění (KVO), některé nádory a neurologicko-psychiatrické choroby, jsou charakterizovány poklesem obsahu vícenenasycených mastných kyselin s dlouhým řetězcem (LC-PUFA). Množství LC-PUFA závisí jednak na exogenním příjmu jejich prekurzorů – kyseliny linolové a α-linolenové – a dále na rychlosti jejich metabolické přeměny, na níž se podílí řada enzymů: delta-6-desaturáza (D6D, FADS2), D5D (FADS1) a elongázy (Elovl2, -5, 6).
Změny aktivit D5D/D6D byly popsány u řady chorob, mezi něž patří neurologicko-psychiatrická onemocnění (depresivní poruchy, bipolární afektivní poruchy, demence), metabolická onemocnění (obezita, metabolický syndrom, DM2), KVO (hypertenze, ischemická choroba srdeční), chronické záněty a alergie (Crohnova nemoc, atopický ekzém) a některé nádory. Analogické výsledky byly prokázány asociačními studiemi mezi genotypy/haplotypy FADS1/FADS2 a výše uvedenými skupinami onemocnění, případně interakce mezi příjmem kyseliny linolové (LA) i α-linolenové (ALA) a výskytem minoritních alel polymorfismů FADS1/FADS2, které mají vesměs nižší enzymatické aktivity.
Pokles aktivit desaturáz se projeví sníženou koncentrací produktů spojenou se zvýšenou koncentrací substrátu. Byly popsány asociace některých SNP FADS s ischemickou chorobou srdeční, koncentracemi lipidů, oxidačním stresem, glukózovou homeostázou i zánětlivou reakcí. Experimentální studie na zvířecích modelech a výskyt vzácných onemocnění spojených s chyběním, resp. výrazným poklesem aktivit D5D/D6D vyzdvihly význam desaturáz pro zdravý vývoj organismu i pro patogenezi některých chorob.Klíčová slova:
delta-5-desaturáza, delta-6-desaturáza, geny FADS1/FADS2, vícenenasycené mastné kyseliny, zánět, oxidační stres, kardiovaskulární a metabolické chorobyÚvod
Trvající vysoká mortalita a morbidita na kardiovaskulární onemocnění (KVO) v ekonomicky vyspělých zemích souvisí s vysokou prevalencí stavů s inzulinovou rezistencí (IR). Inzulinová rezistence je charakteristická pro nadváhu (resp. obezitu), metabolický syndrom (MS), diabetes mellitus 2. typu (DM2), kardiovaskulární choroby, neurologicko-psychiatrická onemocnění (deprese, bipolární afektivní poruchy, schizofrenie, demence) a některé nádory (1−3). Pokles obsahu vícenenasycených mastných kyselin s dlouhým řetězcem (LC-PUFA − long-chain polyunsaturated fatty acids) v krvi a tkáních je jednou z charakteristických známek stavů s IR a byl popsán u výše uvedených chorobných stavů. Z nutričních rizikových faktorů k rozvoji IR přispívají pozitivní energetická bilance, zvýšený příjem nasycených mastných kyselin (SFA − saturated fatty acids), trans-izomerů mastných kyselin (TFA) či rafinovaných cukrů (především fruktózy a sacharózy) a nedostatečný příjem PUFA řady n-3 a n-6 (1, 4, 5).
Množství LC-PUFA závisí na příjmu kyseliny linolové (LA, 18 : 3n-6) a α-linolenové (ALA, 18 : 3n-3) potravou i aktivitě enzymů (desaturázy, elongázy) řídících jejich syntézu. V současné běžné stravě průmyslově vyspělých zemí (modern Western diet) LA přispívá z 85–89 % k celkovému příjmu PUFA, ALA se pak podílí zhruba z 9–11 % na celkovém příjmu PUFA potravou. Kyselina linolová je metabolizována sérií desaturací a elongací až na kyselinu arachidonovou (AA, 20 : 4n-6). Limitujícím krokem přeměny LA na AA je delta-6 desaturace (D6D, FADS2), která konvertuje LA na kyselinu γ-linolenovou (GLA, 18 : 3n-6). Následuje další elongace (ELOVL2) a desaturace (D6D) s přeměnou EPA na DHA. Tato přeměna zahrnuje stejný sled enzymatických kroků (6), přičemž nejdříve vzniká kyselina stearidonová (SDA, 18 : 4n-3). Konverze ALA na EPA je u lidí velmi nízká, její podíl činí pouze 6–10 %. Podobně je metabolizována kyselina olejová (OA, 18 : 1n-9) působením D5D a D6D a ELOVl. Všechny tři řady mastných kyselin (n-3, n-6 a n-9) kompetují o stejné enzymatické systémy, přičemž afinita k D5D a D6D je v následujícím pořadí: n-3 PUFA > n-6 PUFA > n-9 PUFA (7−9).
Substrátem pro D6D je celkem 5 mastných kyselin: 18 : 2n-6, 18 : 3n-3, 24 : 4n-6, 24 : 5n-3 a 16 : 0. Delta-6-desaturáza navíc vykazuje D8D aktivitu vůči 20 : 2n-6 a 20 : 3n-3. Delta-5-desaturáza má vysokou substrátovou specificitu a za normálních okolností jsou známé pouze dvě FA, které slouží jako substrát pro D5D, jedná se o kyseliny 20 : 3n-6 a 20 : 4n-3.
Desaturázovou aktivitu ovlivňují faktory genetické i vlivy negenetické, jako je lačnění, realimentace, karence bílkovin, působení hormonů (inzulin, kortikoidy, katecholaminy), složení diety (nasycené mastné kyseliny, trans-mastné kyseliny, Zn, Mg, pyridoxin, alkohol a další) (10, 11). Dostupnost LA, ALA a LC-PUFA (zvláště AA a DHA) je nezbytná pro zdravý vývoj organismu a jeho optimální fyziologické funkce. Tyto LC-PUFA ovlivňují kardiovaskulární systém a imunitu, jsou nezbytné v těhotenství pro správný růst a vývoj plodu. Některé studie naznačily, že polymorfismy FADS a dietní příjem PUFA ovlivňuje status LC-PUFA a DHA v těhotenství. Koncentrace LC-PUFA a zvláště DHA v mateřském mléce mohou kojením modulovat riziko vzniku alergických onemocnění, ekzému a rozvoj kognitivních funkcí během dospívání (12).
Účinky PUFA se vysvětlují ovlivněním buněčných funkcí, inkorporací do membránových fosfolipidů, modulací enzymů a signálních molekul i přímým ovlivněním genové exprese (1, 13). Dostupnost volných LC-PUFA a možnost regulace genové transkripce závisí nejen na příjmu ALA a LA dietou, ale i na aktivitě desaturáz a elongáz kódovaných příslušnými geny (FADS1, FADS2, SCD-1, Elovl2-6). Některé polymorfismy FADS nesoucí minoritní alely jsou vesměs spojeny s nižší enzymatickou aktivitou. Pokles aktivit FADS se projeví sníženou koncentrací produktu a zvýšenou koncentrací substrátu. Přeměna LA a ALA na LC-PUFA je ukázána na obr. 1.
Obr. 1. Elongace a desaturace vícenenasycených mastných kyselin řady n-3 a n-6 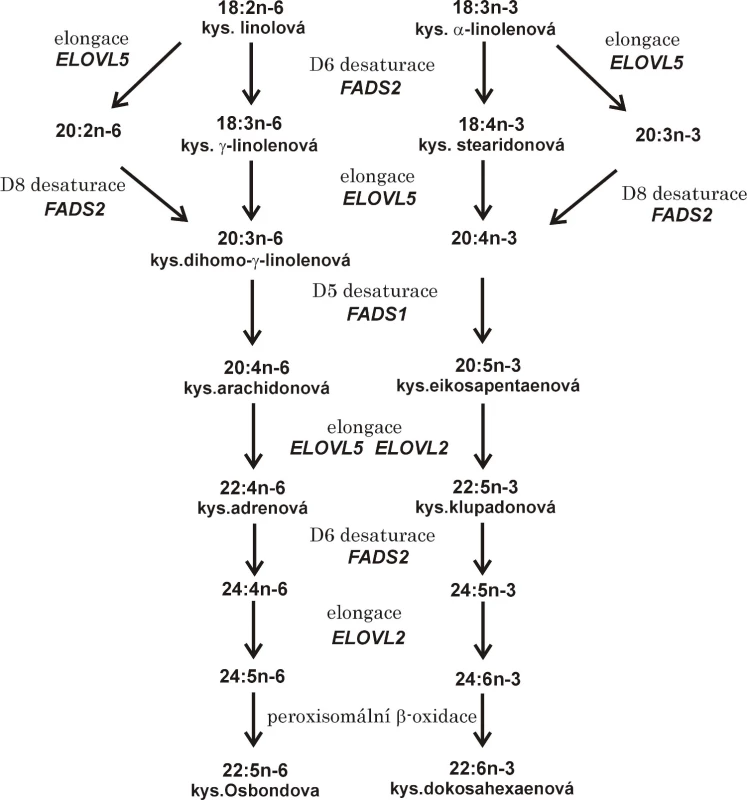
Pozn.: Označení mastné kyseliny = počet atomů uhlíků: počet dvojných vazeb; n = počet atomů uhlíku od methylového konce mastné kyseliny k nejbližší dvojné vazbě. FADS1 = desaturáza mastných kyselin 1; FADS2 = desaturáza mastných kyselin 2; ELOVL2, 5 = elongáza mastných kyselin s velmi dlouhým řetězcem 2, resp. 5. Desaturázy mastných kyselin
Desaturázy jsou enzymy odpovědné za inzerci dvojných vazeb do řetězce FA. Desaturázy mastných kyselin se vyskytují u většiny živočichů a rostlin, též u některých bakterií (14). Existují dvě evolučně nepříbuzné skupiny, a to desaturázy vázané na buněčné membrány a desaturázy solubilní. Vesměs jde o metaloproteiny se dvěma atomy železa v aktivním místě, což vysvětluje velký rozsah katalytických aktivit. Delta desaturázy vyskytující se u savců jsou mikrosomální enzymy, jejich desaturázová aktivita závisí na koordinaci tří enzymů: vlastní desaturázy, cytochromu b5 a NADPH-cytochrom b5 reduktázy.
Geny pro delta desaturázy mastných kyselin jsou lokalizovány na chromosomu 11 a geny pro elongázu-5 (elongation of very long-chain fatty acid, ELOVL5) na chromosomu 6 (15). Genový cluster pro D5D a D6D je kódován na 11. chromosomu (11q12-13.1) a obsahuje geny FADS1, FADS2 a FADS3; D5D je kódována desaturázou mastných kyselin-1 (FADS1), D6D pak FADS2. Gen pro FADS3 má 52–62% sekvenční identitu s FADS1, resp. FADS2 a kóduje zatím strukturně a funkčně neidentifikované proteiny (16, 17).
U člověka jsou FADS1/FADS2/FADS3 exprimovány především v játrech, kosterním svalstvu, myokardu, plicích, nervovém systému a tukové tkáni. FADS genový cluster u člověka sestává z úseku o velikosti 91,9 kb na 11. chromosomu. Všechny tři geny mají podobnou strukturu (12 exonů, 11 intronů). Orientace FADS1 a FADS2 je „hlava-hlava“ a FADS2 a FADS3 „ocas k ocasu“. FADS1 zaujímá 17,2 kb, FADS2 39,1 kb a FADS3 oblast 18 kb. Celkem bylo v oblasti genového FADS clusteru popsáno více než 500 polymorfismů. Z nich u 23 polymorfismů byly popsány významné asociace s koncentracemi FA, hladinami lipidů a komplexními fenotypy. Schematická struktura genového clusteru FADS je ukázána na obr. 2.
Obr. 2. Schéma genového clusteru desaturáz mastných kyselin a klinicky relevantních polymorfismů. Obrázek znázorňuje lidský cluster genůFADSs umístěním některých studovaných polymorfismů, které jsou asociovány s hladinami mastných kyselin a fosfolipidů (volně podle 7). 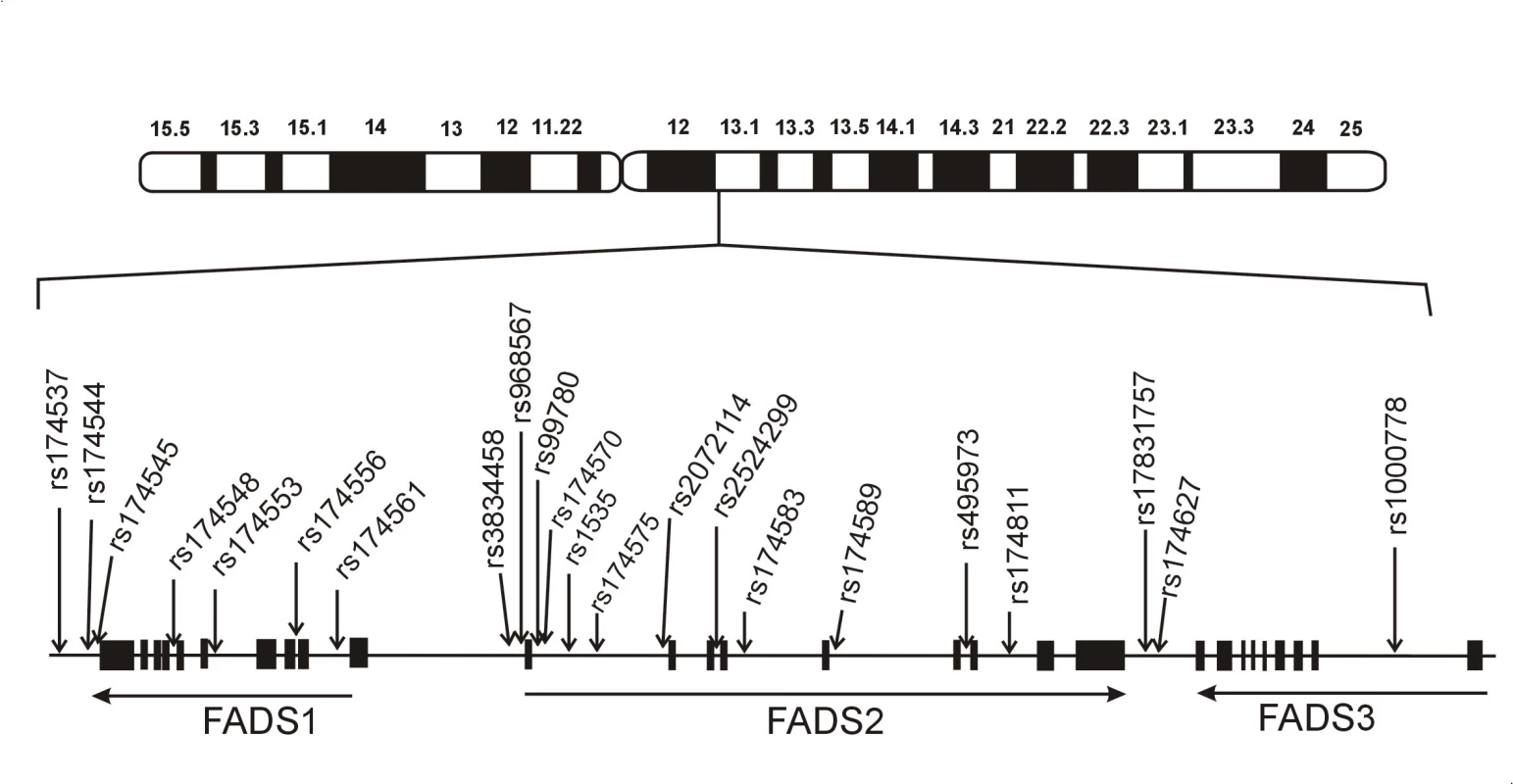
Pozn.: FADS = desaturáza mastných kyselin; rs číslo = číslo označující specifický jednonukleotidový polymorfismus (SNP) uvedený v příslušných databázích. Aktivity delta-5-desaturázy a delta-6-desaturázy za různých patologických stavů
Aktivity D5D a D6D lze analyzovat přímo in vitro nebo u experimentálních zvířat pomocí rychlosti konverze radioaktivně značených FA na jejich produkty. Exprese genů FADS je u lidí měřitelná pouze ve vzorcích jaterních biopsií. Přímé určení aktivity tak není proveditelné na rozsáhlých souborech v klinických a epidemiologických studiích z důvodů etických i praktických. V klinické praxi se jako surogátního markeru využívá poměru produkt/substrát řady PUFA n-6. Koncentrací EPA, resp. DHA v analogických poměrech se neužívá, protože tyto PUFA n-3 jsou výrazněji ovlivněny jejich dietním příjmem. V písemnictví se používá několika markerů: globální (agregovaná nebo celková) desaturázová aktivita jako poměr AA/LA (20 : 4n-6/18 : 2n-6), dále D5D (jako poměr AA/DGLA, 20 : 4n-6/20 : 3n-6) nebo D6D aktivita (jako poměr GLA/LA, 18 : 3n-6/18 : 2n-6) (12).
V tab.1 jsou schematicky uvedeny změny globální desaturázové aktivity, vyjádřené jako agregovaný desaturační index (ADI), dále pak aktivity D5D a D6D za různých patologických stavů. Zvýšení celkové desaturázové aktivity bylo prokázáno u osob s arteriální hypertenzí, IR, obezitou a MS (18−20). Pacienti s DM2 mají zvýšenou celkovou desaturázovou aktivitu, vyšší D6D a nižší D5D. Vysoké aktivity D6D a nízké D5D jsou charakteristické pro stavy asociované s IR (21−23) a predikují vznik DM a MS (24). Podobné nálezy byly zjištěny u osob s nealkoholovou steatózou jater (25). U obou pohlaví koncentrace LDL-C a TG negativně korelují s D5D, a koncentrace LDL-C, TG, LDL-C a non-HDL-C pozitivně korelují s aktivitou D6D (26). Zvýšené aktivity D6D i D5D byly prokázány u cystické fibrózy (27) a pankreatického duktálního adenokarcinomu (28). Zvýšená aktivita D6D byla spojena s proliferací plicního karcinomu i melanomu a popsána také u karcinomu prsu (29, 30). Spektrum FA i změny aktivit DD u depresivní poruchy (31) jsou podobné jako u jiných neurologicko-psychiatrických onemocnění (31−34).
Tab. 1. Změny desaturázových aktivit u různých chorob a patologických stavů 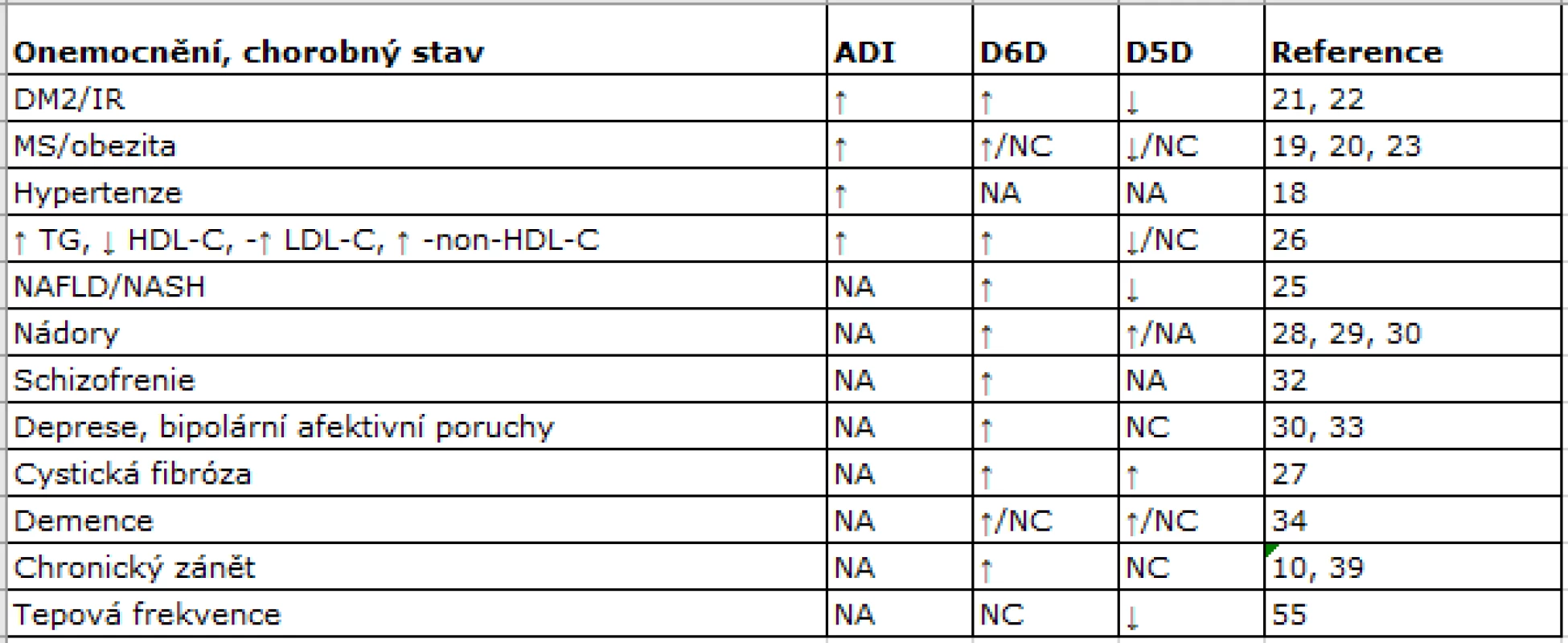
Pozn.: NA = chybění dat(not available); NC = beze změny (not changed); ↑ = vzestup aktivity; ↓ = pokles aktivity; ADI = agregovaný desaturační index; D6D = delta-6-desaturáza; D5D = delta-5-desaturáza; DM2 = diabetes mellitus 2. typu; IR = inzulinová rezistence; MS = metabolický syndrom; TC = celkový cholesterol; TG = triglyceridy; HDL-C = cholesterol obsažený v HDL; LDL-C = cholesterol obsažený v LDL; non-HDL-C = non-HDL cholesterol; NAFLD = nealkoholová steatóza jater; NASH = nealkoholová steatohepatitida. Varianty FADS1/FADS2 a chorobné stavy
Analýzy srovnávající 18 SNP FADS1/FADS2 a složení mastných kyselin (FA − fatty acid) fosfolipidů plazmy, resp. erytrocytových membrán prokázaly, že genetické vlivy vysvětlí až 29 % rozptylu koncentrací AA a rekonstruované haplotypy FADS1/FADS2 10–12 % rozptylu koncentrací prekurzorů AA (EDA − eikosadienová kyselina, 20 : 2n-6; DGLA, 20 : 3n-6) (35). Studie na italské populaci prokázala silnou asociaci mezi 13 SNP clusteru FADS/FADS2/FADS3 a koncentracemi PUFA plazmatických fosfolipidů a membrán erytrocytů. Z nich nejvýznamnější asociace byla prokázána pro AA (20 : 4n-6). Homozygoti a heterozygoti minoritní alely měli vyšší koncentrace LA, ALA a EDA (36). Podobné asociace byly prokázány i v dalších studiích u potomků Evropanů, Afričanů a Asiatů (9, 37−40).
V současné době jsou předmětem rozsáhlého experimentálního i klinického výzkumu funkční polymorfismy genů FADS1/FADS2/FADS3. Několik studií prokázalo významné asociace mezi některými polymorfismy FADS a zastoupením FA ve fosfolipidech séra a erytrocytových membrán. Vyšetřením velkého populačního vzorku mužů a žen bylo zjištěno, že nositelé minoritních alel jedenácti jednonukleotidových polymorfismů (SNP) a příslušných haplotypů mají nižší aktivitu D6D a D5D, což se projevuje zvýšenou koncentrací substrátů, tj. kyseliny linolové, α-linolenové, dihomo-γ-linolenové (DGLA, 20 : 3n-6), a sníženou koncentrací produktů desaturace, tj. kyseliny γ-linolenové, arachidonové a EPA, v sérových fosfolipidech. Nejvýznamnější asociace s polymorfismy a největší podíl geneticky vysvětlitelné variability vykazovala kyselina arachidonová. Minoritní alely byly spojeny s nižším výskytem alergické rinitidy a atopického ekzému, neměly však vliv na celkové ani specifické koncentrace IgE v plazmě (35).
Vliv stejných polymorfismů D6D a D5D na zastoupení FA v sérových fosfolipidech byl potvrzen obdobně koncipovanou studií u souboru mužů sledovaných v rámci jiného výzkumného projektu. Minoritní alely vykazovaly významné asociace s nižšími koncentracemi kyseliny arachidonové a vyšším zastoupením kyseliny linolové, α-linolenové a eikosadienové (36).
Výzkum FADS1/FADS2 probíhal také v rámci evropské kolaborativní studie u početného souboru mladistvých, chlapců a děvčat ve věku 12,5−17,5 roku, s výrazně odlišnými stravovacími zvyklostmi ve srovnání s dospělou populací. Aktivita D5D byla hodnocena poměrem kyseliny arachidonové (20 : 4n-6) ke kyselině dihomo-γ-linolenové (20 : 3n-6), aktivita D6D poměrem kyseliny dihomo-γ-linolenové (20 : 3:n-6) ke kyselině linolové (18 : 2n-6), což přesněji reflektuje aktivity D6D a ELOVL5. Minoritní alely většiny sledovaných polymorfismů byly významně asociovány s nižší aktivitou D5D, jeden polymorfismus s výrazně vyšší aktivitou D6D. Autoři této studie předpokládají, že u mladistvých je fenotyp ovlivněn relativně více genetickými faktory než faktory zevními (41).
Polymorfismy genů kódujících D5D a D6D ovlivňují syntézu PUFA a jejich koncentraci ve většině tkání (8). Vzhledem k transgeneračnímu vlivu genetické variability DD na riziko KVO a dalších závažných chorob jsou cenné výzkumné projekty, které se zaměřují na konkrétní populační skupiny. V nedávno publikované studii byly porovnány funkční polymorfismy FADS1/FADS2 u mladých dospělých osob bělošského a asijského původu. Oba soubory se vyznačovaly obdobnou genetickou variabilitou desaturáz, ale byly zjištěny některé zajímavé rozdíly. Alela C jednoho reprezentativního polymorfismu spojená s nižší aktivitou desaturáz (nižším poměrem AA/LA) byla u mužů asijského původu minoritní, kdežto u bělošské skupiny majoritní. Asijská skupina tedy byla znevýhodněna vzhledem ke kardiovaskulárnímu riziku spojenému s geneticky podmíněnou variabilitou desaturázové aktivity (9).
Autoři ze Spojených států amerických se zaměřili na geograficky izolovanou populaci evropského původu s neměnnými stravovacími zvyklostmi a potvrdili, že variabilita D5D ovlivňuje intenzitu konverze výchozích FA na potenciálně prozánětlivé PUFA řady n-6 (40). Vliv příjmu n-3 PUFA na rozdíly v plazmatické koncentraci LDL-C, HDL-C a triglyceridů, které souvisejí s různou expresí D5D, byl zřejmý při srovnání japonské a mongolské populace; oba soubory byly geneticky příbuzné, ale podstatně se lišily konzumací ryb (42).
Výsledky celogenomového sekvenování naznačují, že homozygotní zastoupení určitých alel přispívá k celkovému kardiovaskulárnímu riziku (43). Podle názoru některých autorů by vyšetření polymorfismů FADS1/FADS2 mělo být součástí experimentálních a intervenčních studií zaměřených na biologické účinky vícenenasycených mastných kyselin (PUFA) (7).
Vztahy variant FADS k diabetes mellitus
Celogenomové asociační studie prokázaly asociaci SNP FADS1 rs174550 s lačnou glykemií a rizikem DM2. V EPIC − Potsdam Study byla prokázána asociace FADS1 rs174546, která je ve vazebné nerovnováze s rs174550, s aktivitami D5D a D6D. Vzhledem k opačnému vlivu D5D a D6D na vznik DM2 je možné, že vliv obou polymorfismů na riziko DM2 se vzájemně ruší. Navíc byla prokázána asociace mezi rs174550 genotypem (FADS1) a časnou sekrecí inzulinu (21, 22).
V rozsáhlé finské studii provedené na skupině 6580 nediabetických mužů byla prokázána významná asociace alely rs174550 FADS1 s koncentracemi glukózy a dyslipidemií (44).
Vztahy variant FADS k dyslipidemii
Statisticky významné asociace některých polymorfismů s lipidovým spektrem byly zjištěny v celogenomových studiích provedených u velkého počtu sledovaných osob. Genomové vyšetření 40 tisíc Evropanů prokázalo významnou asociaci mezi alelou C polymorfismu rs174547 FADS1, poklesem HDL-C a vzestupem TG (45).
V již zmíněné finské studii byla prokázána asociace alely rs174550 FADS1 se zvýšenou koncentrací velkých HDL a sníženou koncentrací všech subfrakcí VLDL (44).
V celogenomové asociační studii In CHIANTI byla prokázána asociace varianty intronů FADS1 rs174537 s koncentrací celkového cholesterolu (TC) a LDL-C (43). U adolescentů indoevropského původu byla prokázána asociace minoritní alely varianty FADS2 rs174570 s koncentrací TG a aktivitou D5D spojenou se vzestupem LA a poklesem AA (41).
V návaznosti na uvedené výsledky byl v souboru mladistvých dotazníkovou metodou vyšetřen příjem LA a ALA ve stravě a sledován jeho vliv na aktivitu D5D. Ukázalo se, že minoritní alela polymorfismu FADS1 (rs174546) byla asociována s nižší koncentrací EPA v sérových fosfolipidech, ale pouze v podskupině s vysokým dietním příjmem ALA. V téže podskupině byla zjištěna významná asociace této minoritní alely s nižšími koncentracemi celkového cholesterolu a non-HDL cholesterolu v séru. Vztahy mezi genetickými a nutričními vlivy jsou zřejmě složitější, než se dosud podařilo objasnit. Kyselina linolová a ALA pravděpodobně kompetují o D5D (46).
V korejské populaci byla prokázána asociace minoritní (T) alely varianty FADS1 rs174537 s nižší koncentrací TC a LDL-C a větší průměrnou velikostí částic LDL i rizikem ischemické choroby srdeční (38).
Vyšetření 137 japonských mužů středního věku prokázalo asociaci mezi homozygotním genotypem variant clusteru FADS (rs174553, rs174546, rs99780), nízkými koncentracemi LDL-C a poměrem LDL-C/celkový cholesterol (47).
Vztahy variant FADS k oxidačnímu stresu
Ve zmíněné korejské studii byla prokázána asociace minoritní (T) alely varianty FADS1 rs174537 s nižší úrovní oxidačního stresu vyjádřeného poklesem koncentrací malondialdehydu (MDA), oxidativně modifikovaných LDL (ox-LDL) a nižší koncentrací 8-epi-PGF2a v moči (38).
Vyšetření peroxidace lipidů v izolovaných LDL a HDL pomocí sledování kinetiky konjugovaných dienů (KD) u homozygotů s delecí v promotoru genu (-/-) FADS2 (rs3834458) ve srovnání s nositeli T alely (TT, T-) prokázalo nižší produkci KD a nižší maximální koncentraci KD (48).
Vztahy variant FADS k metabolickému syndromu
Zvýšená koncentrace ALA tukové tkáně je spojena s nízkou prevalencí MS. Byla prokázána významná interakce mezi polymorfismem varianty FADS2 (rs3834458) v promotoru (T/-) genu pro D6D, koncentrací ALA tukové tkáně a rizikem MS. Chybění asociace u homozygotů (-/-) naznačuje, že tato asociace je zapříčiněna, alespoň částečně, zpomalenou konverzí ALA na EPA (49).
Je známo, že existují rozdíly v prevalenci fenotypu MS u Američanů afrického a evropského původu. Afroameričané s MS mají menší prevalenci dyslipidemie (vzestup TG a pokles HDL-C) a vyšší výskyt poruch glukózové homeostázy. Při vyšetření polymorfismu FADS1 rs174537 byla zjištěna významně vyšší frekvence genotypu GG u Afroameričanů (0,81) ve srovnání s Američany evropského původu (0,41); GG genotyp zmíněného polymorfismu má vysoké koncentrace AA a vyšší úroveň subklinického zánětu (resp. prozánětlivého stavu), který představuje zvýšené riziko vzniku DM2 (39).
Vztahy variant FADS k ischemické chorobě srdeční
Význam genotypů D5D a D6D pro predikci kardiovaskulárního rizika se pokusila prokázat klinická studie, do níž byli zařazeni pacienti vyšetření koronární angiografií. Ve skupině se závažnou stenózou jedné nebo několika tepen (> 50% zúžení) byla zjištěna vyšší aktivita celkové desaturázové aktivity, která byla vyjádřena jako poměr AA/LA (20 : 4n-6/18 : 2n-6) erytrocytových membránových fosfolipidů. Mnohočetná regresní analýza potvrdila, že vyšší hodnoty tohoto poměru (horní tercil) představují nezávislý rizikový faktor pro ischemickou chorobu srdeční. Aktivita desaturáz byla asociována s polymorfismy genů FADS1/FADS2 (rizikovými alelami a haplotypy), které podmiňovaly prozánětlivé spektrum PUFA. Se zvýšenou aktivitou desaturáz pozitivně korelovaly hodnoty hs-CRP (10).
V již citované korejské studii byly vyšetřeny polymorfismy genů pro D5D a D6D u pacientů s ischemickou chorobou srdeční (ICHS) a u zdravých kontrolních osob v Jižní Koreji. U zvoleného polymorfismu (rs174537) se minoritní alela spojená s nižší desaturázovou aktivitou vyskytovala významně méně často ve skupině pacientů než u zdravých osob. Nositelé této alely měli nižší zastoupení AA v sérových fosfolipidech a větší částice LDL (38).
Srovnávací studie Číňanů (440 pacientů s ICHS a 839 kontrolních osob) prokázala interakci mezi polymorfismem rs17547 FADS1 a rizikem ICHS. Nositelé minoritní T alely zmíněného polymorfismu s nízkým příjmem EPA/DHA je rizikovým faktorem ICHS (50).
Interakce variant FADS a příjmu PUFA
Pro prevenci a léčbu dyslipidemií a MS je důležité osvětlit interakce mezi genetickou variabilitou desaturáz a příjmem PUFA ve stravě, popřípadě jejich zvýšeným příjmem v rámci terapie. Průřezové šetření v Doetinchem Cohort Study prokázalo signifikantní asociaci mezi genotypy FADS1 (rs174546) a TC a non-HDL cholesterolem ve skupině s vysokým dietním příjmem n-3 PUFA (≥ 0,51 En %), interakce mezi genotypy rs174546 a TC a non-HDL-C chybí ve skupině s nízkým příjmem n-3 PUFA (< 0,51 En %). Interakce s ostatními vyšetřovanými genotypy FADS (rs174570, rs482548) prokázány nebyly (51).
Obdobný cíl měla studie provedená na souboru respondentů ze švédské populace. Minoritní alela polymorfismu FADS1 (rs174547) byla spojena s nižšími koncentracemi LDL-C pouze u jedinců s nízkým příjmem n-3 PUFA; významné interakce byly prokázány mezi poměrem ALA/LA ve stravě a plazmatickou koncentrací HDL-C a zmíněným polymorfismem. Vysoký příjem n-3 PUFA (vyjádřený vyšším poměrem ALA/LA) zvyšoval koncentrace HDL-C u genotypu CC a TC polymorfismu rs174547 (52).
Polymorfismy clusteru FADS1/FADS2 také vysvětlují hypotriglyceridemickou odpověď a deteriorace homeostázy glukózy a působení inzulinu po podávání n-3 PUFA. Byla prokázána statisticky významná asociace mezi FADS1 variantou rs174546 a koncentracemi glukózy před a po podávání n-3 PUFA (53). Nositelé minoritní alely polymorfismu FADS2 rs482548 měli významně zvýšené koncentrace glukózy po suplementaci n-3 PUFA. Interakce mezi n-3 PUFA a inzulinemií nalačno byly prokázány pro polymorfismus FADS1 rs174546 (54).
Závěr
Studium genetické variability desaturáz mastných kyselin odhaluje důležité interakce s nutričními faktory. V budoucnu by aktivita desaturáz FA mohla být vodítkem při individuálním dávkování n-3 PUFA v rámci prevence a léčby MS a jeho jednotlivých komponent (nadváha/obezita, dyslipidemie, poruchy glukózové homeostázy, subklinický zánět). Obě tyto dílčí oblasti výzkumu bude třeba uvést do vztahu k již známým patogenním faktorům zánětu. Ukazuje se, že intenzita systémového subklinického zánětu a chronického zánětu tukové tkáně spolurozhoduje nejen o stupni kardiovaskulárního rizika spojeného s obezitou, ale je i spojovacím článkem mezi obezitou a metabolickými odchylkami, jako jsou inzulinová rezistence, poruchy sekrece inzulinu a dyslipidemie.
Práce byla podpořena grantem IGA MZ ČR NT/13199.
Seznam zkratek
AA kyselina arachidonová, 20 : 4n-6
ALA kyselina α-linolenová, 18 : 3n-3
DM2 diabetes mellitus 2. typu
D6D delta-6-desaturáza (syn. FADS2)
D5D delta-5-desaturáza (syn. FADS1)
ELOVL elongáza mastných kyselin s velmi dlouhým řetězcem (elongation of very long chain fatty acids protein)
ETA kyselina eikosatetraenová, 20 : 4n-3
FA mastné kyseliny (fatty acids)
FADS desaturáza mastných kyselin (fatty acid desaturase)
GLA kyselina γ-linolenová, 18 : 3n-6
IR inzulinová rezistence
KVO kardiovaskulární onemocnění
LA kyselina linolová, 18 : 2n-6
LC-PUFA vícenenasycené mastné kyseliny (polyunsaturated fatty acids)
MS metabolický syndrom
OA kyselina olejová, 18 : 1n-9
SFA nasycené mastné kyseliny (saturated fatty acids)
SNP jednonukleotidový polymorfismus (single nucleotide polymorphism)
TFA trans-izomery mastných kyselin (trans isomers of fatty acids)
Adresa pro korespondenci
prof. MUDr. Aleš Žák, DrSc.
IV. interní klinika 1. lékařské fakulty UK a Všeobecné fakultní nemocnice v Praze
U Nemocnice 2
128 08 Praha 2
Tel.: 224 962 506
e-mail: zak.ales@email.cz
Zdroje
1. Jump DB. Fatty acid regulation of hepatic lipid metabolism. Curr Opin Clin Nutr Metab Care 2011; 14 : 115–120.
2. Zdravotnická ročenka České republiky 2009. ÚZIS ČR. URL: uzis.cz
3. Euroaspire III. Euro Heart Survey, Vienna, September 2007. URL: escardio.org
4. Lann D, LeRoith D. Insulin resistance as the underlying cause for the metabolic syndrome. Med Clin N Am 2007; 91 : 1063–1077.
5. Erkkila A, de Mello VDF, Risérus U, Laaksonen DE. Dietary fatty acids and cardiovascular disease: an epidemiological approach. Prog Lipid Res 2008; 47 : 172–187.
6. Murff HJ, Edwards TL. Endogenous production of long-chain polyunsaturated fatty acids and metabolic disease risk. Curr Cardiovasc Risk Rep 2014; 8 : 418.
7. Glaser C, Heinrich J, Koletzko B. Role of FADS1 and FADS2 polymorphisms in polyunsaturated fatty acid metabolism. Metabolism 2010; 59 : 993–999.
8. Lattka E, Illig T, Koletzko B et al. Genetic variants of the FADS1 FADS2 gene cluster as related to essential fatty acid metabolism. Curr Opin Lipidol 2010; 21 : 64–69.
9. Merino DM, Johnston H, Clarke S et al. Polymorphisms in FADS1 and FADS2 alter desaturase activity in young Caucasian and Asian adults. Mol Genet Metab 2011; 103 : 171–178.
10. Martinelli N, Girelli D, Malerba G et al. FADS genotypes and desaturase activity estimated by the ratio of arachidonic acid to linoleic acid are associated with inflammation and coronary artery disease. Am J Clin Nutr 2008; 88 : 941–949.
11. Arbo I, Halle C, Malik D et al. Insulin induces fatty acid desaturase expression in human monocytes. Scand J Clin Lab Invest 2011; 71 : 330–339.
12. Tosi F, Sartori F, Gustini P et al. Delta-5 and delta-6 desaturase: crucial enzymes in polyunsaturated fatty acid-related pathways with pleitropic influences in health and disease. Adv Exp Med Biol 2014; 114 : 1269–1279.
13. Jump DB. N-3 polyunsaturated fatty acid regulation of hepatic gene transcription. Curr Opin Lipidol 2008; 19 : 242–247.
14. Hashimoto K, Yoshizawa AC, Saito K et al. The repertoire of desaturases for unsaturated fatty acid synthesis in 397 genomes. Genome Inform 2006; 17 : 173–183.
15. Jakobsson A, Westernberg R, Jakobsson A. Fatty acid elongases: their regulation and roles in metabolism. Prog Lipid Res 2006; 45 : 237–249.
16. Nakamura MT, Nara TY. Structure, function, and dietary regulation of delta6, delta5, and delta9 desaturases. Annu Rev Nutr 2004; 24 : 345–376.
17. Blanchard H, Legrand P, Pédrono F. Fatty acid desaturase 3 (Fads3) is a singular member of Fadscluster. Biochimie 2011; 93 : 87–90.
18. Russo C, Olivieri O, Girelli D. Increased membrane ratios of metabolite to precursor fatty acid in essential hypertension. Hypertension 1997; 29 : 1058–1063.
19. Vessby B, Gustafsson IB, Tengblad S et al. Desaturation and elongation of Fatty acids and insulin action. Ann N Y Acad Sci 2002; 967 : 183–195.
20. Warensjö E, Öhrvall M, Vessby B. Fatty acid composition and estimated desaturase activities are associated with obesity and lifestyle variables in men and women. Nutr Metab Cardiovasc Dis 2006; 16 : 128–136.
21. Kröger J, Zietemann V, Enzenbach C et al. Erythrocyte membrane phospholipid fatty acids, desaturase activity, and dietary fatty acids in relation to risk of type 2 diabetes in the European Prospective Investigation into Cancer and Nutrition (EPIC) – Potsdam Study. Am J Clin Nutr 2011; 93 : 127–142.
22. Kröger J, Schulze MB. Recent insight into the relation of D5 desaturase and D6 desaturase aktivity to the development of type 2 diabetes. Curr Opin Lipidol 2012; 23 : 4–10.
23. Žák A, Burda M, Vecka M et al. Fatty acid composition indicates two types of metabolic syndrome independent of clinical and laboratory parameters. Physiol Res 2014; 63 (Suppl. 3): S375–S385.
24. Saito E, Okada T, Abe Y et al. Abdominal adiposity is associated with fatty acid desaturase activity in boys: implications for C-reactive protein and insulin resistance. Prostaglandins Leukot Essent Fatty Acids 2013; 88 : 307–311.
25. Armutcu F, Akyol S, Ucar F et al. Markers in nonalcoholic steatohepatitis. Adv Clin Chem 2013; 61 : 67–125.
26. Jacobs S, Schiller K, Jansen E et al. Association between erytrocyte membrane fatty acids and biomarkers of dyslipidemia in the EPIC – Potsdam Europ J Clin Nutr 2014; 68 : 517–525.
27. Njoroge SW, Seegmiller AC, Katrangi W et al. Increased D5 - and D5-6 desaturase, cyclooxygenase-2, and lipoxygenase-5 expression and activity associated with fatty acid and eicosanoid changes in cystic fibrosis. Biochim Biophys Acta 2011; 1811 : 431–440.
28. Macášek J, Vecka M, Žák A. et al. Plasma fatty acid composition in patients with pancreatic cancer: correlations to clinical parameters. Nutr Cancer 2012; 64 : 946–955.
29. He C, Qu X, Wan J et al. Inhibiting delta-6 desaturase activity suppresses tumor growth in mice. PLoS One 2012; 7: e47567.
30. Pender-Cudlip MC, Krag KJ, Martini D et al. Delta 6-desaturase activity and arachidonic acid synthesis are increased in human breast cancer tissue. Cancer Sci 2013; 104 : 760–764.
31. Vařeka T, Vecka M, Jirák R et al. Plasma fatty acid profile in depressive disorder resembles insulin resistance state. Neuroendocrinol Lett 2012; 33(Suppl. 2): 83–86.
32. Liu Y, Jandacek R, Rider T et al. Elevated delta-6 desaturase (FADS2) expression in the postmortem prefrontal cortex of schizophrenic patients: relationship with fatty acid composition. Schizophr Res 2009; 109 : 113–120.
33. Liu Y, McNamara RK. Elevated delta-6 desaturase (FADS2) gene expression in the prefrontal cortex of patients with bipolar disorders. J Psychiatr Res 2011; 45 : 269–272.
34. Calon F, Limbo, Yang F et al. Docosahexaenoic acid protects from dendritic pathology in an Alzheimer’s disease mouse model. Neuron 2004; 43 : 633–645.
35. Schaeffer L, Gohlke H, Müller M et al. Common genetic variants of the FADS1 FADS2 gene cluster and their reconstructed haplotypes are associated with the fatty acid composition in phospholipids. Hum Mol Genet 2006; 15 : 1745–1756.
36. Malerba G, Schaeffer L, Xumerle L et al. SNPs of the FADS gene cluster are associated with polyunsaturated fatty acids in a cohort of patients with cardiovascular disease. Lipids 2008; 43 : 289–299.
37. Zietemann V, Kröger J, Enzenbac C et al. Genetic variation of the FADS1 FADS2 gene cluster and n-6 PUFA composition in erythrocyte membranes in the European Prospective Investigation into Cancer and Nutrition – Potsdam. Br J Nutr 2010; 104 : 1748–1759.
38. Kwak JH, Paik JK, Kim OY et al. FADS gene polymorphisms in Koreans: association with ω6 polyunsaturated fatty acids in serum phospholipids, lipid peroxides, and coronary artery disease. Atherosclerosis 2011; 214 : 94–100.
39. Sergeant S, Hugenschmidt CE, Rudock ME et al. Differences in arachidonic acid levels and fatty acid desaturase (FADS) gene variants in African Americans and European Americans with diabetes or the metabolic syndrome. Br J Nutr 2012; 107 : 547–555.
40. Mathias RA, Vergara C, Gao L et al. FADS genetic variants and omega-6 polyunsaturated fatty acid metabolism in a homogeneous island population. J Lipid Res 2010; 51 : 2766–2774.
41. Bokor S, Dumont J, Spinneker A et al. Single nucleotide polymorphisms in the FADS gene cluster are associated with delta-5 and delta-6 desaturase activities estimated by serum fatty acid ratios. J Lipid Res 2010; 51 : 2325–2333.
42. Nakayama K, Bayasgalan T, Tazoe F et al. A single nucleotide polymorphism in the FADS1/FADS2 gene is associated with plasma lipid profiles in two genetically similar Asian ethnic groups with distinctive differences in lifestyle. Hum Genet 2010; 127 : 685–690.
43. Tanaka T, Shen J, Abecasis GR et al. Genome-wide association study of plasma polyunsaturated fatty acids in the InCHIANTI Study. PLoS Genet 2009; 5: e1000338.
44. Stančáková A, Paananen J, Soininen P et al. Effects of 34 risk loci for type 2 diabetes or hyperglycemia on lipoprotein subclasses and their composition in 6,580 nondiabetic Finish men. Diabetes 2011; 60 : 1608–1616.
45. Kathiresan S, Willer CJ, Peloso GM et al. Common variants at 30 loci contribute to polygenic dyslipidemia. Nat Genet 2009; 41 : 56–65.
46. Dumont J, Huybrechts I, Spinneker A et al. FADS1 genetic variability interacts with dietary α-linolenic acid intake to affect serum non-HDL-cholesterol concentrations in European adolescents. J Nutr 2011; 141 : 1247–1253.
47. Sones Y, Kido T, Ainuki T et al. Genetic variants of the fatty acid desaturase gene cluster areassociated with plasma LDL cholesterol in Japanese males. J Nutr Sci Vitaminol 2013; 59 : 325–335.
48. Solakivi T, Kunnas O, Jaaakkola O et al. Delta-6-desaturase gene polymorphism is associated with lipoprotein oxidation in vitro. Lipids Health Dis 2013; 12 : 80.
49. Truong H, DiBello JR, Ruiz-Narvaez E et al. Does genetic variation in the D6-desaturase promoter modify the association between α-linolenic acid and the prevalence of metabolic syndrome? Am J Nutr 2009; 89 : 920–925.
50. Liu F, Li Z, Lv X, Ma J. Dietary polyunsaturated fatty acid intake modifies the effect of genetic variation in fatty acid desaturase 12 on coronary artery disease. Plos One 2015; 10: e0121255.
51. Lu Y, Feskens EJ, Dollé ME et al. Dietary n-3 and n-6 polyunsaturated fatty acid intake interacts with FADS1 genetic variation to affect total and HDL-cholesterol concentrations in the Doetinchem Cohort Study. Am J Clin Nutr 2010; 92 : 258–265.
52. Hellstrand S, Sonestedt E, Ericson U et al. Intake levels of dietary long-chain PUFAs modify the association between genetic variation in FADS and LDL-C. J Lipid Res 2012; 53 : 1183–1189.
53. Cormier H, Rudkowska I, Paradis AM et al. Association between polymorphisms in the fatty acid desaturase gene cluster and the plasma triacylglycerol response to an n-3 PUFA supplementation. Nutrients 2012; 4 : 1026–1041.
54. Cormier H, Rudkowska I, Thifault E et al. Polymorphism in fatty acid desaturase (FADS) gene cluster: effects on glycemic controls following an omega-3 polyunsaturated fatty acids (PUFA) supplementation. Genes 2013; 4 : 485–498.
55. Ebbesson SOE, Lopez-Alvarenga JC, Okin PM et al. Heart rate is associated with markers of fatty acid desaturation: the GOCADAN study. Int J Circumpolar Healt 2012; 71 : 17343.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- INFOGRAFIKA: Léčba CHOPN dle aktuálních doporučení GOLD
-
Všechny články tohoto čísla
- Česká sekce International College of Surgeons a Jubilejní světový chirurgický kongres
- Prof. Gunn − remarkable 90th birthday jubilee
- 85th anniversary of professor Eugen Strouhal
- Zemřel profesor František Kölbel
- Odešel lékař, vědec a muzikant, profesor Jiří Tichý
- Jubilanti − březen 2016
- Kalendář odborných akcí – duben/květen 2016
- Přednáškové večery Spolku českých lékařů v Praze (duben − červen 2016)
- Editorial
- Připomenutí osobnosti profesora Bohumila Prusíka
- Úloha bilirubinu v prevenci kardiovaskulárních a nádorových onemocnění
- Desaturázy mastných kyselin: patofyziologie a klinický význam
- Hodnocení a léčba portální hypertenze
- Prevence kolorektálního karcinomu
- Vývoj znalostí o idiopatických střevních zánětech
- Realimentační syndrom
- History of the 4th Department of Internal Medicine of the First Faculty of Medicine at Charles University and the General University Hospital in Prague
- První elektronické volby v ČLS JEP
- Role mikroRNA u nádorů hlavy a krku se zaměřením na sinonazální karcinom
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hodnocení a léčba portální hypertenze
- Realimentační syndrom
- Desaturázy mastných kyselin: patofyziologie a klinický význam
- Česká sekce International College of Surgeons a Jubilejní světový chirurgický kongres
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



