-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Rysy metabolického syndromu u nemocných s depresivní poruchou
Features of metabolic syndrome in patients with depressive disorder
Background.
Depressive disorder is a serious illness with a high incidence, proxime accessit after anxiety disorders among the psychiatric diseases. It is accompanied by an increased risk of development of type 2 diabetes mellitus, cardiovascular disease, and by increased all-cause mortality. Recently published data have suggested that factors connected with the insulin resistance are at the background of this association.Methods and results.
In this pilot study we have investigated parameters of lipid metabolism and glucose homeostasis in consecutively admitted patients suffering from depressive disorder (DD) (group of 42 people), in 57 patients with the metabolic syndrome (MetS) and in a control group of 49 apparently healthy persons (CON). Depressive patients did not differ from the control group by age or body mass index (BMI) value, but they had statistically significantly higher concentrations of serum insulin, C-peptide, glucose, triglycerides (TG), conjugated dienes in LDL particles (CD-LDL), higher value of microalbuminuria and of insulin resistance (HOMA-IR) index. They simultaneously had significantly lower value of the insulin sensitivity (QUICKI) index. In comparison with the MetS group the depressive patients were characterized by significantly lower both systolic and diastolic blood pressure, BMI , serum TG, apolipoprotein B, uric acid, C-peptide and by higher concentrations of apolipoprotein A-I and HDL-cholesterol. On the contrary, we have not found statistically significant differences between the DD and MetS groups in the concentrations of serum insulin, glucose, HOMA and QUICKI indices, in CD-LDL and MAU.Conclusions.
In this pilot study, we have found in patients with depressive disorder certain features of metabolic syndrome, especially insulin resistance and oxidative stress.Key words:
depressive disorder, metabolic syndrome, insulin resistance, oxidative stress.
Autoři: M. Zeman 1; R. Jirák 2; A. Žák 1; M. Jáchymová 1; M. Vecka 1; E. Tvrzická 1; L. Vávrová 1; J. Kodydková 1; B. Staňková 1
Působiště autorů: Univerzita Karlova v Praze, 1. lékařská fakulta a VFN, IV. interní klinika 1; Univerzita Karlova v Praze, 1. lékařská fakulta a VFN, Psychiatrická klinika, Centrum pro Alzheimerovu chorobu a Katedra psychiatrie IPVZ Praha 2
Vyšlo v časopise: Čas. Lék. čes. 2009; 148: 309-314
Kategorie: Původní práce
Souhrn
Východisko.
Depresivní porucha je závažné onemocnění s častým výskytem. Po úzkostných poruchách je to druhé nejčastější psychické onemocnění. Toto onemocnění je provázeno zvýšeným rizikem vzniku diabetes mellitus 2. typu, kardiovaskulárních onemocnění i zvýšenou celkovou mortalitou. Některé práce posledních let ukazují na to, že v pozadí těchto souvislostí by mohly být faktory spojené s rezistencí na působení inzulínu.Metody a výsledky.
V pilotní studii jsme vyšetřili ukazatele lipidového metabolismu a glukózové homeostázy u skupiny po sobě vyšetřených 42 nemocných s depresivní poruchou, dále skupinu 57 nemocných s metabolickým syndromem (MetS) a 49 zdravých osob. Nemocní s depresí, kteří se od osob kontrolní skupiny (KON) nelišili věkem ani BMI, měli statisticky významně vyšší koncentrace sérového inzulínu, C-peptidu, glykémie, plazmatických triglyceridů (TG), konjugovaných dienů v LDL (CD-LDL), vyšší mikroalbuminurii (MAU) a hodnotu indexu inzulínové rezistence (HOMA-IR); současně měli také významně nižší hodnoty indexu inzulínové senzitivity (QUICKI). Ve srovnání se skupinou MetS měly depresivní osoby statisticky významně nižší systolický i diastolický krevní tlak, BMI, nižší koncentraci TG, apolipoproteinu B, kyseliny močové, C-peptidu a vyšší koncentraci apolipoproteinu A-I a HDL-cholesterolu v plazmě. Na druhé straně jsme u osob s depresí ve srovnání se skupinou MetS nezjistili statisticky významné rozdíly v koncentracích plazmatické glukózy, inzulínu, CD-LDL, MAU a v hodnotách indexů HOMA a QUICKI.Závěry.
V této pilotní studii jsme zjistili u nemocných s depresivní poruchou přítomnost některých rysů metabolického syndromu, zejména inzulínové rezistence a oxidačního stresu.Klíčová slova:
depresivní porucha, metabolický syndrom, inzulínová rezistence, oxidační stres.Úvod
V současné době na celém světě vzrůstá incidence depresivní poruchy. Uvádí se, že v Evropě prodělá během života depresi asi 13 % lidí, přičemž asi u 4 % byla deprese zjištěna v uplynulém roce (1). Podle údajů Světové zdravotnické organizace (WHO) deprese poškozuje kvalitu života více než kardiovaskulární onemocnění (2). V České republice bylo v roce 2007 vyšetřeno nových 168 nemocných s afektivní poruchou na 100 000 obyvatel. Afektivní poruchy jsou po úzkostných a neurotických poruchách druhou nejpočetnější skupinou psychických onemocnění a v České republice jsou po kardiovaskulárních onemocněních čtvrtou nejčastější příčinou plné invalidity (3). Význam deprese spočívá mimo jiné také v tom, že je spojena se zvýšeným rizikem diabetes mellitus 2. typu (DM2) (4), se zvýšenou mortalitou na kardiovaskulární onemocnění (KVO) i se zvýšenou celkovou mortalitou (5).
V současné době je testována hypotéza, že možným spojovacím článkem mezi depresí, KVO a diabetem je metabolický syndrom (MetS) (6, 7). Pojmem metabolický syndrom je označován soubor změn, mezi něž patří abdominální obezita, hypertriglyceridémie, pokles HDL-cholesterolu, arteriální hypertenze, zvýšená hladina glukózy v krvi, ale také subklinický zánět, protrombotický stav nebo zvýšený oxidační stres (8).
Asociace mezi depresivní poruchou a MetS byly popsány ve studii u mužských dvojčat (9). U žen s epizodou deprese v anamnéze byla více než dvojnásobná pravděpodobnost přítomnosti MetS než u žen bez anamnézy deprese podle nálezů NHANES III (Third National Health and Nutrition Examination Survey) (7). Ženy onemocní depresivní poruchou asi dvakrát častěji než muži.
Soubor nemocných a použité metody
Pacienti
Do studie bylo v v období květen 2006 až duben 2008 postupně zařazeno 42 nemocných (7 mužů, 35 žen) s depresivní poruchou (skupina DP) a 57 nemocných s metabolickým syndromem (35 mužů, 22 žen) (skupina MetS), pocházejících z okruhu ambulance Psychiatrické kliniky a Lipidové a diabetologické ambulance IV. interní kliniky 1. LF UK a VFN. Deprese byla klasifikována podle kritérií DSM-IV Americké psychiatrické společnosti (10), metabolický syndrom byl diagnostikován na základě kritérií IDF (International Diabetes Federation) (11). Kontrolní skupinu tvořilo 49 osob (19 mužů, 30 žen) převážně z řad zdravotnického personálu, u kterých v době vyšetření nebylo přítomno žádné závažné onemocnění. Ve skupině DP převažovali nemocní, kteří byli vyšetřeni pro střední a těžkou depresivní fázi (diagnózy podle MKN-10 F 32.1 a F 32.2) nebo pro periodickou depresivní poruchu střední nebo těžkou (diagnózy F 33.1 a F 33.2). U pacientů trpících periodickou depresivní poruchou a již léčených v době prvního vyšetření se nejednalo o první fázi, ale o druhou až jedenáctou fázi. Ve skupině drug-naive byli pacienti s prvním výskytem depresivního onemocnění. Pacienti užívající farmaka užívali antidepresiva minimálně 3 týdny před prvním vyšetřením. Základní charakteristiky probandů jsou uvedeny v tabulce 1. Mezi depresivními pacienty bylo v době vyšetření sedm nemocných bez léčby, dvanáct bylo léčeno escitalopramem v monoterapií v denní dávce 10 mg a devatenáct bylo léčeno kombinací escitalopram 10 mg denně + mirtazapin 30 mg denně. Jeden nemocný byl léčen venlafaxinem v dávce 150 mg denně, jeden kombinací venlafaxin 150 mg denně a mirtazapin 30 mg denně a dvěma nemocným byla podávána kombinace sertralin 100 mg a mirtazapin 30 mg denně. Ve skupině DP bylo 13 hypertoniků, léčených v šesti případech inhibitory angiotenzin-konvertujícího enzymu (ACE-I) v monoterapii, ve třech případech blokátory kalciových kanálů, ve dvou případech blokátory angiotenzinových receptorů (ARB) a dva nemocní byli léčeni kombinací ACE-I + blokátor kalciových kanálů). Ze studie byli vyloučeni jedinci se známkami nádorového onemocnění, hypotyreózy, jaterní nebo renální insuficience či závažného onemocnění gastrointestinálního traktu, dále nemocní s makroalbuminurií (definovanou jako proteinurie vyšší než 300 mg/den) a také osoby užívající vitaminové suplementy, antioxidanty či přípravky, obsahující polyenové mastné kyseliny. Studie byla schválena Etickou komisí VFN a 1. LF UK Praha. Všichni pacienti podepsali informovaný souhlas se zařazením do studie.
Tab. 1. Základní klinické parametry sledovaných skupin 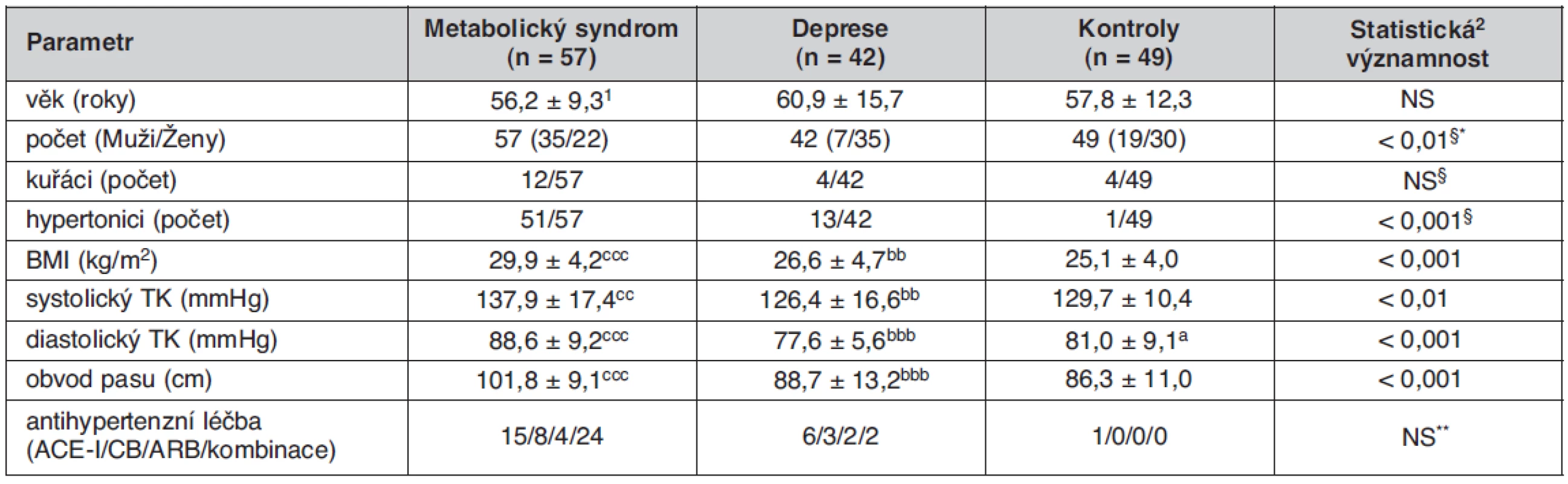
1průměr ± SD; 2Kruskallův-Wallisův test; §Pearsonův χ2 test *rozdíl DP vs. KON i MetS statisticky významný rozdíl DP vs. KON: ap < 0,05 statisticky významný rozdíl DP vs. MetS: bbp < 0,01; bbbp < 0,001 statisticky významný rozdíl MetS vs. KON: ccp < 0,01; cccp < 0,001 ACE-I – inhibitory angiotenzín konvertujícího enzymu, CB – blokátory kalciových kanálů, ARB – blokátory angiotenzínových receptorů **/NS při srovnání metabolického syndromu vs. deprese Laboratorní vyšetření
Ve sledovaných skupinách osob byly vyšetřeny koncentrace plazmatických lipidů, lipoproteinů a apolipoproteinů, hladina konjugovaných dienů (CD) v precipitovaných LDL glykémie, koncentrace imunoreaktivního inzulínu (IRI), C-peptidu, urikémie, volné mastné kyseliny (NEFA), apolipoproteiny (apo) A-I, B v plazmě a mikroalbuminurie.
Odběry krve byly prováděny po celonočním lačnění do K2EDTA (mg/ml krve). Koncentrace celkového cholesterolu (TC), triglyceridů (TG), kyseliny močové a glukózy byly stanoveny pomocí enzymaticko-kolorimetrických metod (CHOD/PAP, GPO/PAP, Test Combination PL, Boehringer Mannheim, FRG, Oxochrom kyselina močová, GOD-PAP Oxochrom Glukosa Lachema a.s., Brno), koncentrace IRI, C‑peptidu a NEFA pomocí enzymaticko-kolorimetrických a RIA metod., HDL-C v supernatantu po precipitaci lipoproteinů B užitím PTA/Mg2+, apolipoproteiny (apo) B, A-I a A-II byly stanoveny EIA podle Laurella s pomocí specifických standard a protilátek (Behring Werke AG Marburg, Boehringer Mannheim, FRG). Konjugované dieny v precipitovaných LDL byly stanoveny metodou podle Ahotupa et al. (12). Mikroalbuminurie byla vyšetřována metodou laserové nefelometrie (Image MA reagent kit, Beckman Coulter, USA). Byly vypočteny matematické ukazatele inzulínové senzitivity – HOMA (homeostasis model assessment) a QUICKI (quantitative insulin sensitivity check index) (13, 14).
Statistické hodnocení bylo prováděno v prostředí STATISTICA CZ ver 7.1 (StatSoft Inc., Tulsa, USA).
Výsledky
Základní klinické parametry sledovaných skupin jsou uvedeny v tabulce 1. Jednotlivé skupiny se nelišily významně věkem, probandi skupiny MetS měli ve srovnání se skupinou KON i DP vyšší hodnotu BMI (MetS vs. KON, p < 0,001, MetS vs. DP p < 0,01), obvodu pasu (obě p < 0,001), systolického krevního tlaku (MetS vs. KON, p < 0,01, MetS vs. DP p < 0,01) i diastolického krevního tlaku (MetS vs. KON, p < 0,001, MetS vs. DP p < 0,001). Skupina DP měla v průměru nižší diastolický krevní tlak ve srovnání s kontrolní skupinou. V tabulce 2 jsou uvedeny hodnoty vyšetřovaných biochemických ukazatelů. Podle očekávání měli jedinci skupiny MetS ve srovnání se skupinou KON významně vyšší koncentrace TC (p < 0,01), TG, apo B, kyseliny močové, glykémie, inzulínu, C-peptidu, CD-LDL a MAU, (všechna p< 0,001), vyšší hodnotu indexu HOMA-IR (p < 0,01), nižší koncentraci HDL-C a hodnotu indexu QUICKI (obě p < 0,001). Při srovnání skupin DP a MetS jsme našli u depresivních nemocných nižší TG, apoB, urikémii a koncentraci C‑peptidu. Depresivní nemocní se však od skupiny MetS nelišili v hodnotách glykémie, inzulínu, indexu HOMA-IR i QUICKI, v koncentraci CD-LDL a v MAU. U těchto analytů byly ve skupině DP zjištěny statisticky významné rozdíly ve srovnání s kontrolní skupinou, podobné jako ve skupině MetS: glykémie (p < 0,05), inzulínu a C-peptidu (obě p < 0,01), HOMA-IR a QUICKI (obě p < 0,05), CD-LDL a MAU (obě p < 0,01). Skupina DP se od skupiny KON lišila také významně vyšší koncentrací TG (p < 0,01). Všechny rozdíly zůstaly statisticky významné i po adjustaci na pohlaví. Mezi jednotlivými skupinami nebyly zjištěny žádné významné rozdíly v koncentracích LDL-C, NEMK a CRP. Pro věší názornost je srovnání hodnot hlavních biochemických ukazatelů metabolického syndromu mezi skupinami MetS, DP a KON uvedeno v grafu 1.
Tab. 2. Metabolické ukazatele u sledovaných skupin 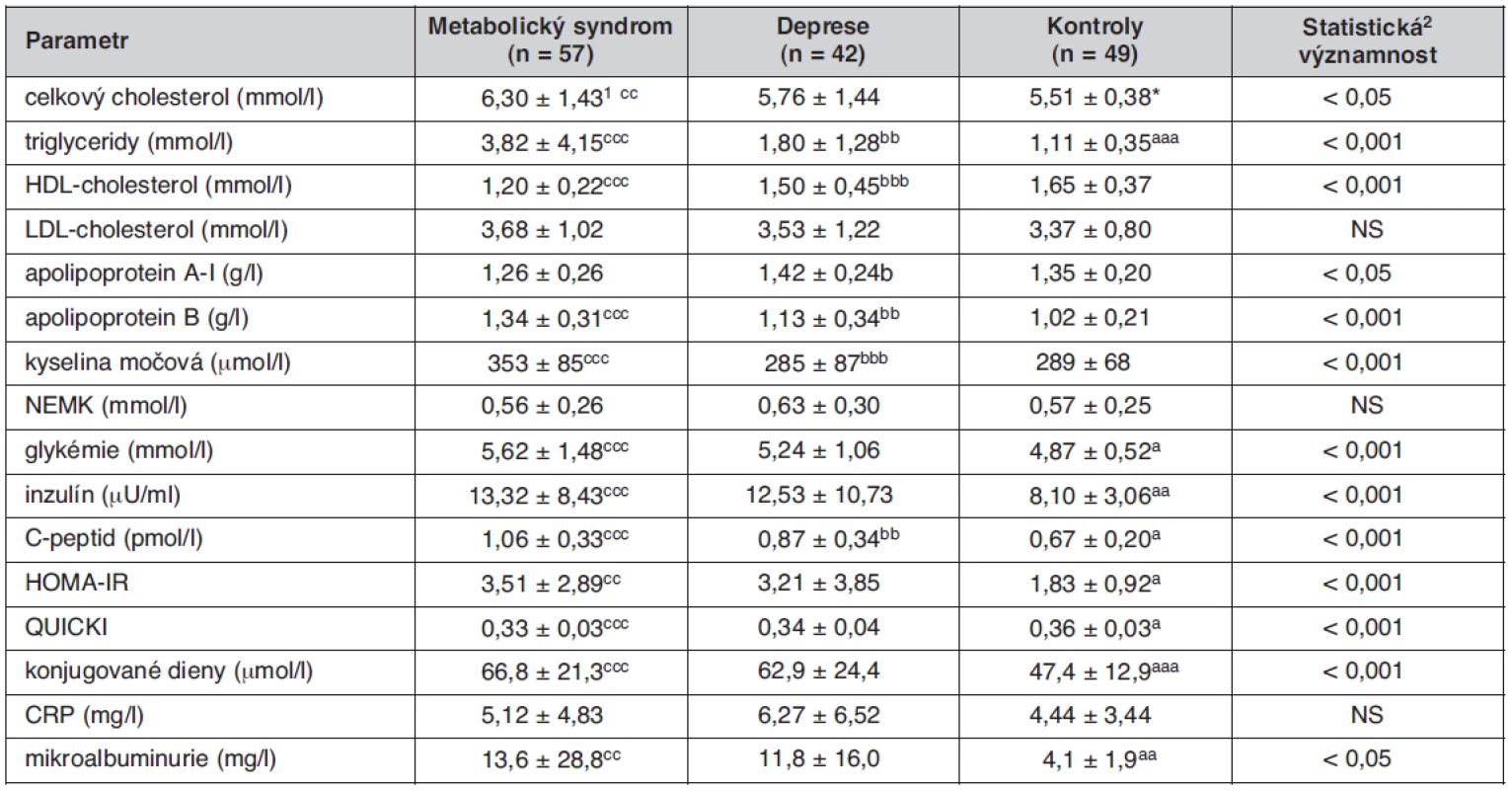
1průměr ± SD; 2Kruskallův-Wallisův test statisticky významný rozdíl DP vs. KON: ap < 0,05; aap < 0,01; aaap < 0,001; *p = 0,09 statisticky významný rozdíl DP vs. MetS: bp < 0,05; bbp < 0,01; bbbp < 0,001 statisticky významný rozdíl MetS vs. KON: cp < 0,05; ccp < 0,01; cccp < 0,001 HOMA – „homeostasis model assessment“, IR – lačná inzulínémie (μU/ml) × lačná glykémie (mmol/l)/22,5, QUICKI – quantitative insulinsensitivity check index = 1/[(log(I0) + log(G0)], kde I0 je lačná inzulinémie (μU/ml) a G0 je lačná glykémie (mg/dl) Graf 1. Hodnoty vybraných biochemických parametrů, charakterizujících metabolický syndrom u jednotlivých sledovaných skupin. Koncentrace plazmatických triacylglycerolů, glykémie, inzulínu, C-peptidu a konjugovaných dienů se u nemocných s depresí statisticky významně liší od hodnot kontrolní skupiny podobně jako u pacientů s metabolickým syndromem, pouze v případě HDL-cholesterolu tento rozdíl nedosahuje statistické významnosti. *p<0,05; **p<0,01; ***p<0,001; Kruskallův-Wallisův test 
Uvnitř skupiny DP celkem 15 žen z 36 (41 %) a 2 muži ze 6 (33 %) splňovali kritéria IDF pro klasifikaci MetS. Z hlavních komponent MetS byla nejčastěji přítomna zvýšená hodnota obvodu pasu (u 24 žen a 4 mužů, tj. vždy u 66 % probandů). Hypertenze byla přítomna u 12 depresivních žen (33 %) a u 3 mužů (50 %), kritérium zvýšené glykémie splňovalo 9 žen (25 %), zatímco žádný muž. Hypertriglyceridémii mělo 9 depresivních žen (25 %) a 4 muži (66 %) a sníženou hladinu HDL‑cholesterolu podle kritérií IDF mělo 10 žen (27 %) a 4 muži (66 %).
Při srovnání hodnot sledovaných parametrů u hlavních podskupin depresivních nemocných podle způsobu léčby, tj. nemocní, kteří v době vyšetření byli bez léčby (n = 7), podskupina léčená escitalopramem v monoterapii (n = 12) a podskupina léčená kombinací escitalopramu s mirtazapinem (n = 19), nebyly zjištěny statisticky významné rozdíly, pouze podskupina nemocných bez léčby byla mladší. Rozdíly nebyly statisticky významné ani po adjustaci na věk.
Diskuze
Hlavním nálezem této pilotní studie byl nález zvýšené koncentrace imunoreaktivního inzulínu (IRI), C-peptidu, glykémie, TG a indexu inzulínové rezistence HOMA a snížené hodnoty indexu inzulínové senzitivity QUICKI u nemocných s depresivní poruchou ve srovnání s osobami kontrolní skupiny, které se od pacientů s depresí nelišily statisticky významně věkem, BMI ani obvodem pasu. Zjištění zvýšené MAU a koncentrace CD-LDL u depresivních osob bylo také významné. Ve srovnání se skupinou MetS se depresivní jedinci na jedné straně statisticky významně nelišili v hodnotách IRI, glykémie, HOMA, QUICKI, MAU a CD-LDL na druhé straně však měli ve srovnání s nimi významně nižší BMI, systolický i diastolický TK, apoB, TG, urikémii a vyšší HDL-C a apoA-I.
V posledních letech byla publikována řada prací, které poukazují na možný význam inzulínové rezistence (IR) v patogenezi deprese. U depresivních nemocných s normální glukózovou tolerancí (NGT) byly nalezeny významně vyšší hodnoty indexu HOMA-IR než u zdravých osob s NGT (15). V jiné studii Okamura et al. (16) hodnotili inzulínovou senzitivitu s užitím minimálního modelu u pacientů s depresí a sledovali její změny v průběhu antidepresivní léčby. Zjistili, že nemocní s depresí mají sníženou inzulínovou senzitivitu s výslednou hyperinzulinémií, a že tyto změny ustupují v průběhu léčby deprese. Působení IR v patogenezi deprese není zcela jasné. Rasgonová et al. (17) našli u žen s bipolární poruchou zvýšené hladiny lačné glykémie, hodnoty HOMA-IR a BMI, přičemž 56 % žen mělo zvýšenou hodnotu HOMA-IR (nad 2,3).
Alespoň u části případů deprese lze prokázat aktivaci sympatoadrenálního systému a zvýšenou hladinu glukokortikoidů, které přispívají k rozvoji IR, DM2 i KVO. Hyperkortisolémie působí toxicky na hippocampus, jehož atrofie byla ve studiích, užívajících zobrazení magnetickou rezonancí, pozorována u DM2 (18) i u deprese (19). Inzulínová rezistence potencuje neurotoxické působení kortikoidů v hippocampu (20). Pokles objemu hippokampu byl zjištěn i u osob s porušenou glukózovou tolerancí, které nebyly dementní, ani neměly DM2 (21). V současné době je deprese – podobně jako Alzheimerova demence – považována za neurodegenerativní onemocnění, kde vedle hormonálních změn hraje mimo jiné významnou roli i oxidační stres (22). Inzulínová rezistence je se zvýšeným oxidačním stresem významně asociována (23). Zajímavé jsou nálezy úpravy kognitivních funkcí po léčbě glitazony (inzulínovými senzitizéry) u časných stadií Alzheimerovy demence (24). V této pilotní studii se depresivní nemocní, přestože byli charakterizováni inzulínovou rezistencí, nelišili od kontrolních osob váhou, hodnotami BMI, obvodem pasu ani neměli vyšší krevní tlak. Je však známo, že IR není podmíněna jen obezitou, vyskytuje se stejně jako část případů DM2 i u štíhlých osob (25). Inzulínová rezistence může být jedním z možných spojovacích článků mezi depresí a zvýšeným rizikem DM2, KVO i zvýšené celkové mortality, které jsou u deprese popisovány (4, 5).
Léčba různými antidepresivy může inzulínovou senzitivitu ovlivňovat různým způsobem; výsledky experimentálních a klinických studií nejsou konzistentní.
Podávání tricyklických antidepresiv může zvyšovat IR (26). Léčba selektivními inhibitory zpětného vychytávání serotoninu (SSRI – selective serotonin-reuptake inhibitors) může naopak IR snižovat (16), i když v experimentu paroxetin a sertralin (skupina SSRI) zhoršovaly signalizaci inzulínu v buňce (27). V nedávno provedené studii u nediabetických depresivních pacientů vedla úspěšná léčba preparátem SSRI i tricyklickým antidepresivem ke zvýšení inzulínové senzitivity (28).
V naší práci jsme nezjistili významné rozdíly v ukazatelích glukózové homeostázy mezi skupinou depresivních nemocných, kteří byli vyšetřeni ještě před nasazením léčby a skupinou nemocných, léčených buď samotným escitalopramem, nebo escitalopramem (SSRI) v kombinaci s mirtazapinem. Mirtazapin je nové antidepresivum, které zvyšuje serotonergní i noradrenergní neurotransmisi a současně blokuje 5HT2 a 5HT3 receptory, což omezuje nežádoucí účinky SSRI (příznaky serotoninového syndromu). Léčba mirtazapinem může vést k vzestupu tělesné hmotnosti, avšak ovlivnění glukózové homeostázy nebývá zjišťováno (29). U escitalopramu nebylo významné ovlivnění glukózového metabolismu a IR pozorováno (30, 31).
V naší skupině depresivních osob jsme stejně jako u skupiny MetS zjistili významně vyšší koncentraci konjugovaných CD-LDL ve srovnání s kontrolní skupinou. Koncentrace konjugovaných dienů odráží hladinu tzv. minimálně modifikovaných (mm) LDL (u kterých je oxidací alterována lipidová složka částice, na rozdíl od složky proteinové) in vivo. Zvýšený oxidační stres je charakteristický pro MetS (32), přispívá ke zvýšenému riziku aterosklerózy a podle novějších poznatků je základním článkem v patogeneze IR, DM2 a KVO (23). Ke zvýšenému oxidačnímu stresu u MetS přispívají jeho komponenty, tj. aterogenní dyslipidémie, zvýšená glykémie, arteriální hypertenze i subklinický („low grade“) zánět.
Prací zabývajících se oxidačním stresem u deprese není mnoho. V ojedinělých pracích byly u depresivních osob popsány zvýšené sérové hladiny markerů lipoperoxidace (33), zvýšené hladiny malondialdehydu, aktivita superoxiddismutázy (SOD) a pokles koncentrace kyseliny askorbové (34). Mozek je vůči oxidačnímu stresu vysoce citlivý v důsledku velké spotřeby kyslíku (až 20 % kyslíku spotřebovávaného organizmem) (35), velkého množství PUFA, citlivých vůči oxidaci, vysokého obsahu železa a nízké koncentrace antioxidačních enzymů. U deprese se oxidační stres může uplatňovat negativním ovlivněním plasticity neuronů (36). Zvýšená úroveň oxidačního stresu by mohla být dalším spojovacím článkem mezi depresí a zvýšeným výskytem DM2 i KVO.
Ve srovnání s kontrolními osobami jsme u depresivních pacientů našli stejně jako u nemocných s MetS významně vyšší MAU. Mikroalbuminurie je v současné době považována za součást metabolického syndromu (8) a za ukazatel zvýšeného kardiovaskulárního rizika. Přesná povaha asociace MAU s rizikem KVO není dosud jasná, předpokládá se, že v pozadí stojí společný patofyziologický mechanismus, jako je zejména endoteliální dysfunkce a chronický (subklinický) zánětlivý stav (37).
Studie byla částečně limitována vyšším podílem žen ve skupině DP, což bylo zřejmě ovlivněno faktem, že deprese se častěji vyskytuje u žen než u mužů (1, 3) a také větší ochotou depresivních žen k zařazení do studie. Naproti tomu v našem souboru nemocných jsme zjistili vyšší prevalenci MetS u mužů. Statistické významnosti pozorovaných rozdílů mezi jednotlivými sledovanými skupinami se také neměnily po adjustaci na pohlaví.
ZÁVĚR
Závěrem lze říci, že výsledky této pilotní studie jsou v souladu s hypotézou, že alespoň u subpopulace nemocných s depresivní poruchou je možné identifikovat některé rysy metabolického syndromu a že u této skupiny nemocných hraje v patogeneze deprese roli inzulínová rezistence. Inzulínová rezistence spolu s dalšími faktory, jako je např. oxidační stres, může stát v pozadí známé asociace depresivní poruchy se zvýšeným rizikem DM2 a KVO. Výsledky bude jistě nutné ověřit v rozsáhlejších studiích. Pokud by se význam inzulínové rezistence v patogeneze deprese i dalších neurodegenerativních onemocnění potvrdil, mohlo by to vést k rozšíření možností prevence i léčby těchto závažných chorob.
Zkratky
BMI – hmotnostní index (body maas index)
CD-LDL – konjugované dieny v LDL
CRP – C - reaktivní protein
DM2 – diabetes mellitus 2. typu
HOMA-IR – hodnota indexu inzulínové rezistence
IR – inzulínová rezistence
KON – kontrolní skupina
KVO – kardiovaskulární onemocnění
MAU – mikroalbuminurie
MetS – metabolický syndrom
MKN-10 – Mezinárodní klasifikace nemocí
NEMK – neesterifikované mastné kyseliny
PGT – porušená glukózová tolerance
PUFA – polyunsaturated fatty acids (vícenenasycené mastné kyseliny)
HOMA – homeostasis model assessment
QUICKI – index inzulínové senzitivity (quantitative insulin sensitivity check index)
SOD – superoxiddismutáza
SSRI – selektivními inhibitory zpětného vychytávání serotoninu (selective serotonin-reuptake inhibitors)
TG – triglyceridy
Práce byla podporována grantem IGA MZČR NR/8806-3.
Adresa pro korespondenci:
doc. MUDr. Miroslav Zeman, CSc.
IV. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
fax: +420 224 923 524, e-mail: mirozem@seznam.cz
Zdroje
1. ESEMeD/MHEDEA2000. Prevalence of mental disorders in Europe: results from the European Study of the Epidemiology od Mental Disorders (ESEMeD) Project. Acta Psychiatr Scand 2004; 109 (Suppl1): 21–27.
2. Murray CJ, Lopez AD. Global mortality, disability, and the contribution of risk factors: Global Burden of Disease Study. Lancet 1997; 349 : 1436–1442.
3. Zdravotnická ročenka České republiky 2007. Praha: ÚZIS 2008.
4. Musselman DL, Betan E, Larsen H, Phillips LS. Relationship of Depression to Diabetes Types 1 and 2: Epidemiology, Biology, and Treatment. Biol Psychiatry 2003; 54 : 317–329.
5. Wulsin LR, Vaillant GE, Wells V-E. A systematic review of the mortality of depression. Psychosom Med 1999; 61 : 6–17.
6. Chrousos GP. The role of stress and the hypothalamic-pituitary-adrenal axis in the pathogenesis of the metabolic syndrome: neuro-endocrine and target tissue-related causes. Int. J Obes 2000; 24: S50–S55.
7. Kinder LS, Carnethon MR, Palaniappan LP, et al. Depression and the metabolic syndrome in young adults: findings from the Third National Health and Nutrition Examination Survey. Psychosom Med 2004; 66 : 316–322.
8. Eckel RH, Grundy SM, Zimmet PZ. The metabolic syndrome. Lancet 2005; 365 : 1415–1428.
9. McCaffery JM, Niaura R, Todaro JF, et al. Depressive symptoms and metabolic risk in adult male twins enrolled in the National Heart, Lung, and Blood Institute Twin Study. Psychosom Med 2003; 65 : 490–497.
10. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, fourth edition. Washington, D. C.: American Psychiatric Association 1994.
11. Alberti KG, Zimmet P, Shaw J. Metabolic syndrome – a new world-wide definition. A Consensus Statement from the International Diabetes Federation. Diabet Med 2006; 23 : 469–480.
12. Ahotupa M, Ruutu M, Mantyla E. Simple methods of quantifying oxidation products and antioxidant potential of low density lipoproteins. Clin Biochem 1996; 29 : 139–144.
13. Matthews DR, Hosker JP, Rudenski AS, et al. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985; 28 : 412–419.
14. Katz A, Nambi SS, Mather K, et al. Quantitative insulin sensitivity check index: a simple, accurate method for assessing insulin sensitivity in humans. J Clin Endocrinol Metab 2000; 85 : 2402–2410.
15. Chiba M, Suzuki S, Hinokio Y, et al. Tyrosine hydroxylase gene microsatellite polymorphism associated with insulin resistance in depressive disorder. Metabolism 2000; 49 : 1145–1149.
16. Okamura F, Tashiro A, Utumi A, et al. Insulin resistance in patients with depression and its changes during the clinical course of depression: minimal model analysis. Metabolism 2000; 49 : 1255–1260.
17. Rasgon N, Altshuler L, Fairbanks L, et al. Reproductive function and risk for PCOS in women treated for bipolar disorder. Bipolar Disord 2005; 7 : 246–259.
18. den Heijer T, Vermeer S, van Dijk E, et al. Type 2 diabetes and atrophy of medial temporal lobe structures on brain MRI. Diabetologia 2003; 46 : 1604–1610.
19. Sheline YI, Wang PW, Gado MH, et al. Hippocampal atrophy in recurrent major depression. Proc Natl Acad Sci USA 1996; 93 : 3908–3913.
20. Rasgon NL, Kenna HA. Insulin resistance in depressive disorders and Alzheimer’s disease: Revisiting the missing link hypothesis. Neurobiol Aging 2005; 26: S103–S107.
21. Convit A, De Leon M.J, Tarshish C, et al. Specific hippocampal volume reductions in individuals at risk for Alzheimer’s disease. Neurobiol Aging 1997; 18 : 131–138.
22. Shelton RC. The molecular neurobiology of depression. Psychiatr. Clin North Am 2007; 30 : 1–11.
23. Ceriello A, Motz E. Is oxidative stress the pathogenic mechanism underlying insulin resistence, diabetes and cardiovascular disease? The common soil hypothesis revisited. Arterioscler. Tromb VascBiol 2004; 24 : 816–823.
24. Watson GS, Cholerton BA, Reger MA, et al. Am J Geriatr Psychiatry 2005; 13 : 950–958.
25. McLaughlin T, Allison G, Abbasi F, et al. Prevalence of insulin resistance and associated cardiovascular disease risk factors among normal weight, overweight, and obese individuals. Metabolism 2004; 53 : 495–499.
26. Chadwick W, Wilson G, van de Venter M, et al. Shifts in metabolic parameters surrounding glucose homoeostasis resulting from tricyclic antidepressant therapy: implications of insulin resistance? J Pharm Pharmacol 2007; 59 : 95–103.
27. Levkovitz Y, Ben-shushan G, Hershkovitz A, et al. Antidepressants induce cellular insulin resistance by activation of IRS-1 kinases. Mol Cell Neurosci 2007; 36 : 305–312.
28. Weber-Hamann B, Gilles M, Lederbogen F, et al. Improved insulin sensitivity in 80 nondiabetic patients with MDD after clinical remission in a double-blind, randomized trial of amitriptyline and paroxetine. J Clin Psychiatry 2006; 67 : 1856–1861.
29. Laimer M, Kramer-Reinstadler K, Rauchentauner M, et al. Effect of mirtazapine treatment on body composition and metabolism. J Clin Psychiatry 2006; 67 : 421–424.
30. McIntyre RS, Soczynska JK, Konarski JZ, Kennedy SH. The effect of antidepressants on glucose homeostasis and insulin sensitivity: synthesis and mechanisms. Expert Opin Drug Saf 2006; 5 : 157–168.
31. Baldwin DS, Reines EH, Guiton C, Weiller E. Escitalopram Therapy for Major Depression and Anxiety Disorders. Ann Pharmacother 2007; 41 : 1583–1589.
32. Žák A, Tvrzická E, Vecka M, et al. Insulin resistance, lipoperoxidation, and fatty acid composition: relationship to metabolic syndrome components in men. Tohoku J Exp Med 2007; 212 : 359–371.
33. Tsuboi H, Shimoi K, Kinae N. et al. Depressive symptoms are independently correlated with lipid peroxidation in a female population: comparison with vitamins and carotenoids. J Psychosom Res 2004; 56 : 53–58.
34. Khanzode SD, Dakhale GN, Khanzode SS, et al. Oxidative damage and major depression: the potential antioxidant action of selective serotonin re uptake inhibitors. Redox Rep 2003; 8 : 365–370.
35. Juurlink BH, Paterson PG. Review of oxidative stress in brain and spinal cord injury: suggestions for pharmacological and nutritional management strategies. J Spinal Cord Med 1998; 2 : 309–334.
36. Wu A, Ying Z, Gomez-Pinilla, F. The interplay between oxidative stress and brain-derived neurotrophic factor modulates the outcome of a saturated fat diet on synaptic plasticity and cognition. Eur J Neuroscience 2004; 19 : 1699–1707.
37. Stehouwer CD, Smulders, YM. Microalbuminuria and risk for cardiovascular disease: Analysis of potential mechanisms. J Am Soc Nephrol 2006; 17 : 2106–2111.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Využití individuálních genomických znalostí
- Sekvenování lidského genomu – technologie nové generace aneb budeme rutinně sekvenovat lidské genomy?
- Kniha
- Přehled poranění pohybového aparátu pacientů ošetřených v zimních měsících v horské nemocnici
- SCAI funguje jako potlačovač invaze nádorových buněk
- Rysy metabolického syndromu u nemocných s depresivní poruchou
- Srovnání sérových hladin vybraných biologických působků u monoklonální gamapatie nejistého významu a mnohočetného myelomu
- Oboustranný spontánní pneumotorax – chybný léčebný postup
- Studium hojení ran začíná u mezibuněčných spojů
- Glykoprotein jako transportér léků u melanomu
- Kurativní efekt karotické endarterektomie
- Nečitelný otisk prstů po cytostatiku xeloda (capecitabinum)
- O lidském stárnutí a dlouhověkosti – 2. vnitřní podmínky
- Návykové nemoci a peníze – důležité souvislosti
- Český model pro snížení mateřské úmrtnosti v Ugandě
- Doporučení k antimikrobiální léčbě u nemocných s alergií na betalaktamová antibiotika
- Eozinofily v gastrointestinálním traktu
- Mastocyty a eozinofily: dvě klíčové efektorové buňky v alergickém zánětu
- Věda a Výroční ceny Nadace český literární fond za rok 2008
- ŽIVOTNÍ JUBILEUM DOC. MUDr. DAGMARLINCOVÉ, CSc
- Docent Petr Bartůněk – 70 let
- Joshua Lederberg
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Oboustranný spontánní pneumotorax – chybný léčebný postup
- Sekvenování lidského genomu – technologie nové generace aneb budeme rutinně sekvenovat lidské genomy?
- Eozinofily v gastrointestinálním traktu
- O lidském stárnutí a dlouhověkosti – 2. vnitřní podmínky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



