-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Tekutinová terapie v intenzivní péči*
Intravenous fluid therapy in intensive care
Fluid therapy is an everyday issue in the daily routine of every anaesthesiologist and intensive care physician. Like with any other drug, administration of intravenous fluids is coupled with effects wanted and unwanted. This review article is a printed supplement and explanation of the electronic Smart Card issued for better understanding of how and when fluids should be indicated and administered.
Keywords:
fluid therapy – fluid challenge – intensive care
Autoři: J. Beneš
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice a Lékařská fakulta v Plzni, Univerzita Karlova v Praze
Vyšlo v časopise: Anest. intenziv. Med., 27, 2016, č. 2, s. 107-115
Kategorie: Intenzivní medicína - Přehledový článek
Souhrn
Tekutinová terapie je neoddělitelnou součástí každodenní anesteziologické a intenzivistické praxe. Stejně jako podání jakéhokoli jiného léčiva je i podání tekutin spojeno s žádoucími a nežádoucími účinky. Předkládáný článek je doprovodným textem elektronicky dostupné Smart Card zabývající se problematikou indikace, načasování, způsobu a rizik intravenózního podání tekutin.
Klíčová slova:
tekutinová terapie – tekutinová výzva – intenzivní péčeÚVOD
Intravenozní podávání tekutin je nutnou součástí péče o kriticky nemocné. Již v roce 1832 navrhl Thomas Atchingson Latta léčit cholerovou epidemii intravenózním podáváním fyziologického roztoku [1]. O století později postuloval Alfred Blalock, že šok (v případě jeho experimentů hlavně traumatický) je spojen s redukcí cirkulujícího objemu, a že intravenózní podání náhradních roztoků a transfuzních přípravků může být život zachraňující [2]. Na druhou stranu již od svých počátků lékaři přikládali za různých okolností pacientům pijavice a prováděli venesekce, v novějších dobách podávají diuretika k odstranění otoků nebo objemového přetížení. Problematika tekutinové terapie se tedy vine jako tenká červená nit celou historií lékařství a díky intenzitě, se kterou pracujeme při péči o kriticky nemocné, je stále jedním z dominantních problémů našeho oboru.
ZÁKLADNÍ PATOFYZIOLOGICKÉ ASPEKTY HYPO - A HYPERVOLÉMIE
Lidský organismus se fyziologicky sestává cca ze 60 % z vody rozdělené do 3 hlavních kompartmentů: největšího – intracelulárního, který zaujímá cca 40 %, intersticiálního tvořícího cca 15 % a intravaskulárního s přibližně 5 % celkové hmotnosti. Mezi těmito prostory je přestup vody a iontů úzkostlivě hlídán pomocí membrán a aktivních nebo pasivních transportních mechanismů. Na intra/extracelulární úrovni je v naprosté většině případů dominantní silou rozdíl v množství osmoticky aktivních látek uvnitř buňky a v intersticiu. Na rozhraní intra-extravaskulárním podle nejnovějších poznatků převládá vliv endotelu a vrstvy endoteliální glykokalyx – výstelky složené z vysoce onkoticky aktivních proteoglykanů. Tato vrstva pravděpodobně významně alteruje klasický Starlingův zákon o vlivu hydrostatických a onkotických tlaků na míru přestupu tekutin v kapiláře [3]. Do jaké míry současné experimenty ospravedlňují předpoklad nulové zpětné filtrace z intersticia přímo do kapilárního řečiště a evakuaci intersticia cestou lymfatické drenáže [4], zatím není vyjasněno. Důkazy o negativním vlivu různých patofyziologických stavů (septikémie, SIRS, hypervolémie) na sílu vrstvy endoteliální glykokalyx (a tedy její bariérovou funkci) se ale jeví dostatečně přesvědčivě a vysvětlují zvýšení permeability kapilár a vznik intersticiálních otoků v těchto situacích [5–7]. Z těchto poznatků vyplývá, že tělo disponuje pouze omezenými možnostmi, jak regulovat množství tekutin v jednotlivých kompartmentech za předpokladu, že dojde k porušení některé z membrán nebo k významné změně objemu tekutin v některém z prostorů. Dosažení optimální volémie u kriticky nemocného (obr. 1) je bez zevního zásahu spíše iluzorní.
*Poznámka: Shrnutí zásad pro tekutinovou terapii najdete v aplikaci České společnosti intenzivní medicína - CSIM Smart Cards (ke stažení v knihovně iTunes nebo Android).
Obr. 1. Vztah mezi optimální volémií a rizikem vzniku komplikací 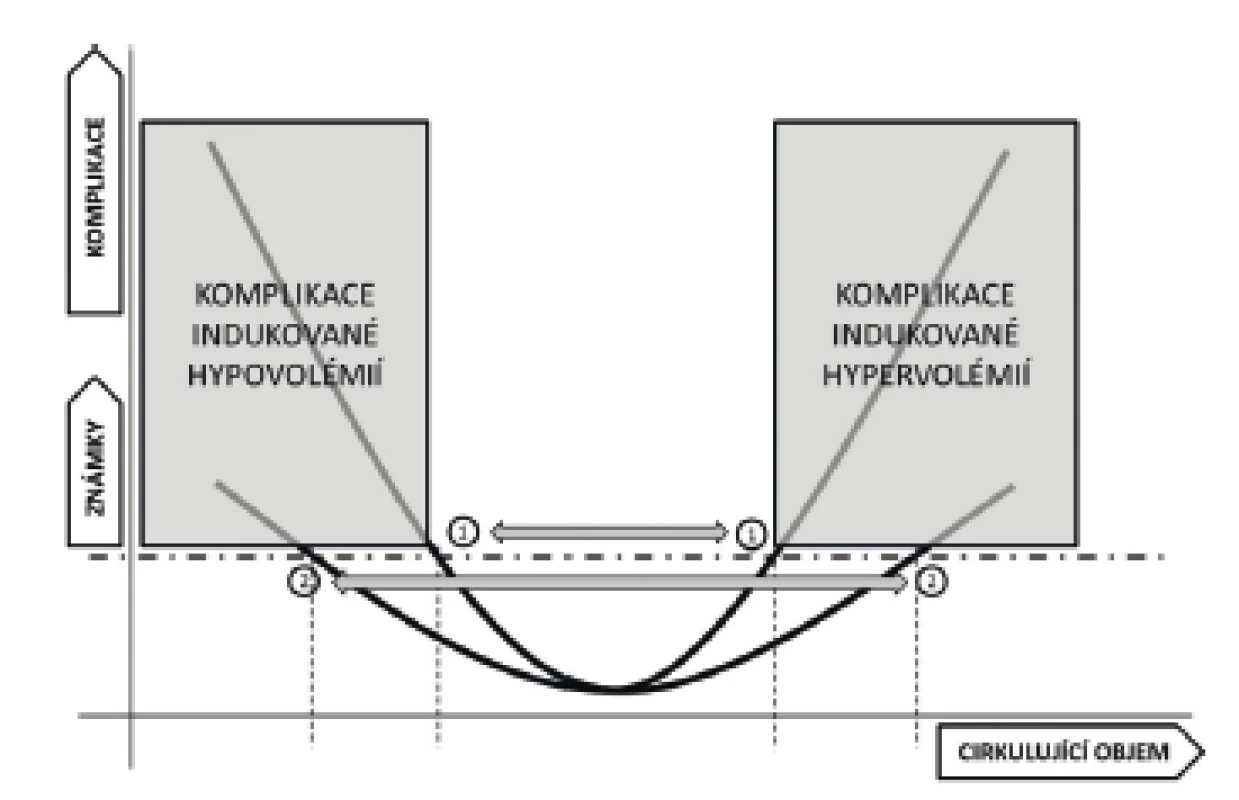
1 – pacient s nízkou tolerancí k tekutinám, 2 – pacient s vysokou tolerancí k tekutinám V akutním stavu se nízká volémie projeví hlavně snížením žilního návratu a ve svém důsledku i tepového objemu. Ve snaze udržet velikost srdečního výdeje a adekvátní dodávku živin do tkání dojde ke kompenzatornímu navýšení tepové frekvence. Druhým regulačním mechanismem je snížení prokrvení méně důležitých regionů (např. kůže, splanchnikus). Tato selektivní vazokonstrikce vede k navýšení afterloadu levé komory a tedy zvýšení perfuzních tlaků a průtoku vitálně důležitými orgány. Tato okultní hypoperfuze, nejčastěji v oblasti kůže a splanchniku, může ve svém důsledku vézt ke zhoršení stavu nemocného [8]. Hypoperfuze splanchniku je v klinické praxi obtížně monitorovatelná, užití gastrické tonometrie nebo intravitální mikroskopie podjazykové krajiny jsou metody, které nenacházejí širšího uplatnění mimo experimentální užití. Prokrvení kůže je oproti tomu velmi dobře sledovatelné. Test kapilárního návratu je mezi lékaři velmi oblíbenou diagnostickou pomůckou, nicméně test je zatížen poměrně velikou chybou v důsledku zevních příčin (podchlazení atd.), je často prováděn chybně a nejednotně interpretován. Nedávno publikované práce doporučují provedení testu u dospělé populace kompresí celého distálního článku ukazováčku na 15 sekund. Čas k dosažení normální kapilární náplně a barvy nehtového lůžka je 2,3–4,5 s [9–11]. Ait-Oufella et al. sledovali korelaci mezi plochou mramoráže dolních končetin (obr. 2) a hypoperfuzí kůže [12]. Oligurie je často užívanou známkou hypoperfuze orgánů, je ovšem nutno přihlédnout i k jiným příčinám. Obecně není v mnoha situacích (peroperační péče, pacienti s rozvojem akutního poškození ledvin apod.) užití oligurie jako jediného kritéria doporučitelné.
Obr. 2. Skóre mramoráže dolní končetiny 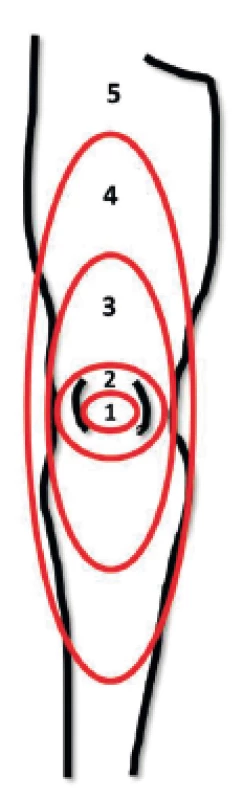
Hypervolémie je na druhou stranu (zvlášť u nemocných se zvýšenou permeabilitou endotelu) spojena s celou škálou patofyziologických změn vedoucích k navýšení postkapilárních tlaků, žilnímu městnání, tvorbě intersticiálních otoků, prodloužení difuzní dráhy pro kyslík a v konečném důsledku ke zhoršení funkce mnoha orgánů (obr. 3). Pro stav multiorgánového selhání v důsledku intersticiálních otoků se vžilo označení polykompartmentový syndrom [13]. V současné době máme k dispozici přesvědčivé důkazy o asociaci mezi kumulací tekutin a nárůstem mortality [14, 15]. Tekutinové přetížení (FO – z anglického „Fluid Overload“) definované jako procentuální nárůst hmotnosti nemocného přesahující 10 % v pooperačním období byl spojen s trojnásobným nárůstem mortality [16]. Pozitivní kumulace tekutin větší než 2 litry byla v jiné multicentrické observační studii spojena s významně horším přežíváním u vysoce rizikových nemocných [17]. Je nutno podotknout, že fylogeneticky je naše tělo mnohem lépe připraveno kompenzovat hypovolémii než tekutinové přetížení.
Obr. 3. Vliv hypervolémie, poruchy endotelu na vznik otoků a poškození orgánů 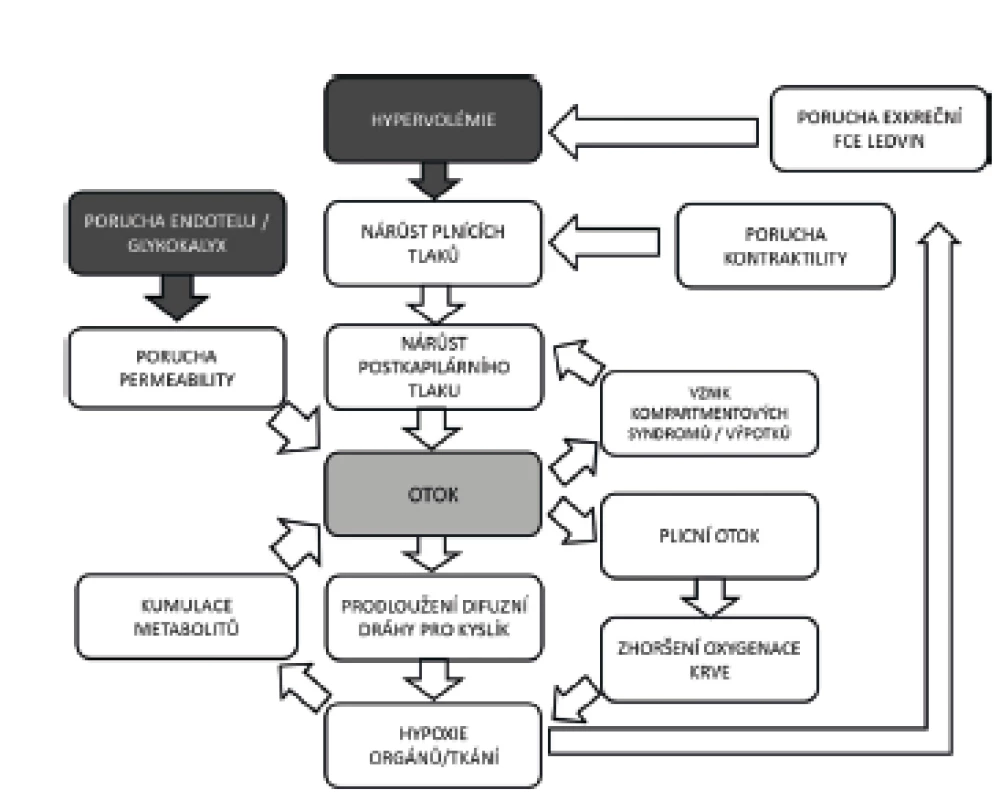
KONCEPT R-O-S-D
Z pohledu stresového metabolismu je kritické onemocnění často děleno do dvou odlišných fází – ebb (odliv), v níž převažují děje katabolické, a flow (příliv) s převahou reparačních a anabolických procesů. V nedávné době bylo obdobné rozfázování aplikováno i na potřeby tekutinové terapie u nemocných v kritickém stavu [18, 19]. Akronym ROSD představuje čtyři základní fáze: Resuscitační (také Rescue), Optimalizační, Stabilizační a Deeskalační (obr. 4 a tab. 1). V literatuře se ale můžeme setkat s odlišnými názvy jednotlivých fázi (a tedy i odlišnou zkratkou Salvage namísto Rescue u Resuscitační fáze, Evacuate namísto Deeskalce v případě užití řízené tekutinové deresuscitace).
Obr. 4. Časový průběh R-O-S-D fází ve vztahu ke kumulativní bilanci tekutin 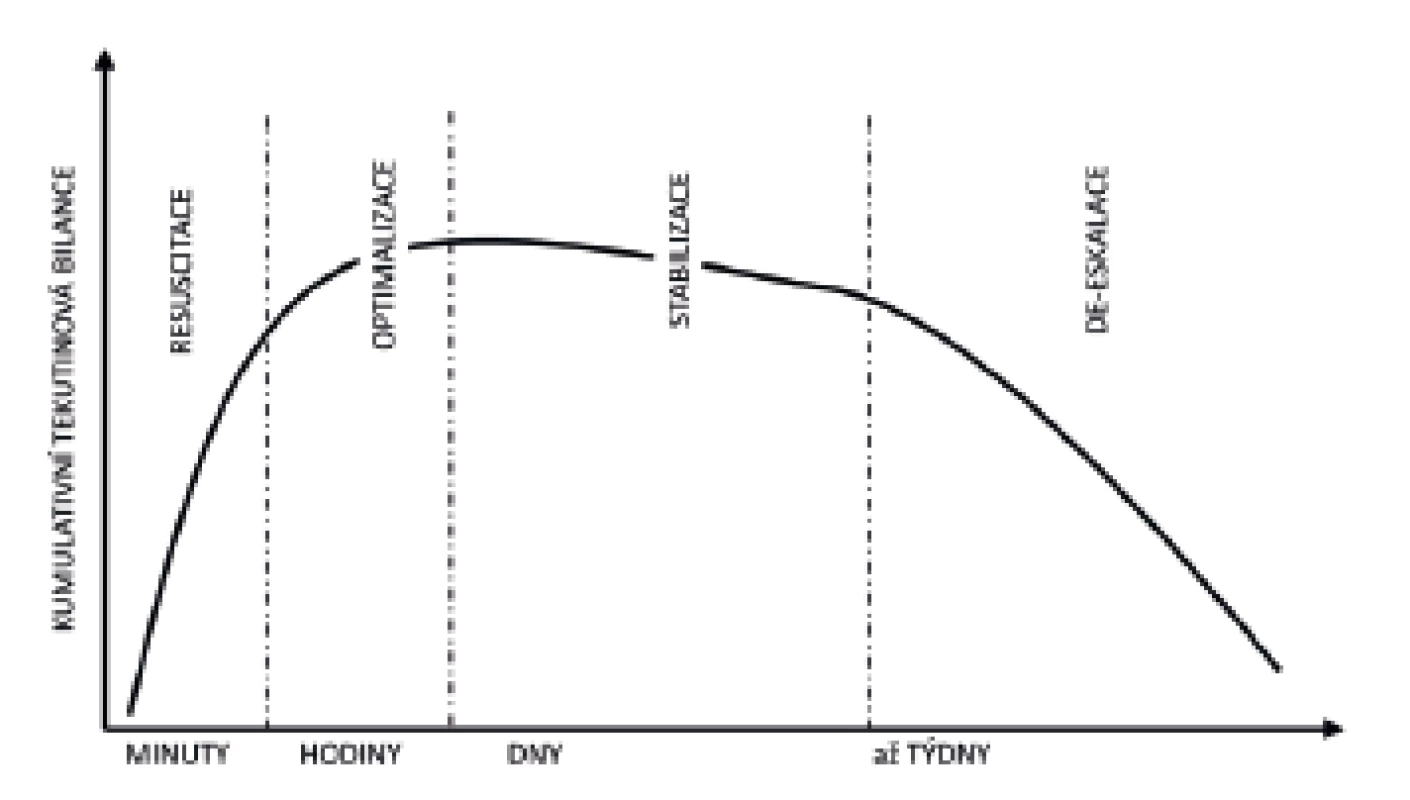
Tab. 1. Fáze tekutinové/hemodynamické terapie 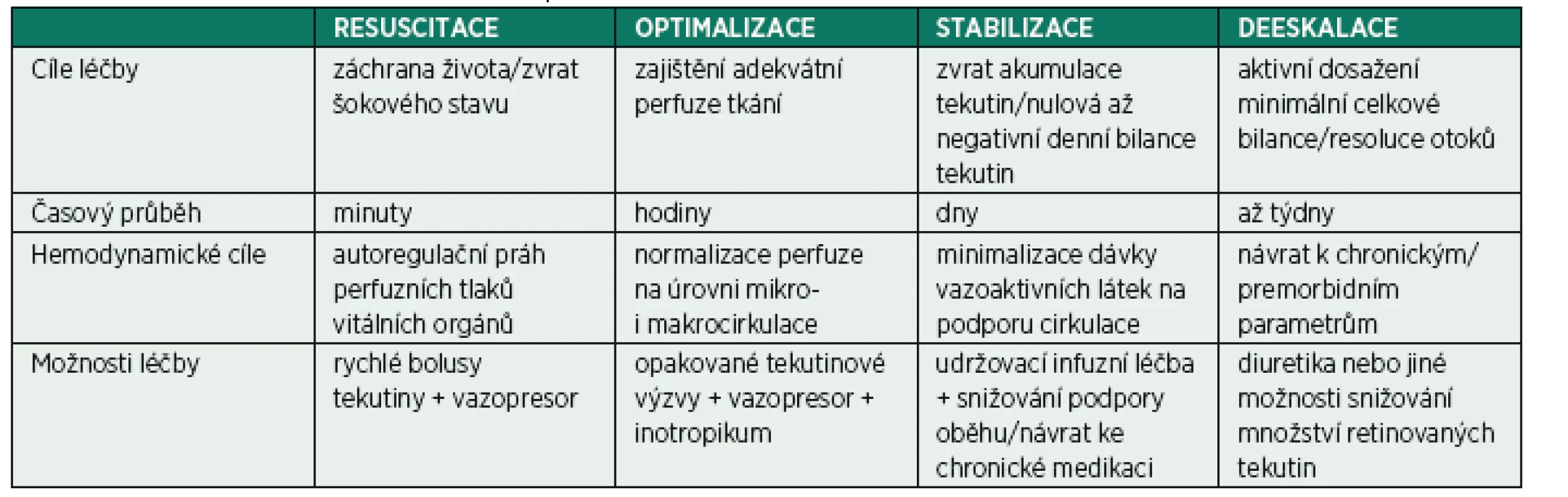
FÁZE „RESUSCITACE“
Cílem resuscitační fáze je záchrana života nemocného v šokovém stavu. Pokud je primární podezření na oběhovou nestabilitu způsobenou centrální hypovolémií (např. masivní krvácení) je zcela na místě opakované podání tekutinových bolusů i bez jakékoli monitorování. V komplikovanějších případech může ke zhodnocení centrální volémie v tomto případě pomoci základní echokardiografické vyšetření. Zvláště u stavů s významnou vazoplegií a porušenou kapilární permeabilitou (typicky septický nebo anafylaktický šok) je rozumné včasné nasazení vazopresorické podpory (noradrenalin nebo adrenalin podle etiologie) v kombinaci s tekutinovou terapií. Je vhodné zmínit, že i v oblasti iniciální resuscitace septických stavů dochází k postupnému snižování iniciálního objemu [20] z původních 30 ml/kg [21] na současných 1000 ml [22–24]. Hemodynamickým cílem resuscitační fáze je obnova funkčního oběhu s dosažením autoregulačního perfuzního prahu vitálních orgánů. Za určitých okolností, může být příliš ambiciozní snaha o normalizaci centrální volémie spojena se zbytečným navýšením tekutinové pozitivní bilance. Příkladem může být přehnaná tekutinová resuscitace s cílem dosažení vyšších perfuzních tlaků u neošetřeného traumatu s následnou progresí krvácení v důsledku navýšení arteriálního tlaku a rozvoje diluční koagulopatie [25].
FÁZE „OPTIMALIZACE“
U nemocného, u kterého bylo úspěšně dosaženo perfuzního prahu vitálních orgánů, je nutno dále uvažovat o pokračování prováděné pozitivní tekutinové terapie ke korekci případné centrální hypovolémie a odstranění okultní hypoperfuze. Postup v optimalizační fázi ale musí být významně opatrnější se snahou podat jen takové množství tekutin, které povede k dosažení optimální volémie. Metodou volby je opakované podávání tekutinových výzev s náležitou snahou o predikci reakce a její následné zhodnocení (viz dále). Je nutno podotknout, že podání tekutin ve snaze zlepšit perfuzi tkání má význam pouze tehdy, pokud toto povede k navýšení středního systémového plnícího tlaku (v literatuře používaná zkratka MCFP – mean circulatory filling pressure) při minimálním navýšení plnícího tlaku pravé komory (běžně monitorovaného cestou CVP), což má za následek zvýšení žilního návratu [20]. Druhou nutnou podmínkou je, aby obě srdeční komory byly schopné reagovat na nárůst žilního návratu zvýšením tepového objemu (tzv. bi-ventrikulární preload responsivenes), tedy aby obě komory pracovaly na vzestupných částech Frank-Starlingovy křivky. Pokud všechny tyto podmínky nejsou splněny, vede podání tekutin k navýšení žilních a postkapilárních tlaků bez nárůstu srdečního výdeje a tedy progresi intersticiálních otoků. U nemocných s významně vazoplegickou cirkulací dochází k nárůstu objemu nepodílejícího se na tvorbě tlakového gradientu žilního návratu (tzv. unstressed volume) na úkor funkčního objemu (stressed volume). Samotné podání vazopresoru může částečně normalizovat tyto poměry. Optimalizace objemu v těchto stavech by proto neměla být vedena snahou o úplně vysazení vazopresorické podpory, ale spíše snahou o zajištění rovnováhy mezi centrální náplní řečiště, srdečním výdejem, systémovou vaskulární rezistencí a klinickými známkami dostatečné perfuze periferních orgánů spojené s poklesem laktatémie, obnovou funkce atp. [26].
Naopak u nemocných, u kterých není kapilární řečiště významně plegické a nesetkáváme se s významnou poruchou kapilární permeability (penetrující poranění, operační výkony), bylo opakovaně prokázáno, že optimální centrální volémie je možno dosáhnout cestou optimalizace srdečního výdeje [27–29]. V současné době je tekutinová a hemodynamická optimalizace u pacientů, podstupujících rizikové výkony vedená pomocí rigorózních monitorovacích pomůcek, doporučena několika národními doporučeními s cílem snížení pooperační morbidity a v nejtěžších případech i mortality [30–32]. Recentní data poněkud relativizují tento postup v případě nemocných nižších rizikových skupin a v situacích využívání méně spolehlivých – zcela neinvazivních – prostředků [33]. Pravděpodobným důvodem je podstatně větší schopnost těchto nemocných vyrovnat se s operačním traumatem, menší množství a závažnost vznikajících komplikací a v neposlední řadě i spolehlivost užitých monitorovacích pomůcek.
FÁZE „STABILIZACE“
Do fáze stabilizace nemocný většinou vstupuje v časovém horizontu 1–3 dní po inzultu. Nemocný dále nevyžaduje navyšování oběhové podpory (spíše naopak), není potřeba provádění významné korekce centrální volémie. Z globálního pohledu dochází k poklesu zánětlivé laboratoře, normalizaci orgánových funkcí atp. Rozpoznání nástupu stabilizační fáze je nutné hlavně s ohledem na ukončení snahy o pozitivní tekutinovou bilanci. Cílené a vědomé snížení udržovacích infuzí se zohledněním množství tekutin podávaných jako vehikulum k cílovému dennímu obratu tekutin cca 25 až 35 ml/kg je naprosto racionální. V optimálním případě, by měla byt denní bilance tekutin u nemocných ve stabilizační fázi vyrovnaná, s minimálními výkyvy. Takovéto restriktivní vedení tekutinové terapie bylo spojeno se zlepšením výstupu jak u nemocných s ARDS [34], tak v Murphyho studii u nemocných v septickém šoku [35]. Je samozřejmé, že z různých důvodů může být stabilizační fáze narušena opětovnými intervencemi, např. v případě sekundárních korektivních operací atd. Vzhledem k tomu, že ve stabilizační fázi by se měl nemocný pohybovat na svém optimu z pohledu kardiovaskulárního systému, potřebné intervence nutné k jeho udržení by měly být vždy limitovány na naprosté minimum a vedeny se stejnou logikou jako ve fázi optimalizační.
Z klinického pohledu je stěžejní, jak se chovat u nemocných, u kterých buď nedochází ke stabilizaci stavu, nebo v důsledku poškození orgánových funkcí (nejčastěji oligurické renální selhání) nejsou schopni udržet vyrovnanou tekutinovou bilanci. U pacientů studie ARDSnet [34] a recentnější FACTT lite study [36] bylo k udržení vyrovnané denní bilance užito časného nasazení diuretik. Jako účelné se může jevit iniciální provedení furosemidového stress testu (podání 1 až 1,5 mg/kg hmotnosti furosemidu v bolusu) s cílem dosažení alespoň 200 ml (více jak 2–3 ml/kg) diurézy v následujícím dvouhodinovém okně [37]. Pokud nemocný v testu selže, je racionální zvážit, zda u pacienta není indikováno časné nasazené mimotělní eliminace [38]. S ohledem na to, že pacient ve stabilizační fázi má jen minimální tendence k mobilizaci tekutin, není vhodná snaha o příliš ambiciozní negativizaci a snižování kumulativní bilance (viz dále).
FÁZE „DEESKALACE“
Fáze deeskalace je spojena s návratem vnitřního prostředí nemocného do plně stabilizovaného (nejlépe premorbidního) stavu s ústupem otoků, mobilizací tekutin a eliminací pozitivní kumulativní bilance. U pacientů v běžné perioperační péči dochází často ke spontánní deeskalaci v řádu několika dní i bez významného zevního přispění. Naopak u pacientů s vážným průběhem kritického onemocnění je často nutné agresivní vedení tekutinové evakuace pomocí farmakologické intervence nebo mimotělní eliminace. Někteří autoři obhajují jako podporu tekutinové deresuscitace užívání kombinace intervencí – tzv. PAL terapii, tedy optimální nastavení PEEP v kombinaci s podáním koncentrovaného albuminu a diuretika. V několika experimentálních pracích [39, 40] a jedné rozsáhlejší retrospektivní studii [41] byl tento postup spojen se zlepšením eliminace tekutin, oxygenace, zkrácením doby ventilace a snížením mortality. Definitivní doporučení a stejně tak posouzení, které osoby mohou z PAL profitovat, ale zatím není z literatury možné poskytnout.
V případě užití aktivní evakuace je nutné cílené vedení se zohledněním rychlosti a výsledné centrální volémie, např. echokardiografickými kontrolami. Užití volumetrických parametrů získaných rozšířeným monitorováním hemodynamiky transpulmonální termodilucí může napomoci k posouzení adekvátní rychlosti, nicméně data, která by tento postup ospravedlnila, zatím nejsou k dispozici. Stejně tak jako v případě tekutinové resuscitace je i deresuscitace spojena s užitím bezpečnostních limitů [42]. V tomto případě se jedná hlavně o znovuobjevení známek oběhové nestability s nutností opětovného nasazení presorické podpory. Důležité je také sledování hodnot dusíkatých katabolitů a iontogramu s cílem včasného snížení rychlosti evakuace při příliš vysokém nárůstu laboratorních parametrů (hlavně urey a natria).
ZPŮSOB PODÁNÍ TEKUTIN
Podání tekutin v prostředí intenzivní péče může mít několik forem. Podání tekutinového bolusu (nejčastěji objem 500–1000 ml podaný v rozmezí 5–15 minut) je postupem se snahou o korekci klinicky významné centrální hypovolémie v resuscitační fázi. Tekutinová výzva (250–500 ml podaných v průběhu 10–30 minut) je postupem diagnosticko-terapeutickým, sloužícím hlavně k posouzení a nalezení optimální centrální volémie. Aspekty korektivního podání (tedy tekutinový bolus a tekutinová výzva) jsou rozebrány v následujícím odstavci. Často opomíjenou součástí tekutinové terapie je i podávání udržovací infuze. Za běžných okolností nejsou potřeby pacientů v intenzivní péči stran množství kontinuálně podávaných infuzí významné. Podle velikosti diurézy, míry pocení či ztrát ventilací (hlavně u neintubovaných pacientů) se pohybují v rozmezí 1–3 ml/kg/hod. Toto množství bývá nezřídka překračováno, což vede ke vzniku pozitivní tekutinové bilance i ve stabilizační nebo deeskalační fázi. V této situaci je nutno si uvědomit, že infuzní roztoky slouží i jako vehikulum podávaných léčiv, sedativ nebo nutrice.
PODÁNÍ TEKUTINOVÉHO BOLUSU ČI VÝZVY
Podání tekutinového bolusu nebo tekutinové výzvy je diagnosticko-léčebným postupem, jehož cílem je korekce centrální hypovolémie cestou zvýšení žilního návratu a tím srdečního výdeje. Jak již bylo uvedeno v předchozí části, v případě tekutinového bolusu převažuje léčebná indikace, neboť tekutinu podáváme v situacích zjevné centrální hypovolémie. Diagnostická část se tedy většinou omezuje na zpětné zhodnocení efektu podané tekutiny. V případě tekutinové výzvy by měla být významnou součástí i předchozí rozvaha ve smyslu predikce pozitivní odpovědi na podání tekutiny. V obou případech je ale vhodné uvažovat o aspektech podání, které zachycuje schéma na obrázku 5 [43–45].
Obr. 5. Schéma rozvahy tekutinové terapie 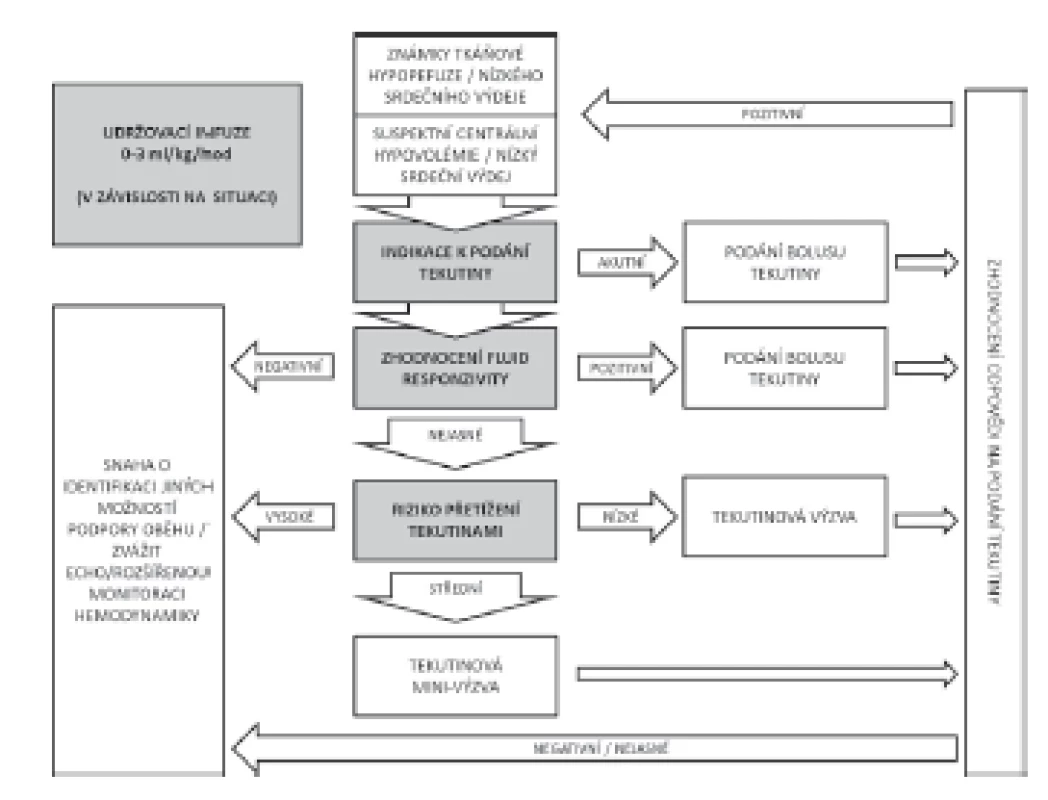
INDIKACE
Je založena na předpokladu, že pacient vykazuje známky centrální hypovolémie nebo oběhové instability, v jejichž důsledku dochází k nedostatečnosti orgánové perfuze. Zároveň je ovšem nutný také předpoklad, že podáním tekutin dojde ke zvrácení tohoto stavu. Z indikace podání tekutiny také vyplývá několik dalších aspektů. Typ podané tekutiny – v současné době v tekutinové léčbě naprosto převažuje podání krystaloidních náhrad. Aktuálně neexistují data, která by vedla k upřednostnění některého ze spektra běžně komerčně dostupných roztoků. Nedávno publikovaná studie SPLIT nepotvrdila obavu o zhoršení renálních funkcí při užívání fyziologického roztoku [46], nepřímá data ovšem přesto spíše nasvědčují proti rutinnímu užívání 0,9% roztoku NaCl [47–49]. Rozhodnutí, který roztok bude zvolen, tedy záleží hlavně na jeho dostupnosti, koncentraci iontů a osmolaritě. Od užití koloidních náhrad se v posledních letech výrazně ustoupilo [50, 51]. Studie CHEST [52] a 6S [53] potvrdily obavu z nefrotoxického účinku koloidních roztoků na bázi hydroxyethylškrobů. Problém úniku onkoticky aktivního umělého (a obtížně odbouratelného) koloidu do intersticia při porušení vaskulární bariéry, riziko vzniku alergických reakcí či vliv na koagulaci jsou ale pravděpodobné i při užití ostatních umělých koloidních náhrad (želatina, dextrany). Užívání 5% albuminu jako izoonkotické koloidní náhrady je také kontroverzní. Pokud odhlédneme od vysoké ceny, může albumin stejně jako umělé koloidy při poruše endotelu uniknout do intersticia a působit zde osmoticky aktivně. V případě běžného ředění 20% 100 ml koncentrátu ve 400 ml krystaloidu získáme 4% roztok, který je hypoonkotický, což může mít za následek snížení výsledného objemového efektu. Obecně lze říci, že objemový efekt koloidních náhrad bývá často přeceňován. Většina rigorózně vedených studií nikdy nepotvrdila fyziology předpokládaný poměr 1 : 4, ale svědčí spíše pro cca 1,5–2násobný objemový efekt koloidu [54, 55]. Na druhou stranu, jak ukázala studie CRYSTMAS [56], koloidní náhrady mohou umožnit rychlejší stabilizaci oběhu v kritickém stavu a lze tedy uvažovat o jejich užití (při respektování rizika nefrotoxicity, vlivu na koagualci atp.) v resuscitační fázi některých šokových stavů.
Riziko extravazace a rychlost podání jsou další aspekty, které je nutné uvažovat v okamžiku indikace podání tekutinového bolusu či výzvy. Jak ukázaly studie Hahna et al. [57] po podání rychlého bolusu krystaloidu dochází během následujících 20 minut k redistribuci do intersticia, při prolongovaném podání, tedy nemusí být nikdy dosaženo cílové objemové expanze. Naopak prudký nárůst žilního návratu při rychlém nekontrolovaném převodu velkého objemu může vést k akutnímu překročení objemové kapacity srdce a plic (hlavně u nemocných s diastolickou dysfunkcí a poruchou relaxace) a zhoršení stavu pacienta. Toto je považováno za jeden z možných důvodů zhoršeného přežívání ve skupinách s bolusovou objemovou resuscitací ve studii FEAST [58]. Riziko extravazace je nutno brát v potaz hlavně u nemocných s plicní patologií (zánět, kontuze atd.) a stavů s významným postižením endotelu (popáleniny, některé případy sepse). Kritické je v tomto případě provádění opakovaných tekutinových výzev v Optimalizační fázi.
PREDIKCE
Snaha předpovědět pozitivní reakci kardiovaskulárního aparátu je významnou součástí indikování tekutinové výzvy. V případě evidentní hypovolémie v Resuscitační fázi šokových stavů je možno z časových důvodů snahu o predikci tekutinové reaktivity vynechat, v ostatních případech bychom jí však měli věnovat náležitou pozornost. V současné době máme k dispozici celé spektrum různých možností, jak otestovat kardiovaskulární systém před vlastním podáním tekutiny, počínaje posouzením interakce srdce a plic a konče dynamickými manévry typu pasivního zvednutí nohou. Problematice tekutinové reaktivity byly nedávno věnovány dva přehledové články uveřejněné v číslech 2/2014 [59] a 5/2015 [60], k dispozici je dále celá řada publikací v anglickém písemnictví [45, 61]. Blíže se této problematice bude věnovat druhá část připravované SmartCard.
REAKCE
Zhodnocení reakce je důležité jednak z pohledu dosažení cíle (normalizace patologie vedoucí k indikaci léčby) a/nebo k posouzení tekutinové reaktivity pro případnou další indikaci podání tekutin. V nedávno provedené studii FENICE [51] pokračovalo u 50 % osob podávání dalších tekutin, a to i v případě, že prvotní zhodnocení reakce bylo negativní. Tento fakt jen podtrhuje, že hodnocení reakce po podání tekutiny je často opomíjeným okamžikem. Pro adekvátní zhodnocení je ovšem nutné stanovení racionálních cílů. Optimální je užití takových parametrů, u kterých lze předpokládat změnu podáním tekutiny – tedy zhodnocení preloadu, srdečního výdeje nebo jejich změny (např. echokardiograficky nebo pomocí monitorování hemodynamiky). Užití nepřímých parametrů – arteriálního tlaku, srdeční frekvence nebo plnících tlaků může být v mnoha případech zavádějící. Naopak důležité je zhodnocení ústupu klinických známek hypoperfuze orgánů.
LIMITACE
Využití bezpečnostních limitů při provádění tekutinové expanze je dalším relativně málo užívaným aspektem péče (ve studii FENICE byly bezpečnostní limity zadány pouze u 28 % případů [51]). Nejčastěji používaným limitním faktorem je hodnocení nárůstu hodnoty CVP (zvýšení o 5 a více mm Hg) nebo jeho absolutní hodnota (ačkoli ta se v literatuře výrazně liší v rozmezí 8–15 mm Hg). V Boydově práci [14] byla absolutní hodnota CVP nad 12 mm Hg spojena s nárůstem mortality, nicméně někteří nemocní mohou i při těchto hodnotách vykazovat známky výrazné tekutinové reaktivity a profitovat z podání tekutin. Kalibrovaná technika transpulmonální termodiluce přinesla do rutinní klinické praxe možnost zhodnocení extravaskulární plicní vody (EVLW – Extra-vascular lung water), parametru, jehož zvýšené hodnoty byly v několika pracích také spojovány se zvýšenou mortalitou [62, 63]. Zhoršení oxygenace případně sonografické zhodnocení B-linií v plicní tkáni mohou být další snadno dostupné parametry použitelné jako bezpečnostní limity.
ZÁVĚR
Tekutinová terapie je podstatnou součástí péče o kriticky nemocné, její správně vedení vyžaduje schopnost integrace mnoha důležitých faktorů dynamiky chování kardiovaskulárního systému, stejně jako celkového stavu a časového průběhu onemocnění.
Poděkování: Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 15-31881A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Do redakce došlo dne 17. 1. 2016.
Do tisku přijato dne 28. 2. 2016.
Adresa pro korespondenci:
doc. MUDr. Jan Beneš, Ph.D.
KARIM FN Plzeň
alej Svobody 80
323 00 Plzeň
e-mail: benesj@fnplzen.cz
Zdroje
1. Latta, T. Letter from Dr. Latta to the Secretary of the Central Board of Health, London, affording a view of the rationale and results of his practice in the treatment of cholera by aqueous and saline injections. 1832. Int. J. Epidemiol., 2013, 42, 2, p. 387–390.
2. Blalock, A. Shock: further studies with particular reference to the effects of hemorrhage. 1934. Arch. Surg., 2010, 145, 4, p. 393–394.
3. Chappell, D., Jacob, M., Becker, B. F., Hofmann-Kiefer, K., Conzen, P., Rehm, M. Expedition glycocalyx. A newly discovered “Great Barrier Reef“. Anaesthesist, 2008, 57, 10, p. 959–969.
4. Levick, J. R., Michel, C. C. Microvascular fluid exchange and the revised Starling principle. Cardiovasc. Res., 2010, 87, 2, p. 198–210.
5. Johansson, P. I., Stensballe, J., Rasmussen, L. S., Ostrowski, S. R. A high admission syndecan-1 level, a marker of endothelial glycocalyx degradation, is associated with inflammation, protein C depletion, fibrinolysis, and increased mortality in trauma patients. Ann. Surg., 2011, 254, 2, p. 194–200.
6. Nelson, A., Berkestedt, I., Schmidtchen, A., Ljunggren, L., Bodelsson, M. Increased levels of glycosaminoglycans during septic shock: relation to mortality and the antibacterial actions of plasma. Shock, 2008, 30, 6, p. 623–627.
7. Chappell, D., Bruegger, D., Potzel, J., Jacob, M., Brettner, F., Vogeser, M., Conzen, P., Becker, B. F., Rehm, M. Hypervolemia increases release of atrial natriuretic peptide and shedding of the endothelial glycocalyx. Crit. Care, 2014, 18, 5, p. 538.
8. Meregalli, A., Oliveira, R. P., Friedman, G. Occult hypoperfusion is associated with increased mortality in hemodynamically stable, high-risk, surgical patients. Crit. Care, 2004, 8, 2, R60-R65.
9. Lima, A., Jansen, T. C., van Bommel, J., Ince, C., Bakker, J. The prognostic value of the subjective assessment of peripheral perfusion in critically ill patients. Crit. Care Med., 2009, 37, 3, p. 934–938.
10. Ait-Oufella, H., Bige, N., Boelle, P. Y., Pichereau, C., Alves, M., Bertinchamp, R., Baudel, J. L., Galbois, A., Maury, E., Guidet, B. Capillary refill time exploration during septic shock. Intensive Care Med., 2014, 40, 7, p. 958–964.
11. Lima, A., Bakker, J. Clinical assessment of peripheral circulation. Curr. Opin. Crit. Care, 2015, 21, 3, p. 226–231.
12. Ait-Oufella, H., Bourcier, S., Alves, M., Galbois, A., Baudel, J. L., Margetis, D., Bige, N., Offenstadt, G., Maury, E., Guidet, B. Alteration of skin perfusion in mottling area during septic shock. Annals of intensive care, 2013, 3, 1, p. 31.
13. Malbrain, M. L. N. G., Roberts, D. J., Sugrue, M., De Keulenaer, B. L., Ivatury, R., Pelosi, P., Verbrugge, F., Wise, R., Mullens, W. The polycompartment syndrome: a concise state-of-the-art review. Anaesthesiology intensive therapy, 2014, 46, 5, p. 433–450.
14. Boyd, J. H., Forbes, J., Nakada, T. A., Walley, K. R., Russell, J. A. Fluid resuscitation in septic shock: a positive fluid balance and elevated central venous pressure are associated with increased mortality. Crit. Care Med., 2011, 39, 2, p. 259–265.
15. Acheampong, A., Vincent, J. L. A positive fluid balance is an independent prognostic factor in patients with sepsis. Crit. Care, 2015, 19, p. 251.
16. Lowell, J. A., Schifferdecker, C., Driscoll, D. F., Benotti, P. N., Bistrian, B. R. Postoperative fluid overload: not a benign problem. Crit. Care Med., 1990, 18, 7, p. 728–733.
17. Silva, J. M., de Oliveira, A. M. R. R., Nogueira, F. A. M., Vianna, P. M. M., Pereira Filho, M. C., Dias, L. F., Maia, V. P. L., Neucamp, C. D. S., Amendola, C. P., Carmona, M. J. C., Malbouisson, L. M. S. The effect of excess fluid balance on the mortality rate of surgical patients: a multicenter prospective study. Crit. Care, 2013, 17, 6, p. R288.
18. Hoste, E. A., Maitland, K., Brudney, C. S., Mehta, R., Vincent, J. L., Yates, D., Kellum, J. A., Mythen, M. G., Shaw, A. D., ADQI XII Investigators Group Four phases of intravenous fluid therapy: a conceptual model. Br. J. Anaesth., 2014, 113, 5, p. 740–747.
19. Vincent, J. L., De Backer, D. Circulatory shock. N. Engl. J. Med., 2013, 369, 18, p. 1726–1734.
20. Marik, P., Bellomo, R. A rational approach to fluid therapy in sepsis. Br. J. Anaesth., 2015.
21. Rivers, E., Nguyen, B., Havstad, S., Ressler, J., Muzzin, A., Knoblich, B., Peterson, E., Tomlanovich, M. Early goal-directed therapy in the treatment of severe sepsis and septic shock (1). N. Engl. J. Med., 2001, 345, 19, p. 1368–1377.
22. ARISE Investigators, ANZICS Clinical Trials Group, Peake, S. L., Delaney, A., Bailey, M., Bellomo, R., Cameron, P. A., Cooper, D. J., Higgins, A. M., Holdgate, A., Howe, B. D., Webb, S. A. R., Williams, P. Goal-directed resuscitation for patients with early septic shock. N. Engl. J. Med., 2014, 371, 16, p. 1496–1506.
23. ProCESS Investigators, Yealy, D. M., Kellum, J. A., Huang, D. T., Barnato, A. E., Weissfeld, L. A., Pike, F., Terndrup, T., Wang, H. E., Hou, P. C., LoVecchio, F., Filbin, M. R., Shapiro, N. I., Angus, D. C. A randomized trial of protocol-based care for early septic shock. N. Engl. J. Med., 2014, 370, 18, p. 1683–1693.
24. Mouncey, P. R., Osborn, T. M., Power, G. S., Harrison, D. A., Sadique, M. Z., Grieve, R. D., Jahan, R., Harvey, S. E., Bell, D., Bion, J. F., Coats, T. J., Singer, M., Young, J. D., Rowan, K. M., ProMISe Trial Investigators Trial of early, goal-directed resuscitation for septic shock. N. Engl. J. Med., 2015, 372, 14, p. 1301–1311.
25. Morrison, C. A., Carrick, M. M., Norman, M. A., Scott, B. G., Welsh, F. J., Tsai, P., Liscum, K. R., Wall, M. J., Mattox, K. L. Hypotensive resuscitation strategy reduces transfusion requirements and severe postoperative coagulopathy in trauma patients with hemorrhagic shock: preliminary results of a randomized controlled trial. J. Trauma, 2011, 70, 3, p. 652–663.
26. Chawla, L. S., Ince, C., Chappell, D., Gan, T. J., Kellum, J. A., Mythen, M., Shaw, A. D. Vascular content, tone, integrity, and haemodynamics for guiding fluid therapy: a conceptual approach. Br. J. Anaesth., 2014, 113, 5, p. 748–755.
27. Benes, J., Giglio, M., Brienza, N., Michard, F. The effects of goal-directed fluid therapy based on dynamic parameters on post-surgical outcome: a meta-analysis of randomized controlled trials. Crit. Care, 2014, 18, 5, p. 584.
28. Grocott, M. P. W., Dushianthan, A., Hamilton, M. A., Mythen, M. G., Harrison, D., Rowan, K., Optimisation Systematic Review Steering Group Perioperative increase in global blood flow to explicit defined goals and outcomes following surgery. The Cochrane database of systematic reviews, 2012, 11, p. CD004082.
29. Hamilton, M. A., Cecconi, M., Rhodes, A. A Systematic Review and Meta-Analysis on the Use of Preemptive Hemodynamic Intervention to Improve Postoperative Outcomes in Moderate and High-Risk Surgical Patients. Anesthesia & Analgesia, 2011, 112, 6, p. 1392–1402.
30. NICE medical technologies guidance 3 CardioQ-ODM oesophageal doppler monitor. Dostupné na www: http://www.nice.org.uk/nicemedia/live/13312/52624/52624.pdf.
31. „Strategy for perioperative vascular filling – Guidelines for perioperative haemodynamic optimization.“ Experts‘ Formalized Recommendations, French Society of Anaesthesia and Intensive Care (SFAR), Validation by the administrative council of SFAR on 19 October 2012. Dostupné na www: http://www.aidara.fr/docs/confconsensus/RFEremplissage-SFAR2012.pdf.
32. Kristensen, S. D., Knuuti, J., Saraste, A., Anker, S., Bøtker, H. E., De Hert, S., Ford, I., Juanatey, J. R. G., Gorenek, B., Heyndrickx, G. R., Hoeft, A., Huber, K., Iung, B., Kjeldsen, K. P., Longrois, D., Luescher, T. F., Pierard, L., Pocock, S., Price, S., Roffi, M., Sirnes, P. A., Uva, M. S., Voudris, V., Funck-Brentano, C., Authors/Task Force Members 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: The Joint Task Force on non-cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA). Eur. J. Anaesthesiol., 2014, 31, 10, p. 517–573.
33. Pestaña, D., Espinosa, E., Eden, A., Nájera, D., Collar, L., Aldecoa, C., Higuera, E., Escribano, S., Bystritski, D., Pascual, J., Fernández-Garijo, P., de Prada, B., Muriel, A., Pizov, R. Perioperative Goal-Directed Hemodynamic Optimization Using Noninvasive Cardiac Output Monitoring in Major Abdominal Surgery: A Prospective, Randomized, Multicenter, Pragmatic Trial: POEMAS Study (PeriOperative goal-directed thErapy in Major Abdominal Surgery). Anesth. Analg., 2014, 119, 3, p. 579–587.
34. Wiedemann, H. P., Wheeler, A. P., Bernard, G. R., Thompson, B. T., Hayden, D., deBoisblanc, B., Connors, A. F., Hite, R. D., Harabin, A. L. Comparison of two fluid-management strategies in acute lung injury. N. Engl. J. Med., 2006, 354, 24, p. 2564–2575.
35. Murphy, C. V., Schramm, G. E., Doherty, J. A., Reichley, R. M., Gajic, O., Afessa, B., Micek, S. T., Kollef, M. H. The importance of fluid management in acute lung injury secondary to septic shock. Chest, 2009, 136, 1, p. 102–109.
36. Grissom, C. K., Hirshberg, E. L., Dickerson, J. B., Brown, S. M., Lanspa, M. J., Liu, K. D., Schoenfeld, D., Tidswell, M., Hite, R. D., Rock, P., Miller, R. R., Morris, A. H. Fluid management with a simplified conservative protocol for the acute respiratorydistress syndrome. Crit. Care Med., 2015, 43, 2, p. 288–295.
37. Chawla, L. S., Davison, D. L., Brasha-Mitchell, E., Koyner, J. L., Arthur, J. M., Shaw, A. D., Tumlin, J. A., Trevino, S. A., Kimmel, P. L., Seneff, M. G. Development and standardization of a furosemide stress test to predict the severity of acute kidney injury. Crit. Care, 2013, 17, 5, p. R207.
38. Rosner, M. H., Ostermann, M., Murugan, R., Prowle, J. R., Ronco, C., Kellum, J. A., Mythen, M. G., Shaw, A. D. Indications and management of mechanical fluid removal in critical illness. Br. J. Anaesth., 2014, 113, 5, p. 764–771.
39. Martin, G. S., Mangialardi, R. J., Wheeler, A. P., Dupont, W. D., Morris, J. A., Bernard, G. R. Albumin and furosemide therapy in hypoproteinemic patients with acute lung injury. Crit. Care Med., 2002, 30, 10, p. 2175–2182.
40. Martin, G. S., Moss, M., Wheeler, A. P., Mealer, M., Morris, J. A., Bernard, G. R. A randomized, controlled trial of furosemide with or without albumin in hypoproteinemic patients with acute lung injury. Crit. Care Med., 2005, 33, 8, p. 1681–1687.
41. Cordemans, C., De Laet, I., Van Regenmortel, N., Schoonheydt, K., Dits, H., Martin, G., Huber, W., Malbrain, M. L. Aiming for a negative fluid balance in patients with acute lung injury and increased intra-abdominal pressure: a pilot study looking at the effects of PAL-treatment. Annals of intensive care, 2012, 2 Suppl 1, p. S15.
42. Goldstein, S., Bagshaw, S., Cecconi, M., Okusa, M., Wang, H., Kellum, J., Mythen, M., Shaw, A. D. Pharmacological management of fluid overload. Br. J. Anaesth., 2014, 113, 5, p. 756–763.
43. Vincent, J. L., Weil, M. H. Fluid challenge revisited. Crit. Care Med., 2006, 34, 5, p. 1333–1337.
44. Cecconi, M., Parsons, A. K., Rhodes, A. What is a fluid challenge? Curr. Opin. Crit. Care, 2011, 17, 3, p. 290–295.
45. Benes, J., Kirov, M., Kuzkov, V., Lainscak, M., Molnar, Z., Voga, G., Monnet, X. Fluid Therapy: Double-Edged Sword during Critical Care? BioMed. Research International, 2015, 2, p. 1–14.
46. Young, P., Bailey, M., Beasley, R., Henderson, S., Mackle, D., McArthur, C., McGuinness, S., Mehrtens, J., Myburgh, J., Psirides, A., Reddy, S., Bellomo, R., SPLIT Investigators, ANZICS CTG Effect of a Buffered Crystalloid Solution vs Saline on Acute Kidney Injury Among Patients in the Intensive Care Unit: The SPLIT Randomized Clinical Trial. JAMA, 2015, 314, 16, p. 1701–1710.
47. Shaw, A. D., Bagshaw, S. M., Goldstein, S. L., Scherer, L. A., Duan, M., Schermer, C. R., Kellum, J. A. Major complications, mortality, and resource utilization after open abdominal surgery: 0.9% saline compared to Plasma-Lyte. Ann. Surg., 2012, 255, 5, p. 821–829.
48. Yunos, N. M., Bellomo, R., Hegarty, C., Story, D., Ho, L., Bailey, M. Association between a chloride-liberal vs chloride-restrictive intravenous fluid administration strategy and kidney injury in critically ill adults. JAMA, 2012, 308, 15, p. 1566–1572.
49. McCluskey, S. A., Karkouti, K., Wijeysundera, D., Minkovich, L., Tait, G., Beattie, W. S. Hyperchloremia after noncardiac surgery is independently associated with increased morbidity and mortality: a propensity-matched cohort study. Anesth. Analg., 2013, 117, 2, p. 412–421.
50. Boulain, T., Boisrame-Helms, J., Ehrmann, S., Lascarrou, J. B., Bouglé, A., Chiche, A., Lakhal, K., Gaudry, S., Perbet, S., Desachy, A., Cabasson, S., Geneau, I., Courouble, P., Clavieras, N., Massanet, P. L., Bellec, F., Falquet, Y., Réminiac, F., Vignon, P., Dequin, P. F., Meziani, F. Volume expansion in the first 4 days of shock: a prospective multicentre study in 19 French intensive care units. Intensive Care Med., 2015, 41, 2, p. 248–256.
51. Cecconi, M., Hofer, C., Teboul, J. L., Pettila, V., Wilkman, E., Molnar, Z., Della Rocca, G., Aldecoa, C., Artigas, A., Jog, S., Sander, M., Spies, C., Lefrant, J. Y., De Backer, D., FENICE Investigators, ESICM Trial Group Fluid challenges in intensive care: the FENICE study: A global inception cohort study. Intensive Care Med., 2015, 41, 9, p. 1529–1537.
52. Myburgh, J. A., Finfer, S., Bellomo, R., Billot, L., Cass, A., Gattas, D., Glass, P., Lipman, J., Liu, B., McArthur, C., McGuinness, S., Rajbhandari, D., Taylor, C. B., Webb, S. A. R., CHEST Investigators, Australian and New Zealand Intensive Care Society Clinical Trials Group Hydroxyethyl starch or saline for fluid resuscitation in intensive care. N. Engl. J. Med., 2012, 367, 20, p. 1901–1911.
53. Perner, A., Haase, N., Guttormsen, A. B., Tenhunen, J., Klemenzson, G., Åneman, A., Madsen, K. R., Møller, M. H., Elkjær, J. M., Poulsen, L. M., Bendtsen, A., Winding, R., Steensen, M., Berezowicz, P., Søe-Jensen, P., Bestle, M., Strand, K., Wiis, J., White, J. O., Thornberg, K. J., Quist, L., Nielsen, J., Andersen, L. H., Holst, L. B., Thormar, K., Kjældgaard, A. L., Fabritius, M. L., Mondrup, F., Pott, F. C., Møller, T. P., Winkel, P., Wetterslev, J. Hydroxyethyl starch 130/0.42 versus Ringer‘s acetate in severe sepsis. N. Engl. J. Med., 2012, 367, 2, p. 124–134.
54. Dubin, A., Pozo, M. O., Casabella, C. A., Murias, G., Pálizas, F., Moseinco, M. C., Kanoore Edul, V. S., Estenssoro, E., Ince, C. Comparison of 6% hydroxyethyl starch 130/0.4 and saline solution for resuscitation of the microcirculation during the early goal-directed therapy of septic patients. J. Crit. Care, 2010, 25, 4, p. 659.e1–659.e8.
55. James, M. F. M., Michell, W. L., Joubert, I. A., Nicol, A. J., Navsaria, P. H., Gillespie, R. S. Resuscitation with hydroxyethyl starch improves renal function and lactate clearance in penetrating trauma in a randomized controlled study: the FIRST trial (Fluids in Resuscitation of Severe Trauma). Br. J. Anaesth., 2011, 107, 5, p. 693–702.
56. Guidet, B., Martinet, O., Boulain, T., Philippart, F., Poussel, J. F., Maizel, J., Forceville, X., Feissel, M., Hasselmann, M., Heininger, A., Van Aken, H. Assessment of hemodynamic efficacy and safety of 6% hydroxyethylstarch 130/0.4 vs. 0.9% NaCl fluid replacement in patients with severe sepsis: The CRYSTMAS study. Crit. Care, 2012, 16, 3, p. R94.
57. Hahn, R. G. Why are crystalloid and colloid fluid requirements similar during surgery and intensive care? Eur. J. Anaesthesiol., 2013, 30, 9, p. 515–518.
58. Maitland, K., Kiguli, S., Opoka, R. O., Engoru, C., Olupot-Olupot, P., Akech, S. O., Nyeko, R., Mtove, G., Reyburn, H., Lang, T., Brent, B., Evans, J. A., Tibenderana, J. K., Crawley, J., Russell, E. C., Levin, M., Babiker, A. G., Gibb, D. M., FEAST Trial Group Mortality after fluid bolus in African children with severe infection. N. Engl. J. Med., 2011, 364, 26, p. 2483–2495.
59. Kanova, M., Sevcik, P. Statické a dynamické testy v řízení volumoterapie. Anesteziologie a intenzivni medicína, 2014, 2, p. 107–1016.
60. Mosna, F. Echokardiografické hodnocení preloadu a reakce na podané tekutiny. Anesteziologie a intenzivní medicína, 2015, 5, p. 280–284.
61. Monnet, X., Teboul, J. L. Assessment of volume responsiveness during mechanical ventilation: recent advances. Crit. Care, 2013, 17, 2, p. 217.
62. Jozwiak, M., Silva, S., Persichini, R., Anguel, N., Osman, D., Richard, C., Teboul, J. L., Monnet, X. Extravascular lung water is an independent prognostic factor in patients with acute respiratory distress syndrome. Crit. Care Med., 2013, 41, 2, p. 472–480.
63. Sakka, S., Klein, M., Reinhart, K., Meier-Hellmann, A. Prognostic Value of Extravascular Lung Water in Critically Ill Patients. Chest, 2002, 122, 6, p. 2080.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2016 Číslo 2- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Tekutinová terapie v intenzivní péči*
- Jak poznat, že EKG je abnormální a co nám zobrazuje standardní EKG záznam
- Anestezie v onkochirurgii
- Praktická doporučení pro prevenci, diagnostiku a léčbu respirační deprese vzniklé v souvislosti s neuroaxiálně podanými opioidy
- Projekt Spireta
- Odmítání transfuzních přípravků pacientem – odpovědi na dotazy čtenářů
- Rady kolegům ve specializačním vzdělávání a informace ze Specializační oborové rady (SOR) oboru anesteziologie a intenzivní medicína (AIM)
- Čekání na nového šéfredaktora – jde o mnohem více než jen o správnou osobu...
- Maligní hypertermie
- Úloha antitrombínu a tromboelastometrie v manažmente počínajúcej diseminovanej intravaskulárnej koagulopatie po peripartálnej hysterektómii
- Současný pohled na kaudální epidurální blokády u dětí a jejich komplikace
- Poruchy spánku u pacientů v perioperačním období a intenzivní péči
- Alarminy a jejich role v perioperační medicíně
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Jak poznat, že EKG je abnormální a co nám zobrazuje standardní EKG záznam
- Maligní hypertermie
- Současný pohled na kaudální epidurální blokády u dětí a jejich komplikace
- Tekutinová terapie v intenzivní péči*
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



