-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Průběh cytokinové odezvy u zvířecího modelu nitrobřišní sepse modifikované imunosupresí
The course of cytokine response in an animal model of intraabdominal sepsis modified by immunosuppression
Objective:
The diagnosis of sepsis in immunocompromised patients is difficult due to their modified response to infection. Our experiment was designed to compare the early clinical and laboratory response to sepsis between experimental groups of septic minipigs with and without immunosuppression.Design:
Experimental, comparative study.Material and methods:
Experiment was performed on minipigs. Sepsis was induced using a model of caecal ligation and puncture (CLP). Minipigs (with identical baseline parameters) were randomized into 3 group; the sepsis group (n = 10), the immunosuppression group (n = 11), which received immunosuppressive drugs (cyclosporine, methylprednisolone, mycophenolate mofetil) before surgery, and the sham group (n = 6). Plasmatic levels of selected cytokines throughout the experiment in three-hour interval were monitored.Results:
All CLP animals developed septic shock with febrile and hemodynamic response. Also the kinetics of the plasma levels of TNFα, IL-1β, interferon-γ and CRP in both experimental groups with and without immunosuppression was similar. In immunosuppressed animals the levels of IL-4 were significantly lower in all time periods observed, on the contrary a significant increase of IL-8 levels in the same experimental group was found as well. Ten hours after surgery, significantly higher level of IL-6 was found in the sepsis group as compared to the immunosuppression group. There was a significantly greater increase in levels of IL-10, 19, 22 and 25 hours after surgery in immunosuppressed animals compared to the group without immunosuppression.Conclusion:
We found significant differencies in cytokine response to experimental sepsis between the groups of immunocompetent and immunosuppressed animals in our experiment.Keywords:
sepsis – immunosuppression – cytokine – caecal ligation and puncture – minipig
Autoři: Ročeň Milan 1; Kieslichová Eva 1; Kudla Michal 2; Merta Dušan 1; Šplichal Igor 3; Čáp Jiří 1; Gürlich Robert 4
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní péče, Transplantcentrum IKEM, Praha 1; Klinika transplantační chirurgie, Transplantcentrum IKEM, Praha 2; Oddělení imunologie a gnotobiologie, Mikrobiologický ústav AVČR, Praha 3; Chirurgická klinika, Fakultní nemocnice Královské Vinohrady, Praha 4
Vyšlo v časopise: Anest. intenziv. Med., 23, 2012, č. 2, s. 91-96
Kategorie: Intenzivní medicína - Původní práce
Souhrn
Cíl studie:
Diagnostika sepse u imunokompromitovaných pacientů je obtížná pro jejich modifikovanou reakci na infekci. Cílem experimentu bylo porovnání časné klinické a laboratorní odpovědi na sepsi mezi experimentální skupinou septických miniprasat s imunosupresí a bez ní.Typ studie:
Experimentální, srovnávací.Materiál a metoda:
Experiment byl prováděn na miniprasatech. Sepse byla vyvolána užitím modelu cekální ligace a punkce (CLP). Miniprasata se shodnými vstupními parametry byla randomizována do 3 skupin, skupiny sepse (n = 10), skupiny imunosuprese (n = 11) s podáváním trojkombinace imunosupresivních léků (cyklosporin, metylprednisolon, mykofenolát mofetil) před operací a kontrolní skupiny (n = 6). Po celou dobu experimentu byly v tříhodinových intervalech monitorovány plazmatické hladiny vybraných cytokinů.Výsledky:
U všech CLP zvířat došlo k rozvoji septického šoku s teplotou a hemodynamickou odezvou. Kinetika plazmatických koncentrací TNFα, IL-1β,interferonu-γ a CRP byla podobná ve skupině zvířat se sepsí i s imunosupresí. U imunosuprimovaných zvířat byly hodnoty IL-4 signifikantně nižší po celou dobu sledování, naopak u stejné skupiny byly hodnoty IL-8 zvýšené. Deset hodin po operaci byly hodnoty IL-6 významně vyšší ve skupině se sepsí než ve skupině s imunosupresí. Byl nalezen signifikantně vyšší vzestup hladin IL-10 v 19., 22., a 25. hodině po operaci ve skupině imunosuprimovaných zvířat ve srovnání se skupinou bez imunosuprese.Závěr:
V našem experimentu jsme zjistili signifikantní rozdíly v cytokinové odpovědi na experimentálně navozenou sepsi mezi skupinami imunokompetentních a imunosuprimovaných zvířat.Klíčová slova:
sepse – imunosuprese – cytokin – cekální ligace a punkce – minipraseÚvod
Navzdory významným pokrokům v diagnostice, prevenci a terapii infekce zůstává sepse hlavní příčinou morbidity a mortality imunokompromitovaných pacientů [1]. Sepse u imunosuprimovaných však přes svoji závažnost zůstává dosud málo prostudovanou problematikou. Klinický obraz sepse je u těchto pacientů velmi proměnlivý, nemusí odpovídat závažnosti stavu, často se jedná o příznaky nespecifické, nedochází k typické manifestaci systémové zánětlivé reakce jako u imunokompetentních jedinců [2]. Stejně jako v jiných populacích pacientů je i u imunokompromitovaných rozhodující pro přežití včasná diagnostika sepse a včasné zahájení odpovídající terapie [3]. O rozdílu dynamiky markerů sepse mezi imunosuprimovanými a neimunosuprimovanými je známo jen málo. Jsou dostupné výsledky studií na malých zvířatech (myši), které určité rozdíly popisují, nicméně bez souvislosti s klinikou a aplikovatelností na člověka [4, 5].
Ke studiu mechanismů sepse byly vyvinuty různé zvířecí modely, z nichž nejčastěji používaným je model cekální ligace a punkce (CLP) u hlodavců [6]. V tomto modelu je zdrojem sepse polymikrobiální infekční fokus v dutině břišní s následnou bakteriální translokací do krevního kompartmentu, vyvolávající systémovou zánětlivou odpověď.
Cílem experimentu bylo porovnání klinických, laboratorních parametrů mezi skupinou miniprasat se sepsí a zvířat se sepsí a imunosupresí.
Studie byla povolena Komisí na ochranu zvířat proti týrání v IKEM. Experimenty byly prováděny na akreditovaném pracovišti experimentální medicíny IKEM v souladu s platnými evropskými předpisy a předpisy České republiky ohledně chovu a využití pokusných zvířat.
Metody
V experimentu bylo užito celkem 30 dospělých miniprasat o průměrné hmotnosti 37,6 kg (medián 36 kg). Zvířata byla rozdělena do 3 skupin. Ve skupině sepse (n = 10) byla vyvolána sepse užitím modifikovaného modelu CLP. Ve skupině imunosuprese (n = 11) byla vyvolána sepse stejným způsobem. Po dobu 5 dnů před operací byl zvířatům skupiny imunosuprese podáván cyklosporin (Sandimun Neoral, Novartis) 10 mg/kg ve 2 denních dávkách, metylprednisolon (Prednison, Zentiva) 20 mg v jedné denní dávce, mykofenolát mofetil (CellCept, Roche Pharma) 2 gramy ve 2 denních dávkách. V den operace byla provedena kontrola hladiny cyklosporinu. U kontrolní skupiny (n = 6) nebyla sepse vyvolána. U třech prasat byla na počátku pokusu zjištěna již probíhající infekce, a zvířata byla proto z experimentu vyřazena.
Po premedikaci a kanylaci ušní žíly byla zvířata uvedena do celkové anestezie s endotracheální intubací. Následně byla zvířata napojena na ventilátor, řízeně ventilována směsí kyslíku a vzduchu (FiO2 0,4, PEEP 5 cm H20, dechový objem 10 ml/kg). Dechová frekvence byla nastavena tak, aby se cílové arteriální pCO2 pohybovalo v rozmezí 4,0–5,0 kPa. Byl zaveden arteriální, centrální žilní a plicnicový katétr k měření hemodynamických parametrů.
V celkové anestezii byla chirurgicky indukována sterkorální peritonitida provedením CLP. Byla provedena střední laparotomie, podvaz céka v jedné čtvrtině délky (5 cm od Bauhinské chlopně). Cévní zásobení bylo přerušeno v rozsahu podvazu céka. Před podvazem céka do něj byl vmasírován střevní obsah z colon ascendens. Na antimezenteriální straně byla provedena perforace céka troakarem. Dutina břišní byla kontaminována střevním obsahem. Byla zavedena gastrostomie a cystostomie. U kontrolní skupiny byla provedena pouze laparotomie, gastrostomie a cystostomie. Po uzavření laparotomie byla všechna zvířata dále řízeně ventilována a analgosedována až do ukončení experimentu (24 hodin po ukončení operace). Byla podávána udržovací infuze balancovaného krystaloidního roztoku 10 ml/kg/hod a bolusy 6% hydroxyetylškrobu 130 kD/0,4. V případě poklesu MAP pod 65 mm Hg nereagujícího na volumoterapii, byl k udržení perfuzního tlaku podáván noradrenalin v kontinuální infuzi. Prostřednictvím katétru v plicní tepně byla u zvířat monitorována teplota jádra, cílem bylo udržet teplotu 37–39 °C pomocí fyzikálních metod (chlazení, ohřívání). Experiment byl u skupiny zvířat se sepsí a skupiny s imunosupresí ukončen po nástupu známek septického šoku, u kontrolní skupiny po 24 hodinách po operaci. Zvířata byla poté utracena podáním bolusu anestetik.
Monitorován byl elektrokardiogram, střední arteriální tlak (MAP), centrální žilní tlak (CVP), tělesná teplota. Tlak v zaklínění (PCWP) a srdeční výdej (CO) byly zaznamenávány v tříhodinových intervalech. Byl počítán srdeční index (CI) a indexovaná systémová vaskulární rezistence (SVRI).
Po úvodu do anestezie (čas T0), po 1 hodině po operaci (čas T1) a dále po 3 hodinách (T2, T3, T4, T5, T6, T7, T8, T9) byly odebírány vzorky arteriální krve k analýze plazmatické koncentrace cytokinů (enzyme immunoassay): interleukin-1β a interleukin-6 (IL-1β, IL-6; DuoSets, R&D Systems, Minneapolis, MN, USA), interleukin-4, interleukin-8, interleukin-10, interferon-γ, tumor necrosis factor-α (IL-4, IL-8, IL-10, IFN-γ, TNF-α – CytoSets, Invitrogen, Carlsbad, CA, USA). Ve stejných intervalech byl vyšetřován C-reaktivní protein (CRP; TA 901 (Tridelta Development Ltd.) porcine C – reactive protein assay). Sledovány byly i sérové koncentrace laktátu a počet leukocytů v krvi.
Na konci experimentu byly odebrány vzorky krve za účelem mikrobiologického vyšetření.
Byly vypočteny základní statistické charakteristiky (průměr, medián, směrodatná odchylka) a udány minimální a maximální hodnoty. Ke srovnání skupin byl užit Mannův-Whitneyův test, Kruskalův-Wallisův test. Jako statisticky signifikantní byla určena hodnota p < 0,05.
Výsledky
Mezi 3 skupinami zvířat (skupina sepse, skupina imunosuprese, kontrolní skupina) nebyly nalezeny statisticky významné rozdíly ve vstupních klinických a laboratorních parametrech. Předoperační hladina cyklosporinu u všech zvířat s imunosupresí přesahovala 200 ng/ml.
Zvířata kontrolní skupiny byla po celou dobu sledování stabilní, nebyla zaznamenána zvýšená teplota, laboratorní parametry se v průběhu experimentu neměnily. U zvířat kontrolní skupiny byla zaznamenána významně nižší spotřeba tekutin než u miniprasat s CLP, žádné zvíře v kontrolní skupině nevyžadovalo k udržení perfuzního tlaku podání noradrenalinu.
U všech zvířat s CLP (skupina sepse, skupina imunosuprese) došlo oproti kontrolní skupině v průměru do 24 hodin (15–36 hodin) k rozvoji septického šoku s febrilní reakcí, tachykardií a hypotenzí, pro udržení MAP v hodnotách nad 65 mm Hg bylo nutno podávat noradrenalin v kontinuální infuzi. Na začátku pokusu byla normotermie ve všech skupinách zvířat. Během experimentu teplota stoupla přes fyzikální chlazení ve skupině sepse na 40,8 ± 0,96, ve skupině imunosuprese na 41,73 ± 0,81 °C, rozdíl mezi skupinami nebyl významný (p = 0,09). Nebyly zaznamenány statisticky významné rozdíly v hemodynamické odpovědi na sepsi mezi skupinou zvířat se sepsí a skupinou s imunosupresí. Průměrná tepová frekvence stoupla z počátečních 70 ± 11,5/min ve skupině sepse a 61 ± 8,3/min ve skupině imunosuprese (p = 0,06) na 143 ± 38/min u septických a na 153 ± 25/min imunosuprimovaných (p = 0,54). Počáteční hodnoty CI a SVRI se mezi skupinou se sepsí (CI: 3,8 ± 1,51 l/min/m2, SVRI: 1887 ± 772 dyne . s.cm5 . m-2) a skupinou s imunosupresí (CI: 3,0 ± 0,86 l/min/m2, SVRI: 2114 ± 754 dyne.s.cm5/m2) nelišily (CI: p = 0,07, SVRI: p = 0,53). Průměrné CI a SVRI byly na konci experimentu u skupiny se sepsí (CI: 3,7 ± 1,55 l/min/m2, SVRI: 1737 ± 836 dyn . s.cm5 . m-2) a u skupiny s imunosupresí (CI: 3,89 ± 1,04 l/min/m2, SVRI: 1354 ± 482 dyn.s.cm5 . m-2) rovněž podobné (CI: p = 0,56, SVRI: p = 0,23). Spotřeba koloidních roztoků v průběhu experimentu byla u obou skupin s CLP podobná. Ve skupině s imunosupresí byl noradrenalin nasazován v průměru později než u skupiny bez imunosuprese, rozdíl však nedosahoval statistické významnosti. Mezi skupinou se sepsí a skupinou s imunosupresí nebyl zaznamenán statisticky významný rozdíl v průměrné dávce noradrenalinu.
Nelišily se ani hodnoty laktátu v arteriální krvi mezi skupinami na začátku (sepse: 3,6 mmol/l, imunosuprese: 3,1 mmol/l, p = 0,44), ani na konci experimentu (sepse: 2,0 mmol/l, imunosuprese 2,0 mmol/l, p = 0,49). Nebyl prokázán významný rozdíl v počtu leukocytů mezi skupinou se sepsí a skupinou s imunosupresí na začátku (sepse: 8,4 ± 5,1 x 109/l, imunosuprese: 10,3 ± 4,7 x109/l) ani na konci experimentu (sepse: 3,5 ± 3,2 x109/l, imunosuprese: 4,2 ± 3,1 x109/l, p = 0,70).
V případě IL-4 byla nalezena nižší koncentrace plazmatických hladin ve skupině imunosuprimovaných než u septických zvířat i kontrolní skupiny během celé doby trvání experimentu. Tento rozdíl dosahuje statistické významnosti. Naopak u IL-8 byla koncentrace plazmatických hladin u imunosuprimovaných zvířat trvale vyšší než u septických. Rozdíl je statisticky významný. Rozdíl mezi skupinou sepse a skupinou imunosuprese v hodnotách sledovaných cytokinů nedosahoval kromě IL-6 a IL-10 v jednotlivých časech statistické významnosti. Byl nalezen statisticky významný rozdíl v hodnotách IL-6 v časech T0–T4 (10 hodin od operace), k elevaci IL-6 došlo ve skupině s imunosupresí se zpožděním oproti skupině se sepsí. Opožděná elevace IL-6 neměla statisticky významnou souvislost s pozdější dobou nasazení noradrenalinu u imunosuprimovaných zvířat. Koncentrace IL-10 byla v pozdějším odstupu od operace (T7–T9, tedy 19–25 hod) signifikantně zvýšena ve skupině imunosuprimovaných oproti skupině se sepsí. U některých ze sledovaných cytokinů (IL-1β, IFN-γ, TNFα) nebyly nalezeny statisticky významné rozdíly mezi kontrolní skupinou a zvířaty s CLP. V časech T0–T2 byla zaznamenána signifikantně vyšší koncentrace CRP v kontrolní skupině. Výsledky jsou pro přehlednost zobrazeny v grafech (obr. 1).
Obr. 1. Časový průběh plazmatických koncentrací IL-1, IL-4, IL-6, IL-8, IL-10, IFN-γ, TNFα, CRP 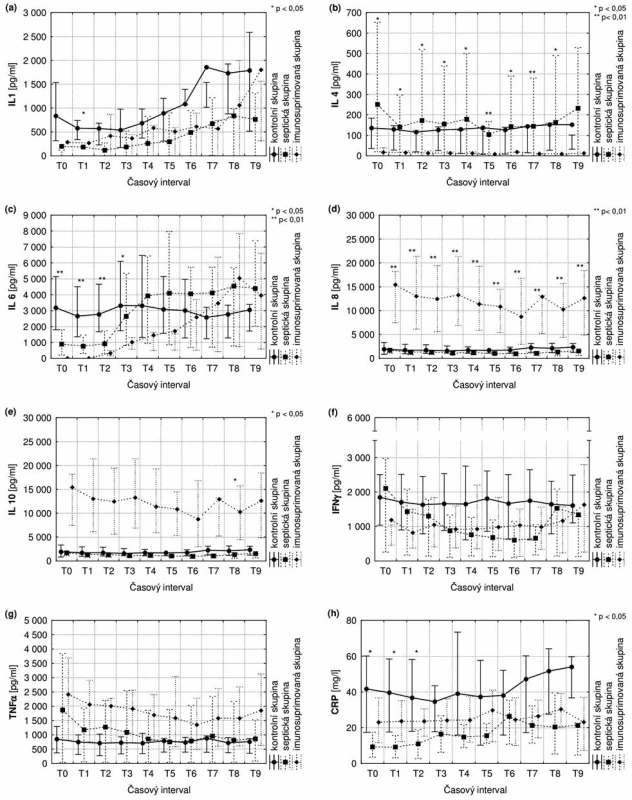
V hemokulturách septických zvířat byla nalezena směs střevních bakterií (Escherichia coli, Enterococcus species, Pseudomonas aeruginosa, Klebsiella pneumoniae, Burgholderia cepacia, Acinetobacter species, Enterobacter cloacae, stafylokoky).
Diskuse
Sepse v humánní medicíně je stále velkým problémem s nedostatečně objasněnou patofyziologií. Ve zvířecích studiích je sepse vzhledem k povaze infekčního agens a chybějících komorbidit více homogenní a snáze kontrolovatelná [7]. Náš experiment byl prováděn na dospělých miniprasatech. Prasečí model je pro zkoumání lidské sepse výhodnější v porovnání s hlodavčím modelem díky relativně bližšímu fyziologickému vztahu mezi člověkem a prasetem [8]. Pro účely výzkumu imunopatologických alterací při sepsi u imunosuprimovaných pacientů jsme zvolili letální model peritonitidy (CLP) na prasatech jako model, který se ohledně etiologie nejvíce blíží reálné náhlé příhodě břišní. Vzhledem k tomu, že je cékum endogenním zdrojem bakteriální kontaminace, vede jeho perforace k bakteriální peritonitidě s translokací smíšených enterických bakterií do krevního oddílu. Bakteriémie při nástupu sepse spouští aktivaci systémové zánětlivé odpovědi, následně dochází k rozvoji septického šoku, orgánové dysfunkce a smrti. Při použití CLP modelu vykazovala všechna zvířata v experimentu typické příznaky septického šoku u všech byla zjištěna rozvinutá peritonitida [9]. Mikrobiologické nálezy v hemokulturách septických zvířat potvrdily polymikrobní příčinu sepse.
U lidí jsou sepse i septický šok spojeny s hemodynamickými změnami, které vyžadují tekutinovou terapii [10]. Toto bylo patrné i u septických miniprasat. Nalezené hemodynamické změny odpovídají i dříve publikované studii srovnávající hemodynamiku u septických krys [11]. Střední arteriální tlak byl u septických zvířat během experimentu udržován v hodnotách nad 65 mm Hg podáváním krystaloidních i koloidních roztoků a podáváním noradrenalinu v kontinuální infuzi. Zvířata v kontrolní skupině potřebovala méně tekutin a byla stabilní po celou dobu experimentu bez nutnosti oběhové podpory. Nasazení podpory noradrenalinem bylo sice ve skupině s imunosupresí oproti skupině se sepsí opožděno, ale rozdíl nebyl statisticky významný. Je ovšem možné, že tento výsledek byl ovlivněn relativně malým počtem zvířat ve skupinách.
Imunosupresivní terapie je v různých variantách užívána při terapii nádorových procesů, autoimunitních onemocnění, střevních zánětů, při transplantaci solidních orgánů a transplantaci kostní dřeně, závažnou komplikací této terapie je zvýšené riziko infekčních komplikací. Imunosupresiva podávaná při transplantaci cílí na jedno či několik míst v imunitním systému, což značně zvyšuje jejich účinek v prevenci i léčbě orgánové rejekce [12]. Imunosupresivní protokol po orgánových transplantacích sestává obvykle z trojkombinace kalcineurinového inhibitoru, kortikoidu a antimetabolitu. Tato kombinace byla zvolena i v našem experimentu. Kontrolní hladina cyklosporinu přesahovala u imunosuprimovaných zvířat 200 ng/ml, bylo tedy dosaženo požadované úrovně imunosuprese.
U imunosuprimovaných nedochází ke klasickým klinickým i biochemickým projevům septické reakce, nemusí být přítomna leukocytóza a ani elevace CRP [13]. Prokalcitonin (PCT) je specifickým ukazatelem systémové bakteriální infekce, jeho elevace je přítomna i u pacientů s imunosupresí [14]. Možnosti analýzy biomarkerů sepse jsou omezené v důsledku nižší dostupnosti kitů ke stanovení prasečích biomarkerů. Ačkoliv bylo prokázáno, že PCT je lepším prediktorem infekční etiologie systémového zánětu než CRP a cytokiny, nemohlo být v experimentu jeho stanovení provedeno. Toto vyšetření v současné době bohužel není pro porcinní model k dispozici.
K významným změnám počtu leukocytů nedošlo. Nebyla zaznamenána významná elevace CRP u CLP miniprasat, což pravděpodobně také souvisí s délkou trvání experimentu, která nebyla dostatečná na to, aby došlo k významným změnám. Vyšší hodnoty CRP v kontrolní skupině na začátku pokusu pravděpodobně ukazují na možnost nepoznaného probíhajícího infektu pokusných zvířat. U septických zvířat nedošlo k nárůstu hodnot laktátu v arteriální krvi, nejspíše z důvodu časné a agresivní volumoterapie.
Rozvoj sepse u zvířat s CLP byl spojen s příslušnou odpovědí cytokinů. Cytokiny jsou biomarkery používané při diagnostice sepse, ke zhodnocení aktuální úrovně zánětlivé odpovědi a prognóze pacienta. Nižší koncentrace IL-4 ve skupině s imunosupresí je vysvětlitelná popsaným farmakologickým efektem užité imunosuprese na produkující buňky (TH2-lymfocyty, paměťové CD4+ buňky). Vyšší koncentrace IL-8 ve stejné skupině je pravděpodobně způsobená kompenzatorní aktivací makrofágů vedoucí ke zvýšení fagocytózy u imunosuprimovaných. Významná diference ve skupině se sepsí a skupině s imunosupresí byla prokázána v případě IL-6 a IL-10. IL-6 je prototypem prozánětlivého cytokinu a IL-10 představuje hlavní protizánětlivý cytokin. Bylo prokázáno, že vysoká koncentrace IL-6 a IL-10 predikuje vyšší mortalitu septických pacientů [15, 16]. Nástup elevace IL-6 byl u imunosuprimovaných zvířat opožděn oproti skupině se sepsí. IL-6 je po podání baktérií nebo LPS (lipopolysacharid) uvolňován do krevního oběhu po 4–6 hodinách. Přestože v naší studii je vzestup IL-6 ve skupině s imunosupresí opožděn, stále představuje časný laboratorní marker sepse. Od počátku zvýšené hodnoty IL-6 v kontrolní skupině byly pravděpodobně způsobeny nerozpoznaným respiračním infektem u dvou zvířat. Vyšší hodnoty IL-10 hrají důležitou roli při omezení intenzity zánětlivé odpovědi inhibicí TNFα, IL-1β a produkcí IL-8, interferonu-γ a IL-6. U ostatních zkoumaných mediátorů nedošlo k významnému ovlivnění jejich kinetiky. V již zmiňované studii prováděné na septických krysách byl v souladu s našimi výsledky popsán vzestup plazmatických koncentrací IL-6, koncentrace TNFα zůstala beze změny. Ve stejné studii popsaný signifikantní vzestup IL-1β nebyl v našem experimentu zaznamenán [11].
Naše studie má několik limitací. Počty zvířat v experimentu nejsou velké, statistické hodnocení tak může být zkresleno. Délka sledování (minimálně 24 hodin po operaci) nemusela být dostatečná. U některých zvířat se sepsí však bylo obtížné, a to i přes terapeutické intervence (volumoterapie, noradrenalin), tento interval dodržet, zásadní prodloužení doby sledování tedy nebylo reálné.
Závěr
Prokázali jsme, že CLP model u miniprasat představuje spolehlivý a reprodukovatelný model polymikrobní sepse u miniprasat. Byly zjištěny signifikantní rozdíly v hemodynamické odpovědi mezi skupinou se zvířaty, u nichž byla vyvolaná sepse metodou CLP, a kontrolní skupinou. U všech CLP zvířat došlo k rozvoji septického šoku s febrilní reakcí, tachykardií a hypotenzí s nutností podávání noradrenalinu. Předpoklad pomalejšího rozvoje septické reakce u zvířat s imunosupresí nebyl v experimentu jednoznačně potvrzen. Klinická i hemodynamická odezva na sepsi byla podobná ve skupině s imunosupresí i ve skupině se sepsí. Nasazení noradrenalinu bylo sice u imunosuprimovaných zvířat opožděné oproti skupině se sepsí, tento rozdíl ale nebyl statisticky významný. Kinetika plazmatických koncentrací IL-4 a IL-8 se signifikantně lišila mezi skupinou imunosuprese a skupinou sepse a kontrolou. Elevace IL-6 byla opožděna v čase ve skupině s imunosupresí oproti skupině se sepsí, rozdíl však nebyl statisticky významný. Průměrné hodnoty IL-6 byly 10 hodin po operaci ve skupině se sepsí významně vyšší než ve skupině s imunosupresí. Koncentrace IL-10 je v pozdějším odstupu od operace signifikantně zvýšena ve skupině imunosuprimovaných oproti skupině se sepsí.
Podporováno výzkumným projektem IGA NS10556-3/2009 Ministerstva zdravotnictví ČR.
Do redakce došlo dne 11. 2. 2012.
Do tisku přijato dne 11. 3. 2012.
Adresa pro korespondenci:
MUDr. Milan Ročeň, Ph.D.
Klinika anesteziologie, resuscitace a intenzivní péče
Transplantcentrum IKEM
Vídeňská 1958/9
140 21 Praha 4
e-mail: milan.rocen@medicon.cz
Zdroje
1. Trecziak, S. et al. Infections and severe sepsis in solid-organ transplant patiens admitted from a university-based ED. Am. J. Emerg. Med., 2004, 22, s. 530–533.
2. Seville, M.T., Kystofiak, S., Kusne, S. Infection kontrol issues after solid organ transplantation. In Bowden, R. A., Ljungman, P., Snydmyn, D. R. Transplant Infection. London: Lippincott Williams & Wilkins, 2010, s. 667–688.
3. Kumar, A. et al. Initiation of inapropriate antimicrobial therapy results in fivefold reduction of survival in human septic shock. Chest, 2009, 136, s. 1237–1248.
4. Iwamura, H., Sato, M., Wakitani, K. Comparative study of Glucocorticoids, Cyklosporine A, and JTE-607 [(-)-Ethyl-N - -{3,5-dichloro-2-hydroxy-4-[2-(4-methylpiperazin-1-1)ethoxy]benzoyl}-L-fenylalaninate Dihydrochloride] in a mouse septic shock model. JPET, 2004, 311, s. 1256–1263.
5. Opal, S. M., Cross, A. S. The use of immunocompromised animals as model for human septic shock. Shock, 2005, 24, s. 64–70.
6. Belikoff, B., Buras, J. A. A practical approach to animal model of sepsis. In Conn, P. M. Sourcebook of models for biomedical research. New York: Humana Press Inc., 2008, s. 473–483.
7. Rittirsch, D., Hoesel, L. M., Ward, P. A. The disconnect between animal model sof sepsis and human sepsis. J. Leukoc. Biol., 2007, 81, s. 137–143.
8. Lunney, J. K. Advances in swine biomedical model genomics. Int. J. Biol. Sci., 2007, 3, s. 179–184.
9. Levy, M. M. et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit. Care Med., 2003, 31, s. 1250–1256.
10. Dellinger, R. P. et al. Surviving Sepsis Campaign: International guidelines for management of severe sepsis and septic shock. Crit. Care Med., 2008, 36, s. 296–327.
11. Sheiermann, P. et al. Comparing hemodynamics, blood gas analyses and proinflammatory cytokines in endotoxemic and severely septic rats. Int. Immunopharmacol., 2011, 11, 6, s. 719–723.
12. Taylor, A. L., Watson, C. J., Bradley, J. A. Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy. Crit. Rev. Oncol. Hematol., 2005, 56, s. 23–46.
13. Bouza, E., Loechs, B., Munoz, P. Fever of unknowm origin in solid organ transplant recipients. Infect. Dis. Clin. North, Am., 2007, 21, s. 1033–1054.
14. Sakr, Y., Sponholz, C., Tuche, F., Brunkhorst, R. A., Reinhart, K. The role of procalcitonin in fibrile neutropenic patiens: review of the literature. Infection, 2008, 36, s. 396–407.
15. Osuchowski, M. F., Welch, K., Siddiqui, J., Remick, D. G. Circulating cytokine/inhibitor profiles reshape the understanding of the SIRS/CARS kontinuum in sepsis and predict mortality. J. Immunol., 2006, 177, s. 1967–1974.
16. Kellum, J. A. et al. GenIMS Investigators. Understanding the inflammatory cytokine response in pneumonia and sepsis: results of the Genetic and Inflammatory Marker of Sepsis /GenIMS) Study. Arch. Intern. Med., 2007, 167, s. 1655–1663.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Výborová schůze ČSARIMČlánek Stanovy
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2012 Číslo 2- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
-
7. Křivánkovy dny
Abstrakta a synopse - Výborová schůze ČSARIM
- Stanovy
- XV. světový kongres anesteziologů
- Nejbližší odborné konference a kongresy
- Implementace imunologických vyšetření do klinické rutinní praxe u kriticky nemocných
- Audit použití supraglotické pomůcky i-gel při celkové anestezii se spontánní a řízenou ventilací – vliv ventilačního režimu a zkušenosti lékaře na sledované parametry
- Validace faktorů predikce obtížné intubace
- Kvalita života pacientů jeden rok po propuštění z intenzivní péče
- Trefoil factor 1 jako ukazatel poškození střevní sliznice během septických stavů u dětí
- Průběh cytokinové odezvy u zvířecího modelu nitrobřišní sepse modifikované imunosupresí
- Získaná hemofilie A s těžkým průběhem - kazuistika
-
7. Křivánkovy dny
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Validace faktorů predikce obtížné intubace
- Kvalita života pacientů jeden rok po propuštění z intenzivní péče
- Získaná hemofilie A s těžkým průběhem - kazuistika
-
7. Křivánkovy dny
Abstrakta a synopse
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



